Method Article
ברזולוציה גבוהה אמצעי הדמיה של נוירונים על ידי שימוש של זריחה החרגה שיטה והתקנים Microfluidic ייעודי
In This Article
Summary
אחסון הוא פרמטר חשוב לגבי מאפיינים פיזיולוגיים ופתולוגיים של תאים. אנו מתארים שיטה הדרה פלורסנט ומאפשר מלא-שדה למדידה של במבחנה כמות עצביים עם תת מיקרומטר רזולוציה צירית הנדרש לניתוח של neurites ומבנים דינמי משתמעת בצמיחה עצביים.
Abstract
אחסון הוא פרמטר חשוב לגבי מאפיינים פיזיולוגיים ופתולוגיים של נוירונים בפרקי זמן שונים. הנוירונים הם תאים די ייחודי ביחס שלהם מורפולוגיות כחוד המורחבת ולגדל כתוצאה מכך מספר אתגרים מתודולוגיים למדידה נפח. במקרה מסוים במבחנה הצמיחה עצביים, המתודולוגיה שבחרת צריך לכלול תת מיקרומטר רזולוציה צירית בשילוב עם שדה מלא התבוננות על פרקי זמן של דקות שעות או ימים. בניגוד לשיטות אחרות כמו תא צורה שחזור באמצעות הדמיה קונאפוקלית, מדידות מבוסס-חשמלית או מיקרוסקופ כוח אטומי, שיטת אי-הכללה של קרינה פלואורסצנטית שפותחו לאחרונה (FXm) יש פוטנציאל להגשים את האתגרים הללו. עם זאת, למרות פשוטים עקרונית שלה מימוש FXm ברזולוציה גבוהה עבור נוירונים דורש התאמות מרובות, מתודולוגיה ייעודי. אנו מציגים כאן שיטה המבוססת על השילוב של הדרה פלורסצנטיות, התקנים נמוכים-חספוס מרובה תאים microfluidic, ולבסוף micropatterning כדי להשיג במבחנה מדידות של אחסון מקומי עצביים. הרזולוציה הגבוהה שמספק המכשיר מותר לנו למדוד נפח מקומי של תהליכים עצביים (neurites), הנפח של כמה מבנים ספציפיים המעורבים צמיחה עצביים, כגון צמיחה קונוסים (Gc).
Introduction
הידע המדויק של תאי האחסון משכה תשומת לב מוגברת בשנים האחרונות, מונע על ידי הנושא של הומאוסטזיס גודל תא מיקרואורגניזמים חד תאיות 1 , באופן כללי יותר תאים mitotic 2. אולם, השאלה של נפח התאים הוא רלוונטי גם עבור תאים mitotic פוסט, שעבורו נוירונים מהווים דוגמה פרדיגמטי.
נפח הוא אכן חתימה חשוב של אירועים פיזיולוגיים ופתולוגיים סולמות שונים, בזמן נקודות בחיים עצביים, מ ארעית דפורמציה עצב משויך (סולם אלפיות השנייה) פעילות חשמלית 3 בלתי הפיך עצביים נפיחות המתרחשים במהלך השלב ללא תסמינים של ניווניות מחלות (השנים אצל בני אדם) 4. עם זאת, השינוי הגדול ביותר של אמצעי האחסון מתרחשת סרגל זמן ביניים של ימים או שבועות (תלוי האורגניזם נחשב) במהלך צמיחה עצביים. המורפולוגיה מורחבת ומורכבת של נוירונים מעלה בעיות כפולות, ביניהם ברגולציה של גודל התא. קוטר לאורכה עצב הם אכן בחוזקה מוסדר ויוו, עם ערכים ספציפיים לכל סוג עצביים 5,6.
סוגיות אלה, מורכבים כדי לטפל ויוו, ניתן לטפל גם באופן פשוט במבחנה. את השאיפה הזאת, שיטה המוקדש אמצעי מדידה מהר מספיק כדי לעקוב אחר הצמיחה דינמיקה (קרי בקנה מידה זמן של דקות) ועומד בקנה אחד עם תצפיות במשך שעות או ימים נדרש. מספר שיטות פותחו במהלך השנים כדי לספק גישה ישירה או עקיפה נפח סלולר בתוך חוץ גופית. תא שחזור של הדמיה קונאפוקלית הוא אחד מהם, אך לשיטה זו תהיה תיוג ו חוזרות חשיפות לאור תוך כדי הצגת רזולוציה צירית המוגבלת של ננומטר בערך 500 7. הערה מחסרונות האחרון שני אלה הם להתגבר חלקית על ידי שיטה מתוחכמת יותר, לאחרונה בשם סריג מיקרוסקופ אור-גיליון 8. מיקרוסקופ כוח אטומי כבר בשימוש 9 אבל זו שיטה סריקה היא תמצית מייגעת ואיטית. יתר על כן, הקשר גופניות שזה דורש עם התא עלול להפריע המדידה בהתחשב רכות קיצוני של נוירונים 10. יש כבר מועסקים שיטה עקיפה באמצעות אימפדנס או תהודה 11סוגי תאים שונים, אך לא מתאימות עבור מורחבות תאים דבק כמו נוירונים.
באחת השיטות המבטיחים ביותר מבוססת על מדידה של נפח אי-כלילה של תאים בתוך תא סגור מלא של הפלורסנט. שיטת אי-הכללה של קרינה פלואורסצנטית (FXm) היא פשוטה בעקרון שלו כפי שהוא דורש אין תיוג, מתאים הדמיה אופטית מהירה לטווח הארוך של אוכלוסיות תאים עם רזולוציה צירית פוטנציאל אופטי תת. ליתר דיוק, רזולוציית ב- z תלוי עוצמת קרינה פלואורסצנטית המרבית בחדר תרבות (כלומר באזור ללא תאים) מחולק הטווח הדינמי של המצלמה, למרות מספר מקורות רעש להגביל החלטה זו האולטימטיבי. שיטה זו כבר חזק מאוד לעקוב אחר כמות תאים חסיד נודדים 12 או ללמוד שינוי אמצעי במהלך מיטוזה בתרבית של תאים, כפי שמתואר באופן יסודי 13. עם זאת, נוירונים מהווה אתגר מתודולוגיים FXm בהתחשב שלהם השלכה נרחב לתוך תהליכים תת מיקרומטר.
אנו מציגים כאן שיטה המוביל הזיוף של צ'יימברס FXm חלקה כדי לגשת עם ברמת דיוק גבוהה עוצמת הקול וגובה של ענפים עצביים ומבנים דינמי מעורב צמיחה עצביים כמו קונוסים צמיחה.
צ'יימברס צריך לגבהים דומים יותר מהאובייקט למדוד כדי לייעל רזולוציה צירית. לכן, תיכננו התקנים FXm שונים, המאופיינת על ידי תאי המדידה המרכזי שלושה בגבהים שונים. הדק (3 מיקרומטר בגובה) מוקדש neurite מידה: גובה נמוך זה לא כולל סומא, שנשארים בתא ליד 15 מיקרומטר גבוהה ביניים. צ'יימברס מרכזי עבה (10 ו 12 מיקרומטר) גבוהים מספיק כדי לעקוב אחר הגידול התא כולו. המכשיר כולל גם שני מאגרים ממוקם משני צידי החדר המרכזי. הזרקת ארבעה חורים (IH) ובכך מיושמים, הן מוגדרות כדלקמן: כניסת ולשקע לשרת להציג את המתלים הסלולר לתוך השבב, ואילו שני האחרים להאכיל המאגרים.
. יש לנו הראשון coverslips כיול מפוברק למדידות גובה באמצעות מבנים photoresist של הגיאומטריה ידוע... לנו יש ואז צילמו נוירונים גדל ללא תשלום, אך גם מורפולוגית מאולצות נוירונים לתוך micropatterns של הידבקות.
Protocol
המחקר בוצע על פי הנחיות הקהילה האירופית על טיפוח ועל השימוש חיות מעבדה: 86/609/EEC. מטרת המחקר והפרוטוקול מתוארים בפרוייקט לספח האתית של ERCadg צ'לו, אשר אושרה, נבדק באופן קבוע על ידי ERCEA. ובמכון קירי מתקן בעלי חיים קיבל רישיון #C75-05-18, 24/04/2012, דיווח Comité d'Ethique en למרות d'expérimentation animale מרכז פריז et Sud (מספר רישום הלאומי: #59).
1. ייצור התבנית
הערה: העובש כולל תאי ביניים ורשויות מחובר מעין שקע בחופו פורקן, פלוס שני מאגרים (ואת אינלטס) ממוקם משני צידי החדר המרכזי.
- השתמש פינצטה שטוח כדי להערים פרוסות סיליקון בקוטר מ מ 51 ולהעביר אותם ממקום אחד למשנהו.
- החדר המרכזי סיליקון עובש
- למלא עם פיפטה פלסטיק 2-mL photoresist חיובי. מקם את פיפטה במרכז רקיק סיליקון 51-מ"מ קוטר ולחץ על המאגר שלו עד כיסוי כ-75% מתוך השטח וופל עם photoresist. ספין-מעיל-3000 סל ד ל 30 s.
- להעביר את לחם הקודש הספין-coater פלטה, עם טמפרטורת פני שטח של 100 מעלות צלזיוס, במשך 50 s.
- להעביר את לחם הקודש פלטת הבישול מחזיק המצע (צ'אק) aligner המסכה. לחשוף את דרך "המסיכה DRIE" (ראה הקבצים המשלימים "masks_neuron_volume_chips.tiff" ו- "masks_neuron_volume_chips.dxf").
- כשהפחד להסיר הצ'אק ולאחר מכן לצלול אותו בכוס 100-mL התגבשות מאכל המכיל היזם (דילול 1:4 במים יונים). לשחרר את לחם הקודש ולתחזק אותו עבור 1 דקות תוך ברציפות ובעדינות תוך ערבוב את המנה crystallizing.
הערה: כדי לחסוך ריאגנטים, למלא את הצלחת crystallizing 1 ס מ גובה מקסימום. - קח בחזרה את וופל מן היזם להטביע אותו לתוך תבשיל crystallizing 100-מ ל מים יונים s.Then כ-10 למקום לחם הקודש על נייר סופג, לייבש אותו עם חנקן בלחץ באמצעות רובה אוויר המכה.
- מקם את לחם הקודש תמורת 50 s על גזייה עם טמפרטורת פני שטח של 115 מעלות צלזיוס.
- לבצע עמוק-תגובתי איכול (DRIE) עם הפרמטרים הבאים (מידע נוסף על טכניקת DRIE ניתן למצוא הפניות 14 , 15); פסיבציה שלב: 50 sccm של C4F8, הוא מגבה לזרום 10 sccm, CP 10 W, Inductively בשילוב פלזמה (ICP) 1500 W, הכולל הלחץ mbar 24, טמפרטורה 18 ° C; תחריט שלב: sccm 100 של SF6, הוא מגבה לזרום 10 sccm, CP 11 W, ICP 1500 W, הכולל הלחץ mbar 24, טמפרטורה 18 ° C; פסיבציה זמן: 4 s; תצריב קו הזמן: 7 s; סה כ משך תהליך: בדרך כלל 5 דקות במשך כ- 10 מיקרומטר חרוט עומק.
- להמיס את photoresist על ידי צלילה המצע לתוך תבשיל crystallizing מלא עם אצטון.
- להטביע את וופל בפתרון פיראניה (2/3 של2O H2 (30%) ו- 1/3 של H2אז4 (95 %)) במשך 5 דקות.
התראה: תמיד להוסיף2O H2 קודם, ואז H2כדי4 ולאחר מכן לשטוף לפחות 3 פעמים ב יונים מים לאחר הניקוי.
- לפברק התבניות המתאים צ'יימברס ביניים על-ידי ביצוע השלבים 1.2.1 כדי 1.2.11 בעקבות הפרמטרים המפורטים בטבלאות 1 -3.
הערה: כל טבלה מקביל התקן מסוים מאופיין בגובה ספציפי של תא תצפית מרכזית.
הערה: בצע את התהליך כולו באמצעות הגדלת photoresists הייטס (מסכות 1 עד 3 עבור כל התקן, ראה הקבצים המשלימים "masks_neuron_volume_chips.tiff" ו- "masks_neuron_volume_chips.dxf").- מניחים את פרוסות הסיליקון חרוט על בעל ספין-coater המצע.
- בדוק הספין-coater פועל כראוי על-ידי אימות כי שאיפתו של המצע הוא יעיל (המצע צריך לסובב ולהישאר במקום במהלך מהירות הסיבוב נומינלי).
- צמיגות של סו-8 עולה עם הגובה של הטווח עובי יישוב. תמיד להשתמש בקבוקים 20-30 מ ל SU-8 photoresists של תשפוך אותו כשהפחד לפני ציפוי ספין (SU-8 עשוי להיות צמיגה יותר מדי כדי להיות מניפולציות עם פיפטה פלסטיק).
- יוצקים אפוקסי שלילית-סוג photoresist SU-8 במרכז המצע עד המכסים כ- 75% הנגדי של סיליקון, ולאחר מכן ספין-קואט באמצעות הפרמטרים המצוין בשורה "Spincoating" של הטבלאות.
- המקום וופל מצופה על גזייה עבור משך הטמפרטורה שצוינו שורה "אופים רך".
- הר כשהפחד חרוט ומסיכה נאותה "סו-8" על aligner המסכה.
- יישר את וופל חרוט עם המסכה באמצעות חוצה יישור ייעודי (גודל טיפוסי של הצלבים: 50 מיקרומטר × 150 מיקרומטר) תוכנן על כל מסכה.
הערה: שני צלבים בכל צד של המכשיר הן מספיקות (אחד בפינה השמאלית התחתונה), אחד בפינה הימנית העליונה. - חושפים באמצעות אני לקו של aligner המסיכה (אורך גל 365 ננומטר) המינון המתאים UV, כמצוין בשורה "חשיפה אנרגיה".
הערה: זמן החשיפה הוא מחושב על ידי חלוקת האנרגיה E חשיפה ייחודיים לכל photoresist על ידי כוח יעיל של המנורה UV, מווסת על ידי קליטת המסכה: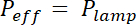 x (1 - הקליטהמסכה). הקליטה הוא כ-20% עבור מסיכות גמיש ולא זניח עבור מסכת קשה של כרום.
x (1 - הקליטהמסכה). הקליטה הוא כ-20% עבור מסיכות גמיש ולא זניח עבור מסכת קשה של כרום. - המקום של וופל מצופה על גזייה משך זמן וטמפרטורה המצוין בשורה "אופים פוסט".
- להכין שני 100-מ ל זכוכית-התגבשות מנות, אחת המכילה את המפתח, רוקן אחרים. צלילה כשהפחד במפתח למשך זמן שצוין בשורה "פיתוח". להתסיס בעדינות את המנה crystallizing לאורך כל פיתוח
- מפזרים את פרוסות עם אלכוהול איזופרופיל מעל המנה crystallizing ריקים לאורך כ-5 s. לבסוף למקם את לחם הקודש על נייר סופג, לייבש אותו עם חנקן בלחץ באמצעות רובה אוויר המכה.
- המקום וופל מצופה על גזייה עבור משך הטמפרטורה המצוין בשורה "קשה לאפות" (אופציונלי).
הערה: השלב זה שימושי למנוע סדקים photoresist לספק משטח שטוח הומוגנית הצעדים הבאים. - חזור על שלבים 1.3.1 - 1.3.10 כדי להשלים את התהליכים המפורטים בטבלה 1 -3.
- לאחר השלב האחרון של פוטוליתוגרפיה, עובש silanize המאסטר הסופי בהיקף של 3 שכבות של photoresists שליליים על ידי שיגור שני µL 100, טיפות Trichloro(1H,1H,2H,2H-perfluoro-octyl) silane בכל צד של המאסטר בצלוחית 100-מ מ. לאטום את הדיסק פטרי עם סרט פרפין פלסטיק, דגירה 20 דקות בטמפרטורת החדר (RT).
הערה: כייר מאסטר מוכן והוא יכול לשמש מספר פעמים.
- מניחים את פרוסות הסיליקון חרוט על בעל ספין-coater המצע.
2. ייצור של שבב PDMS
- יוצקים 90 גר' מבוססי סיליקון פולימרים אורגניים (Polydimethylsiloxane: PDMS) לתוך כוס פלסטיק 100-מ ל. להוסיף 10 גרם של הסוכן שלה בריפוי (1:10 במשקל). מערבבים את התערובת בעזרת פיפטה פלסטיק למשך 2-3 דקות.
הערה: מערבבים 90 גר' PDMS עם 10 גרם של ריפוי סוכן הזיוף של שבבי 6. - מניחים את התערובת בתוך ואקום desiccator וחדר משאבת במשך כ 30 דקות כדי להסיר בועות אוויר לכוד לתוך PDMS.
- למקם את בסיס התבנית בצלוחית P100 ויוצקים 15 מ"ל של התערובת על העובש באמצעות מזרק.
הערה: 15 מ"ל מוביל לגובה הכולל שבב של 1.5 מ מ. - מקם את המבנה PDMS-עובש בתוך ואקום desiccator וחדר משאבת עד אין בועות אוויר יותר מתפוצץ על פני השטח של PDMS.
הערה: שלב זה לוקח בערך 30 דקות. - לדחוף כשהפחד בתחתית הפטרי באמצעות טיפ קונוס כדי למנוע נפח מת PDMS מתחת לחם הקודש. מניחים את המכשיר PDMS-עובש בתנור להגדיר ב- 70 מעלות צלזיוס במשך שעתיים לפחות.
- Demold את הבלוק PDMS ברדס כימי באמצעות מרית נירוסטה שטוח ועל ידי שפיכת אלכוהול איזופרופיל על השבב. למקם אותו על הספסל פלדת אל-חלד של מכסה המנוע.
- לחתוך פרוסות הסיליקון, demold המשוכפל PDMS באמצעות אזמל.
- חותכים מסביב (עזוב 2-מ מ שוליים) השבב בעזרת איזמל או סכין גילוח.
- ניקוב פתחי הכניסה על ידי לחיצה על 1.5 מ מ קוטר בו בחוזקה, להניע אותו לעשות את החור של הים. . לעשות את אותו הדבר על אזורי ייעודי ארבע של השבב שבו להיות מוזרק נוזל.
- לנקות את השבב על ידי דבק ומתקלף דבק בצד microstructured. מפזרים אלכוהול איזופרופיל משני הצדדים. ואז לייבש את השבב עם חנקן בלחץ באמצעות רובה אוויר המכה.
3. ייצור של בדוגמת coverslips (24 × 24 מ מ2)
הערה: לטפל coverslips עם פינצטה מעוקל.
- תבניות פולי-ornithine (אש ף)
- חלות של O2 ניקוי פלזמה על coverslips זכוכית דקה. פלזמה פרמטרים: שאיבה למטה לחץ: 0.25 mbar; המשך אספקת2 : 3 דקות; גז זרימה: 10 sccm; חריגה מקסימלית: ±5 sccm; פלזמה משך: 3 דקות; הגדרת לחץ: 0.36 mbar; חריגה מקסימלית: ±0.10 mbar; הכוח להגדיר: 50 וואט; חריגה מקסימלית: 5%; אוורור משך: 45 s.
- µL 484 תערובת של חומצה אצטית, µL 56 של 3-methacryloxypropyl-trimethoxysilane, להשלים עם אתנול מוחלטת כדי לקבל נפח כולל של 15 מ"ל.
- באמצעות קונוס קצה 1-mL, לשים טיפה של 500 µL של פתרון זה על כל coverslip, לחכות 2-3 דק יבש באמצעות מגב מיקרופייבר חדר נקי.
הערה: Silanized coverslips זכוכית דקה ניתן לאחסן חודש בטמפרטורת החדר בתוך קופסאות פלסטיק אטום עם סרט פרפין פלסטיק. - במקום כל coverslip על coater ספין הממוקמים בסביבת חדר נקי. לשים טיפה של photoresist חיובי המכסים כ- 75% של coverslip (כ-500 µL) ו ספין-מעיל-4000 סל ד ל 30 s כדי להגיע עובי הסופי של 0.45 מיקרומטר.
- המקום coverslips עבור 1 דקות על גזייה עם טמפרטורת פני שטח של 115 מעלות צלזיוס.
- באמצעות aligner של המסכה, לחשוף את כל coverslip באורך-גל של 435 nm (G-קו) דרך המסיכה ייעודיים על פי הפרמטרים fabricant (UV מנה על 50-60 mJ.cm–1)
- להכין 2 התגבשות כלי הזכוכית, אחד, המכיל היזם (ללא דילול), המים יונים המכילים.
- צלילה אחת לכל coverslip ב המפתח עבור 1 דקות תוך ברציפות ובעדינות תוך ערבוב את המנה crystallizing. לאחר מכן להטביע כשהפחד במים יונים למקום ס' 5 כשהפחד על נייר סופג, לייבש אותו עם חנקן בלחץ באמצעות רובה אוויר המכה.
- להחיל על פלזמה2 הפעלת O באותם הפרמטרים כמו 3.1.1.
- מתחת למכסה המנוע, להדיח ארבע 170 µL טיפות של פתרון 100 µg/mL אש ף לכל P100 צלחת פטרי. לשים את הפנים עם תבנית של coverslips על כל אלה טיפות. חותם על צלחת פטרי עם סרט פרפין פלסטיק כדי למנוע ייבוש. דגירה ללון ב- RT.
הערה: הפתרון אש ף צריכים להישאר מחוברים coverslips מאת נימיות. - הכנת ארבעה נמענים (בדרך כלל P60 פטרי), למלא שלושה מהם PBS והרביעי עם מים יונים. להכין שני התגבשות כלי הזכוכית של כוהל טהור.
- להוציא את כל coverslip מן צלחות פטרי, להטביע אותו באמבטיה PBS הראשון עבור s 10-15, לפנות את הנוזל על רקמות סופג על ידי לשים את coverslip בצורה אנכית בצד, להוסיף אותה עם למשל את הפנים בדוגמת למעלה בתוך האמבטיה אתנול.
הערה: עם סיום פירוק photoresist, הוא הופך להיות קשה מאוד לאתר את הצד עם תבנית של coverslip. לכן, חשוב בשלב זה לאתר את המיקום שלו. - מקום האתנול התגבשות מאכל בתוך sonicator באמבט אולטרא (120 W / 35 קילו-הרץ) ולתת את photoresist להיות מומס למשך 3 דקות.
הערה: לשנות האמבטיה אתנול כל coverslips 4 להגביל את דילול על ידי PBS זה עלול לפגום פירוק photoresist. - להוציא את coverslip מהאמבטיה אתנול, ולאחר מכן לצלול זה מספר פעמים לתוך האמבט PBS השני. בדקו את ההיבט השטח שוב ושוב עד משטח שמנוני כמו זה תוצאות הסרט נוזלי הנותרים של אתנול נעלם.
- להטביע עבור s 5-10 את coverslip לתוך האמבט PBS השלישי. ואז מיד להעביר אותו לאמבט מים יונים. מניחים את coverslip על נייר סופג, לייבש אותו עם חנקן בלחץ באמצעות רובה אוויר המכה.
הערה: השטיפה האחרונה במים יונים משמש כדי למנוע היווצרות גבישים PBS במהלך השלב ייבוש.
- Photoresist מבנים לצורך כיול גובה
- בצע צעדים 3.1.4. כדי 3.1.8. באמצעות המסכה ייעודי (מסכה "Photoresist פסים", ראה קובץ משלים "Mask_Photoresist-stripes.dxf").
4. שבב וההספק והאחרון יישום
- צ'יפ בהרכבת על הזכוכית התחתונה מנות
- להכניס לתא פלסמה להפעלה משטח השבב PDMS והן את צלחת זכוכית שעליו בונדד. פרמטרים: שאיבה למטה לחץ: 0.25 mbar; המשך אספקת2 : 3 דקות; גז זרימה: 10 sccm; חריגה מקסימלית: ±5 sccm; פלזמה משך: 30 s; הגדרת לחץ: 0.40 mbar; חריגה מקסימלית: ±0.10 mbar; הכוח להגדיר: 50 וואט; חריגה מקסימלית: 5%; אוורור משך: 45 s.
- בעדינות הכניס את השבב PDMS המופעלת במגע עם coverslip זכוכית, בעדינות הפעילו לחץ על הקצוות של השבב להתחבר את השבב, coverslip. כדי להגדיל את הכוח מליטה, למקם את המכשיר בתנור ב- 70 מעלות צלזיוס למשך 5-10 דקות.
שים לב: אל תלחץ על חלקים המכילים עמודים, הם יקרסו תחת לחץ רב מדי. - מתחת למכסה המנוע (קרי -RT), בתוך 30 דקות לאחר מליטה, מקום קונוס עצה 10-µL מלא עם פתרון 100 µg/mL אש ף-IHs ולאחר מכן מזריקים את הנוזל. לכוון את עוצמת הקול כדי ליצור ירידה בחלק העליון של כל IHs. לאחר מכן, באמצעות קונוס קצה 1-mL, להוסיף PBS בצלוחית הפטרי מסביב השבב.
- תן את השבב-RT עם מינימום של זמן הדגירה 2 h. עבור לילה דגירה, חותם הפטרי באמצעות סרט פרפין פלסטיק כדי למנוע ייבוש.
הערה: הנוזל לא ידלוף החוצה השבב אחרת שהשבב חייב להיות מושלך. - לחץ קונוס עצה 10-µL בקלילות לתוך כל IH ולמצוץ את עודף של נוזלים. ואז לתקוע לחלוטין קונוס קצה בתוך השקע, ינסחו את הנוזל הנותר.
- החלף אש ף על ידי laminin להלן ההוראות שניתנו בשלבים 4.1.5 (ריקון) ו 4.1.3 (מילוי). תקופת דגירה-RT של 1 h.
- החלף laminin מאת הבאות תרבות בינוני ההוראות שניתנו בשלבים 4.1.5 (ריקון) ו 4.1.3 (מילוי). ההרכב של המדיום תרבות: MEM 81.8%; פירובט נתרן 100 מ מ 1%; Glutamax 200 מ"מ 1%; סוס סרום 5%; B27 תוספת של 2%, N2 תוספת של 1%, גנטמיצין 0.2%; לסנן את הפתרון באמצעות מסנן 220-nm. באמצעות קונוס קצה 1-mL, להחליף גם את PBS המקיפים את השבב מאת בינוני.
- מכניסים את השבב לתוך החממה מוסדר-37 מעלות צלזיוס ו-5% CO2 לפחות 5 שעות (או לילה) לפני נוירון זריעה.
- שבב בהרכבת שימוש בדוגמת coverslips
הערה: אם coverslips בדוגמת לכלול אובייקטים התייחסות חיובית photoresist, בצע את השלבים 4.2.1 ל 4.2.9. אחרת, לבצע רק צעד 4.2.3, מקל המכשיר PDMS על coverslip אש ף בדוגמת כפי שמעידה 4.1.2, לשים בינוני תרבות בתוך, מסביב השבב ואז ללכת צעד 4.2.10- להפקיד טיפת מים על משטח זכוכית מיקרוסקופ עבים מלבני, לתקוע את coverslip על השקופית זכוכית על ידי נימיות (שאינם בדוגמת בצד הפונה השקופית זכוכית). תחת מיקרוסקופ, סמן את המיקום של הפסים photoresist בחלקו האחורי של השקופית זכוכית באמצעות עט לבד.
- מניחים את coverslip זכוכית בדוגמת בעל המסיכה aligner המסכה. להסתמך על שנשמעה עם העט הרגיש כדי למרכז את האובייקטים הפניה photoresist.
- בצע את שלב פלזמה כפי שמתואר 4.1.1 על השבב PDMS.
- מקם את השבב PDMS את המחזיק המצע ניידים (צ'אק) aligner המסכה.
הערה: כדי להגדיל את החדות אופטיים, במקום רקיק סיליקון מתחת השבב PDMS. כשהפחד סיליקון צריכים להישאר מחובר בחוזקה על הצ'אק במהלך תהליך יישור (שימוש קלטת שקופה לתקוע את זה לצ'אק). - הרם את הצ'אק על גבול מכניים קשר כדי ליישר את השבב עם המערך של פסים photoresist ממוקם על coverslip.
- להשיג קשר מכני בין השבב של coverslip על ידי מסיים הרמת הצ'אק עד פני השטח של PDMS עמודי מגע של coverslip זכוכית.
- . תוריד את הצ'אק. הסר את coverslip כעת בונדד לשבב ממחזיק מסיכה. ואז למקם את המכשיר לתוך צלחת פטרי 35 מ מ, ולהעביר הכל לתוך התנור (טמפרטורה: 70 מעלות צלזיוס) למשך 5-10 דקות להגביר את עוצמת מליטה.
- בצע כמו שלב 4.1.3.
הערה: אם באמצעות אש ף בדוגמת coverslips, עבור ישירות משלב 4.2.7 לשלב 4.2.9. - החלף את אש ף על ידי הבאות בינוני ציפוי שההליכים המתוארים צעדים 4.1.5 (ריקון) ו 4.1.3 (מילוי). באמצעות קונוס קצה 1-mL, להחליף גם את PBS המקיפים את השבב מאת בינוני.
- מכניסים את השבב לתוך החממה מוסדר-37 מעלות צלזיוס ו-5% CO2 עד נוירון זריעה, עם מינימום של זמן הדגירה 5 שעות.
5. נוירון תרבות
- הכן 100 מ של דיסקציה בינוני (HH בינוני) על ידי ערבוב 10 מ"ל של HBSS 10 x, 2 מ של Hepes 1 מ' ו- 88 מ ל מים סטריליים בקבוקון פלסטיק 200-mL.
הערה: המדיום HH ניתן להכין יום קודם התרבות. - לנתח ההיפוקמפוס של העובר עכברים E18 שחולצו מן אמא מורדמים מאת נקע בצוואר הרחם (C57BL/6J עכברים מן הנהרות צ'ארלס). השלבים של ביתור הם למשל מפורט ב- 16.
- מקום ההיפוקמפוס צינור פלסטיק המכיל טריפסין (0.3 מ"ל של טריפסין 2.5%, ללא EDTA לתוך מ 2.7 ל HH בינוני) למשך 10 דקות ב 37 ° C כדי ליזום דיסוציאציה כימי.
- מחק כמעט את כל הנוזל ולהחליף אותו עם 5-10 מ ל HH באמצעות פיפטות פלסטיק חד פעמיות. לעשות את זה 3 פעמים. למילוי האחרון, להשתמש 1 מ"ל של ציפוי בינוני במקום HH.
- מכנית מביצועם רקמות באמצעות קונוס קצה 1 מ"ל השואף, הוצאת האחסון מלאה מספר פעמים, הימנעות עושה בועות באמצעות לא יותר מ 15-20 קטעים.
- בנמען 500 µL נפרדים, להכין את הפתרון באמצעות 5 µL של השעיה תא מעורבבת עם µL 45 ל- PBS. לקחת 1 µL של פתרון זה באמצעות פיפטה µL 10 והכנס את המתלים מדולל לתוך מונה תא Malassez. להשתמש את הסימנים הניתנים 17 כדי לאמוד את מספר התאים.
הערה: ההיפוקמפוס יחיד מספק בדרך-כלל כ- 0.5 מיליון של נוירונים. - צנטריפוגה ב 100 x g דקות 6-RT.
- למחוק את תגובת שיקוע ולהחליף אותו על ידי נפח בינוני ציפוי הדרוש להשגת ריכוז של 10 מיליון תאים למ"ל. Resuspend תאים על-ידי במרוכז מתאווים והוצא התליה תא עם קונוס קצה 1-mL.
- לצייר את המדיום ציפוי נוכח השבב (עיין שלב 4.1.5). לאסוף 2-3 µL של הפתרון טרי resuspended באמצעות פיפטה של 10-µL, להזריק הים (עיין בהליך הזרקת שמתואר בשלב 4.1.3). חזור מיד את אותה הפעולה משקע החשמל.
- מזריקים באותו אמצעי אחסון של ציפוי במדיום כל המאגר (עיין שלב 4.1.3).
הערה: להתבונן במהירות את השבב מתחת למיקרוסקופ כדי לבדוק את הצפיפות של תאים. סדר גודל של האופטימלית תא צפיפות מקביל בערך 5-10 תאים בתוך השטח מרובע מופרדים על ידי 4 עמודים (על 0.3 מ מ2, כלומר על 15-20 תאים לכל מ מ2). - בסופו של דבר חזור על שלב 5.10 להשתמש במקום זאת 0.5-1 µL של התא השעיה להגיע לצפיפות תא יישוב.
- להכניס את השבב הזריעה בתוך אינקובטור מוסדר ב- 37 ° C 5% CO2.
6. זריחה תצפית הדרה
- החלפה של תרבות בינוני על-ידי המדיום הדמיה.
- להכין המדיום הדמיה כמו 4.1.7 אבל להשתמש במקום זאת MEM ללא פנול אדום ולהוסיף לתוספי פלורסנט. באת השאיפה הזאת, לדלל לתוספי (משקל מולקולרי 10,000 g/mol, פתרון מניות מרוכזת בשעה 10 מ"ג/מ"ל ב- PBS) על מנת להשיג ריכוז סופי של 0.5-1 מ ג/מ ל המדיום הדמיה.
הערה: שימוש לתוספי conjugates עם קליטה/פליטה maxima 496/524 או 650/668. מעדיפים הראשון תמונה 0.45 מיקרומטר מבנים photoresist חיובי גבוה (כדי להיפטר שלהם פלורסצנטיות אוטומטית פס אדום), השנייה התמונה נוירונים (פחות רעיל). - לרוקן את כל פתחי הכניסה באמצעות פיפטה של 10-µL ולמלא מחדש אותם לחלוטין עם המדיום הדמיה (עיין שלבים 4.1.3 ו 4.1.5 על המתודולוגיה המדויקת של החלפת בינונית).
- להכין המדיום הדמיה כמו 4.1.7 אבל להשתמש במקום זאת MEM ללא פנול אדום ולהוסיף לתוספי פלורסנט. באת השאיפה הזאת, לדלל לתוספי (משקל מולקולרי 10,000 g/mol, פתרון מניות מרוכזת בשעה 10 מ"ג/מ"ל ב- PBS) על מנת להשיג ריכוז סופי של 0.5-1 מ ג/מ ל המדיום הדמיה.
- הדמיה
- מקם את השבב תחת מיקרוסקופ epifluorescence מצויד עם חדר הסביבה מוסדר ב 37 ° C ו- 5% של CO2. שימוש 40 X, מפתח נומרי (NA) 0.8 יבש אובייקטיבית, 30% כוח מלא (מלא כוח: 3 W) ו- ms 30 של זמן החשיפה. לרכוש תמונות של תאים על המוקד (מתוך אחת מספר תמונות רצופות במקרה של הניסויים בצילום מואץ).
- ניתוח תמונות
- לנרמל תמונות באמצעות תהליך הפחתת רקע מיושם התוכנה ייעודי כדי לקבל רקע הומוגני. ראה 13 לפרטים על התמונה עיבוד צעדים הכלולים בתוכנה זו. את הדמות פלט. תבנית MAT.
- המר. קובץ MAT לתוך. תמונות של 8 סיביות TIFF באמצעות השגרה לשים חומר משלים (conversion_mattotiff.m, הקוראת importfilevol.m).
- לבצע ייבוא > רצף תמונות ב- ImageJ כדי לבנות סרטון אחד. תמונות TIFF.
- לחשב את עוצמת רשע P של אזור כיכר לשפות אחרות במרכז עמוד (הפניית אובייקט) לבין עוצמת רשע B של אזור מרובע של התא ללא תאים (רקע, כלומר גובה אפס). ראה 18 לקבלת דוגמה של מתודולוגיה מפורט של עיבוד תמונה.
הערה: הממד לרוחב של האזורים מרובע משמש בעוצמה הפניות להיות כמחצית מקוטר עמוד כדי לקבל מספר מספיק של פיקסלים תוך הימנעות זיהום האור של שולי העמוד. - השתמש בערכים P ו- B להקים לחוק ההמרה ליניארי של עוצמת אני גובה h:
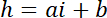
עם hג הגובה ידוע של החדר,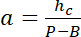 ,
,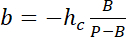
הערה: PDMS מציגה אין autofluorescence לזיהוי. - בחר אזור סביב האזור בעל עניין, לשלב את עוצמת השימוש ImageJ (ראה 19 לפרטים נוספים), יחול חוק הגיור בשנת 6.3.5 כדי למדוד את הנפח של תא לתא.
הערה: האזור של עניין ייתכן שנבחר בהתבסס על זריחה של רכיבי משנה הסלולר כמו אקטין, למשל, עבור הבחירה של צמיחה קונוס בנוירונים GFP-LifeAct, בחר את אזור עניין בערוץ פליטת ה-GFP, שמור קווי המתאר של זה האזור באמצעות של רועי מנהל כלי ולאחר מכן למדוד נפח התאים סגור בתוך אזור אותו בערוץ פליטה של לתוספי (באדום).
תוצאות
התוצאה של תהליך ייצור שמתואר בסעיפים 1 ו- 2 מודגם על-ידי התמונות של איור 1A-1B , העקומה של איור 1C. השולחן של איור 1D מציג את הערכים החספוס של שני אזורים נציג אחר של השבב PDMS, דהיינו המרכזי ו 20 מיקרומטר גבוהה הבא ביניים לתא. ירידה ברמת החספוס בפקטור של כ- 7 התקבל באמצעות וופל סי חרוט במקום SU-8 photoresist. לאחר מכן, FXm הוחל לראשונה על פס photoresist של הגיאומטריה ידוע (איור 2 א) בתוך תא גבוהה 10 מיקרומטר. לאחר עיבוד תמונה ועוצמה המרה גובה (ראה גרף איור 2B), פרופילים FXm לבצע חתכים לאורך פס זו (איור 2C) לספק את הפרופילים גובה הרצויה (איור דו-ממדי). איור דו-ממדי מראה השוואה בין פרופילים שהושג באמצעות profilometry מכני ושיטות FXm. פרופילים אלה, כולל ערך edge ומישור, הם דומים מאוד, אימות השיטה. שימו לב כי הפיזור של נתונים FXm אינה מייצגת הרזולוציה האולטימטיבי של השיטה, כמו עוד העריך ב איור 3 ו- 4 איור, אבל התוצאות בעצימות נמוכה מועסק כדי למנוע השפעה אפשרית של חלש מאוד קרינה פלואורסצנטית-אוטומטי של photoresist ערוץ ה-GFP.
לאחר מכן, הבחנו neurites מיקרומטר 3 ו- 10 מיקרומטר צ'יימברס גבוהה (איור 3). סטיית התקן של רעשי הרקע הוא בערך 18 ננומטר לאחר בעוצמה כדי ההמרה גובה ותיקון רקע. ערך זה הוא מעט גבוה יותר מאשר המראה המחוספס הפיזי של משטחים PDMS casted על משטחי סיליקון (12 ננומטר, עיין בטבלה של איור 1D) אבל הרבה יותר נמוך מאשר בצבעוניות נמדדים על PDMS המתקבל SU-8 תבניות. תוצאות אלו לסמן את הערך המוסף של קדוח בארות סיליקון במקום פתיחה חורים לתוך SU-8 photoresist להטיל עמודים. ערך נמוך מאפשרת קליטה גבוהה יחס לרעש ותמונות מאוד ברור האחסון כגון זו המוצגת באיור 3 א. כדוגמה הנתונים ניתן לאחזר תמונות כאלה, חושבו הנפח של 1.6 מיקרומטר (כלומר 10 פיקסלים) רחב neurite פרוסה (ראה גרף איור 3B). שימוש בהערכה הראשונה התאמה לינארית של נתונים אלה נותן ערך גובה neurite אכזרי של בערך 400 nm, שניתן להשוותו למשל הקוטר עצב 500 ננומטר נמצאו ב 10 ימים הגורים ישן בתוך כפיס המוח 5. אנחנו גם משולב FXm עם micropatterns של אדהזיה המורכב באופן סדרתי abutted 2 מיקרומטר ו 6 מיקרומטר פסים רחב של 30 מיקרומטר באורכו. מטרתנו הייתה לחקור את השפעת רוחב neurite על צורתו התלת-ממד. איור 3C מציג ייצוג תלת-ממד הצבע של תמונת כל נוירון שהושג בחדר גבוהה 10 מיקרומטר. Neurites מתפשטים על 2 מיקרומטר, 6 פסים רחב של מיקרומטר, ואילו ממוקם על החמורים של הפס הגדול. גובה פרופילים נמשכו שלושה מקטעים שונים של הצלב. קוהרנטיות עם הגרף שמוצג באיור 3A, פני השטח משולבים על העלייה חתכים עם רוחב neurite (איור תלת-ממד).
אנחנו גם התמקדו צמיחה קונוס (GC) 3D מבנים. איור 4 A-B מציג שני GC פרופילים שונים להשיג חדר 3 גבוהה מיקרומטר, המבליטים את המבנה שלהם משנה מסועף. בנוסף, אנחנו ביצע ניסויים זמן לשגות לעקוב אחר הדינמיקה של הנפח של מחשבי קטלוגים כלליים בתוך תא גבוהה 12 מיקרומטר. איור 4C מציג מחזור של כיווץ שהפעלה של GC נתון בתוך סולם הזמן של כמה עשרות דקות. בזכות השימוש של עכברים GFP-lifeact, צמיחה קונוסים נרשמו נקודתית בהגל פליטה GFP (510 ננומטר) של התרכזות אקטין גבוהה שלהם. פני השטח המזוהים על אורך הגל שימש לשלב מעל הגל פליטה לתוספי-647 nm לחישוב נפח GC. איור 4D מראה סוף סוף את ההפצה של אמצעי אחסון GC נקודות זמן שונות ומיקום על שלושה נוירונים שונים, שבמרכזה ערך של מיקרומטר על 63.
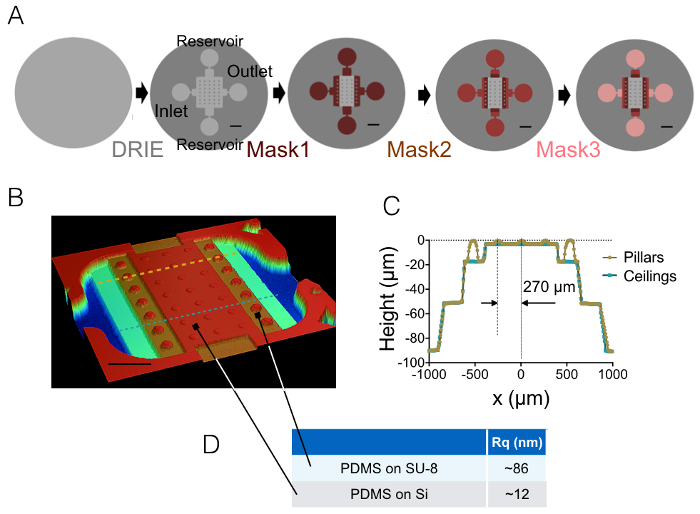
איור 1: צ'יימברס FXm PDMS. (א) ערכות ארבע השלבים העיקריים שונים של מיקרו-מלאכותית שמוביל כייר הסופי. המיקום של כניסת, אאוטלט, מאגרים מצוינים. גודל ברים: 1 מ. (ב) תמונה של התא PDMS FXm תוך שימוש profilometer אופטי. תמונה זו מציגה את החדר המרכזי המכיל 3 שורות של עמודים גבוהים 10 מיקרומטר לאהלי ביניים 20, 50 ו- 90 מיקרומטר בגובה. סרגל קנה מידה: 500 מיקרומטר. (ג) תצוגת חתך הרוחב של השבב לאורך שני הקווים מקווקו שצוירו ב (B). צהוב/זהב: חתך לאורך העמודים, כחול: חתך בין העמודים. (ד) אומר ערכים החספוס PDMS נמדדים על 50 × 50 אזורים2 מיקרומטר, יצוק על הסיליקון ועל תא 20 מיקרומטר ביניים SU-8 גבוה (ראה חצים עבור המיקום של אזורים אלה). ערכים רעים, התקבלו את המידות של שלושה תחומים שונים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
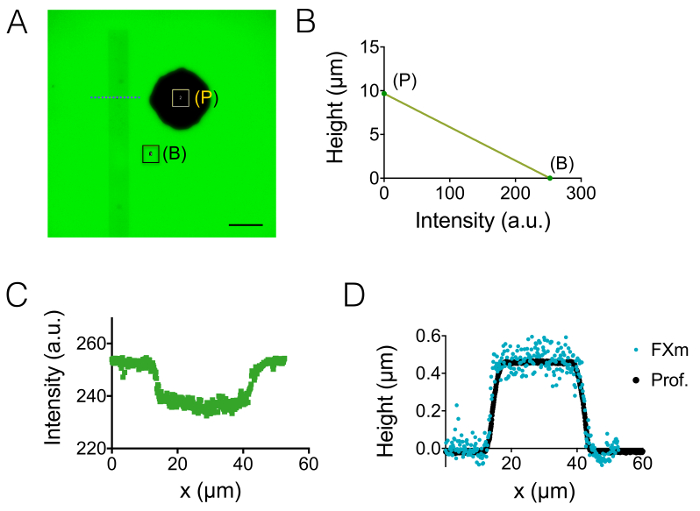
איור 2: כיול של השיטה FXm באמצעות פס photoresist כמו של האובייקט עניין. (א) GFP-זריחה התמונה נלקחה בתוך תא גבוהה 10 מיקרומטר מלא לתוספי MW 10,000 קליטת-488 nm ב 1 מ"ג/מ"ל. (ב': רקע, עמוד p:). התבוננות עם יעד נה X 0.8 40 יבש. סרגל קנה מידה: 50 מיקרומטר. (B) כיול ליניארי חוק המתקבל בעוצמת שני צבעוניים המלבנים שמוצג בפרופיל עוצמת קרינה פלואורסצנטית (ג) א שהושג ברמה של קו מקווקו כחול מוצג ב- (א), חוצה את photoresist רשע פס (0.45 מיקרומטר גבוהה חיובי photoresist). (ד) השוואה של הפרופילים המתקבל profilometer מכנית (נקודות שחורות), FXm לאחר עוצמת גובה המרה של נתוני (B) (נקודות כחולות). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
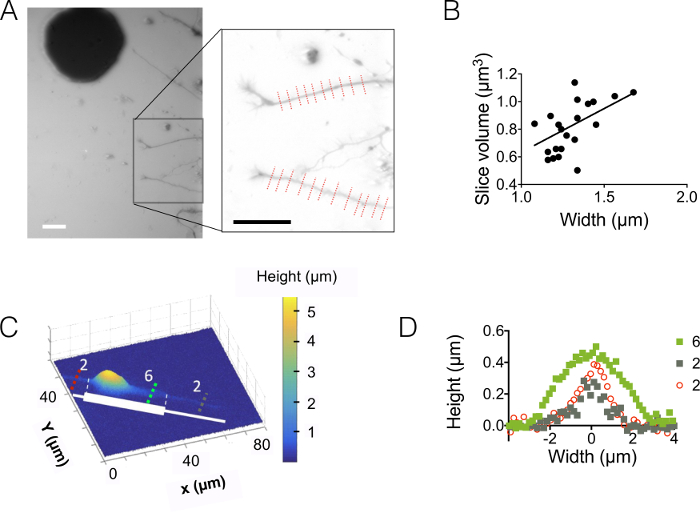
איור 3: הדמיה נפח Neurite. Neurite (א) המשתרעת אל החדר המרכזי של גבוהה מיקרומטר 3 סומא ממוקם בבית הבליעה ביניים הבא 15 מיקרומטר. הדמיה המבוצעת באמצעות לתוספי MW 10,000 קליטת-488 ננומטר, 40 X, נה 0.8 יבש אובייקטיבי. שיבוץ שהושג לאחר השימוש של השגרה הפחתת רקע מדגיש את neurites שני ובחרת כדי להתוות את הגרף בצד הימין. גודל ברים: 30 מיקרומטר. (ב) Neurite נפח פרוסה כפונקציה של neurite רוחב המתקבל הפרופילים 22 (ממוצע ב- 10 פיקסלים, כלומר על 1.6 מיקרומטר "neurite slice") המוצגים ב (א). הקו המלא מייצג התאמה לינארית של מדרון 0.4 מיקרומטר עובר דרך ראשית הצירים. (ג) תמונת צבע שווא של נוירון בדוגמת על פס דבק עשוי רצופים 2 מיקרומטר וגזעי 6 מיקרומטר רחב (המיוצגת בלבן). בתוך תא גבוהה 10 מיקרומטר מלא לתוספי MW 10,000 קליטת-647 נעשו מדידות של נה 40 x ננומטר ושימוש 0.8 יבש אובייקטיבי. (ד) גובה פרופילים התואמים בצבע קווים מקווקווים באיור (ג), שמירה על אותו צבע קוד. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
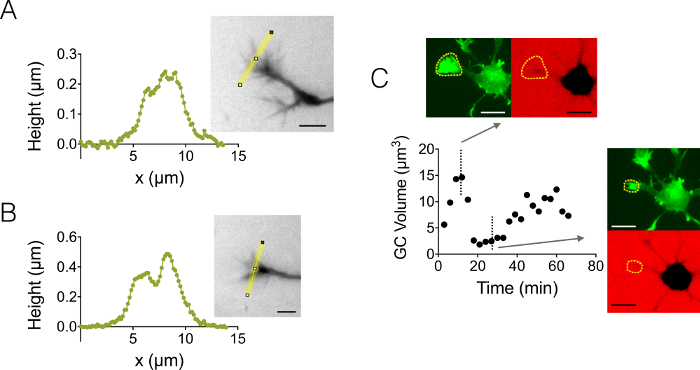
איור 4: הדמיה חרוט הצמיחה סטטיים ודינמיים. (A-B) צמיחה חרוט גובה פרופילי שהושג בחדר גבוהה מיקרומטר 3 לאחר עוצמת המרה גובה לאורך הקווים הצהובים מוצגות התמונות הקשורות. תצפית מבוצעים על-ידי מילוי עם 10,000 לתוספי MW קליטת-488 ננומטר, 40 X, נה 0.8 יבש אובייקטיבי. (ג) כל נוירון הדמיה בחדר גבוהה 12 מיקרומטר מלא לתוספי MW 10,000 קליטת-647 ננומטר. תצפיות שנעשו בשני ערוצים פלורסנט: GFP לוקליזציה חרוט הצמיחה (מקווקו צהוב), CY5 לחישוב נפח GC של קרינה פלואורסצנטית הדרה. השטח כולל באמצעות קווים מקווקווים הצהוב שימש לחישוב נפח GC. הגרף מציג את הווריאציה של GC האחסון לאורך זמן, מורפולוגיות המשויך ערוצי ה-GFP והן CY5 בנקודות זמן שונות נציג שני. כל הנתונים נרכשו באמצעות נה 40 x 0.8 יבש המטרה בכל הברים בקנה מידה מינימלית 3: 10 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
| שלב | מסיכת שכבה 1:8 מיקרומטר | מסיכה 2:30 מיקרומטר שכבה | מסיכה 3:40 שכבה מיקרומטר |
| סוג SU-8 | 2007 | 2025 | 2050 |
| Spincoating | 30 s @ 2000 סל ד | 30 s @ סל ד 3050 | 30 s @ 3250 סל ד |
| אופים רך | 3 דקות @ 95 ° C | 2 דקות @ 65 ° C + 6 דקות @ 95 ° C | 3 דקות @ 65 ° C + 7 דקות @ 95 ° C |
| חשיפה אנרגיה | mJ 110/ס מ2 | mJ 155/cm2 | mJ 170/cm2 |
| לאפות לאחר חשיפה | 4 דקות @ 95 ° C | 1 דקות 65 ° C + 6 דקות @ 95 ° C | 2 דקות @ 65 ° C + 7 דקות @ 95 ° C |
| פיתוח | 2 דקות 30 s | 5 דקות | 6 דקות |
| (אופציונלי) קשה לאפות | 3-5 דקות 200 ° C | 3-5 דקות 200 ° C | 3-5 דקות 200 ° C |
טבלה 1: צעדים פוטוליתוגרפיה שבוצעה לבנות מכשיר המכיל תא מרכזי של μm 12 גובה. גבהים של התאים ביניים: 20, 50 ו- 90 מיקרומטר.
| שלב | מסיכה 1:10 מיקרומטר שכבה | מסיכה 2:30 מיקרומטר שכבה | מסיכה 3:40 שכבה מיקרומטר |
| סוג SU-8 | 2007 | 2025 | 2050 |
| Spincoating | 30 s @ 1500 סל ד | 30 s @ סל ד 3050 | 30 s @ 3250 סל ד |
| אופים רך | 3 דקות @ 95 ° C | 2 דקות @ 65 ° C + 6 דקות @ 95 ° C | 3 דקות @ 65 ° C + 7 דקות @ 95 ° C |
| חשיפה אנרגיה | mJ 125/cm2 | mJ 155/cm2 | mJ 170/cm2 |
| לאפות לאחר חשיפה | 4 דקות @ 95 ° C | 1 דקות 65 ° C + 6 דקות @ 95 ° C | 2 דקות @ 65 ° C + 7 דקות @ 95 ° C |
| פיתוח | 2 דקות 30 s | 5 דקות | 6 דקות |
| (אופציונלי) קשה לאפות | 3-5 דקות 200 ° C | 3-5 דקות 200 ° C | 3-5 דקות 200 ° C |
בטבלה 2: צעדים פוטוליתוגרפיה שבוצעה לבנות מכשיר המכיל תא מרכזי של 10 μm בגובה. גבהים של התאים ביניים: 20, 50 ו- 90 מיקרומטר.
| שלב | מסיכה 1:12 מיקרומטר שכבה | מסיכה 2:32 שכבה מיקרומטר | מסיכה 3:40 שכבה מיקרומטר |
| סוג SU-8 | 2015 | 2025 | 2050 |
| Spincoating | 30 s @ 3250 סל ד | 30 s @ 2500 סל ד | 30 s @ 3250 סל ד |
| אופים רך | 3 דקות @ 95 ° C | 2 דקות @ 65 ° C + 5 דקות @ 95 ° C | 3 דקות @ 65 ° C + 7 דקות @ 95 ° C |
| זמן החשיפה | mJ 140/ס מ2 | mJ 157/cm2 | mJ 170/cm2 |
| לאפות לאחר חשיפה | 4 דקות @ 95 ° C | 1 דקות 65 ° C + 5 דקות @ 95 ° C | 2 דקות @ 65 ° C + 7 דקות @ 95 ° C |
| פיתוח | 3 דקות | 5 דקות | 6 דקות |
| (אופציונלי) קשה לאפות | 3-5 דקות 200 ° C | 3-5 דקות 200 ° C | 3-5 דקות 200 ° C |
טבלה 3: צעדים פוטוליתוגרפיה שבוצעה לבנות מכשיר המכיל תא מרכזי של 3 μm בגובה. גבהים של התאים ביניים: 18, 50 ו- 90 מיקרומטר.
נתונים משלימים 1: masks_neuron_volume_chips.tiff. הצג סכימתי של המסכות נהגה לפברק את המכשיר PDMS (DRIE מסכה, מסכות 1-3). אנא לחץ כאן כדי להוריד את הקובץ.
נתונים משלים 2: קובץ "masks_neuron_volume_chips.dxf". קבצים אלקטרוניים המאפשר לפברק את המסכה DRIE ומסיכות 1-3. אנא לחץ כאן כדי להוריד את הקובץ.
נתונים משלים 3: "Mask_Photoresist-stripes.dxf". קבצים אלקטרוניים המאפשר לפברק את המסיכה המשמש את פוטוליתוגרפיה של פסים photoresist. אנא לחץ כאן כדי להוריד את הקובץ.
משלים נתונים 4: קובץ conversion_mattotiff.m אנא לחץ כאן כדי להוריד את הקובץ.
נתונים משלימים 5: קובץ importfilevol.m אנא לחץ כאן כדי להוריד את הקובץ.
Discussion
אמצעי הדמיה של נוירונים, מהווה אתגר עבור הטכניקה FXm עקב בהרחבות ארוכים ודקים של תאים אלה. פרוטוקול זה מתאר גרסאות של אותו סוג של מכשיר microfluidic המוקדש נוירון הדמיה.
לצד ההיבטים של עיצוב microfluidic, הבחירה של המטרה הבסיסית עבור הדמיה הדרה פלורסצנטיות, מרמז על פשרה בין רוחבי ברזולוציה ובהירות תמונה. הוכח 13 כי נה גבוהה מוביל לעומק של המוקד קטן יותר מאשר הגובה קאמרית איננה מזיקה על הדיוק של מדידת נפח אם דימות בוצע לעבר המוקד ואם שוליים מספיק שנשאר בין קו המתאר של העצם של אני nterest, את גבולות השטח אינטגרציה. עם זאת, השימוש תא גבוהה בהרבה מזו העומק של המוקד פוגע בהירות התמונה עקב פוטון דיפוזיה, אשר מחליק קצוות האובייקטים של ריבית. הזיוף של תא מיקרומטר 3 גבוהה מופחתת טשטוש לרוחב וסיפק תמונות הדרה פלורסנט מוגדרת בצורה יוצאת דופן היטב אפילו באמצעות נה גבוהה (0.8) 40 X מטרות כדי להמחיש סניפים עצביים עם רזולוציה גבוהה לרוחב.
שבב בהרכבת הוא שלב קריטי, במיוחד במקרה של 3 מיקרומטר גבוהה צ'יימברס, אך זהיר מניפולציה כפי שמתואר 4.1.2 ימנע קריסת הגג. פני השטח גבוהה יחס נפח הקשורים ללשכה דק אלה העלה גם את סוגיית יציבות לתוספי ריכוז לאורך זמן. אנחנו בדקנו כי ספיגת לתוספי השטח אחרי לילה אחד של דגירה היה זניח: לאחר החלפת לתוספי על ידי PBS, ההבדל בעוצמה בין העמוד ואת הרקע היה כ 1 לכל 1000 של הניגוד העוצמה הראשונית בין שני אזורים אלה בנוכחות לתוספי. שימו לב כי נוירונים עשויים לדבוק על coverslip התחתון, וגם על הגג PDMS. אפקט זה נעלמת כאשר שימוש בדוגמת coverslips (כלומר כאשר אנו לא דגירה דבק מולקולות בתוך תא PDMS), הציפוי הוא לכן בקפדנות מקומי על החלק התחתון של החדר.
מלבד שלהם מורפולוגיה מאתגר, נוירונים הם די מתאימה כדי FXm בשל העובדה כי אחד המגבלה העיקרית של השיטה, כלומר לתוספי אנדוציטוזה, הוא מוגבל מאוד בתאים אלה. בחרנו 10 kDa ניסוח לדכא בטווח הארוך טווח (בשעות) כל התופעות אנדוציטוזה גלוי.
לסיכום, הפשטות הרעיוני של FXm מאוזנת על ידי קבוצת בעיות ניסיוני אשר נפתרו על ידי פרוטוקול הנוכחי, כגון החספוס PDMS nanometric, גובה קאמרית מיקרומטר, או רקע תיקון לתיקון לא שווה של התקרה PDMS בין העמודים. עם זאת, השימוש תא microfluidic קרוב להגבלת המדיום פלורסנט מניב מספר אילוצים ייחודיים כמו הצורך של עמודי תמיכה, אשר מוריד את השטח יעיל זמין עבור אדהזיה התא, או הצורך לשלול סומא המרכזי תא להתבונן הרחבות עצביים עם הבהירות הגבוהה, אשר מגביל את האזורים של התא נגיש תצפית ברזולוציה גבוהה. אבולוציה אפשרית אחת של שיטה זו יהיה להיפטר ההסגר הפיזי הזה, והוחלף על ידי. אדם אופטי. פיתוח חדש של מיקרוסקופ אור גיליון יכול להיות משולב ביתרון עם FXm בעתיד.
Disclosures
המחברים מצהירים ללא ניגוד אינטרסים.
Acknowledgements
המחברים רצתה להכיר ChiLab, חומרים, מיקרוסיסטמס מעבדה - פוליטקניקו di טורינו - DISAT, בדמותו של פרופסור C F Pirri, ד ר מ' Cocuzza, ד ר Marasso L S, על תמיכתם יקר ב תהליך פיתוח, ייצור המכשיר. אנו מודים ויקטור ראסין מ Quantacell לדיונים ותמיכה בעיבוד תמונה. אנו אסירי תודה איזבל Grandjean, מאנון Chartier מהמתקן חיה ובמכון קירי על תמיכתם של עכברים, ואת פבלו וורגאס לנון אנה-מריה (ובמכון קירי) סיפק לנו העכברים GFP LifeAct. אנו מודים על אוליבייה Thouvenin אינסטיטוט Langevin ו Cadart קלוטיד, לריסה Venkova, מתיו פיעל מ ובמכון קירי - UMR 144, על עזרתם בהבנה של הדרה פלורסצנטיות בשיטה. לבסוף, אנו מודים הפלטפורמה הטכנולוגית של אינסטיטוט פייר-ז'יל דה-ז'אן (CNRS הפותר המתמטי 3750) על תמיכתם במיקרו-מלאכותית. עבודה זו נתמך בחלקה על ידי אירופה מחקר המועצה מתקדם מענק מס 321107 "צ'לו", אוניברסיטת PSL (פרוייקט SwithNeuroTrails), d'Avenir ANR Investissement, ואת IPGG Labex Equipex.
Materials
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Plasmalab System 100 | Oxford Instruments | To perform DRIE | |
| MJB4 mask aligner | SUSS MicroTec | SU-8 photolithography | |
| NXQ 4006 Mask aligner | Neutronix Quintel | Photolithography associated to DRIE | |
| Plasma cleaner | Diener Electronic | Pico PCCE | |
| Cell culture hood | ADS Laminaire | Optimale 12 | |
| Centrifuge | Thermo Fisher Scientific | Heraeus Multifuge X1R | |
| Incubator 37 °C 5% CO2 | Panasonic | MCO-170AICUVH-PE IncuSafe CO2 Incubator | |
| Epifluorescence microscope | Leica | DMi8 | |
| PDMS Oven between 65 and 80 °C | Memmert | ||
| Mechanical profilometer | Veeco | Dektak 6M Stylus Profiler | |
| Optical profilometer | Veeco | Wyko NT9100 | |
| Vacuum desiccator | Verrerie Villeurbanaise (Kartel Labware) | 230KAR | Diameter 200 mm |
| Ultrasonic bath sonicator | Labo Moderne | SHE1000 | Volume of the bath: 0.8 liter |
| Hotplate | Stuart SD162 | SD162 | |
| Masks | |||
| DRIE | Supplementary data | ||
| Su8 Mask 1 | Supplementary data | ||
| Su8 Mask 2 | Supplementary data | ||
| Su8 Mask 3 | Supplementary data | ||
| S1805 calibration stripes | Supplementary data | ||
| Small laboratory equipment | |||
| 1.5 mm hole puncher | Sigma-Aldrich | 29002519 (US reference) | |
| Scalpel or razor blade | |||
| 9" Stainless Steel Flat Spatula with Spoon | VWR International | 82027-532 | To demold PDMS |
| Top Lip Wafer Handling | VWR International | 63042-096 | |
| Curved tweezer | FST | Dumont #7 Forceps - Standard / Dumoxel | To manipulate glass coverslips |
| Substrates | |||
| Silicon wafer | Prolog Semicor Ltd | ||
| 24x24 mm glass coverslips | VWR | 631-0127 | |
| Photoresists and developpers | |||
| AZ 1518 positive photoresist | Microchemicals GmbH | Before DRIE process, thicknes 1.8 µm | |
| AZ 351B developer | Microchemicals GmbH | To develop positive AZ 1518 photoresist | |
| SU-8 2007 | MicroChem | ||
| SU-8 2025 | MicroChem | ||
| SU-8 2050 | MicroChem | ||
| PGMA developer | Technic | To develop SU-8 negative photoresist | |
| Microposit S1805 resist | Chimie Tech Services | Positive photoresist used to obtain 0.5µm high structures | |
| MF 26A developer | Chimie Tech Services | To develop positive S1805 photoresist | |
| Laboratory consumables | |||
| Disposable plastic pipette 3 mL | LifeTechnologies - ThermoFisher | ||
| P100 Petri dishes | TPP | 93100 | |
| 20 mL syringe | Terumo | SS+20ES1 | |
| Transparent scotch tape | |||
| Square wipes | VWR | 115-2148 | |
| Parafilm | DUTSCHER | 90260 | Plastic paraffin film |
| Chemicals | |||
| (3-Methacryloxypropyl)trichlorosilane | abcr | AB 109004 | |
| PDMS and curing agent Sylgard 184 | Sigma-Aldrich | 761036 | |
| isopropanol | W292907 | ||
| poly-ornithine | Sigma-Aldrich | P4957 - 50 mL | |
| Ethanol absolute | Sigma-aldrich | 02865 | 99.8% |
| 3-methacryloxypropyl-trimethoxysilane | Sigma-aldrich | M6514-25ML | (C4H5O2)-(CH2)3- Si(OCH3)3 |
| acetic acid | Sigma-aldrich | 71251-5ML-F | |
| Dextran 10kW conjugated with Alexa488 | LifeTechnologies - ThermoFisher | D22910 | Absoprtion at 488 nm |
| Dextran 10kW conjugated with Alexa647 | LifeTechnologies - ThermoFisher | D22914 | Absoprtion at 647 nm |
| Culture medium | |||
| MEM | LifeTechnologies - ThermoFisher | 21090-022 | |
| Horse Serum | LifeTechnologies - ThermoFisher | 26050088 | |
| B27 | LifeTechnologies - ThermoFisher | 12587-010 | |
| Glutamax 200 mM | LifeTechnologies - ThermoFisher | 35050-061 | |
| Sodium Pyruvate GIBCO 100 mM | LifeTechnologies - ThermoFisher | 11360-070 | |
| Gentamicin | LifeTechnologies - ThermoFisher | 15710-049 | |
| PBS | Sigma-Aldrich | D8537-500ML | |
| HBSS 10x | LifeTechnologies - ThermoFisher | 14180-046 | |
| Hepes 1M | LifeTechnologies - ThermoFisher | 15630-056 | |
| trypsin-EDTA | Sigma-Aldrich | 59418C-100ML | |
| Neurobasal | LifeTechnologies - ThermoFisher | 21103-049 | |
| Neurobasal without phenol red | LifeTechnologies - ThermoFisher | 12348-017 | |
| Softwares | |||
| Routine in Matlab for background normalization | Quantacell | Contact Victor Racine: victor.racine@quantacell.com | |
| ImageJ | To select specific ROI for image analysis | ||
| Routine | ImageJ | Supplementary data | |
| Routine | Matlab | Supplementary data |
References
- Jun, S., Taheri-Araghi, S. Cell-size maintenance: universal strategy revealed. Trends Microbiol. 23 (1), 4-6 (2015).
- Zlotek-Zlotkiewicz, E., Monnier, S., Cappello, G., Le Berre, M., Piel, M. Optical volume and mass measurements show that mammalian cells swell during mitosis. J. Cell Biol. 211 (4), 765-774 (2015).
- Kim, G. H., Kosterin, P., Obaid, A. L., Salzberg, B. M. A mechanical spike accompanies the action potential in Mammalian nerve terminals. Biophys J. 92 (9), 3122-3129 (2007).
- Iacono, D., et al. Neuronal Hypertrophy in Asymptomatic Alzheimer Disease. J Neuropathol Exp Neurol. 67 (6), 578-589 (2008).
- Cheli, V. T., et al. Conditional Deletion of the L-Type Calcium Channel Cav1. 2 in Oligodendrocyte Progenitor Cells Affects Postnatal Myelination in Mice. J Neurosci. 36 (42), 10853-10869 (2016).
- Kneynsberg, A., Collier, T. J., Manfredsson, F. P., Kanaan, N. M. Quantitative and semi-quantitative measurements of axonal degeneration in tissue and primary neuron cultures. J Neurosci Methods. 266, 32-41 (2016).
- Fouquet, C., et al. Improving axial resolution in confocal microscopy with new high refractive index mounting media. PloS one. 10 (3), (2015).
- Aguet, F., et al. Membrane dynamics of dividing cells imaged by lattice light-sheet microscopy. Mol Biol Cell. 27 (22), 3418-3435 (2016).
- Roland, A. B., et al. Cannabinoid-induced actomyosin contractility shapes neuronal morphology and growth. eLife. 3, (2014).
- Lu, Y. B., et al. Viscoelastic properties of individual glial cells and neurons in the CNS. Proc Natl Acad Sci USA. 103 (47), 17759-17764 (2006).
- Chen, J., Xue, C., Zhao, Y., Chen, D., Wu, M. H., Wang, J. Microfluidic impedance flow cytometry enabling high-throughput single-cell electrical property characterization. Int J Mol Sci. 16 (5), 9804-9830 (2015).
- Bottier, C., et al. Dynamic measurement of the height and volume of migrating cells by a novel fluorescence microscopy technique. Lab Chip. 11, 3855-3863 (2011).
- Cadart, C., et al. Fluorescence eXclusion Measurement of volume in live cells. Methods Cell Biol. 139, 103-120 (2017).
- Marasso, S. L., et al. A novel graphene based nanocomposite for application in 3D flexible micro-supercapacitors. Materials Research Express. 3 (6), 065001(2016).
- Welch, C. C., Goodyear, A. L., Wahlbrink, T., Lemme, M. C., Mollenhauer, T. Silicon etch process options for micro-and nanotechnology using inductively coupled plasmas. Microelectronic Engineering. 83 (4), 1170-1173 (2006).
- Fath, T., Ke, Y. D., Gunning, P., Götz, J., Ittner, L. M. Primary support cultures of hippocampal and substantia nigra neurons. Nat. Protoc. 4 (1), 78-85 (2008).
- abcam. Counting cells using a hemocytometer. , Available from: http://www.abcam.com/protocols/counting-cells-using-a-haemocytometer (2017).
- ImageJ. Getting intensity values from single ROI. Image Intensity Processing. , Available from: https://imagej.net/Image_Intensity_Processing (2017).
- ImageJ. 19. Tools. ImageJ User Guide. , Available from: https://imagej.nih.gov/ij/docs/guide/146-19.html (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved