A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
أثر تطبيق النفط الزعتر على الحمولة الميكروبية أثناء تجفيف اللحوم
In This Article
Summary
الكائنات الحية الدقيقة مثل الإشريكيّة القولونية التي تلوث منتجات اللحوم تسبب الأمراض المنقولة عن طريق الأغذية. استخدام الزيوت الأساسية في عملية تجفيف اللحوم لم تدرس عميق. وهنا نقدم طريقة جديدة لتطبيق النفط الزعتر اللحوم أثناء التجفيف لتقليل الحمل الميكروبي في اللحوم المجففة.
Abstract
اللحوم هي وجبة عالية من بروتين المستخدمة في إعداد متشنج، وجبة غذائية شعبية، فيها بأهمية الحفاظ عليها والسلامة. لضمان سلامة الأغذية، وتمديد العمر الافتراضي للحوم ومنتجات اللحوم، استخدام المواد الحافظة الاصطناعية أو الطبيعية تم تطبيقها على عنصر التحكم والقضاء على البكتيريا المنقولة عن طريق الأغذية. ازداد اهتمام متزايد في تطبيق المواد المضافة إلى الأغذية الطبيعية للحوم. الكائنات الحية الدقيقة، مثل الإشريكيّة القولونية، تلوث اللحوم ومنتجات اللحوم، مما تسبب في الأمراض المنقولة عن طريق الأغذية. ولذلك، من الضروري تحسين عملية حفظ اللحوم. ومع ذلك، لم تدرس عميق استخدام الزيوت الأساسية عندما يتم يجري المجففة اللحوم. وفي هذا الصدد، هناك فرصة لزيادة قيمة اللحوم المجففة والحد من مخاطر الأمراض المنقولة عن طريق الأغذية عن طريق تطبيق الزيوت الأساسية أثناء عملية التجفيف. في هذا البروتوكول، نقدم طريقة جديدة لتطبيق الزعتر النفط (تيو) أثناء التجفيف، وعلى وجه التحديد في شكل بخار مباشرة في غرفة تجفيف اللحوم. للتقييم، ونحن نستخدم تركيز الحد الأدنى المثبطة (MIC) للكشف عن العدد من البكتيريا الضارة في العينات المعالجة مقارنة بعينات الخام. وتظهر النتائج الأولية أن هذا الأسلوب خيار قابلة للاستمرار والبديلة للمواد الحافظة الاصطناعية وأنه يقلل كثيرا من الحمل الميكروبي في اللحوم المجففة.
Introduction
وقد استخدمت التجفيف كطريقة تقليدية للحفاظ على الأطعمة منذ العصور القديمة. في الوقت الحاضر، هناك اهتمام متزايد بالتجفيف كوسيلة فعالة للغذاء الحفاظ على1،،من23. يتم استخدامه لتقديم مجموعة متنوعة من اللحوم المجهزة خصيصا. واحدة من الأكثر شهرة متشنج.
متشنج، واحدة من أقدم طرق حفظ اللحوم، يستند إلى المعالجة والتجفيف إلى انخفاض المياه النشاط، وبالتالي تمديد لها الصلاحية4. في الوقت الحاضر، متشنج كلحوم شُفي الحفاظ عليها لا تزال تحظى بشعبية كبيرة، حيث سلامة الغذاء والنكهة، والملمس ضرورية. يمكن استخدام إعداد متشنج لما يقرب من أي نوع من اللحوم، بما في ذلك لحم البقر ولحم الخنزير والدواجن، أو لعبة5، ويتطلب تقطيع اللحوم في شرائط العجاف والتجفيف. عادة، التنقيع اللحوم في التدخين أو حل علاج تستخدم جنبا إلى جنب مع التجفيف لإعطاء متشنج نكهة مميزة6.
على الرغم من اهتمام واسعة لتجفيف حقاً الحفاظ على الغذاء، احتمال تفشي الأمراض المنقولة عن طريق الأغذية من كولاي من اللحوم المجففة سيئة حرج ويلزم التحكم. وهناك بعض الدراسات الإبلاغ عن تفشي الأمراض المعوية المنقولة عن طريق الأغذية خاصة مع O157:H7 كولاي ، يعزى إلى الحرارة عدم كفاية المعالجة أثناء التجفيف الرئيسية. حالات مشابهة حدثت حتى في إعداده تجارياً متشنج7،،من89. ليفين وآخرون. 10 اقترح أن تنتقل عن طريق الكائنات الدقيقة يمكن البقاء على قيد الحياة من ظروف التجفيف معتدلة (حوالي 60 درجة مئوية) المستخدمة من قبل المنتجين متشنج التجارية. كولاي O157:H7 حالات تفشي الأمراض المنقولة بالأغذية في منتصف التسعينات ونسبت إلى الأرض المجففة منتجات اللحوم6،11. من المثير للاهتمام، وفي جميع الحالات السابقة، الخطر الرئيسي هو الناجمة عن مسببات الأمراض البكتيرية المعترف بها كقابلة للتطبيق ولكن غير كولتورابل (فبنك). تحت مختلف الضغوط مثل التغيرات في درجة الحرارة أو المجاعة، يمكن إدخال الخلايا كولاي المعروفة باسم ال12،الدولة فبنك13دولة بعينها. الخلايا فبنك قد أحياء ثم العودة إلى خلايا كولتورابل بالتعرض لظروف مناسبة وبعد ذلك خطرا على صحة الإنسان بسبب تنتقل عن طريق تلوث14،15. وهذا يعني أنه إذا كان يتم استهلاك اللحوم فورا بعد تجفيف المنتج أنها آمنة. بيد في حالة تخزين غير كافية، مثل زيادة الرطوبة، هناك مخاطر عالية لإعادة تنشيط الكائنات الممرضة والنمو الجرثومي.
وإلى جانب أساليب التجفيف وماء مالح، هناك ارتفاع طلب من المستهلكين لاستخدام المنتجات الطبيعية كبديل للمواد المضافة لتحسين نوعية الغذاء16،17. كان هناك اهتمام خاص بتطبيق المواد المضافة إلى الأغذية الطبيعية للحوم بدلاً من المواد الحافظة الاصطناعية الكلاسيكية18،19،،من2021. على الرغم من أن هناك عدم وجود أدلة تجريبية كافية في استخدام الزيوت الأساسية عند تجفيف اللحوم، يوضح البحث المبكر في هذا المجال فعلا نتائج إيجابية22،23.
منذ العصور الوسطى، وقد اعترفت الناس "مجمعات النفط" (الأخلاقيات)25،24،تشراكتيريستيكس مضادات الميكروبات، ومبيدات الحشرات والطفيليات على26. الأخلاقيات اليوم جزء من واحدة من أهم مجموعة من المركبات الطبيعية النشطة بيولوجيا. بين الأخلاقيات المختلفة، ثيمول واحد من أكثر معروفة جيدا. وهو يتألف من أكثر من 85% من تيو23. يمنع هذا الفينول التدهور الجرثومية والكيميائية عند إضافتها للغذاء. بالإضافة إلى ذلك، يمكن تحسين خصائصه المضادة للبكتيريا في تركيبة مع سائر المواد الحافظة الطبيعية27،2،،من2829،30. في الوقت الحاضر، الزعتر (الغدة الصعترية الشائع)، قد اعترفت عشب الذي ينتمي إلى أسرة شفوية ، كعامل توابل، فضلا عن لحوم فعالة جداً حافظة31. دراسة أجرتها غارسيا-Díez وآخرون. 30 على منتجات اللحوم وجدت أن تيو عرض نمط تثبيط أوسع نطاقا ضد مسببات الأمراض المنقولة عن طريق الأغذية عند مقارنتها بالزيوت الأساسية الأخرى. ولذلك، هناك فرصة لزيادة قيمة اللحوم المجففة والحد من مخاطر الأمراض المنقولة عن طريق الأغذية عن طريق تطبيق الزيوت الأساسية أثناء عملية التجفيف.
في هذا البروتوكول، نقدم طريقة جديدة لتطبيق تيو أثناء تجفيف اللحوم، وعلى وجه التحديد باستخدام ذلك في شكل بخار مباشرة في التجفيف الدائرة. للتقييم، ونحن نستخدم هيئة التصنيع العسكري لتحديد عدم وجود البكتيريا المسببة للمرض في عينات المعالجة بالمقارنة مع الخام منها. وتظهر النتائج الأولية أن هذا الأسلوب بديل فعال للغاية للمواد الحافظة الاصطناعية وأن يقلل إلى حد كبير الحمل الميكروبي في اللحوم المجففة.
Protocol
1-إعداد اللحوم
- الحصول حقو قصيرة من لحم البقر (لحم البقر الطازج من العضلة ذات الرأسين الفخذية) من مخبزين محلية ونقلها إلى المختبر.
ملاحظة: من المستحسن لنقل الخاصرة لحم البقر في درجة حرارة الغرفة (20-25 درجة مئوية)، لفترة لا تزيد عن 20 دقيقة في حقيبة مختومة المحكم. - لتعقيم السطح الخارجي لعضلة لحم البقر، في سلامة الصفحي مجلس الوزراء، يغسل العضلات بالرش مع الإيثانول 70% (v/v) ل 10 s باستخدام زجاجة ضغط من 500 مل. تطبيق 0.025 ز الإيثانول كل 1 سم2 من سطح العضلات.
- إزالة السطح الخارجي للحم أسيبتيكالي بسكين لتجنب الإيثانول المتبقي في العضلات الداخلية. قم بإزالة حوالي 3 مم الداخلية العضلات للحفاظ على الاتساق العضلات السطحية.
- حزمة العضلات في كيس من بلاستيك مختومة ونقلها إلى ثلاجة.
- تخزن في العضلات عند-18 درجة مئوية لمدة يوم واحد. ثم ذوبان الجليد العضلات المجمدة في 4 درجات مئوية عن ح 6.
ملاحظة: لذوبان الجليد، من المستحسن لنقل عضلة من المجمد إلى الثلاجة. - في مجلس الوزراء سلامة الصفحي، شريحة كل العضلات إلى شرائح سميكة 0.5 سم مع قطع لحم. ثم، بسكين قطع عليه في صغيرة 5 × 2.5 سم2 عينات مستطيلة.
- مجموعة عينات اللحوم مستطيلة في أكياس بلاستيكية وتخزينها في الثلاجة عند-18 درجة مئوية لاستخدامها في وقت لاحق.
2-إعداد العدوى موحدة وإجراء التطعيم في خزانة سلامة الصفحي
- تعد العدوى موحدة (1.5 × 108 زيمبابوي/mL) من كولاي ATCC 25922 لتطعيم عينات اللحوم.
- لإعداد العدوى الأسهم، أولاً الاستغناء عن ثقافة البكتيرية المجففة بالتبريد (تسليم المورد) في أنبوب معقم 15 مل المملوء مسبقاً مع 10 مل من تعقيم مخزنة مولر هينتون مرق (بمهب). زراعة هذا التعليق عن 24 ساعة عند 37 درجة مئوية.
- إعداد الحل الأسهم البكتيرية كما يلي: يستغرق حوالي 0.1-0.2 مل من تعليق البكتيرية وتمييع في قنينة 20 مل مغلقة بسداده مطاطية مع غطاء ألومنيوم المملوء مسبقاً مع 15 مل بمهب معقمة. زراعة هذا التعليق عن 24 ساعة عند 37 درجة مئوية.
- تخزين داخل الثلاجة عند درجة 4 مئوية للتحضير للعدوى موحدة.
- من الحل الأسهم (راجع الخطوة 2.1.1) تأخذ القولونية ه حوالي 0.1-0.2 مل من تعليق البكتيرية وتمييع في بلاستيك 15 مل تعقيم الأنبوب المملوء مسبقاً مع 10 مل من تعقيم مخزنة مولر هينتون مرق (بمهب). احتضان الأنبوب في 37 درجة مئوية ح 24.
- لإعداد العدوى موحدة (1.5 × 108 زيمبابوي/mL)، إضافة كميات صغيرة من هذا التعليق في أنبوب معقم 15 مل المملوء مسبقاً مع 10 مل بمهب معقمة.
- دقة دوامة الخليط وقياس الكثافة البصرية (OD) 600 نانومتر ب الكثافة32.
- كرر الخطوات 2.1.3-2.1.4 حتى OD أعرب كما هو زيادة القيمة ماكفارلاند بواسطة 0.5 مقارنة بقيمة بمهب نظيفة.
- لإعداد العدوى الأسهم، أولاً الاستغناء عن ثقافة البكتيرية المجففة بالتبريد (تسليم المورد) في أنبوب معقم 15 مل المملوء مسبقاً مع 10 مل من تعقيم مخزنة مولر هينتون مرق (بمهب). زراعة هذا التعليق عن 24 ساعة عند 37 درجة مئوية.
- لإجراء التلقيح، بوضع عينات اللحوم مستطيلة في رقائق الألومنيوم مختلفة اثنين (20 سم × 30 سم)، واحد لعينات مراقبة والثانية لعينات اللحوم الملقحين.
- على رقائق الألومنيوم الثانية، تطعيم عينات اللحوم النيئة مستطيلة مع 800 ميليلتر من تعليق البكتيريا من سلالة المحدد (وهذا يتوافق مع 1.2 × 108 زيمبابوي كل عينة اللحوم) بتوزيع بالتساوي العدوى على السطح.
- "الماصة؛" 400 ميليلتر على جانب واحد من العينة ولطف انتشر استخدام الناشرة خلية عقيمة على السطح. والسماح لهم الجافة للحد الأدنى 10 تكرار نفس الإجراء لبقية التعليق على الجانب الآخر من العينة.
- على رقائق الألومنيوم الثانية، تطعيم عينات اللحوم النيئة مستطيلة مع 800 ميليلتر من تعليق البكتيريا من سلالة المحدد (وهذا يتوافق مع 1.2 × 108 زيمبابوي كل عينة اللحوم) بتوزيع بالتساوي العدوى على السطح.
3-التجفيف والتطبيق تيو
- نقل كلا رقائق الألومنيوم التي تحتوي على عينات اللحوم مستطيلة من سلامة الصفحي مجلس الوزراء إلى المجفف: تغطية كل مع رقائق الألومنيوم، ثم قم بوضع العينات داخل المجفف.
- القيام بتجفيف في مختبر قياسية مجفف.
ملاحظة: أولاً، يسخن الفرن إلى 55 درجة مئوية. هذا الإجراء يمكن أن تستمر لمدة 20 دقيقة.- الجاف لعينات مراقبة ح 6 في 55 درجة مئوية، مع تجفيف قيم الرطوبة النسبية للهواء تتراوح بين 30-45 في المائة.
ملاحظة: تختلف قيم الرطوبة النسبية لهواء التجفيف في الوقت المناسب تبعاً لمعدل تبخر السائل من اللحم.
- الجاف لعينات مراقبة ح 6 في 55 درجة مئوية، مع تجفيف قيم الرطوبة النسبية للهواء تتراوح بين 30-45 في المائة.
- حساب حجم تيو المطبقة، والتعبير عن تركيز النفط كوحدة تخزين تيو كل مجلد مجفف (الهواء مل/لتر). على سبيل المثال، ينتج الجرعة من 1.5 مل تيو ل 53 (حجم المجفف) تركيز الهواء 0.028 مل/لتر. لتحديد هيئة التصنيع العسكري تيو كولاي، استخدام جرعات من 1.5 مل (الهواء 0.028 مل/لتر)، 1 مل (الهواء 0.019 مل/لتر)، ومل 0.75 (الهواء 0.014 مل/لتر).
- قبل التجفيف، لتطبيق تيو نقع الأبخرة (مع ثيمول كما المجمع الرئيسي 79%)، ورق الترشيح (12 سم × 20 سم) مع جرعة 1.5 مل تيو والمكان إلى المجفف أمام المروحة.
- الجاف للحوم تيو تعامل العينات باستخدام نفس الإجراء فيما يتعلق بعينات مراقبة (الخطوات 3.1 و 3.2).
ملاحظة: بعد إزالة نهايات عملية التجفيف وعينات، التبديل في الفرن ح 3 عند 80 درجة مئوية وتعيين إشارة صمام الهواء لتهوية بنسبة 100% من أجل تنظيف مخلفات الزيوت من الفرن.
4-العوامل الجرثومية التحليل
- قبل تلقيح اللحوم مع البكتيريا، فحص عينات اللحوم لأي غش. مظهر الوحل والكشف عن أي رائحة لاذعة وقوية إرشادية لتلف اللحوم. إذا كان النسيج يشعر غروي، قد بدأت البكتيريا تتكاثر على سطح اللحم.
- لتقييم كفاءة التطعيم، اختبار العينات الملقحين الخام لوجود كولاي ATCC 25922 ومقارنتها مع عينات مراقبة عدم تلقيح قبل عملية التجفيف. لهذا الغرض:
- تغسل كل عينة اللحوم (2 مراقبة العينات وعينات الملقحين 2). تعليق كل عينة اللحوم في قارورة معقمة ماء ببتون مخزنة (8.5 غرام من كلوريد الصوديوم، 1 غرام ببتون، وأقراص 5 من الفوسفات مخزنة المالحة، وز 1 "بولي سوربات" 80 في 1 لتر الماء) في نسبة 01:10 (w/v) مع مجموعة الأس الهيدروجيني من 7-7.3. اهتز باستخدام شاكر 140 لفة في الدقيقة لمدة 10 دقائق في درجة حرارة الغرفة.
ملاحظة: يغسل فورا بعد إجراء التطعيم. - تقييم العدد من البكتيريا بمعدل 6 × 6 إسقاط لوحة إجراء تلخيص تشن، والتصنيف، واروين33 على لوحة العد أجار (PCA) وماكونكي أجار (MCA).
ملاحظة: الأسلوب قطره 6 × 6 يستخدم أسلوب مرق التخفيف الجزئي لإعداد الوقت تخفيف المسلسل من العينة يتم التحقيق مع ماصة متعددة القنوات، وهو أقل من العمالة المكثفة وأكثر اقتصادا بالمقارنة مع الطريقة التقليدية33، 34. - زراعة تخفيف العينة التسلسلي الوقت قبل الإجراء طبق قطره 6 × 6 لتقييم كولاي.
ملاحظة: خاصة بالنسبة للأسلوب قطره × 6 6، لزراعة استخدام ستة 5 ميليلتر قطرات، من ستة تحديد تخفيف العينة يتم التحقيق مع ماصة متعددة القنوات. على أطباق بيتري المجففة على نحو ملائم، القطرات استيعاب بسرعة إلى أجار وزرع بهذه الطريقة مريحة جداً ويمكن التحكم فيها34. - احتضان أطباق بيتري في 37 درجة مئوية ح 24. وبعد فترة زراعة، تقييم عدد المستعمرات كولاي في أطباق بتري (زيمبابوي ز-1 من اللحوم المجففة) كما هو موضح في القسم 5.
- تغسل كل عينة اللحوم (2 مراقبة العينات وعينات الملقحين 2). تعليق كل عينة اللحوم في قارورة معقمة ماء ببتون مخزنة (8.5 غرام من كلوريد الصوديوم، 1 غرام ببتون، وأقراص 5 من الفوسفات مخزنة المالحة، وز 1 "بولي سوربات" 80 في 1 لتر الماء) في نسبة 01:10 (w/v) مع مجموعة الأس الهيدروجيني من 7-7.3. اهتز باستخدام شاكر 140 لفة في الدقيقة لمدة 10 دقائق في درجة حرارة الغرفة.
- بعد التجفيف، أخذ العينات المجففة الملقحين اثنين ومقارنتها مع عينتي المجففة التحكم غير تلقيح لصالحه كولاي، على التوالي. لتحديد وجود أو عدم وجود كولاي من هذه أمبليس sأربعة، الاضطلاع بعملية تخصيب اليورانيوم قبل كل عينة اللحوم على النحو التالي:
- تعليق كل عينة اللحوم في قارورة معقمة ماء ببتون مخزنة بشكل مؤقت (انظر الخطوة 4.2.1) ويهز باستخدام شاكر 140 لفة في الدقيقة لمدة 10 دقائق في درجة حرارة الغرفة. ثم احتضان كل قارورة في 37 درجة مئوية خلال ح 6 لتخصيب اليورانيوم قبل.
- للتقييم وزراعة البكتيريا، اتبع نفس الإجراء كما هو موضح في الخطوات 4-2-2-4-2-4.
5-استعراض النتائج
- بعد اكتمال الحضانة، إزالة أطباق بيتري من الحاضنة واستعراض النتائج على النحو التالي:
- دراسة لتقييم إجمالي عدد المستعمرات، اللوحات لوجود البكتيريا الهوائية الوسطى في محكمة التحكيم الدائمة (البقع البيضاء) ونموذجية كولاي المستعمرات (أحمر إلى وردي داكن) على هيئة مكافحة الاحتكارات. إذا تغيب مسببات المرض، يقدم كلا أجارس أي نمو.
- عد المستعمرات، وتحديد مقدار كولاي (زيمبابوي/غرام-1 من اللحوم المجففة) الحالية.
ملاحظة: حساب عدد المستعمرات (N) في تخفيف متتالية اثنين تحتوي على المستعمرات 30 أو أقل كل قطره (الشكل 1). ويتحدد عدد N من زيمبابوي/غرام-1 من اللحوم المجففة كالتالي35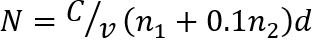
فيها، ج هو مجموع المستعمرات في جميع قطرات عدها، الخامس هو حجم تخفيف العينة المستخدمة كل قطره (هنا، مل 0.05)، ن1 هو عدد قطرات المستخدمة في إضعاف الأول، ن2 هو عدد قطرات المستخدمة في تخفيف الثانية، ويمثل د التخفيف منه تم القبض على التهم الأولى.
- تحليل البيانات الدقيقة، بتحويل عدد المستعمرات تسجيل زيمبابوي ز-1 وإخضاعها لتحليل التباين (ANOVA) للآثار الرئيسية للعلاج36.
- إجراء اختبار "توكي صادقة فرق كبير" (HSD توكي) لعدة مقارنات يعني36 وتحديد الفوارق الكبيرة بين العلاجات.
النتائج
ونحن قد أولاً سبق أن وضعت هذا الأسلوب باستخدام توابل النفط (أو) لتعزيز سلامة الأغذية، وزيادة قيمة اللحوم المجففة. وبصفة عامة، أظهرت التجارب السابقة أن كولاي يذهب إلى الدولة فبنك خلال التجفيف كاستراتيجية للبقاء على قيد الحياة. ويتضح من حقيقة أن هناك لا البكتيريا كولت...
Discussion
وقد أظهرت الأبحاث السابقة أن الكائنات الدقيقة التي تسبب الأمراض المنقولة بالأغذية البقاء التجفيف10. ولذلك من الضروري تطبيق المواد الحافظة قبل التجفيف لضمان سلامة الأغذية. في هذه الدراسة، علينا أن نركز على استخدام تيو. والسبب ذات شقين: أولاً، هناك طلب كبير من المستهلكين لاستخ?...
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
هذا العمل كان مدعوم من وكالة المنح الداخلية من "كلية أجريسسيينسيس المدارية"، (رقم المشروع: 20175013) و 20182023 سيجا المنح على حد سواء، من "الجامعة التشيكية لعلوم الحياة".
Materials
| Name | Company | Catalog Number | Comments |
| Meat cutter | Kalorik | KP 3530 | from Miami Gardens, FL, USA |
| Laminar safety cabinet | Faster s.r.l | from Italy | |
| Squeeze bottle of 500 mL | Merci | 632 524 325 025 | from CZ |
| Standard laboratory drier UFE 400 | Memmert | DE 66812464 | from Germany |
| Incubator | BT 120 | N/A | from CZ |
| Refrigerator and Freezer | Bosch | KGN34VW20G | from DE |
| Densitometer | Biosan | 220 000 050 122 | Latvia; supplier Merci, CZ |
| Escherichia coli ATCC 25922 | Oxoid | CL7050 | from CZ |
| Vortex | Chromservis | 22008013 | from CZ |
| Sterilized plastic tubes 15 mL | Gama | 331 000 020 115 | from CZ, supplier Merci |
| 20 mL injection vial | Healthy vial | hvft169 | from China |
| 20 mm sterile butyl rubber stopper | Merci | 22008013 | from CZ |
| 20 mm aluminum cap | Healthy vial | N/A | from China |
| Thyme essential oil | Sigma Aldrich | W306509 | from St Louis, MO, USA |
| Mueller Hinton Broth | Oxoid | CM0337 | from CZ |
| NaCl | Penta | 16610-31000 | from CZ |
| Peptone | Oxoid | LP0034 | from CZ |
| Phosphate-buffered saline | Sigma Aldrich | P4417 | from CZ |
| Polysorbate 80 (Tween 80) | Roth | T 13502 | from DE, supplier P-lab |
| Shaker SHO-1D | Verkon | DH.WSR04020 | from CZ, 10 - 300 rpm. 350 x 350 mm with a platform for flasks |
| Ethanol 70% | Bioferm | N/A | from CZ |
| MacConkey Agar | Oxoid | CM007 | from CZ |
| Plate Count Agar | Oxoid | CM0325 | from CZ |
| Filter paper | Merci | 480 622 080 040 | from CZ |
| Erlenmeyer flasks 250 mL | Simax | 610 002 122 636 | from CZ; supplier Merci CZ |
| Multichannel pipette | Socorex | S852820 | from Switzerland; supplier P lab, CZ |
| Microtiter plate | Gamma | V400916 | CZ |
| Microlitre pipette 100-1000 μL | Eppendorf | 333 120 000 062 | from Germany; supplier Merci, CZ |
References
- Eklund, M. W., Peterson, M. E., Poysky, F. T., Paranjpye, R. N., Pelroy, G. A. Control of bacterial pathogens during processing of cold-smoked and dried salmon strips. J. Food Prot. 67 (2), 347-351 (2004).
- Mahmoud, B. S. M., et al. Preservative effect of combined treatment with electrolyzed NaCl solutions and essential oil compounds on carp fillets during convectional air-drying. Int. J. Food Microbiol. 106 (3), 331-337 (2006).
- Rahman, M. S., Guizani, N., Al-Ruzeiki, M. H., Al Khalasi, A. S. Microflora Changes in Tuna Mince During Convection Air Drying. Dry. Technol. 18 (10), 2369-2379 (2000).
- Faith, N. G., et al. Viability of Escherichia coli O157: H7 in ground and formed beef jerky prepared at levels of 5 and 20% fat and dried at 52, 57, 63, or 68 C in a home-style dehydrator. Int. J. Food Microbiol. 41 (3), 213-221 (1998).
- Hierro, E., De La Hoz, L., Ordóñez, J. A. Headspace volatile compounds from salted and occasionally smoked dried meats (cecinas) as affected by animal species. Food Chem. 85 (4), 649-657 (2004).
- Nummer, B. A., et al. Effects of Preparation Methods on the Microbiological Safety of Home-Dried Meat Jerky. J. Food Prot. 67 (10), 2337-2341 (2004).
- Greig, J. D., Ravel, A. Analysis of foodborne outbreak data reported internationally for source attribution. Int. J. Food Microbiol. 130 (2), 77-87 (2009).
- Eidson, M., Sewell, C. M., Graves, G., Olson, R. Beef jerky gastroenteritis outbreaks. J. Environ. Health. 62 (6), 9-13 (2000).
- Allen, K., Cornforth, D., Whittier, D., Vasavada, M., Nummer, B. Evaluation of high humidity and wet marinade methods for pasteurization of jerky. J. Food Sci. 72 (7), (2007).
- Levine, P., Rose, B., Green, S., Ransom, G., Hill, W. Pathogen testing of ready-to-eat meat and poultry products collected at federally inspected establishments in the United States, 1990 to 1999. J. Food Prot. 64 (8), 1188-1193 (1990).
- Keene, W. E., et al. An outbreak of Escherichia coli O157:H7 infections traced to jerky made from deer meat. JAMA. 277 (15), 1229-1231 (1997).
- Oliver, J. D. The viable but nonculturable state in bacteria. J. Microbiol. 43, 93-100 (2005).
- Oliver, J. D. Recent findings on the viable but nonculturable state in pathogenic bacteria. FEMS Microbiol. Rev. 34 (4), 415-425 (2010).
- Khamisse, E., Firmesse, O., Christieans, S., Chassaing, D., Carpentier, B. Impact of cleaning and disinfection on the non-culturable and culturable bacterial loads of food-contact surfaces at a beef processing plant. Int. J. Food Microbiol. 158 (2), 163-168 (2012).
- Li, L., Mendis, N., Trigui, H., Oliver, J. D., Faucher, S. P. The importance of the viable but non-culturable state in human bacterial pathogens. Front. Microbiol. 5, 258 (2014).
- Hernández, H., Claramount, D., Kučerová, I., Banout, J. The effects of modified blanching and oregano essential oil on drying kinetics and sensory attributes of dried meat. J. Food Process. Preserv. , (2016).
- García-Díez, J., et al. The Impact of Essential Oils on Consumer Acceptance of Chouriço de vinho - A Dry-Cured Sausage Made from Wine-Marinated Meat - Assessed by the Hedonic Scale, JAR Intensity Scale and Consumers' "Will to Consume and Purchase.". J. Food Process. Preserv. 41 (4), (2017).
- Govaris, A., Solomakos, N., Pexara, A., Chatzopoulou, P. S. The antimicrobial effect of oregano essential oil, nisin and their combination against Salmonella Enteritidis in minced sheep meat during refrigerated storage. Int. J. Food Microbiol. 137 (2-3), 175-180 (2010).
- Holley, R. A., Patel, D. Improvement in shelf-life and safety of perishable foods by plant essential oils and smoke antimicrobials. Food Microbiol. 22 (4), 273-292 (2005).
- Petrou, S., Tsiraki, M., Giatrakou, V., Savvaidis, I. N. Chitosan dipping or oregano oil treatments, singly or combined on modified atmosphere packaged chicken breast meat. Int. J. Food Microbiol. 156 (3), 264-271 (2012).
- Ballester-costa, C., Sendra, E., Viuda-martos, M. Assessment of Antioxidant and Antibacterial Properties on Meat Homogenates of Essential Oils Obtained from Four Thymus Species Achieved from Organic Growth. Foods. 6 (8), 59 (2017).
- Hernández, H., et al. The effect of oregano essential oil on microbial load and sensory attributes of dried meat. J. Sci. Food Agric. 97 (1), 82-87 (2017).
- García-Díez, J., Alheiro, J., Falco, V., Fraqueza, M. J., Patarata, L. Chemical characterization and antimicrobial properties of herbs and spices essential oils against pathogens and spoilage bacteria associated to dry-cured meat products. J. Essent. Oil Res. 29 (2), 117-125 (2017).
- Cavanagh, H. M. A. Antifungal Activity of the Volatile Phase of Essential Oils: A Brief Review. Nat. Prod. Commun. 2 (12), 1297-1302 (2007).
- Tajkarimi, M. M., Ibrahim, S. A., Cliver, D. O. Antimicrobial herb and spice compounds in food. Food Control. 21 (9), 1199-1218 (2010).
- Nedorostova, L., Kloucek, P., Kokoska, L., Stolcova, M., Pulkrabek, J. Antimicrobial properties of selected essential oils in vapour phase against foodborne bacteria. Food Control. 20 (2), 157-160 (2009).
- Burt, S. Essential oils: Their antibacterial properties and potential applications in foods - A review. Int. J. Food Microbiol. 94 (3), 223-253 (2004).
- Ramanathan, L., Das, N. Studies on the control of lipid oxidation in ground fish by some polyphenolic natural products. J. Agric. Food Chem. 40 (1), 17-21 (1992).
- Yamazaki, K., Yamamoto, T., Kawai, Y., Inoue, N. Enhancement of antilisterial activity of essential oil constituents by nisin and diglycerol fatty acid ester. Food Microbiol. 21 (3), 283-289 (2004).
- García-Díez, J., Alheiro, J., Falco, V., Fraqueza, M. J., Patarata, L. Synergistic activity of essential oils from herbs and spices used on meat products against food borne pathogens. Nat. Prod. Commun. 12 (2), 281-286 (2017).
- Hussein Hamdy Roby, M., Atef Sarhan, M., Abdel-Hamed Selim, K., Ibrahim Khalel, K. Evaluation of antioxidant activity, total phenols and phenolic compounds in thyme (Thymus vulgaris L.), sage (Salvia officinalis L.), and marjoram (Origanum majorana L.) extracts. Ind. Crops Prod. 43, 827-831 (2013).
- Gouveia, A. R., et al. The Antimicrobial Effect of Essential Oils Against Listeria monocytogenes in Sous vide Cook-Chill Beef during Storage. J. Food Process. Preserv. 41 (4), (2017).
- Chen, C., Nace, G., Irwin, P. A 6 x 6 drop plate method for simultaneous colony counting and MPN enumeration of Campylobacter jejuni, Listeria monocytogenes, and Escherichia coli. J. Microbiol. Methods. 55 (2), 475-479 (2003).
- Herigstad, B., Hamilton, M., Heersink, J. How to optimize the drop plate method for enumerating bacteria. J. Microbiol. Methods. 44 (2), 121-129 (2001).
- . Practical food microbiology Available from: https://drive.google.com/file/d/0BzyVOLllJ0B1YmlEemZ5M1RZekU/view?ts=590d8019 (2003)
- Smith-Palmer, A., Stewart, J., Fyfe, L. Antimicrobial properties of plant essential oils and essences against five important food-borne pathogens. Lett. Appl. Microbiol. 26 (2), 118-122 (1998).
- Burt, S. a., Reinders, R. D. Antibacterial activity of selected plant essential oils against Escherichia coli O157:H7. Lett. Appl. Microbiol. 36 (3), 162-167 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved