JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
고기 건조 하는 동안 미생물 부하에 백 리 향 에센셜 오일의 응용 프로그램의 효과
요약
육류 제품을 오염 하는 대장균 등 미생물 발생 foodborne 병. 고기 건조 과정에서 에센셜 오일의 사용 깊이 공부 하지 했다. 여기, 우리는 고기에 말린 고기에서 미생물 부하를 줄이기 위해 건조 하는 동안 하는 백 리 향 에센셜 오일 적용의 새로운 방법을 제시.
초록
고기는 보존과 안전은 중요 한 육 포, 음식 식사의 준비에 사용 되는 고 단백 식사입니다. 식품 안전 보장을 하 고기 및 육류 제품의 수명 연장, 합성 또는 천연 방부 제를 사용 하 여 컨트롤에 적용 된 고 식중독 박테리아를 제거. 고기에 대 한 자연 식품 첨가제의 응용 프로그램에 관심이 점점 증가 했다. 미생물, 대장균, 등 고기 및 육류 제품, foodborne 병을 일으키는 오염. 따라서, 그것은 고기 보존 프로세스를 개선 하는 데 필요한입니다. 그러나, 고기는 건조 되 고 때 에센셜 오일의 사용은 하지 깊이 연구 되었습니다. 이와 관련, 말린된 고기 값을 증가 하 고 건조 과정에서 에센셜 오일을 적용 하 여 음식 관련 질병의 위험을 줄일 수 있는 기회가입니다. 이 프로토콜에서 우리 고기 건조, 건조 챔버에 직접 증기 형태로 특히 동안 백 리 향 에센셜 오일을 (테오) 적용의 새로운 방법을 제시. 평가, 우리는 원시 샘플에 비해 치료 샘플에서 해로운 박테리아의 수를 검색 하기 위해 최소 억제 농도 (MIC)를 사용 합니다. 예비 결과이 방법은 합성 방부 제를 가능한 대체 옵션 그리고 그것은 크게 말린된 고기 미생물 부하 감소를 보여준다.
서문
건조 식품을 보존 하기 위해 전통적인 방법으로는 고 대부터 사용 되었습니다. 요즘, 식품 보존1,2,3에 대 한 효과적인 방법으로 건조에 관심이 있다. 다양 한 특수 처리 된 고기를 만들기 위해 사용 됩니다. 가장 잘 알려진 중 하나입니다 육 포입니다.
경화 및 낮은 물 활동에 건조를 기반으로 하는 육 포, 고기 보존에 대 한 가장 오래 된 방법 중 하나 및 그러므로 그것의 수명을4확장 하. 요즘, 보존된 치유 고기는 여전히 매우 인기 있는 육 포, 어디 식품 안전, 맛, 질감은 필수품입니다. 육 포 준비 고기, 쇠고기, 돼지고기, 닭고기, 또는 게임5를 포함 하 여 거의 모든 종류에 사용할 수 있습니다 그리고 마른 스트립에 고기를도 마와 건조 필요 합니다. 일반적으로, 치료 솔루션 또는 흡연에 고기 marinating 사용 됩니다 건조 함께 주고 육 포의 특징적인 맛6.
진정으로 보존 식품을 건조의 광대 한 관심에도 불구 하 고 제대로 말린된 고기에서 대장균 , 식중독 발생의 위험이 중요 하 고 제어할 수 필요 합니다. 일부 연구 대장균 O157:H7, 부적절 한 열 처리 집 건조 하는 동안에와 특히 식중독 위장염 발발을 보고 있다. 비슷한 경우에도 상업적으로 육 포7,,89준비 생겼다. 레빈 외. 10 식중독 미생물 적당 한 건조 조건 (약 60 ° C) 상업 육 포 생산자에 의해 사용을 살아남을 수 있다고 제안 했다. E. 콜라이 O157:H7는 1990 년대의 한가운데에 음식 관련 질병의 발생 지상 말린 고기 제품6,11에 기인 했다. 흥미롭게도, 모든 이전 경우에서 주요 위험 비 culturable (VBNC)만 가능한 것으로 인식 하는 세균성 병원 체에 의해 발생 합니다. 온도 변화 또는 기아 등 다양 한 스트레스에서 대장균 세포 VBNC 상태12,13로 알려진 특정 상태를 입력할 수 있습니다. VBNC 셀 다음 적당 한 조건에 노출에 의해 culturable 셀에 다시 회복 될 수 있습니다 그리고 식중독 오염14,15인해 인간의 건강을 위협 하는 존재. 즉, 고기 제품을 건조 후 즉시 사용 하는 경우 안전 하다. 그러나, 증가 습도 등 부적 절 한 스토리지의 경우 병원 균 및 미생물 성장의 재 활성화의 높은 위험이 있다.
건조와 마리 네 이드 방법 외 첨가물 대신 천연 제품을 사용 하 여 식품 품질16,17개선에 소비자 로부터 높은 수요가 있다. 고전적인 합성 방부 제18,19,,2021대신 고기에 대 한 자연 식품 첨가제의 응용 프로그램에 특별 한 관심이 되었습니다. 비록 고기를 건조 할 때 에센셜 오일의 사용에 충분 한 실험적 증거의 부족이 있다,이 분야의 초기 연구는 이미 긍정적인 결과22,23보여 줍니다.
중세 시대부터 사람들이 그들의 항균, 살 충 용, 그리고 날짜인 chracteristics24,,2526에 대 한 에센셜 오일 화합물 (EOCs) 인식 했다. 오늘, EOCs 천연 생리 활성 화합물의 가장 중요 한 그룹 중 하나의 일부입니다. 다른 EOCs 중 티는 가장 잘 알려진 중 하나입니다. 그것은 테오23의 85% 이상 구성 됩니다. 이 페 놀은 음식에 추가 될 때 미생물 및 화학 저하를 방지 합니다. 또한 항균 속성 다른 천연 방부 제2,,2728,29,30와 함께에서 향상 될 수 있습니다. 요즘, 백 리 향 (Thymus vulgaris), 꿀풀과 가족에 속하는 허브 매우 효과적 고기 방부 제31뿐만 아니라 맛 내기 요원으로 인정을 받고 있다. 가르시아-Díez 외에의해 연구. 육류 제품에 30 테오 다른 에센셜 오일에 비해 foodborne 병원 체에 대 한 광범위 한 금지 패턴 표시 발견. 따라서, 말린된 고기 값을 증가 하 고 건조 과정에서 에센셜 오일을 적용 하 여 음식 관련 질병의 위험을 줄일 수 있는 기회가입니다.
이 프로토콜에서 우리 고기 건조 동안 테오 적용의 새로운 방법을 제시, 챔버는 건조에 직접 증기 형태로 구체적으로 그것을 사용 하 여. 평가, 우리는 원시 사람에 비해 치료 샘플에서 병원 성 박테리아의 부재를 확인 하려면 마이크를 사용 합니다. 예비 결과이 방법은 합성 방부 제에 대 한 매우 효과적인 대안 그리고 그것은 크게 말린된 고기 미생물 부하 감소를 보여준다.
프로토콜
1. 고기 준비
- 로컬 도살에서 쇠고기 (신선한 쇠고기 팔 뚝 femoris)의 짧은 허리를 얻을 하 고 실험실에 전송.
참고:이 좋습니다 주위 온도 (20-25 ° C)에서 쇠고기의 허리를 수송 하지 연금술 봉인된 봉투에 20 분 이상에 대 한. - 10 70% (v/v) 에탄올을 분사 하 여 근육 층 류 안전 캐비닛, 쇠고기 근육의 외부 표면 소독 세척 s 500 mL의 짜기 병을 사용 하 여. 근육 표면 1 c m2 당 에탄올의 0.025 g을 적용 합니다.
- Aseptically 근육 내부에 남아 있는 에탄올을 피하기 위해 칼으로 고기의 외부 표면을 제거 합니다. 근육의 표면 균일도 유지 하는 근육 내부 약 3 m m를 제거 합니다.
- 패키지 봉인된 된 비닐 봉투에 근육 하 고 냉동 실에 그것을 전송.
- 1 일-18 ° C에서 근육을 저장 합니다. 다음, 6 h 4 ° C에서 냉동된 근육 녹여.
참고: 녹고, 그것 것이 좋습니다 냉장고에 냉동 실에서 근육을 이동. - 층 류 안전 캐비닛, 각 근육 고기 커터 0.5 cm 두꺼운 조각으로 슬라이스. 다음, 칼으로 잘라 작은 5 × 2.5 c m로2 직사각형 샘플.
- 비닐 봉지에 사각형 고기 샘플을 패키지 하 고 나중에 사용에 대 한-18 ° C에서 냉동 실에 보관.
2. 표준화 된 Inoculum 및 층 류 안전 캐비닛에 접종 절차 준비
- 표준화 된 inoculum (1.5 × 108 CFU/mL)의 대장균 ATCC 25922 접종 고기 샘플을 준비 합니다.
- 재고 inoculum의 준비를 위해 먼저 10 mL의 멸 균된 버퍼링 뮬러 힌 튼 국물 (BMHB)으로 pre-filled 15 mL 소독된 튜브에 동결 건조 된 세균성 문화 (공급 업체에 의해 제공) 분배. 37 ° c.에 24 h에 대 한이 정지를 육성
- 다음과 같이 세균 재고 솔루션을 준비: 걸릴 약 0.1-0.2 mL 세균 현 탁 액 및 20 mL 유리병에 희석 폐쇄 고무 마 개와 함께 사전 멸 균된 BMHB의 15 mL 가득 알루미늄 캡. 37 ° c.에 24 h에 대 한이 정지를 육성
- 냉장고 내부에 표준화 된 inoculum의 준비를 위한 4 ° C에서 저장 합니다.
- 재고 솔루션 (2.1.1 단계 참조) 전자 대장균 의 약 0.1-0.2 mL 세균 현 탁 액 및 15 mL 플라스틱에 희석 소독 튜브 미리 10 mL의 멸 균된 버퍼링 뮬러 힌 튼 국물 (BMHB)으로 가득. 24 h에 대 한 37 ° C에서 튜브를 품 어.
- 표준화 inoculum (1.5 × 108 CFU/mL)의 준비를 위해 미리 멸 균된 BMHB의 10 mL 가득 15 mL 소독된 튜브에이 서 스 펜이 션의 작은 금액을 추가 합니다.
- 철저 하 게 소용돌이 혼합물 및 측정 광학 밀도 (OD) 600에 의해 농도계32nm.
- 단계 2.1.3-2.1.4 맥 팔 랜드 값 0.5 깨끗 한 BMHB의 가치에 비해 증가 표현 OD까지를 반복 합니다.
- 재고 inoculum의 준비를 위해 먼저 10 mL의 멸 균된 버퍼링 뮬러 힌 튼 국물 (BMHB)으로 pre-filled 15 mL 소독된 튜브에 동결 건조 된 세균성 문화 (공급 업체에 의해 제공) 분배. 37 ° c.에 24 h에 대 한이 정지를 육성
- 접종 절차에 대 한 두 개의 다른 알루미늄 포 일 (20 cm x 30 cm), 컨트롤 샘플 및 접종된 고기 샘플에 대 한 두 번째에서에서 사각형 고기 샘플을 놓습니다.
- 두 번째 알루미늄 호 일 동안 표면에 inoculum을 균등 하 게 배포 하 여 원시 사각형 고기 샘플 (이 1.2 × 108 CFU 고기 샘플 당에 해당) 선택한 긴장의 박테리아 정지의 800 µ L 접종.
- 400 µ L 샘플의 1 개의 측에 플라스틱 하 고 부드럽게 표면에 살 균 셀 스프레더를 사용 하 여 확산. 샘플의 10 분 반복 반대편에 서 스 펜 션의 나머지 부분에 대 한 동일한 절차 동안 건조 하자.
- 두 번째 알루미늄 호 일 동안 표면에 inoculum을 균등 하 게 배포 하 여 원시 사각형 고기 샘플 (이 1.2 × 108 CFU 고기 샘플 당에 해당) 선택한 긴장의 박테리아 정지의 800 µ L 접종.
3. 건조와 테오 응용 프로그램
- 건조 기를 층 류 안전 캐비닛에서 사각형 고기 샘플 포함 모두 알루미늄 포 일 전송: 각각의 알루미늄 호 일을 커버 하 고 다음 장소 건조 기 내부 샘플.
- 표준 실험실 건조 기에 건조를 실시 합니다.
참고: 먼저, 55 ° c 오븐을 예 열 이 절차는 20 분 동안 지난 수 있습니다.- 건조 공기 상대 습도 값은 30-45%와 55 ℃에서 6 h에 대 한 제어 샘플을 건조.
참고: 건조 공기 상대 습도 값에 고기에서 액체의 증발 속도 따라 다릅니다.
- 건조 공기 상대 습도 값은 30-45%와 55 ℃에서 6 h에 대 한 제어 샘플을 건조.
- 적용, 테오의 볼륨을 계산 하 고 드라이어 볼륨 (mL/L 공기) 당 테오의 볼륨으로 에센셜 오일의 농도 표현. 예를 들어 53 L (건조 기의 볼륨)에 테오의 1.5 mL의 복용량 0.028 mL/L의 농도에서 발생합니다. 대장균에 대 한 테오의 마이크를 결정, 1.5 mL (0.028 mL/L 공기), 1 mL (0.019 mL/L 공기), 0.75 mL (0.014 mL/L 공기)의 복용량을 사용 합니다.
- 건조 하 고, 전에 테오의 응용 프로그램 (주요 복합 79%로 티)와 증기 담가 테오와 장소의 1.5 mL 복용량 필터 종이 (12 cm x 20 cm) 팬 앞 건조 기에.
- 컨트롤 샘플 (3.1, 3.2 단계)에 대해서 동일한 절차를 사용 하 여 처리 하는 테오 고기 샘플을 건조.
참고: 건조 과정 끝과 샘플 제거 후 80 ° C에서 3 h 동안 오븐에 전환 하 고 오븐에서 에센셜 오일 잔류물을 청소 하기 위하여 100% 공기 환기에 공기 밸브 표시를 설정 합니다.
4. 미생물 분석
- 박테리아와 고기 접종 하기 전에 어떤 혼합물에 대 한 고기 샘플을 검사 합니다. 점액의 모양과 어떤 강하고 매운 냄새의 탐지는 고기 부패의 지표. 텍스처는 칙칙한 느낌이 든다면, 박테리아는 고기 표면에 증식 하기 시작 했습니다 수 있습니다.
- 접종 효율성 평가, 대장균 ATCC 25922의 존재에 대 한 원시 접종된 샘플을 테스트 하 고 건조 절차 전에 비 주사 제어 샘플 들을 비교 합니다. 이 위해:
- 각 고기 샘플 (2 제어 샘플 및 2 접종된 샘플)을 씻어. 7-7.3에서 pH 범위 (w/v)를 1시 10분의 비율로 버퍼링된 펩 물 (8.5 g의 NaCl, 펩의 1 g, 인산 염 버퍼 식 염 수의 5 정제와 물 1 L에 폴 80의 1 g)로 소독된 플라스 크에 각 고기 샘플을 일시 중단 합니다. 실 온에서 10 분 동안 140 rpm에서 통을 사용 하 여 흔들.
참고: 즉시 접종 절차 후 세척입니다. - 조정 6 × 6 드롭 프로시저가 접시 첸, Nace, 어윈33 판 수 한 천 (PCA)와 MacConkey 한 천 (MCA)에 의해 요약 된 박테리아의 수를 평가 합니다.
참고: 6 × 6 드롭 메서드를 사용 하 여 국물 마이크로 희석 방법 10 직렬 희석 집중 하 고 더 경제적인 종래의 방법33, 에 비해 더 적은 노동은 멀티 채널 피 펫과 조사 샘플의 준비 34. - 대장균의 평가 대 한 6 × 6 드롭 판 절차에 의해 10 직렬 샘플 희석을 육성.
참고: 특히 대 한 방울-재배 사용 6 5 µ L, 6 × 6 드롭 메서드를 6 선택 멀티 채널 피 펫과 조사 샘플의 희석. 적절 하 게 건조 배양 접시에 방울은 agar에 신속 하 게 흡수 하 고 매우 편리 하 고 관리34는이 방법으로 설치 합니다. - 24 h에 대 한 37 ° C에서 배양 접시를 품 어. 섹션 5에에서 설명 된 대로 재배 기간 후 대장균 의 배양 접시 (CFU g-1 의 말린된 고기)에 식민지의 수를 평가 합니다.
- 각 고기 샘플 (2 제어 샘플 및 2 접종된 샘플)을 씻어. 7-7.3에서 pH 범위 (w/v)를 1시 10분의 비율로 버퍼링된 펩 물 (8.5 g의 NaCl, 펩의 1 g, 인산 염 버퍼 식 염 수의 5 정제와 물 1 L에 폴 80의 1 g)로 소독된 플라스 크에 각 고기 샘플을 일시 중단 합니다. 실 온에서 10 분 동안 140 rpm에서 통을 사용 하 여 흔들.
- 건조, 후 두 접종된 말린된 샘플 고 그들 두 말린된 비 주사 제어 샘플을 비교 가능한 대장균, 각각. 이러한 4 개의 s더의 대장균 의 존재 여부를 확인 하려면 다음과 같이 각 고기 샘플의 사전 농축 과정을 수행:
- 버퍼링 된 펩 물 소독된 플라스 크에 고기 샘플 각 중단 (참조 단계 4.2.1) 140 rpm에서 통을 사용 하 여 실 온에서 10 분 동안 흔들어. 다음 사전 농축 6 h 동안 37 ° C에서 각 플라스 크를 품 어.
- 평가 및 박테리아의 경작, 4.2.4 4.2.2-단계에서 설명한 대로 동일한 절차를 따릅니다.
5. 결과 검토
- 부 화 완료 후 인큐베이터에서 배양 접시를 제거 하 고 다음과 같은 결과 검토:
- 식민지의 총 수를 평가 하려면 PCA (흰 반점) 및 일반 대장균 mesophilic 호 기성 박테리아의 존재에 대 한 번호판을 검사 MCA에 식민지 (어두운 분홍색 빨간색). 병원 체 결 석 인 경우 두 agars 성장이 제시.
- 식민지를 계산 하 고 대장균 (CFU/g-1 의 말린된 고기) 존재의 양을 결정 합니다.
참고: 드롭 (그림 1) 당 30 이하의 식민지를 포함 하는 두 개의 연속 희석에 식민지 (N)의 수를 계산 합니다. 말린 고기 CFU/g-1 의 수 N 다음과35 로 결정 됩니다.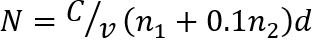
어디, C 는 계산 하는 모든 상품에 식민지의 합계, v 는 드롭 (여기, 0.05 mL) 당 사용 하는 샘플 희석의 볼륨, n1 은 첫 번째 희석에서 사용 하는 상품의 수, n2 방울의 수는 두 번째 희석에서 사용 하 고 d 는 첫 번째 카운트 캡처된 희석을 나타냅니다.
- 생물학적 데이터를 분석 하려면 CFU g-1 를 기록 하 고 치료36의 주요 효과 대 한 그들을 분산 분석 (ANOVA)을 주제로 식민지의 수를 변환 합니다.
- 여러 의미 비교36 Tukey 정직한 상당한 차이가 테스트 (Tukey HSD)를 수행 하 고 치료의 중요 한 차이점을 확인.
결과
우리 먼저 이전 개발 했다이 방법은 식품 안전을 강화 하 고 말린된 고기 값을 증가에 오 레가 노 에센셜 오일 (OEO)를 사용 하 여. 일반적으로, 이전 실험 E. 콜라이 생존 전략으로 서 건조 하는 동안 VBNC 상태로는 보였다. 이 끝나면 건조22culturable 박테리아 없음 이었다고 하는 사실에 의해 증명 됩니다. 따라서, 6 h에 대 한 사전 농축 과정은 긴장의 계...
토론
이전 연구는 음식 관련 질병을 일으키는 미생물 건조10생존을 보이고 있다. 그것은 따라서 식품 안전을 보장 하기 위해서 건조 하기 전에 방부 제를 적용 하는 데 필요한입니다. 이 연구에서 우리는 테오를 사용 하 여에 집중 한다. 이유는 두 가지 이다: 먼저, 개선 식품 품질16; 대체 첨가물으로 천연 제품을 사용 하는 소비자에서 수요는 둘째, 이전 연구 OEO 고기 ...
공개
저자는 공개 없다.
감사의 말
이 작품은 열 대 AgriSciences의 학부의 내부 부여 기관에 의해 지원 되었다 (프로젝트 번호: 20175013)와 둘 다 생명 과학의 체코 대학에서 부여 CIGA 20182023.
자료
| Name | Company | Catalog Number | Comments |
| Meat cutter | Kalorik | KP 3530 | from Miami Gardens, FL, USA |
| Laminar safety cabinet | Faster s.r.l | from Italy | |
| Squeeze bottle of 500 mL | Merci | 632 524 325 025 | from CZ |
| Standard laboratory drier UFE 400 | Memmert | DE 66812464 | from Germany |
| Incubator | BT 120 | N/A | from CZ |
| Refrigerator and Freezer | Bosch | KGN34VW20G | from DE |
| Densitometer | Biosan | 220 000 050 122 | Latvia; supplier Merci, CZ |
| Escherichia coli ATCC 25922 | Oxoid | CL7050 | from CZ |
| Vortex | Chromservis | 22008013 | from CZ |
| Sterilized plastic tubes 15 mL | Gama | 331 000 020 115 | from CZ, supplier Merci |
| 20 mL injection vial | Healthy vial | hvft169 | from China |
| 20 mm sterile butyl rubber stopper | Merci | 22008013 | from CZ |
| 20 mm aluminum cap | Healthy vial | N/A | from China |
| Thyme essential oil | Sigma Aldrich | W306509 | from St Louis, MO, USA |
| Mueller Hinton Broth | Oxoid | CM0337 | from CZ |
| NaCl | Penta | 16610-31000 | from CZ |
| Peptone | Oxoid | LP0034 | from CZ |
| Phosphate-buffered saline | Sigma Aldrich | P4417 | from CZ |
| Polysorbate 80 (Tween 80) | Roth | T 13502 | from DE, supplier P-lab |
| Shaker SHO-1D | Verkon | DH.WSR04020 | from CZ, 10 - 300 rpm. 350 x 350 mm with a platform for flasks |
| Ethanol 70% | Bioferm | N/A | from CZ |
| MacConkey Agar | Oxoid | CM007 | from CZ |
| Plate Count Agar | Oxoid | CM0325 | from CZ |
| Filter paper | Merci | 480 622 080 040 | from CZ |
| Erlenmeyer flasks 250 mL | Simax | 610 002 122 636 | from CZ; supplier Merci CZ |
| Multichannel pipette | Socorex | S852820 | from Switzerland; supplier P lab, CZ |
| Microtiter plate | Gamma | V400916 | CZ |
| Microlitre pipette 100-1000 μL | Eppendorf | 333 120 000 062 | from Germany; supplier Merci, CZ |
참고문헌
- Eklund, M. W., Peterson, M. E., Poysky, F. T., Paranjpye, R. N., Pelroy, G. A. Control of bacterial pathogens during processing of cold-smoked and dried salmon strips. J. Food Prot. 67 (2), 347-351 (2004).
- Mahmoud, B. S. M., et al. Preservative effect of combined treatment with electrolyzed NaCl solutions and essential oil compounds on carp fillets during convectional air-drying. Int. J. Food Microbiol. 106 (3), 331-337 (2006).
- Rahman, M. S., Guizani, N., Al-Ruzeiki, M. H., Al Khalasi, A. S. Microflora Changes in Tuna Mince During Convection Air Drying. Dry. Technol. 18 (10), 2369-2379 (2000).
- Faith, N. G., et al. Viability of Escherichia coli O157: H7 in ground and formed beef jerky prepared at levels of 5 and 20% fat and dried at 52, 57, 63, or 68 C in a home-style dehydrator. Int. J. Food Microbiol. 41 (3), 213-221 (1998).
- Hierro, E., De La Hoz, L., Ordóñez, J. A. Headspace volatile compounds from salted and occasionally smoked dried meats (cecinas) as affected by animal species. Food Chem. 85 (4), 649-657 (2004).
- Nummer, B. A., et al. Effects of Preparation Methods on the Microbiological Safety of Home-Dried Meat Jerky. J. Food Prot. 67 (10), 2337-2341 (2004).
- Greig, J. D., Ravel, A. Analysis of foodborne outbreak data reported internationally for source attribution. Int. J. Food Microbiol. 130 (2), 77-87 (2009).
- Eidson, M., Sewell, C. M., Graves, G., Olson, R. Beef jerky gastroenteritis outbreaks. J. Environ. Health. 62 (6), 9-13 (2000).
- Allen, K., Cornforth, D., Whittier, D., Vasavada, M., Nummer, B. Evaluation of high humidity and wet marinade methods for pasteurization of jerky. J. Food Sci. 72 (7), (2007).
- Levine, P., Rose, B., Green, S., Ransom, G., Hill, W. Pathogen testing of ready-to-eat meat and poultry products collected at federally inspected establishments in the United States, 1990 to 1999. J. Food Prot. 64 (8), 1188-1193 (1990).
- Keene, W. E., et al. An outbreak of Escherichia coli O157:H7 infections traced to jerky made from deer meat. JAMA. 277 (15), 1229-1231 (1997).
- Oliver, J. D. The viable but nonculturable state in bacteria. J. Microbiol. 43, 93-100 (2005).
- Oliver, J. D. Recent findings on the viable but nonculturable state in pathogenic bacteria. FEMS Microbiol. Rev. 34 (4), 415-425 (2010).
- Khamisse, E., Firmesse, O., Christieans, S., Chassaing, D., Carpentier, B. Impact of cleaning and disinfection on the non-culturable and culturable bacterial loads of food-contact surfaces at a beef processing plant. Int. J. Food Microbiol. 158 (2), 163-168 (2012).
- Li, L., Mendis, N., Trigui, H., Oliver, J. D., Faucher, S. P. The importance of the viable but non-culturable state in human bacterial pathogens. Front. Microbiol. 5, 258 (2014).
- Hernández, H., Claramount, D., Kučerová, I., Banout, J. The effects of modified blanching and oregano essential oil on drying kinetics and sensory attributes of dried meat. J. Food Process. Preserv. , (2016).
- García-Díez, J., et al. The Impact of Essential Oils on Consumer Acceptance of Chouriço de vinho - A Dry-Cured Sausage Made from Wine-Marinated Meat - Assessed by the Hedonic Scale, JAR Intensity Scale and Consumers' "Will to Consume and Purchase.". J. Food Process. Preserv. 41 (4), (2017).
- Govaris, A., Solomakos, N., Pexara, A., Chatzopoulou, P. S. The antimicrobial effect of oregano essential oil, nisin and their combination against Salmonella Enteritidis in minced sheep meat during refrigerated storage. Int. J. Food Microbiol. 137 (2-3), 175-180 (2010).
- Holley, R. A., Patel, D. Improvement in shelf-life and safety of perishable foods by plant essential oils and smoke antimicrobials. Food Microbiol. 22 (4), 273-292 (2005).
- Petrou, S., Tsiraki, M., Giatrakou, V., Savvaidis, I. N. Chitosan dipping or oregano oil treatments, singly or combined on modified atmosphere packaged chicken breast meat. Int. J. Food Microbiol. 156 (3), 264-271 (2012).
- Ballester-costa, C., Sendra, E., Viuda-martos, M. Assessment of Antioxidant and Antibacterial Properties on Meat Homogenates of Essential Oils Obtained from Four Thymus Species Achieved from Organic Growth. Foods. 6 (8), 59 (2017).
- Hernández, H., et al. The effect of oregano essential oil on microbial load and sensory attributes of dried meat. J. Sci. Food Agric. 97 (1), 82-87 (2017).
- García-Díez, J., Alheiro, J., Falco, V., Fraqueza, M. J., Patarata, L. Chemical characterization and antimicrobial properties of herbs and spices essential oils against pathogens and spoilage bacteria associated to dry-cured meat products. J. Essent. Oil Res. 29 (2), 117-125 (2017).
- Cavanagh, H. M. A. Antifungal Activity of the Volatile Phase of Essential Oils: A Brief Review. Nat. Prod. Commun. 2 (12), 1297-1302 (2007).
- Tajkarimi, M. M., Ibrahim, S. A., Cliver, D. O. Antimicrobial herb and spice compounds in food. Food Control. 21 (9), 1199-1218 (2010).
- Nedorostova, L., Kloucek, P., Kokoska, L., Stolcova, M., Pulkrabek, J. Antimicrobial properties of selected essential oils in vapour phase against foodborne bacteria. Food Control. 20 (2), 157-160 (2009).
- Burt, S. Essential oils: Their antibacterial properties and potential applications in foods - A review. Int. J. Food Microbiol. 94 (3), 223-253 (2004).
- Ramanathan, L., Das, N. Studies on the control of lipid oxidation in ground fish by some polyphenolic natural products. J. Agric. Food Chem. 40 (1), 17-21 (1992).
- Yamazaki, K., Yamamoto, T., Kawai, Y., Inoue, N. Enhancement of antilisterial activity of essential oil constituents by nisin and diglycerol fatty acid ester. Food Microbiol. 21 (3), 283-289 (2004).
- García-Díez, J., Alheiro, J., Falco, V., Fraqueza, M. J., Patarata, L. Synergistic activity of essential oils from herbs and spices used on meat products against food borne pathogens. Nat. Prod. Commun. 12 (2), 281-286 (2017).
- Hussein Hamdy Roby, M., Atef Sarhan, M., Abdel-Hamed Selim, K., Ibrahim Khalel, K. Evaluation of antioxidant activity, total phenols and phenolic compounds in thyme (Thymus vulgaris L.), sage (Salvia officinalis L.), and marjoram (Origanum majorana L.) extracts. Ind. Crops Prod. 43, 827-831 (2013).
- Gouveia, A. R., et al. The Antimicrobial Effect of Essential Oils Against Listeria monocytogenes in Sous vide Cook-Chill Beef during Storage. J. Food Process. Preserv. 41 (4), (2017).
- Chen, C., Nace, G., Irwin, P. A 6 x 6 drop plate method for simultaneous colony counting and MPN enumeration of Campylobacter jejuni, Listeria monocytogenes, and Escherichia coli. J. Microbiol. Methods. 55 (2), 475-479 (2003).
- Herigstad, B., Hamilton, M., Heersink, J. How to optimize the drop plate method for enumerating bacteria. J. Microbiol. Methods. 44 (2), 121-129 (2001).
- . Practical food microbiology Available from: https://drive.google.com/file/d/0BzyVOLllJ0B1YmlEemZ5M1RZekU/view?ts=590d8019 (2003)
- Smith-Palmer, A., Stewart, J., Fyfe, L. Antimicrobial properties of plant essential oils and essences against five important food-borne pathogens. Lett. Appl. Microbiol. 26 (2), 118-122 (1998).
- Burt, S. a., Reinders, R. D. Antibacterial activity of selected plant essential oils against Escherichia coli O157:H7. Lett. Appl. Microbiol. 36 (3), 162-167 (2003).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유