É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
O efeito da aplicação do óleo essencial de tomilho na carga microbiana durante a secagem da carne
Neste Artigo
Resumo
Microorganismos tais como Escherichia coli que contaminam produtos à base de causam doenças transmitidas por alimentos. O uso de óleos essenciais no processo de secagem de carne não tem sido estudado profundamente. Aqui, apresentamos um novo método de aplicar o óleo essencial de tomilho a carne durante a secagem para reduzir a carga microbiana em carne seca.
Resumo
Carne é uma refeição rica em proteínas que é usada na preparação de carne seca, um lanche de alimento popular, onde a preservação e segurança são importantes. Para garantir a segurança alimentar e para prolongar a vida de prateleira da carne e produtos cárneos, o uso de conservantes sintéticos ou naturais têm sido aplicados para controle e eliminar as bactérias transmitidas por alimentos. Um crescente interesse na aplicação dos aditivos de alimento natural para carne aumentou. Microorganismos, tais como Escherichia coli, contaminam a carne e produtos cárneos, causando doenças transmitidas por alimentos. Portanto, é necessário melhorar o processo de conservação de carne. No entanto, o uso de óleos essenciais, quando a carne está sendo secada não foi profundamente estudado. A este respeito, há uma oportunidade para aumentar o valor de carne seca e reduzir o risco de doenças transmitidas por alimentos, através da aplicação de óleos essenciais durante o processo de secagem. Neste protocolo, apresentamos um novo método de aplicação de óleo essencial de tomilho (TEO) durante a secagem, especificamente na forma de vapor diretamente em uma câmara de secagem de carne. Para avaliação, usamos a concentração inibitória mínima (CIM) para detectar o número de bactérias nocivas nas amostras tratadas em comparação com amostras raw. Os resultados preliminares mostram que este método é uma opção viável e alternativa para conservantes sintéticos e que reduz significativamente a carga microbiana em carne seca.
Introdução
Secagem como um método tradicional para preservar alimentos tem sido usada desde tempos antigos. Hoje em dia, há um interesse crescente na secagem como um método eficaz para preservação de alimentos a1,2,3. Ele é usado para fazer uma variedade de carnes processadas especialmente. Dentre os mais well-known é irregular.
Carne seca, um dos mais antigos métodos de preservação de carne, baseia-se na cura e secagem à baixa atividade de água e, portanto, para estender sua vida útil de4. Hoje em dia, seca como uma carne curada preservada ainda é muito popular, onde segurança alimentar, sabor e textura são essenciais. Preparação de carne seca pode ser usada para praticamente qualquer tipo de carne, incluindo carne bovina, carne de porco, aves de capoeira ou jogo5, e requer a cortar a carne em tiras de magras e secá-lo. Geralmente, marinar a carne em uma solução de cura ou fumar são usados juntamente com secagem para dar a carne seu sabor característico6.
Apesar do grande interesse de secagem para verdadeiramente preservar alimentos, o risco de surtos de intoxicação alimentar por e. coli através da carne mal seca é crítico e precisa ser controlada. Existem alguns estudos relatando a surtos de gastroenterite transmitidas por alimentos particularmente com Escherichia coli O157: H7, atribuída ao calor inadequado processamento durante a secagem de casa. Casos semelhantes ocorreram mesmo no preparado comercialmente seca7,8,9. Levine et al. 10 propostas que microorganismos de origem alimentar podem sobreviver a condições de secagem moderadas (cerca de 60 ° C) usadas pelos produtores de charque comerciais. Escherichia coli O157: H7 surtos de doenças transmitidas por alimentos no meio da década de 1990 foram atribuídos a terra secada carne produtos6,11. Curiosamente, em todos os casos anteriores, o principal risco é causado por patógenos bacterianos reconhecidos como viável mas não-viáveis (VBNC). Sob várias tensões como mudanças de temperatura ou a fome, as células de e. coli poderiam entrar em um estado particular conhecido como o VBNC estado12,13. As células VBNC podem ser ressuscitadas volta para células viáveis por exposição a condições adequadas e em seguida, apresentar uma ameaça para a saúde humana devido à contaminação de origem alimentar14,15. Isto significa que se a carne é consumida imediatamente após a secagem do produto é seguro. No entanto, no caso de armazenamento inadequado, tais como aumento de umidade, há um alto risco de reativação de patógenos e crescimento microbiano.
Além de métodos de secagem e marinada, há uma alta demanda de consumidores para usar produtos naturais como uma alternativa aos aditivos para melhorar a qualidade de alimento16,17. Tem havido um interesse particular na aplicação dos aditivos de alimento natural para carne em vez de conservantes sintéticos clássica18,19,20,21. Mesmo que haja uma falta de evidência experimental suficiente no uso de óleos essenciais quando a secagem da carne, primeiras pesquisas neste campo já demonstra resultados positivos22,23.
Desde a idade média, as pessoas reconheceram compostos do óleo essencial (EOCs) para seus chracteristics antimicrobiano, inseticida e antiparasitários24,25,26. Hoje, EOCs fazem parte de um dos grupos mais importantes de compostos naturais bioativos. Entre os diferentes EOCs, timol é um do mais well-known. É composto por mais de 85% de TEO23. Este fenol previne a deterioração microbiana e química quando adicionado à comida. Além disso, suas propriedades antibacterianas podem ser melhoradas em combinação com outros conservantes naturais2,,27,28,29,30. Hoje em dia, o tomilho (Thymus vulgaris), uma erva que pertence à família Lamiaceae , tem sido reconhecida como um agente flavoring, bem como um conservante de carne muito eficaz31. Um estudo realizado por García-Díez et al. 30 em produtos cárneos encontrado que TEO demonstraram um padrão de inibição mais amplo contra agentes patogénicos de origem alimentar quando comparado com outros óleos essenciais. Portanto, há uma oportunidade para aumentar o valor de carne seca e reduzir o risco de doenças transmitidas por alimentos, através da aplicação de óleos essenciais durante o processo de secagem.
Neste protocolo, apresentamos um novo método de aplicação TEO durante a secagem de carne, especificamente, usá-lo em forma de vapor diretamente em uma secagem de câmara. Para avaliação, usamos o MIC para determinar a ausência de bactérias patogênicas em amostras tratadas em comparação com os brutos. Os resultados preliminares mostram que este método é uma alternativa altamente eficaz para conservantes sintéticos e que reduz significativamente a carga microbiana em carne seca.
Protocolo
1. preparação de carne
- Obter um lombo curto de carne (carne fresca de bíceps femoris) de um talho local e transferi-lo para o laboratório.
Nota: É recomendável para transportar o lombo de carne à temperatura ambiente (20-25 ° C), por um período não superior a 20 min em um saco hermético selado. - Para esterilizar a superfície externa do músculo bovino, um laminar de segurança, lave o músculo por pulverização com etanol a 70% (v/v) por 10 s usando uma garrafa de 500 mL. Aplica 0,025 g de etanol por 1 cm2 de superfície muscular.
- Remova assepticamente a superfície exterior da carne com uma faca para evitar etanol remanescente no interior do músculo. Remova cerca de 3 mm do interior muscular para manter a uniformidade de superfície do músculo.
- O músculo em um saco plástico selado do pacote e transferi-lo para um freezer.
- Armazene o músculo a-18 ° C para 1 dia. Em seguida, descongele o músculo congelado a 4 ° C, durante 6 h.
Nota: Para descongelar, é recomendável mover o músculo do congelador para o frigorífico. - Em uma armário de segurança laminar, fatie cada músculo em 0,5 centímetro de espessura com um cortador de carne. Em seguida, com uma faca corte em pequeno 5 × 2,5 cm2 amostras retangulares.
- As amostras de carne retangular em sacos de plástico do pacote e armazená-los no freezer a-18 ° C para uso posterior.
2. preparação do inóculo padronizado e procedimento de inoculação em um armário de segurança Laminar
- Prepare o inóculo padronizado (1,5 × 108 UFC/mL) de e. coli ATCC 25922 para inocular as amostras de carne.
- Para a preparação do inóculo estoque, primeiro dispense a cultura bacteriana liofilizada (entregada pelo fornecedor) para um tubo esterilizado 15 mL pré-preenchido com 10 mL de esterilizado em buffer Mueller Hinton caldo (BMHB). Cultivar esta suspensão por 24 h a 37 ° C.
- Prepare a solução-mãe bacteriana da seguinte maneira: tomar aproximadamente 0,1 - 0,2 mL de suspensão bacteriana e diluir dentro de um frasco de 20 mL fechado com uma rolha de borracha com uma tampa de alumínio preenchida com 15 mL de BMHB esterilizado. Cultivar esta suspensão por 24 h a 37 ° C.
- Armazenar no frigorífico a 4 ° C, para a preparação do inóculo padronizado.
- A partir da solução estoque (consulte a etapa 2.1.1) de E coli toma aproximadamente 0,1 - 0,2 mL de suspensão bacteriana e diluir em um plástico de 15 mL esterilizado tubo preenchido com 10 mL de esterilizado em buffer Mueller Hinton caldo (BMHB). Incube o tubo a 37 ° C por 24 h.
- Para a preparação do inóculo padronizado (1,5 × 108 UFC/mL), adicione pequenas quantidades desta suspensão em um tubo de 15 mL esterilizado previamente preenchido com 10 mL de BMHB esterilizado.
- Cuidadosamente a mistura de vórtice e medida da densidade óptica (OD) em 600 nm por um densitômetro32.
- Repita as etapas 2.1.3 - 2.1.4 até o OD expressado como o valor de McFarland é aumentado por 0,5 em comparação com o valor de BMHB limpo.
- Para a preparação do inóculo estoque, primeiro dispense a cultura bacteriana liofilizada (entregada pelo fornecedor) para um tubo esterilizado 15 mL pré-preenchido com 10 mL de esterilizado em buffer Mueller Hinton caldo (BMHB). Cultivar esta suspensão por 24 h a 37 ° C.
- Para o procedimento de inoculação, coloca as amostras de carne retangular em duas folhas de alumínio diferentes (20 cm x 30 cm), um para as amostras de controle e o segundo para as amostras de carne inoculados.
- Sobre a segunda folha de alumínio, inocule as amostras de carne crua rectangular com 800 µ l de suspensão de bactérias da linhagem selecionada (isto corresponde a 1,2 × 108 UFC por amostra de carne), distribuindo uniformemente o inóculo na superfície.
- Distribuir 400 µ l de um lado da amostra e espalhe suavemente usando um propagador da pilha de estéril na superfície. Deixe-os secar por 10 min. repetir o mesmo procedimento para o resto da suspensão do outro lado da amostra.
- Sobre a segunda folha de alumínio, inocule as amostras de carne crua rectangular com 800 µ l de suspensão de bactérias da linhagem selecionada (isto corresponde a 1,2 × 108 UFC por amostra de carne), distribuindo uniformemente o inóculo na superfície.
3. secagem e aplicação de TEO
- Transferir as duas folhas de alumínio contendo as amostras de carne retangular da segurança laminar do armário ao secador: Cubra cada um com papel alumínio e coloque as amostras dentro do secador.
- Realize a secagem em um secador padrão de laboratório.
Nota: em primeiro lugar, pré-aqueça o forno a 55 ° C. Este procedimento pode durar por 20 min.- Seca as amostras de controle para 6 h a 55 ° C, com valores de umidade relativa do ar variando entre 30-45% de secagem.
Nota: Valores de umidade relativa do ar secagem variam no tempo, dependendo da taxa de evaporação do líquido da carne.
- Seca as amostras de controle para 6 h a 55 ° C, com valores de umidade relativa do ar variando entre 30-45% de secagem.
- Calcular o volume de TEO aplicado e expressar a concentração de óleo essencial como um volume de TEO por volume secador (ar mL/L). Por exemplo, a dose de 1,5 mL de TEO em 53 L (volume do secador) resulta em uma concentração de ar 0,028 mL/L. Para determinar o MIC de TEO para Escherichia coli, use doses de 1,5 mL (ar de 0,028 mL/L), 1 mL (ar de 0,019 mL/L) e 0,75 mL (ar de 0,014 mL/L).
- Antes da secagem, para a aplicação do TEO vapores (com timol como o principal composto 79%), mergulhar num filtro de papel (12 cm x 20 cm) com uma dose de 1,5 mL de TEO e coloque o secador na frente do ventilador.
- Seca as amostras de carne TEO tratada usando o mesmo procedimento para as amostras de controle (medidas 3.1 e 3.2).
Nota: Após a secagem processo termina e amostras são removidas, ligue o forno por 3 h a 80 ° C e definir a indicação de válvula de ar para 100% de ar para limpar os resíduos do óleo essencial do forno.
4. microbiana análise
- Antes da inoculação de carne com bactérias, examine as amostras de carne para qualquer adulteração. O aparecimento de limo e a detecção de qualquer cheiro forte e pungente são indicativos de deterioração de carne. Se a textura parece nojenta, a bactéria pode ter começado a multiplicar-se sobre a superfície da carne.
- Para avaliar a eficiência da inoculação, testar as amostras inoculadas crus para a presença de Escherichia coli ATCC 25922 e compará-los com amostras de controlo não-inoculadas antes do processo de secagem. Para essa finalidade:
- Lave cada amostra de carne (2 amostras de controle e 2 amostras inoculadas). Suspenda a cada amostra de carne em um frasco esterilizado com água peptona tamponada (8,5 g de NaCl, 1 g de peptona, 5 comprimidos de fosfato-salino e 1 g de Polissorbato 80 em 1 litro de água) em uma proporção de 01:10 (p/v) com uma faixa de pH de 7-7.3. Shake, utilizando um agitador a 140 rpm durante 10 minutos à temperatura ambiente.
Nota: Lavagem imediatamente após o procedimento de inoculação. - Avalie o número de bactérias por um procedimento ajustado de chapa gota 6 × 6 resumido por Chen, Nace e Irwin33 na Plate Count Agar (PCA) e ágar MacConkey (MCA).
Nota: O método de soltar 6 × 6 usa o método de micro diluição do caldo para preparar 10 vezes seriais diluições da amostra investigada com uma pipeta multicanal, que é menos intensivo e mais econômico em comparação com o método convencional33, de trabalho 34. - Cultive as diluições de série amostra 10 vezes pelo procedimento de chapa gota 6 × 6, para a avaliação de e. coli.
Nota: Particularmente para o método de queda de 6 × 6, para cultivo uso seis 5 µ l-gotas, de seis seleccionados diluições da amostra investigada com uma pipeta multicanal. Em placas de Petri devidamente secas, as gotas de absorvem rapidamente sobre o agar e o plantio por esse método é muito conveniente e gerenciável34. - Incube as placas de Petri a 37 ° C por 24 h. Após o período de cultivo, avalie o número de colônias de Escherichia coli sobre os pratos de Petri (CFU g-1 de carne seca), conforme descrito na seção 5.
- Lave cada amostra de carne (2 amostras de controle e 2 amostras inoculadas). Suspenda a cada amostra de carne em um frasco esterilizado com água peptona tamponada (8,5 g de NaCl, 1 g de peptona, 5 comprimidos de fosfato-salino e 1 g de Polissorbato 80 em 1 litro de água) em uma proporção de 01:10 (p/v) com uma faixa de pH de 7-7.3. Shake, utilizando um agitador a 140 rpm durante 10 minutos à temperatura ambiente.
- Após a secagem, pegue duas amostras secas inoculadas e compará-los com duas amostras de controle não-inoculadas secas para viável, Escherichia coli, respectivamente. Para determinar a presença ou ausência de Escherichia coli dessas quatro práticas de s, realizar o processo de pré-enriquecimento de cada amostra de carne como segue:
- Suspender a cada amostra de carne em um frasco esterilizado com água peptona tamponada (ver passo 4.2.1) e agitar utilizando um agitador a 140 rpm durante 10 minutos à temperatura ambiente. Então incube cada balão a 37 ° C durante 6 h para pré-enriquecimento.
- Para a avaliação e o cultivo das bactérias, siga o mesmo procedimento como descrito nos passos 4.2.2 - 4.2.4.
5. análise de resultados
- Após a incubação estiver concluída, retire os pratos de Petri da incubadora e rever os resultados como segue:
- Para avaliar o número total de colônias, examinar as placas para a presença de bactérias aeróbias mesófilas na PCA (manchas brancas) e típico de e. coli colônias (vermelhas de rosa escuro) na MCA. Se o patógeno é ausente, os dois ágares não apresentam nenhum crescimento.
- Contar as colônias e determinar a quantidade de Escherichia coli (UFC/g-1 de carne seca) presente.
Nota: Conte o número de colônias (N) em duas diluições consecutivas contendo 30 ou menos colónias por gota (Figura 1). O número N de n-1 UFC/g de carne seca é determinado como segue35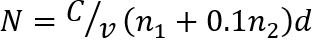
onde, C é a soma das colônias em gotas todos contadas, v é o volume de diluição da amostra utilizada por gota (aqui, 0,05 mL), 1 de n é o número de gotas utilizadas na primeira diluição, n2 é o número de gotas usado na segunda diluição, e d representa a diluição do qual as primeiras contagens foram capturadas.
- Para analisar os dados microbiológicos, converta o número de colônias para log UFC g-1 e sujeitá-los à análise de variância (ANOVA) para os principais efeitos do tratamento36.
- Realize o teste de Tukey diferença significativa honesto (Tukey HSD) para múltiplas comparações média36 e determinar as diferenças significativas entre os tratamentos.
Resultados
Tínhamos primeiro anteriormente desenvolvido esse método usando o óleo essencial do orégano (OEO) para melhorar a segurança alimentar e aumentar o valor de carne seca. Em geral, as experiências anteriores mostraram que a e. coli entrará no estado VBNC durante a secagem como uma estratégia de sobrevivência. Isso é demonstrado pelo fato de que não havia nenhuma bactéria viáveis após a secagem terminou22. Portanto, o processo de pré-enriquecime...
Discussão
Pesquisa anterior mostrou que os microrganismos que causam doenças transmitidas por alimentos sobrevivem secagem10. Portanto, é necessário aplicar conservantes antes da secagem para garantir a segurança alimentar. Neste estudo, enfocamos usando TEO. A razão é dupla: primeiro, há uma alta demanda de consumidores para usar produtos naturais como aditivos alternativos para melhorar a qualidade de alimento16; Em segundo lugar, um estudo anterior demonstrou resultados pos...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi financiado pela Agência de Grant interna da faculdade de AgriSciences Tropical, (número do projecto: 20175013) e o 20182023 de CIGA ambos concede, da Universidade de Ciências da vida Checa.
Materiais
| Name | Company | Catalog Number | Comments |
| Meat cutter | Kalorik | KP 3530 | from Miami Gardens, FL, USA |
| Laminar safety cabinet | Faster s.r.l | from Italy | |
| Squeeze bottle of 500 mL | Merci | 632 524 325 025 | from CZ |
| Standard laboratory drier UFE 400 | Memmert | DE 66812464 | from Germany |
| Incubator | BT 120 | N/A | from CZ |
| Refrigerator and Freezer | Bosch | KGN34VW20G | from DE |
| Densitometer | Biosan | 220 000 050 122 | Latvia; supplier Merci, CZ |
| Escherichia coli ATCC 25922 | Oxoid | CL7050 | from CZ |
| Vortex | Chromservis | 22008013 | from CZ |
| Sterilized plastic tubes 15 mL | Gama | 331 000 020 115 | from CZ, supplier Merci |
| 20 mL injection vial | Healthy vial | hvft169 | from China |
| 20 mm sterile butyl rubber stopper | Merci | 22008013 | from CZ |
| 20 mm aluminum cap | Healthy vial | N/A | from China |
| Thyme essential oil | Sigma Aldrich | W306509 | from St Louis, MO, USA |
| Mueller Hinton Broth | Oxoid | CM0337 | from CZ |
| NaCl | Penta | 16610-31000 | from CZ |
| Peptone | Oxoid | LP0034 | from CZ |
| Phosphate-buffered saline | Sigma Aldrich | P4417 | from CZ |
| Polysorbate 80 (Tween 80) | Roth | T 13502 | from DE, supplier P-lab |
| Shaker SHO-1D | Verkon | DH.WSR04020 | from CZ, 10 - 300 rpm. 350 x 350 mm with a platform for flasks |
| Ethanol 70% | Bioferm | N/A | from CZ |
| MacConkey Agar | Oxoid | CM007 | from CZ |
| Plate Count Agar | Oxoid | CM0325 | from CZ |
| Filter paper | Merci | 480 622 080 040 | from CZ |
| Erlenmeyer flasks 250 mL | Simax | 610 002 122 636 | from CZ; supplier Merci CZ |
| Multichannel pipette | Socorex | S852820 | from Switzerland; supplier P lab, CZ |
| Microtiter plate | Gamma | V400916 | CZ |
| Microlitre pipette 100-1000 μL | Eppendorf | 333 120 000 062 | from Germany; supplier Merci, CZ |
Referências
- Eklund, M. W., Peterson, M. E., Poysky, F. T., Paranjpye, R. N., Pelroy, G. A. Control of bacterial pathogens during processing of cold-smoked and dried salmon strips. J. Food Prot. 67 (2), 347-351 (2004).
- Mahmoud, B. S. M., et al. Preservative effect of combined treatment with electrolyzed NaCl solutions and essential oil compounds on carp fillets during convectional air-drying. Int. J. Food Microbiol. 106 (3), 331-337 (2006).
- Rahman, M. S., Guizani, N., Al-Ruzeiki, M. H., Al Khalasi, A. S. Microflora Changes in Tuna Mince During Convection Air Drying. Dry. Technol. 18 (10), 2369-2379 (2000).
- Faith, N. G., et al. Viability of Escherichia coli O157: H7 in ground and formed beef jerky prepared at levels of 5 and 20% fat and dried at 52, 57, 63, or 68 C in a home-style dehydrator. Int. J. Food Microbiol. 41 (3), 213-221 (1998).
- Hierro, E., De La Hoz, L., Ordóñez, J. A. Headspace volatile compounds from salted and occasionally smoked dried meats (cecinas) as affected by animal species. Food Chem. 85 (4), 649-657 (2004).
- Nummer, B. A., et al. Effects of Preparation Methods on the Microbiological Safety of Home-Dried Meat Jerky. J. Food Prot. 67 (10), 2337-2341 (2004).
- Greig, J. D., Ravel, A. Analysis of foodborne outbreak data reported internationally for source attribution. Int. J. Food Microbiol. 130 (2), 77-87 (2009).
- Eidson, M., Sewell, C. M., Graves, G., Olson, R. Beef jerky gastroenteritis outbreaks. J. Environ. Health. 62 (6), 9-13 (2000).
- Allen, K., Cornforth, D., Whittier, D., Vasavada, M., Nummer, B. Evaluation of high humidity and wet marinade methods for pasteurization of jerky. J. Food Sci. 72 (7), (2007).
- Levine, P., Rose, B., Green, S., Ransom, G., Hill, W. Pathogen testing of ready-to-eat meat and poultry products collected at federally inspected establishments in the United States, 1990 to 1999. J. Food Prot. 64 (8), 1188-1193 (1990).
- Keene, W. E., et al. An outbreak of Escherichia coli O157:H7 infections traced to jerky made from deer meat. JAMA. 277 (15), 1229-1231 (1997).
- Oliver, J. D. The viable but nonculturable state in bacteria. J. Microbiol. 43, 93-100 (2005).
- Oliver, J. D. Recent findings on the viable but nonculturable state in pathogenic bacteria. FEMS Microbiol. Rev. 34 (4), 415-425 (2010).
- Khamisse, E., Firmesse, O., Christieans, S., Chassaing, D., Carpentier, B. Impact of cleaning and disinfection on the non-culturable and culturable bacterial loads of food-contact surfaces at a beef processing plant. Int. J. Food Microbiol. 158 (2), 163-168 (2012).
- Li, L., Mendis, N., Trigui, H., Oliver, J. D., Faucher, S. P. The importance of the viable but non-culturable state in human bacterial pathogens. Front. Microbiol. 5, 258 (2014).
- Hernández, H., Claramount, D., Kučerová, I., Banout, J. The effects of modified blanching and oregano essential oil on drying kinetics and sensory attributes of dried meat. J. Food Process. Preserv. , (2016).
- García-Díez, J., et al. The Impact of Essential Oils on Consumer Acceptance of Chouriço de vinho - A Dry-Cured Sausage Made from Wine-Marinated Meat - Assessed by the Hedonic Scale, JAR Intensity Scale and Consumers' "Will to Consume and Purchase.". J. Food Process. Preserv. 41 (4), (2017).
- Govaris, A., Solomakos, N., Pexara, A., Chatzopoulou, P. S. The antimicrobial effect of oregano essential oil, nisin and their combination against Salmonella Enteritidis in minced sheep meat during refrigerated storage. Int. J. Food Microbiol. 137 (2-3), 175-180 (2010).
- Holley, R. A., Patel, D. Improvement in shelf-life and safety of perishable foods by plant essential oils and smoke antimicrobials. Food Microbiol. 22 (4), 273-292 (2005).
- Petrou, S., Tsiraki, M., Giatrakou, V., Savvaidis, I. N. Chitosan dipping or oregano oil treatments, singly or combined on modified atmosphere packaged chicken breast meat. Int. J. Food Microbiol. 156 (3), 264-271 (2012).
- Ballester-costa, C., Sendra, E., Viuda-martos, M. Assessment of Antioxidant and Antibacterial Properties on Meat Homogenates of Essential Oils Obtained from Four Thymus Species Achieved from Organic Growth. Foods. 6 (8), 59 (2017).
- Hernández, H., et al. The effect of oregano essential oil on microbial load and sensory attributes of dried meat. J. Sci. Food Agric. 97 (1), 82-87 (2017).
- García-Díez, J., Alheiro, J., Falco, V., Fraqueza, M. J., Patarata, L. Chemical characterization and antimicrobial properties of herbs and spices essential oils against pathogens and spoilage bacteria associated to dry-cured meat products. J. Essent. Oil Res. 29 (2), 117-125 (2017).
- Cavanagh, H. M. A. Antifungal Activity of the Volatile Phase of Essential Oils: A Brief Review. Nat. Prod. Commun. 2 (12), 1297-1302 (2007).
- Tajkarimi, M. M., Ibrahim, S. A., Cliver, D. O. Antimicrobial herb and spice compounds in food. Food Control. 21 (9), 1199-1218 (2010).
- Nedorostova, L., Kloucek, P., Kokoska, L., Stolcova, M., Pulkrabek, J. Antimicrobial properties of selected essential oils in vapour phase against foodborne bacteria. Food Control. 20 (2), 157-160 (2009).
- Burt, S. Essential oils: Their antibacterial properties and potential applications in foods - A review. Int. J. Food Microbiol. 94 (3), 223-253 (2004).
- Ramanathan, L., Das, N. Studies on the control of lipid oxidation in ground fish by some polyphenolic natural products. J. Agric. Food Chem. 40 (1), 17-21 (1992).
- Yamazaki, K., Yamamoto, T., Kawai, Y., Inoue, N. Enhancement of antilisterial activity of essential oil constituents by nisin and diglycerol fatty acid ester. Food Microbiol. 21 (3), 283-289 (2004).
- García-Díez, J., Alheiro, J., Falco, V., Fraqueza, M. J., Patarata, L. Synergistic activity of essential oils from herbs and spices used on meat products against food borne pathogens. Nat. Prod. Commun. 12 (2), 281-286 (2017).
- Hussein Hamdy Roby, M., Atef Sarhan, M., Abdel-Hamed Selim, K., Ibrahim Khalel, K. Evaluation of antioxidant activity, total phenols and phenolic compounds in thyme (Thymus vulgaris L.), sage (Salvia officinalis L.), and marjoram (Origanum majorana L.) extracts. Ind. Crops Prod. 43, 827-831 (2013).
- Gouveia, A. R., et al. The Antimicrobial Effect of Essential Oils Against Listeria monocytogenes in Sous vide Cook-Chill Beef during Storage. J. Food Process. Preserv. 41 (4), (2017).
- Chen, C., Nace, G., Irwin, P. A 6 x 6 drop plate method for simultaneous colony counting and MPN enumeration of Campylobacter jejuni, Listeria monocytogenes, and Escherichia coli. J. Microbiol. Methods. 55 (2), 475-479 (2003).
- Herigstad, B., Hamilton, M., Heersink, J. How to optimize the drop plate method for enumerating bacteria. J. Microbiol. Methods. 44 (2), 121-129 (2001).
- . Practical food microbiology Available from: https://drive.google.com/file/d/0BzyVOLllJ0B1YmlEemZ5M1RZekU/view?ts=590d8019 (2003)
- Smith-Palmer, A., Stewart, J., Fyfe, L. Antimicrobial properties of plant essential oils and essences against five important food-borne pathogens. Lett. Appl. Microbiol. 26 (2), 118-122 (1998).
- Burt, S. a., Reinders, R. D. Antibacterial activity of selected plant essential oils against Escherichia coli O157:H7. Lett. Appl. Microbiol. 36 (3), 162-167 (2003).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados