Method Article
تحديد مستوى التعبير البروتين في الخلايا المستزرعة إيمونوسيتوتشيميستري في كتل الخلايا جزءا لا يتجزأ من البارافين
In This Article
Summary
حاليا، تلطيخ إيمونوفلوريسسينت على الخلايا الثابتة هو الأسلوب المفضل لتحديد مستويات التعبير البروتين عند المورفولوجية المعلومات ضرورية أيضا. يوفر هذا البروتوكول المعروضة هنا لطريقة بديلة إيمونوسيتوتشيميستري في كتل الخلايا جزءا لا يتجزأ من البارافين.
Abstract
تلوين إيممونوفلوريسسينت حاليا الأسلوب المفضل لتحديد مستويات التعبير البروتين في نظم زراعة الخلايا عند المورفولوجية المعلومات ضرورية أيضا. بروتوكول immunocytochemical تلطيخ في كتل الخلايا جزءا لا يتجزأ من البارافين، المقدمة في هذه الوثيقة، بديل ممتاز لتلطيخ إيمونوفلوريسسينت على الخلايا الثابتة البارافين غير مضمن. في هذا البروتوكول، كتلة بارافين خلية من خلايا هيلا أعد باستخدام الأسلوب ثرومبوبلاستين البلازما، وأجرى إيمونوسيتوتشيميستري لتقييم علامات انتشار اثنين، CKAP2، وكي-67. نوى ومورفولوجيا هيولى خلايا هيلا قد حفظت جيدا في الشرائح من كتلة الخلية. في الوقت نفسه، كانت أنماط المصبوغة CKAP2 وكي-67 في إيمونوسيتوتشيميستري مماثلة تماما لتلك في المناعي تلطيخ في أنسجة السرطان البارافين. مع ظروف زراعة الخلايا المحورة، بما في ذلك الحضانة قبل خلايا هيلا تحت ظروف خالية من المصل، يمكن تقييم التأثير مع الحفاظ على المعلومات المعمارية. وفي الختام، إيمونوسيتوتشيميستري في كتل الخلايا جزءا لا يتجزأ من البارافين بديل ممتاز لتلطيخ إيمونوفلوريسسينت.
Introduction
كتل الخلايا جزءا لا يتجزأ من البارافين في معظم المختبرات، لا تستخدم عادة. بدلاً من ذلك، إصلاح الخلايا المستزرعة، الخلايا غير مضمن البارافين، يعملون في دراسات الترجمة سوبسيلولار. وقد استخدمت لتلك الثابتة الخلايا المستزرعة، fluorescence بدلاً من تشروموجين. ولذلك، تلطيخ إيمونوفلوريسسينت حاليا الأسلوب المفضل لتحديد مستويات التعبير البروتين في البحوث التي تستخدم الثقافات الخلية1. ومع ذلك، يمكن ملاحظة الشرائح المعدة لتلطيخ إيمونوفلوريسسينت، فقط تحت المجهر إيمونوفلوريسسينت، التي قد تظهر الصور مختلفة تماما عن تلك المشار إليها تحت المجهر الطائرة2. بالإضافة إلى ذلك، يتطلب الحفاظ على الشرائح لتلطيخ إيمونوفلوريسسينت الحماية من الضوء الساطع، وإشارات الفلورسنت تصبح أضعف مع التعرض المتكرر للتصوير بسبب فقدان إشارة مضيئة3. النتائج من إيمونوسيتوتشيميستري في كتل الخلايا جزءا لا يتجزأ من البارافين مماثلة تماما لتلك من immunohistochemistry على الأنسجة جزءا لا يتجزأ من البارافين4، وأنها يمكن أن يترجم بسهولة إلى المعلومات السريرية. ولذلك، يمكن أن يكون إيمونوسيتوتشيميستري بديل ممتاز. ومع ذلك، لم يكن إعداد الخلية كتلة شعبية في مختبرات البحوث الأساسية. في هذا البروتوكول، ثم تقدم إعداد كتلة الخلية و immunocytochemical تلطيخ للترويج لاستخدام هذا الأسلوب في مجال دراسات الخلية-الثقافة.
إعداد كتلة الخلايا وإيمونوسيتوتشيميستري ليست أساليب فريدة من نوعها، وأنها فعلا قد تم تطبيقه من التشخيص السريري للبحوث الأساسية4،5. على الرغم من أن إعداد كتلة الخلية مختلف الأساليب قد تم الإبلاغ عن4،الأسلوب6 ثرومبوبلاستين البلازما بسيطة وفعالة من حيث التكلفة وسهولة التكيف. ولذلك، يستخدم8 في البروتوكول المعروضة في هذه الورقة، أن ثرومبوبلاستين البلازما الأسلوب4،5،،من67،لإعداد كتل الخلايا جزءا لا يتجزأ من البارافين.
في هذه الدراسة، وقد عرضت الإجراءات المفصلة لإعداد كتل الخلايا ثرومبوبلاستين البلازما والأسلوب immunocytochemistry توظيف اثنين انتشار علامات. علامة واحدة من البروتينات المرتبطة سيتوسكيليتون 2 (CKAP2)، التي سجلت مؤخرا علامة الانقسامية9،،من1011؛ الآخر هو أن كي-67، الذي هو علامة انتشار شهرة12. ويرد النظام الممثل في الشكل 1.
Protocol
تمت الموافقة بروتوكول الدراسة المؤسسية استعراض المجلس للمركز الوطني للسرطان، كوريا (نككنكس-12-630).
1-نموذج إعداد (30 دقيقة)
- لاستزراع خلايا هيلا (CCL 2، ATCC)، استخدام 10 مل المتوسطة دميم كاملة (10% مصل بقرى الجنين، 1% القلم-بكتيريا) في صحن ثقافة 100 مم. إعداد خلايا هيلا المتعطشة للمصل، احتضان خلايا هيلا المتلاقية في دميم دون المصل البقري الجنين لمدة 48 ساعة، كما هو موضح في دراسة سابقة11.
- لفصل الخلايا، غسلها مع 2 مل مخزنة الفوسفات المالحة (PBS)، وإضافة التربسين يدتا 0.25% 2 مل كل طبق الثقافة 100 مم. ثم احتضانها لمدة 2-3 دقيقة في حاضنة2 CO في 37 درجة مئوية.
- إضافة 5 مل من إكمال دميم المتوسطة إلى الطبق الثقافة لإلغاء تنشيط التربسين، ونقل الخلايا المنفصلة إلى أنبوب 15 مل. ثم الطرد المركزي الخلايا في 300 غرام x لمدة 10 دقيقة لتشكيل بيليه.
- إزالة المادة طافية، وتغسل بيليه مرتين مع برنامج تلفزيوني الباردة 2 مل بالطرد المركزي على 300 غرام x لمدة 10 دقائق.
- بعد إزالة المادة طافية، إضافة 1 مل إيثانول 95% إلى بيليه الخلية، ومزيج بيليه الخلية مع الإيثانول من فورتيكسينج. تبقى الخلايا الثابتة على الجليد حتى إعداد كتلة الخلية.
2-كتلة الخلايا إعداد (1 ساعة و 30 دقيقة)
- للتحضير لبلازما مجمدة مختبرين، جمع يدتا البلازما من الدم المانحة صحية وتجميع أجهزة الطرد المركزي في س 13,000 ز للحد الأدنى 10 البلازما طافية، وقاسمه 200-400 ميليلتر كل في [ميكروفوج] أنابيب. تخزين مختبرين في-80 درجة مئوية حتى الاستخدام. عندما مختبرين بلازما مجمدة على استعداد، استردادها والذوبان في البلازما بالحضانة عند 37 درجة مئوية لمدة 5 دقائق.
- الطرد المركزي الخلايا الثابتة في 700 غ س لمدة 10 دقائق، ثم تجاهل المادة طافية.
- مزيج بيليه الخلية مع قطرات 2 (حوالي 200 ميليلتر) من البلازما، 2 قطرات من ثرومبوبلاستين، و 2 قطرات من كلوريد الكالسيوم 0.025 م. ثم مزجها بيبيتينج.
- اسمحوا المخلوط لتشكيل جلطة خلية في درجة حرارة الغرفة لمدة 10 دقائق، كما هو مبين في الشكل 2 ألف. ثم، يغسل تجلط الخلية مع برنامج تلفزيوني مرتين بصب وإزالة برنامج تلفزيوني بواسطة ماصة. ويبين الشكل 2Bجلطة الممثل الأبيض الخلية.
- بلل قطعة من ورق الترشيح مع الفورمالين، والتفاف تجلط الخلية مع ورق الترشيح قبل ترطب. ثم، ضع الخليط كلوتيد مع بينسيتي في كاسيت نسيج كما هو مبين في الشكل 2.
- مكان الكاسيت الأنسجة في وعاء زجاجي يحتوي على 50 مل من المخزن الفورمالين (10% فورمالين في برنامج تلفزيوني) بين عشية وضحاها في 4 درجات مئوية للتثبيت الفورمالين.
3-الأنسجة المعالجة وتضمينها البارافين (بين عشية وضحاها)
- تحميل الكاسيت الأنسجة المحتوية على تجلط خلية الفورمالين--الثابتة في معالج أنسجة بين عشية وضحاها كما هو موضح سابقا11. يتم تجهيز الأنسجة لإزالة المياه وتكييف الخلايا الثابتة قبل تضمين البارافين. للبحث دون معالجة الأنسجة وأداء الأنسجة التجهيز الداخلي كما هو مبين في الجدول 1.
- تشغيل تدقيق محطة، و 60 دقيقة في وقت لاحق، تضمين ساخنة أن هناك البرافين المنصهر في قالب معدني فيه (الشكل 2D).
- تأخذ تجلط شكلت خلية من نسيج كاسيت ووضعه في البرافين المنصهر داخل القالب المعدني.
- مكان الكاسيت الأنسجة الجديدة دون الغطاء في القالب المعدني الذي يحتوي على الخلية تجلط في منتصف البرافين المنصهر، وصب البرافين المنصهر أكثر في كاسيت الأنسجة وعلى القالب المعدني. ثم، اسمحوا البارافين يصلب في لوحة الباردة لمدة 30-60 ثانية.
- فصل في الكاسيت الأنسجة من العفن معدنية. ثم، كتلة الخلية البارافين جاهز إيمونوسيتوتشيميستري. تتم الإشارة إلى جلطة الخلية المدمجة في كتلة الخلية جزءا لا يتجزأ من البارافين بالسهم في الشكل 2E.
4-إعداد الشرائح إيمونوسيتوتشيميستري (ح 1)
- تحقق من المجال تجلط الخلية في الزنزانات البارافين، ومقطعة شرائح بسمك من 3-4 ميكرون باستخدام مبضع من الزنزانات. وضع المقاطع البارافين على الشرائح المغلفة سيلاني الزجاج، كما هو مبين في الشكل 2 واو.
- ضع الشرائح القسم في فرن 37 درجة مئوية لمدة 30 دقيقة جعل الفروع الالتزام بالشرائح.
5-إيمونوسيتوتشيميستري كتل الخلايا (ح 6)
ملاحظة: ل immunocytochemical تلطيخ على أبواب الزنزانات، مجموعات مختلفة يمكن استخدامها (انظر الجدول للمواد). جميع هذه المجموعات قد مختلف الحساسيات والخصوصيات تبعاً لتلك التعديلات.
- احتضان الفروع في 50 مل من زيلين نفط لمدة 4 دقيقة إزالة بارافينيزي.
- احتضان الشرائح في الإيثانول 100% لمدة 2 دقيقة للجفاف، ومرتين في الإيثانول 95%، وفي الإيثانول 80% لمدة 2 دقيقة. ثم إزالة الإيثانول في الماء لمدة 10 دقائق.
- لاسترجاع مستضد، وضع الشرائح في جرة تحتوي على 40 مل تريس يدتا استرداد مخزن مؤقت، pH 9.0، ويغلي في طنجرة لمدة 30 دقيقة.
- يغسل الشرائح تحت الماء الجاري، واحتضان لهم في الإيثانول 95% لمدة 10 دقائق في 4 درجات مئوية. ثم، وضع علامة منطقة تلطيخ الخلية على الشرائح بقلم Pap لتحديد سهلة.
- يغسل الشرائح في تريس مخزنة المالحة التي تحتوي على نسبة 0.2% 20 توين (TBS-T)، واحتضان في كتلة بيروكسيد الهيدروجين (انظر الجدول للمواد) في درجة حرارة الغرفة لمدة 15 دقيقة لإزالة أي بقايا البيروكسيديز النشاط. ثم، يغسل الشرائح في تي تبس ثلاث مرات لكل 2 دقيقة.
- إعداد حل جسم المخفف بإذابة جسم الأولية في كتلة البروتين (انظر الجدول للمواد). على سبيل المثال، تضعف CKAP2 جسم الأولية يمكن أن تكون 1: 100، و 1: 500 في جسم كي-67. ثم احتضان الشرائح في 100 ميليلتر من حل جسم المخفف ح 1.
- بعد الغسيل في تي تبس خمس مرات لكل 2 دقيقة، احتضان الشرائح في محسن الضد الرئيسي في هذه المجموعة لمدة 15 دقيقة في درجة حرارة الغرفة في الظلام.
- بعد الغسيل في تي تبس أربع مرات لكل 2 دقيقة, 2 إضافة قطرات من برنامج الصحة الإنجابية البوليمر (جسم ثانوي المسمى مع الفجل البيروكسيديز)، واحتضان الشرائح في درجة حرارة الغرفة لمدة 30 دقيقة.
- بعد الغسيل في تي تبس خمس مرات لكل 2 دقيقة، إضافة 100 ميليلتر لحل ديامينوبينزيديني (DAB) (انظر الجدول للمواد)، واحتضان الشرائح لمدة 3 دقائق.
- بعد الغسيل في تي تبس مرتين، إضافة 100 ميليلتر من حل الهيماتوكسيلين (الخليط من 100 ميليلتر من الهيماتوكسيلين و 600 ميليلتر من الماء المقطر)، واحتضان الشرائح لمدة 1 دقيقة.
- بعد الغسيل يذوي الشرائح في تي تبس مرة واحدة، التي تفرخ في الإيثانول 95% لمدة 2 دقيقة وغمس في الإيثانول 95% مرة واحدة، وغمس في الإيثانول 100% مرتين. ثم احتضان الشرائح في 40 مل زيلين نفط في وعاء زجاجي لمدة 5 دقائق.
- عندما تكون الشرائح الجافة من زيلين نفط، وجبل كوفيرسليبس الخاصة بكل منها.
- التقيد أنماط المصبوغة باستخدام الفحص المجهري الخفيفة.
النتائج
في شريحة الملون الهيماتوكسيلين ويوزين من كتلة الخلية جزءا لا يتجزأ من البارافين (الشكل 3 ألف، باء)، ومعظم الأنوية والسيتوبلازم للخلايا سليمة، مما يدل على أن الحفاظ على الخصائص المورفولوجية ممتازة مع (البروتوكول الحالي الشكل 3 ألف). في immunocytochemical تلطيخ، تلطيخ CKAP2 الإيجابية قد لوحظ في الكروماتين المكثف والمغزل التفتلي والسيتوبلازم (الشكل 4)، كما ذكر سابقا10. ولوحظ تلطيخ كي-67 في نواة الخلية، كالمتوقع (الشكل 4). فقط الخلايا مع CKAP2 تلطيخ في الكروماتين المكثف (انظر الأسهم في الشكل 4 أ، ب) كانت الخلايا الانقسامية. وعرضت العديد من CKAP2-إيجابية الخلايا في خلايا هيلا عاليا الانقسامية التي أعدت بعد حضانة في المتوسط كاملة (الشكل 4 أ). وبالمقارنة، كان هناك قليل المناعة CKAP2 الخلايا في خلايا هيلا المتعطشة للمصل (الشكل 4 باء). كانت معظم الخلايا هيلا الانقسامية عاليا كي-67 الإيجابية (الشكل 4). كونتراستينجلي، وظل معدل كي-67-الإيجابية في خلايا هيلا المتعطشة للمصل مرتفعا كما ~ 50% (الشكل 4). هذه النتائج قابلة للمقارنة تماما لتلك التي السابقة تقرير11، مما يوحي بأن CKAP2 علامة انتشار أكثر موثوقية في الخلايا السرطانية مما أن كي-67.
في كتل الخلايا سيئة الإعداد، يتم فصل الأنوية من السيتوبلازم، وهناك أيضا، ريسولتانتلي، الحفاظ على السمات الفقراء. قد يسبب الحضانة أطول من ليلة أمس للخلايا الثابتة في ثلاجة هذه النتائج السيئة. مشكلة هامة أخرى أن الخلايا ملطخة ليس جيدا من قبل إيمونوسيتوتشيميستري، وبغض النظر عن مورفولوجيا ممتازة. تظهر هذه المشكلة أكثر في كثير من الأحيان عندما يكون تجلط خلية صغيرة. عادة ما يكون كثافة المصبوغة غير النظامية كما هو موضح في الشكل 3 (ب)؛ ولكن عندما تكون تجلط خلية أكبر، هناك فرصة أقل بكثير من تلطيخ غير النظامية. ولذلك، في هذا البروتوكول، قمنا بزيادة حجم البلازما، ثرومبوبلاستين، وكلوريد الكالسيوم بغية تشكيل جلطة خلية كبيرة.
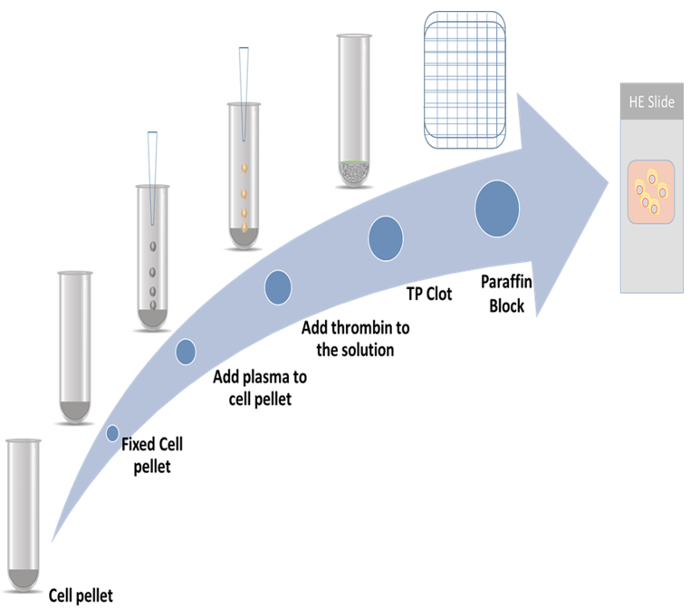
رقم 1: مخطط إعداد كتلة الخلية. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
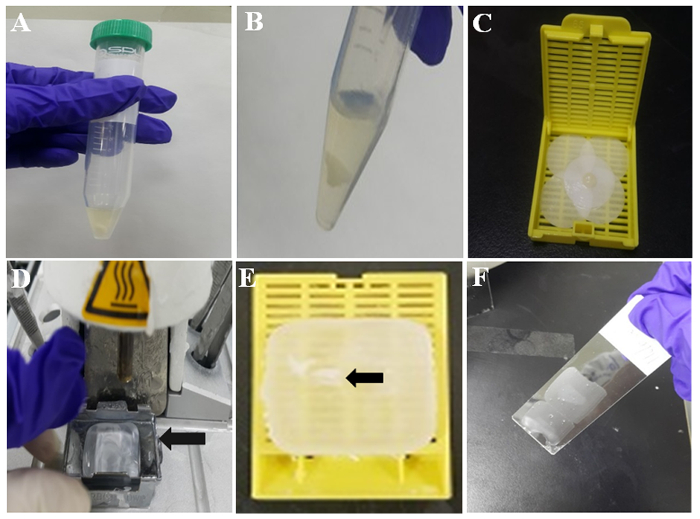
رقم 2: رسم توضيحي لإعداد كتلة الخلية البارافين. (أ) ثرومبوبلاستين البلازما تجلط الخلية في أنبوب. (ب) TP "خلية" جلطة بعد الغسيل برنامج تلفزيوني. (ج) خلية تجلط على ورق الترشيح ترطب. (د) تضمين الأنسجة المحطة بالشمع المنصهر. القالب المعدني (السهم) يحمل الشمع المنصهر للتجميد. (E) الخلية البارافين-جزءا لا يتجزأ من جلطة (السهم) المضمنة في البارافين أو كتلة الخلية جزءا لا يتجزأ من البارافين. (و (قسم البارافين رقيقة في الجزء الأوسط من شريحة المغلفة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
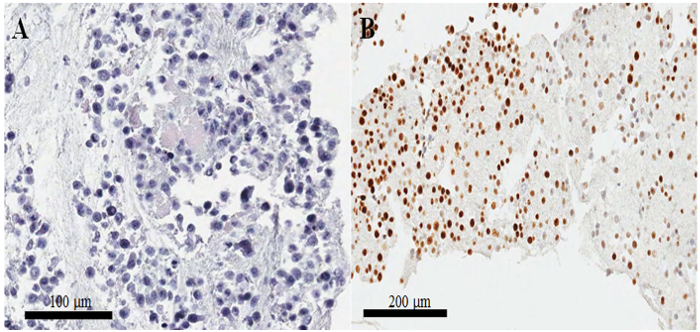
الشكل 3: إعداد كتلة الخلية، وتأكيد الجودة الهيماتوكسيلين ويوزين وإيمونوستينينج- (أ) توضع وويوزين-ملطخة بصورة خلايا هيلا في مقطع كتلة خلية جزءا لا يتجزأ من البارافين. (ب) تلوين غير النظامية لكي-67 في إيمونوسيتوتشيميستري على سوء إعداد قسم الزنزانات جزءا لا يتجزأ من البارافين. أشرطة مقياس 100 (أ) و (ب) 200 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
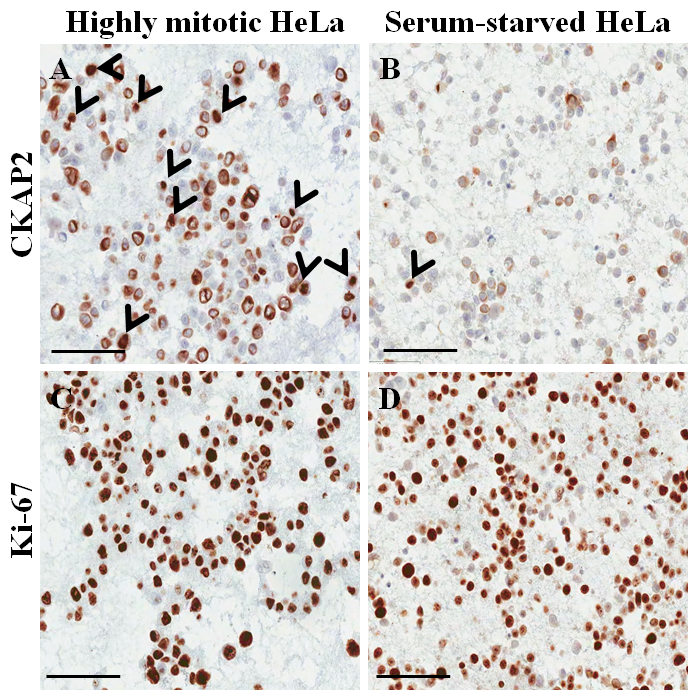
الشكل 4: Immunocytochemical تلطيخ في الزنزانات جزءا لا يتجزأ من البارافين لخلايا هيلا. (أ) CKAP2 تلطيخ تحت ظروف شديدة الانقسامية. (ب) CKAP2 تلطيخ ظروف المتعطشة للمصل. (ج) أن كي-67 تلطيخ تحت ظروف شديدة الانقسامية. (د) أن كي-67 تلطيخ ظروف المتعطشة للمصل. يتم عرض أشرطة مقياس ميكرومتر 100. رؤوس الأسهم تشير إلى الخلايا CKAP2 إيجابية. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
| الإجراء | الخطوات | الحل | الوقت/درجات الحرارة |
| الجفاف | 1 | الكحول 70% | 15 دقيقة/RT |
| 2 | الكحول 80% | 15 دقيقة/RT | |
| 3 | الكحول 95% | 15 دقيقة/RT | |
| 4 | الكحول 100% | 15 دقيقة/RT | |
| مسح | 1 | زيلين نفط | 60 دقيقة/4 درجة مئوية |
| 2 | زيلين نفط | 10 دقيقة/RT | |
| 3 | زيلين نفط | 10 دقيقة/RT | |
| 4 | زيلين نفط | 10 دقيقة/RT | |
| * RT، درجة حرارة الغرفة |
الجدول 1. الأنسجة التجهيز الداخلي.
Discussion
تلوين إيمونوفلوريسسينت في الخلايا المستزرعة الثابتة حاليا الأسلوب المفضل لتحديد مستوى التعبير البروتين في الخلايا مع الحفاظ على الخصائص المورفولوجية المعلومات1. ومع ذلك، يمكن أن إيمونوسيتوتشيميستري على كتل الخلايا جزءا لا يتجزأ من البارافين بديل ممتاز. وقد وصف الإجراءات المفصلة لإعداد كتل جزءا لا يتجزأ من البارافين الخلايا وإيمونوسيتوتشيميستري في هذا البروتوكول، ونأمل أن يمكن أن تسهل تطبيق إيمونوسيتوتشيميستري في الدراسات الخلية.
وقد Immunocytochemistry تلطيخ إيممونوفلوريسسينت العديد من المزايا. تلوين إيمونوفلوريسسينت للخلايا وعادة ما تتطلب الخلايا المستزرعة طازجة، ولكن يمكن الاحتفاظ بكتل الخلايا البارافين في درجة حرارة الغرفة لعدة سنوات13. بالإضافة إلى ذلك، إيمونوسيتوتشيميستري في كتل الخلايا يمكن استكشاف أنماط التعبير داخل الخلايا باستخدام الأجسام المضادة نفسها المستخدمة في إيمونوهيستوتشيميستري الروتينية في الأنسجة البشرية4. وعلاوة على ذلك، فإنه يمكن استكشاف التغيرات في مستويات البروتين أو تعديلات بوستترانسلاشونال أما من قبل حضانة الخلايا مع مختلف العقاقير أو تحت مختلف الظروف الثقافة11.
وعلى النقيض من مزايا immunocytochemical تلطيخ، إعداد كتل الخلايا جزءا لا يتجزأ من البارافين يستغرق وقتاً طويلاً وهي مكلفة14. أيضا، معظم بحوث المختبرات تفتقر إلى الخبرة في هذا الأسلوب، وتشيع الأخطاء التقنية في مثل هذه الظروف. الأخطاء الأكثر شيوعاً هي الحفاظ على مورفولوجيا الخلايا الفقراء والفقراء أو غير النظامية immunocytochemical تلطيخ على الأقسام كتلة الخلية البارافين. يمكن تجنب هذه ومعظم الآخرين بجعل كتل الخلايا في أفضل ظروف الخلية واستخدام الحل ما يكفي لتشكيل جلطات الخلية.
وإظهارا لهذا البروتوكول، وأعدت كتل الخلايا لخلايا هيلا، و immunocytochemical تلطيخ أجريت لاثنين من علامات الانتشار، CKAP2 وكي-67، كما ذكر من قبل11. إيمونوسيتوتشيميستري، تم التلاعب بها الخلايا بالحضانة في وسائل الإعلام مع أو بدون المصل البقري الجنين، ويمكن ملاحظة تأثير المجاعة المصل. ويمكن استخدام هذه الكتل الخلية جزءا لا يتجزأ من البارافين استعداد عدد كبير من الأجسام المضادة، لأنه يمكن إعداد شرائح كثيرة من كتلة خلية فقط قسم 4-5 ميكرومتر سميكة الزنزانات كل شريحة باستخدام. ولذلك، يمكن تقييم أنماط التعبير المطابق لشرطين مختلفة مع العديد من الأجسام المضادة المختلفة. Immunostaining أنماط ل CKAP2 وذكرت أن كي-67 في سرطان الأنسجة قد تم بالفعل9،10،،من1112immunocytochemical تلطيخ النتائج يمكن بسهولة تقييم، نظراً أنماط المصبوغة كانت مماثلة تماما لتلك من إيمونوهيستوتشيميستري.
وفي الختام، immunocytochemical تلطيخ في كتل البارافين خلية يمكن أن تكون بديلاً ممتازا لتلطيخ إيمونوفلوريسسينت؛ وعلاوة على ذلك، فإنه يمكن بسهولة وبشكل موثوق توظيف في البحوث الأساسية للتعبير التنميط في خطوط الخلايا مع الحفاظ على معلومات الخصائص المورفولوجية.
Disclosures
وقد أعلنت جميع المؤلفين لا تضارب في المصالح.
Acknowledgements
هذا العمل كان يدعمها المنح البحثية لمحمد ك. من مركز السرطان الوطني، كوريا (1510121) والمؤسسة الوطنية للبحوث، كوريا (لا. NRF-2015R1A2A2A04007432).
Materials
| Name | Company | Catalog Number | Comments |
| HeLa Cells | ATCC | HeLa (ATCC CCL-2) | |
| Ki-67 Antibody | Thermo Fisher Scientific | RM-9106-S1 | |
| Paraffin | Leica | 39601006 | |
| Xylene | Fisher SCientific | 1330-20-7,100-41-4 | |
| Ethenol | GD Chem | DJ16016 | |
| Hematoxylin | Agilent | 10118581 | |
| DAB Quanto Kit | Thermo Fisher Scientific | TA-125-QHDX, QHCX 170405 | |
| Ultravision LP detection Kit | Thermo Fisher Scientific | PBQ141209, LPB141209, LPH141210 | Kit for immunocytochemistry; contains protein block |
| TintoRetriever Pressure Cooker | Bio SB Corporation | BSB 7008 | |
| Tris-buffered saline | iNtRON Biotechnology | IBS-BT008 | |
| Tween 20 | USB Corporation | 115106 | |
| Thromboplastin | Neoplastin Cl Plus | NC0591432 | |
| Tris-EDTA retrival Buffer | Dignostic Biosystem | E625-A | |
| Trypsin EDTA | Thermo Fisher Scientific | 25200056 | |
| Fetal bovine serum (FBS) | Hyclone Laboratories Inc | SH30910.03 | |
| DMEM | Hyclone Laboratories Inc | SH30243.01 | |
| Antibiotic-Antimycotic, 100X | Thermo Fisher Scientific | 15240062 | |
| Ultra vision peroxide block H2O2 | Thermo Fisher Scientific | 02Q141212 | |
| Mounting Medium | Thermo Fisher Scientific | 363313 | |
| Pap-Pen | Vector Laboratories | H-4000 | |
| Filter Paper | GE Healthcare Life Sciences | 1001-0155 | |
| Calcium Chloride | Sigma-Aldrich | 21115-100ml | |
| Phosphate-buffered saline | PAA Laboratories | H21-002 | |
| Formalin | Daejung | 50-00-0 | |
| 15 ml tube | SPL Life Sciences | 50015 | |
| tissue processing cassette | Simport | M492-5 | |
| 100 mm culture dishes | BD Biosciences | 08-772E | |
| Glass Slide | Muto Pure Chemicals | 140712 | |
| Cover Glass | Marienfeld | 2262817 | |
| Glass Zar | Hyunil Lab-Mate | HIP-1027 | |
| Centrifuge | Eppendorf | 5810R | |
| Class II Laminar Flow Hood | Thermo Fisher Scientific | 1300 series A2 | |
| CO2 Incubator | Thermo Fisher Scientific | Series A2 | |
| Tissue Processor | Leica BioSystem | TP1020 | |
| Microtome | Thermo Fisher Scientific | HM340E | |
| Microscope | Olympus | CX-21 | |
| Paraffin embedding station | Thermo Fisher Scientific | EC 350-1, EC 350-2 | |
| Tissue Section Bath (Round) | CellPath | HCP-JAW-0100-00AEU | |
| Fume Hood | Hanyang Scientific Equipment Co. Ltd. | FH-150 |
References
- Bhattacharyya, D., Hammond, A. T., Glick, B. S. High-quality immunofluorescence of cultured cells. Methods Mol Biol. 619, 403-410 (2010).
- Brown, C. M. Fluorescence microscopy - Avoiding the pit falls. J Cell Sci. 120, 1703-1705 (2007).
- Odell, I. D., Cook, D. Immunofluorescence Techniques. J Invest Dermatol. 133, e4 (2013).
- Kulkarni, M. B., Desai, S. B., Ajit, D., Chinoy, R. F. The utility of the thromboplastin-plasma cell-block technique for fine-needle aspiration and serous effusions. Diagn Cytopathol. 37 (2), 86-90 (2009).
- Shivakumarswamy, U., Arakeri, S. U., Karigowdar, M. H., Yelikar, B. Diagnostic utility of the cell block method versus the conventional smear study in pleural fluid cytology. J Cytol. 29 (1), 11-15 (2012).
- Nathan, N. A., Narayan, E., Smith, M. M., Horn, M. J. Cell block cytology: Improved preparation and its efficacy in diagnostic cytology. Am J Clin Pathol. 114 (4), 599-606 (2000).
- Keyhani-Rofagha, S., Vesey-Shecket, M. Diagnostic value, feasibility, and validity of preparing cell blocks from fluid-based gynecologic cytology specimens. Cancer. 96, 204-209 (2002).
- Young, N. A., Naryshkin, S., Katz, S. M. Diagnostic value of electron microscopy on paraffin-embedded cytologic material. Diagn Cytopathol. 9, 282-290 (1993).
- Jin, Y., Murakumo, Y., Ueno, K., Hashimoto, M., Watanabe, T., Shimoyama, Y., et al. Identification of a mouse cytoskeleton-associated protein, CKAP2, with microtubule-stabilizing properties. Cancer Sci. 95 (10), 815-821 (2004).
- Hong, K. U., Choi, Y. -. B., Lee, J. -. H., Kim, H. -. J., Kwon, H. -. R., Seong, Y. -. S., et al. Transient phosphorylation of tumor associated microtubule associated protein (TMAP)/cytoskeleton associated protein 2 (CKAP2) at Thr-596 during early phases of mitosis. Exp Mole Med. 40, 377-386 (2008).
- Sim, S. H., Bae, C. D., Kwon, Y., Hwang, H. -. L., Poojan, S., Hong, H. -. I., et al. CKAP2 (cytoskeleton-associated protein2) is a new prognostic marker in HER2-negative luminal type breast cancer. PLoS ONE. 12 (8), e0182107 (2017).
- Inwald, E. C., Klinkhammer-Schalke, M., Hofstadter, F., Zeman, F., Koller, M., Gerstenhauer, M., et al. Ki-67 is a prognostic parameter in breast cancer patients: results of a large population-based cohort of a cancer registry. Breast Cancer Res Treat. 139 (2), 539-552 (2013).
- Katikireddy, K. R., O'Sullivan, F. Immunohistochemical and immunofluorescence procedures for protein analysis. Methods Mol Biol. 784, 155-167 (2011).
- Beutner, E. H. Immunofluorescent staining: The fluorescent antibody method. Microbiol Mol Biol Rev. 25 (1), 49-76 (1961).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved