Method Article
Determinación del nivel de expresión de la proteína en células cultivadas por Immunocytochemistry en bloques de parafina-encajado de la célula
En este artículo
Resumen
En la actualidad, coloración inmunofluorescente en células fijas es el método de elección para la determinación de los niveles de expresión de la proteína cuando información morfológica también es necesario. Este protocolo presentada en este documento se proporciona para un método alternativo de immunocytochemistry en bloques de parafina-encajado de la célula.
Resumen
Tinción inmunofluorescente es actualmente el método de elección para la determinación de los niveles de expresión de la proteína en los sistemas de cultivo celular información morfológica también es necesario. El protocolo de immunocytochemical que manchaba en bloques de parafina-encajado de la célula, presentados en este documento, es una excelente alternativa a la tinción inmunofluorescente en células fijas parafina-encajado. En este protocolo, un bloque de parafina celular de células HeLa fue preparado usando el método de plasma thromboplastin e inmunocitoquímica se realizó la evaluación de dos marcadores de proliferación, CKAP2 y Ki-67. Los núcleos y morfología citoplasmática de las células HeLa fueron bien preservados en las diapositivas de la célula en bloque. Al mismo tiempo, los patrones de tinción CKAP2 y Ki-67 en la inmunocitoquímica eran absolutamente similares a los de immunohistochemical que manchaba en tejidos de cáncer de parafina. Con condiciones de cultivo de células modificadas, incluyendo la incubación de células HeLa en condiciones libres de suero, el efecto podría evaluarse preservando información arquitectónica. En conclusión, la inmunocitoquímica en bloques de parafina-encajado de la célula es una excelente alternativa a la tinción inmunofluorescente.
Introducción
En la mayoría de los laboratorios, bloques de parafina-encajado de la célula no se utilizan. Por el contrario, fija las células cultivadas, células no embebido en parafina, se emplean en estudios de localización subcelular. Para aquellos cultivos de células, se ha utilizado la fluorescencia en lugar de cromógeno. Por lo tanto, coloración inmunofluorescente es actualmente el método de elección para la determinación de niveles de expresión de la proteína en la investigación utilizando células culturas1. Diapositivas preparadas para la tinción inmunofluorescente, sin embargo, pueden observarse sólo bajo microscopia inmunofluorescente, que podría mostrar imágenes muy diferentes de las indicadas en el plano microscopia2. Además, preservación de portaobjetos para la tinción inmunofluorescente requiere protección contra la luz brillante y fluorescentes señales se vuelven más débiles con la exposición repetida de la proyección de imagen debido a la pérdida de la señal fluorescente3. Los resultados de inmunocitoquímica en bloques de parafina-encajado de la célula son muy similares a los de inmunohistoquímica en tejido parafina-encajado4, y fácilmente puede ser traducidos en información clínica. Por lo tanto, inmunocitoquímica puede ser una excelente alternativa. Sin embargo, preparación de bloque celular no ha sido popular en los laboratorios de investigación básica. En este protocolo, entonces, preparación de bloque celular y la coloración immunocytochemical se proporcionan para promover el uso de este método en el campo de los estudios de cultivo celular.
Immunocytochemistry y la preparación del bloque de la célula no son métodos únicos, y ya se han aplicado de diagnosis clínica investigación básica4,5. Aunque la preparación de bloque celular varios métodos han sido registrados4,6 el plasma thromboplastin método es simple, rentable y fácilmente adaptable. Por lo tanto, en el protocolo presentado en este documento, la tromboplastina-plasma método4,5,6,7,8 se utiliza para la preparación de bloques de parafina-encajado de la célula.
En el presente estudio se demostraron los procedimientos detallados para la preparación de bloques de celdas de plasma thromboplastin y el método de inmunocitoquímica con dos marcadores de proliferación. Un marcador es citoesqueleto proteína 2 (CKAP2), que se ha divulgado recientemente como un marcador mitótico9,10,11; el otro es Ki-67, que es el más conocido de marcador de proliferación12. El régimen representativo se muestra en la figura 1.
Protocolo
El protocolo de estudio fue aprobado por el institucional de Junta de centro nacional del cáncer, Corea (NCCNCS-12-630).
1. preparación (30 minutos)
- Para el cultivo de células HeLa (CCL-2, ATCC), utilice el medio DMEM completo 10 mL (suero bovino fetal 10%, 1% pen-strep) en una placa de cultivo de 100 mm. Para preparar suero de hambre las células HeLa, incubar las células HeLa confluentes en DMEM sin suero fetal bovino durante 48 horas, como se describe en un anterior estudio11.
- Para separar las células, lavar con solución salina 2 mL con tampón fosfato (PBS) y añadir tripsina de EDTA de 0.25% de 2 mL por placa de cultivo de 100 mm. A continuación, incubar durante 2-3 minutos en un incubador de CO2 a 37 ° C.
- Añadir 5 mL de medio DMEM completo a la placa de cultivo para desactivar la tripsina y transferir las células separadas a un tubo de 15 mL. Luego, centrifugar las células a 300 x g durante 10 min formar un pellet.
- Quite el sobrenadante y lavar el pellet dos veces con PBS frío 2 mL por centrifugación a 300 x g durante 10 minutos.
- Después de la eliminación del sobrenadante, agregar 1 mL de etanol al 95% para el precipitado de células y mezclar el sedimento celular con etanol con un vórtex. Mantenga las células fijas en el hielo hasta que la preparación del bloque de la célula.
2. célula-bloque preparación (1 h 30 min)
- Para la preparación de plasma congelado alícuotas, recoja EDTA plasma de sangre de donantes sanos y centrifugar a 13.000 x g durante 10 minutos recoja el plasma sobrenadante y tubos alícuota 200-400 μL cada en microcentrífuga. Almacenar las alícuotas a-80 ° C hasta su uso. Cuando las alícuotas de plasma congelado, recuperarlos y descongelar el plasma por la incubación a 37 ° C durante 5 minutos.
- Centrifugar las células fijadas a 700 x g durante 10 minutos, luego deseche el sobrenadante.
- Mezclar el sedimento celular con 2 gotas (aproximadamente 200 μL) del plasma, 2 gotas de tromboplastina y 2 gotas de cloruro de calcio de 0,025 M. Luego, mezclar mediante pipeteo.
- Deje que la mezcla formar un coágulo de células a temperatura ambiente durante 10 min, como se muestra en la figura 2A. Luego, lavar el coágulo de células con PBS dos veces vertiendo y PBS con una pipeta. El coágulo de la representante de la célula blanco se muestra en la figura 2B.
- Humedecer un trozo de papel de filtro con formalina y envuelva el coágulo de células con el papel de filtro previamente humedecido. Luego, coloque la mezcla coagulada con un pincette en una cinta de tejido como se muestra en la figura 2.
- Lugar el cassette de tejido en un frasco de vidrio conteniendo 50 mL de formalina tamponada (formol al 10% en PBS) durante la noche a 4 ° C para la fijación de formalina.
3. tejido procesamiento y la inclusión en parafina (noche)
- Cargar la cinta de tejido que contiene el coágulo de células formalina-fijo en un procesador de tejido durante la noche como se describió anteriormente11. El proceso de tejido es para eliminación de agua y acondicionamiento de células fijadas antes de la inclusión en parafina. Para la investigación sin procesamiento de tejidos, realizar el tejido procedimiento de procesamiento, como se muestra en la tabla 1.
- Encienda la climatizada empotrar estación y 60 minutos más tarde, verificar que hay parafina fundida en el molde de metal en ella (Figura 2D).
- Tome el coágulo formado de la célula del cassette de tejido y colóquelo en la parafina fundida en el molde de metal.
- Lugar el nuevo cassette de tejido sin la tapa en el molde de metal que contiene la celda coagula en el medio de la parafina fundida y verter más parafina fundida en el cassette de tejido y en el molde de metal. Entonces, que la parafina solidifique en la placa fría durante 30-60 segundos.
- Separar el cartucho tejido del molde de metal. Entonces, el bloque de parafina de la célula está listo para inmunocitoquímica. El coágulo de células incrustadas en el bloque de parafina-encajado de la célula es indicado por la flecha en la Figura 2E.
4. preparación de portaobjetos para inmunocitoquímica (1 h)
- Revise el área para el coágulo de células en el bloque de la célula de la parafina y cortar el bloque de la célula con espesores de 3-4 μm utilizando un micrótomo. Coloque las secciones de parafina en portaobjetos de vidrio recubierto de silano, como se muestra en la figura 2F.
- Coloque la sección los portaobjetos en un horno de 37 ° C durante 30 min para hacer las secciones que se adhieren a las diapositivas.
5. inmunocitoquímica de bloques de celdas (6 h)
Nota: Para immunocytochemical que manchaba en secciones de bloque celular, varios kits pueden utilizarse (véase Tabla de materiales). Todos los kits tienen diferentes sensibilidades y especificidades dependiendo de sus modificaciones.
- Incubar las secciones en 50 mL de xileno por 4 min a-paraffinize.
- Incubar los portaobjetos en etanol al 100% por 2 min para la deshidratación y dos veces en etanol al 95% y en etanol al 80% por 2 min. Luego, retire el etanol en agua durante 10 minutos.
- Para la recuperación de antígeno, coloque los portaobjetos en un tarro que contiene 40 mL Tris-EDTA recuperación tampón, pH 9.0 y hervir en una olla durante 30 minutos.
- Lavar los portaobjetos con agua corriente e incubar en etanol al 95% durante 10 min a 4 ° C. Luego, marque el área de tinción de células en el portaobjetos con un lápiz de Papanicolau para la identificación fácil.
- Lavar los portaobjetos en solución salina tamponada con Tris que contiene 0.2% Tween 20 (TBS-T) e incubar en el bloque de peróxido de hidrógeno (véase Tabla de materiales) a temperatura ambiente durante 15 min eliminar cualquier actividad de la peroxidasa de remanente. Luego, lave las diapositivas en TBS-T tres veces de 2 minutos cada uno.
- Preparar la solución de anticuerpo diluido por diluir el anticuerpo primario en el bloque de proteína (véase Tabla de materiales). Por ejemplo, el CKAP2 anticuerpo primario puede ser diluido 1: 100 y el Ki-67 anticuerpos 1: 500. Luego, incubar los portaobjetos en 100 μl de solución de anticuerpo diluido durante 1 hora.
- Después del lavado en TBS-T cinco veces por 2 minutos, incubar los portaobjetos en el reforzador de anticuerpo primario en el juego por 15 min a temperatura ambiente en la oscuridad.
- Después del lavado en TBS-T cuatro veces por 2 minutos, añadir 2 gotas de polímero HRP (un anticuerpo secundario marcado con peroxidasa de rábano) e incubar los portaobjetos a temperatura ambiente durante 30 minutos.
- Después del lavado en TBS-T cinco veces por 2 minutos, agregar 100 μl de solución de diaminobenzidina (DAB) (véase Tabla de materiales) e incubar el portaobjetos durante 3 minutos.
- Después del lavado en TBS-T dos veces, añada 100 μl de solución de hematoxilina (la mezcla de 100 μl de la hematoxilina y 600 μl de agua destilada) e Incube los portaobjetos durante 1 minuto.
- Después de lavar los portaobjetos en TBS-T una vez, deshidratar por incubando en etanol al 95% por 2 min, inmersión en etanol al 95% una vez e inmersión en etanol al 100% dos veces. Luego, incubar el portaobjetos en xileno de 40 mL en un frasco de vidrio durante 5 minutos.
- Cuando las diapositivas estén secas de xileno, Monte el respectivo cubreobjetos.
- Observar los patrones de tinción utilizando la microscopía de luz.
Resultados
En un portaobjetos de tinción hematoxilina y eosina del bloque parafina-encajado de la célula (Figura 3AB), la mayoría de los núcleos y el citoplasma de las células están intactas, lo que sugiere que la preservación morfológica con el actual protocolo ( Figura 3A). En la coloración immunocytochemical, coloración positiva de CKAP2 se observó en el huso mitótico y cromatina condensada y citoplasma (figura 4), previamente divulgados10. Tinción de Ki-67 se observó en los núcleos celulares, como esperado (figura 4). Sólo las células con CKAP2 tinción de cromatina condensada (ver las flechas en la Figura 4AB) eran las células mitotic. Muchas células CKAP2-positivos se muestran en las células HeLa altamente mitóticas que se habían preparadas después de una incubación en medio completo (Figura 4A). En comparación, hubo pocas células CKAP2-positivo en el suero de hambre las células HeLa (Figura 4B). La mayoría de las células HeLa altamente mitotic eran Ki-67 positivo (figura 4). En contraste, el índice Ki-67-positive en las células HeLa suero de hambre seguía siendo tan alto como 50% (figura 4). Estos resultados son absolutamente comparables a los de un anterior informe11, que sugiere que la CKAP2 es un marcador más confiable de proliferación en células de cáncer que es Ki-67.
En bloques de celdas mal preparados, los núcleos están separados del citoplasma, y también hay, en consecuencia, mala preservación morfológica. Incubación más largo que la noche de las células fijas en un refrigerador puede hacer que estos pobres resultados. Otro problema importante es que las células no se tiñen bien por inmunocitoquímica, a pesar de la excelente morfología. Este problema se presenta más a menudo cuando el coágulo de células es pequeño. Por lo general, la intensidad de la tinción es irregular como se muestra en la figura 3B; pero cuando el coágulo de células es mayor, hay mucho menos posibilidad de tinción irregular. Por lo tanto, en este protocolo, hemos aumentado los volúmenes de plasma, tromboplastina y cloruro de calcio para formar un coágulo de células grandes.
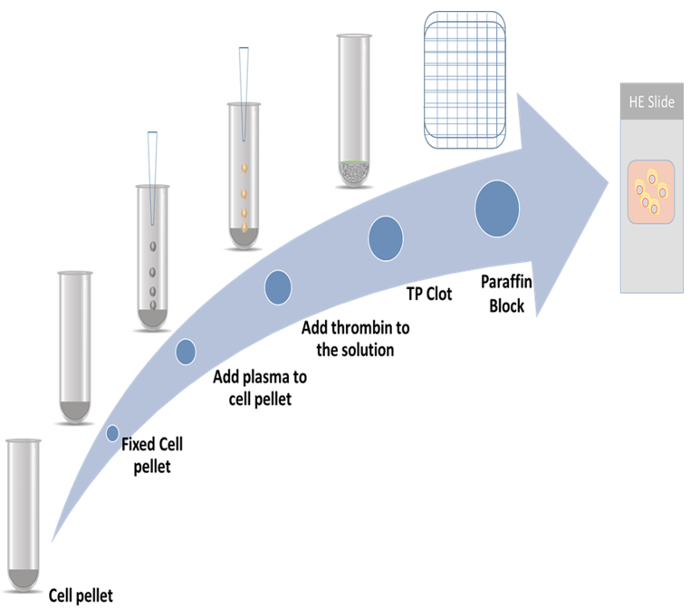
Figura 1: esquema de preparación de bloque celular. Haga clic aquí para ver una versión más grande de esta figura.
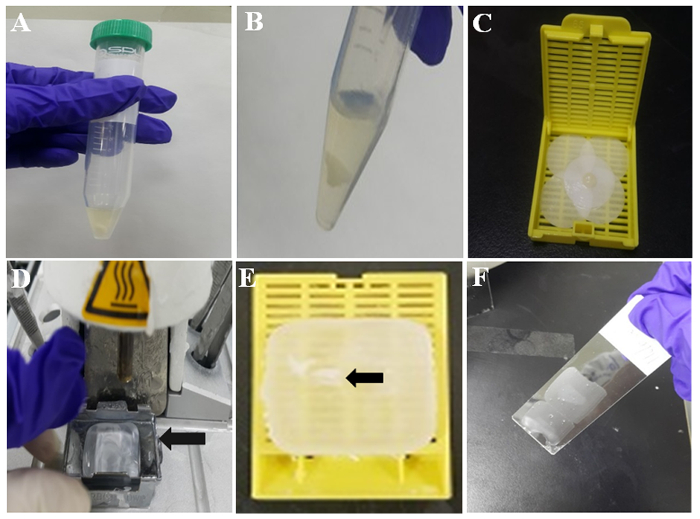
Figura 2: ilustración de la preparación de parafina bloque celular. (A) coágulo de células de la tromboplastina-plasma en tubo. B coágulo de células TP después de lavado PBS. Coágulo (C) células en papel de filtro humedecido. (D) estación inclusión de tejido con cera fundida. Molde de metal (flecha) tiene cera fundida para la solidificación. E coágulo de células incluidas en parafina (flecha) embebido en parafina o bloque parafina-encajado de la célula. F sección fina de parafina sobre la parte central de un portaobjetos recubierto. Haga clic aquí para ver una versión más grande de esta figura.
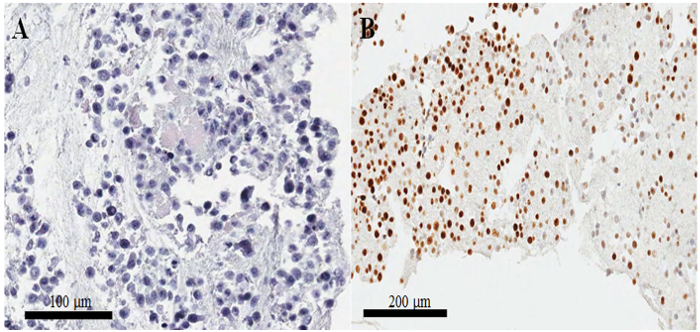
Figura 3: preparación de bloque celular y confirmación de calidad por la hematoxilina y la eosina y el immunostaining. (A) imagen de hematoxilina-y-eosina-manchadas de células HeLa en una sección de la célula-bloque parafina-encajado. (B) irregular tinción de Ki-67 en immunocytochemistry en mal preparado sección celular-bloque parafina-encajado. Barras de escala son (A) 100 y (B) 200 μm. Haga clic aquí para ver una versión más grande de esta figura.
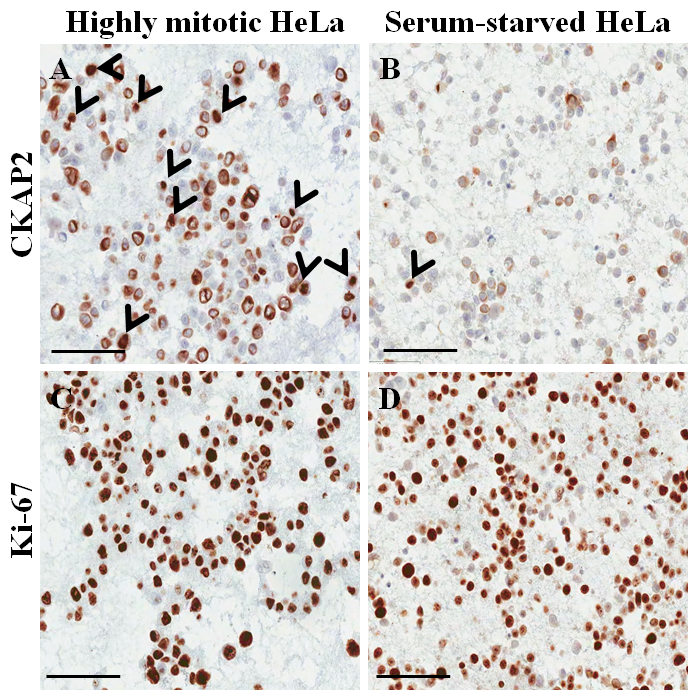
Figura 4: coloración Immunocytochemical en bloque parafina-encajado de la célula de células HeLa. (A) CKAP2 tinción bajo condiciones altamente mitotic. (B) CKAP2 tinción bajo condiciones de escasez de suero. (C) Ki-67 tinción bajo condiciones altamente mitotic. (D) Ki-67 tinción bajo condiciones de escasez de suero. Se muestran barras de escala de 100 μm. Las puntas de flecha indican las células positivas de CKAP2. Haga clic aquí para ver una versión más grande de esta figura.
| Procedimiento | Pasos | Solución | Tiempo/temperatura |
| Deshidratación | 1 | alcohol al 70% | 15 min/RT |
| 2 | 80% de alcohol | 15 min/RT | |
| 3 | alcohol de 95% | 15 min/RT | |
| 4 | 100% alcohol | 15 min/RT | |
| Claro | 1 | Xileno | 60 min/4 ° C |
| 2 | Xileno | 10 min/RT | |
| 3 | Xileno | 10 min/RT | |
| 4 | Xileno | 10 min/RT | |
| * RT, temperatura ambiente |
Tabla 1. Procedimiento de elaboración del tejido.
Discusión
Tinción inmunofluorescente en células cultivadas fijadas es actualmente el método de elección para la determinación del nivel de expresión de la proteína en células conservando información morfológica1. Sin embargo, inmunocitoquímica en bloques de parafina-encajado de la célula puede ser una excelente alternativa. Se han descrito los procedimientos detallados para la preparación de bloques de parafina-encajado de la célula e immunocytochemistry en este protocolo, y esperamos que puede facilitar la aplicación de immunocytochemistry en estudios celulares.
Immunocytochemistry tiene varias ventajas sobre coloración inmunofluorescente. Tinción inmunofluorescente de células generalmente requiere células recién cultivadas, pero bloques de parafina de la célula pueden conservarse a temperatura ambiente durante varios años13. Además, la inmunocitoquímica en bloques de celdas puede explorar patrones de expresión intracelular empleando el mismo anticuerpo usado en rutina inmunohistoquímica en tejidos humanos4. Además, pueden explorar los cambios en los niveles de proteínas o modificaciones del posttranslational por Pre incubar las células con diversos fármacos o bajo diferentes condiciones de cultivo11.
En contraste con las ventajas de la coloración immunocytochemical, la preparación de bloques de parafina-encajado de la célula toma tiempo y es costoso14. Además, laboratorios de investigación de la mayoría carecen de experiencia en esta técnica, y errores técnicos en tales circunstancias son comunes. Los errores más comunes son pobre preservación de la morfología de la célula e immunocytochemical pobre o irregular, la coloración en las secciones de bloque celular de parafina. Estos y muchos otros pueden evitarse haciendo bloques de celdas en las mejores condiciones de la célula y con suficiente solución para formar coágulos de la célula.
Como una manifestación del presente Protocolo, se prepararon bloques de celdas para las células HeLa, y coloración immunocytochemical fue realizada para los dos marcadores de proliferación, CKAP2 y Ki-67, como previamente divulgados11. Para inmunocitoquímica, las células fueron manipuladas por la incubación en medios con y sin suero fetal bovino y se pudo observar el efecto de la inanición de suero. Estos bloques de células de parafina-encajado preparado se pueden emplear para una gran cantidad de anticuerpos, porque muchas diapositivas se pueden preparar de un bloque de celdas usando sólo una sección μm de espesor de la célula-bloque 4-5 por diapositiva. Por lo tanto, los patrones de expresión correspondientes a dos condiciones diferentes pueden evaluarse con varios anticuerpos diferentes. Los patrones de la inmunotinción para CKAP2 y Ki-67 en el cáncer de los tejidos ya han sido reportados9,10,11,12y la immunocytochemical que manchaba resultados puede ser evaluado fácilmente, porque la patrones de tinción fueron bastante similares a las de inmunohistoquímica.
En conclusión, immunocytochemical que manchaba en bloques de parafina de la célula puede ser una excelente alternativa a la tinción inmunofluorescente. por otra parte, puede ser fácil y fiable empleado en la investigación básica de perfiles de expresión en líneas celulares preservando información morfológica.
Divulgaciones
Todos los autores han declarado no hay conflictos de intereses.
Agradecimientos
Este trabajo fue apoyado por becas de investigación a K. M.H. del Nacional Cancer Center, Corea (1510121) y National Research Foundation, Corea (no. NRF-2015R1A2A2A04007432).
Materiales
| Name | Company | Catalog Number | Comments |
| HeLa Cells | ATCC | HeLa (ATCC CCL-2) | |
| Ki-67 Antibody | Thermo Fisher Scientific | RM-9106-S1 | |
| Paraffin | Leica | 39601006 | |
| Xylene | Fisher SCientific | 1330-20-7,100-41-4 | |
| Ethenol | GD Chem | DJ16016 | |
| Hematoxylin | Agilent | 10118581 | |
| DAB Quanto Kit | Thermo Fisher Scientific | TA-125-QHDX, QHCX 170405 | |
| Ultravision LP detection Kit | Thermo Fisher Scientific | PBQ141209, LPB141209, LPH141210 | Kit for immunocytochemistry; contains protein block |
| TintoRetriever Pressure Cooker | Bio SB Corporation | BSB 7008 | |
| Tris-buffered saline | iNtRON Biotechnology | IBS-BT008 | |
| Tween 20 | USB Corporation | 115106 | |
| Thromboplastin | Neoplastin Cl Plus | NC0591432 | |
| Tris-EDTA retrival Buffer | Dignostic Biosystem | E625-A | |
| Trypsin EDTA | Thermo Fisher Scientific | 25200056 | |
| Fetal bovine serum (FBS) | Hyclone Laboratories Inc | SH30910.03 | |
| DMEM | Hyclone Laboratories Inc | SH30243.01 | |
| Antibiotic-Antimycotic, 100X | Thermo Fisher Scientific | 15240062 | |
| Ultra vision peroxide block H2O2 | Thermo Fisher Scientific | 02Q141212 | |
| Mounting Medium | Thermo Fisher Scientific | 363313 | |
| Pap-Pen | Vector Laboratories | H-4000 | |
| Filter Paper | GE Healthcare Life Sciences | 1001-0155 | |
| Calcium Chloride | Sigma-Aldrich | 21115-100ml | |
| Phosphate-buffered saline | PAA Laboratories | H21-002 | |
| Formalin | Daejung | 50-00-0 | |
| 15 ml tube | SPL Life Sciences | 50015 | |
| tissue processing cassette | Simport | M492-5 | |
| 100 mm culture dishes | BD Biosciences | 08-772E | |
| Glass Slide | Muto Pure Chemicals | 140712 | |
| Cover Glass | Marienfeld | 2262817 | |
| Glass Zar | Hyunil Lab-Mate | HIP-1027 | |
| Centrifuge | Eppendorf | 5810R | |
| Class II Laminar Flow Hood | Thermo Fisher Scientific | 1300 series A2 | |
| CO2 Incubator | Thermo Fisher Scientific | Series A2 | |
| Tissue Processor | Leica BioSystem | TP1020 | |
| Microtome | Thermo Fisher Scientific | HM340E | |
| Microscope | Olympus | CX-21 | |
| Paraffin embedding station | Thermo Fisher Scientific | EC 350-1, EC 350-2 | |
| Tissue Section Bath (Round) | CellPath | HCP-JAW-0100-00AEU | |
| Fume Hood | Hanyang Scientific Equipment Co. Ltd. | FH-150 |
Referencias
- Bhattacharyya, D., Hammond, A. T., Glick, B. S. High-quality immunofluorescence of cultured cells. Methods Mol Biol. 619, 403-410 (2010).
- Brown, C. M. Fluorescence microscopy - Avoiding the pit falls. J Cell Sci. 120, 1703-1705 (2007).
- Odell, I. D., Cook, D. Immunofluorescence Techniques. J Invest Dermatol. 133, e4 (2013).
- Kulkarni, M. B., Desai, S. B., Ajit, D., Chinoy, R. F. The utility of the thromboplastin-plasma cell-block technique for fine-needle aspiration and serous effusions. Diagn Cytopathol. 37 (2), 86-90 (2009).
- Shivakumarswamy, U., Arakeri, S. U., Karigowdar, M. H., Yelikar, B. Diagnostic utility of the cell block method versus the conventional smear study in pleural fluid cytology. J Cytol. 29 (1), 11-15 (2012).
- Nathan, N. A., Narayan, E., Smith, M. M., Horn, M. J. Cell block cytology: Improved preparation and its efficacy in diagnostic cytology. Am J Clin Pathol. 114 (4), 599-606 (2000).
- Keyhani-Rofagha, S., Vesey-Shecket, M. Diagnostic value, feasibility, and validity of preparing cell blocks from fluid-based gynecologic cytology specimens. Cancer. 96, 204-209 (2002).
- Young, N. A., Naryshkin, S., Katz, S. M. Diagnostic value of electron microscopy on paraffin-embedded cytologic material. Diagn Cytopathol. 9, 282-290 (1993).
- Jin, Y., Murakumo, Y., Ueno, K., Hashimoto, M., Watanabe, T., Shimoyama, Y., et al. Identification of a mouse cytoskeleton-associated protein, CKAP2, with microtubule-stabilizing properties. Cancer Sci. 95 (10), 815-821 (2004).
- Hong, K. U., Choi, Y. -. B., Lee, J. -. H., Kim, H. -. J., Kwon, H. -. R., Seong, Y. -. S., et al. Transient phosphorylation of tumor associated microtubule associated protein (TMAP)/cytoskeleton associated protein 2 (CKAP2) at Thr-596 during early phases of mitosis. Exp Mole Med. 40, 377-386 (2008).
- Sim, S. H., Bae, C. D., Kwon, Y., Hwang, H. -. L., Poojan, S., Hong, H. -. I., et al. CKAP2 (cytoskeleton-associated protein2) is a new prognostic marker in HER2-negative luminal type breast cancer. PLoS ONE. 12 (8), e0182107 (2017).
- Inwald, E. C., Klinkhammer-Schalke, M., Hofstadter, F., Zeman, F., Koller, M., Gerstenhauer, M., et al. Ki-67 is a prognostic parameter in breast cancer patients: results of a large population-based cohort of a cancer registry. Breast Cancer Res Treat. 139 (2), 539-552 (2013).
- Katikireddy, K. R., O'Sullivan, F. Immunohistochemical and immunofluorescence procedures for protein analysis. Methods Mol Biol. 784, 155-167 (2011).
- Beutner, E. H. Immunofluorescent staining: The fluorescent antibody method. Microbiol Mol Biol Rev. 25 (1), 49-76 (1961).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados