Method Article
Определение уровня выражения протеина в культивируемых клеток Immunocytochemistry на клетки, парафин врезанных блоков
В этой статье
Резюме
В настоящее время immunofluorescent окрашивание на фиксированные клетки является методом выбора для определения уровнях выражения протеина при морфологическом информация также необходима. Этот протокол, представленная в настоящем документе предоставляет альтернативный метод immunocytochemistry на ячейку парафин врезанных блоков.
Аннотация
Immunofluorescent окрашивание в настоящее время методом выбора для определения уровнях выражения протеина в системах культуры клеток при морфологическом информация также необходима. Протокол иммуноцитохимическое окрашивания клеток парафин врезанных блоков, представленных в настоящем документе, является отличной альтернативой immunofluorescent окрашивания на не парафин врезанных фиксированные клетки. В этом протоколе парафин ячейки блока от клеток HeLa был подготовлен с использованием метода тромбопластина плазмы, и immunocytochemistry была выполнена для оценки двух маркеров распространения, CKAP2 и Ki-67. Ядра и цитоплазмы морфологию клеток НеЬа были хорошо сохранились в камере слайды. В то же время окрашивания моделей CKAP2 и Ki-67 в immunocytochemistry были очень похожи на тех, кто в иммуногистохимическое окрашивание в парафин ткани рака. С изменение культуры клеток условия, в том числе предварительной инкубации клеток HeLa сыворотки свободных условиях эффект может быть вычислено при сохранении архитектурных информации. В заключение immunocytochemistry на клетки, парафин врезанных блоков является отличной альтернативой для immunofluorescent окраски.
Введение
В большинстве лабораторий парафин врезанных клеток блоки обычно не используются. Скорее фиксированный культивируемых клеток, не парафин врезанных клетки, заняты в исследования внутриклеточных локализации. Для тех, кто фиксированной культивируемых клеток был использован вместо хромогена флуоресценции. Таким образом immunofluorescent окрашивание в настоящее время является методом выбора для определения уровнях выражения протеина в исследованиях, используя ячейку культуры1. Слайды, подготовленный для immunofluorescent окрашивание, однако, может наблюдаться только под immunofluorescent микроскопии, который может показывать изображения отличаются от тех, которые указаны в плоскости микроскопии2. Кроме того сохранение слайдов для immunofluorescent окраски требует защиты от яркого света, и флуоресцентные сигналы становятся слабее с повторяющегося воздействия для изображений из-за потери флуоресцентного сигнала3. Результаты от immunocytochemistry на клетки, парафин врезанных блоков очень похожи на тех, от иммуногистохимия парафин врезанных тканей4, и они могут быть легко переведены на клинической информации. Таким образом immunocytochemistry может быть отличной альтернативой. Однако подготовка клетки блок не был популярен в основных исследовательских лабораториях. В этом протоколе затем, клетки блок подготовки иммуноцитохимическое окрашивание предоставляются и содействовать использованию этого метода в области исследований культуры клеток.
Подготовка клетки блок и immunocytochemistry не уникальные методы, и они уже применялись от клинической диагностики для фундаментальных исследований4,5. Хотя различные клетки блок подготовки методы были сообщили о4,6 тромбопластина плазменный метод простой, экономически эффективным и легко адаптируемыми. Таким образом в протоколе, представленных в настоящем документе, тромбопластиновое плазменный метод4,5,6,7,8 используется для приготовления клеток парафин врезанных блоков.
В настоящем исследовании были продемонстрированы подробные процедуры для подготовки тромбопластина плазмы клеток блоков и immunocytochemistry метод, используя два распространения маркеров. Один маркер является белок цитоскелета связанные 2 (CKAP2), который недавно сообщалось как митотической маркер9,10,11; другой-Ki-67, который является известным маркер распространения12. Представитель схема показана на рисунке 1.
протокол
Протокол исследования был одобрен институционального обзора Совет Национального онкологического центра, Корея (NCCNCS-12-630).
1. Пробоподготовка (30 мин)
- Для культуры клеток HeLa (ККЛ-2, ЦУВД) используйте полный DMEM среднего 10 мл (плода бычьим сывороточным 10%, 1% перо стрептококк) в 100 мм культуры блюдо. Подготовить сыворотки голод клетки HeLa, Проинкубируйте вырожденная клетки HeLa в среде DMEM без плода бычьим сывороточным 48 часов, как описано в предыдущем исследовании11.
- Чтобы отсоединить клетки, вымыть их с 2 мл фосфат амортизированное saline (PBS) и добавить 2 мл 0,25% ЭДТА трипсина на 100 мм культуры блюдо. Затем проинкубируйте 2-3 мин в инкубатор CO2 при 37 ° C.
- Добавить 5 мл полного среднего DMEM культуры блюдо для деактивации трипсина и передавать отдельные ячейки 15 мл. Затем центрифуга клетки на 300 g x 10 мин сформировать лепешки.
- Удалить супернатант и помыть лепешка дважды с 2 мл холодной PBS центрифугированием при 300 g x 10 мин.
- После удаления супернатанта добавьте 1 mL этанола 95% клеток Пелле и смешивать Пелле ячейки с этанолом, vortexing. Держите фиксированные ячейки на льду до подготовки клетки блок.
2. ячейки блок подготовки (1ч 30 мин)
- Для подготовки свежезамороженной плазмы аликвоты, собирать ЭДТА плазмы крови здоровых доноров и центрифуги на 13 000 x g 10 мин сбор супернатанта плазмы и Алиготе 200-400 мкл в отцентрифугировать трубки. Храните аликвоты-80 ° c до использования. Когда готовы свежезамороженной плазмы аликвоты, извлечь их и размораживать плазмы по инкубации при 37 ° C за 5 мин.
- Центрифуга фиксированные клетки на 700 g x 10 мин, затем удалить супернатант.
- Смешайте Пелле ячейки с 2 капель (около 200 мкл) плазмы, 2 капли тромбопластина и 2 капли кальция хлорида 0,025 М. Затем смешайте их закупорить.
- Разрешить смесь сформировать сгусток клеток при комнатной температуре в течение 10 минут, как показано на рисунке 2А. Затем вымойте сгусток клеток с PBS два раза путем заливки и удаление PBS с пипеткой. Представитель белых клеток сгусток показано на рисунке 2B.
- Смочите кусок фильтровальной бумаги с формалином и обернуть сгусток клеток с предварительно смоченной фильтровальной бумаги. Затем поместите свернувшийся смесь с pincette в ткани кассеты, как показано на рисунке 2 c.
- Место ткани кассету в стеклянной банке, содержащие 50 мл формалина буферизации (10% формалина в PBS) на ночь при 4 ° C для фиксации формалин.
3. ткань обработки и парафин встраивания (ночевка)
- Загрузите кассету ткани, содержащие формалин Исправлена клеток сгусток в процессоре ткани на ночь как описано выше11. Обработка тканей — для удаления воды и кондиционирования фиксированной клеток до внедрения парафина. Для исследования без обработки ткани выполняют ткани, процедуры обработки, как показано в таблице 1.
- Включите подогревом внедрения станции и 60 минут позже, проверьте, что есть расплавленный парафин в кокиль нем (Рисунок 2D).
- Возьмите сгусток форматом ячейки из кассеты ткани и поместите его в расплавленный парафин в кокиль.
- Место новой ткани кассеты без крышки в металлические формы, содержащей ячейку сгусток в середине расплавленный парафин и полить больше расплавленного парафина в кассету ткани и на металлической формы. Затем пусть парафин затвердеть в холодной пластины для 30-60 секунд.
- Отделите ткани кассеты от металлической формы. Затем парафин сотовый блок готов к иммуноцитохимии. Сгусток встраиваемых клеток в блоке парафин врезанных клеток обозначается стрелкой на рисунке 2E.
4. Подготовка слайдов Immunocytochemistry (1 h)
- Проверьте область для сгусток клеток в блоке клеток парафин и нарезать кружочками толщиной 3-4 мкм, используя микротом клеточного блока. Положите парафиновых срезах на слайдах силана покрытием стекла, как показано на рисунке 2F.
- Место в разделе Слайды в 37 ° C духовку на 30 минут, чтобы сделать в разделах придерживаться слайды.
5. Immunocytochemistry клеток блоков (6 ч)
Примечание: Для иммуноцитохимическое окраски на клетки блок секции, различные наборы могут использоваться (см. Таблицу материалы). Все такие комплекты имеют различные чувства и специфику в зависимости от их изменения.
- Инкубируйте разделы в 50 мл ксилол для 4 мин де paraffinize.
- Инкубируйте слайды в 100% этанола для 2 минут для обезвоживания и два раза в 95% этаноле и в 80% этанола на 2 мин. Затем удалите этанола в проточной воде в течение 10 мин.
- Для извлечения антигена место слайды в сосуд содержащий 40 мл трис-ЭДТА извлечения буфер, рН 9,0 и варить в плита за 30 мин.
- Вымойте слайды под проточной водой и инкубировать их в 95% этаноле для 10 мин при 4 ° C. Затем Марк области окрашивания клеток на слайды с ППА ручка для простоты идентификации.
- Вымойте слайды в трис буфер солевой раствор, содержащий 0,2% Tween-20 (TBS-T) и инкубировать в блоке перекиси водорода (см. Таблицу материалов) при комнатной температуре в течение 15 минут удалить любые остатки активность пероксидазы. Затем вымойте слайды в TBS-T три раза за 2 мин.
- Приготовляют раствор разбавленные антитела путем разбавления основное антитело в блоке белка (см. Таблицу материалы). К примеру CKAP2 основное антитело может быть разбавлен масштаба 1: 100 и 1: 500 антитело Ki-67. Затем Инкубируйте слайды в 100 мкл раствора разбавленные антитела для 1 h.
- После стирки в TBS-T пять раз за 2 мин, Инкубируйте слайды в основное антитело усилитель в комплект 15 мин при комнатной температуре в темноте.
- После стирки в TBS-T четыре раза за 2 мин, добавить 2 капли HRP полимера (вторичное антитело обозначено с пероксидазой хрена) и инкубировать слайды при комнатной температуре за 30 мин.
- После стирки в TBS-T пять раз за 2 мин, добавить 100 мкл раствора Диаминобензидин (DAB) (см. Таблицу материалы) и инкубировать слайды для 3 мин.
- После мытья в TBS-T в два раза, 100 мкл раствора гематоксилином (смесь 100 мкл гематоксилином и 600 мкл дистиллированной воды) и инкубировать слайды за 1 мин.
- После мытья слайды в TBS-T, обезвоживает инкубации в 95% этаноле за 2 мин, погружение в 95% этаноле раз и погружения в 100% этанола в два раза. Затем Инкубируйте слайды в ксилоле 40 мл в стеклянной банке за 5 мин.
- Когда слайды сухой от ксилол, смонтируйте соответствующих coverslips.
- Соблюдайте окрашивания моделей с использованием световой микроскопии.
Результаты
В окрашенных гематоксилином и эозином слайд от парафин врезанных ячейку блока (рис. 3аB) большинство из ядра и цитоплазмы клеток нетронутыми, предположить, что морфологические сохранение отлично с текущей (протокол Рис. 3A). В иммуноцитохимическое окрашивание, положительный пятнать CKAP2 было отмечено в конденсированных хроматина, митотическая шпинделя и цитоплазмы (рис. 4), как сообщалось ранее10. Ki-67 окрашивание было отмечено в ядрах клеток, как ожидается (рис. 4). Только клетки с CKAP2 пятнать в конденсированных хроматина (см. стрелки на рисунке 4AB) были митотическая клетки. Многие CKAP2-положительных клеток были показаны в высокой митотической НеЬа клетки, которые были подготовлены после инкубации в полной средней (рис. 4A). В сравнении были несколько CKAP2-положительных клеток в сыворотке голод НеЬа клетки (рис. 4B). Большинство высоко митотическая клеток НеЬа были Ki-67 положительный (рис. 4 c). Контрастно уровень Ki-67-положительных клеток HeLa сыворотки голод по-прежнему достигает ~ 50% (Рисунок 4 d). Эти результаты являются вполне сопоставимы с предыдущего доклада11, которых свидетельствует о том, что CKAP2 является более надежным маркер распространения в раковых клетках чем Ki-67.
В блоках плохо подготовлены клеток ядер отделяются от цитоплазмы, и есть также, resultantly, бедные морфологической сохранения. Больше чем ночь инкубации фиксированных ячеек в холодильнике может вызвать такие плохие результаты. Еще одной важной проблемой является, что клетки являются не запятнана хорошо immunocytochemistry, несмотря на отличные морфологии. Эта проблема чаще всего возникает, когда сгусток клеток мал. Как правило интенсивность окрашивания нерегулярные, как показано на рисунке 3B; но когда сгусток клеток больше, существует гораздо меньше шансов нерегулярных окрашивания. Таким образом в настоящем Протоколе, мы увеличили объемы плазмы, тромбопластиновое и хлорида кальция для образуют сгусток большой ячейки.
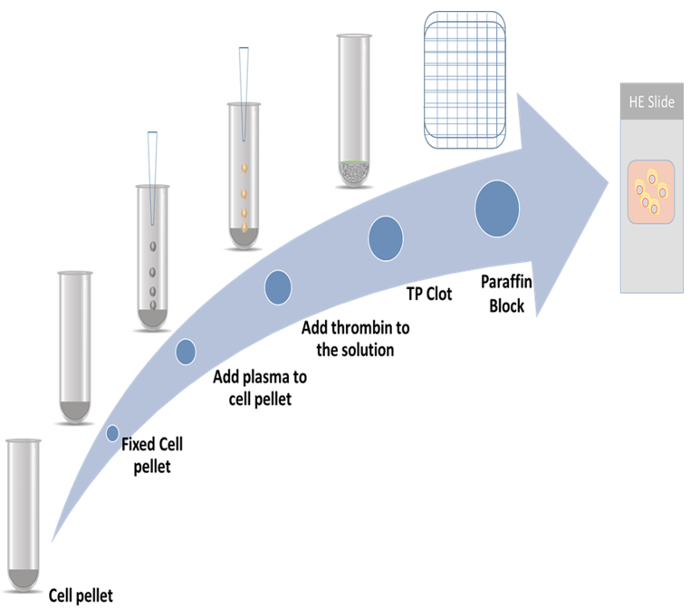
Рисунок 1: схема подготовки клетки блок. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
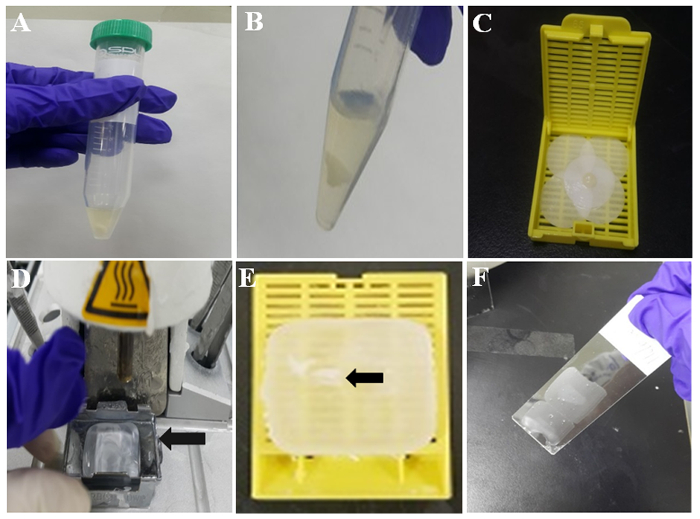
Рисунок 2: Иллюстрация парафина клеток блок подготовки. (A) тромбопластиновое плазмы сгусток клеток в трубку. (B) ТП клеток сгусток после мытья PBS. (C) клеток сгусток на смоченную фильтр-бумаги. (D) ткани встраивание станция с расплавленным воском. Кокиль (стрелка) проводит расплавленный воск для затвердевания. (E) парафин врезанных клеток сгусток (стрелка) встроенный в парафин или парафин врезанных ячейку блока. (F) тонкий парафиновый Секция по средней части слайда с покрытием. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
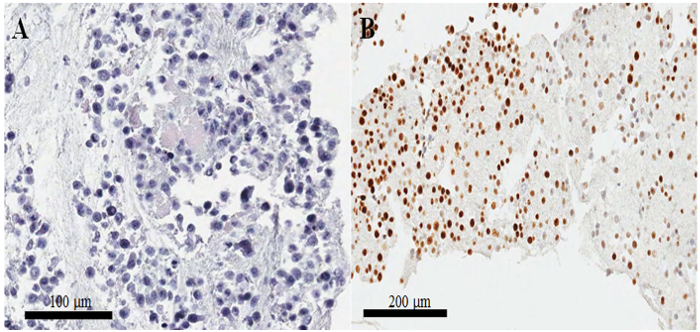
Рисунок 3: подготовка клетки блок и подтверждения качества гематоксилином и эозином и иммуноокрашивания. (A) гематоксилином и эозином витражные изображения клеток HeLa в разделе парафин врезанных клеток блока. (B) нерегулярные пятнать Ki-67 в immunocytochemistry на плохо подготовлен парафин врезанных клеток-блоке. Масштаб гистограммы являются (A) 100 и (B) 200 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
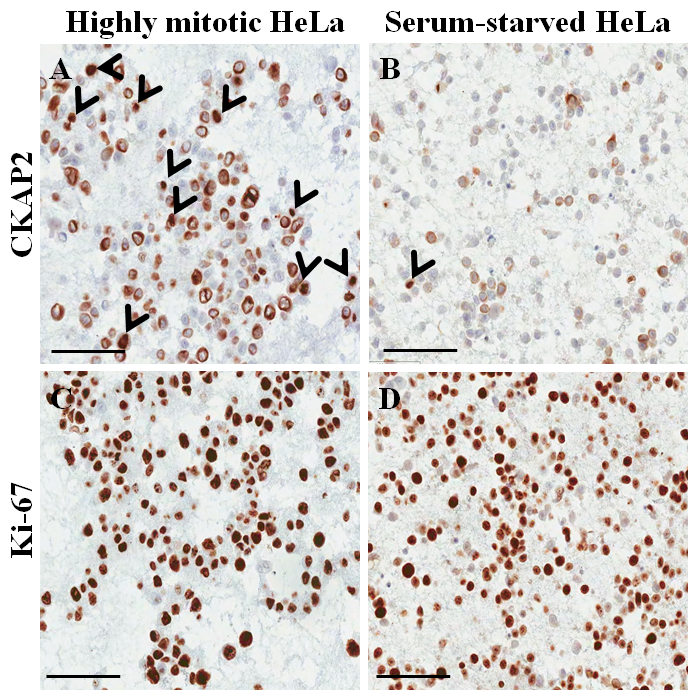
Рисунок 4: иммуноцитохимическое окрашивания на парафин врезанных ячейки блока для клеток HeLa. (A) CKAP2 пятнать высокой митотической условиях. (B) CKAP2 пятнать условиях сыворотки голод. (C) Ki-67 пятнать высокой митотической условиях. (D) Ki-67 пятнать условиях сыворотки голод. Показаны 100 мкм масштаба баров. Стрелки указывают CKAP2-положительных клеток. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Процедура | Шаги | Решение | Время/температура |
| Обезвоживание | 1 | 70% спирта | 15 мин/RT |
| 2 | 80% алкоголя | 15 мин/RT | |
| 3 | 95% спирте | 15 мин/RT | |
| 4 | 100% алкоголя | 15 мин/RT | |
| Очистка | 1 | Ксилол нефтяной | 60 мин/4 ° C |
| 2 | Ксилол нефтяной | 10 мин/RT | |
| 3 | Ксилол нефтяной | 10 мин/RT | |
| 4 | Ксилол нефтяной | 10 мин/RT | |
| * RT, комнатной температуре |
Таблица 1. Процедура обработки ткани.
Обсуждение
Immunofluorescent окрашивания на фиксированные клетки культивировали в настоящее время является методом выбора для определения уровня выражения белка в клетках при сохранении морфологической информации1. Однако immunocytochemistry на клетки, парафин врезанных блоков может быть отличной альтернативой. Подробные процедуры для подготовки клетки парафин врезанных блоков и immunocytochemistry были описаны в настоящем Протоколе, и мы надеемся, что это может облегчить применение immunocytochemistry в ячейке исследований.
Immunocytochemistry имеет ряд преимуществ перед immunofluorescent окрашивание. Immunofluorescent пятная для клеток обычно требует свежих культивируемых клеток, но парафиновые блоки ячеек может храниться при комнатной температуре в течение нескольких лет13. Кроме того immunocytochemistry на ячейку блоки могут исследовать шаблоны внутриклеточных выражений, используя же антитела, используемые в обычных иммуногистохимия на тканях человека4. Кроме того он может исследовать изменения в уровни белка или Посттрансляционная изменений либо по предварительной инкубации клеток с различными препаратами или под различные культуры условия11.
В отличие от преимущества иммуноцитохимическое окрашивание подготовка клетки парафин врезанных блоков занимает время и дорогостоящих14. Кроме того большинство научно-исследовательских лабораторий не хватает опыта в этой технике, и технические ошибки в таких обстоятельствах являются общими. Наиболее распространенные ошибки являются бедные сохранение морфологии клеток и бедных или нерегулярных иммуноцитохимическое окрашивание парафиновых срезах ячейку блока. Эти и многие другие можно избежать, сделав клеток блоков на лучших условиях клетки и используя достаточно решение сформировать ячейку сгустки.
Как проявление настоящего протокола для клеток НеЬа были подготовлены блоки ячеек, и иммуноцитохимическое окрашивание была выполнена для двух маркеров распространения, CKAP2 и Ki-67, как сообщалось ранее11. Для immunocytochemistry клетки были манипулируют инкубации в СМИ с и без плода бычьим сывороточным, и можно наблюдать эффект сыворотки голода. Эти подготовленные ячейки парафин врезанных блоков могут быть использованы для большое количество антител, потому что многие слайды можно приготовить из блока ячейки, используя только 4-5 микрон толщиной клеток-блоке каждого слайда. Таким образом выражение шаблоны, соответствующие два разных условиях может вычисляться с нескольких различных антител. Иммуноокрашивания шаблонов для CKAP2 и Ki-67 в раковых тканей уже сообщили9,10,11,12и иммуноцитохимическое, пятнать результаты можно было бы легко оценить, потому что Окрашивание шаблоны были очень похожи на те, от иммуногистохимия.
В заключение иммуноцитохимическое окрашивание парафиновых блоков ячеек может быть отличной альтернативой immunofluorescent окрашивание; Кроме того она может быть легко и надежно занятых в фундаментальных исследований для выражения профилирования в клеточных линиях при сохранении морфологической информации.
Раскрытие информации
Все авторы объявили отсутствие конфликта интересов.
Благодарности
Эта работа была поддержана исследовательских грантов K.-м.х. Национальный онкологический центр, Кореи (1510121) и Национальный исследовательский фонд, Корея (no. NRF-2015R1A2A2A04007432).
Материалы
| Name | Company | Catalog Number | Comments |
| HeLa Cells | ATCC | HeLa (ATCC CCL-2) | |
| Ki-67 Antibody | Thermo Fisher Scientific | RM-9106-S1 | |
| Paraffin | Leica | 39601006 | |
| Xylene | Fisher SCientific | 1330-20-7,100-41-4 | |
| Ethenol | GD Chem | DJ16016 | |
| Hematoxylin | Agilent | 10118581 | |
| DAB Quanto Kit | Thermo Fisher Scientific | TA-125-QHDX, QHCX 170405 | |
| Ultravision LP detection Kit | Thermo Fisher Scientific | PBQ141209, LPB141209, LPH141210 | Kit for immunocytochemistry; contains protein block |
| TintoRetriever Pressure Cooker | Bio SB Corporation | BSB 7008 | |
| Tris-buffered saline | iNtRON Biotechnology | IBS-BT008 | |
| Tween 20 | USB Corporation | 115106 | |
| Thromboplastin | Neoplastin Cl Plus | NC0591432 | |
| Tris-EDTA retrival Buffer | Dignostic Biosystem | E625-A | |
| Trypsin EDTA | Thermo Fisher Scientific | 25200056 | |
| Fetal bovine serum (FBS) | Hyclone Laboratories Inc | SH30910.03 | |
| DMEM | Hyclone Laboratories Inc | SH30243.01 | |
| Antibiotic-Antimycotic, 100X | Thermo Fisher Scientific | 15240062 | |
| Ultra vision peroxide block H2O2 | Thermo Fisher Scientific | 02Q141212 | |
| Mounting Medium | Thermo Fisher Scientific | 363313 | |
| Pap-Pen | Vector Laboratories | H-4000 | |
| Filter Paper | GE Healthcare Life Sciences | 1001-0155 | |
| Calcium Chloride | Sigma-Aldrich | 21115-100ml | |
| Phosphate-buffered saline | PAA Laboratories | H21-002 | |
| Formalin | Daejung | 50-00-0 | |
| 15 ml tube | SPL Life Sciences | 50015 | |
| tissue processing cassette | Simport | M492-5 | |
| 100 mm culture dishes | BD Biosciences | 08-772E | |
| Glass Slide | Muto Pure Chemicals | 140712 | |
| Cover Glass | Marienfeld | 2262817 | |
| Glass Zar | Hyunil Lab-Mate | HIP-1027 | |
| Centrifuge | Eppendorf | 5810R | |
| Class II Laminar Flow Hood | Thermo Fisher Scientific | 1300 series A2 | |
| CO2 Incubator | Thermo Fisher Scientific | Series A2 | |
| Tissue Processor | Leica BioSystem | TP1020 | |
| Microtome | Thermo Fisher Scientific | HM340E | |
| Microscope | Olympus | CX-21 | |
| Paraffin embedding station | Thermo Fisher Scientific | EC 350-1, EC 350-2 | |
| Tissue Section Bath (Round) | CellPath | HCP-JAW-0100-00AEU | |
| Fume Hood | Hanyang Scientific Equipment Co. Ltd. | FH-150 |
Ссылки
- Bhattacharyya, D., Hammond, A. T., Glick, B. S. High-quality immunofluorescence of cultured cells. Methods Mol Biol. 619, 403-410 (2010).
- Brown, C. M. Fluorescence microscopy - Avoiding the pit falls. J Cell Sci. 120, 1703-1705 (2007).
- Odell, I. D., Cook, D. Immunofluorescence Techniques. J Invest Dermatol. 133, e4 (2013).
- Kulkarni, M. B., Desai, S. B., Ajit, D., Chinoy, R. F. The utility of the thromboplastin-plasma cell-block technique for fine-needle aspiration and serous effusions. Diagn Cytopathol. 37 (2), 86-90 (2009).
- Shivakumarswamy, U., Arakeri, S. U., Karigowdar, M. H., Yelikar, B. Diagnostic utility of the cell block method versus the conventional smear study in pleural fluid cytology. J Cytol. 29 (1), 11-15 (2012).
- Nathan, N. A., Narayan, E., Smith, M. M., Horn, M. J. Cell block cytology: Improved preparation and its efficacy in diagnostic cytology. Am J Clin Pathol. 114 (4), 599-606 (2000).
- Keyhani-Rofagha, S., Vesey-Shecket, M. Diagnostic value, feasibility, and validity of preparing cell blocks from fluid-based gynecologic cytology specimens. Cancer. 96, 204-209 (2002).
- Young, N. A., Naryshkin, S., Katz, S. M. Diagnostic value of electron microscopy on paraffin-embedded cytologic material. Diagn Cytopathol. 9, 282-290 (1993).
- Jin, Y., Murakumo, Y., Ueno, K., Hashimoto, M., Watanabe, T., Shimoyama, Y., et al. Identification of a mouse cytoskeleton-associated protein, CKAP2, with microtubule-stabilizing properties. Cancer Sci. 95 (10), 815-821 (2004).
- Hong, K. U., Choi, Y. -. B., Lee, J. -. H., Kim, H. -. J., Kwon, H. -. R., Seong, Y. -. S., et al. Transient phosphorylation of tumor associated microtubule associated protein (TMAP)/cytoskeleton associated protein 2 (CKAP2) at Thr-596 during early phases of mitosis. Exp Mole Med. 40, 377-386 (2008).
- Sim, S. H., Bae, C. D., Kwon, Y., Hwang, H. -. L., Poojan, S., Hong, H. -. I., et al. CKAP2 (cytoskeleton-associated protein2) is a new prognostic marker in HER2-negative luminal type breast cancer. PLoS ONE. 12 (8), e0182107 (2017).
- Inwald, E. C., Klinkhammer-Schalke, M., Hofstadter, F., Zeman, F., Koller, M., Gerstenhauer, M., et al. Ki-67 is a prognostic parameter in breast cancer patients: results of a large population-based cohort of a cancer registry. Breast Cancer Res Treat. 139 (2), 539-552 (2013).
- Katikireddy, K. R., O'Sullivan, F. Immunohistochemical and immunofluorescence procedures for protein analysis. Methods Mol Biol. 784, 155-167 (2011).
- Beutner, E. H. Immunofluorescent staining: The fluorescent antibody method. Microbiol Mol Biol Rev. 25 (1), 49-76 (1961).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены