Method Article
Determinação do nível de expressão da proteína em pilhas cultivadas por imunocitoquímica em blocos de parafina
Neste Artigo
Resumo
Atualmente, coloração imunofluorescente sobre células fixas é o método de escolha para determinação dos níveis de expressão de proteínas quando informações morfológicas também são necessárias. Este protocolo apresentado neste documento prevê-se um método alternativo de imunocitoquímica em blocos de parafina.
Resumo
Coloração imunofluorescente é atualmente o método de escolha para determinação dos níveis de expressão de proteínas em sistemas de cultura de células quando informações morfológicas também são necessárias. O protocolo de immunocytochemical em blocos de parafina de célula, apresentados neste documento, a coloração é uma excelente alternativa para coloração imunofluorescente sobre células fixas não-parafina. Neste protocolo, um bloco de parafina de células HeLa foi preparado usando o método de tromboplastina-plasma e imunocitoquímica foi realizada para a avaliação dos dois marcadores de proliferação, CKAP2 e Ki-67. Os núcleos e morfologia citoplasmática das células HeLa foram bem preservadas em slides o bloco de celas. Ao mesmo tempo, os padrões de coloração CKAP2 e Ki-67 na imunocitoquímica foram bastante semelhantes às de imuno-histoquímica de coloração em tecidos de câncer de parafina. Com condições de cultura de células modificadas, incluindo pré-incubação de células HeLa sob condições isento de soro, o efeito pode ser avaliado, preservando informações arquitetônicas. Em conclusão, imunocitoquímica em blocos de parafina é uma excelente alternativa à mancha de imunofluorescência.
Introdução
Na maioria dos laboratórios, blocos de parafina não são comumente usados. Em vez disso, fixo de culturas de células, células não parafina, são empregadas em estudos de Localização subcellular. Para aqueles fixo pilhas cultivadas, fluorescência em vez de cromogénio tem sido utilizada. Portanto, a coloração imunofluorescente atualmente é o método de escolha para determinação dos níveis de expressão de proteínas em pesquisa empregando culturas de pilha1. Lâminas preparadas para coloração imunofluorescente, no entanto, podem ser observadas sob microscopia de imunofluorescência, que pode mostrar imagens muito diferentes daqueles indicados sob microscopia de avião2. Além disso, preservação de slides para coloração imunofluorescente exige proteção de luz brilhante, e sinais fluorescentes tornam-se mais fracos com exposição repetida para a imagem latente devido à perda do sinal fluorescente3. Resultados de imunocitoquímica em blocos de parafina são bastante semelhantes aos de imuno-histoquímica em tecidos de parafina4, e eles podem facilmente ser traduzidos em informação clínica. Portanto, imunocitoquímica pode ser uma excelente alternativa. No entanto, preparação do bloco de celas não foi popular em laboratórios de pesquisa básica. Neste protocolo, em seguida, bloco preparação e coloração de immunocytochemical são fornecidos para promover o uso desse método no campo de estudos de cultura de células.
Imunocitoquímica e preparação do bloco de celas não são métodos exclusivos, e eles já foram aplicados de diagnóstico clínico para pesquisa básica4,5. Embora a preparação de celas vários métodos têm sido relatados4,6 -plasma tromboplastina método é simples, rentável e facilmente adaptável. Portanto, o protocolo apresentado neste trabalho, o plasma tromboplastina método4,5,6,7,8 é usado para a preparação dos blocos de parafina.
No presente estudo, foram demonstrados os procedimentos detalhados para a preparação dos blocos de tromboplastina-plasma e o método de imunocitoquímica, empregando dois marcadores de proliferação. Um marcador é proteína associada citoesqueleto 2 (CKAP2), que recentemente tem sido relatada como um marcador mitótica9,10,11; o outro é Ki-67, que é o mais conhecido de marcador de proliferação12. O regime representativo é mostrado na Figura 1.
Protocolo
O protocolo de estudo foi aprovado pela institucional Review Board do National Cancer Center, Coreia (NCCNCS-12-630).
1. amostra preparação (30 min)
- Para a cultura de células HeLa (CCL-2, ATCC), use meio DMEM completo 10 mL (10% de soro fetal bovino, 1% caneta-estreptococo) em uma placa de cultura de 100 mm. Para preparar o soro de fome as células HeLa, incube HeLa confluentes em DMEM sem soro fetal bovino por 48 horas, conforme descrito em um anterior de estudo11.
- Para desprender as células, lave-os com 2 mL fosfato salino (PBS) e adicione a tripsina de EDTA de 0,25% de 2 mL por placa de cultura de 100 mm. Em seguida, incubar durante 2-3 min numa incubadora de CO2 a 37 ° C.
- Adicionar 5 mL de meio DMEM completo para o prato de cultura para desactivar a tripsina e transfira as células destacadas para um tubo de 15 mL. Em seguida, Centrifugar as células a 300 x g durante 10 minutos formar um pellet.
- Remover o sobrenadante e lavar o sedimento duas vezes com PBS frio 2 mL por centrifugação a 300 x g durante 10 minutos.
- Após a remoção do líquido sobrenadante, adicionar 1 mL de etanol a 95% para o centrifugado e misture o centrifugado com etanol vortexing. Manter as células fixas no gelo até a preparação do bloco de celas.
2. bloco de celas-preparação (1 h 30 min)
- Para a preparação de plasma congelado alíquotas, coleta de plasma EDTA de sangue de doadores saudáveis centrifugar 13.000 x g por 10 min. coletar o plasma sobrenadante e tubos de alíquota 200-400 µ l cada em microcentrífuga. Armazene as alíquotas a-80 ° C até o uso. Quando as alíquotas de plasma congelado estão prontas, recuperá-los e descongelar o plasma por incubação a 37 ° C por 5 min.
- Centrifugar as células fixas em 700 x g durante 10 minutos e, em seguida, descartar o sobrenadante.
- Misture o centrifugado com 2 gotas (cerca de 200 µ l) do plasma, 2 gotas de tromboplastina e 2 gotas de cloreto de cálcio 0,025 M. Em seguida, misturá-los por pipetagem.
- Deixe a mistura formar um coágulo de célula em temperatura ambiente por 10 min, conforme mostrado na Figura 2A. Em seguida, lave o coágulo de célula com PBS duas vezes derramando e removendo PBS com uma pipeta. O coágulo representativas de células brancas é mostrado na Figura 2B.
- Umedeça um pedaço de papel de filtro com formalina e enrole o coágulo de célula com o papel de filtro úmido. Em seguida, coloque a mistura coagulada com um pincette em uma fita de tecido, como mostrado na Figura 2.
- Lugar a fita de tecido em um frasco de vidro contendo 50 mL de formalina tamponada (formol a 10% em PBS) durante a noite a 4 ° C para a fixação de formol.
3. tecido processamento e incorporação de parafina (Overnight)
- Carregar a fita de tecido que contém o coágulo célula fixada em formol em um processador de tecido durante a noite, conforme descrito anteriormente,11. O processamento do tecido é para remoção de água e condicionamento de células fixas à incorporação de parafina. Para pesquisa sem processamento de tecido, execute o tecido procedimento de processamento, como mostrado na tabela 1.
- Ative a verificação estação e 60 minutos depois, incorporação aquecida é parafina derretida no molde metal nele (Figura 2D).
- Retirar o coágulo formado célula a fita de tecido e coloque-o na parafina derretida dentro do molde de metal.
- Lugar a nova fita de tecido sem a tampa para o molde de metal que contém a célula coagular no meio a parafina derretida e despeje mais parafina derretida dentro do estojo de tecido e o molde de metal. Então, deixe a parafina solidificar na placa fria por 30-60 segundos.
- Separe o molde de metal, a fita de tecido. Em seguida, o bloco de parafina está pronto para imunocitoquímica. O coágulo celular incorporado no bloco de celas de parafina é indicado pela seta na Figura 2E.
4. preparação de Slides para imunocitoquímica (1 h)
- Verificar a área para o coágulo de célula no bloco de celas de parafina e corte o bloco de celas em fatias com espessuras de 3-4 µm usando um micrótomo. Colocar as secções de parafina em lâminas de vidro revestido-silano, como mostrado na Figura 2F.
- Coloque as lâminas de seção em um forno de 37 ° C por 30 min fazer as seções aderir para os slides.
5. imunocitoquímica de celas (6 h)
Nota: Para immunocytochemical manchas nas seções do bloco de celas, vários kits podem ser usados (ver Tabela de materiais). Todos esses kits tem várias sensibilidades e especificidades dependendo de suas modificações.
- Incube as seções em 50 mL de xileno para 4 min para eliminação paraffinize.
- Incube em etanol 100% por 2 min para a desidratação e duas vezes em etanol a 95% e em 80% de etanol por 2 min. Em seguida, remova o etanol em água corrente por 10 min.
- Para recuperação do antígeno, coloque os slides em um frasco contendo 40 mL Tris-EDTA recuperação buffer, pH 9.0 e ferver em uma panela por 30 min.
- Lavar as lâminas em água corrente e incube-os em etanol a 95% durante 10 minutos a 4 ° C. Em seguida, marque a área de Coloracao Celular sobre os slides com uma caneta de Pap para fácil identificação.
- Lavar as lâminas em solução salina tampão Tris contendo 0,2% Tween 20 (TBS-T) e incube no bloco de peróxido de hidrogênio (ver Tabela de materiais) à temperatura ambiente por 15 min remover qualquer atividade de peroxidase remanescente. Em seguida, lave os slides na TBS-T 3 vezes por 2 min cada.
- Preparar a solução diluída de anticorpo diluindo o anticorpo primário no bloco de proteína (ver Tabela de materiais). Por exemplo, o CKAP2 anticorpo primário pode ser diluído 1: 100 e a 1: 500 do anticorpo de Ki-67. Em seguida, a incubar em 100 µ l de solução diluída de anticorpo por 1h.
- Após a lavagem TBS-t cinco vezes por 2 min cada, a incubar no realçador de anticorpo primário no kit para 15 min à temperatura ambiente no escuro.
- Após a lavagem TBS-t, quatro vezes por 2 min cada, adicione 2 gotas de polímero HRP (um anticorpo secundário marcado com peroxidase de rábano silvestre) e a incubar à temperatura ambiente por 30 min.
- Após a lavagem TBS-t cinco vezes por 2 min cada, adicionar 100 µ l de solução de diaminobenzidina (DAB) (ver Tabela de materiais) e a incubar por 3 min.
- Após a lavagem TBS-t duas vezes, adicionar 100 µ l de solução de hematoxilina (a mistura de 100 µ l de hematoxilina e 600 µ l de água destilada) e a incubar durante 1 min.
- Depois de lavar as lâminas em TBS-T uma vez, desidrata-se por incubando em etanol a 95% por 2 min, mergulhando em etanol a 95%, uma vez e mergulhando em etanol 100% duas vezes. Em seguida, a incubar em xilol 40 mL num frasco de vidro por 5 min.
- Quando os slides estiverem secos de xileno, monte as respectivas lamelas.
- Observe os padrões de coloração usando microscopia de luz.
Resultados
Em um slide manchado de hematoxilina e eosina do bloco de celas de parafina (Figura 3AB), a maioria dos núcleos e citoplasma das células estão intactas, sugerindo que a preservação morfológica é excelente com o atual protocolo ( Figura 3A). Na immunocytochemical de coloração, coloração positiva de CKAP2 foi observada em fuso mitótico, cromatina condensada e citoplasma (Figura 4), como relatado anteriormente10. Coloração de Ki-67 foi observado no núcleo celular, como esperado (Figura 4). Apenas as células com CKAP2 coloração na cromatina condensada (veja as setas na Figura 4AB) eram células mitóticas. Muitas células de CKAP2-positivos foram mostradas nas células HeLa altamente mitóticas que tinham sido preparadas após uma incubação em meio completo (Figura 4A). Em comparação, havia poucas células de CKAP2 positivo nas soro de fome as células HeLa (Figura 4B). A maioria das células HeLa altamente mitóticas foram Ki-67 positivo (Figura 4). Por outro lado, estima, a taxa de Ki-67-positivo nas células HeLa faminta de soro permaneceu tão alta quanto ~ 50% (Figura 4). Estes resultados são bastante comparáveis de um anterior relatório11, que sugere que o CKAP2 é um marcador proliferação mais confiável em células cancerosas do que é o Ki-67.
Em celas mal preparada, os núcleos estão separados do citoplasma, e há também, resultantly, pobre preservação morfológica. Mais-do que-durante a noite incubação das células fixas no frigorífico pode causar resultados tão pobres. Outro problema importante é que as células não estão manchadas bem por imunocitoquímica, não obstante a excelente morfologia. Este problema surge mais frequentemente quando o coágulo de célula é pequeno. Normalmente, a intensidade da coloração é irregular, como mostrado na Figura 3B; Mas quando o coágulo da célula é maior, há muito menos chance de manchas irregulares. Portanto, neste protocolo, aumentamos os volumes de plasma tromboplastina e cloreto de cálcio a fim de formar um coágulo de grandes células.
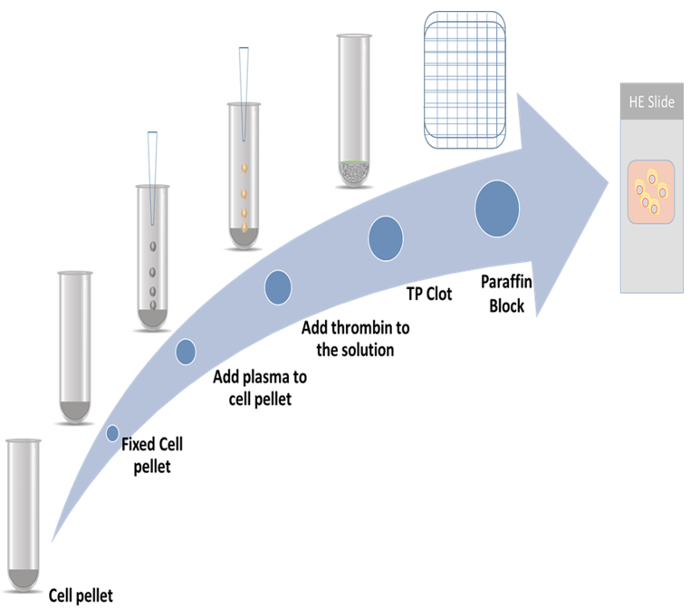
Figura 1: esquema de preparação do bloco de celas. Clique aqui para ver uma versão maior desta figura.
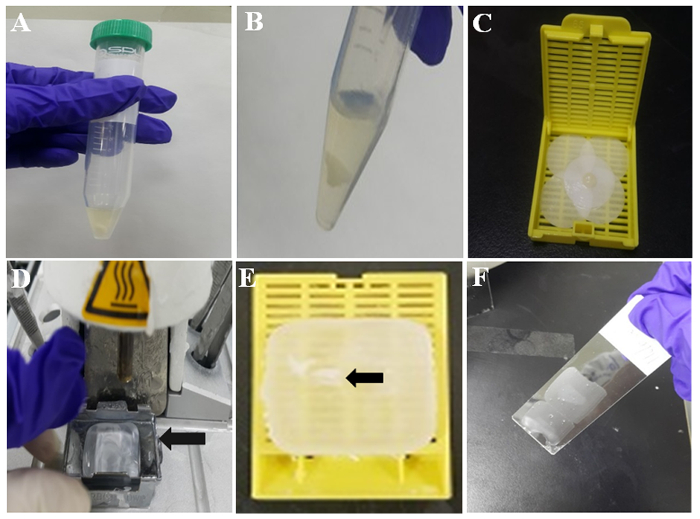
Figura 2: ilustração da preparação de célula-bloco de parafina. (A) coágulo de célula tromboplastina-plasma em tubo. (B) coágulo TP célula após a lavagem PBS. Coágulo (C) célula no papel de filtro umedecido. (D) incorporação de tecido estação com cera derretida. Molde de metal (seta) detém a cera derretida para solidificação. (E) coágulo de célula parafina (seta) incorporado em parafina ou bloco de parafina. (F) seção de parafina na parte central de um slide revestido. Clique aqui para ver uma versão maior desta figura.
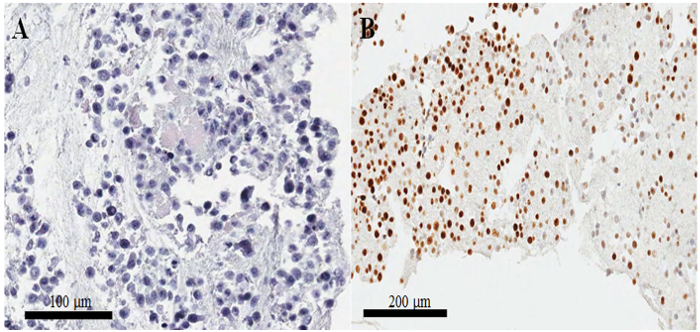
Figura 3: preparação do bloco de celas e confirmação de qualidade pela hematoxilina e eosina e imunocoloração. (A) hematoxilina-e-eosina-manchado a imagem de células HeLa em uma seção de parafina-bloco das celas. (B) irregular mancha de Ki-67 em imunocitoquímica em um mal preparado seção de parafina-bloco das celas. Barras de escala são (A) 100 e (B) 200 μm. Clique aqui para ver uma versão maior desta figura.
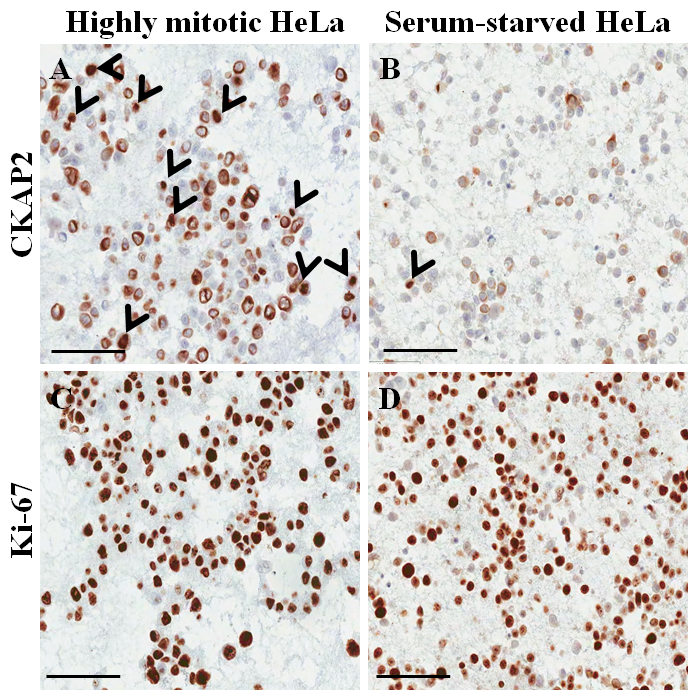
Figura 4: Immunocytochemical coloração em bloco de parafina de célula para as células HeLa. (A) CKAP2 coloração sob condições altamente mitóticas. (B) CKAP2 coloração sob condições soro de fome. (C) coloração sob condições altamente mitóticas Ki-67. (D) Ki-67 coloração sob condições soro de fome. 100 μm escala barras são mostradas. As setas indicam as células CKAP2-positivo. Clique aqui para ver uma versão maior desta figura.
| Procedimento | Passos | Solução | Tempo/temperatura |
| Desidratação | 1 | álcool a 70% | 15 min/RT |
| 2 | 80% de álcool | 15 min/RT | |
| 3 | 95% de álcool | 15 min/RT | |
| 4 | 100% de álcool | 15 min/RT | |
| Clareira | 1 | Xileno | 4 ° C/60 min |
| 2 | Xileno | 10 min/RT | |
| 3 | Xileno | 10 min/RT | |
| 4 | Xileno | 10 min/RT | |
| * RT, temperatura ambiente |
Tabela 1. Procedimento de processamento do tecido.
Discussão
Coloração imunofluorescente em pilhas cultivadas fixas é atualmente o método de escolha para determinação do nível de expressão de proteínas nas células, preservando informações morfológicas1. No entanto, imunocitoquímica em blocos de parafina pode ser uma excelente alternativa. Os procedimentos detalhados para a preparação dos blocos de parafina e imunocitoquímica foram descritos no presente protocolo, e esperamos que isso pode facilitar a aplicação da imunocitoquímica em estudos de célula.
Imunocitoquímica tem várias vantagens sobre a coloração de imunofluorescência. Imunofluorescência, coloração para células geralmente requer pilhas cultivadas na hora, mas blocos de parafina podem ser mantidos em temperatura ambiente por vários anos13. Além disso, imunocitoquímica em celas pode explorar padrões de expressão intracelular, empregando o mesmo anticorpo utilizado na rotina imuno-histoquímica em tecidos humanos4. Além disso, ele pode explorar as mudanças nos níveis de proteína ou modificações posttranslational através de pré-incubação de células com várias drogas ou sob diferentes condições de cultura11.
Em contraste com as vantagens da coloração de immunocytochemical, a preparação dos blocos de parafina célula leva tempo e é onerosa14. Além disso, a maioria dos laboratórios de pesquisa faltam experiência nesta técnica, e erros técnicos sob tais circunstâncias são comuns. Os erros mais comuns são pobre preservação da morfologia celular e immunocytochemical pobre ou irregular, coloração sobre as seções de bloco de pilha de parafina. Estes e muitos outros podem ser evitados por fazer celas sob as melhores condições de célula e usando a solução suficiente para formar coágulos de célula.
Como uma demonstração do presente protocolo, celas estavam preparadas para as células HeLa, e coloração de immunocytochemical foi realizada por dois marcadores de proliferação, CKAP2 e Ki-67, como relatado anteriormente11. Por imunocitoquímica, as células foram manipuladas pela incubação em meios com e sem soro fetal bovino, e o efeito de fome de soro pode ser observado. Esses blocos de cela preparada de parafina podem ser empregados para um grande número de anticorpos, porque muitos slides podem ser preparados de um bloco de celas, usando apenas uma seção 4-5 µm de espessura-bloco das celas por slide. Portanto, correspondente a duas condições diferentes de padrões de expressão podem ser avaliados com vários anticorpos diferentes. A imunocoloração padrões para CKAP2 e Ki-67 em câncer de tecidos já foram relatados9,10,11,12, e o immunocytochemical resultados de coloração pode ser facilmente avaliada, porque a padrões de coloração foram bastante semelhantes de imuno-histoquímica.
Em conclusão, immunocytochemical coloração em blocos de parafina pode ser uma excelente alternativa para coloração imunofluorescente; Além disso, pode ser fácil e confiável empregado em pesquisa básica para expressão de criação de perfil em linhas celulares preservando informações morfológicas.
Divulgações
Todos os autores declararam que não há conflitos de interesse.
Agradecimentos
Este trabalho foi apoiado por bolsas de investigação para K.-MH do National Cancer Center, Coreia (1510121) e Fundação de pesquisa nacional, Coreia (n. NRF-2015R1A2A2A04007432).
Materiais
| Name | Company | Catalog Number | Comments |
| HeLa Cells | ATCC | HeLa (ATCC CCL-2) | |
| Ki-67 Antibody | Thermo Fisher Scientific | RM-9106-S1 | |
| Paraffin | Leica | 39601006 | |
| Xylene | Fisher SCientific | 1330-20-7,100-41-4 | |
| Ethenol | GD Chem | DJ16016 | |
| Hematoxylin | Agilent | 10118581 | |
| DAB Quanto Kit | Thermo Fisher Scientific | TA-125-QHDX, QHCX 170405 | |
| Ultravision LP detection Kit | Thermo Fisher Scientific | PBQ141209, LPB141209, LPH141210 | Kit for immunocytochemistry; contains protein block |
| TintoRetriever Pressure Cooker | Bio SB Corporation | BSB 7008 | |
| Tris-buffered saline | iNtRON Biotechnology | IBS-BT008 | |
| Tween 20 | USB Corporation | 115106 | |
| Thromboplastin | Neoplastin Cl Plus | NC0591432 | |
| Tris-EDTA retrival Buffer | Dignostic Biosystem | E625-A | |
| Trypsin EDTA | Thermo Fisher Scientific | 25200056 | |
| Fetal bovine serum (FBS) | Hyclone Laboratories Inc | SH30910.03 | |
| DMEM | Hyclone Laboratories Inc | SH30243.01 | |
| Antibiotic-Antimycotic, 100X | Thermo Fisher Scientific | 15240062 | |
| Ultra vision peroxide block H2O2 | Thermo Fisher Scientific | 02Q141212 | |
| Mounting Medium | Thermo Fisher Scientific | 363313 | |
| Pap-Pen | Vector Laboratories | H-4000 | |
| Filter Paper | GE Healthcare Life Sciences | 1001-0155 | |
| Calcium Chloride | Sigma-Aldrich | 21115-100ml | |
| Phosphate-buffered saline | PAA Laboratories | H21-002 | |
| Formalin | Daejung | 50-00-0 | |
| 15 ml tube | SPL Life Sciences | 50015 | |
| tissue processing cassette | Simport | M492-5 | |
| 100 mm culture dishes | BD Biosciences | 08-772E | |
| Glass Slide | Muto Pure Chemicals | 140712 | |
| Cover Glass | Marienfeld | 2262817 | |
| Glass Zar | Hyunil Lab-Mate | HIP-1027 | |
| Centrifuge | Eppendorf | 5810R | |
| Class II Laminar Flow Hood | Thermo Fisher Scientific | 1300 series A2 | |
| CO2 Incubator | Thermo Fisher Scientific | Series A2 | |
| Tissue Processor | Leica BioSystem | TP1020 | |
| Microtome | Thermo Fisher Scientific | HM340E | |
| Microscope | Olympus | CX-21 | |
| Paraffin embedding station | Thermo Fisher Scientific | EC 350-1, EC 350-2 | |
| Tissue Section Bath (Round) | CellPath | HCP-JAW-0100-00AEU | |
| Fume Hood | Hanyang Scientific Equipment Co. Ltd. | FH-150 |
Referências
- Bhattacharyya, D., Hammond, A. T., Glick, B. S. High-quality immunofluorescence of cultured cells. Methods Mol Biol. 619, 403-410 (2010).
- Brown, C. M. Fluorescence microscopy - Avoiding the pit falls. J Cell Sci. 120, 1703-1705 (2007).
- Odell, I. D., Cook, D. Immunofluorescence Techniques. J Invest Dermatol. 133, e4 (2013).
- Kulkarni, M. B., Desai, S. B., Ajit, D., Chinoy, R. F. The utility of the thromboplastin-plasma cell-block technique for fine-needle aspiration and serous effusions. Diagn Cytopathol. 37 (2), 86-90 (2009).
- Shivakumarswamy, U., Arakeri, S. U., Karigowdar, M. H., Yelikar, B. Diagnostic utility of the cell block method versus the conventional smear study in pleural fluid cytology. J Cytol. 29 (1), 11-15 (2012).
- Nathan, N. A., Narayan, E., Smith, M. M., Horn, M. J. Cell block cytology: Improved preparation and its efficacy in diagnostic cytology. Am J Clin Pathol. 114 (4), 599-606 (2000).
- Keyhani-Rofagha, S., Vesey-Shecket, M. Diagnostic value, feasibility, and validity of preparing cell blocks from fluid-based gynecologic cytology specimens. Cancer. 96, 204-209 (2002).
- Young, N. A., Naryshkin, S., Katz, S. M. Diagnostic value of electron microscopy on paraffin-embedded cytologic material. Diagn Cytopathol. 9, 282-290 (1993).
- Jin, Y., Murakumo, Y., Ueno, K., Hashimoto, M., Watanabe, T., Shimoyama, Y., et al. Identification of a mouse cytoskeleton-associated protein, CKAP2, with microtubule-stabilizing properties. Cancer Sci. 95 (10), 815-821 (2004).
- Hong, K. U., Choi, Y. -. B., Lee, J. -. H., Kim, H. -. J., Kwon, H. -. R., Seong, Y. -. S., et al. Transient phosphorylation of tumor associated microtubule associated protein (TMAP)/cytoskeleton associated protein 2 (CKAP2) at Thr-596 during early phases of mitosis. Exp Mole Med. 40, 377-386 (2008).
- Sim, S. H., Bae, C. D., Kwon, Y., Hwang, H. -. L., Poojan, S., Hong, H. -. I., et al. CKAP2 (cytoskeleton-associated protein2) is a new prognostic marker in HER2-negative luminal type breast cancer. PLoS ONE. 12 (8), e0182107 (2017).
- Inwald, E. C., Klinkhammer-Schalke, M., Hofstadter, F., Zeman, F., Koller, M., Gerstenhauer, M., et al. Ki-67 is a prognostic parameter in breast cancer patients: results of a large population-based cohort of a cancer registry. Breast Cancer Res Treat. 139 (2), 539-552 (2013).
- Katikireddy, K. R., O'Sullivan, F. Immunohistochemical and immunofluorescence procedures for protein analysis. Methods Mol Biol. 784, 155-167 (2011).
- Beutner, E. H. Immunofluorescent staining: The fluorescent antibody method. Microbiol Mol Biol Rev. 25 (1), 49-76 (1961).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados