Method Article
الخلايا الاساسيه الثقافة المنقية جابايرجيك أو الخلايا العصبية جلوتاميجيك أنشئت من خلال الفرز الخلية المنشطة الفلورية
In This Article
Summary
يصف هذا البروتوكول طريقه فرز الخلايا القائمة علي تنقيه وثقافة الخلايا العصبية الفلورية جابايرجيك أو جلوتاميرجيك من نيوكورتكس والحصين من الفئران بعد الولادة أو الفئران.
Abstract
الهدف العام لهذا البروتوكول هو توليد الثقافات العصبية المنقية المستمدة من الخلايا العصبية جابايرجيك أو جلوتاموجيك. يمكن ان تكون مثقف الخلايا العصبية المنقية في وسائل الاعلام المحددة لمده 16 يوما في المختبر وقابله لأي تحليلات تجري عاده علي الثقافات المنفصلة ، بما في ذلك التحاليل الفسيولوجية والمورفولوجية والبقاء علي قيد الحياة. والميزة الرئيسية لهذه الثقافات هي ان أنواعا معينه من الخلايا يمكن دراستها بشكل انتقائي في غياب التاثيرات الخارجية المعقدة ، مثل تلك الناشئة عن الخلايا الدبقيه أو أنواع عصبيه أخرى. عند التخطيط للتجارب مع الخلايا المنقية ، ومع ذلك ، من المهم ان نلاحظ ان الخلايا العصبية تعتمد بقوة علي وسائل الاعلام المكيفة لنموها والبقاء علي قيد الحياة. الاضافه إلى ذلك ، تعتمد الخلايا العصبية الجلوتاماليه علي العوامل التي تفرزها الخلايا غير المشبعة لإنشاء ناقل الحركة المتشابك. ولذلك ، فاننا نقوم أيضا بوصف طريقه لمشاركه الخلايا العصبية والكريات الداليه في ترتيب عدم الاتصال. باستخدام هذه الطرق ، وقد حددنا الاختلافات الرئيسية بين تطوير الشبكات العصبية جابايرجيك والخلايا الجلوتاموجيك. التالي ، دراسة ثقافات الخلايا العصبية المنقية لديها إمكانات كبيره لتعزيز فهمنا لكيفيه تطور الجهاز العصبي ووظائفه. وعلاوة علي ذلك ، قد تكون الثقافات المنقية مفيده للتحقيق في العمل المباشر للعوامل الدوائية ، وعوامل النمو أو لاستكشاف عواقب التلاعب الجيني علي أنواع معينه من الخلايا. بما ان المزيد والمزيد من الكائنات المحورة وراثيا تصبح متاحه ، ووصف أنواع اضافيه من الخلايا المحددة من الفائدة ، ونحن نتوقع ان البروتوكولات الموصوفة هنا سوف تنمو في تطبيقها وإمكاناتها.
Introduction
فرز الخلايا هو أداه قويه لعزل الخلايا الحية من الفائدة من خليط غير متجانس من الخلايا. يمكن فرز الخلايا استنادا إلى معايير الحجم والشكل ، فضلا عن التعبير عن علامات الفلورسنت1،2. في كثير من الأحيان ، تستخدم الأجسام المضادة المترافقة بالفلور لتسميه أنواع الخلايا المتميزة عن طريق استهداف مستضدات السطح الخاصة بالخلايا3،4. وبدلا من ذلك ، تم تصميم الكائنات المحورة وراثيا أو منظومات الإيصال الفيروسية للتعبير عن الفلوبوريس ببموجب المروجين الخاصين بالخلايا5،6. تاريخيا ، كان تطوير الاداات المحورة وراثيا والحيوانية مكلفه ومضيعه للوقت. وفي الاونه الاخيره ، ادي تناقص التكاليف وقله الصعوبات التقنية إلى زيادة هائله في عدد خطوط المراسلين المتاحة. وبما ان توافر الاداات المحورة وراثيا والحيوانية المراسلة لا يزال ينمو ، فانه ينبغي أيضا فائده وامكانيه تطبيق أساليب فرز الخلايا القائمة علي الفلورية.
وقد أثبتنا مؤخرا ان فرز الخلايا من الكائنات المحورة وراثيا يمكن تطبيقه بشكل روتيني لتنقيه الخلايا العصبية الاوليه استعدادا لثقافة الخلية7. عن طريق فرز الخلايا من الفئران أو الفئران, كنا قادرين علي عزل والثقافة الخلايا العصبية الفلورسنت, التي تعبر عن البروتينات الفلورية مراسل علي وجه التحديد في اما جابايرجيك أو الخلايا العصبية جلوتامريجيك6,8,9. من خلال دراسة هذه الثقافات العصبية المنقية, كنا قادرين علي تحديد فرق مهم في الطريقة جابايرجيك والخلايا العصبية جلوتاموجيك تعتمد علي العوامل التي تفرزها الخلايا التي يفرزها لإنشاء الإرسال متشابك7. بالاضافه إلى ذلك ، من خلال المشاركة في الخلايا الددميه مع العصبية المنقية ، تمكنا من تمديد الملاحظات السابقة التي تثبت الدور الحاسم الذي تلعبه الخلايا الددميه في نمو وبقاء العصبونات10،11. وهكذا ، من خلال مزيج من خليه الفرز وثقافة الخلية ، تمكنا من دراسة ليس فقط تطوير أنواع معينه من الخلايا العصبية في عزله ، ولكن كانت قادره علي التحقيق في تاثير الكريات الدبقيه علي وظيفتها.
نحن نقدم هنا بروتوكولا لتنقيه وثقافة الخلايا العصبية جابايرجيك و جلوتاميرجيك من القشرة والحصين من الفئران المحورة وراثيا أو الفئران. ونحن نقدم أيضا طريقه لعدم الاتصال الثقافة المشتركة للخلايا العصبية المنقية والخلايا الدليج ، وتكييفها من جيسسلر وآخرون12. من أجل توليد الثقافات جابايرجيك المنقية ، قمنا بفرز الخلايا العصبية الفلورية من VGAT-فينوس-والفئران Wistar8 أو vgat-فينوس الفئران13، والتي تعبر بشكل انتقائي عن تعزيز البديل البروتين الفلوري الأصفر (فينوس) في > 95 ٪ من الخلايا العصبية جابايرجيك القشرية. لتوليد الثقافات جلوتاميرجيك المنقية ، قمنا بفرز الخلايا العصبية الفلورية من NexCre. Ai9 الفئران6،9، والتي تعبر عن tdtomato في الخلايا العصبية القشرية جلوتاميرجيك. يمكن اجراء الفرز والثقافة بأكملها في غضون 3-4 h ويمكن استخدامها لتوليد مئات من الثقافات تكرار مناسبه للتحليل الكهربي ، المورفولوجية وبقاء الخلية. طريقه بسيطه وقابله للتكرار ويمكن ان تنتج الثقافات العصبية المنقية التي هي أكبر من 97 ٪ نقيه لنوع الخلية من الفائدة.
Protocol
وأجريت جميع الإجراءات والصيانة الحيوانية وفقا للمبادئ التوجيهية المؤسسية ، والقانون ألماني لرعاية الماشية ، وتوجيه المجلس الأوروبي 86/609/EEC بشان حماية الماشية ، في وجود أذونات من المحلية السلطات (LaGeSo Berlin, 0215/11).
ملاحظه: يصف هذا البروتوكول ثقافة الخلايا العصبية المنقية من الفاره المحورة وراثيا واحده أو الفئران الجرو (يوم ما بعد الولادة 0 – 2). يجب ان يتم تنفيذ جميع التقنيات في ظل ظروف معقمه. يجب تعقيم جميع الحلول باستخدام فلتر 0.2 μm (انظر جدول المواد). وينبغي ان تكون الشفتين الزجاج وأداات تشريح تعقيم الحرارة ل 3 ح في 185 درجه مئوية.
1. طلاء الزجاج Coverslips مع بولي-L-ليسين
- اعداد الشفتين الزجاجية عن طريق أذابه الجليد 5 مل من 200 ميكروغرام/مل بولي-L-يسين (PLL) الحل. تمييع هذا الحل الأسهم إلى 20 ميكروغرام/مل عن طريق أضافه 45 مل من المياه النقية حقن الصف. تصفيه-تعقيم الحل إلى أنبوب مخروطي جديد 50 mL. تسميه هذا الأنبوب باسم "PLL العقيمة".
ملاحظه: استخدام المياه المخزنة في درجه حرارة الغرفة لتسريع عمليه أذابه الجليد. - أضافه 100 معقمه ، مستديرة ، 12 ملم الزجاج coverslips للحل العقيم PLL. التحريض علي أنبوب كل 5-10 دقيقه ، لمده 2-3 دقيقه ، لضمان الطلاء حتى. معطف الشفتين في هذه الطريقة ل 1 ح.
ملاحظه: المانيه--تصنيع الزجاج المستديرة الزجاجية (قطر = 12 ملم) ويفضل ، كما انها توفر سطح ثقافة موثوق بها وتناسب بسهوله في ابار لوحه ثقافة الخلية 24 بئر. - بعد 40 دقيقه من طلاء PLL ، واتخاذ 2 قطعه من المناديل الورقية ووضع لهم شقه في تدفق مجلس الوزراء. تعقيم الورق باستخدام 70 ٪ الايثانول ، ثم تسطيح لأزاله التجاعيد وترك لتجف.
- بعد طلاء الشفتين الزجاج لمده 1 ح مع PLL ، وأزاله الحل PLL الزائدة وأضافه معقمه المياه الصف الحقن. التحريض بلطف علي الشفتين لمده 2 – 3 ثانيه للسماح بازاله الزائدة PLL. كرر هذه الخطوة الشطف 2 مرات اضافيه.
- أزاله المياه الزائدة ، ومن ثم نقل الشفتين إلى المناديل الورقية العقيمة. افصل كل مشبك بعناية باستخدام ملقط منحني واتركه ليجف.
ملاحظه: يمكن تجاهل الشفاه التي لا تفصل بسهوله. بدلا من ذلك ، يمكن أضافه كميه صغيره من الماء للمساعدة في الانفصال. - مره واحده الجافة ، ونقل الشفتين إلى لوحه ثقافة 24 بئر.
ملاحظه: وينبغي جعل coverslips جاهزه حوالي 30 دقيقه-1 ساعة قبل البدء في عمليه تشريح. ويمكن تخزين لوحات في حاضنه في 37 درجه مئوية و 5 ٪ CO2 حتى المطلوبة.
2. تفكك الانسجه الهيبوكامباله والقشرية
- اعداد حلول ثقافة الخلية
- لتفكك الانسجه العصبية ، تذويب الاولي 40 mL قسامه من العازلة ثقافة الخلية (التكوين [في مم]: 116 nacl ، 5.4 kcl ، 26 ناسكو3، 1.3 الجناح2بو4، 1 mgso4· 7h2o ، 1 cacl2· 2h2o ، 0.5 أدتا · 2Na · 2Na2O و 25 D-الجلوكوز ، pH = 7.4). قياس 12 مل من العازلة ثقافة الخلية إلى أنبوب مخروطي 15 مل; تسميه باسم "جيش الصرب البوسنيين". قياس 5 مل من المخزن المؤقت للثقافة الخلية إلى أنبوب 15 مل مختلفه. تسميه باسم "papain". احتضان كلا الأنبوبين في حمام مائي لمده 15 دقيقه عند 37 درجه مئوية.
- تصفيه-تعقيم المخزن المؤقت للثقافة الخلية المتبقية ، والتسمية باسم "العازلة-معقمه" وتخزين في 4 درجه مئوية حتى المطلوبة.
- تزن 120 ملغ من الزلال المصل البقري (جيش الصرب البوسني) وأضافه إلى أنبوب المسمي "جيش صرب الجمهورية". تزن 7 ملغ من بابين وأضافه إلى أنبوب المسمي "بابين". أعاده كلا الأنبوبين إلى حمام الماء لمده 15 دقيقه.
ملاحظه: فمن المفيد لأضافه كميه صغيره من العازلة إلى وزن القارب لتسهيل نقل مسحوق بابين. - مره واحده وقد حلت جميع مساحيق ، فلتر-تعقيم كل حل لأنبوب مخروطي جديد 15 مل. ل papain أنبوب ، تسميه الحل المصفاة باسم "بابين-معقمه". لأنبوب الجيش الصربي البوسني ، وتقسيم الحل العقيمة جيش الصرب البوسنيين إلى 3 أنابيب ، كل تحتوي علي 4 مل من محلول جيش صرب الجمهورية. تسميه كل أنبوب ك "بوسنيا-معقمه" واما "1" ، "2" أو "3". أعاده جميع الأنابيب مره أخرى إلى حمام المياه والاستمرار في احتضان في 37 درجه مئوية حتى المطلوبة.
- التحضير لتشريح الانسجه
- تاخذ قطعه واحده من 35 mm ورقه فلتر (انظر جدول المواد) وتعقيم مع 70 ٪ الايثانول ؛ اتركه ليجف في غطاء طبق بيتري 100 مم ، في خزانه التدفق.
- وضع المقص ، ملقط ، مشرط وملعقة (انظر جدول المواد) المطلوبة لتشريح الحصين والقشرة.
- مكان 2 35 mm اطباق بيتري وطبق بيتري 100 مم يحتوي علي ورقه فلتر معقمه في موقع يمكن الوصول اليها في مركز مجلس الوزراء تدفق.
- جمع NexCre المحورة وراثيا; Ai9 و VGAT فينوس الفار الجراء التي يتم تشريحها. استخدام مصباح الفلورسنت مع الاثاره المناسبة ومرشحات الانبعاثات (انظر جدول المواد) للتمييز بين الجراء الفلورية من نوع البرية أصحاب.
- علي الفور قبل تشريح الماشية ، وملء كل طبق بيتري 35 مم مع المبردة ، والعازلة الخلية المعقمة.
ملاحظه: طبق بيتري واحد لتنظيف الاداات بين التفكيك ، والاخر هو لجمع الحصين والقشرة.
- تشريح الانسجه
- بمجرد سكب المخزن المؤقت للثقافة الخلية ، وقطع الراس يوم بعد الولادة 0-2 الماوس المحورة وراثيا أو الفئران الجرو باستخدام مقص كبير ، حاد واستخدام العقيم 100 mm طبق بيتري لنقل رئيس في مجلس الوزراء تدفق. استخدام ملقط ، مقص وملعقة لنقل بعناية الدماغ من الجرو المحورة وراثيا إلى ورقه فلتر معقمه.
- استخدم مشرط من النوع 22 لتشريح المخيخ وفصل نصفي الكره. استخدام ملعقة صغيره للفه نصفي الكره الجانبية. في كل نصف الكره الارضيه ، اضغط برفق بحيث تلامس القشرة مع ورقه الفلتر. حرك برفق مناطق الدماغ الوسطي للكشف عن الحصين والقشرة.
ملاحظه: يجب الحرص علي عدم تطبيق الكثير من الضغط عند الضغط لأسفل علي نصفي الكره أو الخلايا يمكن ان تصبح سحقت. - استخدام مشرط أو ملعقة لفصل الحصين والقشرة من كل نصف الكره الارضيه. نقل الانسجه التشريح إلى صحن بيتري 35 مم يحتوي علي عازله للثقافة الخلوية المبردة.
ملاحظه: إذا تشريح العديد من الكائنات ، تخزين معقمه الخلية العازلة المخزنة في أنبوب مخروطي 50 mL علي الجليد. بعد كل تشريح ، نقل تشريح الانسجه إلى المخزن المؤقت ثقافة الخلية المبردة. - بعد تشريح ناجح من الانسجه cortico-هيبوكامبال ، نقل الحل بابين معقمه من حمام المياه إلى مجلس الوزراء تدفق. استخدام ماصه 3 مل باستور لنقل الحصين تشريح والقشرة إلى غطاء صحن بيتري معقم 35 مم. قطعي في حركه متقاطعة ، باستخدام الجزء المسطح من مشرط من النوع 22 ، حتى يصبح النسيج في قطع صغيره.
- استخدم كميه صغيره من محلول الباباين لنقل النسيج المفروم من غطاء طبق بيتري إلى أنبوب الورق المعقم. العودة أنبوب بابين إلى حمام المياه واحتضان الانسجه في 37 درجه مئوية لمده 25 دقيقه.
- اثناء الحضانة بابين ، تشكل حل وسائل الاعلام كامله فلوري. تذويب 1 مل قسامه من B27, 0.5 ml قسامه من جلوساماكس و 0.5 ml قسامه من القلم-بكتيريا. Aliquot 48.5 mL من السبات وسائل الاعلام منخفضه الفلورية إلى أنبوب مخروطي 50 mL. أضافه B27 ، جلوساماكس والقلم-بكتيريا إلى الحل. يهز الحل بشكل جيد ، ثم تصفيه تعقيم والتسمية باسم "اسبات A وسائل الاعلام الكاملة" (مع التاريخ والأحرف الاستهلالية). احتضان في 37 درجه مئوية في حمام مائي.
- بعد حضانة بابين ، انقل أنبوب الباب وأنابيب التعقيم المعقمة إلى الخزانة المتدفقة. استخدم ماصه 1 مل من باستور لأزاله الانسجه الهيبوكامباله فقط من أنبوب الباباين إلى الأنبوب 1.
ملاحظه: رعاية للحد من نقل الحل بابين الزائدة.
- تفكك الخلايا
- من أجل تفريق اي كتل كبيره من الانسجه ، تريلوريتي الانسجه عده مرات باستخدام ماصه 1 مل باستور. وبعد ذلك ، تريلوريتي الانسجه 7 مرات باستخدام غيض الغرامة باستور ماصه. اترك النسيج للوقوف لمده 30 ثانيه ، مما يسمح بقطع أكبر من الانسجه إلى الرواسب.
- بعد 30 ثانيه ، ونقل اقل 1 مل من الحل والانسجه من جيش صرب الجمهورية-أنبوب 1 إلى جيش صرب البوسنيين أنبوب 2. تريتوريت الانسجه في الأنبوب الصربي 2 عده مرات باستخدام غيض الغرامة باستور ماصه.
- بعد تريلوريشن ، نقل مره أخرى انخفاض 1 مل من الانسجه والمحلول من جيش صرب الجمهورية 1 ، ولكن الآن إلى جيش صرب البوسنيين أنبوب 3. تريتوريت الانسجه في جيش صرب البوسنية-أنبوب 3 عده مرات باستخدام طرف غرامه باستور ماصه.
- بعد تريلوريشن ، نقل جميع الحلول والانسجه من أنابيب 2 و 3 إلى جيش صرب البوسنيين أنبوب 1. [تريورريت] بعيد 2-3 أوقات وجهاز طرد مركزي في 3,000 [اكس] [ غ ] ل 3 [مين.].
- اثناء طرد, يشكلون كامله عصبيه قاعديه [ا] أوساط ([NBA] أوساط). Aliquot 48.5 mL من وسائل الاعلام الدوري الأميركي للمحترفين إلى أنبوب مخروطي 50 مل واحتضان في 37 درجه مئوية في حمام مائي. تسميه هذا الأنبوب "الدوري الأميركي للمحترفين فقط". الاضافه إلى ذلك ، تذويب 1 مل قسامه من B27 ، a 0.5 ml قسامه من جلوساماكس و 0.5 ml قسامه من القلم-بكتيريا في درجه حرارة الغرفة.
- بعد طرد ، بعناية أزاله ماده طافي من الانسجه المغلفة وأعاده تعليق الخلايا في 2 مل من وسائل الاعلام الكاملة. استخدم ماصه P1000 لتنظيف الانسجه صعودا وهبوطا 20 مره.
ملاحظه: يجب الحرص علي عدم ماصه الخلايا بقوة. إذا تم تطبيق الكثير من الضغط ، قد تتلف الخلايا. - استخدام ماصه 1 مل باستور لتصفيه تعليق الخلية من خلال غربال الخلية 30 μm في أنبوب عينه البوليسترين.
ملاحظه: إذا كان تعليق الخلية لا يمر علي الفور من خلال غربال الخلية ، قد يكون من الضروري الضغط علي اعلي الغربال مع قفاز معقم لبدء تدفق. هذه الخطوة الهامه يمنع انسداد فأرز الخلية. - لجمع الخلايا العصبية بعد الفرز ، واعداد أنابيب جمع عن طريق التنضيد 300 μL من وسائل الاعلام الكاملة إلى العدد المطلوب من أنابيب البولي بروبيلين.
- تعليق الخلية جاهز الآن ليتم نقلها إلى فأرز الخلية للفرز. اتخاذ تعليق الخلية ، وأنابيب جمع اضافيه وقطع الغيار وسائل الاعلام الكاملة في حاله التخفيف من العينة مطلوب.
3. فرز خليه من الخلايا العصبية المنقية جابايرجيك أو جلوتاميرجيك
ملاحظه: للتقليل من فرصه التلوث البكتيري اثناء الفرز شطف الأنابيب عينه من فأرز مع 70 ٪ الايثانول لمده 5 دقائق علي الأقل قبل الفرز. تختلف معلمات الفرز المفصلة بين الاداات ، والاعتبارات الاساسيه هي كما يلي.
- خلال فرز الخلايا الاولي ، وإنشاء مستويات من الخلفية الفلورية من الخلايا غير المسمية عن طريق فرز ومقارنه الخلايا من نوع البرية الحيوانية.
- لكل نوع من أنواع الخلايا الفلورية ليتم فرزها ، اختر مرشحات الاثاره والانبعاثات المناسبة. تثير الزهرة والبروتينات الطماطم التي تستخدم 488 نانومتر أو 531 nm موجات الاثاره ، علي التوالي. الكشف عن ضوء المنبعثة من خلال 530/40 و 575/30 مجموعات تصفيه الانبعاثات ، علي التوالي.
- أضافه أنابيب جمع البولي بروبيلين ، التي تحتوي علي 300 μL من وسائل الاعلام الكاملة ، إلى فأرز الخلية لجمع الخلايا.
- لنقاء عاليه ، فرز الخلايا الفلورية المسمية الزاهية (انظر الشكل 1B علي سبيل المثال المؤامرات نقطه من الخلايا المفروزة).
- بعد الفرز ، للحصول علي أفضل النتائج ، قم باجراء اختبار نقاء للخلايا المفروزة لتقدير مستويات النقاء. لاحظ ان معدل الاسترداد النموذجي للخلايا التالية للفرز يتراوح بين 70 – 80%.
- لاحظ انخفاض عدد الخلايا التي تم فرزها في كل أنبوب تجميع. يتم إعطاء هذه القيمة بواسطة أداه فرز الخلايا.
ملاحظه: ويمكن اجراء فرز الخلايا باستخدام فوهه 70 μm (70 psi ضغط السائل غمد) أو فوهه 100 μm (20 رطل ضغط السائل غمد).
4. الذبح من الخلايا العصبية فرزها
- بعد فرز الخلايا ، نقل الخلايا التي تم جمعها إلى 2 ملليلتر أنابيب الطرد المركزي أسفل الجولة ، وذلك باستخدام ماصه 1 مل باستور. الطرد المركزي الخلايا في 3,000 x g ل 3 دقيقه لتشكيل خليه بيليه.
ملاحظه: للمساعدة في تحديد موقع بيليه الخلية ، توجيه أنابيب الطرد المركزي أسفل الجولة مع المفصلي من الغطاء الذي يواجه الخارج ، والذي يسمح بيليه الخلية لتشكيل علي الجزء الخلفي من أنبوب الطرد المركزي (اي ، علي نفس الجانب من الأنبوب كما المفصلي). - خلال طرد ، أضافه 1 مل من B27 ، 0.5 مل من جلوساماكس و 0.5 مل من القلم-بكتيريا إلى 48.5 مل من وسائل الاعلام الدوري الأميركي للمحترفين قبل حرارة. يهز الحل بشكل جيد ، ثم تصفيه تعقيم والتسمية باسم "الدوري الأميركي للمحترفين وسائل الاعلام كامله" (مع التاريخ والأحرف الاستهلالية). العودة إلى حمام المياه حتى المطلوبة.
- بعد طرد, استخدام 1 مل باستور ماصه لنقل ماده طافي إلى أنبوب الطرد المركزي مختلفه (الاحتفاظ في حاله اضطراب الخلية بيليه). أعاده تعليق بيليه الخلية في الكمية المطلوبة من قبل حرارة الدوري الأميركي للمحترفين كامله وسائل الاعلام لتحقيق كثافة خليه من 1,000 خلايا/μL. أعاده تعليق الخلايا عن طريق التعبئة صعودا وهبوطا مع ماصه P200 أو P1000.
- لتاكيد وجود الخلايا المنفصلة ، افحص محلول الخلية تحت المجهر ، باستخدام عدسه موضوعيه بدقه 4x أو 10x. بدلا من ذلك ، ماصه كميه صغيره من محلول الخلية علي الشفة والتحقق تحت المجهر. إذا كانت اعداد كبيره من الخلايا موجودة ، يمكن تجاهل ماده طافي من الخطوة 4.3.
- قبل طلاء الخلايا ، دوامه علي سرعه متوسطه لمده 2 – 3 ليالي لضمان تعليق الخلية حتى. بعد vortexing ، ماصه بسرعة 10 μL من تعليق الخلية إلى وسط كل الشفتين. بعد التنضيد الخلايا ، والعودة بسرعة كل لوحه إلى الحاضنة (5 ٪ CO2/37 درجه مئوية) واحتضان لمده 1 ساعة.
ملاحظه: إذا أضافه خلايا إلى عده لوحات 24 جيدا ، وضمان كثافة الخلايا حتى عن طريق الخلايا الفورتكينغ بين لوحات. - بعد 1 ح ، تغذيه الخلايا مع 500 μL من قبل استعدت وسائل الاعلام الدوري الأميركي للمحترفين كامله والعودة إلى الحاضنة.
ملاحظه: عند تغذيه الخلايا ، من المهم لماصه وسائل الاعلام بلطف أسفل الجانب من البئر لتجنب انفصال الخلايا. للتجارب القصيرة (< 16 يوما) ، والتغذية في الكثافة المذكورة أعلاه ليست ضرورية. عند الطلاء كثافة أكبر من الخلايا ، قد تكون هناك حاجه إلى فترات تغذيه أكثر تواترا (انظر المناقشة).
5-الثقافات المعززة لدعم الفيزياء الفلكية
ملاحظه: وقد وصف إنتاج الثقافات الدالالي14 واستخدام ادراج الثقافة الخلوية في السابق12. وخلاصه القول ان ثقافات الخلايا غير الهيبوكامباله المخصبة استروسيتيه مشتقه من الانسجه القشرية (مع أزاله السحايا ؛ P2-ف-5) ، التي تم استزراعها لمده أسبوع واحد علي 20 ميكروغرام/مل PLL مغلفه لوحات 6-حسنا ، في مصل تكمله DMEM وسائل الاعلام.
- للثقافة المشتركة تنقيه الخلايا العصبية والكريات الطائرة الشراعية ، مرور الخلايا متموج الدبقيه إلى العدد المطلوب من ادراج ثقافة الخلية (0.4 μm حجم المسام-انظر جدول المواد). لتمرير الخلايا ، وأزاله لوحه 6-حسنا تحتوي علي خلايا متموج الدبقيه من الحاضنة وغسل 2 الآبار ، 2 مرات ، مع 2 مل من حرارة ما قبل (37 درجه مئوية) الفوسفات مخزنه المالحة (تلفزيوني).
- يستنشق محلول التلفزيونية واستخدام ماصه P1000 لأضافه 1 مل من الحرارة السابقة (37 °C) التربسين (1:250)/أدتا (0.25 ٪/0.02 ٪) حل لكل بئر.
- العودة لوحه 6-حسنا إلى الحاضنة وتحقق كل 2-3 دقيقه لمفرزه الخلية.
- وبمجرد حدوث انفصال كبير في الخلية ، يتم ماصه الخلايا ومحلول الخلايا بلطف صعودا وهبوطا باستخدام ماصه الراس الناعمة ، للمساعدة في انفصال الخلايا الفردية وفصلها.
- نقل حل الخلية إلى أنبوب مخروطي 15 مل وأجهزه الطرد المركزي في 3,000 x g لمده 3 دقائق.
- أعاده تعليق الخلايا باستخدام ماصه P1000 في 5 مل من الحرارة السابقة (37 درجه مئوية) الدوري الأميركي للمحترفين وسائل الاعلام كامله عن طريق الأنابيب بلطف صعودا وهبوطا حتى بيليه الخلية في الحل.
- قم باجراء عدد خلايا باستخدام مقياس الكريات الدموية أو عداد الخلايا المؤتمت.
ملاحظه: بعد 7 أيام في الثقافة ، ويمكن حصاد ما يقرب من 750000-1000000 الخلايا من كل بئر من لوحه 6-حسنا. - لوحه 40,000 الخلايا الدبقيه لكل خليه الثقافة ادراج في قطره 500 μl (80 خلايا/μl).
- بعد السماح للخلايا بالتصاق ب 1 ساعة ، استخدم ملقط معقم لنقل ادراج ثقافة الخلايا المغطية إلى لوحات 24 بئر تحتوي علي الخلايا العصبية المنقية. أزاله الوسائط الزائدة من سطح ادراج ثقافة الخلية (حوالي 300 μL).
ملاحظه: كما يمكن الحصول علي فقاعات الهواء في كثير من الأحيان المحاصرين تحت ادراج ثقافة الخلية ، قد يكون من الضروري أماله بلطف ادراج لأزاحه هذه الفقاعات. إذا تم أضافه المزيد من الخلايا المنزلقة إلى ادراج ثقافة الخلية ، قد تكون هناك حاجه إلى مزيد من الغسيل والطرد المركزي الخطوات لأزاله التريبسين الزائدة ، والتي يمكن ان تكون ضاره لبقاء الخلية.
النتائج
ويمكن اجراء التفكك وفرز الخلايا من الخلايا العصبية الفلورية من الماوس المحورة وراثيا أو الفئران cortico-هيبوكامبال الانسجه في ما يقرب من 3-4 ح. والنتيجة هي السكان من الخلايا العصبية الفلورية النقية للغاية ، والتي يمكن زراعتها في الثقافة لمده 16 يوما.
لتوليد الثقافات النقية ، تم تحديد الحيوانية المحورة وراثيا لأول مره باستخدام مصباح الفلورسنت مع مجموعات مرشح المناسبة (أمثله من النيون الوليد VGAT فينوس و NexCre ؛ وتظهر الجراء Ai9 الفار في الشكل 1A). بعد التعرف علي الكائنات المحورة وراثيا ، تم فصل الانسجه التي تم تشريحها ، وتم فرز الخلايا العصبية الفلورية الأكثر قوه لإنتاج الخلايا المنقية. مثال كثافة القطع الفلورية لنقطه NexCre ؛ يتم عرض Ai9 و VGAT فينوس الخلايا العصبية الماوس ، التي تم الحصول عليها خلال FACS ، في الشكل 1B. عندما الأمثل ، فمن الممكن لحصاد بين 500,000 و 800,000 الخلايا من القشرة والحصين من P0 NexCre الفردية ؛ Ai9 أو VGAT فينوس الفئران. يمكن فرز الخلايا بسرعة اعلي من 600 احداث/ق. وأجريت تقديرات لنقاء الخلايا باستخدام DAPI كعلامة نوويه (الشكل 1 ج). عن طريق فرز الخلايا الايجابيه بقوة ، ويمكن تحقيق نقاء أكثر من 97 ٪ بشكل روتيني7.
بعد الفرز الناجح ، يجب ان تظهر الخلايا العصبية مطلي الجولة في الشكل ، لديها غشاء أملس ، وينبغي ان ينظر إلى تنبت العصب بعد حوالي 1 ح في المختبر (الشكل 2A، B). وبحلول 7 أيام في المختبر ، علي الرغم من ان بعض موت الخلايا قد يكون ظاهرا ، ينبغي ان تكون الخلايا القابلة للحياة موجودة في جميع الظروف الثقافية (الشكل 2 ج، د). في 12-16 يوما في المختبر ، وذلك باستخدام كامل خليه التصحيح المشبك التسجيلات والبيتا-ملء15، فمن الممكن للتحقيق في التطوير المورفولوجية والكهربية من الخلايا العصبية المنقية (الشكل 3). تحليل الثقافات المنقية يكشف ان كلا من الخلايا العصبية جلوتاموجيك وجابايرجيك كانت قادره علي توسيع محاور و تشعبات من أجسادهم الخلية (الشكل 3a، B) والاحتفاظ بالقدرة علي توليد إمكانات العمل استجابه الحقن بالاستقطاب الحالي (الشكل 3 ج، د). ومن الجدير بالذكر, ومع ذلك, بعد تنقيه, فقط تلقت الخلايا العصبية جابايرجيك كميات كبيره من ناقل الحركة التلقائي متشابك, والخلايا العصبية جلوتاموجيك تلقي القليل جدا من انتقال متشابك في غياب الخلية الداليه (الشكل 3E ، واو) 7-
كما ذكرنا سابقا ، الخلايا في الثقافات المنقية تميل إلى البقاء علي قيد الحياة أكثر سوءا من تلك التي في الثقافات التي لم يتم فرزها ولها تشعبات أصغر بكثير و محاور7. للتغلب علي هذه العجز ، قمنا بتكييف وتطبيق أساليب لدعم تطوير الثقافات المنقية مع الخلايا الدالي12،14. يظهر التكوين الخلوي لثقافات الدعم الخاصة بنا (DIV7) في الشكل 4A. هذه الثقافات التي تحتوي غالبا علي البروتين الحمضي الليفي الليليطي (gfap) الايجابيه astrocytes ، ولكن أيضا تحتوي علي بعض مجموعه من جزيء التمايز (CD11b) الايجابيه ميكروليا والبروتين الأساسي المايلين (mbp) الايجابيه oligodendrocytes. بعد DIV 7 ، يمكن ان تكون هذه الخلايا العبور إلى ادراج ثقافة الخلية لتوفير دعم عدم الاتصال من الخلايا العصبية المنقية (الشكل 4B، C). ويكشف تحليل الثقافات المشتركة بين الخلايا العصبية غير العضوية ان ما يقرب من 40,000ا كانت كافيه لتحسين البقاء والنمو علي المدى الطويل للخلايا العصبية المنقية والعصبية جابايرجيك (الشكل 4D, E)7. وعلاوة علي ذلك ، يكشف التحليل الكهربي الفسيولوجي ان الخلايا العصبية جلوتاميرجيك ، شارك في الاستزراع مع الكريات الداليه ، كانت نشطه للغاية وزادت بقوة نشاط الشبكة (النسبة المئوية من الخلايا العصبية المدعومة بالرصاص التي تطلق رشقات ناريه من العمل الإمكانات: 62 في المائة ؛ ن = 28 ؛ الشكل 4 واو ، زاي). دعم glial ولذلك مهم ليس فقط لتعزيز نمو الخلايا العصبية والبقاء علي قيد الحياة, ولكن أيضا لتعزيز انتقال متشابك وإنشاء نشاط الشبكة في الثقافات جلوتاماماتجيك.
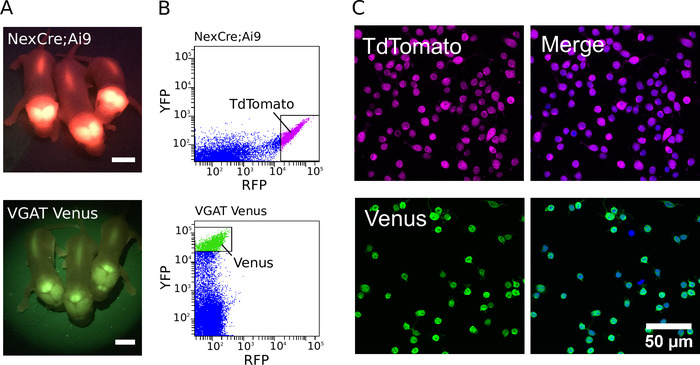
الشكل 1: تنقيه الخلايا العصبية جلوتاموجيك وجابايرجيك. (ا) الصور التي تظهر اشاره الفلورسنت من التعبير عبر الجينات من TdTomato في NexCre ؛ Ai9 الفئران (اعلي) والزهرة في الفئران VGAT فينوس (أسفل). قضبان المقياس = 5 مم. (ب) القطع المبعثرة الكثيفة لخلايا الطماطم الصغيرة والزهرة الفلورية للخلايا الهيبوكامباله المنفصلة من NexCre ؛ Ai9 الفئران (اعلي) و VGAT فينوس الفئران (أسفل). بقوة الفلورسنت TdTomato أو الخلايا العصبية فينوس تم اختيارها للفرز (المشار اليها من قبل صناديق النابضة). (ج، يسار) الصور المنسقة لل TdTomato فرزها (اعلي) والزهرة (أسفل) الخلايا العصبية الايجابيه. (ج، يمين) صوره مدمجه تظهر الخلايا المشتركة ملطخه DAPI (في الأزرق الزائف). TdTomato مضان هو الذاتية ويبقي قويا علي الرغم من التثبيت (في شبه اللون الأرجواني). ويتعزز التعبير فينوس باستخدام مزيج من الأجسام المضادة الاوليه الموجهة ضد GFP والأجسام المضادة الثانوية 488-المترافقة اليكسا (في شبه اللون الأخضر). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
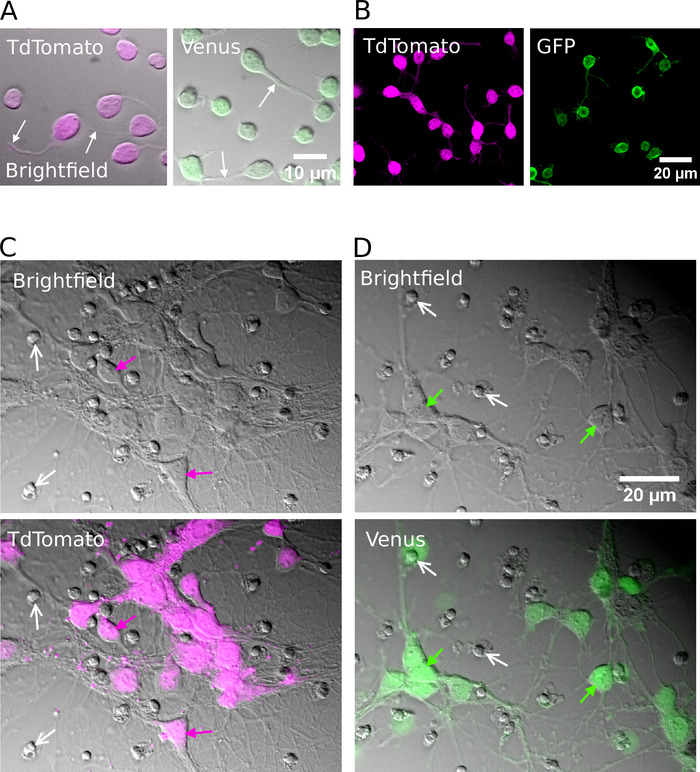
الشكل 2: ثقافة خليه من الخلايا العصبية المنقية جلوتاموجيك أو جابايرجيك. (ا) الاشعه تحت الحمراء مجتمعه (حقل مشرق) الصور والإشارات الفلورية المتراكبه من TdTomato (اليسار) والزهرة (الحق) الخلايا العصبية الايجابيه مثقف ل 1 ح في المختبر. تشير الأسهم البيضاء إلى موقع العصب المتزايد. (ب) الصور المنسقة للخلايا العصبية (اليسار) والزهرة (اليمني) الايجابيه المثقفة لمده 1 ساعة في المختبر. (جيم ، دال) حقل مشرق (اعلي) والجمع بين حقل مشرق والصور الفلورية (أسفل) من TdTomato (C) والخلايا العصبية الايجابيه فينوس (D) مثقف لمده 7 أيام في المختبر (DIV). تظهر الأسهم البيضاء موقع النوى المكثفة من الخلايا الميتة. السهام الملونة تحديد فلوريسسينتلي المسمي الخلايا العصبية. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
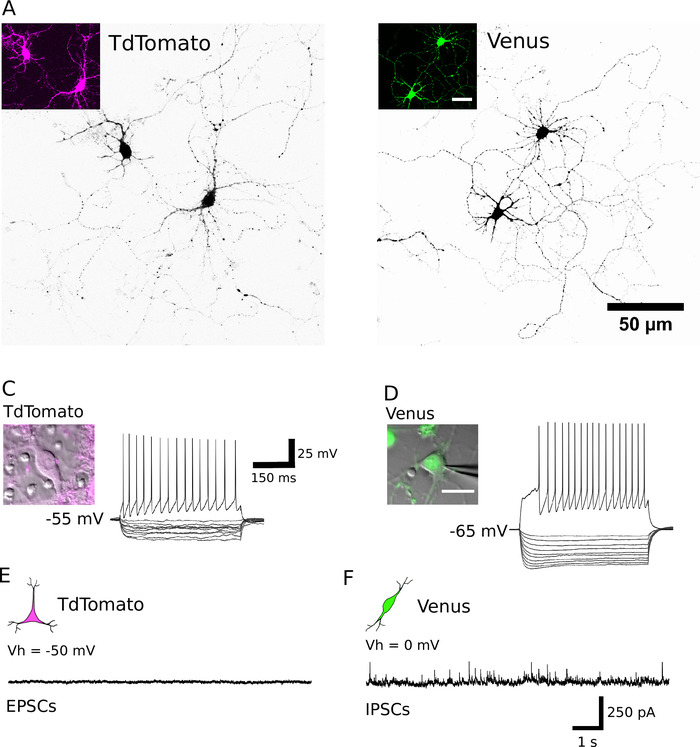
الشكل 3: خصائص مورفولوجية ، الكتروفيزيولوجيه ومتشابكة من الخلايا العصبية المنقية. (الف ، باء) الصور المحورية لل TdTomato (A) والخلايا العصبية الايجابيه فينوس (B) في DIV 13 و DIV 14 ، علي التوالي. يتم عرض الخلايا باللون الأسود باستخدام جدول البحث المقلوب للمساعدة في التصور العصبي. تظهر insets اشاره الفلورسنت التي عبر عنها الخلايا العصبية المحددة. (جيم ، دال) استجابه الجهد من TdTomato (C) والزهرة العصبية الايجابيه (د) إلى فرط الاستقطاب (200 إلى-20 باسكال ، في 20 خطوه باسكال) والاستقطاب (200 pA) النبضات الحالية ، التي تم الحصول عليها من قبل خليه كامله التصحيح المشبك التسجيلات. تظهر insets الخلايا العصبية المسجلة المقابلة. يتم الاشاره إلى امكانيه الغشاء اليستريح لكل خليه إلى يسار تتبع التسجيل. (هاء ، واو) ممثل الجهد المشبك التسجيلات (10 ق) الحصول عليها من TdTomato (E) والخلايا العصبية الزهرة الايجابيه (F). وسجلت الاحداث العفوية بعد متشابك (EPSCs) من الخلايا العصبية الايجابيه TdTomato, الحفاظ علي امكانيه عقد من 50 mV. الاحداث المثبطة التي تحدث تلقائيا (IPSCs) تم تسجيلها من الخلايا العصبية الايجابيه فينوس الحفاظ علي امكانيه عقد من 0 mV. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
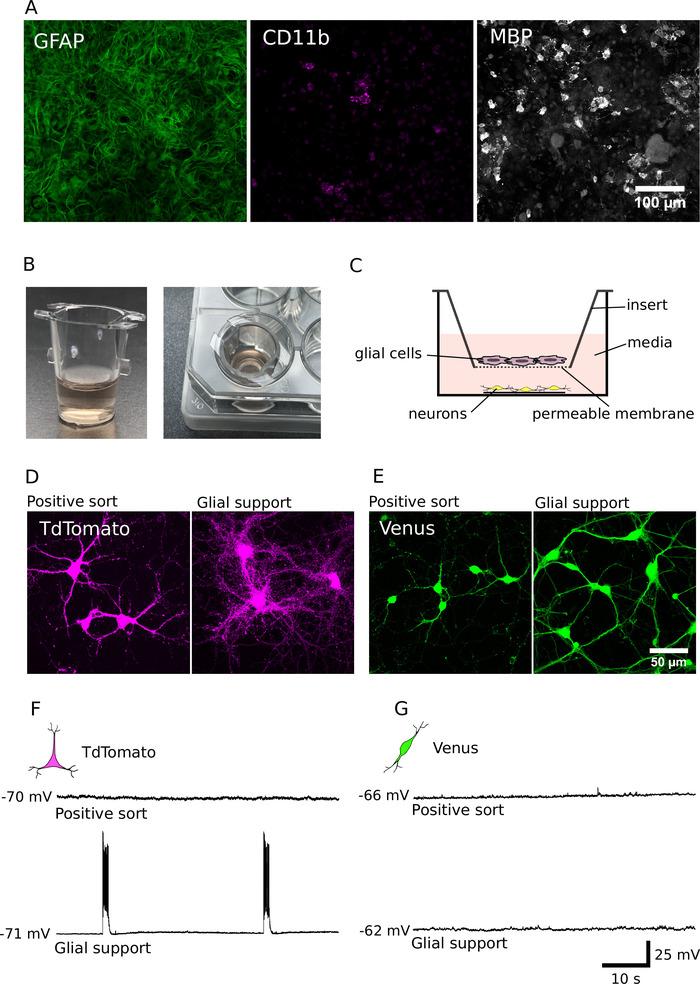
الشكل 4: دعم تطوير الخلايا العصبية مع الثقافة المشتركة. (ا) الصور البؤرية للثقافات الداليه المناعية للبروتين الحمضي الليفي الجليطي (gfap ، اليسار) ، ومجموعه من جزيئات التمايز (CD11b ، والوسط) ، والبروتين الأساسي الميلين (mbp ، اليمين). وقد تم استزراع الخلايا الدليج ل DIV 7. (ب) صور لادراج الثقافة الخلوية المستخدمة في الاستزراع المشترك للخلايا المنزلقة مع الخلايا العصبية المنقية في ترتيب عدم الاتصال. (ج) تخطيطي للترتيب المكاني المستخدم في الاستزراع العصبي المشترك والخلايا الدبقيه. (دال ، هاء) الصور المحورية من TdTomato (D) والخلايا العصبية الايجابيه فينوس (E) ، نمت لمده 14 يوما ، في غياب (اليسار) أو وجود (يمين) من الدعم الدالي. (واو ، زاي) الحالية-المشبك التسجيلات (60 s) من TdTomato (F) والخلايا العصبية الايجابيه فينوس (ز) مثقف لمده 14 يوما في غياب (اعلي) أو وجود (أسفل) من الدعم الدالي. وسجلت الخلايا العصبية في إمكاناتها الغشاء يستريح (قدم إلى اليسار من كل تتبع التسجيل). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
Discussion
ونحن هنا وصف الطريقة التي تجمع بين فرز وذبح الخلايا العصبية الاساسيه لتوليد الخلايا العصبية النقية الثقافات. هذا الأسلوب يستغرق حوالي 1 ساعة أطول من بروتوكول ثقافة الخلايا العصبية منفصلة الاساسيه النموذجية حتى الآن يسمح لتوليد مئات من الثقافات النسخ المتماثل التي تحتوي علي أنواع معينه من الخلايا العصبية. الخلايا العصبية المنقية ، والتي يمكن زراعتها في عزله لمده 16 يوما علي الأقل ، وتوسيع محاور و تشعبات ويمكن إطلاق القطارات المتكررة من إمكانات العمل (الشكل 2 والشكل 3). والاهم من ذلك ، ان هذه الخلايا قابله لنفس التحاليل التجريبية مثل الثقافات العصبية الاساسيه المنفصلة ، بما في ذلك التحاليل الكهربية والمورفولوجية والبقاء. ومن الفوائد الرئيسية للعمل مع هذه الثقافات المنقية ان تطوير أنواع معينه من الخلايا يمكن دراسته في عزله. لدعم تطوير الثقافات المنقية ، ونحن نقدم أيضا بروتوكول لمشاركه الخلايا العصبية المنقية مع الخلية المنزلقة. كما هو مبين سابقا ، المشتركة في الخلايا العصبية المنقية مع الكريات الطائرات الشراعية يحسن البقاء علي قيد الحياة ، والنمو ، ويمكن تعزيز تكوين شبكه7 (الشكل 4). التالي ، فاننا نقدم هنا مجموعه من الأساليب التي ينبغي ان تعزز دراسة تفاعلات الخلايا العصبية غير الخلوية ، وقد تكون مفيده لدراسة التنمية والتفاعل بين أنواع الخلية الأخرى من الفائدة.
وقد كشفت الدراسات حول ثقافات الخلايا العصبية جلوتاميرجيك المنقي الرؤى الاساسيه في الطريقة التي تفرزها خليه الدال العوامل التي تعزز تطوير الشبكات العصبية وتكوين المشبك16,17,18 . بشكل عام, وقد تم تطبيق أساليب لتنقيه أنواع الخلايا العصبية محدده بنجاح أكبر لدراسة تطور الخلايا العصبية جلوتاموجيك بدلا من الخلايا العصبية جابايرجيك. وقد ادي ذلك إلى تفاوت في فهمنا لكيفيه تطور هذين النوعين من الخلايا. النظر إلى ان جابايرجيك والخلايا العصبية جلوتاموجيك تختلف بشكل كبير من حيث التشريح, علم وظائف الجسم وأصول النمو, فمن المهم ان ندرس الخلايا العصبية جابايرجيك في حقهم الخاص, لفهم أفضل وظائفهم ووظائفهم. باستخدام البروتوكول المعروض هنا ، وقد حددنا سابقا الاختلافات الهامه في الطريقة جابايرجيك والخلايا العصبية جلوتاموجيك تعتمد علي العوامل التي تفرزها الخلايا التي يفرزها لإنشاء الإرسال متشابك7. من خلال نشر هذا البروتوكول نامل ان الآخرين يمكن ان تجعل المزيد من الرؤى في التفاعلات الهامه بين الخلايا العصبية والكريات الدبقيه.
في هذا البروتوكول ، ونحن وصف تدفق الخلوي علي أساس طريقه فرز الخلايا ، والتي استخدمناها لتنقيه جابايرجيك أو الخلايا العصبية جلوتاموجيك من خطوط القوارض المحورة وراثيا مختلفه. تم فرز الخلايا العصبية الزهرة الايجابيه جابايرجيك من VGAT فينوس الفئران13 أو الفئران8 و tdtomato ايجابيه جلوتاماماتيك الخلايا العصبية تم فرزها من nexcre. Ai9 الفئران (ولدت أصلا من NexCre9 و Ai9 مراسل الخطوط6، انظر توركو وآخرون ، 20187). في السنوات الاخيره ، وبسبب التطورات التكنولوجية ، أصبح جيل الكائنات المحورة وراثيا أسهل بكثير. وعلي هذا النحو ، فان توافر الكائنات التي تعبر عن جزيئات الفلورسنت ، في العديد من أنواع الخلايا المختلفة ، قد نما بسرعة. وقد ادي هذا ، بدوره ، إلى زيادة استخدام وتطبيق فرز الخلايا المنشطة الفلورية. في حين توجد الطرق البديلة لعزل خلايا الفائدة حاليا16،19،20، فانها تعرقل إلى حد ما باعتمادها علي توافر الأجسام المضادة المناسبة للسطح الذي يحدث بشكل طبيعي مستضدات. وهذا يحد من تنوعها بالمقارنة مع طرق فرز الخلايا المستندة إلى الفلورية ، والتي يمكن استخدامها بالفعل لفرز الخلايا من العديد من الخلايا الخاصة بالمراسلات المعدلة وراثيا والمتوفرة بالفعل. ومع ذلك ، عندما الأمثل ، وطرق الفرز المستندة إلى الأجسام المضادة يمكن ان تكون سريعة وعاليه الغلة ، وربما أفضل الحفاظ علي تشريح الخلية ، من خلال السماح تنقيه الخلايا مع محاور والتشعبات سليمه21. ولذلك ينبغي النظر في أساليب فرز الأجسام المضادة عند اتخاذ قرار بشان استراتيجية الفرز. وفي نهاية المطاف ، فان نوع الخلية من الفائدة ، والعمر الذي يتم فيه فرز الخلايا ، وتوافر الكائنات المحورة وراثيا أو المستضدات السطحية وعدد الخلايا اللازمة سيكون العوامل الحاسمة عند اختيار استراتيجية الفرز الأنسب.
علي الرغم من ان الفرز الخلوي القائم علي الفلورية هو طريقه بسيطه وقابله للتكرار لتنقيه الخلايا ، ينبغي توخي الحذر اثناء خطوات معينه من البروتوكول للحفاظ علي جوده الخلية. علي سبيل المثال ، بعد كل خطوه طرده ، من المهم التاكد من أعاده تعليق الخلية بيليه بأسرع وقت ممكن وان الخلايا قد تم استردادها بنجاح. في بعض الأحيان ، يمكن ان يزعج بيليه الخلية عند أزاله supernatant. ولذلك ينصح ، بين الخطوات الطردة ، للتحقق من وجود خلايا تحت المجهر لاستبعاد اي فقدان الخلايا واسعه النطاق. بعد طلاء الخلايا ، يجب السماح للخلايا بالتصاق ب 1 ساعة علي الأقل قبل الرضاعة. إذا تم تغذيه الخلايا في وقت مبكر جدا ، قد تصبح بعض الخلايا طردت من الشفة ، التالي الحد من كثافة الثقافة. بعد 1 ح في الثقافة ، فمن الحكمة لتقييم صحة الخلية. إذا كانت الخلايا لا تظهر بصحة جيده (يظهر مثال للخلايا السليمة في الشكل 2 ا) ، أو ان هناك موتا كبيرا للخلايا ، فقد يكون هذا مؤشرا علي وجود مشكله اثناء اجراء التفكك أو الفرز. وهناك اعتبار آخر مهم ، عند زراعه اي نوع من الخلايا ، هو ان تاخذ الرعاية عند أداره وسائل الاعلام الثقافة الخلية. الدوري الأميركي للمحترفين وسائل الاعلام يحتوي علي الفينول الأحمر ، الذي يعمل كمؤشر الأس الهيدروجيني22. إذا أصبحت الوسائط صفراء جدا في اللون ، فهذا يشير إلى ان درجه الحموضة حمضيه جدا. إذا أصبحت الوسائط ورديه جدا ، فهذا يشير إلى ان الحل قلوي جدا. حلول الأسهم مفتوحة لفترات طويلة ، وخاصه وسائل الاعلام المنقولة إلى أنابيب مخروطيه ، تميل إلى ان تصبح أكثر قلوية مع مرور الوقت. ولذلك فمن المستحسن ان تشكل وسائل الاعلام الجديدة كامله الدوري الأميركي للمحترفين كل أسبوع ووسائل الاعلام كامله كل أسبوعين (المخازن المؤقتة المتوسطة في ظروف الغلاف الجوي ، وينبغي بالتالي ان تكون أكثر استقرارا). أخذ هذه النقاط في الاعتبار انه ينبغي ان يكون من الممكن إنشاء الخلايا المنقية الثقافات في اي مختبر مع الوصول إلى فرز الخلايا ومعدات ثقافة الخلية.
في معظم تجاربنا أنتجنا الثقافات النقية من الحيوانية واحده. ومع ذلك ، عند تنقيه الخلايا للتحليلات البيوكيميائية ، قد يكون من الضروري تجميع العديد من الكائنات معا للفرز. لقد نجحنا في فرز ما يصل إلى 8 فئران جنينيه (اليوم الجنيني 13 الحيوانية) باستخدام البروتوكول المذكور أعلاه (البيانات غير معروضه). ومع ذلك ، إذا كان من المقرر فرز المزيد من الماشية ، فقد يكون من الضروري زيادة حجم كل من الحلول الورقية والصربية (الموصوفة في الخطوات 2-1-1-2-1-4) لاستيعاب الزيادة في كميه الانسجه. بالاضافه إلى ذلك ، إذا تم طلاء المزيد من الخلايا في الثقافة ، ثم قد يكون هناك حاجه إلى جدول التغذية أكثر تواترا. كنقطه انطلاق ، يمكن تغذيه الخلايا كل 7 أيام عن طريق أزاله 100 μL من وسائل الاعلام المكيفة وأضافه 200 μL من وسائل الاعلام الجديدة كامله الدوري الأميركي للمحترفين. من أجل بقاء الخلايا العصبية ، وإذا فرز المزيد من الماشية ، وينبغي إعطاء الفكر للتقليل من وقت الفرز قدر الإمكان. وهذا يتطلب في كثير من الأحيان الأمثل الدقيق للتحليلات المصب للاستخدام الفعال للخلايا المنقية. لقد قمنا بفرز بشكل روتيني الخلايا العصبية الماوس بمعدلات 600 الاحداث/s ، ما يصل إلى 500000-800000 خليه لكل الحيوانية (يوم بعد الولادة 0-2). ومع ذلك ، كان هذا دون الأمثل شامله لسرعه الفرز والظروف. ولذلك ، ينبغي ان يكون من الممكن إدخال مزيد من التحسينات علي سرعه الفرز والغلة.
تتطلب الخلايا العصبية المنقية وسائل الاعلام المكيفة لبقاءها. وقد ثبت هذا من قبل من قبل الخلايا العصبية والكريات الطائرات الشراعية بشكل منفصل ، وقبل علاج العصبونات مع وسائل الاعلام المكيفة المنزلقة10. في تجاربنا ، اخترنا لدعم الخلايا العصبية المنقية عن طريق القيام بالزراعات الخلوية السطحية علي ادراج الخلية شبه نفاذيه ، والتي يتم وضعها داخل لوحه ثقافة الخلية. وقد تم تطبيق هذه الطريقة بنجاح لدراسة البروتينات المشتقة من الخلايا غير الخلوية وتفاعلها مع الخلايا العصبية12. عدم الاتصال ، ولكن الدعم المستمر المقدمة من هذا الأسلوب لديه عدد من المزايا بالمقارنة مع ثقافة منفصلة من الخلايا. وعلي الأخص ، فان الثقافة المشتركة للخلايا الددميه مع الخلايا العصبية تسمح للتنظيم المستمر وتكييف وسائل الاعلام الثقافة الخلية ، والتي تشبه بشكل وثيق في حاله الجسم الحي. الاضافه إلى ذلك ، فان الثقافة المشتركة المستمرة للخلايا تسمح بإشارات التغذية المرتدة المحتملة بين الخلايا العصبية والبقية ، وهو أمر غير ممكن في الثقافات المنفصلة. في البروتوكول الخاص بنا ، إذا لزم الأمر ، يمكن بسهوله حذف طريقه الثقافة المشتركة المستمرة ويمكن اجراء العلاج الكلاسيكي من الخلايا العصبية مع وسائل الاعلام المكيفة.
وباختصار ، يهدف البروتوكول المعروض هنا إلى تزويد القارئ بأساس متين يمكنه من خلاله تاسيس تجاربه الخاصة الخاصة بثقافة الخلايا المنقية. ونتوقع ان يستمر توافر الكائنات المحورة وراثيا والتركيبات الفيروسية في الزيادة في المستقبل المنظور. ولذلك ، فان تقنيات فرز الخلايا استنادا إلى الفلورية من المرجح ان تصبح أكثر استخداما وقيمه.
Disclosures
ويعلن صاحبا البلاغ انهما لا يملكان مصالح مالية متنافسة.
Acknowledgements
ويود أصحاب البلاغ ان يشكروا الدعم التقني الممتاز الذي قدمته جيني كيرش وانا تييشمولر في المرفق الأساسي لقياس التدفق الخلوي ، وهو المركز ألماني ريكوما-فورشونغزنتروم ، برلين. ونود ان نشكر جي سونغ علي مساعدته في تحليل البقاء علي قيد الحياة. ونود أيضا ان نشكر ريتا لورييرو علي مساعدتها في التقاط صور الفئران الفلورية وكريستيان ابنر للقراءة الناقدة للبروتوكول. وقد ولدت الفئران VGAT-فينوس المحورة وراثيا من قبل المؤسسة الوطنية للعلوم الفسيولوجية ، اوكازاكي ، m. هيباياشي و y. كاواجوتشي في معهد العلوم الفيزيولوجية ، Okazaki ، اليابان ، وذلك باستخدام pCS2 الزهرة التي قدمها الدكتور ا. مياواكي. ساندت هذا عمل كان بالمانيه بحث مجلس ([ديوتسكه] [فورسكهنغجيميندسكهفت], [دغ] [اكسك] 257 إلى [ايف]).
Materials
| Name | Company | Catalog Number | Comments |
| Neural Basal A media (NBA) | ThermoFisher Scientific | 10888022 | Cell Culture Buffer |
| B27 | ThermoFisher Scientific | 17504001 | Culture supplement |
| Glutamax | ThermoFisher Scientific | 35050-038 | Culture supplement |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140-122 | Antibiotic |
| Poly-L-Lysine | SIGMA | P1399 | Coverslip coating |
| Papain | SIGMA | P4762-1G | Enzyme |
| Bovine Serum Albumin | SIGMA | A3294-100G | Serum |
| Hibernate A low fluorescence media | Brain Bits Ltd | HALF | Cell Transport media |
| Dulbeccos Modified Eagles Medium (DMEM) | Biochrom | F0435 | Glial Culture Buffer |
| Fetal Calf Serum (FCS) | Biochrom | S0115 | Serum |
| Trypsin/EDTA | Biochrom | L2163 | Enzyme |
| Fine Tip Pasteur Pipette | Neo Labs | - | Used for trituration of cells |
| 24-well plates | BD | 353047 | Culture plate |
| 50 mL Falcon tubes | BD | 352070 | - |
| 15 mL Falcon tubes | BD | 352096 | - |
| Glass coverslips: 12 mm round | Roth | P231.1 | - |
| 35 mm Petri dish | Corning | 353001 | - |
| 100 mm Petri dish | Corning | 353003 | - |
| 30 µm CellTrics Cell Sieve | sysmex | 04-004-2326 | To remove cell clumps before cell sorting |
| Round bottom polystyrene tubes | BD | 352054 | Transport tube for sorted cells |
| Round bottom polypropylyne tubes | BD | 352063 | Collection tube for sorted cells |
| Cell culture inserts – 0.4 µm transparent PET | Falcon | 353 095 | For the co-culture of neurons and glia |
| Extra fine Bonn Scissors | Fine Scientific Tools | 14084-08 | To remove overlying skin and bone of mice |
| Extra narrow Scissors | Fine Scientific Tools | 14088-10 | To remove overlying skin and bone of rats |
| Forceps | Fine Scientific Tools | 11242-40 | To hold the head in place |
| Spatula (130 mm long/5 mm tip width) | Fine Scientific Tools | 3006.1 | To remove the brain to filter paper |
| Scalpel Blades | Swan-Morton | #0308 | To mechanically dissociate neural tissue |
| Haemocytometer (Neubauer Imroved) | Optik Labor | - | To cell count dissociated cells |
| Fluorescent Miners Goggles (excitation light) | Biological Laboratory Equipment Maintenance and Servce Ltd (BLS) | FHS/LS-1G | To excite TdTomato |
| Fluorescent Miners Goggles (emission filter) | Biological Laboratory Equipment Maintenance and Servce Ltd (BLS) | FHS/EF-4R2 | Td Tomato compatible emission filter |
| Fluorescent Miners Goggles (excitation light) | Biological Laboratory Equipment Maintenance and Servce Ltd (BLS) | FS/ULS-02B2 | To excite Venus |
| Fluorescent Miners Goggles (emission filter) | Biological Laboratory Equipment Maintenance and Servce Ltd (BLS) | FS/TEF-3GY1 | Venus compatible emission filter |
| Mouse-Anti-GFP primary antibodies | UC Davis | 75-132 | To enhance Venus signal following fixation |
| Mouse-Anti-GFAP primary antibodies | SIGMA | G-3893 | The identification of reactive astrocytes |
| Rabbit-Anti-CD11b primary antibodies | Southern Biotech | 1561-15 | The identification of microglial cells |
| Rabbit-Anti-MBP primary antibodies | Millipore | AB980 | The identification of oligodendrocyes |
References
- Radcliff, G., Jaroszeski, M. J. Basics of flow cytometry. Methods in Molecular Biology. 91, 1-24 (1998).
- Feher, K., Kirsch, J., Radbruch, A., Chang, H. D., Kaiser, T. Cell population identification using fluorescence-minus-one controls with a one-class classifying algorithm. Bioinformatics. 30 (23), 3372-3378 (2014).
- Sergent-Tanguy, S., Chagneau, C., Neveu, I., Naveilhan, P. Fluorescent activated cell sorting (FACS): a rapid and reliable method to estimate the number of neurons in a mixed population. Journal of Neuroscience Methods. 129 (1), 73-79 (2003).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Critical Reviews in Biotechnology. 37 (2), 163-176 (2017).
- Guez-Barber, D., et al. FACS purification of immunolabeled cell types from adult rat brain. Journal of Neuroscience Methods. 203 (1), 10-18 (2012).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Turko, P., Groberman, K., Browa, F., Cobb, S., Vida, I. Differential Dependence of GABAergic and Glutamatergic Neurons on Glia for the Establishment of Synaptic Transmission. Cerebral Cortex. , (2018).
- Uematsu, M., et al. Quantitative chemical composition of cortical gabaergic neurons revealed in transgenic venus-expressing rats. Cerebral Cortex. 18, 315-330 (2008).
- Goebbels, S., Bormuth, I., Bode, U., Hermanson, O., Schwab, M. H., Nave, K. -. A. Genetic targeting of principal neurons in neocortex and hippocampus of NEX-Cre mice. Genesis. 44, 611-621 (2006).
- Banker, G. A. Trophic interactions between astroglial cells and hippocampal neurons in culture. Science. 209, 809-810 (1980).
- Lindsay, R. M. Adult rat brain astrocytes support survival of both NGF-dependent and NGF-insensitive neurones. Nature. 282 (5734), 80-82 (1979).
- Geissler, M., et al. Primary hippocampal neurons, which lack four crucial extracellular matrix molecules, display abnormalities of synaptic structure and function and severe deficits in perineuronal net formation. Journal of Neuroscience. 33 (18), 7742-7755 (2013).
- Wang, Y., et al. Fluorescent labeling of both gabaergicand glycinergic neurons in vesicular GABA transporter (VGAT)-venus transgenic mouse. Neuroscience. 164 (3), 1031-1043 (2009).
- Höltje, M., et al. Role of Rho gtpasein astrocyte morphology and migratory response during in vitro wound healing. Journal of Neurochemistry. 95 (5), 1237-1248 (2005).
- Booker, S. A., Song, J., Vida, I. Whole-cell Patch-clamp Recordings from Morphologically- and Neurochemically-identified Hippocampal Interneurons. Journal of Visualized Experiments. , e51706 (2014).
- Pfrieger, F. W., Barres, B. A. Synaptic efficacy enhanced by glial cells in vitro. Science. 277 (5332), 1684-1687 (1997).
- Ullian, E. M., Sapperstein, S. K., Christopherson, K. S., Barres, B. A. Control of synapse number by glia. Science. 291, 657-661 (2001).
- Christopherson, K. S., et al. Thrombospondins are astrocyte-secreted proteins that promote CNS synaptogenesis. Cell. 120, 421-433 (2005).
- Berghuis, P., et al. Brain-derived neurotrophic factor controls functional differentiation and microcircuit formation of selectively isolated fast-spiking gabaergic interneurons. European Journal of Neuroscience. 20 (5), 1290-1306 (2004).
- Liddelow, S. A., et al. Activated microglia induce neurotoxic reactive astrocytes via Il-1α, tnfα, and c1q. Nature. 541, 481-487 (2017).
- Tomlinson, M. J., Tomlinson, S., Yang, X. B., Kirkham, J. Cell separation: Terminology and practical considerations. Journal of Tissue Engineering. 4, (2013).
- Brewer, G. J., Torricelli, J. R., Evege, E. K., Price, P. J. Optimized survival of hippocampal neurons in B27-supplemented Neurobasal, a new serum-free medium combination. Journal of Neuroscience Research. 35 (5), 567-576 (1993).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved