Method Article
Floresans ile kurulan Purified Gabaerojik veya glutamaterjik nöronların primer hücre kültürü-aktif hücre sıralama
Bu Makalede
Özet
Bu protokol, bir hücre sıralama temel yöntem, floresan gabaergic veya glutamaterjik nöronların neokorteks ve Hippocampus gelen postnatal fareler veya farelerin arıtma ve kültürü için açıklar.
Özet
Bu protokolün genel amacı, GABAergic veya glutamaterjik nöronlardan elde edilen saflaştırılmış nöronal kültürler oluşturmaktir. Saflaştırılmış nöronlar 16 gün içinde vitro için tanımlanmış medyada kültürlü olabilir ve tipik olarak ayrık kültürler üzerinde gerçekleştirilen herhangi bir analizler için imkan vardır, elektrofizyolojik dahil, morfolojik ve hayatta kalma analizleri. Bu kültürlerin en önemli avantajı, belirli hücre türlerinin, glial hücrelerden veya diğer nöron türlerinden kaynaklanan gibi karmaşık dış etkilerinin yokluğunda seçmeli olarak incelenebilir olmasıdır. Ancak, arıtılmış hücrelerle deneyler planlarken, nöronlar güçlü onların büyüme ve hayatta kalmak için glia-Klima medya bağlıdır dikkat etmek önemlidir. Buna ek olarak, glutamaterjik nöronlar daha da sinaptik iletim kurulması için glia-salgılanmış faktörlere bağlıdır. Bu nedenle aynı zamanda bir temas olmayan düzenleme nöronlar ve glial hücreler Co-kültürleme için bir yöntem açıklanmaktadır. Bu yöntemleri kullanarak, biz gabaergic ve glutamaterjik nöronal ağlar gelişimi arasında büyük farklar tespit ettik. Böylece, saflaştırılmış nöronların kültürlerinin incelenmesi sinir sisteminin nasıl geliştiğini ve işlevlerini anlamımızı sürdürmek için büyük bir potansiyele sahiptir. Ayrıca, arıtılmış kültürler farmakolojik ajanların doğrudan eylemini, büyüme faktörlerini veya belirli hücre türlerinde genetik manipülasyonların sonuçlarını araştırmak için yararlı olabilir. Daha fazla ve daha fazla transgenik hayvanlar kullanılabilir hale, ilgi ek belirli hücre türleri etiketleme, biz protokoller burada açıklanan kendi Uygulanabilirlik ve potansiyel büyüyecektir bekliyoruz.
Giriş
Hücre sıralama hücrelerin heterojen bir karışımı ilgi yaşam hücrelerinin yalıtım için güçlü bir araçtır. Hücreler boyut ve şekil ölçütlerine bağlı olarak, floresan işaretleyicilerinin1,2ifadesinin yanı sıra sıralanabilir. Genellikle, fluorophore-konjuke antikorlar hücre özgü yüzey antijenleri3,4hedefleme tarafından farklı hücre türlerini etiketlemek için kullanılır. Alternatif olarak, transgenik hayvanlar veya viral teslimat sistemleri, hücre spesifik promotörler5,6altında fluorophores ifade etmek için tasarlandı. Tarihsel olarak, transgenik araçların ve hayvanların gelişimi maliyetli ve zaman alıcı oldu. Daha yakın zamanda, Azalan maliyetler ve daha az teknik zorluklar mevcut muhabir hatları sayısında dramatik bir artış yol açmıştır. Transgenik araçların ve muhabir hayvanların mevcudiyeti büyümeye devam ederken, fluoresan tabanlı hücre sıralama yöntemlerinin kullanışlılığı ve uygulanabilirliğini de gerekir.
Son zamanlarda transgenik hayvanlardan gelen hücrenin, hücre kültürünü7' ye hazırlanırken primer nöronları arındırmak için rutin olarak uygulanacağını göstermiştir. Ya fareler veya fareler hücreleri sıralayarak, biz izole ve kültür floresan nöronlar, hangi gabaergic ya da glutamaterjik nöronlar özellikle floresan Reporter proteinleri ifade başardık6,8,9. Bu saflaştırılmış nöronal kültürler inceleyerek, biz gabaergic ve glutamaterjik nöronlar sinaptik iletim kurulması için glia-salgılanmış faktörlere bağlı şekilde önemli bir fark belirlemek başardık7. Ayrıca, saflaştırılmış nöronlar ile glial hücreler Co-kültür tarafından, biz, glial hücrelerin büyüme ve nöronların hayatta kalması kritik rolü gösteren önceki gözlemler uzatmak başardık10,11. Böylece, hücre sıralama ve hücre kültürünün bir kombinasyonu ile, biz izolasyonda spesifik nöron türlerinin gelişimini sadece çalışma başardık, ancak glial hücrelerin işlevlerinde etkisini araştırmak başardı.
Burada, transjenik fareler veya fareler korteks ve hipokampus gabaergic ve glutamaterjik nöronların arıtma ve kültürü için bir protokol sunuyoruz. Ayrıca Geissler ve ark.12' den uyarlanmış, saflaştırılmış nöronlar ve glial hücrelerin temas olmayan ortak kültürü için bir yöntem sunuyoruz. Saf Gabaerınjik kültürler oluşturmak için, biz VGAT-Venus-A Wistar Rats8 veya Vgat-Venus fareler13, seçici bir Gelişmiş Sarı floresan protein varyantı (Venüs) ifade floresan nöronlar sıralanmış var > 95% kortikal GABAerjik nöronlar. Arıtılmış glutamaterjik kültürler oluşturmak için, biz nexcre gelen floresan nöronlar sıralanmış var; AI9 fareler6,9, hangi hızlı tdtomato kortikal glutamaterjik nöronlar. Tüm sıralama ve kültür prosedürü 3-4 h içinde yapılabilir ve elektrofizyolojik, morfolojik ve hücre hayatta kalma analizi için uygun yüzlerce çoğaltmak kültürler oluşturmak için kullanılabilir. Yöntem basit, tekrarlanabilir ve% 97 ' den büyük olan saflaştırılmış nöronal kültürler elde edebilirsiniz hücre türü ilgi için saf.
Protokol
Tüm prosedürler ve hayvan bakımı kurumsal yönergelere uygun olarak, Alman hayvan refahı Yasası ve Avrupa Konseyi Direktifi 86/609/EEC hayvanların korunması ile ilgili olarak, yerel izinlerin varlığında gerçekleştirildi makamları (LaGeSo Berlin, T-0215/11).
Not: Bu protokol tek bir transjenik fare veya sıçan PUP (postnatal gün 0 – 2) tarafından saflaştırılmış nöronların kültürünü açıklar. Tüm teknikler steril koşullarda yapılmalıdır. Tüm çözümler 0,2 μm filtre kullanılarak sterilize edilmelidir (bkz. malzeme tablosu). Cam kapak ve diseksiyon aletleri ısı sterilize olmalıdır 3 saat 185 °C.
1. poli-L-lizin ile kaplama cam Coverfları
- 200 μg/ml Poly-L-lizin (PLL) çözeltisi 5 ml kısım buz çözme ile cam Cover, hazırlayın. 45 mL saf enjeksiyon suyu ekleyerek bu stok çözümünü 20 μg/mL 'ye seyreltin. Filtre-solüsyonu yeni 50 mL konik tüpüne sterilize edin. Bu tüpü "PLL steril" olarak etiketleyin.
Not: Buzlanma sürecini hızlandırmak için oda sıcaklığında saklanan suyu kullanın. - Steril PLL çözeltisi için 100 Steril, yuvarlak, 12 mm cam kapak ekleyin. Tüpü her 5 – 10 dakikada, 2 – 3 dakika boyunca, hatta kaplama sağlamak için karıştırın. Ceket 1 h için bu şekilde Cover,.
Not: Almanya 'da üretilmiş yuvarlak cam coverları (çap = 12 mm), güvenilir bir kültür yüzeyi sağlarsa ve 24-kuyu hücresi kültürü plakasının kuyularına kolayca sığması gibi tercih edilir. - PLL kaplama 40 dk sonra, doku kağıt 2 adet almak ve onları akış kabine düz yatıyordu. 70% etanol kullanarak kağıt sterilize, sonra kırışıklıkları kaldırmak ve kuru bırakmak için Düzleştir.
- PLL ile 1 h için cam Cover, kaplama sonra, aşırı PLL çözeltisi kaldırmak ve steril enjeksiyon sınıfı su ekleyin. Aşırı PLL 'nin kaldırılmasına izin vermek için coverfaları 2 – 3 s için yavaşça karıştırın. Bu durulama adımını 2 ek kez tekrarlayın.
- Fazla suyu çıkarın ve ardından coverları steril kağıt dokusuna aktarın. Kavisli forseps kullanarak her lamel magazini dikkatle ayırın ve kurumaya bırakın.
Not: Kolayca ayrı olmayan coverfiş atılabilir. Alternatif olarak, ayrılmaya yardımcı olmak için küçük bir miktar su eklenebilir. - Kuru bir kez, 24-Well kültür plaka için Cover, transfer.
Not: Kaplama işlemleri, diseksiyon işlemine başlamadan önce yaklaşık 30 dk – 1 saat hazır yapılmalıdır. Plakalar 37 °C ve% 5 CO2 ' de bir kuluçta saklanabilir.
2. hipokampal ve Kortikel dokusunun dağılma
- Hücre kültürü çözümlerinin hazırlanması
- Nöral dokunun dağılabilmesi için, ilk olarak 40 mL 'Lik bir hücre kültürü arabelleğini defrost (kompozisyon [mM]: 116 NaCl, 5,4 KCl, 26 NaHCO3, 1,3 Nah2Po4, 1 MgSO4· 7h2o, 1 CACL2· 2H2o, 0,5 EDTA · 2Na · 2H2O ve 25 D-glikoz, pH = 7,4). 12 mL hücre kültürü arabelleğini 15 mL konik tüpten ölçün; "BSA" olarak etiketleyin. 5 mL hücre kültürü arabelleğini farklı bir 15 mL tüpüne ölçün; "papain" olarak etiketleyin. 37 °C ' de 15 dakika boyunca su banyosunda her iki tüpü de kulküat.
- Filtre-kalan hücre kültürü tamponunu, etiketi "tampon-steril" olarak sterilize edin ve gerekli olana kadar 4 °C ' de saklayın.
- Ağırlığı 120 mg Sığır serum albumin (BSA) ve "BSA" etiketli tüp ekleyin. 7 mg papain dışarı tartım ve "papain" etiketli tüp ekleyin. İki tüpü 15 dakika boyunca su banyosuna geri dönün.
Not: Papain tozu transferini kolaylaştırmak için tartım teknesine küçük bir miktar tampon eklemek yararlıdır. - Tüm tozlar çözündüğünde, her bir solüsyonu taze 15 mL konik boruya filtreleyin. Tüp papain için, filtrelenmiş çözümü "papain-steril" olarak etiketleyin. Tüp BSA için, her biri 4 mL BSA çözeltisi içeren steril BSA çözümünü 3 tüplere bölün. Her tüpü "BSA-steril" ve "1", "2" veya "3" olarak etiketleyin. Tüm tüpleri su banyosuna geri dönün ve gerektiğinde 37 °C ' de inküymeye devam edin.
- Doku diseksiyonu için hazırlık
- 35 mm filtre kağıdı tek bir parça alın ( malzeme tablosunabakın) ve% 70 etanol ile sterilize; 100 mm Petri tabağı kapağında, bir akış kabininde kurumaya bırakın.
- Hippocampus ve korteks diseksiyonu için gerekli makas, forseps, neşter ve spatula ( malzeme tablosunabakın) koymak.
- Yer 2 35 mm Petri yemekleri ve akış kabine merkezinde erişilebilir bir konumda steril filtre kağıdı içeren bir 100 mm Petri çanak.
- Transjenik NexCre toplamak; AI9 ve VGAT Venüs Fare yavruları dissected olmaktır. Vahşi tip Littermates gelen floresan pups ayrımcılık için uygun uyarılma ve emisyon filtreleri ( malzeme tablosunabakın) ile bir floresan lamba kullanın.
- Hayvanları kesmeden hemen önce, her 35 mm Petri tabağı ile soğutulmuş, steril hücre kültürü arabelleği doldurun.
Not: Bir petri çanak disiksiyonlar arasındaki araçları temizlemek için, ve diğer hipokampus ve korteks toplamak için.
- Doku diseksiyonu
- En kısa sürede hücre kültürü tampon döküldü, bir postnatal gün 0 – 2 transjenik fare veya sıçan yavru büyük, keskin makas kullanarak ve sterilizasyon 100 mm Petri tabak akış kabine içine başını aktarmak için kullanın. Dikkatli bir transgenik yavru beyin steril filtre kağıt aktarmak için forseps, makas ve bir spatula kullanın.
- Bir tip 22 neşter kullanın ve serebellum uzakta ayırmak için 2 Yarımküre ayırın. Lateral hemheres rulo küçük bir spatula kullanın. Her Yarımküre üzerinde, yavaşça böylece korteks filtre kağıdı ile temas içine gelir basın. Nazikçe Hippocampus ve korteks ortaya çıkarmak için orta beyin bölgeleri taşıyın.
Not: Hemheres veya hücreler üzerinde bastırırken çok fazla basınç uygulamak için dikkatli olun ezilmiş hale gelebilir. - Hippocampus ve korteks her Yarımküre ayırmak için bir neşter veya spatula kullanın. Disseke dokuyu, soğutulmuş hücre kültürü arabelleği içeren 35 mm Petri tabağına aktarın.
Not: Birden fazla hayvanı kesiyorsanız, 50 mL konik tüpte steril hücre kültürü arabelleğini buzda saklayın. Her diseksiyondan sonra, disseke dokusu soğutulmuş hücre kültürü arabelleğine aktarın. - Cortico-hipokampal dokusunun başarılı diseksiyondan sonra, steril papain solüsyonu su banyosundan akış kabinesine aktarın. Disseke hipokampus ve korteks steril 35 mm Petri tabağı kapağına aktarmak için 3 ml Pasteur pipet kullanın. Bir Criss-Cross hareket Chop, bir tip 22 neşter düz kısmını kullanarak, doku küçük parçalara kadar.
- Petri çanağının kapağındaki doğranmış dokusu steril papain tüpüne aktarmak için küçük bir miktar papain çözeltisi kullanın. Papain tüpünü su banyosuna geri dönün ve 37 °C ' de 25 dak.
- Papain kuluçkan sırasında, tam floresan medya çözümü makyaj. Defrost bir 1 ml kısım B27, bir 0,5 ml kısım glutamax ve bir 0,5 ml kısım pen-strep. Aliquot 48,5 mL hazırda bekletme 50 mL konik tüpüne düşük floresan medya. Çözüme B27, Glutamax ve pen-strep ekleyin. İyi, sonra filtre sterilize ve etiket "hibernate A tam medya" (Tarih ve baş harfleri ile) çözüm Shake. 37 °C ' de su banyosuna inküye yapın.
- Papain kuluçarı sonrası, papain-tüp ve steril BSA-tüpleri akış kabinine aktarın. Papain tüpünden sadece korico-hipokampal dokusunu BSA-tüp 1 ' e çıkarmak için 1 mL Pasteur pipet kullanın.
Not: Aşırı papain çözeltisi transferini en aza indirmek için özen yapın.
- Hücrelerin dissociation
- Herhangi bir büyük doku kümesini kırmak için 1 mL Pasteur pipet kullanarak dokuyu birkaç kez triturate. Bunun ardından, güzel bir bahşiş Pasteur pipet kullanarak doku 7 kez triturate. 30 sn için doku bırakın, daha büyük doku parçaları sediment izin.
- 30 s sonra, 1 mL solüsyonu ve dokusunu BSA-Tube 1 ' den BSA-Tube 2 ' ye aktarın. Güzel bir bahşiş Pasteur pipet kullanarak BSA-Tube 2 ' deki dokuyu birkaç kez triturate.
- Tritürasyon sonrası, BSA-Tube 1 ' den daha düşük 1 mL doku ve solüsyonu tekrar aktarın, ancak şimdi BSA-Tube 3 ' e gidin. Güzel bir bahşiş Pasteur pipet kullanarak BSA-Tube 3 ' te dokuyu birkaç kez triturate.
- Triturasyon sonrası, 2 ve 3 numaralı tüplerden tüm solüsyonu ve dokusu BSA-tüp 1 ' ye aktarın. Daha fazla 2-3 kez triturate ve 3 dakika için 3.000 x g Santrifüjü.
- Santrifüjleme sırasında, tam neural bazal bir medya (NBA medya) makyaj. Aliquot 48,5 mL bir 50 mL konik tüp için NBA medya ve bir su banyosunda 37 °C ' de inküat. Etiket bu tüp "sadece NBA". Ayrıca, bir 1 ml kısım B27, glutamax bir 0,5 ml kısım ve oda sıcaklığında pen-strep bir 0,5 ml kısım defrost.
- Santrifüjleme sonrasında, süpernatant 'ı pelletli dokudan dikkatle çıkarın ve 2 ml 'lik tam medya içinde hücreleri yeniden askıya alın. Dokusunu 20 kez yukarı ve aşağı triturate için bir P1000 pipet kullanın.
Not: Hücreleri çok güçlü bir şekilde pipet etmeye dikkat et. Çok fazla basınç uygulandığında, hücreler zarar görebilir. - Hücre süspansiyonunu bir polistiren numune tüpüne 30 μm hücreli elek aracılığıyla filtrelemek için 1 mL Pasteur pipet kullanın.
Not: Hücre süspansiyon hemen hücre elek üzerinden geçmiyorsa, akış başlatmak için steril bir eldiven ile elek üstüne basın gerekli olabilir. Bu önemli adım , hücre sıralayıcısı tıkanmasını önler. - Sıralamadan sonra nöronlar toplamak için, gerekli sayıda Polipropilen tüpün tam medya 300 μL pipetleme ile toplama tüpleri hazırlayın.
- Hücre süspansiyonu şimdi sıralama için hücre sıralayıcısı alınacak hazırdır. Hücre süspansiyonu alın, ekstra toplama tüpleri ve yedek parça komple medya numunenin seyreltme gereklidir.
3. hücre sıralama Purified GABAergic veya Glutamatergic neurons
Not: Sıralama sırasında bakteriyel kontaminasyon olasılığını en aza indirmek için, Sıralayıcı numune tüpünü, sıralama işleminden en az 5 dakika önce 70% etanol ile durulayın. Ayrıntılı sıralama parametreleri araçlar arasında farklılık gösterir, temel hususlar aşağıdaki gibidir.
- İlk hücre sıralaması sırasında, vahşi bir tür hayvandan hücreleri sıralayarak ve karşılaştırarak etiketlenmemiş hücrelerden arka plan floresans düzeylerini oluşturun.
- Her floresan hücre türünün sıralanması için uygun uyarılma ve emisyon filtrelerini seçin. Sırasıyla 488 nm veya 531 nm uyarma dalga boyları kullanarak Venüs ve TdTomato proteinlerini Excite. Sırasıyla 530/40 ve 575/30 emisyon filtre setleri aracılığıyla yayılan ışığı algılayın.
- Hücre toplama için hücre sıralayıcısı, tam medya 300 μL içeren Polipropilen toplama tüpleri ekleyin.
- Yüksek saflıkta, parlak etiketli floresan hücreleri sıralayın (bkz. Şekil 1B örneğin sıralanmış hücrelerin nokta grafikleri).
- En iyi sonuçlar için sıralamayı takiben, saflık düzeylerini tahmin etmek için sıralanmış hücrelerin bir saflık testi gerçekleştirin. Sıralamayı izleyen hücrelerin tipik kurtarma oranının% 70-80 arasında olduğunu unutmayın.
- Her koleksiyon tüpünde sıralanmış hücre sayısını not edin. Bu değer, hücre sıralama aleti tarafından verilir.
Not: Hücre sıralama 70 μm nozul (70 psi kılıf sıvı basıncı) veya 100 μm nozul (20 psi kılıf sıvı basıncı) kullanılarak gerçekleştirilebilir.
4. sıralanmış nöronların kültürü
- Hücre sıralamanın ardından, 1 mL Pasteur pipet kullanarak toplanan hücreleri 2 mL yuvarlak alt santrifüjlere aktarın. Hücre Pelet oluşturmak için 3 dakika 3.000 x g 'de hücreleri santrifüjler.
Not: Hücre Pelet konumunu belirlemeye yardımcı olmak için, yuvarlak alt santrifüjli tüpler dışa dönük kapak menteşe ile oryantasyon, hangi hücre Pelet Santrifüjü tüp arkasında formu sağlar (yani, menteşe olarak tüp aynı tarafında). - Santrifüjleme sırasında, 1 mL B27, 0,5 mL Glutamax ve 0,5 mL pen-strep ' i k i ön ısıtılmış NBA medyasını 48,5 mL 'ye ekleyin. İyi, sonra filtre sterilize ve etiket "NBA komple medya" (Tarih ve baş harfleri ile) çözüm sallayın. Gerekli olana kadar su banyosuna dönün.
- Santrifüjleme sonrasında, süpernatant 'ı farklı bir santrifüj tüpüne aktarmak için 1 ml Pasteur pipet kullanın (hücre peleti rahatsız edildi süpernatant örtmek korumak). Hücre/μL 1.000 hücre yoğunluğunu elde etmek için ön-ısıtılmış komple NBA medya gerekli miktarda cep Pelet yeniden askıya. P200 veya P1000 pipet ile yukarı ve aşağı pipetleme ile hücreleri yeniden askıya alın.
- Ayrılmış hücrelerin varlığını onaylamak için, 4X veya 10X objektif bir objektif kullanarak, mikroskop altında hücre çözümünü kontrol edin. Alternatif olarak, küçük bir miktar hücre çözümünü bir lamel magazini üzerine pipet ve mikroskop altında kontrol edin. Çok sayıda hücre varsa, adım 4,3 süpernatant atılabilir.
- Hücreleri kaplamadan önce, 2-3 s için orta hızda Vortex, hatta hücre süspansiyonu sağlamak için. En kısa sürede, hızlı bir şekilde 10 μL hücre süspansiyon her coverslip merkezine pipet. Hücreleri pipetleme yaptıktan sonra, her plakayı hızlı bir şekilde kuluçağa (5% CO2/37 °c) dönün ve 1 saat boyunca inkübe edin.
Not: Birden fazla 24-kuyu plakaları için hücre ekleme, plakalar arasında hücreler vortekslenir tarafından bile hücre yoğunlukları emin olun. - 1 saat sonra, 500 ile hücreleri beslemek ön-ısıtılmış komple NBA medya μL ve kuluçk dönün.
Not: Hücreleri beslerken, hücre dekolmanı önlemek için medyayı yavaşça kuyu tarafına pipet etmek önemlidir. Kısa deneyler için (< 16 gün), yukarıdaki yoğunlukta beslenme gerekli değildir. Hücrelerin daha fazla yoğunluğunu kaplamasını yaparken, daha sık beslenme aralıkları gerekebilir ( tartışmakonusuna bakın).
5. astrocyte zenginleştirilmiş glial destek kültürler
Not: Glial kültürler14 üretimi ve hücre kültürü ekler kullanımı daha önce açıklanan12. Kısacası, astrosit zenginleştirilmiş glia kültürler cortico-hipokampal dokudan türetilir (meningler kaldırıldı; P2-P5), bir hafta boyunca bir 20 μg/mL PLL-kaplamalı 6-kuyu plakaları, serum tamamlayıcı DMEM medya üzerinde kültürlü olmuştur.
- Co-Culture saflaştırılmış nöronlar ve glial hücreler için, geçiş confluent glial hücreler hücre kültürü ekler gerekli sayıda (0,4 μm gözenek boyutu- malzeme tablosunabakın). Hücreler arasında geçiş yapmak için, 2 mL ön ısıtılmış (37 °C) fosfat tamponlu tuz (PBS) ile 2 kuyu, iki kez, kuluçağından confluent glial hücreleri içeren 6 kuyu plakasını çıkarın.
- PBS çözümünü aspirate ve 1 mL ön ısıtılmış (37 °C) tripsin (1:250)/EDTA (% 0,25/0.02%) eklemek için bir P1000 pipet kullanın Her kuyu için çözüm.
- 6-kuyu plakasını kuluçağa dönün ve hücre dekolmanı için her 2 – 3 dakikada bir kontrol edin.
- Önemli bir hücre dekolmanı oluştuğunda, hücreler ve hücre çözümünü hafifçe yukarı ve aşağı ince bir ipucu Pasteur pipet kullanarak pipet, daha fazla ayrışma ve bireysel hücrelerin ayrılması yardımcı olmak için.
- Hücre çözümünü 15 mL Konik Tüpe aktarın ve 3.000 x g 'de santrifüjle 3 dakika boyunca santrifüj yapın.
- Hücre peleti çözelti kadar yavaşça yukarı ve aşağı pipetleme tarafından ön ısıtılmış (37 °C) NBA komple medya 5 mL bir P1000 pipet kullanarak hücreleri yeniden askıya.
- Bir hemokytometer veya otomatik hücre sayacı kullanarak bir hücre sayısı gerçekleştirin.
Not: Kültür 7 gün sonra, yaklaşık 750000-1000000 hücreler her iyi bir 6-kuyu plaka hasat edilebilir. - Plaka 40.000 glial hücreler her hücre kültürü için bir 500 μL damlacık (80 hücreler/μL) ekleyin.
- Hücrelerin 1 h için uygun izin verdikten sonra, 24-kuyu plakaları saflaştırılmış nöronlar içeren glial kaplı hücre kültürü ekler aktarmak için steril forseps kullanın. Hücre kültürü ekler (yaklaşık 300 μL) yüzeyinden aşırı medya kaldırın.
Not: Hava kabarcıkları genellikle hücre kültürü ekler altında sıkışıp alabilirsiniz gibi, yavaşça bu kabarcıklar kurtulmak için ekler Tilt gerekli olabilir. Hücre kültürü eklemek için daha fazla glial hücreler eklenirse, daha fazla yıkama ve santrifüjün adımları hücre hayatta kalma için zararlı olabilir aşırı tripsin, kaldırmak için gerekli olabilir.
Sonuçlar
Floresan nöronların transjenik fare veya sıçan cortico-hipokampal dokudan kesilmesi ve hücre sıralaması yaklaşık 3 – 4 saat içinde gerçekleştirilebilir. Sonuç, 16 gün boyunca kültürde yetiştirilebilir, son derece saf floresan nöronların bir popülasyon.
Saflaştırılmış kültürler oluşturmak için, transgenik hayvanlar ilk olarak uygun filtre setleri ile floresan lamba kullanılarak tespit edildi (floresan yenidoğan vgat Venüs ve nexcre örnekleri; AI9 fare yavruları Şekil 1a'da gösterilir). Transgenik hayvanların tanımlanmasını takiben, disseke doku dağılmıştı, ve en güçlü floresan nöronlar bir arıtılmış hücre nüfus üretmek için sıralanır. Örnek floresan yoğunluğu nokta çizimleri NexCre için; AI9 ve VGAT Venüs Fare nöronlar, FACS sırasında elde edilen, Şekil 1Bgösterilir. Optimize edildiğinde, 500.000 ve 800.000 hücreleri arasında hasat etmek mümkündür, bireysel P0-2 NexCre korteks ve Hippocampus; AI9 veya VGAT Venüs fareler. Hücreler 600 olaylar/s bir hızda yukarı sıralanabilir. hücre saflığının tahminleri, nükleer Marker olarak DAPı kullanılarak yapılmıştır (Şekil 1C). Güçlü pozitif hücreleri sıralayarak,% 97 ' den fazla saflık rutin olarak7elde edilebilir.
Başarılı sıralamanın ardından, kaplama nöronlar şeklinde yuvarlak görünmesi gerekir, pürüzsüz bir membran var ve yaklaşık sonra nöronlar spaya görülmelidir 1 h in vitro (Şekil 2a, B). 7 gün içinde vitro olarak, bazı hücre ölümü belirgin olabilir, ancak tüm kültür koşullarında uygun hücreler bulunmalıdır (Şekil 2C, D). 12 – 16 gün içinde vitro, tam hücreli yama-kelepçe kayıtları ve biocytin-doldurma15kullanarak, saf nöronların morfolojik ve elektrofizyolojik gelişimini araştırmak mümkündür (Şekil 3). Arıtılmış kültürlerin Analizi hem glutamaterjik ve GABAerjik nöronların hücre organları (Şekil 3A, B) akons ve dendritler genişletmek için mümkün olduğunu ortaya çıkarır ve yanıt olarak eylem potansiyelleri oluşturmak için yeteneğini korumak suprathreshold mevcut enjeksiyonları depolarizan (Şekil 3c, D). Özellikle, ancak, arıtma aşağıdaki, sadece gabaerojik nöronlar spontan sinaptik iletim önemli miktarlarda alınan, ve glutamaterjik nöronlar glial hücrelerin yokluğunda çok az sinaptik iletim almak (Şekil 3e , F) 7' ye kadar.
Daha önce rapor ettiğimiz gibi, saflaştırılmış kültürlerdeki hücreler, sıralanmamış kültürlerde olandan daha kötü hayatta kalmak ve önemli ölçüde küçük dendritler ve akons7eğilimindedir. Bu açıkları aşmak için, glial hücreler ile saflaştırılmış kültürlerin gelişimini desteklemek için uyarlanmış ve uygulamalı yöntemler var12,14. Glial destek Kültürlerimizin hücresel bileşimi (DIV7) Şekil 4A'da gösterilir. Bu kültürler ağırlıklı olarak glial fibriler asidik protein (GFAP) pozitif astrositler içerdiği, aynı zamanda farklılaşma molekül (CD11b) pozitif mikroglia ve miyelin temel protein (MBP) pozitif oligodendrocytes bazı küme içeriyordu. DIV 7 ' den sonra, bu hücreler, arındırılmış nöronların (Şekil 4b, C) temassız destek sağlamak için hücre kültürü ekler için pasajlı olabilir. Glia-nöron Co-kültürler Analizi yaklaşık 40.000 glial hücrelerin uzun vadeli hayatta kalma ve hem de arıtılmış glutamaterjik ve gabaergic nöronların büyümesini artırmak için yeterli olduğunu ortaya çıkarır (Şekil 4d, E)7. Ayrıca, elektrofizyolojik analiz bu glutamaterjik nöronlar, glial hücreler ile birlikte kültürlü ortaya çıkarır, son derece aktif ve güçlü bir ağ aktivitesi arttı (glial desteklenen glutamaterjik nöronların yüzdesi eylem patlamaları ateş potansiyeller: 62%; n = 28; Şekil 4F , G). Glial desteği bu nedenle sadece nöron büyüme ve hayatta kalma teşvik için değil, aynı zamanda sinaptik iletim ve glutamaterjik kültürlerde ağ aktivitesinin kurulması teşvik için önemlidir.
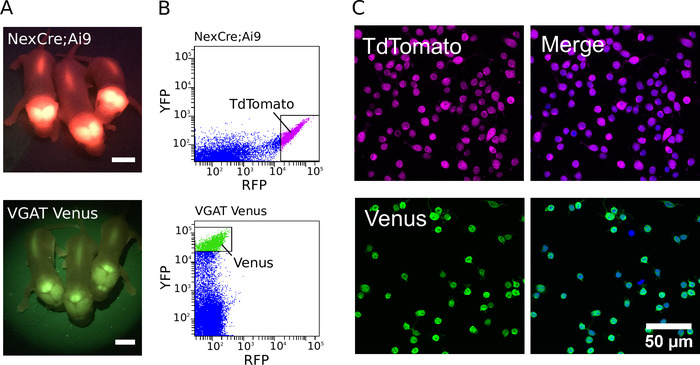
Şekil 1: glutamaterjik ve gabaerojik nöronların arıtılması. (A) NexCre 'de TdTomato transgen ifadesinden floresan sinyali gösteren görüntüler; AI9 fareler (üst) ve Venus VGAT Venüs fareler (alt). Ölçek çubukları = 5 mm. (B) NexCre gelen cortico-hipokampal ayrık hücrelerin TdTomato ve Venüs floresans yoğunluğu dağılım çizimleri; AI9 fareler (üst) ve VGAT Venüs fareler (alt). Sıralama için güçlü floresan tdtomato veya Venus nöronlar seçildi (gating kutuları ile gösterilir). (C, sol) Sıralı TdTomato (üst) ve Venüs (alt) pozitif nöronların Konfokal görüntüler. (C, sağ) DAPı ile (mavi pseudocolour) birlikte lekelenmiş hücreleri gösteren birleştirilmiş görüntü. TdTomato floresans endojen ve fiktasyon rağmen güçlü kalır (Magenta pseudocolor). Venüs ifadesi, GFP ve Alexa Fluor-488-konjuze ikincil antikor (yeşil pseudocolor) karşı yönlendirilmiş bir primer antikor kombinasyonu kullanılarak geliştirilmiştir. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
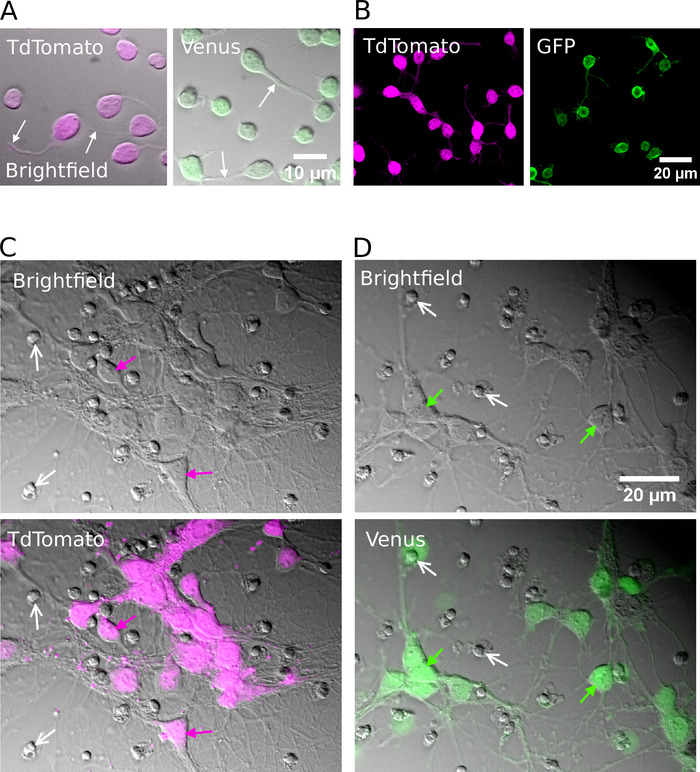
Şekil 2: arıtılmış glutamaterjik veya gabaerojik nöronların hücre kültürü. (A) kombine kızılötesi (parlak alan) görüntüler ve TdTomato (sol) ve Venüs (sağ) pozitif nöronlar 1 h in vitro için Kültürlenmiş gelen floresan sinyali. Beyaz oklar büyüyen nöronların yerini gösterir. (B) TdTomato (sol) ve Venüs (sağ) pozitif nöronlar 1 h in vitro için kültürlü konfokk görüntüler. (C, D) Parlak alan (üst) ve kombine parlak alan ve floresan görüntüleri (alt) TdTomato (C) ve Venüs pozitif nöronlar (D) için kültür 7 gün içinde vitro (DıV). Beyaz oklar ölü hücrelerden yoğuşmalı çekirdeklerin yerini gösterir. Renkli oklar floresan etiketli nöronları tanımlar. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
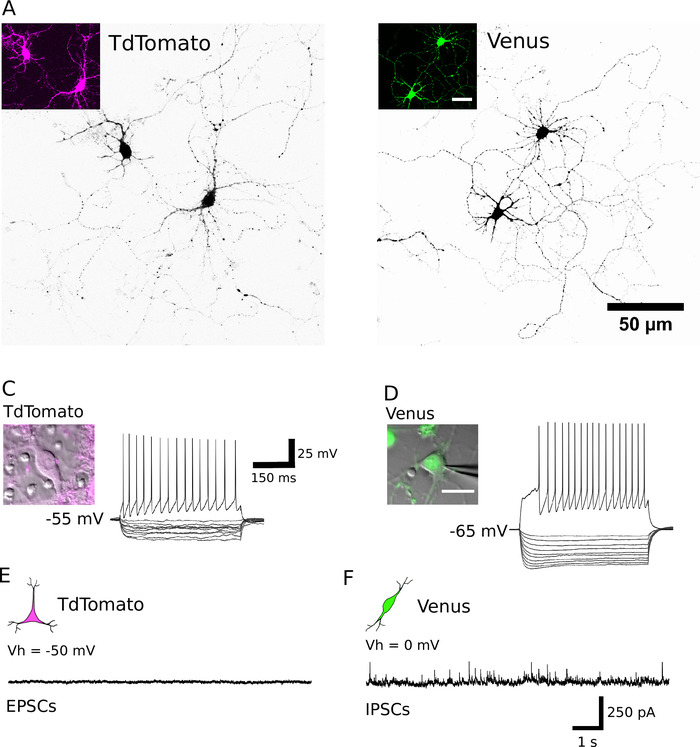
Şekil 3: saflaştırılmış nöronların morfolojik, elektrofizyolojik ve sinaptik özellikleri. (A, B) TdTomato (A) ve Venus pozitif nöronların (B) DıV 13 ve DıV 14 ' teki Konfokal görüntüleri sırasıyla. Hücreler, nörit görselleştirme yardımcı olmak için ters bir görünüm tablosu kullanarak siyah sunulur. İnsets tanımlanan nöronlar tarafından ifade floresan sinyali gösterir. (C, D) Bir tdtomato (C) ve Venüs pozitif nöron (D) ' den hiperpolarize edilen voltaj tepkisi (200-20 PA, 20 PA basamaklarında) ve depolarizan (200 PA) akım darbeleri, tüm hücreli yama kelepçe kayıtları ile elde edilir. İnsets karşılık gelen kaydedilmiş nöronlar gösterir. Her hücrenin dinlenme membranı potansiyeli, kayıt izini sol tarafta gösterilir. (E, F) Tdtomato (E) ve Venus Positive nöronlar (F) ' dan alınan temsilci gerilim-kelepçe kayıtları (10 s). Spontan uyarıcı postsinaptik Olaylar (EPSCs) TdTomato pozitif neurons kaydedildi, 50 mV bir tutma potansiyeli tutulan. Kendiliğinden meydana gelen inhibitör postsinaptik Olaylar (IPSCs) 0 mV bir tutma potansiyeli tutulan Venüs pozitif nöronların kaydedildi. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
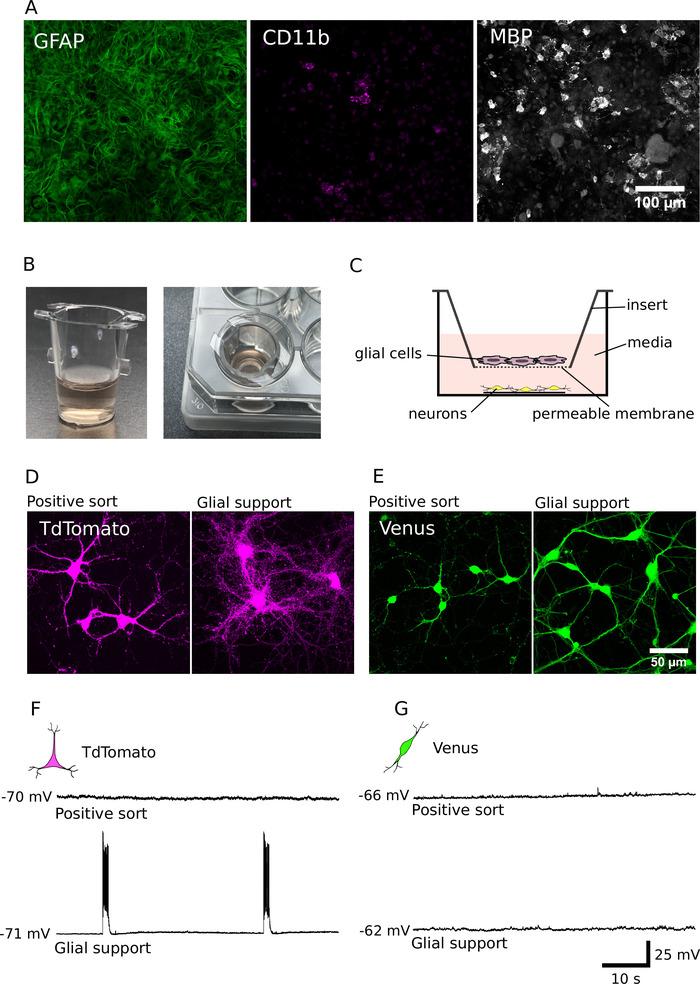
Şekil 4: glial Co-Culture ile nöron gelişimini destekleme. (A) glial fibrillü asidik PROTEIN (GFAP, sol), diferenfik molekül kümesi (CD11b, orta) ve miyelin temel protein (MBP, sağ) için immünolabeled glial kültürlerin konfoksel görüntüleri. Glial hücreler DıV 7 için Kültürlenmiş. (B) iletişim olmayan bir düzenlemede saflaştırılmış nöronlar ile ortak kültür glial hücrelere kullanılan hücre kültürü eklemlerinin görüntüleri. (C) bir mekansal düzenleme bir şematik Co-Culture nöronlar ve glia için kullanılır. (D, E) Tdtomato (D) ve Venüs pozitif nöronlar (E), 14 gün boyunca yetiştirilen, Devamsızlık (sol) veya glial destek varlığı (sağ) konfoksal görüntüler. (F, G) Geçerli-kelepçe kayıtları (60 s) TdTomato (F) ve Venüs pozitif nöronlar (G) kültüre 14 gün devamsızlık (üst) veya varlığı (alt) glial destek. Nöronlar kendi istirahat membranı potansiyeline kaydedildi (her kayıt izini sola sundu). Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
Tartışmalar
Burada sıralama ve primer nöronların yetiştirme birleştiren bir yöntem saf nöronal hücre kültürlerini oluşturmak için tarif. Bu yöntem yaklaşık alır 1 normal birincil Disosiye nöronal kültür protokolünden daha uzun saat henüz belirli nöronal türleri içeren çoğaltmak kültürler yüzlerce nesil için izin verir. En az 16 gün boyunca izolasyonda yetiştirilen, akons ve dendritler uzatmak ve eylem potansiyelleri tekrarlayan trenler ateş edebilir saflaştırılmış nöronlar (Şekil 2 ve Şekil 3). Daha da önemlisi, bu hücreler, elektrofizyolojik, morfolojik ve hayatta kalma analizleri de dahil olmak üzere düzenli primer kesilmeli nöronal kültürler gibi aynı deneysel analizlere imkan tanır. Bu saflaştırılmış kültürlerle çalışmanın büyük bir yararı, spesifik hücre türlerinin gelişiminin izolasyonda incelenmesini sağlarken. Saflaştırılmış kültürlerin gelişimini desteklemek için, ayrıca glial hücrelerle birlikte arıtılmış nöronlar için bir protokol sunuyoruz. Daha önce gösterildiği gibi, glial hücreler ile saf nöronlar yaşam, büyüme geliştirir ve ağ oluşumu yükseltebilirsiniz7 (Şekil 4). Böylece, burada daha fazla glia-nöron etkileşimleri çalışma ve geliştirme ve ilgi diğer hücre türleri arasındaki etkileşimi incelemek için yararlı olabilir gerektiğini gösteren yöntemlerin bir kombinasyonu sunuyoruz.
Saflaştırılmış glutamatergik nöronların kültürlerinde yapılan çalışmalar, glial hücrelerin nöronal ağlar ve sinapse oluşumunun gelişimini teşvik eden faktörleri salgılaştırması yönünde temel Öngörüler ortaya koymuştur16,17,18 . Genel olarak, spesifik nöron türleri arındırma için yöntemler daha başarıyla glutamaterjik nöronlar yerine gabaergic nöronlar gelişimini incelemek için uygulandı. Bu, bu iki hücre türünün nasıl gelişebilmesini anlayışımızda bir eşitsizlik yol açmıştır. Bu gabaergic ve glutamaterjik nöronların anatomi, fizyoloji ve gelişimsel kökenleri açısından önemli ölçüde farklılık göz önüne alındığında, biz kendi sağ GABAerjik nöronlar çalışması, daha iyi onların fonksiyon ve fizyolojisi anlamak için hayati önem taşımaktadır. Burada sunulan protokolü kullanarak, daha önce gabaergic ve glutamaterjik nöronların sinaptik iletim7kurulması için glia-salgılanmış etkenlere bağlı şekilde önemli farklar tespit ettik. Bu protokol yayımlayarak, başkalarının nöronlar ve glial hücreler arasındaki önemli etkileşimler daha fazla anlayış yapabilirsiniz umuyoruz.
Bu protokolde, biz farklı transgenik kemirgen hatları gabaergic veya glutamaterjik nöronları arındırmak için kullanılan bir akış sitometri tabanlı hücre sıralama yöntemi, tarif. Venüs pozitif GABAerjik nöronlar vgat Venüs fareler sıralanır13 veya Rats8 ve tdtomato pozitif glutamaterjik nöronlar nexcre sıralanır; AI9 fareler (aslen NexCre9 ve AI9 Reporter Lines6' dan yetiştirilen, bkz: türko ve al., 20187). Son yıllarda, teknolojik gelişmeler nedeniyle, transgenik hayvanların üretimi önemli ölçüde daha kolay hale gelmiştir. Bu nedenle, birçok farklı hücre tiplerinde, floresan molekülleri ifade hayvanların kullanılabilirliği hızla büyüdü. Bu, sırayla, floresan aktif hücre sıralamanın kullanımını ve uygulanabilirliğini artırmıştır. İlgi hücreleri izole etmek için alternatif yöntemler şu anda var16,19,20, onlar biraz doğal yüzey meydana gelen uygun antikorların kullanılabilirliği üzerinde bağımlılığı tarafından engellenmektedir Antijen. Bu, floresan tabanlı hücre sıralama yöntemleri ile karşılaştırıldığında, zaten mevcut olan birçok hücreye özgü transgenik muhabir hayvanlardan hücreleri sıralamak için kullanılabilecek çok yönlülüğünü sınırlar. Yine de, optimize edildiğinde, antikor tabanlı sıralama yöntemleri hızlı ve yüksek verim olabilir ve hatta daha iyi hücre anatomisini korumak, kendi akons ve dendritler bozulmamış21ile hücrelerin arıtma izin vererek. Bu nedenle bir sıralama stratejisine karar verirken antikor sıralama yöntemleri yine de dikkate alınmalıdır. Sonuçta, ilgi hücre türü, hangi hücrelerin sıralanacağı yaş, transgenik hayvanların veya yüzey antijenlerinin kullanılabilirliği ve gerekli hücre sayısı en uygun sıralama stratejisini seçerken belirleyici faktörler olacaktır.
Floresan tabanlı hücre sıralama hücreleri arındırmak için basit ve tekrarlanabilir bir yöntem olmasına rağmen, hücre kalitesini korumak için protokolün belirli adımlar sırasında bakım alınmalıdır. Örneğin, her santrifüjleme adımının ardından, hücre Pelet mümkün olduğunca hızlı bir şekilde yeniden askıya olduğundan emin olmak önemlidir ve hücreler başarıyla kurtarıldı. Bazen, hücre Pelet supernatant çıkarmadan rahatsız edilebilir. Bu nedenle, santrifüjleme adımları arasında, mikroskobun altındaki hücrelerin varlığını kontrol etmek için herhangi bir kapsamlı hücre kaybını göz ardı etmek tavsiye edilir. Hücre kaplamasını takiben, hücrelerin beslenmeden önce en az 1 saat uymasına izin verilmelidir. Hücreler çok erken besleniyorsanız, bazı hücreler coverslip 'dan çıkmış olabilir, böylece kültür yoğunluğunu azaltır. Kültür 1 saat sonra, hücre sağlığını değerlendirmek için akıllıca olduğunu. Hücreler sağlıklı görünmüyorsa ( Şekil 2a'da sağlıklı hücrelerin bir örneği gösterilir) veya önemli hücre ölümü varsa, bu, ayrışma veya sıralama prosedürü sırasında bir sorunun belirtisi olabilir. Herhangi bir hücre türü kültür, daha önemli bir göz, hücre kültürü medya yönetirken dikkatli olmaktır. NBA medyası, pH göstergesi22olarak hareket eden fenol kırmızısı içerir. Eğer medya çok sarı renkte olur, o zaman bu pH çok asidik olduğunu gösterir; medya çok pembe olur, o zaman bu çözümün çok alkalin olduğunu gösterir. Stok çözümleri uzun süreler için açık, özellikle konik borular içine seyreltilmemeli medya, zaman içinde daha alkalin olma eğilimindedir. Bu nedenle her hafta ve komple medya her iki hafta taze komple NBA medya yapmak için tavsiye edilir (atmosferik koşullar altında orta tamponlar ve bu nedenle daha istikrarlı olmalıdır). Bu noktaları dikkate alarak, hücre sıralama ve hücre kültürü ekipmanına erişimi olan herhangi bir laboratuvarda arıtılmış hücre kültürlerini kurmak mümkün olmalıdır.
Deneylerimizin çoğunda, tek bir hayvandan arındırılmış kültürler üretiyoruz. Ancak, biyokimyasal analizler için hücreleri arındırırken, sıralama için birden fazla hayvanı birlikte havuza almak gerekebilir. Biz başarıyla yukarıda protokol (veri gösterilmez) kullanarak 8 embriyonik fareler (embriyonik gün 13 hayvan) kadar sıralanır. Ancak, daha fazla hayvan sıralanacak ise, doku miktarında artış karşılamak için her iki papain ve BSA çözeltileri (2.1.1-2.1.4 adımda açıklanan) hacmi artırmak için gerekli olabilir. Ayrıca, daha fazla hücre kültürde kaplama ise, daha sık bir beslenme programı gerekebilir. Bir başlangıç noktası olarak, hücreler her 7 günde bir 100 μL tarafından ayarlanabilir medya kaldırarak ve 200 μL taze komple NBA medyası ekleyerek beslenebilir. Nöron viability uğruna, daha fazla hayvan sıralama ise, mümkün olduğunca sıralama süresini minimize etmek için düşünce verilmelidir. Bu genellikle arıtılmış hücrelerin verimli kullanımı için aşağı akış analizlerinin dikkatli optimizasyonu gerektirir. Biz rutin olarak sıralanmış fare nöronlar 600 olaylar/s, en fazla 500,000-800.000 hücre hayvan başına (postnatal gün 0 – 2) oranlarında. Ancak, bu sıralama hızları ve koşulları kapsamlı optimizasyon olmadan oldu. Bu nedenle, sıralama hızı ve verim daha fazla iyileştirmeler mümkün olmalıdır.
Saflaştırılmış nöronlar onların hayatta kalması için glia-Klima medya gerektirir. Bu daha önce glial Klima medya ile nöronlar tedavi etmeden önce, ayrı olarak, nöronlar ve glial hücreler kültür tarafından gösterilmiştir10. Bizim deneylerde, biz hücre kültürü plaka içine yerleştirilir yarı geçirgen hücre kültürü ekler, glial hücreler kültür tarafından saflaştırılmış nöronlar desteklemek için seçti. Bu yöntem, glia türevi ekstrellüler matris proteinleri ve nöronlar12ile etkileşimi çalışmak için başarıyla uygulandı. Kişi olmayan, ancak bu yöntem tarafından sağlanan sürekli destek hücrelerin ayrı kültüre kıyasla bir dizi avantaj vardır. En önemlisi, nöronlar ile glial hücrelerin Co-Culture sürekli düzenleme ve hücre kültürü medya, daha yakından in vivo duruma benzeyen Klima sağlar. Buna ek olarak, hücrelerin sürekli ortak kültürü, ayrı kültürlerde mümkün olmayan nöronlar ve glia arasında sinyal alma olasılığı sağlar. Protokolümüzde, gerekirse sürekli Co-Culture yöntemi kolayca atlanabilir ve glia-Klima medya ile nöronların klasik tedavisi gerçekleştirilebilir.
Özetle, burada sunulan protokol kendi saflaştırılmış hücre kültürü deneylerini kurabilen sağlam bir temel ile okuyucu sağlamayı amaçlamaktadır. Transgenik hayvanların ve viral yapıların mevcudiyeti, öngörülebilen gelecek için artmaya devam edeceğini tahmin ediyoruz. Bu nedenle, floresan dayalı hücre sıralama teknikleri daha yaygın olarak kullanılan ve değerli olması muhtemeldir.
Açıklamalar
Yazarlar, rakip finansal çıkarların olmadığını beyan ederler.
Teşekkürler
Yazarlar, Jenny Kirsch ve ana Teichmüller tarafından akış cytometry çekirdek tesisi, Deutsches Rheuma-FORSCHUNGSZENTRUM, Berlin 'de sağlanan mükemmel teknik desteğe teşekkür etmek istiyor. Hayatta kalma analizine yardım etmesi için Jie Song 'a teşekkür etmek istiyoruz. Biz de onun yardımcı olmak için Rita Loureiro teşekkür etmek istiyorum floresan fareler ve Hıristiyan Ebner görüntülerini yakalama protokolünün kritik okuma için. VGAT-Venus transjenik fareler, Dr. A. Miyawaki tarafından sağlanan pCS2-Venus kullanarak, Ulusal Fizyolojik Bilimler Enstitüsü, Okazaki, Japonya 'da DRS. Y. Yanagawa, M. Hirabayashi ve Y. Kawaguchi tarafından üretildiler. Bu çalışma Alman Araştırma Konseyi (Deutsche Forschungsgemeinschaft, DFG EXC 257 ila IV) tarafından destekleniyordu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Neural Basal A media (NBA) | ThermoFisher Scientific | 10888022 | Cell Culture Buffer |
| B27 | ThermoFisher Scientific | 17504001 | Culture supplement |
| Glutamax | ThermoFisher Scientific | 35050-038 | Culture supplement |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140-122 | Antibiotic |
| Poly-L-Lysine | SIGMA | P1399 | Coverslip coating |
| Papain | SIGMA | P4762-1G | Enzyme |
| Bovine Serum Albumin | SIGMA | A3294-100G | Serum |
| Hibernate A low fluorescence media | Brain Bits Ltd | HALF | Cell Transport media |
| Dulbeccos Modified Eagles Medium (DMEM) | Biochrom | F0435 | Glial Culture Buffer |
| Fetal Calf Serum (FCS) | Biochrom | S0115 | Serum |
| Trypsin/EDTA | Biochrom | L2163 | Enzyme |
| Fine Tip Pasteur Pipette | Neo Labs | - | Used for trituration of cells |
| 24-well plates | BD | 353047 | Culture plate |
| 50 mL Falcon tubes | BD | 352070 | - |
| 15 mL Falcon tubes | BD | 352096 | - |
| Glass coverslips: 12 mm round | Roth | P231.1 | - |
| 35 mm Petri dish | Corning | 353001 | - |
| 100 mm Petri dish | Corning | 353003 | - |
| 30 µm CellTrics Cell Sieve | sysmex | 04-004-2326 | To remove cell clumps before cell sorting |
| Round bottom polystyrene tubes | BD | 352054 | Transport tube for sorted cells |
| Round bottom polypropylyne tubes | BD | 352063 | Collection tube for sorted cells |
| Cell culture inserts – 0.4 µm transparent PET | Falcon | 353 095 | For the co-culture of neurons and glia |
| Extra fine Bonn Scissors | Fine Scientific Tools | 14084-08 | To remove overlying skin and bone of mice |
| Extra narrow Scissors | Fine Scientific Tools | 14088-10 | To remove overlying skin and bone of rats |
| Forceps | Fine Scientific Tools | 11242-40 | To hold the head in place |
| Spatula (130 mm long/5 mm tip width) | Fine Scientific Tools | 3006.1 | To remove the brain to filter paper |
| Scalpel Blades | Swan-Morton | #0308 | To mechanically dissociate neural tissue |
| Haemocytometer (Neubauer Imroved) | Optik Labor | - | To cell count dissociated cells |
| Fluorescent Miners Goggles (excitation light) | Biological Laboratory Equipment Maintenance and Servce Ltd (BLS) | FHS/LS-1G | To excite TdTomato |
| Fluorescent Miners Goggles (emission filter) | Biological Laboratory Equipment Maintenance and Servce Ltd (BLS) | FHS/EF-4R2 | Td Tomato compatible emission filter |
| Fluorescent Miners Goggles (excitation light) | Biological Laboratory Equipment Maintenance and Servce Ltd (BLS) | FS/ULS-02B2 | To excite Venus |
| Fluorescent Miners Goggles (emission filter) | Biological Laboratory Equipment Maintenance and Servce Ltd (BLS) | FS/TEF-3GY1 | Venus compatible emission filter |
| Mouse-Anti-GFP primary antibodies | UC Davis | 75-132 | To enhance Venus signal following fixation |
| Mouse-Anti-GFAP primary antibodies | SIGMA | G-3893 | The identification of reactive astrocytes |
| Rabbit-Anti-CD11b primary antibodies | Southern Biotech | 1561-15 | The identification of microglial cells |
| Rabbit-Anti-MBP primary antibodies | Millipore | AB980 | The identification of oligodendrocyes |
Referanslar
- Radcliff, G., Jaroszeski, M. J. Basics of flow cytometry. Methods in Molecular Biology. 91, 1-24 (1998).
- Feher, K., Kirsch, J., Radbruch, A., Chang, H. D., Kaiser, T. Cell population identification using fluorescence-minus-one controls with a one-class classifying algorithm. Bioinformatics. 30 (23), 3372-3378 (2014).
- Sergent-Tanguy, S., Chagneau, C., Neveu, I., Naveilhan, P. Fluorescent activated cell sorting (FACS): a rapid and reliable method to estimate the number of neurons in a mixed population. Journal of Neuroscience Methods. 129 (1), 73-79 (2003).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Critical Reviews in Biotechnology. 37 (2), 163-176 (2017).
- Guez-Barber, D., et al. FACS purification of immunolabeled cell types from adult rat brain. Journal of Neuroscience Methods. 203 (1), 10-18 (2012).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Turko, P., Groberman, K., Browa, F., Cobb, S., Vida, I. Differential Dependence of GABAergic and Glutamatergic Neurons on Glia for the Establishment of Synaptic Transmission. Cerebral Cortex. , (2018).
- Uematsu, M., et al. Quantitative chemical composition of cortical gabaergic neurons revealed in transgenic venus-expressing rats. Cerebral Cortex. 18, 315-330 (2008).
- Goebbels, S., Bormuth, I., Bode, U., Hermanson, O., Schwab, M. H., Nave, K. -. A. Genetic targeting of principal neurons in neocortex and hippocampus of NEX-Cre mice. Genesis. 44, 611-621 (2006).
- Banker, G. A. Trophic interactions between astroglial cells and hippocampal neurons in culture. Science. 209, 809-810 (1980).
- Lindsay, R. M. Adult rat brain astrocytes support survival of both NGF-dependent and NGF-insensitive neurones. Nature. 282 (5734), 80-82 (1979).
- Geissler, M., et al. Primary hippocampal neurons, which lack four crucial extracellular matrix molecules, display abnormalities of synaptic structure and function and severe deficits in perineuronal net formation. Journal of Neuroscience. 33 (18), 7742-7755 (2013).
- Wang, Y., et al. Fluorescent labeling of both gabaergicand glycinergic neurons in vesicular GABA transporter (VGAT)-venus transgenic mouse. Neuroscience. 164 (3), 1031-1043 (2009).
- Höltje, M., et al. Role of Rho gtpasein astrocyte morphology and migratory response during in vitro wound healing. Journal of Neurochemistry. 95 (5), 1237-1248 (2005).
- Booker, S. A., Song, J., Vida, I. Whole-cell Patch-clamp Recordings from Morphologically- and Neurochemically-identified Hippocampal Interneurons. Journal of Visualized Experiments. , e51706 (2014).
- Pfrieger, F. W., Barres, B. A. Synaptic efficacy enhanced by glial cells in vitro. Science. 277 (5332), 1684-1687 (1997).
- Ullian, E. M., Sapperstein, S. K., Christopherson, K. S., Barres, B. A. Control of synapse number by glia. Science. 291, 657-661 (2001).
- Christopherson, K. S., et al. Thrombospondins are astrocyte-secreted proteins that promote CNS synaptogenesis. Cell. 120, 421-433 (2005).
- Berghuis, P., et al. Brain-derived neurotrophic factor controls functional differentiation and microcircuit formation of selectively isolated fast-spiking gabaergic interneurons. European Journal of Neuroscience. 20 (5), 1290-1306 (2004).
- Liddelow, S. A., et al. Activated microglia induce neurotoxic reactive astrocytes via Il-1α, tnfα, and c1q. Nature. 541, 481-487 (2017).
- Tomlinson, M. J., Tomlinson, S., Yang, X. B., Kirkham, J. Cell separation: Terminology and practical considerations. Journal of Tissue Engineering. 4, (2013).
- Brewer, G. J., Torricelli, J. R., Evege, E. K., Price, P. J. Optimized survival of hippocampal neurons in B27-supplemented Neurobasal, a new serum-free medium combination. Journal of Neuroscience Research. 35 (5), 567-576 (1993).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır