Method Article
Primärzellkultur von gereinigten Gurified GABAergic oder Glutamatergic Neuronen, die durch Fluoreszon-Sortierung gegründet wurden
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine zellsortierbasierte Methode zur Reinigung und Kultur von fluoreszierenden GABAergischen oder glutamaterderen Neuronen aus dem Neocortex und Hippocampus von postnatalen Mäusen oder Ratten.
Zusammenfassung
Das übergeordnete Ziel dieses Protokolls ist es, gereinigte neuronale Kulturen zu erzeugen, die entweder von GABAergischen oder glutamatertischen Neuronen abgeleitet werden. Gereinigte Neuronen können in definierten Medien für 16 Tage in vitro kultiviert werden und sind für alle Analysen geeignet, die typischerweise auf dissoziierte Kulturen durchgeführt werden, einschließlich elektrophysiologischer, morphologischer und überlebensüberlebensanalytischer. Der große Vorteil dieser Kulturen besteht darin, dass bestimmte Zelltypen selektiv untersucht werden können, wenn es keine komplexen äußeren Einflüsse gibt, wie sie beispielsweise aus Gliazellen oder anderen Neuronentypen entstehen. Bei der Planung von Experimenten mit gereinigten Zellen ist jedoch zu beachten, dass Neuronen für ihr Wachstum und Überleben stark von Gliazisen-konditionierten Medien abhängig sind. Darüber hinaus sind glutamatergische Neuronen weiter von Gliazensekretärenten abhängig, um eine synaptische Übertragung zu etablieren. Wir beschreiben daher auch eine Methode zur Ko-Kultivierung von Neuronen und Gliazellen in einer berührungslosen Anordnung. Mit diesen Methoden haben wir große Unterschiede zwischen der Entwicklung von GABAergischen und glutamatergischen neuronalen Netzwerken festgestellt. So hat das Studium von Kulturen von gereinigten Neuronen ein großes Potenzial, unser Verständnis dessen, wie sich das Nervensystem entwickelt und funktioniert, zu fördern. Darüber hinaus können gereinigte Kulturen nützlich sein, um die direkte Wirkung pharmakologischer Wirkstoffe, Wachstumsfaktoren oder die Folgen genetischer Manipulationen auf bestimmte Zelltypen zu untersuchen. Da immer mehr transgene Tiere verfügbar werden und zusätzliche spezifische Zelltypen kennzeichnen, erwarten wir, dass die hier beschriebenen Protokolle in ihrer Anwendbarkeit und ihrem Potenzial wachsen werden.
Einleitung
Die Zellsortierung ist ein leistungsfähiges Werkzeug zur Isolierung lebender Zellen, die von Interesse sind, von einer heterogenen Zellmischung. Die Zellen können nach Größe und Formkriterien sortiert werden, ebenso wie der Ausdruck von Leuchtstoffmarkern1,2. Oft werden fluorophorisch konjugierte Antikörper verwendet, um verschiedene Zelltypen zu kennzeichnen, indem sie zellspezifischeOberflächenantigene 3,4ins Visier nehmen. Alternativ wurden transgene Tiere oder virale Liefersysteme entwickelt, um Fluorophorale unter zellspezifischen Promotern 5,6auszudrücken. Historisch gesehen war die Entwicklung transgener Werkzeuge und Tiere kostspielig und zeitaufwendig. In jüngerer Zeit haben sinkende Kosten und weniger technische Schwierigkeiten zu einem dramatischen Anstieg der Zahl der verfügbaren Reporterlinien geführt. Da die Verfügbarkeit von transgenen Werkzeugen und Reportertieren weiter zunimmt, sollte auch der Nutzen und die Anwendbarkeit fluoreszenzbasierter Zellsortiermethoden zunehmen.
Wir haben vor kurzem gezeigt, dass die Zellsortierung von transgenen Tieren routinemäßig zur Reinigung der Primärneuronen in Vorbereitungauf die Zellkultur angewendet werden kann. 7 Durch die Sortierung von Zellen von Ratten oder Mäusen konnten wir fluoreszierende Neuronen isolieren und kultivieren, die fluoreszierende Reporterproteine gezielt in GABAergischen oder glutamatergischenNeuronen 6,8,9ausdrücken. Durch das Studium dieser gereinigten neuronalen Kulturen konnten wir einen wichtigen Unterschied in der Art und Weise erkennen, wie GABAergische und glutamatertische Neuronen von gliafregenen Faktoren abhängig sind, um synaptische Übertragung 7 zu etablieren. Darüber hinaus konnten wir durch die Ko-Kultivierung von Gliazellen mit gereinigten Neuronen auf frühere Beobachtungen eingehen, die die entscheidende Rolle der Gliazellen für das Wachstum und Überleben der Neuronen 10,11zeigen. So konnten wir durch eine Kombination aus Zellsortierung und Zellkultur nicht nur die Entwicklung bestimmter Neuronentypen isoliert untersuchen, sondern auch den Einfluss von Gliazellen auf ihre Funktion untersuchen.
Wir präsentieren hier ein Protokoll für die Reinigung und Kultur von GABAergischen und glutamaterderen Neuronen aus dem Kortex und Hippocampus von transgenen Mäusen oder Ratten. Wir stellen auch eine Methode zur berührungslosen Ko-Kultur von gereinigten Neuronen und Gliazellen vor, die von Geissler etal. 12 angepasst ist. Um gereinigte GABAergic-Kulturenzu erzeugen, haben wir fluoreszierende Neuronen von VGAT-Venus-A Wistar-Raten 8 oder VGAT-Venus-Mäuse 13 sortiert, die selektiv eine verbesserte gelbe fluoreszierende Proteinvariante (Venus) in & gt;95% der Kortikale GABAergen-Neuronen. Um gereinigte glutamatergische Kulturen zu erzeugen, haben wir fluoreszierende Neuronen von NexCre sortiert; Ai9 Mäuse6,9,dietdTomato in kortikalen glutamaterischen Neuronen ausdrücken. Das gesamte Sortier-und Kulturverfahren kann innerhalb von 3-4 Stunden durchgeführt werden und kann zur Erzeugung von Hunderten von Replikationskulturen verwendet werden, die für elektrophysiologische, morphologische und zellüberlebensfähige Analysen geeignet sind. Die Methode ist einfach, reproduzierbar und kann gereinigte neuronale Kulturen erzeugen, die mehr als 97% rein für die Zellart des Interesses sind.
Protokoll
Alle Verfahren und Tierpflege wurden in Übereinstimmung mit den institutionellen Richtlinien, dem Tierschutzgesetz und der Richtlinie 86/609/EWG des Europäischen Rates über den Tierschutz in Anwesenheit von Genehmigungen aus der lokalen Region durchgeführt. Behörden (LaGeSo Berlin, T-0215/11).
NOTE: Dieses Protokoll beschreibt die Kultur der gereinigten Neuronen von einer einzigen transgenen Maus oder Rattenpup (postnataler Tag 0 – 2). Alle Techniken sollten unter sterilen Bedingungen durchgeführt werden. Alle Lösungen sollten mit einem 0,2 μm Filter sterilisiert werden (siehe Materialtabelle). Glaskoverslippen und Trennwerkzeuge sollten bei 185 ° C für 3 h erhitzt werden.
1. Beschichtung Glas-Coverslips mit Poly-L-Lysin
- Bereiten Sie Glaskaumtippen vor, indem Sie einen 5 mL Aliquot von 200 μg/mL Poly-Lysine (PLL) auftauen. Verdünnen Sie diese Bestandslösung auf 20 μg/mL, indem Sie 45 ml reines Einspritzwasser hinzufügen. Filtersterilisieren Sie die Lösung in ein neues 50 ml konisches Rohr. Beschriftet diese Röhre als "PLL Sterile".
NOTE: Verwenden Sie Wasser, das bei Raumtemperatur gespeichert wird, um den Auftausprozess zu beschleunigen. - 100 sterile, runde, 12 mm Glaskadeln in die sterile LSPL-Lösung geben. Raten Sie das Rohr alle 5 – 10 min, für 2 – 3 min, um eine gleichmäßige Beschichtung zu gewährleisten. Die Coverslips auf diese Weise für 1 h.
NOTE: Bevorzugt werden in Deutschland hergestellte runde Glaskerkospippen (Durchmesser = 12 mm), da sie eine zuverlässige Kulturfläche bieten und sich problemlos in die Brunnen einer 24-Well-Zellkulturplatte einfügen. - Nach 40 Minuten PLL-Beschichtung 2 Stück Gewebepapier nehmen und flach in den Fließschrank legen. Sterilisieren Sie das Papier mit 70% Ethanol, dann flach, um Falten zu entfernen und trocknen lassen.
- Nach der Beschichtung der Glaskerkuppen für 1 h mit PLL, entfernen Sie überschüssige PLL-Lösung und fügen Sie steriles Einspritzwasser. Rühren Sie die Coverslips für 2 – 3 s sanft auf, um überschüssige PLL zu entfernen. Wiederholen Sie diesen Spülschritt 2 zusätzliche Zeiten.
- Überschüssiges Wasser entfernen und die Coverslips dann auf das sterile Gewebepapier übertragen. Jeden Kerkel vorsichtig mit gebogenen Zangen trennen und trocknen lassen.
NOTE: Coverslips, die sich nicht leicht trennen lassen, können verworfen werden. Alternativ kann eine kleine Menge Wasser zur Trennung hinzugefügt werden. - Wenn Sie einmal trocken sind, übertragen Sie die Coverslips auf eine 24-köpfige Kulturplatte.
NOTE: Coverslips sollten etwa 30 min–1 h vor Beginn des Trennungsprozesses fertig gemacht werden. Die Platten können bis zum Bedarf in einem Inkubator bei 37 ° C und 5% CO2 gelagert werden.
2. Dissoziation von Hippocampal und Kortical Tissue
- Vorbereitung von Zellkultur-Lösungen
- Zur Trennung von neuronalem Gewebe, Erster Defrost ein 40 mL Aliquot Zellkultur-Puffer (Komposition [in mM]: 116 NaCl, 5.4 KCl,26 NaHCO 3, 1.3 NaH2PO4, 1 MgSO4· 7H2O, 1 CaCl2· 2H 2O, 0,5 EDTA · 2Na·2H2O und 25 D-Glukose, pH = 7,4). Messen Sie 12 ml Zellkultur-Puffer zu einer 15 ml konischen Röhre; Etikett als "BSA". Messen Sie 5 ml Zellkultur-Puffer zu einem anderen 15-ML-Rohr; Etikett als "Papain". Beide Rohre 15 min bei 37 ° C in ein Wasserbad eintauchen.
- Filtersteriliz des verbliebenen Zellkulturpuffers, Etikett als "Buffer-Sterile" und bei 4 ° C aufbewahren, bis es erforderlich ist.
- 120 mg Bovine Serum Albumin (BSA) abwägen und in die Röhre mit der Aufschrift "BSA" geben. 7 mg Papain abwägen und in die Röhre mit der Aufschrift "Papain" geben. Beide Rohre 15 Minuten lang in das Wasserbad zurückgeben.
NOTE: Es ist hilfreich, dem Gewichtsboot eine kleine Menge Puffer hinzuzufügen, um die Übertragung des Papain-Pulvers zu erleichtern. - Sobald sich alle Pulver aufgelöst haben, wird jede Lösung mit einem frischen 15 mL konischen Rohr gefiltert. Für Röhrenpapain die gefilterte Lösung als "Papain-Sterile" kennzeichnen. Für die Röhre BSA, teilen Sie die sterile BSA-Lösung in 3 Rohre, die jeweils 4 ml BSA-Lösung enthalten. Etikettieren Sie jede Röhre als "BSA-Sterile" und entweder "1", "2" oder "3". Alle Rohre zurück ins Wasserbad geben und bis zum Bedarf bei 37 ° C weiter inkubieren.
- Vorbereitung auf Gewebeabfall
- Nehmen Sie ein Stück 35 mm Filterpapier (siehe Materialtabelle) und Sterilisieren mit 70% Ethanol; Im Deckel einer 100 mm Petrischale, im Fließschrank trocknen lassen.
- Die Schere, die Zangen, das Skalpell und den Spachtel (siehe Materialtabelle), die für die Trennung von Hippocampus und Cortex erforderlich sind, auslegen.
- Legen Sie zwei 35-mm-Petrischalen und eine 100 mm Petrischale mit sterilen Filterpapier in einer zugänglichen Lage in der Mitte des Fließschranks.
- Sammeln transgene NexCre; Ai9 und VGAT Venus Maus-Welpen, die zerlegt werden sollen. Verwenden Sie eine Leuchtstofflampe mit entsprechenden Anregungs-und Emissionsfiltern (siehe Materialtabelle), um fluoreszierende Welpen von wilden Wurstkollegen zu unterscheiden.
- Vor der Zerstreuung der Tiere jede 35 mm Petrischale mit gekühltem, sterilen Zellkulturpuffer füllen.
NOTE: Die eine Petrischale ist für die Reinigung der Werkzeuge zwischen den Abschnitten, die andere ist für das Sammeln des Hippocampus und Kortex.
- Gewedissection
- Sobald der Zellkulturpuffer gegossen ist, dekapitulieren Sie einen postnatalen Tag 0 – 2 transgene Maus oder Rattenpuppel mit großer, scharfer Schere und verwenden Sie eine sterile 100 mm Petrischale, um den Kopf in den Fließschrank zu übertragen. Verwenden Sie Zangen, Scheren und einen Spachtel, um das Gehirn eines transgenen Pup vorsichtig auf steriles Filterpapier zu übertragen.
- Verwenden Sie ein Skalpell vom Typ 22, um das Kleinhirn zu zerlegen und die beiden Hemisphären zu trennen. Verwenden Sie einen kleinen Spachtel, um die Halbkugel seitlich zu rollen. Auf jeder Hemisphäre vorsichtig nach unten drücken, damit der Kortex mit dem Filterpapier in Kontakt kommt. Bewegen Sie sich sanft in Mittelhirn-Regionen, um den Hippocampus und den Kortex zu enthüllen.
NOTE: Achten Sie darauf, nicht zu viel Druck auszuüben, wenn Sie auf die Hemisphären oder Zellen drücken, kann zerkleinert werden. - Verwenden Sie ein Skalpell oder Spachtel, um den Hippocampus und den Kortex von jeder Hemisphäre zu trennen. Übertragen Sie das zerkleinerte Gewebe auf eine 35 mm Petrischale mit gekühltem Zellkulturpuffer.
NOTE: Wenn Sie mehrere Tiere trennen, lagern Sie sterilen Zellkulturpuffer in einer 50 ml konischen Röhre auf Eis. Nach jeder Sektion wird das zerseelene Gewebe in den gekühlten Zellkulturpuffer übertragen. - Nach erfolgreichem Zerfall des Cortico-Hippocampalgewebes die sterile Papain-Lösung vom Wasserbad in den Fließschrank übertragen. Verwenden Sie eine 3 mL Pasteur-Pipette, um den zerkleinerten Hippocampus und Cortex auf den Deckel einer sterilen 35 mm Petrischale zu übertragen. In einer kreuzförmigen Bewegung hacken, mit dem flachen Teil eines Skalpells vom Typ 22, bis das Gewebe in kleinen Stücke ist.
- Verwenden Sie eine kleine Menge Papain-Lösung, um das gehackte Gewebe aus dem Deckel der Petrischale auf das sterile Papainrohr zu übertragen. Das Papain-Rohr in das Wasserbad zurückgeben und das Gewebe bei 37 ° C für 25 Minuten inkubieren.
- Während der Papain-Inkubation, machen Sie komplette Fluoreszenz-Medien-Lösung. Defrost ein 1 mL Aliquot von B27, ein 0,5 mL Aliquot Glutamax und ein 0,5 mL Aliquot von Pen-Strep. Aliquot 48,5 mL Hibernate Ein niedriges Fluoreszenzmedium zu einem 50 mL konischen Rohr. B27, Glutamax und Pen-Strep in die Lösung einbauen. Schütteln Sie die Lösung gut, dann Filtersteriliz und Etikett als "Hibernate A complete media" (mit Datum und Initialen). Inkubat bei 37 ° C in einem Wasserbad.
- Nach der Papain-Inkubation das Papierrohr und die sterilen BSA-Rohre in den Fließschrank übertragen. Verwenden Sie eine 1 mL Pasteur-Pipette, um nur das Cortico-Hippocampal-Gewebe aus dem Papain-Rohr in das BSA-Rohr 1 zu entfernen.
NOTE: Achten Sie darauf, den Transfer von überschüssigen Papain-Lösung zu minimieren.
- Trennung von Zellen
- Um große Gewebekklumpen aufzubrechen, triturieren Sie das Gewebe mehrmals mit einer 1 ml Pasteur-Pipette. Im Anschluss daran wird das Gewebe 7 mal mit einer feinen Spitze Pasteur-Pipette triturieren. Lassen Sie das Gewebe für 30 s stehen, so dass größere Teile des Gewebes sediment.
- Nach 30 s die untere 1 ml Lösung und Gewebe von BSA-Röhre 1 auf BSA-Röhre 2 übertragen. Das Gewebe im BSA-Rohr 2 mehrmals mit einer feinen Spitze Pasteur-Pipette trimmen.
- Nach der Trituration noch einmal die untere 1 ml Gewebe und Lösung von BSA-Röhre 1, aber jetzt auf BSA-Röhre 3. Das Gewebe im BSA-Rohr 3 mehrmals mit einer feinen Spitze Pasteur-Pipette trimmen.
- Übertragen Sie nach der Trituration alle Lösung und das Gewebe von den Röhren 2 und 3 in das BSA-Rohr 1. Weitere 2-3-mal und Zentrifuge bei 3.000 x g für 3 min.
- Während der Zentrifugation, bilden komplette Neural Basal A Medien (NBA-Medien). Aliquot 48,5 mL der NBA-Medien zu einem 50 mL konischen Rohr und inkubieren bei 37 ° C in einem Wasserbad. Label this tube "NBA only". Darüber hinaus entfrost ein 1 mL Aliquot B27, ein 0,5 mL Aliquot Glutamax und ein 0,5 mL Aliquot Pen-Strep bei Raumtemperatur.
- Nach der Zentrifugation das Supernatant vorsichtig aus dem gepellten Gewebe entfernen und die Zellen in 2 ml kompletter Medien wieder aussetzen. Verwenden Sie eine P1000-Pipette, um das Gewebe 20 Mal auf und ab zu triturtieren.
NOTE: Achten Sie darauf, die Zellen nicht zu kräftig zu pipetten. Wird zu viel Druck ausgeübt, können die Zellen beschädigt werden. - Verwenden Sie eine 1 mL Pasteur-Pipette, um die Zellaufhängung durch ein 30 μm-Zellsieb in ein Polystyrol-Probenrohr zu filtern.
NOTE: Wenn die Zellaufhängung nicht sofort durch das Zellsieb geht, kann es notwendig sein, mit einem sterilen Handschuh auf das Sieb zu drücken, um den Fluss zu starten. Dieser wichtige Schritt verhindert das Verstopfen des Zellsorters. - Für das Sammeln von Neuronen nach der Sortierung, bereiten Sammlungsrohre durch Pipetting 300 μL von kompletten Medien auf die erforderliche Anzahl von Polypropylen-Rohre.
- Die Zellaufhängung ist nun bereit, zum Sortieren zum Zellsorter gebracht zu werden. Nehmen Sie die Zellaufhängung, zusätzliche Sammelrohre und schonen Sie komplette Medien, falls eine Verdünnung der Probe erforderlich ist.
3. Zellsortierung von gereinigten GABAergic oder Glutamatergic Neurons
NOTE: Um die Wahrscheinlichkeit einer bakteriellen Kontamination während der Sortierung zu minimieren, wird das Probenrohr des Sorters mit 70% Ethanol für mindestens 5 Minuten vor dem Sortieren mit 70% Ethanol verzinst. Detaillierte Sortierparameter variieren zwischen den Instrumenten, grundlegende Überlegungen sind folgende.
- Während der ersten Zellsorte, stellen Sie die Ebenen der Hintergrundfluoreszenz von nicht gekennzeichneten Zellen durch Sortierung und Vergleich von Zellen von einem wilden Tier.
- Für jeden zu sortierenden Leuchtstoffzellentyp wählen Sie die passenden Anregungs-und Emissionsfilter. Mit 488 nm bzw. 531 nm Anregungswellenlänge werden Venus-und TdTomato-Proteine exzessieren. Erkennen Sie das ausgestrahlte Licht durch 530/40 bzw. 575/30 Emissionsfilter-Sets.
- Fügen Sie dem Zellsorter Polypropylen-Sammelrohre mit 300 μL komplettem Medium zur Zellentnahme hinzu.
- Für eine hohe Reinheit sortieren Sie hell beschriftete Fluoreszenzzellen (siehe Abbildung 1B zum Beispiel Punktplots sortiert).
- Nach der Sortierung, für optimale Ergebnisse, führen Sie einen Reinheitstest der sortierten Zellen durch, um den Reinheitsgrad zu schätzen. Beachten Sie, dass die typische Wiederherstellungsrate der Zellen nach der Sortierung zwischen 70 – 80% liegt.
- Beachten Sie die Anzahl der Zellen, die in jedem Sammelrohr sortiert sind. Dieser Wert wird durch das Zellsortierungsinstrument angegeben.
NOTE: Die Zellsortierung kann mit einer 70 μm Düse (70 Psi-Hülle Flüssigkeitsdruck) oder einer 100 μm-Düse (20 Psi-Hülle Flüssigkeitsdruck) durchgeführt werden.
4. Kultivierung von Sortierten Neuronen
- Nach der Zellsortierung werden die gesammelten Zellen mit einer 1 mL Pasteur-Pipette auf 2 mL runde Zentrifugenröhren übertragen. Zentrifugen Sie die Zellen mit 3.000 x g für 3 min zu einem Zellpellet.
NOTE: Um den Standort des Zellpellets zu identifizieren, orientieren Sie die runden Zentrifugenröhren mit dem nach außen gerichteten Scharnier des Deckels, wodurch sich das Zellpellet auf der Rückseite des Zentrifugenrohrs (d.h. auf der gleichen Seite des Rohres wie das Scharnier) bilden kann. - Während der Zentrifugation 1 ml B27, 0,5 mL Glutamax und 0,5 mL Pen-Strep zu den 48,5 mL der vorgewärmten NBA-Medien hinzufügen. Schütteln Sie die Lösung gut, dann Filter sterilisieren und als "NBA complete media" (mit Datum und Initialen). Zurück ins Wasserbad, bis es erforderlich ist.
- Nach der Zentrifugation sollte man mit einer 1 mL Pasteur-Pipette den Supernatant in ein anderes Zentrifugenrohr überführen (das Supernatant behalten, falls das Zellpellet gestört wurde). Setzen Sie das Zellpellet in der erforderlichen Menge von vorgewärmten kompletten NBA-Medien wieder aus, um eine Zelldichte von 1.000 Cells/μL zu erreichen.
- Um das Vorhandensein von dissoziierten Zellen zu bestätigen, überprüfen Sie die Zelllösung unter einem Mikroskop, mit einer 4x oder 10x Objektivlinse. Alternativ wird eine kleine Menge Zelllösung auf einen Copplip pipettiert und unter dem Mikroskop überprüft. Wenn eine große Anzahl von Zellen vorhanden ist, kann das Supernatant aus Schritt 4.3 verworfen werden.
- Vor dem Abplatken der Zellen, Wirbel auf einer mittleren Geschwindigkeit für 2 – 3 s, um eine gleichmäßige Zellaufhängung zu gewährleisten. Nach dem Wirrbarschen, schnell pipette 10 μL der Zellaufhängung in die Mitte eines jeden Coverslips. Nach dem Ablegen der Zellen, schnell jede Platte zurück in den Inkubator (5% CO2/37 ° C) und Inkubat für 1 h.
NOTE: Wenn Sie Zellen zu mehreren 24-well-Platten hinzufügen, stellen Sie eine gleichmäßige Zelldichte sicher, indem Sie Zellen zwischen den Platten verlegen. - Nach 1 Stunde die Zellen mit 500 μL vorgewärmter kompletter NBA-Medien füttern und zum Inkubator zurückkehren.
NOTE: Bei der Fütterung der Zellen ist es wichtig, die Medien sanft auf die Seite des Brunnens zu piptieren, um Zellablösung zu vermeiden. Bei kurzen Experimenten (& lt;16 Tagen) ist eine Fütterung an der oben genannten Dichte nicht notwendig. Bei der Beschichtung einer größeren Zelldichte können häufigere Fütterungsintervalle erforderlich sein (siehe Diskussion).
5. Astrozyte Enriched Glial Support Cultures
NOTE: Die Produktion von Gliazitäten14 und die Verwendung von Zellkultureinlagen wurden zuvor12beschrieben. Kurz gesagt, Astrozyten angereicherte Gliakturen werden aus Cortico-Hippocampen-Gewebe abgeleitet (mit Meninges entfernt; P2–P5), die seit einer Woche auf einer 20 μg/mL PLL PLL-beschichteten 6-well-Platten kultiviert werden, ergänzte DMEM-Medien.
- Zur Ko-Kultur gereinigten Neuronen und Gliazellen, Passage konfluent Gliazellen auf die erforderliche Anzahl von Zellkultureinsätzen (0,4 μm Porengröße — siehe Materialtabelle). Um die Zellen zu durchlaufen, entfernen Sie eine 6-Well-Platte, die zusammenfließende Gliazellen enthält, aus dem Inkubator und waschen Sie 2 Brunnen, 2 Mal, mit 2 ml vorgewärmter (37 ° C) Phosphat-gepufferter Saline (PBS).
- Aspirieren Sie die PBS-Lösung und verwenden Sie eine P1000-Pipette, um 1 mL vorgewärmte (37°C) Trypsin (1:250)/EDTA (0,25%/0,02%) hinzuzufügen. Lösung für jeden Brunnen.
- Die 6-Well-Platte in den Inkubator zurückgeben und alle 2 – 3 Minuten auf die Zellablösung überprüfen.
- Sobald eine signifikante Zellablösung aufgetreten ist, pipette die Zellen und die Zelllösung mit einer feinen Spitze Pasteur-Pipette sanft auf und ab, um die Trennung und Trennung einzelner Zellen weiter zu erleichtern.
- Die Zelllösung auf ein 15 ml konisches Rohr und eine Zentrifuge mit 3.000 x g für 3 min übertragen.
- Die Zellen mit einer P1000-Pipette in 5 mL vorgewärmter (37 ° C) NBA-Komplettmedien neu aussetzen, indem sie sanft nach oben und unten kippten, bis das Zellpellet in Lösung ist.
- Führen Sie eine Zellzahl mit einem Hämozytometer oder einem automatisierten Zellzähler aus.
NOTE: Nach 7 Tagen Kultur können aus jedem Brunnen einer 6-Brunnen-Platte ca. 750000 – 1000000 Zellen geerntet werden. - Platzieren 40.000 Gliazellen zu jeder Zellkultur in einem 500 μL-Tröpfchen (80 Cells/μL).
- Nachdem die Zellen 1 h halten lassen, verwenden Sie sterile Zangen, um glielebedeckte Zellkultureinsätze auf 24-Brunnen-Platten zu übertragen, die gereinigte Neuronen enthalten. Entfernen Sie überschüssige Medien von der Oberfläche der Zellkultureinsätze (ca. 300 μL).
NOTE: Da Luftblasen oft unter den Zellkultureinsätzen gefangen werden können, kann es notwendig sein, die Einsätze sanft zu kippen, um diese Blasen zu entfernen. Wenn mehr Gliazellen in die Zellkultureinlage aufgenommen werden, können weitere Wasch-und Zentrifugenschritte erforderlich sein, um überschüssiges Trypsin zu entfernen, was dem Zellüberleben schaden kann.
Ergebnisse
Die Dissoziation und Zellsortierung fluoreszierender Neuronen aus transgener Maus oder Rattenkortiko-Hippocampagegewebe kann in etwa 3 – 4 h durchgeführt werden. Die Folge ist eine Population von hochreinen Leuchtstoffneuronen, die 16 Tage lang in der Kultur angebaut werden können.
Um gereinigte Kulturen zu erzeugen, wurden transgene Tiere zunächst mit einer Leuchtstofflampe mit entsprechenden Filtersätzen identifiziert (Beispiele für fluoreszierende neonatale VGAT-Venus und NexCre; Ai9 Maus-Welpen werden in Abbildung 1A) angezeigt. Nach der Identifizierung transgener Tiere wurde das zerstrebte Gewebe zerlegt und die stark fluoreszierenden Neuronen sortiert, um eine gereinigte Zellpopulation zu erzeugen. Beispiel Fluoreszenzintensität Punkt Plots für NexCre; Ai9 und VGAT Venus Mausneuronen, die während der FACS gewonnen wurden, werden in Abbildung 1Bgezeigt. Bei optimierter Optimierung ist es möglich, zwischen 500.000 und 800.000 Zellen aus dem Cortex und Hippocampus der einzelnen P0-2 NexCre zu ernten; Ai9 oder VGAT Venus Mäuse. Die Zellen können mit einer Geschwindigkeit von bis zu 600 ereignis/sortiert werden. Schätzungen der Zellreinheit wurden mit DAPI als Kernmarker durchgeführt (Abbildung1C). Durch die Sortierung stark positiver Zellen kann eine Reinheit von mehr als 97% routinemäßig erreicht werden7.
Nach erfolgreicher Sortierung sollten geplatzte Neuronen rund in Form erscheinen, eine glatte Membran haben und Neuriten nach etwa 1 h in vitro (Abbildung 2A, B) sprießen. Bis 7 Tage in vitro, obwohl ein gewisser Zelltod offensichtlich sein kann, sollten lebensfähige Zellen unter allen Kulturbedingungen vorhanden sein (Abbildung 2C, D). Bei 12 – 16 Tagen in vitro ist es möglich, die morphologische und elektrophysiologische Entwicklung von gereinigtenNeuronen mit Hilfe von Vollzellen-Patch-Klampen-Aufnahmen und biozytinfüllenden 15 zu untersuchen (Abbildung3). Die Analyse der gereinigten Kulturen zeigt, dass sowohl glutamatergische als auch gABAergische Neuronen in der Lage waren, Axone und Dendriten aus ihren Zellkörpern zu erweitern (Abbildung 3A, B)und die Fähigkeit zu behalten, Aktionspotenziale als Reaktion auf Die Dolarisierung aktueller Injektionen (Abbildung 3C, D). Vor allem aber erhielten nach der Reinigung nur GABAergic-Neuronen signifikante Mengen an spontaner synaptischer Übertragung, und glutamateurhafte Neuronen erhalten in Ermangelung von Gliazellen nur sehr wenig synaptische Übertragung (Abbildung 3E). , F) 7. Platz
Wie wir bereits berichtet haben, überleben Zellen in gereinigten Kulturen tendenziell schlechter als in unsortierten Kulturen und haben deutlich kleinere Dendriten und Axone7. Um diese Defizite zu überwinden, haben wir Methoden zur Unterstützung der Entwicklung von gereinigten KulturenmitGliazellen 12,14angepasst und angewandt. Die zelluläre Zusammensetzung unserer Glialförderkulturen (DIV7) ist in Abbildung 4Adargestellt. Diese Kulturen enthielten überwiegend glielig fibrilläres saures Protein (GFAP) positive Astrozyten, enthielten aber auch einige Cluster von Differenzierungsmolekülen (CD11b) positive Mikroglien und Myelin-Grundprotein (MBP) positive Oligodendrozyten. Nach DIV 7 können diese Zellen zu Zellkultureinsätzen geleitet werden, um gereinigte Neuronen berührungslos zu unterstützen (Abbildung 4B, C). Die Analyse der Glia-Neuronen-Kokulturen zeigt, dass etwa 40.000 Gliazellen ausreichten, um das langfristige Überleben und das Wachstum sowohl der gereinigten glutamatanischen als auch der gABAergic-Neuronen zu verbessern (Abbildung 4D, E)7. Darüber hinaus zeigt die elektrophysiologische Analyse, dass glutamatergische Neuronen, die mit Gliazellen kokulturiert wurden, hochaktiv waren und eine stark erhöhte Netzwerkaktivität hatten (Prozentsatz der Glialgestützten glutamatergen Neuronen, die Aufschläge von Handlungen abfeuerten Potenziale: 62%; N = 28; Bild 4F , G). Die Glionsprofit ist daher nicht nur für die Förderung von Neuronwachstum und-überleben wichtig, sondern auch für die Förderung der synaptischen Übertragung und die Etablierung von Netzwerkaktivitäten in glutamatergischen Kulturen.
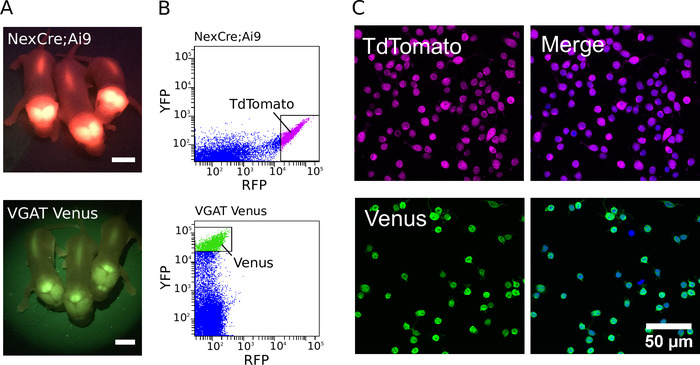
Abbildung 1: Reinigung von glutamatergischen und gABAergen-Neuronen. A) Bilder, die fluoreszierendes Signal von der transgenen Expression von TdTomato in NexCre zeigen; Ai9 Mäuse (oben) und Venus in VGAT Venus Mäuse (unten). (B) Intensitätsstreuungsgrundstücke der TdTomato-und Venus-Fluoreszenz von Cortico-Hippocampal dissoziierten Zellen von NexCre; Ai9 Mäuse (oben) und VGAT Venus-Mäuse (unten). Stark fluoreszierende TdTomato-Neuronen oder Venus-Neuronen wurden für die Sortierung ausgewählt (angezeigt durch die Gating-Boxen). (C, links) Kontrafokalbilder von sortierten TdTomato (oben) und Venus (unten) positive Neuronen. (C, rechts) Zusammengefügte Bild, das die mit DAPI beigehakten Zellen (in blauer Pseudofarbe) zeigt. Die TdTomato-Fluoreszenz ist endogen und bleibt trotz Fixierung (in Magenta-Pseudofarbe) stark. Der Venusausdruck wird durch eine Kombination aus einem primären Antikörper gegen GFP und Alexa Fluor-488-konjugierte sekundäre Antikörper (in grüner Pseudofarbe) verstärkt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
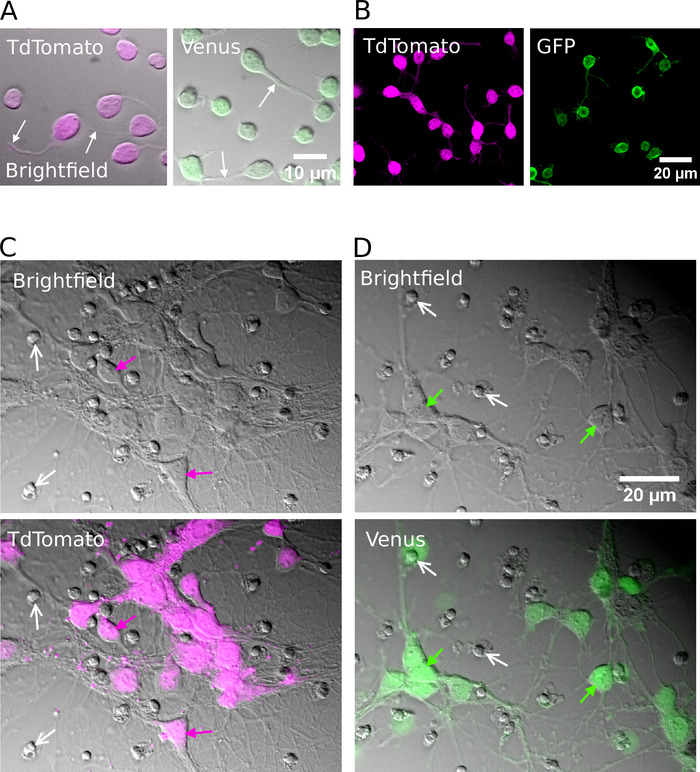
Abbildung 2: Zellkultur von gereinigten glutamatergen oder gABAergischen Neuronen. (A) Kombinierte Infrarot-(helles Feld) Bilder und überlagerte Fluoreszenzsignale von TdTomato (links) und Venus (rechts) positive Neuronen, die für 1 h in vitro kultiviert wurden. Weiße Pfeile zeigen die Lage wachsender Neuriten an. (B) Kontrafokalbilder von TdTomato (links) und Venus (rechts) positive Neuronen, die für 1 h in vitro kultiviert wurden. (C, D) Helles Feld (oben) und kombinierte helle Feld-und Leuchtstoffbilder (unten) von TdTomato (C) und Venus positive Neuronen (D) kultiviert für 7 Tage in vitro (DIV). Weiße Pfeile zeigen die Lage von kondensierten Kernen aus abgestorbenen Zellen. Farbige Pfeile identifizieren fluoreszierend beschriftete Neuronen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
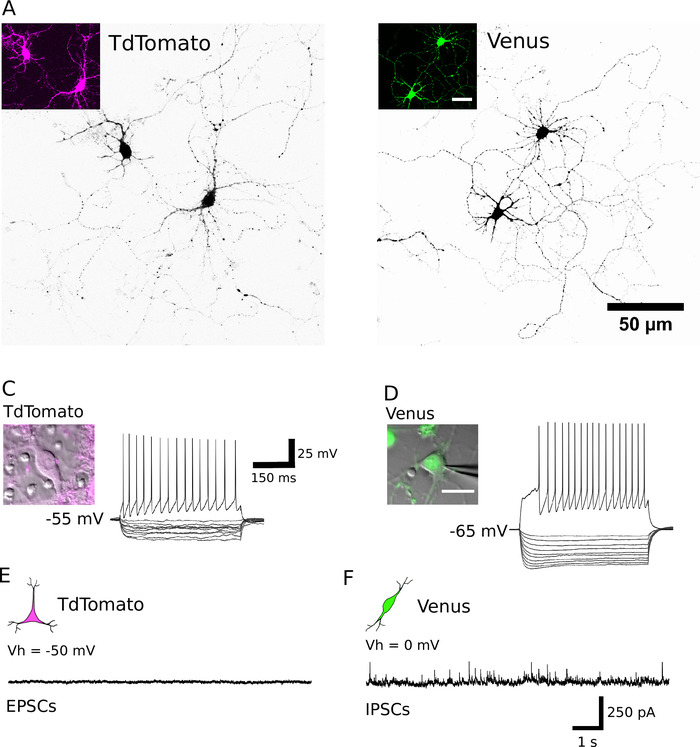
Abbildung 3: Morphologische, elektrophysiologische und synaptische Eigenschaften von gereinigten Neuronen. A, B) Kontrafokalbilder von TdTomato (A) und Venus positive Neuronen (B) bei DIV 13 bzw. DIV 14. Die Zellen werden in Schwarz mit einer umgekehrten Aufsichtstabelle dargestellt, um die Neurite-Visualisierung zu unterstützen. Insets zeigen das fluoreszierende Signal, das von den identifizierten Neuronen ausgedrückt wird. (C, D) Die Spannungsreaktion von einem TdTomato (C) und Venus positive Neuron (D) auf Hyperpolarisierung (200 bis-20 pA, in 20 pA-Schritten) und die Depolarisierung (200 pA) Stromimpulse, die durch Vollzellen-Patch-Klemm-Aufnahmen gewonnen werden. Insets zeigen die entsprechenden aufgezeichneten Neuronen. Das RuhepErinnerungspotenzial jeder Zelle wird links von der Aufzeichnungsspur angezeigt. (E, F) Repräsentative Spannungsklemm-Aufnahmen (10 s), die von TdTomato (E) und Venus positive Neuronen (F) erhalten. Spontane, aufregende postsynaptische Ereignisse (EPSCs) wurden von TdTomato positiven Neuronen aufgezeichnet, die mit einem Holdingpotenzial von 50 mV aufrechterhalten wurden. Spontan auftretende hemmende postsynaptische Ereignisse (IPSCs) wurden von Venus positive Neuronen aufgezeichnet, die bei einem Haltepotenzial von 0 mV gehalten wurden. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
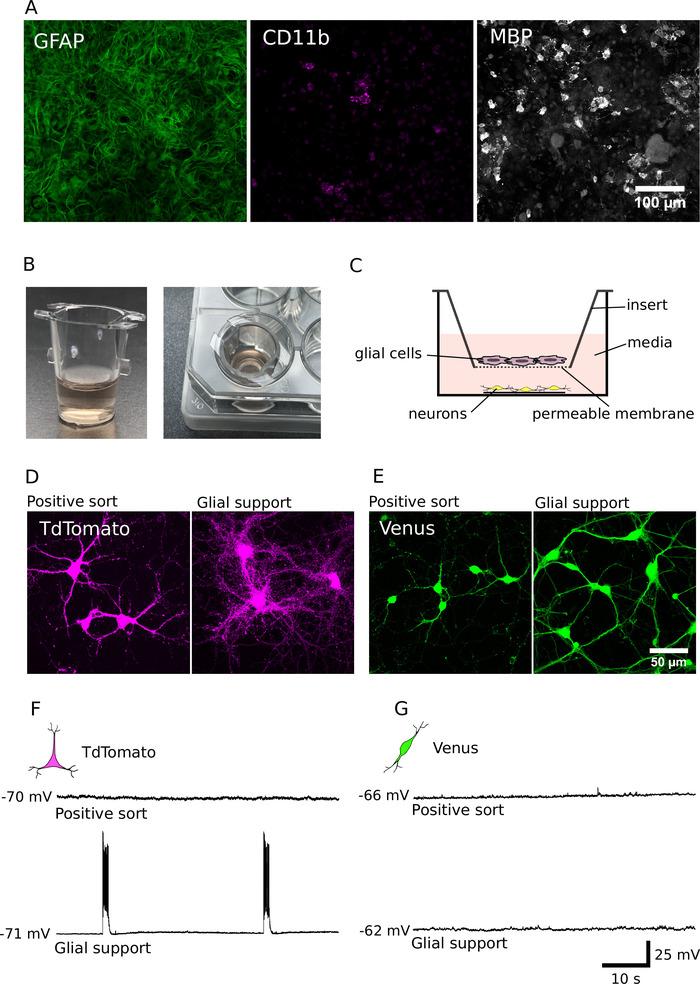
Abbildung 4: Unterstützung der Neuronenentwicklung mit der Glial-Co-Kultur. (A) Kontrafokalbilder von Gliazenkulturen, die für glialfibrilläres saures Protein (GFAP, links), Cluster von Differenzierungsmolekül (CD11b, Mitte) und Myelin-Grundeiweiß (MBP, rechts) immunolabeled sind. Glialtzellen wurden für DIV 7 kultiviert. B) Bilder von Zellkultureinsätzen, die verwendet werden, um Gliazellen mit gereinigten Neuronen in einer berührungslosen Anordnung zu kokulturieren. C) Ein Schema der räumlichen Anordnung, die zur Ko-Kultur von Neuronen und Glia verwendet wird. (D, E) Kontrafokalbilder von TdTomato (D) und Venus positive Neuronen (E), die 14 Tage lang gewachsen sind, in Abwesenheit (links) oder Präsenz (rechts) der Gliazenstütze. (F, G) Stromklemme (60 s) von TdTomato (F) und Venus positive Neuronen (G) kultiviert für 14 Tage in Abwesenheit (oben) oder Präsenz (unten) der Gliedunterstützung. Neuronen wurden an ihrem Ruhembranpotenzial aufgezeichnet (links von jeder Aufzeichnungsspur). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Wir beschreiben hier eine Methode, die die Sortierung und Kultivierung von Primärneuronen kombiniert, um gereinigte neuronale Zellkulturen zu erzeugen. Diese Methode dauert etwa 1 h länger als ein typisches primäres, dissoziiertes neuronales Kulturprotokoll, erlaubt aber die Generierung von Hunderten von Replikationskulturen, die bestimmte neuronale Typen enthalten. Gerögte Neuronen, die mindestens 16 Tage lang isoliert angebaut werden können, dehnen Axone und Dendriten aus und können wiederholte Züge von Wirkungspotenzialen abfeuern (Abbildung 2 und Abbildung 3). Wichtig ist, dass diese Zellen für die gleichen experimentellen Analysen wie regelmäßige primäre dissoziierte neuronale Kulturen, einschließlich elektrophysiologischer, morphologischer und überlebensüberlebensanalysierter, geeignet sind. Ein wesentlicher Vorteil der Arbeit mit diesen gereinigten Kulturen ist, dass die Entwicklung bestimmter Zelltypen isoliert untersucht werden kann. Um die Entwicklung von gereinigten Kulturen zu unterstützen, stellen wir auch ein Protokoll zur Ko-Kkultivierung von gereinigten Neuronen mit Gliazellen vor. Wie bereits gezeigt, verbessert die Ko-Kulierung gereinigter Neuronen mit Gliazellen ihr Überleben, Wachstum und kann die Netzwerkbildung7 fördern (Abbildung4). So stellen wir hier eine Kombination von Methoden vor, die die Erforschung von Glia-Neuron-Interaktionen fördern und sich als nützlich für die Untersuchung der Entwicklung und Interaktion zwischen anderen Zelltypen erweisen können.
Studien über Kulturen von gereinigten glutamaterderen Neuronen haben grundlegende Einblicke in die Art und Weise enthüllt, wie Gliazellen Faktoren abscheiden, die die Entwicklung von neuronalen Netzwerkenund Synapsbildung 16, 17,18fördern. . Im Allgemeinen wurden Methoden zur Reinigung bestimmter Neuronentypen erfolgreicher eingesetzt, um die Entwicklung von glutamatergischen Neuronen zu untersuchen, anstatt GABAergische Neuronen. Dies hat zu einer Diskrepanz in unserem Verständnis der Entwicklung dieser beiden Zelltypen geführt. Angesichts der Tatsache, dass sich GABAergische und glutamatanische Neuronen in Bezug auf ihre Anatomie, Physiologie und Entwicklungsentwicklung erheblich unterscheiden, ist es wichtig, dass wir GABAergische Neuronen in ihrem eigenen Recht untersuchen, um ihre Funktion und Physiologie besser zu verstehen. Mit dem hier vorgestellten Protokoll haben wir zuvor wichtige Unterschiede in der Art und Weise identifiziert, wie GABAergische und glutamatertische Neuronen von gliafartigen Faktoren für die Etablierungvon synaptischen Übertragungen 7 abhängig sind. Mit der Veröffentlichung dieses Protokolls hoffen wir, dass andere weitere Einblicke in die wichtigen Wechselwirkungen zwischen Neuronen und Gliazellen geben können.
In diesem Protokoll beschreiben wir eine Fließzytometrie-basierte Zellsortiermethode, mit der wir GABAergische oder glutamatergische Neuronen aus verschiedenen transgenen Nagetierlinien reinigen. Venus positive GABAergic Neuronen wurden von VGAT Venus-Mäusen 13 oder Ratten 8 und TdTomatopositive glutamateurhafte Neuronen wurden von NexCre sortiert; Ai9 Mäuse (ursprünglich aus den Reporterlinien 6 NexCre 9 und Ai9 gezüchtet,siehe Turko et al., 20187). In den letzten Jahren ist die Generation der transgenen Tiere durch die technologischen Fortschritte deutlich einfacher geworden. Damit ist die Verfügbarkeit von Tieren, die fluoreszierende Moleküle ausdrücken, in vielen verschiedenen Zelltypen rapide gewachsen. Dies wiederum hat den Einsatz und die Anwendbarkeit der fluoreszierenden aktivierten Zellsortierung erhöht. Während alternative Methoden zur IsolierungvonInteressenzellen derzeit16,19,20existieren, werden sie durch ihre Abhängigkeit von der Verfügbarkeit geeigneter Antikörper zur natürlich vorkommenden Oberfläche etwas behindert. Antigene. Das schränkt ihre Vielseitigkeit im Vergleich zu fluoreszenzbasierten Zellsortiermethoden ein, mit denen bereits Zellen aus den vielen zellspezifischen transgenen Reportertieren sortiert werden können, die bereits verfügbar sind. Dennoch können optimierte, auf Antikörper-basierter Sortiermethoden schnell und ertragreich sein und die Zellanatomie sogar besser erhalten, indem sie die Reinigung von Zellen mit ihren Axonen und Dendritenintakt 21 ermöglichen. Bei der Entscheidung für eine Sortierkabategie sollten Antikörper-Sortiermethoden daher weiterhin berücksichtigt werden. Letztlich werden die Zelltypen des Interesses, das Alter, in dem die Zellen sortiert werden sollen, die Verfügbarkeit von transgenen Tieren oder Oberflächenantigenen und die Anzahl der benötigten Zellen die entscheidenden Faktoren bei der Auswahl der geeignetsten Sortierstrategie sein.
Obwohl die fluoreszenzbasierte Zellsortierung eine einfache und reproduzierbare Methode zur Reinigung von Zellen ist, sollte bei bestimmten Schritten des Protokolls darauf geachtet werden, die Zellqualität zu erhalten. So ist es beispielsweise wichtig, nach jedem Zentrifugationsschritt darauf zu achten, dass das Zellpellet so schnell wie möglich wieder aufgehängt wird und die Zellen erfolgreich geborgen werden. Gelegentlich kann das Zellpellet beim Entfernen des Supernatanten gestört werden. Es wird daher empfohlen, zwischen Zentrifugationsschritten das Vorhandensein von Zellen unter dem Mikroskop zu überprüfen, um einen ausgiebigen Zellverlust auszuschließen. Nach der Zellbeschichtung sollten die Zellen vor der Fütterung mindestens 1 Stunde halten dürfen. Werden die Zellen zu früh gefüttert, können einige Zellen aus der Kofenlippe entfernt werden, wodurch die Kulturdichte reduziert wird. Nach 1 Stunde in der Kultur ist es klug, die Zellgesundheit zu beurteilen. Wenn Zellen nicht gesund erscheinen (ein Beispiel für gesunde Zellen wird in Abbildung 2Agezeigt), oder es einen signifikanten Zelltod gibt, dann kann dies ein Hinweis auf ein Problem während des Dissoziations-oder Sortiervorgangs sein. Eine weitere wichtige Überlegung bei der Kultivierung eines Zelltyps ist die Sorgfalt bei der Verwaltung der Zellkulturmedien. NBA-Medien enthalten Phenol-Rot, das als pH-Indikator22fungiert. Wenn das Medium zu gelb wird, dann deutet das darauf hin, dass der pH-Wert zu sauer ist; Wenn die Medien zu rosa werden, dann deutet das darauf hin, dass die Lösung zu alkalisch ist. Aktienlösungen, die über lange Zeiträume offen sind, insbesondere Medien, die in konischen Röhren veraltet sind, neigen dazu, im Laufe der Zeit alkalischer zu werden. Es wird daher empfohlen, jede Woche frische komplette NBA-Medien und alle zwei Wochen komplette Medien zusammenzustellen (die mittleren Puffer unter atmosphärischen Bedingungen und sollten daher stabiler sein). Unter Berücksichtigung dieser Punkte sollte es möglich sein, in jedem Labor gereinigte Zellkulturen mit Zugang zu Zellsortier-und Zellkulturgeräten zu etablieren.
In den meisten unserer Experimente haben wir aus einem einzigen Tier gereinigte Kulturen hergestellt. Bei der Reinigung von Zellen für biochemische Analysen kann es jedoch notwendig sein, mehrere Tiere zur Sortierung zusammenzulegen. Wir haben mit dem obigen Protokoll bis zu 8 embryonale Mäuse (Embryonaltag 13 Tiere) erfolgreich sortiert (Daten nicht abgebildet). Wenn jedoch mehr Tiere sortiert werden sollen, kann es notwendig sein, das Volumen sowohl der Papain-als auch der BSA-Lösungen (beschrieben in den Schritten 2.1.1 – 2.1.4) zu erhöhen, um der Erhöhung der Gewebemenge Rechnung zu tragen. Wenn in der Kultur mehr Zellen geplatzt werden, kann zudem ein häufigerer Fütterungsprogramm erforderlich sein. Als Ausgangspunkt können die Zellen alle 7 Tage gefüttert werden, indem 100 μL konditionierter Medien entfernt werden und 200 μL frischer NBA-Medien hinzugefügt werden. Um der Lebensfähigkeit des Neurons willen sollte man, wenn man mehr Tiere sortiert, darüber nachdenken, die Sortierzeit so weit wie möglich zu minimieren. Dies erfordert oft eine sorgfältige Optimierung nachgeschalteter Analysen für den effizienten Einsatz von gereinigten Zellen. Wir haben routinemäßig sortierte Mausneuronen mit einer Rate von 600 ereigniszähen, bis zu 500000 – 800000 Zellen pro Tier (postnataler Tag 0 – 2). Dies geschah jedoch ohne eine umfassende Optimierung der Sortiergeschwindigkeiten und-bedingungen. Daher sollten weitere Verbesserungen bei der Sortiergeschwindigkeit und dem Ertrag möglich sein.
Gereinigte Neuronen benötigen für ihr Überleben glielierte Medien. Dies wurde zuvor durch die separat kultivierte Neuronen und Gliazellen demonstriert, bevor Neuronen mit Gliondistierten Medien 10 behandelt wurden. In unseren Experimenten haben wir uns entschieden, gereinigte Neuronen zu unterstützen, indem wir Gliazellen auf halbdurchlässigen Zellkultureinlagen kultivieren, die in der Zellkulturplatte platziert werden. Diese Methode wurde erfolgreich angewendet, um gliengeleitete extrazelluläre Matrixproteine und derenInteraktion mit Neuronen 12 zu untersuchen. Die berührungslose, aber kontinuierliche Unterstützung, die durch diese Methode geboten wird, hat eine Reihe von Vorteilen im Vergleich zur separaten Zellkultur. Vor allem die Ko-Kultur der Gliazellen mit Neuronen ermöglicht die kontinuierliche Regulierung und Konditionierung der Zellkulturmedien, die eher der In-vivo-Situation ähnelt. Darüber hinaus ermöglicht die kontinuierliche Ko-Kultur der Zellen mögliche Rückkopplungssignale zwischen Neuronen und Glia, was in getrennten Kulturen nicht möglich ist. In unserem Protokoll kann bei Bedarf die kontinuierliche Co-Kultur-Methode leicht weggelassen und eine klassische Behandlung von Neuronen mit Gliazisstikmedien durchgeführt werden.
Zusammenfassend möchte ich sagen, dass das hier vorgestellte Protokoll dem Leser ein solides Fundament bieten soll, von dem aus er seine eigenen Experimente mit gereinigten Zellkulturen etablieren kann. Wir gehen davon aus, dass die Verfügbarkeit von transgenen Tieren und viralen Konstrukten in absehbarer Zeit weiter zunehmen wird. Daher dürften Zellsortierungstechniken, die auf Fluoreszenz basieren, noch weiter verbreitet und wertvoll werden.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen haben.
Danksagungen
Die Autoren danken der hervorragenden technischen Unterstützung von Jenny Kirsch und Ana Teichmüller am Flow Cytometry Core Facility, Deutsches Rheuma-Forschungszentrum, Berlin. Wir danken Jie Song für seine Hilfe bei der Überlebensanalyse. Wir möchten uns auch bei Rita Loureiro für ihre Hilfe bedanken, die Bilder von fluoreszierenden Mäusen zu erfassen, und Christian Ebner für die kritische Lektüre des Protokolls. Die transgenen Ratten VGAT-Venus wurden von Dr. Y. Yanagawa, M. Hirabayashi und Y. Kawaguchi im National Institute for Physiological Sciences, Okazaki, Japan, mit pCS2-Venus erzeugt, die von Dr. A. Miyawaki zur Verfügung gestellt wurde. Diese Arbeit wurde von der Deutschen Forschungsgemeinschaft (DFG EXC 257 bis IV) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Neural Basal A media (NBA) | ThermoFisher Scientific | 10888022 | Cell Culture Buffer |
| B27 | ThermoFisher Scientific | 17504001 | Culture supplement |
| Glutamax | ThermoFisher Scientific | 35050-038 | Culture supplement |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140-122 | Antibiotic |
| Poly-L-Lysine | SIGMA | P1399 | Coverslip coating |
| Papain | SIGMA | P4762-1G | Enzyme |
| Bovine Serum Albumin | SIGMA | A3294-100G | Serum |
| Hibernate A low fluorescence media | Brain Bits Ltd | HALF | Cell Transport media |
| Dulbeccos Modified Eagles Medium (DMEM) | Biochrom | F0435 | Glial Culture Buffer |
| Fetal Calf Serum (FCS) | Biochrom | S0115 | Serum |
| Trypsin/EDTA | Biochrom | L2163 | Enzyme |
| Fine Tip Pasteur Pipette | Neo Labs | - | Used for trituration of cells |
| 24-well plates | BD | 353047 | Culture plate |
| 50 mL Falcon tubes | BD | 352070 | - |
| 15 mL Falcon tubes | BD | 352096 | - |
| Glass coverslips: 12 mm round | Roth | P231.1 | - |
| 35 mm Petri dish | Corning | 353001 | - |
| 100 mm Petri dish | Corning | 353003 | - |
| 30 µm CellTrics Cell Sieve | sysmex | 04-004-2326 | To remove cell clumps before cell sorting |
| Round bottom polystyrene tubes | BD | 352054 | Transport tube for sorted cells |
| Round bottom polypropylyne tubes | BD | 352063 | Collection tube for sorted cells |
| Cell culture inserts – 0.4 µm transparent PET | Falcon | 353 095 | For the co-culture of neurons and glia |
| Extra fine Bonn Scissors | Fine Scientific Tools | 14084-08 | To remove overlying skin and bone of mice |
| Extra narrow Scissors | Fine Scientific Tools | 14088-10 | To remove overlying skin and bone of rats |
| Forceps | Fine Scientific Tools | 11242-40 | To hold the head in place |
| Spatula (130 mm long/5 mm tip width) | Fine Scientific Tools | 3006.1 | To remove the brain to filter paper |
| Scalpel Blades | Swan-Morton | #0308 | To mechanically dissociate neural tissue |
| Haemocytometer (Neubauer Imroved) | Optik Labor | - | To cell count dissociated cells |
| Fluorescent Miners Goggles (excitation light) | Biological Laboratory Equipment Maintenance and Servce Ltd (BLS) | FHS/LS-1G | To excite TdTomato |
| Fluorescent Miners Goggles (emission filter) | Biological Laboratory Equipment Maintenance and Servce Ltd (BLS) | FHS/EF-4R2 | Td Tomato compatible emission filter |
| Fluorescent Miners Goggles (excitation light) | Biological Laboratory Equipment Maintenance and Servce Ltd (BLS) | FS/ULS-02B2 | To excite Venus |
| Fluorescent Miners Goggles (emission filter) | Biological Laboratory Equipment Maintenance and Servce Ltd (BLS) | FS/TEF-3GY1 | Venus compatible emission filter |
| Mouse-Anti-GFP primary antibodies | UC Davis | 75-132 | To enhance Venus signal following fixation |
| Mouse-Anti-GFAP primary antibodies | SIGMA | G-3893 | The identification of reactive astrocytes |
| Rabbit-Anti-CD11b primary antibodies | Southern Biotech | 1561-15 | The identification of microglial cells |
| Rabbit-Anti-MBP primary antibodies | Millipore | AB980 | The identification of oligodendrocyes |
Referenzen
- Radcliff, G., Jaroszeski, M. J. Basics of flow cytometry. Methods in Molecular Biology. 91, 1-24 (1998).
- Feher, K., Kirsch, J., Radbruch, A., Chang, H. D., Kaiser, T. Cell population identification using fluorescence-minus-one controls with a one-class classifying algorithm. Bioinformatics. 30 (23), 3372-3378 (2014).
- Sergent-Tanguy, S., Chagneau, C., Neveu, I., Naveilhan, P. Fluorescent activated cell sorting (FACS): a rapid and reliable method to estimate the number of neurons in a mixed population. Journal of Neuroscience Methods. 129 (1), 73-79 (2003).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Critical Reviews in Biotechnology. 37 (2), 163-176 (2017).
- Guez-Barber, D., et al. FACS purification of immunolabeled cell types from adult rat brain. Journal of Neuroscience Methods. 203 (1), 10-18 (2012).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Turko, P., Groberman, K., Browa, F., Cobb, S., Vida, I. Differential Dependence of GABAergic and Glutamatergic Neurons on Glia for the Establishment of Synaptic Transmission. Cerebral Cortex. , (2018).
- Uematsu, M., et al. Quantitative chemical composition of cortical gabaergic neurons revealed in transgenic venus-expressing rats. Cerebral Cortex. 18, 315-330 (2008).
- Goebbels, S., Bormuth, I., Bode, U., Hermanson, O., Schwab, M. H., Nave, K. -. A. Genetic targeting of principal neurons in neocortex and hippocampus of NEX-Cre mice. Genesis. 44, 611-621 (2006).
- Banker, G. A. Trophic interactions between astroglial cells and hippocampal neurons in culture. Science. 209, 809-810 (1980).
- Lindsay, R. M. Adult rat brain astrocytes support survival of both NGF-dependent and NGF-insensitive neurones. Nature. 282 (5734), 80-82 (1979).
- Geissler, M., et al. Primary hippocampal neurons, which lack four crucial extracellular matrix molecules, display abnormalities of synaptic structure and function and severe deficits in perineuronal net formation. Journal of Neuroscience. 33 (18), 7742-7755 (2013).
- Wang, Y., et al. Fluorescent labeling of both gabaergicand glycinergic neurons in vesicular GABA transporter (VGAT)-venus transgenic mouse. Neuroscience. 164 (3), 1031-1043 (2009).
- Höltje, M., et al. Role of Rho gtpasein astrocyte morphology and migratory response during in vitro wound healing. Journal of Neurochemistry. 95 (5), 1237-1248 (2005).
- Booker, S. A., Song, J., Vida, I. Whole-cell Patch-clamp Recordings from Morphologically- and Neurochemically-identified Hippocampal Interneurons. Journal of Visualized Experiments. , e51706 (2014).
- Pfrieger, F. W., Barres, B. A. Synaptic efficacy enhanced by glial cells in vitro. Science. 277 (5332), 1684-1687 (1997).
- Ullian, E. M., Sapperstein, S. K., Christopherson, K. S., Barres, B. A. Control of synapse number by glia. Science. 291, 657-661 (2001).
- Christopherson, K. S., et al. Thrombospondins are astrocyte-secreted proteins that promote CNS synaptogenesis. Cell. 120, 421-433 (2005).
- Berghuis, P., et al. Brain-derived neurotrophic factor controls functional differentiation and microcircuit formation of selectively isolated fast-spiking gabaergic interneurons. European Journal of Neuroscience. 20 (5), 1290-1306 (2004).
- Liddelow, S. A., et al. Activated microglia induce neurotoxic reactive astrocytes via Il-1α, tnfα, and c1q. Nature. 541, 481-487 (2017).
- Tomlinson, M. J., Tomlinson, S., Yang, X. B., Kirkham, J. Cell separation: Terminology and practical considerations. Journal of Tissue Engineering. 4, (2013).
- Brewer, G. J., Torricelli, J. R., Evege, E. K., Price, P. J. Optimized survival of hippocampal neurons in B27-supplemented Neurobasal, a new serum-free medium combination. Journal of Neuroscience Research. 35 (5), 567-576 (1993).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten