A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الحصول على البيانات وتحليلها في الدماغ أثار استجابة القياس السمعي في الفئران
In This Article
Summary
الدماغ أثار استجابة القياس السمعي هو أداة هامة في علم وظائف الأعضاء العصبية السريرية. في الوقت الحاضر، يتم تطبيق الدماغ أثار استجابة القياس السمعي أيضا في العلوم الأساسية والدراسات ما قبل السريرية التي تنطوي على كل من النماذج الحيوانية الدوائية والوراثية. نقدم هنا وصفًا مفصلًا لكيفية تسجيل الاستجابات السمعية للجذع الدماغي وتحليلها بنجاح في الفئران.
Abstract
[برينستم] يستحضر استجابة علم سمعيّ ([بيرا]) ذو أهمية مركزية في الفيزيولوجيا عصبيّة سريريّة. كما التقنيات المحتملة الأخرى التي أثيرت (EP)، مثل الإمكانات التي أثيرت بصريا (VEPs) أو الإمكانات الحسية الجسدية التي أثيرت (SEPs)، يتم تشغيل الإمكانات السمعية التي أثيرت (AEPs) من خلال العرض المتكرر للمحفزات متطابقة، و استجابة الدماغ الكهربائي (EEG) التي يتم متوسطها في وقت لاحق مما أدى إلى انحراف إيجابي متميز (ع) وسلبي (ن). في البشر، يمكن استخدام كل من السعة والكمون من القمم الفردية لتوصيف التعديلات في التزامن وسرعة التوصيل في الدوائر العصبية الكامنة. والأهم من ذلك، يتم تطبيق هذه التقييمات أيضاً في العلوم الأساسية وما قبل السريرية لتحديد وتوصيف الوظيفة السمعية في النماذج الدوائية والحيوانية الوراثية. وحتى أكثر من ذلك، يتم استخدام النماذج الحيوانية جنبا إلى جنب مع الاختبارات الدوائية للتحقيق في الفوائد المحتملة في علاج فقدان السمع الحسي العصبي (على سبيل المثال، العجز في السمع الناجم عن العمر أو الضوضاء). نقدم هنا وصفًا تفصيليًا ومتكاملًا لكيفية تسجيل الاستجابات السمعية التي تثيرها جذع الدماغ (ABRs) في الفئران باستخدام تطبيق النقر والاندفاع النغمة. وينصب تركيز هذا البروتوكول بشكل خاص على الإسكان الحيواني قبل التجريبية، والتخدير، وتسجيل ABR، وعمليات تصفية ABR، وتحليل وظيفة نمو السعة الآلية القائمة على الموجة، والكشف عن الكمون.
Introduction
جانب مركزي من علم وظائف الأعضاء في الدماغ هو قدرته على معالجة المعلومات البيئية مما يؤدي إلى مختلف الناتج الجوهرية أو الخارجية، مثل التعلم، والذاكرة، وردود الفعل العاطفية، أو الاستجابات الحركية. ويمكن استخدام مختلف النهج التجريبية والتشخيصية لتوصيف الاستجابة الكهرولوجية لأنواع الخلايا العصبية الفردية أو مجموعات /مجموعات من الخلايا العصبية داخل الدوائر العصبية ذات الصلة التحفيز. هذه التقنيات الكهرولوجية تغطي أبعاد مختلفة spatiotimeعلى الجزئي، والمتوسط، والكلي 1. ويشمل مستوى الميكروسك التجانب والنهج الحالية المشبك في مختلف وسائط التصحيح المشبك باستخدام، على سبيل المثال، الخلايا العصبية المستزرعة أو المنفصلة بشكل حاد1. هذه التقنيات في المختبر تسمح لتوصيف الكيانات الحالية الفردية وتعديلها الدوائية2،3. بيد أن أحد العيوب الأساسية يتمثل في الافتقار إلى المعلومات النظامية فيما يتعلق بتكامل وتجهيز المعلومات المتعلقة بالدوائر الجزئية والكلية. يتم التغلب على هذا الضعف جزئيا من خلال تقنيات في المختبر من مقياس الأقطاب، مثل صفائف متعددة الأقطاب التي تسمح لتسجيلات متعددة الأقطاب خارج الخلية في وقت واحد ليس فقط في الخلايا العصبية المستزرعة ولكن أيضا في شرائح الدماغ الحاد4، 5.في حين يمكن الحفاظ على الدوائر الدقيقة في شرائح الدماغ إلى حد معين (على سبيل المثال، في الحصين)، وعادة ما تفقد الترابطات طويلة المدى6. في نهاية المطاف، لدراسة الترابط الوظيفي داخل الدوائر العصبية، الجهازية في التقنيات الكهرولوجية الحية على مقياس الكلي هي طريقة الاختيار7. وتشمل هذه النهج، من بين أمور أخرى، السطحية (فوق الجافية) والعميقة (داخل الدماغ) EEG التسجيلات التي يتم تنفيذها في كل من البشر والنماذج الحيوانية1. وتستند إشارات تخطيط الدماغ EEG في الغالب على المدخلات متشابك متزامنة على الخلايا العصبية الهرمية في طبقات القشرية المختلفة التي يمكن أن تكون مثبطة أو محفزة في الرئيسية، على الرغم من الغلبة العامة للمدخلات المحفزة8. عند التزامن، يتم تلخيص التحولات التي تستند إلى المشاركات المحفزة المحتملة في المجالات الكهربائية خارج الخلية لتشكيل إشارة قوة كافية ليتم تسجيلها على فروة الرأس باستخدام الأقطاب السطحية. وتجدر الإشارة إلى أن تسجيل فروة الرأس القابل للكشف من قطب كهربائي فردي يتطلب نشاط عشرة آلاف من الخلايا العصبية الهرمية وسلاح معقد من الأجهزة التقنية وأدوات المعالجة، بما في ذلك مكبر للصوت، وعمليات التصفية (مرشح تمرير منخفض، عالية تمرير مرشح، مرشح الشق)، والأقطاب الكهربائية مع خصائص موصل محددة.
في معظم الأنواع الحيوانية التجريبية (أي الفئران والفئران)، وطريقة نهج EEG فروة الرأس المستندة إلى الإنسان لا ينطبق من الناحية الفنية، كما أن الإشارة التي تولدها القشرة الكامنة ضعيفة جدا بسبب العدد المحدود من الخلايا العصبية الهرمية متزامنة9، 10،11. في القوارض، والأقطاب السطحية (فروة الرأس) أو الأقطاب تحت الجلد وبالتالي ملوثة بشدة عن طريق تخطيط القلبوالقطع الأثرية الكهربائي في الغالب التي تجعل من التسجيلات تخطيط كهربية الدماغ عالية الجودة مستحيلة 9،11، 12.عند استخدام الفئران والفئران تتحرك بحرية غير مُنقّع، وبالتالي فإنه من الإلزامي أن تسجل مباشرة إما من القشرة عن طريق أقطاب فوق الجافية أو من الهياكل العميقة داخل الدماغ لضمان الاتصال المادي المباشر لطرف الاستشعار من القطب الرصاص / زرع إلى مجموعات الخلايا العصبية توليد إشارة. ويمكن تنفيذ هذه النهج EEG إما في إعداد نظام مقيد المربوطة أو باستخدام نهج القياسعن بعد الراديو EEG غير المقيد زرع 9،10،11. كلا الأسلوبين لها إيجابياتها وسلبياتها ويمكن أن تكون نهجا قيما في التوصيف النوعي والكمي للنوبات حساسية / ضبط النشاط، إيقاع circadian، والهندسة المعمارية النوم، والنشاط المذبذب، والتزامن، بما في ذلك تحليل التردداتالزمنية، وتحليل المصادر، وما إلى ذلك 9،10،13،14،15،16،17.
وفي حين أن النظم المربوطة والقياس عن بعد الراديوي تسمح بتسجيلات تخطيط كهربية الدماغ في ظل ظروف تقييدية/شبه تقييدية أو غير تقييدية، على التوالي، فإن الظروف التجريبية ذات الصلة لا تتطابق مع متطلبات تسجيلات ABR. الطلب الأخير على المحفزات الصوتية المحددة التي يتم تقديمها بشكل متكرر مع مرور الوقت مع مواقف محددة من مكبر الصوت والحيوان التجريبي ومستويات ضغط الصوت الخاضعة للرقابة (SPLs). ويمكن تحقيق ذلك إما عن طريق تثبيت الرأس في ظل ظروف تقييدية أو بعد التخدير18،19. للحد من الإجهاد التجريبي ، يتم تخدير الحيوانات عادة خلال تجربة ABR ، ولكن ينبغي اعتبار أن التخدير يمكن أن يتداخل مع ABRs19،20.
كسمة عامة، يتم بناء تخطيط كهربية الدماغ من ترددات مختلفة في نطاق الجهد من 50-100 درجة مئوية. في الحالة اليقظة، تسود ترددات بيتا (β) وغاما (γ) مع سعة أقل. عندما تصبح الحيوانات نعسان أو تغفو، ألفا (α)، ثاتا (θ)، ودلتا (δ) الترددات تنشأ، وتظهر زيادة EEG السعة21. وبمجرد تحفيز القناة الحسية (مثل المسار الصوتي)، يتم التوسط في نشر المعلومات عن طريق النشاط العصبي من خلال الجهاز العصبي المحيطي والمركزي. مثل هذا التحفيز الحسي (على سبيل المثال، الصوتي) يؤدي إلى ما يسمى بـ EPs أو الاستجابات التي تثيرها. وتجدر الإشارة إلى أن الإمكانات المتصلة بالأحداث أقل بكثير من القدرة على السعة من تخطيط الدماغ (أي بضعة ميكروفولتات فقط). وبالتالي، فإن أي نظام تخطيط موارد المؤسسات الفردية على أساس حافز واحد سيفقد على خلفية تخطيط كهربية الدماغ ذات السعة الأعلى. ولذلك، فإن تسجيل نظام تخطيط موارد المؤسسات يتطلب التطبيق المتكرر للمحفزات المتطابقة (على سبيل المثال، النقرات في تسجيلات ABR) والمتوسط اللاحق للقضاء على أي نشاط خلفي وتحف تخطيط كهربية الدماغ. إذا تم إجراء تسجيلات ABR في الحيوانات التخدير، فمن السهل استخدام الأقطاب تحت الجلد هنا.
وأساساً، تشمل هذه التدابير المجالات المجالات التي تُعنى بالكمون القصير، والتي ترتبط عادة ً بـ ABRs أو BERA، بالإضافة إلى الإمكانات اللاحقة مثل الاستجابات الإلكترونية للمتوسّطات (استجابات الكمون المتوسّط] [MLR]) وEPs22طويلة الكمون. الأهم من ذلك، اضطراب في معالجة المعلومات من المعلومات السمعية غالبا ما تكون سمة مركزية من الأمراض العصبية النفسية (أمراض إزالة الميايلينا، والفصام، وما إلى ذلك) والمرتبطة التعديلات AEP23،24 ،25. في حين أن التحقيقات السلوكية هي فقط قادرة على الكشف عن ضعف وظيفي، والدراسات AEP تسمح لتحليل دقيق spatiotime من الخلل السمعي المتعلقة هياكل عصبية تشريحية محددة26.
يتم عادة ً الكشف عن ABRs في وقت مبكر، ووقت الكمون القصير صوتياً EPs عند تطبيق النقر اتّبع معتدل إلى عالي الكثافة، وقد تحدث ما يصل إلى سبع قمم ABR (WI-WVII). ترتبط الموجات الأكثر أهمية (WI-WV)بالهياكل العصبية التشريحية التالية: WI إلى العصب السمعي (الجزء القاصي، داخل الأذن الداخلية)؛ WII إلى نواة القوقعة (الجزء القريب من العصب السمعي، إنهاء جذع الدماغ)؛ WIII إلى مجمع القلة متفوقة (SOC)؛ WIV إلى lemniscus الجانبية (LL); WV إلى إنهاء lemniscus الجانبية (LL) داخل كوليكولوس السفلي (IC) على الجانب التعارضي27 (الشكلالتكميلي 1). وتجدر الإشارة إلى أن WII-WV من المرجح أن يكون أكثر من بنية تشريحية واحدة من المسار السمعي الصاعد المساهمة فيها. وتجدر الإشارة إلى أن الارتباط الدقيق بين القمم والهياكل الأساسية للجهاز السمعي لم يتم توضيحه بالكامل بعد.
في علم السمع، يمكن استخدام ABRs كأداة للفحص والتشخيص وللرصد الجراحي28،29. من المهم للغاية لتحديد خلل الحدوث، وفرط الهسق، والغضروف (على سبيل المثال، في فقدان السمع المرتبط بالعمر، وفقدان السمع الناجم عن الضوضاء، وفقدان السمع الأيضي والخلقي، وفقدان السمع غير المتماثلة والعجز في السمع بسبب التشوهات أو التشوهات والإصابات والأورام)28. كما أن هذه التقارير ذات صلة كاختبار فحص للأطفال المصابين بفرط النشاط وذوي الإعاقة الذهنية أو للأطفال الآخرين الذين لن يتمكنوا من الاستجابة للقياس السمعي التقليدي (على سبيل المثال، في الأمراض العصبية/النفسية مثل إعاقة، ومرض التصلب المتعدد، والتوحد، وما إلى ذلك29 , 30)وفي تطوير وتركيب الجراحية من يزرع القوقعة28. وأخيرا، يمكن أن توفر ABRs نظرة ثاقبة قيمة في الآثار الجانبية السامة للأوتوكسالات العصبية النفسية، مثل مضادات الصرع31،32.
وقد ثبت قيمة ترجمة المعرفة العصبية الفسيولوجية التي تم الحصول عليها من نماذج الماوس الدوائية أو المعدلة وراثيا للبشر في العديد من البيئات، وخاصة على مستوى ERPs في النماذج السمعية في الفئران والفئران33، 34و35 . وبالتالي يمكن ترجمة نظرة جديدة إلى الـ AEPs المبكرة المتغيرة والتغيرات المرتبطة بها في معالجة المعلومات السمعية في الفئران والجرذان إلى البشر، وهي ذات أهمية مركزية في توصيف والنماذج الإنفئية للسمعيات والعصبية و الأمراض العصبية النفسية في المستقبل. نقدم هنا وصفًا مفصلًا لكيفية تسجيل وتحليل ABRs بنجاح في الفئران للأغراض العلمية والسمية والدوائية الأساسية.
Protocol
تم تنفيذ جميع الإجراءات الحيوانية وفقا للمبادئ التوجيهية للمجلس الألماني لرعاية الحيوان وتمت الموافقة على جميع البروتوكولات من قبل اللجنة المؤسسية والوطنية المحلية لرعاية الحيوانات (Landesamt für Natur, Umwelt, und Verbraucherschutz, State مكتب شمال الراين وستفاليا، وزارة الطبيعة والبيئة والاستهلاكية [LANUV NRW]، ألمانيا). كما يشهد المؤلفان بأن جميع التجارب على الحيوانات قد أجريت وفقاً للدليل الوطني للمعاهد الصحية لرعاية واستخدام الحيوانات المختبرية (منشورات المعاهد القومية للصحة رقم 80-23) المنقحة لعام 1996 أو قانون الحيوانات في المملكة المتحدة (الإجراءات العلمية) 1986 والمبادئ التوجيهية المرتبطة بها، أو توجيه مجلس الجماعات الأوروبية المؤرخ 24 نوفمبر 1986 (86/609/EEC) و22 سبتمبر 2010 (2010/63/EU). وقد بُذلت جهود محددة للتقليل إلى أدنى حد من عدد الحيوانات المستخدمة ومعاناتها (استراتيجية 3R [الاستبدال والتخفيض والصقل]).
1- الحيوانات التجريبية
-
اختيار الحيوانات والأنواع التجريبية
- إجراء دراسات ABR في القوارض / نماذج القوارض (أي الفئران أو الفئران) التي تفي بمتطلبات الهومولوجيا، ومتساوي الأشكال، والقدرة على التنبؤ المتعلقة بمرض بشري معين. وهذا أمر له أهمية خاصة من حيث الجوانب الأساسية في علم الأعصاب الترجمة.
ملاحظة: النظر في أن السلالات الماوس والفئران المتنوعة المتاحة يمكن أن تظهر الاختلافات في الخصائص الفسيولوجية والمرضية الفسيولوجية الأساسية36،37،38. ويجب أن تؤخذ هذه الخصائص المتصلة بخط الماوس/الفئران في الاعتبار عند التخطيط التجريبي. - النظر في التعديلات الخاصة بالماوس والفئران في علم وظائف الأعضاء والصيدلة التي قد يكون لها تأثير على التجارب الفسيولوجية الكهربائية (على سبيل المثال الحساسيات المخدرة المتغيرة، والإيقاعي الدائري، والتعرض للنوبات [السمعية] ، والعمر، والخلفية الوراثية)39،40،41،42.
- إدراج الطبقات الجنسانية في تصميم الدراسة. تذكر أن الدورة الإستفاضة يمكن أن تؤثر بشدة على حساسية التخدير، والإيقاع المركزي، والتبعية الدائرية، ونشاط النوبات (النوبات السمعية) ومعالجة المعلومات الحسية (السمعية)43،44 , 45- وهكذا، يجري تحليل جنساني.
ملاحظة: تقييد الفئران الذكور إذا كانت القدرة المالية والتجريبية محدودة، على الرغم من أن مختلف المعلمات العصبية الفسيولوجية من الإناث ركوب الدراجات عادة لا يبدو أن تظهر زيادة التباين مقارنة مع الذكور46.
- إجراء دراسات ABR في القوارض / نماذج القوارض (أي الفئران أو الفئران) التي تفي بمتطلبات الهومولوجيا، ومتساوي الأشكال، والقدرة على التنبؤ المتعلقة بمرض بشري معين. وهذا أمر له أهمية خاصة من حيث الجوانب الأساسية في علم الأعصاب الترجمة.
-
إسكان الحيوانات ومناولتها
- منزل الفئران أو الفئران في أقفاص التهوية بشكل فردي داخل منشأة حيوانية.
- نقل الحيوانات التجريبية من منشأة الحيوان إلى خزانات التهوية الموجودة في غرف مختبر خاصة مخصصة للتخدير، ووضع القطب ABR، وتسجيلات ABR.
- تأكد من أن الحيوانات يتم إيواؤها في خزانة التهوية في ظل الظروف البيئية القياسية (أي، مع درجة حرارة 21 ± 2 درجة مئوية، 50٪ -60٪ الرطوبة النسبية، والتقليدية 12/12 ساعة ضوء / دورة مظلمة). السماح للالحيوانات للتأقلم والتكيف مع هذا النمط circadian لمدة 14 يوما على الأقل قبل التجريب اللاحقة.
- استخدام أقفاص البولي واضحة النوع الثاني (26.7 سم × 20.7 سم × 14.0 سم، مساحة 410 سم2)لإسكان الفئران في مجموعات من 3-4 واستخدام أقفاص البولي واضحة النوع الثالث (42.5 سم × 26.6 سم × 18.5 سم، وهي مساحة 800 سم2)للفئران. توفير إمكانية الحصول على مياه الشرب والكريات الغذائية القياسية.
- تجنب فصل/عزل الحيوانات التجريبية قبل وبعد تسجيلات ABR حيث يمكن أن تمارس العزلة إجهادًا شديدًا يؤثر على النتائج التجريبية. وهكذا، وضع الحيوانات مرة أخرى في قفص منزلهم بعد التخدير، ووضع القطب ABR، وتسجيلات ABR.
- لا تطبق شروط السكن المفتوح لأنها تخضع لمجموعة متنوعة من العيوب التجريبية، لا سيما في الدراسات السمعية. خزانات التهوية، بدلا من ذلك، حماية من الإجهاد الصوتي قبل وفيما بين الإجراءات السمعية التجريبية التي يمكن أن تؤدي خلاف ذلك إلى فقدان السمع الحسي العصبي (على سبيل المثال، فقدان السمع الناجم عن الضوضاء) وبالتالي تؤثر على النتائج.
- استخدام المعدات الصحية والتخدير والتقنية الخاصة بالماوس والفئران بحيث لا يمكن للفئران أو الفئران أن تشعر بوجود بعضها البعض لأن الإدراك الحسي المتبادل للأنواع المتنافسة قد يؤدي إلى عوامل مربكة يمكن تجنبها في الدراسات.
2. تخدير الماوس
- إجراء التخدير باستخدام التخدير عن طريق الحقن. إعداد مزيج من هيدروكلوريد الكيتامين (جرعة القوارض: 100 ملغ / كغ) وهيدروكلوريد xylazine (جرعة القوارض: 10 ملغ / كغ) في 0.9٪ كلوريد كل أو حل الرنين وحقن الحيوان intraperitoneally على أساس وزن الجسم.
ملاحظة: لا ينصح باستنشاق المخدرات عن طريق الإيسوفلوران لأن إجراء ABR يتطلب عادة مقصورة مخففة سليمة وقفص فاراداي، مما يؤدي إلى قيود مكانية داخل إعداد التسجيل. على الرغم من أن العديد من التخدير تعمل على نظام NMDA والتأثير الواضح على نتائج تسجيل ABR، لا ينصح نهج تقييد غير مخدر في تسجيلات ABR كإجراءات تقييدية تحت الوعي تحفز الإجهاد الدرامي للحيواني، مع شديدة تشكيل القطع الأثرية اللاحقة في ABRs. - مراقبة الحيوانات بعناية لعمق التخدير عن طريق إجراء قرصة الذيل، قرصة القدم، ورصد معدل التنفس (الفئران: 150-220 التنفس / دقيقة). تحقق من وجود يلهث ممكن والتصدي إذا لزم الأمر.
ملاحظة: خطوط الماوس المختلفة أو نماذج الماوس الدوائية يمكن أن تظهر حساسيات مختلفة للتخدير. وينطبق الشيء نفسه على نماذج الماوس المتحولة. التنبيب داخل الرغامى ليس أمرًا ضروريًا في هذا الإعداد التجريبي ولا ينصح به. كما أن التنبيب يزيد من خطر الصدمة إلى القصبة الهوائية والعدوى، وفائدة / خطر التنبيب داخل الرغامى خلال إجراء ABR سلبي.
3- الجوانب العامة للترتيبات والأجهزة المتعلقة بعلم اللب
- تطبيق الدفء التكميلي ة أثناء وبعد تسجيلات ABR باستخدام بطانية التدفئة المنزلية للحفاظ على درجة حرارة الجسم الأساسية للجسم. الحفاظ على هذا الأخير في 36.5-38.0 درجة مئوية (98.6-100.4 درجة فهرنهايت).
ملاحظة: انخفاض حرارة الجسم هو عامل خطر في القوارض الصغيرة بسبب ارتفاع نسبة سطح الجسم (سطح جسم الماوس = 10.5 × (الوزن في ز)2/3؛ سطح جسم الفئران = 10.5 × (الوزن في ز)2/3)إلى حجم الجسم. - تغطية عيون الحيوان مع مرهم المسيل للدموع الاصطناعية القائمة على النفط أو 5٪ dexpanthenol خلال عملية تسجيل ABR كامل لتجنب جفاف القرنية. تابع هذا الإجراء حتى يتم استعادة رد الفعل الوامض بشكل كامل.
- تعقيم الأدوات التجريبية (انظر جدولالمواد) باستخدام الأوتوكلاف أو المطهرات.
ملاحظة: ينصح باستخدام جهاز تعقيم أداة جراحية قائمة على الحرارة مع الخرز الزجاجي. - لوضع القطب ABR الدقيق، استخدم مجهر التكبير الجراحي ة مع مصدر الضوء البارد للإضاءة المكثفة عبر أدلة الضوء المنقولة المرنة أو ذاتية الدعم.
- استخدام معطف مختبر نظيفة، قناع الوجه، غطاء الرأس، والقفازات المعقمة أثناء التعامل مع الحيوانات التجريبية والتجريب.
ملاحظة: يمكن أن تختلف الأدوات واللوازم المثلى بين المختبرات ويجب أن تفي بالمعايير الخاصة بالمختبر والمعايير المؤسسية.
4. ABR التسجيلات
ملاحظة: يستند البروتوكول الموضح هنا إلى نظام ABR متاح تجارياً للتسجيلات المنوية وثنائية الأذن. والأهم من ذلك أن المسألة العلمية التي يتعين معالجتها يجب أن تستوفي المواصفات التقنية لنظام ABR المستخدم. فعلى سبيل المثال، يمكن استخدام تحليل ABR للتسجيلات بكلتا الأذنين للتحقيق في الترميز الجانبي للمحفزات السمعية في المسار السمعي ولدراسة عدم التماثل الجانبي المحيطي في الأمراض العصبية النفسية.
- إجراء معايرة ترددات التحفيز في كل يوم من التسجيل عن طريق وضع ميكروفون متصل بمكبر للصوت ونظام المعالجة (انظر جدولالمواد) داخل مقصورة تخفيف الصوت في الموقع مع الصحيح الاتجاه حيث سيتم وضع الأذن murine التجريبية.
- قم بتشغيل مكبر الصوت المسبق المتصل بالميكروفون قبل 5 دقائق على الأقل من المعايرة للسماح بمعادلة النظام.
- قم بتشغيل منظار الذبذبات.
- ضع الميكروفون المتصل بمكبر للصوت مسبقًا داخل حجرة تخفيف الصوت لمحاكاة أذن المورين التجريبية.
- افتح برنامج المعالجة والاستحواذ المتاح تجارياً (انظر جدولالمواد).
- حدد ملف Cal200K المعايرة داخل البرنامج لتنشيط وضع تكوين المعايرة واختيار المعلمات وفقا للظروف التجريبية.
- استخدم نظام المعالج لتنفيذ إجراء المعايرة. تأكد من أن المواصفات الفنية للميكروفون ومكبر الصوت من حيث حدود SPL، ونطاق التردد، والتوزيع تتماشى.
- حدد وبدء تشغيل بروتوكول تحفيز النقرة المعرفة مسبقاً.
- تشغيل بنقرة واحدة SPL (ويفضل، الحد الأقصى SPL) للتحقق من أن الطيف من المحفزات الصوتية كما تم تحليلها من قبل على الانترنت سريع فورييه التحول (FFT) من الذبذبات يطابق المتطلبات (نطاق الطاقة كبيرة).
- حدد وبدء بروتوكول تحفيز انفجار النغمة المحدد مسبقًا ضمن نطاق الاهتمام (على سبيل المثال، 1-42 كيلو هرتز).
- تأكد من طيف تردد محفزات الاختبار الصوتية المسجلة باستخدام منظار الذبذبات وFFT عبر الإنترنت.
ملاحظة: المعايرة اليومية للنظام وترددات التحفيز ضرورية لضمان أن ترددات التحفيز وSPLs ضمن نطاقات العمل المقبولة.
- ضع الفأر المُعْلَّم داخل حجرة مخففة صوتية مبطنة برغوة صوتية.
ملاحظة: يجب أن تكون المقصورة بأكملها مغطاة بقفص فاراداي (معدن متشابك حسب الطلب أو واحد تجاري) لحماية تسجيلات ABR من التداخل الكهربائي الخارجي وحمايتها من الضوضاء. - لتسجيل الإمكانات السمعية التي تثيرها الدماغ المنوية، أدخل أقطاب اولات من الفولاذ المقاوم للصدأ تحت الجلد في الرأس، محوري من البينا (إيجابية [+] قطب كهربائي) والبطين من بينا اليمين أو اليسار (سلبي [-] القطب الكهربائي) اعتمادا على الأذن ليتم قياسها. بالنسبة للتسجيلات بكلتا الأذنين، ضع الأقطاب الكهربائية السالبة على كل من البينا الأيمن والأيسر. وضع القطب الأرضي في الورك من الحيوان (الشكلالتكميلي1).
- قبل الإدراج، شكل شكل هوك في غيض من القطب الفولاذ المقاوم للصدأ بحيث يتم ضمان تثبيت تحت الجلد من الأقطاب الكهربائية47.
- إجراء قياسات المعاوقة لجميع الأقطاب الكهربائية قبل كل تسجيل للتحقق من تحديد موضع القطب المناسب / الموصلية. استخدم زر فحص المقاومة على خشبة الرأس المكونة من أربع قنوات للتحقق من كل مستوى من مستويات مقاومة القطب الكهربائي.
ملاحظة: يجب أن تكون المقاومة أقل من 5 كيلو وات. - سجل ABRs في ظروف المجال الحر باستخدام مكبر صوت واحد (عرض نطاق تردد التردد، على سبيل المثال، في 1-65 كيلو هرتز) وضعت 10 سم مقابل منصة الحيوانات (الحافة الرائدة مكبر الصوت عمودي على محور الماوس بين الأورال). تأكد من أن موضع رأس الماوس/آذان الماوس هو موضع ميكروفون المعايرة، وفقًا للمسافة المحددة المختارة بين مكبر الصوت والميكروفون أثناء المعايرة.
ملاحظة: بدلاً من ظروف الحقل الحر، يمكن أيضًا استخدام أنابيب الأذن. ومع ذلك، الاحتياطات الخاصة والاختبارات ضرورية لتحديد SPLs في هذه الإعدادات. - برنامج بروتوكولات التحفيز للنقرات ورشقات نارية لهجة باستخدام البرامج المبرمجة ذاتيا أو المتاحة تجاريا (انظر جدول المواد). يجب إضافة معلمات التحفيز الفردية المذكورة أدناه إلى واجهة المستخدم الرسومية ذات الصلة.
- ابدأ بتكوين كيان التحفيز فوق (أي، حافز مدة 100 ميكروثانية مع قطبية بالتناوب [التبديل بين التكثيف والندرة] والطاقة الكبيرة المحددة. استخدم هذا الكيان التحفيزي لتحليل وتحديد عتبات النقر، وتماثل ABR للأذن اليسرى واليسرى، وسعة ABR W (I - IV)، وW (I - IV) في وقت لاحق.
- بدء تشغيل البرنامج واستخدام إطار التكوين لإضافة معلمات التحفيز فوق. انقر فوق تنفيذ لتشغيل البروتوكول.
- الاستمرار في تكوين الكيان التحفيزي الثاني، وهو انفجار نغمة 4.5 مللي ثانية (نبض الجيوب الأنفية العابرة) من القطبية بالتناوب مع ارتفاع المغلف هان وأوقات الخريف من 1.5 مللي ثانية لكل (بوابة / المنحدر مدة زمنية). النظر في مدة انفجار لهجة الحد الأدنى من 3 مللي ثانية، وخاصة بالنسبة لرشقات نارية لهجة منخفضة التردد. استخدم هذا التحفيز لتحليل وتحديد عتبات السمع الخاصة بالتردد في جميع الأنماط الجينية.
- مشابهة للخطوة 4.6.2 استخدام إطار التكوين لإضافة معلمات التحفيز الاندفاع نغمة ثم انقر فوق تنفيذ لتشغيل البروتوكول (كما هو مذكور من قبل الشركة المصنعة48).
- بالنسبة لدراسات انفجار النغمة، قم ببرمجة نطاق التردد المناسب الذي سيتم اختباره وفقًا للسؤال العلمي (على سبيل المثال، من kHz 1-42 في خطوات kHz 6). تأكد من أن نطاقات التردد التي سيتم تطبيقها تفي بالقدرات التقنية لمكبر الصوت (في هذه الحالة، مكبر صوت مغناطيسي متعدد الحقول مع عرض تردد يتراوح بين 1 و65 كيلو هرتز لظروف الحقول الحرة أو المغلقة).
- بالنسبة للمتوسط، قم بتعيين عدد المحفزات الصوتية المتسلسلة (النقرات أو رشقات النبرة)، على سبيل المثال، بمعدل 300 x بمعدل 20 هرتز.
- زيادة SPLs في 5 dB خطوات للنقرات و 10 خطوات ديسيبل لرشقات نارية لهجة، بدءاً من 0 ديسيبل تصل إلى 90 ديسيبل (زيادة وضع SPL).
ملاحظة: تم وصف كل من زيادة وتناقص أوضاع SPL في الأدبيات. قد يتم تكييف حجم خطوة SPL بسبب الأسئلة العلمية.
- تحديد مدة الحصول على بيانات ABR 25 مللي ثانية، بدءاً من فترة خط الأساس 5 مللي ثانية قبل ظهور التحفيز الصوتي الفردي (خط الأساس قبل ABR) وتجاوز قسم ABR 10 مللي ثانية بخط أساس آخر 10 مللي ثانية (خط الأساس بعد ABR) (الشكلالتكميلي 1 ).
- تطبيق معدل أخذ عينات مناسب لاكتساب بيانات ABR (على سبيل المثال، 24.4 كيلو هرتز) وفلتر ممر النطاق (تمرير عالي: 300 هرتز، تمرير منخفض: 5 كيلوهرتز) باستخدام مرشح بترورث 6 أعمدة. قم بتنشيط فلتر الدرجة إذا لزم الأمر.
ملاحظة: قد يتم تكييف معدل أخذ العينات وخصائص التصفية بسبب المتطلبات التجريبية. - نقل الإشارات الكهربائية الحيوية الناتجة المسجلة من الأقطاب الكهربائية تحت الجلد إلى مرحلة الرأس وإلى الأمام إلى مضخم مع تضخيم مناسب (على سبيل المثال، 20 أضعاف).
- استخدم برنامج معالجة نظام ABR محدد لتنسيق التحكم في مكبر الصوت والحصول على ABR ومعالجته ومتوسط وإدارة البيانات.
- حاول تنفيذ بروتوكولات ABR بأكملها (لعتبات السمع التي تثيرها النقرة والنغمة، والسعة القصوى، وتحليل زمن الوصول القصوى، وما إلى ذلك) في غضون حوالي 45 دقيقة. وهذا يتوافق مع وقت المخدرات العميقة باستخدام 100/10 ملغ الكيتامين / إكسيليزين داخل اقبيريونيال.
- تأكد من أن المعايرة، والبرمجة / التعديلات لعرض التحفيز والاستحواذ، وإعدادات التصفية، وما إلى ذلك تعمل كما هو متوقع قبل التخدير الحيوان وإجراء التسجيل الفعلي.
5. تحليل ABR
- تحليل عتبة السمع ABR الذي يثيره النقر والنغمة
- إجراء الكشف الآلي عن العتبة استناداً إلى منشورات سابقة لتجنب أوجه عدم الاتساق المحتملة في تحديد عتبة ABR عن طريق الفحص البصري/التقدير49و50و51و52.
- حدد ثلاث نوافذ زمنية متميزة (TWs) لحساب نسبة الإشارة إلى الضوضاء (SNR): TW1 (0-5 مللي ثانية)، TW2 (5-15 مللي ثانية)، وTW3 (15-25 مللي ثانية) (الشكلالتكميلي1).
- حساب الانحراف المعياري للضوضاء في خط الأساس داخل اثنين من TWs متميزة (أي TW1 و TW3)حيث لا يلاحظ أي AEPs. ويمكن إجراء هذا الحساب باستخدام برامج مبرمجة ذاتيا.
- حساب لكل قياس SPL ضمن سجل ABR تعيين كل من المتوسط والانحراف المعياري للبيانات المجمعة من TW1 و TW3.
- إعادة تعيين كافة نماذج التسجيل بشكل فردي بواسطة المتوسط المحسوب المقابل لإزالة أي إزاحة DC.
- لتحديد عتبة السمع، حدد أدنى SPL (dB) حيث تجاوزت قيمة سعة موجة واحدة على الأقل (WI-WIV)في إطار وقت استجابة ABR (TW2)أربعة أضعاف الانحراف المعياري المحسوب سابقاً.
ملاحظة: إذا لم يتم الكشف عن موجة ABR لتحليل عتبة النقر والتردد عند الحد الأقصى SPL، يتم تعيين مستوى عتبة اسمية 100dB إلى الأذن.
- ABR موجة السعة وموجة الكمون التحليل
- إجراء نهج قائم على الويفليت باستخدام موجة القبعة المكسيكية لتحديد الترتيب الزمني المتسلسل للموجات الإيجابية (ع) (القمم) وكذلك الموجات السلبية (ن) (الحفر) باستخدام موجة افتراضية عن طريق تحويل الويفليت المستمر (CWT) القائم على خوارزمية مطابقة النمط52 (الشكلالتكميلي1).
- رياضيا، يتم تمثيل CWT على النحو التالي53.
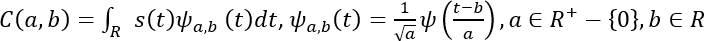
هنا، ق (ر) هو إشارة، a هو مقياس، ب هو الترجمة، و(ر) هو الموجة الأم، وa،ب(ر) هو الموجي تحجيم وترجمة، وC هو مصفوفة 2D من معاملات الموجة.
- رياضيا، يتم تمثيل CWT على النحو التالي53.
- في البداية، استخدم قياس 55 ديسيبل لكل تشغيل ABR لتحديد أفضل معلمات المقياس لكل موجة يتم تمريرها إلى CWT، مما يؤدي إلى ثلاث فئات: المقاييس 0.5-4 لجميع الموجات n، 0.5-6 لجميع موجات p، و0.5-12 لWIV لأن هذا هو الأوسع موجة داخل العينات.
ملاحظة: تم اختيار DB 55 SPL كموجات عموما ً الأكثر بروزاً هنا ويمكن الكشف عنها بشكل موثوق. - إثبات جميع الفئات للكشف بشكل موثوق عن التجميع الزمني الصحيح لـ WI-WIV ضمن جميع قياسات dB 55.
- لتحديد ABR WI-WIV في الترتيب الزمني الدقيق ضمن قياس dB 55، يتم تحديد القمم p وn-peaks (pits) في تسلسل ثابت باستخدام المواضع النسبية للقمم المحددة مسبقًا للحد من الإطار الزمني عمليات المسح اللاحقة.
- وبمجرد تحديد جميع القمم التسع عند dB 55، استخدم القيم ذات الصلة كنقاط انطلاق لإطار البحث الزمني لقياسات ضغط الصوت المجاورة (dB 50 وdB 60) قبل تكرار تحديد القمم 1-9.
- وبهذه الطريقة، حدد القمم p و n لجميع مستويات ديسيبل (dB 55-0 و dB 60-90) إن أمكن. وبمجرد أن لا يتم تحديد الذروة p و n بواسطة تحليل الوثيرة، يتم تحديد ترتيبها الزمني عن طريق حساب الإزاحة الزمنية للذروة إلى أي ذروة أخرى تم تحديدها في مستوى dB السابق.
- يؤدي تطبيق الإزاحة الزمنية إلى الذرى إلى أي قمة أخرى في مستوى الديسيبل الحالي إلى ثمانية مواضع زمنية محددة كحد أقصى للقمم غير المحددة حيث يؤخذ المتوسط على أنه أقرب تقريب.
- لتقييم وظيفة نمو السعة ومقارنة زمن الوصول لجميع الموجات (WI-WIV)،تميز السعة القصوى ومتوسط العصور المتوسطة لكل من القمم p ضمن الإطار الزمني للقمم n ذات الصلة.
- فحص بصريا جميع النتائج على أساس أداة wavelet التلقائية مبرمجة ذاتيا بعد ذلك، وإذا لزم الأمر، استبعاد ABR الفردية يعمل من الإحصاءات إذا كانت لا تفي بمعايير الإدراج /الجودة الصارمة.
ملاحظة: في كل من التحليل الآلي والتفتيش البصري لـ ABRs، يوصى باتباع نهج مزدوج التعمية.
- إجراء نهج قائم على الويفليت باستخدام موجة القبعة المكسيكية لتحديد الترتيب الزمني المتسلسل للموجات الإيجابية (ع) (القمم) وكذلك الموجات السلبية (ن) (الحفر) باستخدام موجة افتراضية عن طريق تحويل الويفليت المستمر (CWT) القائم على خوارزمية مطابقة النمط52 (الشكلالتكميلي1).
6- الرعاية بعد العملية الجراحية والعلاج بعد الجراحة
- مراقبة باستمرار الحيوانات حتى أنها قد استعادت وعيها وقادرة على الحفاظ على recumbency صارمة.
- لا تقم بإعادة الحيوان الذي خضع لتسجيلات ABR إلى الشركة من الحيوانات الأخرى حتى تعافى تماما.
- حقن كاربروفين (الماوس: 1X 5-10 ملغ / كغ، تحت الجلد؛ الفئران: 1x 2.5-5.0 ملغ / كغ، تحت الجلد) لعلاج الألم بعد الجراحة.
ملاحظة: لا يلزم علاج الألم طويل الأمد كما يتم إدخال أقطاب تسجيل ABR تحت الجلد. - بعد الجراحة، تغذية الكريات مبللة من أجل تسهيل تناول الطعام. مراقبة بعناية الغذاء (~ 15 غرام / 100 غرام من وزن الجسم / يوم؛ ~ 5 غرام / 24 ساعة) والماء (~ 15 مل / 100 غرام من وزن الجسم / يوم؛ ~ 5 مل / 24 ساعة) الاستهلاك.
- مراقبة الحيوانات عن كثب لعودة مواقفها الطبيعية والسلوك.
ملاحظة: لا ينصح الإدارة النظامية للمضادات الحيوية مثل إينروفلوكساسين أو تريميثوبريم-سلفوناميد هنا، لأن وضع القطب تحت الجلد هو من الحد الأدنى من الغازية فقط. يجب تقييد استخدام المضادات الحيوية ما لم تحدث علامات التهاب محلي أو معمم. - متابعة الانتعاش بعد التجريبية بعد تسجيلات ABR عن طريق التحكم في وزن جسم الحيوان.
النتائج
يمكن استخدام تسجيلات ABR التي تثيرها علامة النقر والنغمة لتقييم الاختلافات في عتبة السمع، ووظيفة نمو السعة، ومقارنة زمن الوصول. يتم تصوير ABRs التي تم استحضارها في وضع زيادة SPL في الشكل 1 للتحكم واثنين من خطوط الماوس المتحولة النموذجية التي تعاني من نقص في قن...
Discussion
يقدم هذا البروتوكول وصفًا مفصلًا ومتكاملًا لكيفية تسجيل استجابات جذع الدماغ السمعية في الفئران. وهو يركز بشكل خاص على المعالجة المسبقة للحيوانية، والتخدير، والعوامل المنهجية المربكة المحتملة. وتشمل هذه الأخيرة، في سبيل أمور منها نوع الجنس، وخط الماوس، والعمر، وظروف السكن. وتجدر الإشار?...
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
ويود المؤلفان أن يشكرا الدكتورة كريستينا كولب (المركز الألماني للأمراض العصبية) والدكتور روبرت ستارك (DZNE) على مساعدتهما في تربية الحيوانات والرعاية الصحية الحيوانية. وقد تلقى هذا العمل دعما ماليا من المعهد الاتحادي للأدوية والأجهزة الطبية.
Materials
| Name | Company | Catalog Number | Comments |
| AEP/OAE Software for RZ6 (BioSigRZ software) | Tucker-Davis Technologies (TDT) | BioSigRZ | |
| Binocular surgical magnification microscope | Zeiss Stemi 2000 | 0000001003877, 4355400000000, 0000001063306, 4170530000000, 4170959255000, 4551820000000, 4170959040000, 4170959050000 | |
| Cages (Macrolon) | Techniplast | 1264C, 1290D | |
| Carprox vet, 50mg/ml | Virbac Tierarzneimittel GmbH | PZN 11149509 | |
| Cold light source | Schott KL2500 LCD | 9.705 202 | |
| Cotton tip applicators (sterile) | Carl Roth | EH12.1 | |
| Custom made meshed metal Faraday cage (stainless steel, 2 mm thickness, 1 cm mesh size) | custom made | custom made | |
| 5% Dexpanthenole (Bepanthen eye and nose creme) | Bayer Vital GmbH | PZN: 01578681 | |
| Disposable Subdermal stainless steel Needle electrodes, 27GA, 12mm | Rochester Electro-Medical, Inc. | S03366-18 | |
| Surgical drape sheets (sterile) | Hartmann | PZN 0366787 | |
| Ethanol, 70% | Carl Roth | 9065.5 | |
| 1/4'' Free Field Measure Calibration Mic Kit | Tucker-Davis Technologies (TDT) | PCB-378C0 | |
| Gloves (sterile) | Unigloves | 1570 | |
| Graefe Forceps-curved, serrated | FST | 11052-10 | |
| GraphPad Prism 6 Software, V6.07 | GraphPad Prism Software, Inc. | https://www.graphpad.com/ | |
| Heat-based surgical instrument sterilizer | FST | 18000-50 | |
| Homeothermic heating blanked | ThermoLux | 461265 / -67 | |
| Ketanest S (Ketamine), 25mg/ml | Pfizer | PZN 08707288 | |
| Ringer’s solution (sterile) | B.Braun | PZN 01471434 | |
| Matlab software | MathWorks, Inc. | https://de.mathworks.com/products/matlab.html | |
| Medusa 4-Channel Low Imped. Headstage | Tucker-Davis Technologies (TDT) | RA4LI | |
| Medusa 4-Channel Pre-Amp/Digitizer | Tucker-Davis Technologies (TDT) | RA4PA | |
| Microphone | PCB Pieztronics | 378C01 | |
| Multi Field Speaker- Stereo | Tucker-Davis Technologies (TDT) | MF1-S | |
| Oscilloscope | Tektronix | DPO3012 | |
| Optical PC1 express card for Optibit Interface) | Tucker-Davis Systems (TDT) | PO5e | |
| Askina Braucel pads (cellulose absorbet pads) | B.Braun | PZN 8473637 | |
| Preamplifier | PCB Pieztronics | 480C02 | |
| RZ6 Multi I/O Processor system (BioSigRZ) | Tucker-Davis Technologies (TDT) | RZ6-A-PI | |
| 0.9% saline (NaCl, sterile) | B.Braun | PZN:8609255 | |
| SigGenRZ software | Tucker-Davis Technologies (TDT) | https://www.tdt.com/ | |
| Software R (version 3.2.1) + Reshape 2 (Version 1.4.1) + ggplot 2 (version 1.0.1) + datatable (version 1.9.4), + gdata (version 2.13.3), + pastecs (version 1.3.18), + waveslim (version 1.7.5), + MassSpecWavelet (version 1.30.0) | The R Foundation, R Core Team 2015 | Open Source Software (freely distributable) | |
| Sound attenuating cubicle | Med Associates Inc. | ENV-018V | |
| Standard Pattern Forceps, 12cm and 14.5 cm length | FST | 11000-12, 11000-14 | |
| Leukosilk tape | BSN medical GmbH & Co. KG | PZN 00397109 | |
| Tissue Forceps- 1x2 Teeth 12 cm | FST | 11021-12 | |
| Uniprotect ventilated cabinet | Bioscape | THF3378 | |
| Ventilated cabinet | Tecniplast | 9AV125P | |
| Xylazine (Rompun), 2% | Bayer Vital GmbH | PZN 1320422 |
References
- Sporns, O., Tononi, G., Kotter, R. The human connectome: A structural description of the human brain. PLOS Computational Biology. 1 (4), e42 (2005).
- Bebarova, M. Advances in patch clamp technique: towards higher quality and quantity. General Physiology and Biophysics. 31 (2), 131-140 (2012).
- Kornreich, B. G. The patch clamp technique: principles and technical considerations. Journal of Veterinary Cardiology. 9 (1), 25-37 (2007).
- Spira, M. E., Hai, A. Multi-electrode array technologies for neuroscience and cardiology. Nature Nanotechnology. 8 (2), 83-94 (2013).
- Obien, M. E., Deligkaris, K., Bullmann, T., Bakkum, D. J., Frey, U. Revealing neuronal function through microelectrode array recordings. Frontiers in Neuroscience. 8, 423 (2014).
- Heuschkel, M. O., Fejtl, M., Raggenbass, M., Bertrand, D., Renaud, P. A three-dimensional multi-electrode array for multi-site stimulation and recording in acute brain slices. Journal of Neuroscience Methods. 114 (2), 135-148 (2002).
- Kimiskidis, V. K. Transcranial magnetic stimulation (TMS) coupled with electroencephalography (EEG): Biomarker of the future. Reviews in Neurology. 172 (2), 123-126 (2016).
- Nunez, P. L. Toward a quantitative description of large-scale neocortical dynamic function and EEG. Behavioral Brain Science. 23 (3), 371-437 (2000).
- Lundt, A., et al. EEG Radiotelemetry in Small Laboratory Rodents: A Powerful State-of-the Art Approach in Neuropsychiatric, Neurodegenerative, and Epilepsy Research. Neural Plasticity. 2016, 8213878 (2016).
- Papazoglou, A., et al. Non-restraining EEG Radiotelemetry: Epidural and Deep Intracerebral Stereotaxic EEG Electrode Placement. Journal of Visualized Experiments. 112 (112), e54216 (2016).
- Weiergraber, M., Henry, M., Hescheler, J., Smyth, N., Schneider, T. Electrocorticographic and deep intracerebral EEG recording in mice using a telemetry system. Brain Research Brain Research Protocols. 14 (3), 154-164 (2005).
- Kallstrand, J., Nehlstedt, S. F., Skold, M. L., Nielzen, S. Lateral asymmetry and reduced forward masking effect in early brainstem auditory evoked responses in schizophrenia. Psychiatry Research. 196 (2-3), 188-193 (2012).
- Muller, R., et al. Automatic Detection of Highly Organized Theta Oscillations in the Murine EEG. Journal of Visualized Experiments. (121), e55089 (2017).
- Papazoglou, A., et al. Gender specific hippocampal whole genome transcriptome data from mice lacking the Cav2.3 R-type or Cav3.2 T-type voltage-gated calcium channel. Data in Brief. 12, 81-86 (2017).
- Papazoglou, A., et al. Gender-Specific Hippocampal Dysrhythmia and Aberrant Hippocampal and Cortical Excitability in the APPswePS1dE9 Model of Alzheimer's Disease. Neural Plasticity. 2016, 7167358 (2016).
- Papazoglou, A., et al. Motor Cortex Theta and Gamma Architecture in Young Adult APPswePS1dE9 Alzheimer Mice. PLOS ONE. 12 (1), e0169654 (2017).
- Siwek, M. E., et al. Altered theta oscillations and aberrant cortical excitatory activity in the 5XFAD model of Alzheimer's disease. Neural Plasticity. , 781731 (2015).
- Welch, T. M., Church, M. W., Shucard, D. W. A method for chronically recording brain-stem and cortical auditory evoked potentials from unanesthetized mice. Electroencephalography and Clinical Neurophysiology. 60 (1), 78-83 (1985).
- Church, M. W., Gritzke, R. Effects of ketamine anesthesia on the rat brain-stem auditory evoked potential as a function of dose and stimulus intensity. Electroencephalography and Clinical Neurophysiology. 67 (6), 570-583 (1987).
- van Looij, M. A., et al. Impact of conventional anesthesia on auditory brainstem responses in mice. Hearing Research. 193 (1-2), 75-82 (2004).
- Schomer, D. L., da Silva, F. L. . Niedermeyer's Electroencephalography: Basic Principles, Clinical Applications, and Related Fields. , (2011).
- De Cosmo, G., Aceto, P., Clemente, A., Congedo, E. Auditory evoked potentials. Minerva Anestesiology. 70 (5), 293-297 (2004).
- Rosburg, T. Auditory N100 gating in patients with schizophrenia: A systematic meta-analysis. Clinical Neurophysiology. 129 (10), 2099-2111 (2018).
- DiLalla, L. F., McCrary, M., Diaz, E. A review of endophenotypes in schizophrenia and autism: The next phase for understanding genetic etiologies. American Journal of Medical Genetics Part C Seminar in Medical Genetics. 175 (3), 354-361 (2017).
- Walsh, P., Kane, N., Butler, S. The clinical role of evoked potentials. Journal of Neurology, Neurosurgery and Psychiatry. 76 Suppl 2, ii16-ii22 (2005).
- Opgen-Rhein, C., Neuhaus, A., Urbanek, C., Dettling, M. New strategies in schizophrenia: impact of endophentotypes. Psychiatrische Praxis. 31 Suppl 2, S194-S199 (2004).
- Knipper, M., Van Dijk, P., Nunes, I., Ruttiger, L., Zimmermann, U. Advances in the neurobiology of hearing disorders: recent developments regarding the basis of tinnitus and hyperacusis. Progress in Neurobiology. 111, 17-33 (2013).
- Miller, C. A., Brown, C. J., Abbas, P. J., Chi, S. L. The clinical application of potentials evoked from the peripheral auditory system. Hearing Research. 242 (1-2), 184-197 (2008).
- Manouilenko, I., Humble, M. B., Georgieva, J., Bejerot, S. Brainstem Auditory Evoked Potentials for diagnosing Autism Spectrum Disorder, ADHD and Schizophrenia Spectrum Disorders in adults. A blinded study. Psychiatry Research. 257, 21-26 (2017).
- Talge, N. M., Tudor, B. M., Kileny, P. R. Click-evoked auditory brainstem responses and autism spectrum disorder: A meta-analytic review. Autism Research. 11 (6), 916-927 (2018).
- Hamed, S. A. The auditory and vestibular toxicities induced by antiepileptic drugs. Expert Opinion in Drug Safety. 16 (11), 1281-1294 (2017).
- Ismi, O., et al. The Effect of Methylphenidate on the Hearing of Children with Attention Deficit Hyperactivity Disorder. International Archive in Otorhinolaryngology. 22 (3), 220-224 (2018).
- Michna, M., et al. Cav1.3 (alpha1D) Ca2+ currents in neonatal outer hair cells of mice. Journal of Physiology. 553 (Pt 3), 747-758 (2003).
- Platzer, J., et al. Congenital deafness and sinoatrial node dysfunction in mice lacking class D L-type Ca2+ channels. Cell. 102 (1), 89-97 (2000).
- Willaredt, M. A., Ebbers, L., Nothwang, H. G. Central auditory function of deafness genes. Hearing Research. 312, 9-20 (2014).
- Yee, B. K., Singer, P. A conceptual and practical guide to the behavioural evaluation of animal models of the symptomatology and therapy of schizophrenia. Cell Tissue Research. 354 (1), 221-246 (2013).
- Fahey, J. R., Katoh, H., Malcolm, R., Perez, A. V. The case for genetic monitoring of mice and rats used in biomedical research. Mammalian Genome. 24 (3-4), 89-94 (2013).
- Hunsaker, M. R. Comprehensive neurocognitive endophenotyping strategies for mouse models of genetic disorders. Progress in Neurobiology. 96 (2), 220-241 (2012).
- Turner, J. G., Parrish, J. L., Hughes, L. F., Toth, L. A., Caspary, D. M. Hearing in laboratory animals: strain differences and nonauditory effects of noise. Computational Medicine. 55 (1), 12-23 (2005).
- Neumann, P. E., Collins, R. L. Genetic dissection of susceptibility to audiogenic seizures in inbred mice. Proceedings of the National Academy of Sciences of the United States of America. 88 (12), 5408-5412 (1991).
- Meier, S., Groeben, H., Mitzner, W., Brown, R. H. Genetic variability of induction and emergence times for inhalational anaesthetics. European Journal of Anaesthesiology. 25 (2), 113-117 (2008).
- Majewski-Tiedeken, C. R., Rabin, C. R., Siegel, S. J. Ketamine exposure in adult mice leads to increased cell death in C3H, DBA2 and FVB inbred mouse strains. Drug Alcohol Dependence. 92 (1-3), 217-227 (2008).
- Bonthuis, P. J., et al. Of mice and rats: key species variations in the sexual differentiation of brain and behavior. Frontiers in Neuroendocrinology. 31 (3), 341-358 (2010).
- Buckmaster, P. S., Haney, M. M. Factors affecting outcomes of pilocarpine treatment in a mouse model of temporal lobe epilepsy. Epilepsy Research. 102 (3), 153-159 (2012).
- Jonasson, Z. Meta-analysis of sex differences in rodent models of learning and memory: a review of behavioral and biological data. Neuroscience and Biobehavioral Reviews. 28 (8), 811-825 (2005).
- Prendergast, B. J., Onishi, K. G., Zucker, I. Female mice liberated for inclusion in neuroscience and biomedical research. Neuroscience and Biobehavioral Reviews. 40, 1-5 (2014).
- Ingham, N. J., Pearson, S., Steel, K. P. Using the Auditory Brainstem Response (ABR) to Determine Sensitivity of Hearing in Mutant Mice. Current Protocols in Mouse Biology. 1 (2), 279-287 (2011).
- . SigGenRZ Manual Available from: https://www.tdt.com/files/manuals/SigGenRZ_Manual.pdf (2012)
- Bogaerts, S., Clements, J. D., Sullivan, J. M., Oleskevich, S. Automated threshold detection for auditory brainstem responses: comparison with visual estimation in a stem cell transplantation study. BMC Neuroscience. 10, 104 (2009).
- Probst, F. J., et al. A point mutation in the gene for asparagine-linked glycosylation 10B (Alg10b) causes nonsyndromic hearing impairment in mice (Mus musculus). PLOS ONE. 8 (11), e80408 (2013).
- Alvarado, J. C., Fuentes-Santamaria, V., Gabaldon-Ull, M. C., Blanco, J. L., Juiz, J. M. Wistar rats: a forgotten model of age-related hearing loss. Frontiers in Aging Neuroscience. 6, 29 (2014).
- Du, P., Kibbe, W. A., Lin, S. M. Improved peak detection in mass spectrum by incorporating continuous wavelet transform-based pattern matching. Bioinformatics. 22 (17), 2059-2065 (2006).
- Daubechies, I. . Ten lectures on wavelets. , (1992).
- Pearson, J. D., et al. Gender differences in a longitudinal study of age-associated hearing loss. Journal of the Acoustical Society of America. 97 (2), 1196-1205 (1995).
- Murphy, M. P., Gates, G. A. Hearing Loss: Does Gender Play a Role?. Medscape Womens Health. 2 (10), 2 (1997).
- Henry, K. R. Males lose hearing earlier in mouse models of late-onset age-related hearing loss; females lose hearing earlier in mouse models of early-onset hearing loss. Hearing Research. 190 (1-2), 141-148 (2004).
- Ison, J. R., Allen, P. D., O’Neill, W. E. Age-related hearing loss in C57BL/6J mice has both frequency-specific and non-frequency-specific components that produce a hyperacusis-like exaggeration of the acoustic startle reflex. Journal of the Association for Research in Otolaryngology. 8 (4), 539-550 (2007).
- Zheng, Q. Y., Johnson, K. R., Erway, L. C. Assessment of hearing in 80 inbred strains of mice by ABR threshold analyses. Hearing Research. 130 (1-2), 94-107 (1999).
- Zhou, X., Jen, P. H., Seburn, K. L., Frankel, W. N., Zheng, Q. Y. Auditory brainstem responses in 10 inbred strains of mice. Brain Research. 1091 (1), 16-26 (2006).
- Lundt, A., et al. Cav3.2 T-Type Calcium Channels Are Physiologically Mandatory For The Auditory System. Neuroscience. , (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved