È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Acquisizione e analisi dei dati nel cervello evocato Audiometria di risposta nei topi
In questo articolo
Riepilogo
L'audiometria di risposta evocata dal tronco encefalico è uno strumento importante nella neurofisiologia clinica. Al giorno d'oggi, l'audiometria di risposta evocata dal tronco encefalico viene applicata anche nella scienza di base e negli studi preclinici che coinvolgono modelli animali farmacologici e genetici. Qui forniamo una descrizione dettagliata di come le risposte del tronco encefalico uditivo possono essere registrate e analizzate con successo nei topi.
Abstract
Cervello evocato risposta audiometria (BERA) è di rilevanza centrale nella neurofisiologia clinica. Come altre tecniche di potenziale evocato (EP), come potenziali evocati visivamente (VEP) o somatosensoriali, i potenziali uditivi evocati (AImp) sono innescati dalla presentazione ripetitiva di stimoli identici, risposta elettroencefalografica (EEG) di cui viene successivamente mediata con conseguente distinte deviazioni positive (p) e negative (n). Nell'uomo, sia l'ampiezza che la latenza dei singoli picchi possono essere utilizzate per caratterizzare le alterazioni nella sincronizzazione e nella velocità di conduzione nei circuiti neuronali sottostanti. È importante sottolineare che gli AEP sono applicati anche nella scienza di base e preclinica per identificare e caratterizzare la funzione uditiva nei modelli animali farmacologici e genetici. Ancora di più, vengono utilizzati modelli animali in combinazione con test farmacologici per studiare potenziali benefici nel trattamento della perdita dell'udito neurosensoriale (ad esempio, deficit uditivi indotta dall'età o dal rumore). Qui forniamo una descrizione dettagliata e integrativa di come registrare le risposte uditive con cellule staminali cerebrali (ADR) nei topi utilizzando l'applicazione click e tone-burst. Un obiettivo specifico di questo protocollo è l'alloggiamento degli animali pre-sperimentale, l'anestesia, la registrazione ABR, i processi di filtraggio ABR, l'analisi automatizzata della funzione di crescita dell'ampiezza basata sulle wavelet e il rilevamento della latenza.
Introduzione
Un aspetto centrale della fisiologia cerebrale è la sua capacità di elaborare le informazioni ambientali con conseguente produzione intrinseca o estrinseca diversa, come l'apprendimento, la memoria, le reazioni emotive o le risposte motorie. Vari approcci sperimentali e diagnostici possono essere utilizzati per caratterizzare la reattività elettrofisiologica dei singoli tipi di cellule neuronali o ammassi/insiemi di neuroni all'interno di un circuito neuronale correlato allo stimolo. Queste tecniche elettrofisiologiche coprono diverse dimensioni spatiotemporali su micro, meso e macroscala1. Il livello di microscala comprende la tensione e gli approcci di morsetto di corrente in diverse modalità patch-clamp utilizzando, ad esempio, neuroni coltivati o acutamente dissociati1. Queste tecniche in vitro consentono la caratterizzazione delle singole entità attuali e la loro modulazione farmacologica2,3. Un inconveniente essenziale, tuttavia, è la mancanza di informazioni sistemiche per quanto riguarda l'integrazione e l'elaborazione delle informazioni micro e macrocircuitiche. Questa menomazione è parzialmente superata da tecniche in vitro del mesoscalato, come gli array multielettrodi che consentono registrazioni simultanee di multielettrodi extracellulari non solo nei neuroni coltivati, ma anche nelle fette acute del cervello4, 5. Mentre i microcircuiti possono essere conservati nelle fette di cervello in misura specifica (ad esempio, nell'ippocampo), le interconnessioni a lungo raggio sono in genere perse6. In definitiva, per studiare le interconnessioni funzionali all'interno dei circuiti neuronali, le tecniche elettrofisiologiche sistemiche in vivo sulla macroscala sono il metodo di scelta7. Questi approcci includono, tra le altre cose, le registrazioni EEG di superficie (epidurale) e profonde (intracerebrali) che vengono effettuate sia nell'uomo che nei modelli animali1. I segnali EEG sono prevalentemente basati sull'input sinaptico sincronizzato sui neuroni piramidali in diversi strati corticali che possono essere inibitori o eccitatori in principale, nonostante la predominanza generale dell'input eccitatorio8. Dopo la sincronizzazione, gli eccitatori spostamenti post-based potenziali nei campi elettrici extracellulari vengono riassunti per formare un segnale di forza sufficiente per essere registrati sul cuoio capelluto utilizzando elettrodi di superficie. In particolare, una registrazione del cuoio capelluto rilevabile da un singolo elettrodo richiede l'attività di diecimila neuroni piramidali e un complesso armamentario di dispositivi tecnici e strumenti di lavorazione, tra cui un amplificatore, processi di filtraggio (filtro a passa-basso, filtro passa-alto, filtro tacca) ed elettrodi con proprietà specifiche del conduttore.
Nella maggior parte delle specie animali sperimentali (ad esempio topi e ratti), l'approccio EEG del cuoio capelluto basato sull'uomo non è tecnicamente applicabile, in quanto il segnale generato dalla corteccia sottostante è troppo debole a causa del numero limitato di neuroni piramidali sincronizzati9, 10,11. Nei roditori, gli elettrodi superficiali (scalp) o gli elettrodi subdermici sono quindi gravemente contaminati da elettrocardiogramma e prevalentemente artefatti elettromiogramma che rendono impossibili le registrazioni EEG di alta qualità9,11, 12. Quando si utilizzano topi e ratti in movimento libero senza soscia, è quindi obbligatorio registrare direttamente dalla corteccia tramite elettrodi epidurali o dalle strutture profonde e intracerebrali per garantire il collegamento fisico diretto della punta di rilevamento dell'elettrodo piombo/impiantato ai cluster di cellule neuronali che generano segnale. Questi approcci EEG possono essere eseguiti sia in una configurazione di sistema legato restrittivo o utilizzando l'approccio di telemetria radio EEG impiantabile non restraining9,10,11. Entrambe le tecniche hanno i loro pro e contro e possono essere un approccio prezioso nella caratterizzazione qualitativa e quantitativa della suscettibilità/sequestro delle crisi epilettiche, della ritmicità circadiana, dell'architettura del sonno, dell'attività oscillatoria e della sincronizzazione, compresa l'analisi della frequenza temporale, l'analisi delle fonti, ecc.9,10,13,14,15,16,17.
Mentre i sistemi di tetheing e la telemetria radio consentono rispettivamente le registrazioni EEG in condizioni di contenimento/semirestraining o non di addestramento, le condizioni sperimentali correlate non corrispondono ai requisiti per le registrazioni ABR. Quest'ultima richiesta di stimoli acustici definiti che vengono presentati ripetutamente nel tempo con posizioni definite di un altoparlante e livelli di pressione sonora sperimentale e controllati (SPL). Questo può essere ottenuto sia con la fissazione della testa in condizioni di contenimento o in seguito all'anestesia18,19. Per ridurre lo stress sperimentale, gli animali sono normalmente anestesizzati durante la sperimentazione ABR, ma va considerato che l'anestesia può interferire con gli ABR19,20.
Come caratteristica generale, l'EEG è costituito da frequenze diverse in un intervallo di tensione di 50-100 - V. Frequenze di sfondo e ampiezze dipendono fortemente dallo stato fisiologico dell'animale sperimentale. Nello stato di veglia predominano le frequenze beta e gamma (z) con ampiezza inferiore. Quando gli animali si addormentano, si verificano frequenze alfa (z), theta (z) e delta (z) , che presentano una maggiore ampiezza EEG21. Una volta stimolato un canale sensoriale (ad esempio, il percorso acustico), la propagazione delle informazioni viene mediata attraverso l'attività neuronale attraverso il sistema nervoso periferico e centrale. Tale stimolazione sensoriale (ad esempio acustica) attiva i cosiddetti EP o risponde alle risposte evocate. In particolare, i potenziali legati agli eventi (ERP) sono molto più bassi rispetto all'EEG (cioè solo alcuni microvolt). Pertanto, ogni singolo ERP basato su un singolo stimolo andrebbe perso in un contesto EEG ad alta ampiezza. Pertanto, una registrazione di un ERP richiede l'applicazione ripetitiva di stimoli identici (ad esempio, clic nelle registrazioni ABR) e la successiva media per eliminare qualsiasi attività e artefatti in background EEG. Se le registrazioni ABR vengono eseguite in animali anestesizzati, è facile usare elettrodi subdermici qui.
Principalmente, gli AEP includono EP a breve latenza, che sono normalmente correlati ad ATAR o BERA, e ulteriori potenziali successivi come eP di midlatency (risposte di midlatency [MLR]) e EP a lunga latenza22. È importante sottolineare che il disturbo nell'elaborazione delle informazioni uditive è spesso una caratteristica centrale delle malattie neuropsichiatriche (malattie demielinanti, schizofrenia, ecc.) e associato a alterazioni AEP23,24 ,25. Mentre le indagini comportamentali sono in grado di rivelare solo un danno funzionale, gli studi AEP consentono un'analisi spatiotemporale precisa della disfunzione uditiva relativa a specifiche strutture neuroanatomiche26.
ADR come primi, breve latenza acusticamente EP sono normalmente rilevati su applicazione di click da moderata ad alta intensa, e ci possono verificarsi fino a sette picchi ABR (WI-WVII). Le onde più importanti (WI-WV)sono legate alle seguenti strutture neuroanatomiche: WI al nervo uditivo (porzione distale, all'interno dell'orecchio interno); WII al nucleo cocleare (parte prossimale del nervo uditivo, terminazione del tronco encefalico); WIII al complesso olivastico superiore (SOC); WIV al lemniscus laterale (LL); WV alla terminazione del lemniscus laterale (LL) all'interno del collicolo inferiore (IC) sul lato contralaterale27 (supplementari Figura 1). Va notato che WII-WV hanno probabilmente più di una struttura anatomica del percorso uditivo ascendente che li contribuisce. In particolare, l'esatta correlazione dei picchi e delle strutture sottostanti del tratto uditivo non è ancora completamente chiarita.
In audiologia, gli ADR possono essere utilizzati come strumento di screening e diagnostica e per il monitoraggio chirurgico28,29. È molto importante per l'identificazione di disacusis, ipacusi e anacusie (ad esempio, nella perdita dell'udito legata all'età, perdita dell'udito indotta dal rumore, perdita dell'udito metabolica e congenita e perdita uditiva asimmetrica e deficit uditivi a causa di deformità o malformazioni, lesioni e neoplasmi)28. Gli ADR sono rilevanti anche come test di screening per bambini iperattivi, con disturbi dell'intestino o per altri bambini che non sarebbero in grado di rispondere all'audiometria convenzionale (ad esempio, in malattie neurologiche/psichiatriche come ADHD, SM, autismo ecc.29 , 30) e nello sviluppo e nell'allestimento chirurgico di impianti cocleari28. Infine, le ADR possono fornire preziose informazioni sui potenziali effetti collaterali ototossici dei neuropsicofarmaci, come gli antiepilelettici31,32.
Il valore della traduzione delle conoscenze neurofisiologiche ottenute da modelli murini farmacologici o transgenici all'uomo è stato dimostrato in numerosi ambienti, in particolare sul livello di ERP nei paradigmi uditivi nei topi e nei ratti33, 34,35. Nuove informazioni sui primi AEP alterati e sui cambiamenti associati nell'elaborazione delle informazioni uditive nei topi e nei ratti possono quindi essere tradotti nell'uomo ed è di importanza centrale nella caratterizzazione e nell'endofenotipizzazione uditiva, neurologica e neuropsichiatriche in futuro. Qui forniamo una descrizione dettagliata di come gli ADR possono essere registrati e analizzati con successo nei topi per scopi scientifici, tossicologici e farmacologici di base.
Protocollo
Tutte le procedure sugli animali sono state eseguite secondo le linee guida del Consiglio tedesco sulla cura degli animali e tutti i protocolli sono stati approvati dal comitato istituzionale e nazionale locale per la cura degli animali (Landesamt fàr Natur, Umwelt, und Verbraucherschutz, Stato Ufficio della Renania Settentrionale-Vestfalia, Dipartimento della Natura, dell'Ambiente e del Consumismo [LANUV NRW], Germania). Gli autori certificano inoltre che tutta la sperimentazione animale è stata effettuata in conformità con il National Institutes of Health Guide for the Care and Use of Laboratory Animals (NIH Publications n. 80-23) riveduto 1996 o il UK Animals (Procedure Scientific) Act 1986 e gli orientamenti associati, o la direttiva del Consiglio delle Comunità europee del 24 novembre 1986 (86/609/CEE) e del 22 settembre 2010 (2010/63/UE). È stato fatto uno sforzo specifico per ridurre al minimo il numero di animali utilizzati e le loro sofferenze (3R [sostituzione, riduzione e perfezionamento] strategia).
1. Animali sperimentali
-
Selezione di animali e specie sperimentali
- Eseguire studi ABR in modelli di roditori/roditori (ad esempio topi o ratti) che soddisfano i requisiti di omologia, isomorfismo e prevedibilità legati a una specifica malattia umana. Questo è di particolare importanza in termini di aspetti fondamentali nelle neuroscienze traslazionali.
NOTA: Si consideri che i ceppi di topo e ratto vari disponibili possono mostrare differenze nelle caratteristiche fisiologiche e patologiche di base36,37,38. Queste specificità relative alla linea del topo/ratto devono essere prese in considerazione nella pianificazione sperimentale. - Considerare alterazioni specifiche di ceppo di topo e ratto in fisiologia e farmacologia che potrebbero avere un impatto sugli esperimenti elettrofisiologici (ad es. sensibilità anestetiche alterate, ritmicità circadiana, suscettibilità alle crisi [audiogeniche], età, e il background genetico)39,40,41,42.
- Includere la stratificazione specifica del genere nella progettazione dello studio. Ricordate che il ciclo esborso può influenzare gravemente la suscettibilità anestetica, la ritmicità centrale, la dipendenza circadiana e l'attività sequestrale (sequestri uditivi) e l'elaborazione delle informazioni sensoriali (uditive)43,44 , 45. Quindi, eseguire un'analisi specifica di genere.
NOTA: Limitare ai topi maschi se la capacità finanziaria e sperimentale è limitata, anche se vari parametri neurofisiologici delle femmine normalmente in bicicletta non sembrano mostrare una maggiore variabilità rispetto ai maschi46.
- Eseguire studi ABR in modelli di roditori/roditori (ad esempio topi o ratti) che soddisfano i requisiti di omologia, isomorfismo e prevedibilità legati a una specifica malattia umana. Questo è di particolare importanza in termini di aspetti fondamentali nelle neuroscienze traslazionali.
-
Alloggieri e manipolazioni per animali
- Casa topi o ratti in gabbie ventilate individualmente all'interno di un impianto animale.
- Spostare gli animali sperimentali dall'impianto animale agli armadi ventilati situati in speciali laboratori destinati all'anestesia, al posizionamento degli elettrodi ABR e alle registrazioni ABR.
- Assicurarsi che gli animali siano alloggiati in un armadio ventilato in condizioni ambientali standard (ad esempio, con una temperatura di 21 2 gradi centigradi, 50%-60% di umidità relativa e un ciclo convenzionale di luce/buio di 12/12 h). Lasciare che gli animali si acclimatano e si adattino a questo modello circadiano per almeno 14 giorni prima della successiva sperimentazione.
- Utilizzare gabbie di policarbonato chiaro di tipo II (26,7 cm x 20,7 cm x 14,0 cm, un'area di 410 cm2) per alloggiare topi in gruppi di 3-4 e utilizzare gabbie di policarbonato chiaro di tipo III (42,5 cm x 26,6 cm x 18,5 cm, una superficie di 800 cm2) per i ratti. Fornire l'accesso al libitum ad acqua potabile e pellet alimentari standard.
- Evitare la separazione/isolamento degli animali sperimentali prima e dopo le registrazioni ABR come isolamento può esercitare uno stress grave che influisce sui risultati sperimentali. Quindi, riporre gli animali nella loro gabbia di casa a seguito di anestesia, posizionamento degli elettrodi ABR e registrazioni ABR.
- Non applicare condizioni abitative aperte in quanto sono soggette a una serie di inconvenienti sperimentali, in particolare negli studi uditivi. Gli armadi ventilati, invece, proteggono dallo stress acustico prima e tra procedure uditive sperimentali che potrebbero altrimenti portare a perdita dell'udito sensoriale (ad esempio, perdita dell'udito indotta dal rumore) e quindi influenzare i risultati.
- Utilizzare apparecchiature igienico-sanitarie, anestetiche e tecniche specifiche per topi e topi in modo che né i topi né i ratti possano percepire la presenza reciproca come la reciproca percezione sensoriale delle specie rivali può dar luogo a fattori confondanti evitabili negli studi.
2. Anestesia del topo
- Eseguire l'anestesia utilizzando anestetici iniettabili. Preparare una combinazione di cloruro di chetamina (dosaggio del roditore: 100 mg/kg) e idrocloruro di xilologina (dosaggio roditore: 10 mg/kg) in 0,9% NaCl o Ringer soluzione e iniettare l'animale intraperitonealmente sulla base del suo peso corporeo.
NOTA: La narcosi di inalazione tramite isoflurane non è raccomandata in quanto la procedura ABR normalmente richiede un cubicolo di attenuazione del suono e una gabbia di Faraday, con conseguenti limitazioni spaziali all'interno della configurazione di registrazione. Anche se molti anestetici agiscono sul sistema NMDA e ovviamente influenzano i risultati di registrazione ABR, un approccio di contenimento non anestetico nelle registrazioni ABR non è raccomandato come procedure di contenimento sotto coscienza inducono drammaticamente lo stress per l'animale, con severa formazione successiva di artefatti negli ADR. - Osservare attentamente gli animali per la profondità dell'anestesia eseguendo un pizzico di coda, un pizzico del piede e il monitoraggio della frequenza respiratoria (topi: 150-220 respiri/min). Verificare la presenza di possibili ansimanti e contrastare, se necessario.
NOTA: diverse linee di topo o modelli di topo farmacologici possono presentare diverse sensibilità all'anestesia. Lo stesso vale per i modelli di topo mutanti. L'intubazione endotracheale non è un must in questo ambiente sperimentale e non è raccomandata. Poiché l'intubazione aumenta il rischio di traumi alla trachea e all'infezione, il beneficio/rischio di intubazione endotracheale durante la procedura ABR è negativo.
3. Aspetti generali degli accordi perianestesici e della strumentazione
- Applicare il calore supplementare durante e dopo le registrazioni ABR utilizzando una coperta di riscaldamento omeotermico per mantenere la temperatura interna del corpo dell'animale. Mantenere quest'ultimo a 36,5-38,0 gradi centigradi (98,6-100,4 gradi centigradi).
NOTA: L'ipotermia è un fattore di rischio nei piccoli roditori a causa del loro alto rapporto di superficie del corpo (superficie del corpo del topo - 10,5 x (peso in g)2/3; superficie del corpo del ratto - 10,5 x (peso in g)2/3) al volume del corpo. - Coprire gli occhi dell'animale con unguento lacrimale a base di petrolio o 5% dexpanthenol durante l'intero processo di registrazione ABR per evitare la disidratazione corneale. Continuare questa procedura fino a quando il riflesso lampeggiante non viene completamente ripristinato.
- Sterilizzare gli strumenti sperimentali (si veda la Tabella deiMateriali) utilizzando un'autoclave o disinfettanti.
NOTA: Si raccomanda l'uso di uno sterilizzatore a strumento chirurgico a base di calore con perline di vetro. - Per il posizionamento esatto degli elettrodi ABR, utilizzare un microscopio di ingrandimento chirurgico binoculare con una fonte di luce fredda per l'intensa illuminazione tramite guide luminose mobili flessibili o autosufficienti.
- Utilizzare un cappotto da laboratorio pulito, una maschera per il viso, un copricapo e guanti sterili durante la manipolazione e la sperimentazione sperimentale degli animali.
NOTA: gli strumenti e le forniture ottimali possono variare da un laboratorio all'altro e devono soddisfare standard istituzionali e di laboratorio.
4. Registrazioni ABR
NOTA: Il protocollo qui descritto si basa su un sistema ABR disponibile in commercio per registrazioni monaurali e binaurali. È importante sottolineare che la questione scientifica da affrontare deve soddisfare le specifiche tecniche del sistema ABR utilizzato. L'analisi ABR delle registrazioni binaurali, ad esempio, può essere utilizzata per studiare la codifica laterale degli stimoli uditivi nel percorso uditivo e per studiare l'asimmetria laterale periferica nelle malattie neuropsichiatriche.
- Eseguire una calibrazione delle frequenze di stimolazione su ogni giorno di registrazione posizionando un microfono collegato a un preamplificatore e il sistema di elaborazione (vedere il Sommario deimateriali) all'interno del cubicolo attenuante nel punto con il corretto l'orientamento in cui verrà posizionato l'orecchio morino sperimentale.
- Accendere il preamplificatore collegato al microfono almeno 5 minuti prima della calibrazione per consentire l'equilibratione del sistema.
- Accendere l'oscilloscopio.
- Posizionare il microfono collegato a un preamplificatore all'interno del cubicolo attenuante del suono per imitare l'orecchio morno sperimentale.
- Aprire il software di elaborazione e acquisizione disponibile in commercio (vedere la Tabella dei materiali).
- Selezionare il file Cal200K di calibrazione all'interno del software per attivare la modalità di calibrazione-configurazione e scegliere i parametri in base alle condizioni sperimentali.
- Utilizzare il sistema del processore per eseguire la procedura di calibrazione. Assicurarsi che le specifiche tecniche del microfono e dell'altoparlante in termini di limiti SPL, gamma di frequenza e distribuzione si armonizzino.
- Selezionare e avviare il protocollo di stimolazione dei clic predefinito.
- Eseguire un singolo click SPL (preferibilmente, il massimo SPL) per verificare che lo spettro di stimoli sonori come analizzato da Fast Fourier Transformation (FFT) online dell'oscilloscopio corrisponda ai requisiti (gamma di energia sostanziale).
- Selezionare e avviare il protocollo di stimolazione tono-burst predefinito entro la portata di interesse (ad esempio, 1-42 kHz).
- Confermare lo spettro di frequenza degli stimoli di prova acustici registrati utilizzando un oscilloscopio e ffT online.
NOTA: la calibrazione giornaliera del sistema e le frequenze di stimolazione sono necessarie per garantire che le frequenze di stimolazione e le SPL rientrino in intervalli di lavoro accettabili.
- Posizionare il topo anetizzato all'interno di un cubicolo attenuante del suono rivestito con schiuma acustica.
NOTA: L'intero cubicolo deve essere coperto da una gabbia di Faraday (metallo a rete su misura o commerciale) per proteggere le registrazioni ABR da interferenze elettriche esterne e proteggerle dal rumore. - Per la registrazione dei potenziali uditivi monaurali evocati dal tronco encefalico, inserire elettrodi in acciaio inossidabile subdermico sul vertice, assiale delle pinne (elettrodo positivo ) e ventrolateral dell'obietto destro o sinistro (elettrodo negativo [-]) a seconda l'orecchio da misurare. Per le registrazioni binaurali, posizionare gli elettrodi negativi sia a destra che a sinistra. Posizionare l'elettrodo di terra all'anca dell'animale (Figura supplementare 1).
- Prima dell'inserimento, formare una forma a gancio sulla punta dell'elettrodo in acciaio inossidabile in modo che la fissazione subdermica degli elettrodi sia garantita47.
- Eseguire misurazioni impiallasi di tutti gli elettrodi prima di ogni registrazione per verificare il corretto posizionamento/conduttività degli elettrodi. Utilizzare il pulsante di controllo impedibile sulla fase di headstage a quattro canali per verificare ogni livello di impedazione dell'elettrodo.
NOTA: Impedance dovrebbe essere inferiore a 5 k. - Registrare gli AR in condizioni di campo libero utilizzando un singolo altoparlante (larghezza di banda di frequenza, ad esempio, a 1-65 kHz) posizionato 10 cm di fronte al rostro degli animali (il bordo iniziale dell'altoparlante perpendicolabile all'asse dell'interaura del mouse). Assicurarsi che la posizione delle orecchie della testa del mouse/del mouse sia quella del microfono di calibrazione, a seconda della distanza specifica scelta tra l'altoparlante e il microfono durante la calibrazione.
NOTA: Invece di condizioni di campo libero, è possibile utilizzare anche tubi auricolari. Tuttavia, sono necessarie precauzioni e test speciali per determinare gli SPL in queste impostazioni. - Programmare i protocolli di stimolo per i clic e i burst di tono utilizzando software autoprogrammato o disponibile in commercio (vedere la Tabella dei Materiali). I singoli parametri di stimolo elencati di seguito devono essere aggiunti all'interfaccia utente grafica correlata.
- Iniziare con la configurazione dell'entità di stimolo del clic (cioè uno stimolo di durata di 100 s con polarità alternata [passare dalla condensazione alla rara fazione] e l'energia sostanziale definita. Utilizzare questa entità stimolo per analizzare e determinare le soglie di clic, la simmetria ABR dell'orecchio sinistro e destro, le ampiezza ABR W (I - IV) e le latenze W (I - IV) in un secondo momento.
- Avviare il software e utilizzare la finestra di configurazione per aggiungere i parametri di stimolo click. Fare clic su Esegui per eseguire il protocollo.
- Continuare con la configurazione della seconda entità di stimolo, che è un burst di tono di 4,5 ms (impulso sinusoidale transitorio) di polarità alternata con inviluppo Hann salita e tempi di caduta di 1,5 ms ciascuno (durata del tempo di gate/ramp). Si consideri una durata minima dell'esplosione del tono di 3 ms, in particolare per le raffiche di tono a bassa frequenza. Utilizzare questo stimolo per analizzare e identificare le soglie uditive specifiche della frequenza in tutti i genotipi.
- Analogamente al passaggio 4.6.2, utilizzare la finestra di configurazione per aggiungere parametri di stimolo burst tono e fare clic su Esegui per eseguire il protocollo (come indicato dal produttore48).
- Per gli studi di burst tono, programmare la gamma di frequenza appropriata da testare a seconda della domanda scientifica (ad esempio, da 1-42 kHz in 6 passi kHz). Assicurarsi che gli intervalli di frequenza da applicare soddisfino le capacità tecniche dell'altoparlante (in questo caso, un altoparlante magnetico multicampo con una larghezza di banda di frequenza di 1-65 kHz per condizioni di campo libero o chiuso).
- Per la media, impostare il numero di stimoli acustici sequenziali (clic o burst di tono), ad esempio, a 300x con una velocità di 20 Hz.
- Aumentare gli SPL in 5 dB per i clic e 10 dB per i toni che si avviano, a partire da 0 dB fino a 90 dB (aumento della modalità SPL).
NOTA: entrambe le modalità SPL crescenti e decrescenti sono state descritte nella letteratura. La dimensione del passo SPL potrebbe essere adattata a causa di domande scientifiche.
- Determinare una durata di acquisizione dati ABR di 25 ms, a partire da un periodo di base di 5 ms prima dell'insorgenza di stimoli acustici individuali (linea di base pre-ABR) e superiore a una sezione ABR di 10 ms di un'altra linea di base di 10 ms (linea di base post-ABR) (grafico supplementare 1) (figurasupplementare 1) ).
- Applicare una frequenza di campionamento appropriata per l'acquisizione di dati ABR (ad esempio, 24,4 kHz) e il filtro passabanda (passaggio alto: 300 Hz, passa basso: 5 kHz) utilizzando un filtro Butterworth a 6 poli. Attivare il filtro tacca, se necessario.
NOTA: la frequenza di campionamento e le caratteristiche del filtro potrebbero essere adattate a causa di requisiti sperimentali. - Trasferire i segnali bioelettrici risultanti registrati dagli elettrodi subdermici a uno stadio della testa e più avanti verso un preamplificatore con un'adeguata amplificazione (ad esempio, 20 volte).
- Utilizzare uno specifico software di elaborazione del sistema ABR per coordinare il controllo degli altoparlanti e l'acquisizione, l'elaborazione, la media e la gestione dei dati di ABR.
- Provare a eseguire l'intero protocollo ABR (per soglie uditive evocate da click-and burst, ampiezza di picco e analisi della latenza di picco, ecc.) entro circa 45 min. Questo corrisponde al tempo di narcosi profonda utilizzando 100/10 mg ketamina/xylazina intraperitonealmente.
- Assicurarsi che la calibrazione, la programmazione/regolazione per la presentazione e l'acquisizione degli stimoli, le impostazioni del filtro, ecc. funzionino come previsto prima di anestetizzare l'animale ed eseguire la registrazione effettiva.
5. Analisi ABR
- Analisi della soglia uditiva ABR richiamata a raffica di a squisita e a toni
- Eseguire il rilevamento automatico delle soglie basato su pubblicazioni precedenti per evitare potenziali incoerenze nella determinazione della soglia ABR mediante ispezione visiva/stima49,50,51,52.
- Definire tre intervalli di tempo distinti (TW) per calcolare il rapporto segnale-rumore (SNR): TW1 (0-5 ms), TW2 (5-15 ms) e TW3 (15-25 ms) (Figura supplementare 1).
- Calcolare la deviazione standard del rumore della linea di base all'interno dei due TW distinti (cioè TW1 e TW3)in cui non viene osservato alcun AEP. Questo calcolo può essere fatto utilizzando software auto-programmato.
- Calcolare per ogni misurazione SPL all'interno di un record ABR impostando sia la media che la deviazione standard per i dati raggruppati di TW1 e TW3.
- Reimpostare tutti i campioni di registrazione singolarmente in base alla media calcolata corrispondente per rimuovere qualsiasi offset DC.
- Per la determinazione della soglia dell'udito, identificare l'SPL (dB) più basso in cui almeno un valore di ampiezza dell'onda (WI-WIV) nell'intervallo di tempo di risposta ABR (TW2) ha superato il quadruplo della deviazione standard calcolata in precedenza.
NOTA: se non è stata rilevata alcuna onda ABR per l'analisi della soglia di click e frequenza al livello di SPL massimo, all'orecchio viene assegnato un livello di soglia nominale di 100dB.
- Analisi dell'ampiezza delle onde ABR e della latenza delle onde
- Condurre un approccio basato sulle wavelet usando il wavelet messicano per determinare la disposizione temporale sequenziale delle onde positive (p) (picchi) e delle onde negative (n) utilizzando una wavelet di default basata sulla algoritmo di corrispondenza dei modelli52 (Figura supplementare 1).
- Matematicamente, il CWT è rappresentato come segue53.
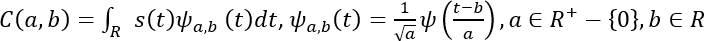
Qui, s(t) è il segnale, a è la scala, b è la traduzione, s(t) è la culla madre, a,b(t) è l'onda in scala e tradotta, e C è la matrice 2D di coefficienti wavelet.
- Matematicamente, il CWT è rappresentato come segue53.
- Inizialmente, utilizzare la misura 55-dB di ogni corsa ABR per identificare i migliori parametri di scala per ogni onda da passare al CWT, che si traduce in tre classi: scale 0.5-4 per tutte le ondate n, 0.5-6 per tutte le onde p, e 0.5-12 per WIV come questo è il più ampio all'interno dei campioni.
NOTA: Il 55 dB SPL è stato scelto come onde sono generalmente più prominenti qui e possono essere rilevati in modo affidabile. - Dimostra a tutte le classi di rilevare in modo affidabile la corretta collocazione temporale di WI-WIV all'interno di tutte le misurazioni 55 dB.
- Per determinare ABR WI-WIV nell'ordine temporale preciso all'interno della misura 55 dB, i picchi p e n (pozzi) sono identificati in una sequenza fissa utilizzando posizioni relative di picchi identificati in precedenza per limitare la scansioni successive.
- Una volta identificati tutti e nove i picchi a 55 dB, utilizzare i valori correlati come punti di partenza per il riquadro di ricerca temporale per le misurazioni della pressione sonora adiacenti (50 dB e 60 dB) prima che venga ripetuta l'identificazione dei picchi da 1 a 9.
- In questo modo, determinare p e n-picchi di tutti i livelli dB (55-0 dB e 60-90 dB) se possibile. Una volta che un p- e n-picco non è più identificato dall'analisi wavelet, la sua disposizione temporale viene impostata calcolando l'offset temporale del picco a qualsiasi altro picco identificato nel livello dB precedente.
- L'applicazione dell'offset temporale ai picchi a qualsiasi altro p e n-peak all'interno del livello di decibel corrente comporta un massimo di otto posizioni temporali determinate per i picchi indefiniti di cui la media viene considerata come l'approssimazione più vicina.
- Per valutare la funzione di crescita dell'ampiezza e il confronto della latenza di tutte le onde (WI-WIV), caratterizzano le ampiezze massime e le latenze medie di ciascuna delle p-peaks entro l'intervallo di tempo dei relativi n-peaks.
- Controllare visivamente tutti i risultati in base allo strumento wavelet automatico autoprogrammato in seguito e, se necessario, escludere le singole esedi ABR dalle statistiche se non soddisfano i rigorosi criteri di inclusione/qualità.
NOTA: sia nell'analisi automatizzata che nell'ispezione visiva degli ALAR, si consiglia un approccio in doppio cieco.
- Condurre un approccio basato sulle wavelet usando il wavelet messicano per determinare la disposizione temporale sequenziale delle onde positive (p) (picchi) e delle onde negative (n) utilizzando una wavelet di default basata sulla algoritmo di corrispondenza dei modelli52 (Figura supplementare 1).
6. Assistenza post-operatoria e trattamento post-ABR
- Monitorare continuamente gli animali fino a quando non hanno ripreso conoscenza e sono in grado di mantenere la recumbency sternale.
- Non restituire un animale che ha subito registrazioni ABR alla compagnia di altri animali fino a quando non si è completamente ripreso.
- Iniettare carprofen (topo: 1x 5-10 mg/kg, sottocutaneamente; ratto: 1x 2,5-5,0 mg/kg, sottocutaneamente) per il trattamento del dolore post-operatorio.
NOTA: Il trattamento del dolore di lunga durata non è necessario in quanto gli elettrodi di registrazione ABR vengono inseriti sottocutaneamente. - Postoperatorio, nutrire pellet inumiditi al fine di facilitare l'assorbimento di cibo. Osservare attentamente il cibo (15 g/100 g di peso corporeo/giorno; 5 g/24 h) e l'acqua (15 mL/100 g di peso corporeo al giorno; 5 mL/24 h) consumo.
- Monitorare attentamente gli animali per il ritorno delle loro normali posture e comportamenti.
NOTA: La somministrazione sistemica di antibiotici come enrofloxacin o trimethoprim-sulfonamide non è raccomandata qui, poiché il posizionamento degli elettrodi subdermici è di minima invasività. L'applicazione di antibiotici dovrebbe essere limitata a meno che non si verifichino segni di infiammazione locale o generalizzata. - Follow-up recupero postsperimentale dopo le registrazioni ABR controllando il peso corporeo dell'animale.
Risultati
Le registrazioni ABR evocate da raffiche di tipo click- e tono possono essere utilizzate per valutare le differenze di soglia dell'udito, la funzione di crescita dell'ampiezza e il confronto della latenza. ADR a cui è esibito con il clic nella modalità di aumento SPL sono illustrati nella Figura 1 per i controlli e due linee di mouse mutantiesemplari che sono carenti per il canale Cav3.2 T-type voltage-gated Ca2 <...
Discussione
Questo protocollo fornisce una descrizione dettagliata e integrativa di come registrare le risposte del tronco encefalico evocato uditivo nei topi. Si pone un'attenzione specifica sul pretrattamento degli animali, l'anestesia e i potenziali fattori di confusione metodologica. Questi ultimi includono, tra gli altri, il sesso, la linea del mouse, l'età e le condizioni abitative. Va notato che tutti questi fattori possono avere un impatto sulla perdita dell'udito sensoriale e sugli aspetti fondamentali dell'elaborazione ud...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori desiderano ringraziare la Dott.ssa Christina Kolb (Centro tedesco per le malattie neurodegenerative[D-NE]) e il Dr. Robert Stark per l'assistenza nell'allevamento degli animali e nell'assistenza sanitaria degli animali. Questo lavoro è stato sostenuto finanziariamente dall'Istituto federale per la droga e i dispositivi medici (Bundesinstitut fàr Arzneimittel und Medizinprodukte, BfArM, Bonn, Germania).
Materiali
| Name | Company | Catalog Number | Comments |
| AEP/OAE Software for RZ6 (BioSigRZ software) | Tucker-Davis Technologies (TDT) | BioSigRZ | |
| Binocular surgical magnification microscope | Zeiss Stemi 2000 | 0000001003877, 4355400000000, 0000001063306, 4170530000000, 4170959255000, 4551820000000, 4170959040000, 4170959050000 | |
| Cages (Macrolon) | Techniplast | 1264C, 1290D | |
| Carprox vet, 50mg/ml | Virbac Tierarzneimittel GmbH | PZN 11149509 | |
| Cold light source | Schott KL2500 LCD | 9.705 202 | |
| Cotton tip applicators (sterile) | Carl Roth | EH12.1 | |
| Custom made meshed metal Faraday cage (stainless steel, 2 mm thickness, 1 cm mesh size) | custom made | custom made | |
| 5% Dexpanthenole (Bepanthen eye and nose creme) | Bayer Vital GmbH | PZN: 01578681 | |
| Disposable Subdermal stainless steel Needle electrodes, 27GA, 12mm | Rochester Electro-Medical, Inc. | S03366-18 | |
| Surgical drape sheets (sterile) | Hartmann | PZN 0366787 | |
| Ethanol, 70% | Carl Roth | 9065.5 | |
| 1/4'' Free Field Measure Calibration Mic Kit | Tucker-Davis Technologies (TDT) | PCB-378C0 | |
| Gloves (sterile) | Unigloves | 1570 | |
| Graefe Forceps-curved, serrated | FST | 11052-10 | |
| GraphPad Prism 6 Software, V6.07 | GraphPad Prism Software, Inc. | https://www.graphpad.com/ | |
| Heat-based surgical instrument sterilizer | FST | 18000-50 | |
| Homeothermic heating blanked | ThermoLux | 461265 / -67 | |
| Ketanest S (Ketamine), 25mg/ml | Pfizer | PZN 08707288 | |
| Ringer’s solution (sterile) | B.Braun | PZN 01471434 | |
| Matlab software | MathWorks, Inc. | https://de.mathworks.com/products/matlab.html | |
| Medusa 4-Channel Low Imped. Headstage | Tucker-Davis Technologies (TDT) | RA4LI | |
| Medusa 4-Channel Pre-Amp/Digitizer | Tucker-Davis Technologies (TDT) | RA4PA | |
| Microphone | PCB Pieztronics | 378C01 | |
| Multi Field Speaker- Stereo | Tucker-Davis Technologies (TDT) | MF1-S | |
| Oscilloscope | Tektronix | DPO3012 | |
| Optical PC1 express card for Optibit Interface) | Tucker-Davis Systems (TDT) | PO5e | |
| Askina Braucel pads (cellulose absorbet pads) | B.Braun | PZN 8473637 | |
| Preamplifier | PCB Pieztronics | 480C02 | |
| RZ6 Multi I/O Processor system (BioSigRZ) | Tucker-Davis Technologies (TDT) | RZ6-A-PI | |
| 0.9% saline (NaCl, sterile) | B.Braun | PZN:8609255 | |
| SigGenRZ software | Tucker-Davis Technologies (TDT) | https://www.tdt.com/ | |
| Software R (version 3.2.1) + Reshape 2 (Version 1.4.1) + ggplot 2 (version 1.0.1) + datatable (version 1.9.4), + gdata (version 2.13.3), + pastecs (version 1.3.18), + waveslim (version 1.7.5), + MassSpecWavelet (version 1.30.0) | The R Foundation, R Core Team 2015 | Open Source Software (freely distributable) | |
| Sound attenuating cubicle | Med Associates Inc. | ENV-018V | |
| Standard Pattern Forceps, 12cm and 14.5 cm length | FST | 11000-12, 11000-14 | |
| Leukosilk tape | BSN medical GmbH & Co. KG | PZN 00397109 | |
| Tissue Forceps- 1x2 Teeth 12 cm | FST | 11021-12 | |
| Uniprotect ventilated cabinet | Bioscape | THF3378 | |
| Ventilated cabinet | Tecniplast | 9AV125P | |
| Xylazine (Rompun), 2% | Bayer Vital GmbH | PZN 1320422 |
Riferimenti
- Sporns, O., Tononi, G., Kotter, R. The human connectome: A structural description of the human brain. PLOS Computational Biology. 1 (4), e42 (2005).
- Bebarova, M. Advances in patch clamp technique: towards higher quality and quantity. General Physiology and Biophysics. 31 (2), 131-140 (2012).
- Kornreich, B. G. The patch clamp technique: principles and technical considerations. Journal of Veterinary Cardiology. 9 (1), 25-37 (2007).
- Spira, M. E., Hai, A. Multi-electrode array technologies for neuroscience and cardiology. Nature Nanotechnology. 8 (2), 83-94 (2013).
- Obien, M. E., Deligkaris, K., Bullmann, T., Bakkum, D. J., Frey, U. Revealing neuronal function through microelectrode array recordings. Frontiers in Neuroscience. 8, 423 (2014).
- Heuschkel, M. O., Fejtl, M., Raggenbass, M., Bertrand, D., Renaud, P. A three-dimensional multi-electrode array for multi-site stimulation and recording in acute brain slices. Journal of Neuroscience Methods. 114 (2), 135-148 (2002).
- Kimiskidis, V. K. Transcranial magnetic stimulation (TMS) coupled with electroencephalography (EEG): Biomarker of the future. Reviews in Neurology. 172 (2), 123-126 (2016).
- Nunez, P. L. Toward a quantitative description of large-scale neocortical dynamic function and EEG. Behavioral Brain Science. 23 (3), 371-437 (2000).
- Lundt, A., et al. EEG Radiotelemetry in Small Laboratory Rodents: A Powerful State-of-the Art Approach in Neuropsychiatric, Neurodegenerative, and Epilepsy Research. Neural Plasticity. 2016, 8213878 (2016).
- Papazoglou, A., et al. Non-restraining EEG Radiotelemetry: Epidural and Deep Intracerebral Stereotaxic EEG Electrode Placement. Journal of Visualized Experiments. 112 (112), e54216 (2016).
- Weiergraber, M., Henry, M., Hescheler, J., Smyth, N., Schneider, T. Electrocorticographic and deep intracerebral EEG recording in mice using a telemetry system. Brain Research Brain Research Protocols. 14 (3), 154-164 (2005).
- Kallstrand, J., Nehlstedt, S. F., Skold, M. L., Nielzen, S. Lateral asymmetry and reduced forward masking effect in early brainstem auditory evoked responses in schizophrenia. Psychiatry Research. 196 (2-3), 188-193 (2012).
- Muller, R., et al. Automatic Detection of Highly Organized Theta Oscillations in the Murine EEG. Journal of Visualized Experiments. (121), e55089 (2017).
- Papazoglou, A., et al. Gender specific hippocampal whole genome transcriptome data from mice lacking the Cav2.3 R-type or Cav3.2 T-type voltage-gated calcium channel. Data in Brief. 12, 81-86 (2017).
- Papazoglou, A., et al. Gender-Specific Hippocampal Dysrhythmia and Aberrant Hippocampal and Cortical Excitability in the APPswePS1dE9 Model of Alzheimer's Disease. Neural Plasticity. 2016, 7167358 (2016).
- Papazoglou, A., et al. Motor Cortex Theta and Gamma Architecture in Young Adult APPswePS1dE9 Alzheimer Mice. PLOS ONE. 12 (1), e0169654 (2017).
- Siwek, M. E., et al. Altered theta oscillations and aberrant cortical excitatory activity in the 5XFAD model of Alzheimer's disease. Neural Plasticity. , 781731 (2015).
- Welch, T. M., Church, M. W., Shucard, D. W. A method for chronically recording brain-stem and cortical auditory evoked potentials from unanesthetized mice. Electroencephalography and Clinical Neurophysiology. 60 (1), 78-83 (1985).
- Church, M. W., Gritzke, R. Effects of ketamine anesthesia on the rat brain-stem auditory evoked potential as a function of dose and stimulus intensity. Electroencephalography and Clinical Neurophysiology. 67 (6), 570-583 (1987).
- van Looij, M. A., et al. Impact of conventional anesthesia on auditory brainstem responses in mice. Hearing Research. 193 (1-2), 75-82 (2004).
- Schomer, D. L., da Silva, F. L. . Niedermeyer's Electroencephalography: Basic Principles, Clinical Applications, and Related Fields. , (2011).
- De Cosmo, G., Aceto, P., Clemente, A., Congedo, E. Auditory evoked potentials. Minerva Anestesiology. 70 (5), 293-297 (2004).
- Rosburg, T. Auditory N100 gating in patients with schizophrenia: A systematic meta-analysis. Clinical Neurophysiology. 129 (10), 2099-2111 (2018).
- DiLalla, L. F., McCrary, M., Diaz, E. A review of endophenotypes in schizophrenia and autism: The next phase for understanding genetic etiologies. American Journal of Medical Genetics Part C Seminar in Medical Genetics. 175 (3), 354-361 (2017).
- Walsh, P., Kane, N., Butler, S. The clinical role of evoked potentials. Journal of Neurology, Neurosurgery and Psychiatry. 76 Suppl 2, ii16-ii22 (2005).
- Opgen-Rhein, C., Neuhaus, A., Urbanek, C., Dettling, M. New strategies in schizophrenia: impact of endophentotypes. Psychiatrische Praxis. 31 Suppl 2, S194-S199 (2004).
- Knipper, M., Van Dijk, P., Nunes, I., Ruttiger, L., Zimmermann, U. Advances in the neurobiology of hearing disorders: recent developments regarding the basis of tinnitus and hyperacusis. Progress in Neurobiology. 111, 17-33 (2013).
- Miller, C. A., Brown, C. J., Abbas, P. J., Chi, S. L. The clinical application of potentials evoked from the peripheral auditory system. Hearing Research. 242 (1-2), 184-197 (2008).
- Manouilenko, I., Humble, M. B., Georgieva, J., Bejerot, S. Brainstem Auditory Evoked Potentials for diagnosing Autism Spectrum Disorder, ADHD and Schizophrenia Spectrum Disorders in adults. A blinded study. Psychiatry Research. 257, 21-26 (2017).
- Talge, N. M., Tudor, B. M., Kileny, P. R. Click-evoked auditory brainstem responses and autism spectrum disorder: A meta-analytic review. Autism Research. 11 (6), 916-927 (2018).
- Hamed, S. A. The auditory and vestibular toxicities induced by antiepileptic drugs. Expert Opinion in Drug Safety. 16 (11), 1281-1294 (2017).
- Ismi, O., et al. The Effect of Methylphenidate on the Hearing of Children with Attention Deficit Hyperactivity Disorder. International Archive in Otorhinolaryngology. 22 (3), 220-224 (2018).
- Michna, M., et al. Cav1.3 (alpha1D) Ca2+ currents in neonatal outer hair cells of mice. Journal of Physiology. 553 (Pt 3), 747-758 (2003).
- Platzer, J., et al. Congenital deafness and sinoatrial node dysfunction in mice lacking class D L-type Ca2+ channels. Cell. 102 (1), 89-97 (2000).
- Willaredt, M. A., Ebbers, L., Nothwang, H. G. Central auditory function of deafness genes. Hearing Research. 312, 9-20 (2014).
- Yee, B. K., Singer, P. A conceptual and practical guide to the behavioural evaluation of animal models of the symptomatology and therapy of schizophrenia. Cell Tissue Research. 354 (1), 221-246 (2013).
- Fahey, J. R., Katoh, H., Malcolm, R., Perez, A. V. The case for genetic monitoring of mice and rats used in biomedical research. Mammalian Genome. 24 (3-4), 89-94 (2013).
- Hunsaker, M. R. Comprehensive neurocognitive endophenotyping strategies for mouse models of genetic disorders. Progress in Neurobiology. 96 (2), 220-241 (2012).
- Turner, J. G., Parrish, J. L., Hughes, L. F., Toth, L. A., Caspary, D. M. Hearing in laboratory animals: strain differences and nonauditory effects of noise. Computational Medicine. 55 (1), 12-23 (2005).
- Neumann, P. E., Collins, R. L. Genetic dissection of susceptibility to audiogenic seizures in inbred mice. Proceedings of the National Academy of Sciences of the United States of America. 88 (12), 5408-5412 (1991).
- Meier, S., Groeben, H., Mitzner, W., Brown, R. H. Genetic variability of induction and emergence times for inhalational anaesthetics. European Journal of Anaesthesiology. 25 (2), 113-117 (2008).
- Majewski-Tiedeken, C. R., Rabin, C. R., Siegel, S. J. Ketamine exposure in adult mice leads to increased cell death in C3H, DBA2 and FVB inbred mouse strains. Drug Alcohol Dependence. 92 (1-3), 217-227 (2008).
- Bonthuis, P. J., et al. Of mice and rats: key species variations in the sexual differentiation of brain and behavior. Frontiers in Neuroendocrinology. 31 (3), 341-358 (2010).
- Buckmaster, P. S., Haney, M. M. Factors affecting outcomes of pilocarpine treatment in a mouse model of temporal lobe epilepsy. Epilepsy Research. 102 (3), 153-159 (2012).
- Jonasson, Z. Meta-analysis of sex differences in rodent models of learning and memory: a review of behavioral and biological data. Neuroscience and Biobehavioral Reviews. 28 (8), 811-825 (2005).
- Prendergast, B. J., Onishi, K. G., Zucker, I. Female mice liberated for inclusion in neuroscience and biomedical research. Neuroscience and Biobehavioral Reviews. 40, 1-5 (2014).
- Ingham, N. J., Pearson, S., Steel, K. P. Using the Auditory Brainstem Response (ABR) to Determine Sensitivity of Hearing in Mutant Mice. Current Protocols in Mouse Biology. 1 (2), 279-287 (2011).
- . SigGenRZ Manual Available from: https://www.tdt.com/files/manuals/SigGenRZ_Manual.pdf (2012)
- Bogaerts, S., Clements, J. D., Sullivan, J. M., Oleskevich, S. Automated threshold detection for auditory brainstem responses: comparison with visual estimation in a stem cell transplantation study. BMC Neuroscience. 10, 104 (2009).
- Probst, F. J., et al. A point mutation in the gene for asparagine-linked glycosylation 10B (Alg10b) causes nonsyndromic hearing impairment in mice (Mus musculus). PLOS ONE. 8 (11), e80408 (2013).
- Alvarado, J. C., Fuentes-Santamaria, V., Gabaldon-Ull, M. C., Blanco, J. L., Juiz, J. M. Wistar rats: a forgotten model of age-related hearing loss. Frontiers in Aging Neuroscience. 6, 29 (2014).
- Du, P., Kibbe, W. A., Lin, S. M. Improved peak detection in mass spectrum by incorporating continuous wavelet transform-based pattern matching. Bioinformatics. 22 (17), 2059-2065 (2006).
- Daubechies, I. . Ten lectures on wavelets. , (1992).
- Pearson, J. D., et al. Gender differences in a longitudinal study of age-associated hearing loss. Journal of the Acoustical Society of America. 97 (2), 1196-1205 (1995).
- Murphy, M. P., Gates, G. A. Hearing Loss: Does Gender Play a Role?. Medscape Womens Health. 2 (10), 2 (1997).
- Henry, K. R. Males lose hearing earlier in mouse models of late-onset age-related hearing loss; females lose hearing earlier in mouse models of early-onset hearing loss. Hearing Research. 190 (1-2), 141-148 (2004).
- Ison, J. R., Allen, P. D., O’Neill, W. E. Age-related hearing loss in C57BL/6J mice has both frequency-specific and non-frequency-specific components that produce a hyperacusis-like exaggeration of the acoustic startle reflex. Journal of the Association for Research in Otolaryngology. 8 (4), 539-550 (2007).
- Zheng, Q. Y., Johnson, K. R., Erway, L. C. Assessment of hearing in 80 inbred strains of mice by ABR threshold analyses. Hearing Research. 130 (1-2), 94-107 (1999).
- Zhou, X., Jen, P. H., Seburn, K. L., Frankel, W. N., Zheng, Q. Y. Auditory brainstem responses in 10 inbred strains of mice. Brain Research. 1091 (1), 16-26 (2006).
- Lundt, A., et al. Cav3.2 T-Type Calcium Channels Are Physiologically Mandatory For The Auditory System. Neuroscience. , (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon