Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Adquisición y análisis de datos en Brainstem Evocada Audiometría de Respuesta en Ratones
En este artículo
Resumen
La audiometría de respuesta evocada por el tronco cerebral es una herramienta importante en la neurofisiología clínica. Hoy en día, la audiometría de respuesta evocada con tronco encefálico también se aplica en la ciencia básica y los estudios preclínicos que involucran modelos animales farmacológicos y genéticos. Aquí proporcionamos una descripción detallada de cómo las respuestas del tronco cerebral auditivo se pueden registrar y analizar con éxito en ratones.
Resumen
La audiometría de respuesta evocada por el tronco cerebral (BERA) es de importancia central en la neurofisiología clínica. Como otras técnicas de potencial evocada (EP), como los potenciales evocados visualmente (VIP) o los potenciales evocados somatosensoriales (SEP), los potenciales evocados auditivos (PEE) se desencadenan por la presentación repetitiva de estímulos idénticos, el respuesta electroencefalográfica (EEG) de la cual se promedia posteriormente dando lugar a distintas desviaciones positivas (p) y negativas (n). En los seres humanos, tanto la amplitud como la latencia de los picos individuales se pueden utilizar para caracterizar alteraciones en la sincronización y la velocidad de conducción en los circuitos neuronales subyacentes. Es importante destacar que los AAP también se aplican en la ciencia básica y preclínica para identificar y caracterizar la función auditiva en los modelos farmacológicos y genéticos de animales. Aún más, los modelos animales en combinación con pruebas farmacológicas se utilizan para investigar los beneficios potenciales en el tratamiento de la pérdida auditiva neurosensorial (por ejemplo, déficitauditivo inducido por la edad o ruido). Aquí proporcionamos una descripción detallada e integradora de cómo registrar respuestas auditivas evocadas por tronco cerebral (ABR) en ratones usando la aplicación de clic y ráfaga de tono. Un enfoque específico de este protocolo se centra en la vivienda animal preexperimental, la anestesia, la grabación abr, los procesos de filtrado ABR, el análisis automatizado de la función de crecimiento de amplitud basado en ondas y la detección de latencia.
Introducción
Un aspecto central de la fisiología cerebral es su capacidad para procesar información ambiental que resulta en diferentes resultados intrínsecos o extrínsecos, como el aprendizaje, la memoria, las reacciones emocionales o las respuestas motoras. Se pueden utilizar varios enfoques experimentales y diagnósticos para caracterizar la capacidad de respuesta electrofisiológica de los tipos de células neuronales individuales o grupos/conjuntos de neuronas dentro de un circuito neuronal relacionado con el estímulo. Estas técnicas electrofisiológicas cubren diferentes dimensiones espaciotemporales en la microescala, meso- y macroescala1. El nivel de microescala incluye enfoques de abrazadera de voltaje y corriente en diferentes modos de abrazadera de parche utilizando, por ejemplo, neuronas cultivadas o disociadas agudamente1. Estas técnicas in vitro permiten la caracterización de entidades actuales individuales y su modulación farmacológica2,3. Sin embargo, un inconveniente esencial es la falta de información sistémica en lo que respecta a la integración y el procesamiento de la información de micro y macrocircuitos. Este deterioro se supera parcialmente mediante técnicas in vitro de la mesoescala, como las matrices de multielectrodos que permiten grabaciones simultáneas de multielectrodos extracelulares no sólo en neuronas cultivadas, sino también en rebanadas cerebrales agudas4, 5. Mientras que los microcircuitos se pueden conservar en las rebanadas cerebrales en una medida específica (por ejemplo, en el hipocampo), las interconexiones de largo alcance se pierden típicamente6. En última instancia, para estudiar las interconexiones funcionales dentro de los circuitosneuronales, las técnicas electrofisiológicas sistémicas in vivo en la macroescala son el método de elección 7. Estos enfoques incluyen, entre otras cosas, grabaciones de EEG superficiales (epidural) y profundas (intracerebrales) que se llevan a cabo tanto en los modelos humanos como en los animales1. Las señales EEG se basan predominantemente en la entrada sináptica sincronizada en las neuronas piramidales en diferentes capascorticales que pueden ser inhibitorias o excitatorias en principio, a pesar del predominio general de la entrada excitatoria 8. Tras la sincronización, los cambios excitatorios basados en el potencial postsináptico en campos eléctricos extracelulares se suman para formar una señal de suficiente resistencia para ser registrado en el cuero cabelludo usando electrodos de superficie. En particular, una grabación detectable del cuero cabelludo a partir de un electrodo individual requiere la actividad de diez mil neuronas piramidales y un complejo armamentario de dispositivos técnicos y herramientas de procesamiento, incluyendo un amplificador, procesos de filtrado (filtro de paso bajo, filtro de paso alto, filtro de muesca) y electrodos con propiedades específicas del conductor.
En la mayoría de las especies animales experimentales (es decir, ratones y ratas), el enfoque del EEG del cuero cabelludo basado en el ser humano técnicamente no es aplicable, ya que la señal generada por la corteza subyacente es demasiado débil debido al número limitado de neuronas piramidales sincronizadas9, 10,11. En roedores, los electrodos superficiales (escalpelos) o electrodos subdérmicos están gravemente contaminados por electrocardiograma y, predominantemente, artefactos electromiogramas que hacen imposibles las grabaciones de EEG de alta calidad9,11, 12. Cuando se utiliza ratones y ratas que no se mueven libremente, por lo tanto es obligatorio registrar directamente desde la corteza a través de electrodos epidurales o desde las estructuras intracerebrales profundas para asegurar la conexión física directa de la punta de la punta de la punta de la punta de la punta de la punta de la punta de la punta de la punta del electrodo de plomo/implantado a los cúmulos de células neuronales generadoras de señal. Estos enfoques de EEG se pueden llevar a cabo ya sea en una configuración de sistema de sujeción o utilizando el enfoque de radiotelemetría EEG implantablenoretenible 9,10,11. Ambas técnicas tienen sus pros y sus contras y pueden ser un enfoque valioso en la caracterización cualitativa y cuantitativa de la actividad de susceptibilidad/convulsiones, la rítmico circadiano, la arquitectura del sueño, la actividad oscilatoria y la sincronización, incluyendo análisis de frecuencia-tiempo, análisis de fuentes, etc.9,10,13,14,15,16,17.
Mientras que los sistemas ateados y la radiotelemetría permiten grabaciones de EEG en condiciones de restricción/semirestricción o no restricción, respectivamente, las condiciones experimentales conexas no se ajustan a los requisitos de las grabaciones ABR. Esta última demanda de estímulos acústicos definidos que se presentan de forma repetitiva a lo largo del tiempo con posiciones definidas de un altavoz y los niveles experimentales de presión sonora (SPÁ). Esto se puede lograr ya sea por fijación de la cabeza en condiciones de restricción o después de la anestesia18,19. Para reducir el estrés experimental, los animales normalmente se anestesian durante la experimentación con ABR, pero se debe considerar que la anestesia puede interferir con los ABRs19,20.
Como característica general, el EEG se construye de diferentes frecuencias en un rango de voltaje de 50-100 V. Las frecuencias y amplitudes de fondo dependen en gran medida del estado fisiológico del animal experimental. En el estado despierto, predominan las frecuencias beta (o) y gamma con menor amplitud. Cuando los animales se vuelven somnolientos o se duermen, surgen frecuencias alfa (a), theta y delta, que presentan una mayor amplitud del EEG21. Una vez que se estimula un canal sensorial (por ejemplo, la vía acústica), la propagación de la información se media a través de la actividad neuronal a través del sistema nervioso periférico y central. Esta estimulación sensorial (por ejemplo, acústica) desencadena los llamados EPs o respuestas evocadas. En particular, los potenciales relacionados con eventos (ERP) son mucho menores en amplitud que el EEG (es decir, solo unos pocos microvoltios). Por lo tanto, cualquier ERP individual basado en un solo estímulo se perdería en el fondo EEG de mayor amplitud. Por lo tanto, una grabación de un ERP requiere la aplicación repetitiva de estímulos idénticos (por ejemplo, clics en grabaciones ABR) y el promedio posterior para eliminar cualquier actividad de fondo eEG y artefactos. Si las grabaciones ABR se realizan en animales anestesiados, aquí es fácil utilizar electrodos subdérmicos.
Principalmente, los AEE incluyen ePs de latencia corta, que normalmente están relacionados con los ABP o BERA, y, además, potenciales de inicio posterior, como ePs de latencia media (respuestas de latencia media [MLR]) y EPs de latencia larga22. Es importante destacar que la perturbación en el procesamiento de la información auditiva es a menudo una característica central de las enfermedades neuropsiquiátricas (enfermedades desmielinizantes, esquizofrenia, etc.) y asociada con alteraciones de la AEP23,24 ,25. Mientras que las investigaciones conductuales sólo son capaces de revelar deterioro funcional, los estudios AEP permiten un análisis espaciotemporal preciso de la disfunción auditiva relacionada con estructuras neuroanatómicas específicas26.
Los ABR a principios de la latencia corta, los ePs acústicos de latencia corta se detectan normalmente en la aplicación de clic moderada a alta intensa, y puede ocurrir hasta siete picos ABR (WI-WVII). Las ondas más importantes (WI-WV) están relacionadas con las siguientes estructuras neuroanatómicas: WI al nervio auditivo (parte distal, dentro del oído interno); WII al núcleo coclear (porción proximal del nervio auditivo, terminación del tronco encefálico); WIII al complejo olivario superior (SOC); WIV al lemnisco lateral (LL); WV a la terminación del lemnisco lateral (LL) dentro del colículo inferior (IC) en el lado contralateral27 (Figurasuplementaria 1). Cabe señalar que WII-WV es probable que tenga más de una estructura anatómica de la vía auditiva ascendente que contribuye a ellos. En particular, la correlación exacta de picos y estructuras subyacentes del tracto auditivo todavía no se aclara completamente.
En audiología, los ABRs se pueden utilizar como herramienta de cribado y diagnóstico y para la monitorización quirúrgica28,29. Es más importante para la identificación de la disacusis, la hipacusis y la anacusis (por ejemplo, en la pérdida auditiva relacionada con la edad, la pérdida auditiva inducida por ruido, la pérdida auditiva metabólica y congénita, y la pérdida auditiva asimétrica y los déficits auditivos debido a deformes o malformaciones, lesiones y neoplasias)28. Los ABR también son relevantes como prueba de detección para niños hiperactivos con discapacidad intelectual o para otros niños que no serían capaces de responder a la audiometría convencional (por ejemplo, en enfermedades neurológicas/psiquiátricas como el TDAH, la SM, el autismo, etc.29. , 30) y en el desarrollo y montaje quirúrgico de implantes cocleares28. Por último, los ABR pueden proporcionar información valiosa sobre los posibles efectos secundarios ototóxicos de los neuropsicofarmacéuticos, como los antiepilépticos31,32.
El valor de la traducción de los conocimientos neurofisiológicos obtenidos de modelos de ratón farmacológicos o transgénicos a seres humanos se ha demostrado en numerosos entornos, en particular en el nivel de ERPs en paradigmas auditivos en ratones y ratas33, 34,35. Una nueva visión de los AAP tempranos alterados y los cambios asociados en el procesamiento de información auditiva en ratones y ratas pueden traducirse a los seres humanos y es de importancia central en la caracterización y endofenotipación de auditor, neurológico y enfermedades neuropsiquiátricas en el futuro. Aquí proporcionamos una descripción detallada de cómo los BBR pueden ser registrados y analizados con éxito en ratones para fines científicos básicos, toxicológicos y farmacológicos.
Protocolo
Todos los procedimientos de animales se realizaron de acuerdo con las directrices del Consejo Alemán de Cuidado de Animales y todos los protocolos fueron aprobados por el comité institucional y nacional local de cuidado de animales (Landesamt f'r Natur, Umwelt, und Verbraucherschutz, Estado Oficina de Renania del Norte-Westfalia, Departamento de Naturaleza, Medio Ambiente y Consumismo [LANUV NRW], Alemania). Los autores certifican además que toda la experimentación con animales se llevó a cabo de conformidad con la Guía de Los Institutos Nacionales de Salud para el Cuidado y Uso de Animales de Laboratorio (NIH Publications No 80-23) revisada de 1996 o la Ley de Animales del Reino Unido (Procedimientos Científicos) 1986 y las directrices asociadas, o la Directiva del Consejo de las Comunidades Europeas de 24 de noviembre de 1986 (86/609/CEE) y de 22 de septiembre de 2010 (2010/63/UE). Se hicieron esfuerzos específicos para minimizar el número de animales utilizados y su sufrimiento (estrategia 3R [de reemplazo, reducción y refinamiento]).
1. Animales experimentales
-
Selección de animales y especies experimentales
- Realizar estudios de ABR en modelos de roedores/roedores (es decir, ratones o ratas) que cumplen con los requisitos de homología, isomorfismo y previsibilidad relacionados con una enfermedad humana específica. Esto es de importancia específica en términos de aspectos básicos en la neurociencia traslacional.
NOTA: Tenga en cuenta que las cepas de ratón y rata diversas disponibles pueden mostrar diferencias en las características fisiológicas y fisiopatológicas básicas36,37,38. Estas especificidades relacionadas con la línea de ratón/rata deben tenerse en cuenta en la planificación experimental. - Considere las alteraciones específicas del ratón y de la cepa de ratas en la fisiología y la farmacología que podrían tener un impacto en los experimentos electrofisiológicos (por ejemplo, sensibilidades anestésicas alteradas, rítmidad circadiana, susceptibilidad [audiogénica] a las convulsiones, edad, y antecedentes genéticos)39,40,41,42.
- Incluya la estratificación específica del género en el diseño del estudio. Recuerde que el ciclo esteroso puede afectar gravemente la susceptibilidad anestésica, la rítmica central, la dependencia circadiana y la actividad convulsiva (convulsiones auditivas) y el procesamiento de información sensorial (auditivo)43,44 , 45. Por lo tanto, realice un análisis específico de género.
NOTA: Restringir a los ratones machosi la capacidad financiera y experimental es limitada, aunque varios parámetros neurofisiológicos de las hembras normalmente ciclistas no parecen exhibir una mayor variabilidad en comparación con los hombres46.
- Realizar estudios de ABR en modelos de roedores/roedores (es decir, ratones o ratas) que cumplen con los requisitos de homología, isomorfismo y previsibilidad relacionados con una enfermedad humana específica. Esto es de importancia específica en términos de aspectos básicos en la neurociencia traslacional.
-
Alojamiento y manipulación de animales
- Casa ratones o ratas en jaulas ventiladas individualmente dentro de una instalación de animales.
- Mueva a los animales experimentales de las instalaciones de animales a gabinetes ventilados ubicados en salas de laboratorio especiales destinadas a la anestesia, colocación de electrodos ABR y grabaciones abr.
- Asegúrese de que los animales estén alojados en un armario ventilado en condiciones ambientales estándar (es decir, con una temperatura de 21 oC, una humedad relativa del 50%-60% y un ciclo convencional de luz/oscuridad de 12/12 h). Permita que los animales se aclimaten y se adapten a este patrón circadiano durante al menos 14 días antes de la experimentación posterior.
- Utilizar jaulas de policarbonato transparente tipo II (26,7 cm x 20,7 cm x 14,0 cm, un área de 410 cm2) para albergar ratones en grupos de 3-4 y utilizar jaulas de policarbonato transparente tipo III (42,5 cm x 26,6 cm x 18,5 cm, un área de 800 cm2)para ratas. Proporcione acceso ad libitum al agua potable y a los pellets de alimentos estándar.
- Evite la separación/aislamiento de los animales experimentales antes y después de las grabaciones de ABR, ya que el aislamiento puede ejercer un estrés severo que afecta a los resultados experimentales. Por lo tanto, coloque a los animales de nuevo en su jaula de casa después de la anestesia, la colocación de electrodos ABR y las grabaciones abr.
- No aplique condiciones de vivienda abierta, ya que están sujetas a una variedad de inconvenientes experimentales, particularmente en estudios auditivos. Los gabinetes ventilados, en cambio, protegen del estrés acústico antes y entre los procedimientos auditivos experimentales que de otro modo podrían conducir a pérdida auditiva neurosensorial (por ejemplo, pérdida auditiva inducida por ruido) y, por lo tanto, afectar a los resultados.
- Utilizar equipos sanitarios, anestésicos y técnicos específicos de ratones y ratas para que ni los ratones ni las ratas puedan sentir la presencia entre sí, ya que la percepción sensorial mutua de especies rivales puede dar lugar a factores de confunción evitables en los estudios.
2. Anestesia del ratón
- Realice anestesia con anestésicos inyectables. Preparar una combinación de clorhidrato de ketamina (dosis de roedores: 100 mg/kg) e hidrocloruro de xilazina (dosis de roedores: 10 mg/kg) en 0,9% De NaCl o Ringer solución e inyectar el animal por vía intraperitoneal en función de su peso corporal.
NOTA: No se recomienda la narcosis por inhalación vía isoflurano, ya que el procedimiento ABR normalmente requiere un cubículo atenuante de sonido y una jaula Faraday, lo que resulta en limitaciones espaciales dentro de la configuración de grabación. Aunque muchos anestésicos actúan sobre el sistema NMDA y obviamente influyen en los resultados de grabación de ABR, no se recomienda un enfoque de restricción no anestésico en las grabaciones ABR, ya que los procedimientos de restricción bajo la conciencia inducen estrés dramático al animal, con formación de artefactos posteriores graves en los BBÁR. - Observe a los animales cuidadosamente para la profundidad de la anestesia mediante la realización de un pellizco de cola, pellizco de pie, y el monitoreo de la tasa de respiración (ratones: 150-220 respiraciones / min). Compruebe si hay un posible jadeo y contrarreste si es necesario.
NOTA: Diferentes líneas de ratón o modelos farmacológicos de ratón pueden mostrar diferentes sensibilidades a la anestesia. Lo mismo se aplica a los modelos de ratón mutantes. La intubación endotraqueal no es imprescindible en este entorno experimental y no se recomienda. Como la intubación aumenta el riesgo de traumatismo en la tráquea y la infección, el beneficio/riesgo de intubación endotraqueal durante el procedimiento de ABR es negativo.
3. Aspectos generales de los arreglos e instrumentación perianestésicos
- Aplique calor suplementario durante y después de las grabaciones de ABR usando una manta de calentamiento homeothermic para mantener la temperatura del núcleo corporal del animal. Mantener este último a 36,5-38,0 oC (98,6-100,4 oF).
NOTA: La hipotermia es un factor de riesgo en los roedores pequeños debido a su alta relación de superficie corporal (superficie corporal del ratón 10,5 x (peso en g)2/3; superficie del cuerpo de la rata a 10,5 x (peso en g)2/3) al volumen corporal. - Cubra los ojos del animal con un ungón lagrimeo lagrimal artificial a base de petróleo o un 5% de dexpantenol durante todo el proceso de grabación de ABR para evitar la desecación corneal. Continúe este procedimiento hasta que el reflejo parpadeante se restaure por completo.
- Esterilice los instrumentos experimentales (ver la Tabla de Materiales)utilizando un autoclave o desinfectantes.
NOTA: Se recomienda el uso de un esterilizador de instrumento quirúrgico a base de calor con cuentas de vidrio. - Para la colocación exacta del electrodo ABR, utilice un microscopio de aumento quirúrgico binocular con una fuente de luz fría para la iluminación intensa a través de guías de luz móviles flexibles o autosuficientes.
- Use una capa de laboratorio limpia, una máscara facial, una cubierta para la cabeza y guantes estériles durante el manejo y la experimentación experimentales de animales.
NOTA: Los instrumentos y suministros óptimos pueden variar entre laboratorios y deben cumplir con los estándares institucionales y específicos del laboratorio.
4. Grabaciones ABR
NOTA: El protocolo descrito aquí se basa en un sistema ABR disponible comercialmente para grabaciones monoaurales y binaurales. Es importante destacar que la cuestión científica que debe abordarse debe cumplir las especificaciones técnicas del sistema ABR utilizado. El análisis ABR de grabaciones binaurales, por ejemplo, se puede utilizar para investigar la codificación lateral de estímulos auditivos en la vía auditiva y para estudiar la asimetría lateral periférica en enfermedades neuropsiquiátricas.
- Realice una calibración de las frecuencias de estimulación en cada día de grabación colocando un micrófono conectado a un preamplificador y al sistema de procesamiento (consulte la Tabla de materiales)dentro del cubículo de atenuación del sonido en la ubicación con el lugar correcto orientación donde se colocará el oído murino experimental.
- Encienda el preamplificador conectado al micrófono al menos 5 minutos antes de la calibración para permitir el equilibrio del sistema.
- Encienda el osciloscopio.
- Coloque el micrófono conectado a un preamplificador dentro del cubículo de atenuación de sonido para imitar el oído murino experimental.
- Abra el software de procesamiento y adquisición disponible comercialmente (consulte la Tabla de materiales).
- Seleccione el archivo Cal200K de calibración dentro del software para activar el modo de calibración-configuración y elegir los parámetros de acuerdo con las condiciones experimentales.
- Utilice el sistema de procesador para ejecutar el procedimiento de calibración. Asegúrese de que las especificaciones técnicas del micrófono y el altavoz en términos de límites de SPL, rango de frecuencia y distribución armonizan.
- Seleccione e inicie el protocolo de estimulación de clics predefinido.
- Ejecute un SPL de un solo clic (preferiblemente, el SPL máximo) para verificar que el espectro de estímulos de sonido analizados por Fast Fourier Transformation (FFT) en línea del osciloscopio coincide con los requisitos (rango de energía sustancial).
- Seleccione e inicie el protocolo de estimulación de ráfaga de tono predefinido dentro del rango de interés (por ejemplo, 1-42 kHz).
- Confirme el espectro de frecuencia de los estímulos de prueba acústica registrados utilizando un osciloscopio y FFT en línea.
NOTA: La calibración diaria del sistema y las frecuencias de estimulación es necesaria para garantizar que las frecuencias de estimulación y los SP estén dentro de los rangos de trabajo aceptables.
- Coloque el ratón anestesiado dentro de un cubículo atenuante de sonido forrado con espuma acústica.
NOTA: Todo el cubículo debe estar cubierto por una jaula Faraday (metal mallado hecho a medida o uno comercial) para proteger las grabaciones ABR de interferencias eléctricas externas y protegerlas del ruido. - Para el registro de potenciales auditivos evocados por el tronco encefálico monaural, inserte electrodos subdérmicos de acero inoxidable en el vértice, axiales de las pinnae (electrodo positivo [+]) y ventrolaterales del pinna derecho o izquierdo (electrodo negativo [-]) dependiendo del electrodo oído a medir. Para grabaciones binaurales, coloque los electrodos negativos en las pinnos derecha e izquierda. Coloque el electrodo de tierra en la cadera del animal (FiguraSuplementaria 1).
- Antes de la inserción, formar una forma de gancho en la punta del electrodo de acero inoxidable para que la fijación subdérmica de los electrodos está garantizada47.
- Realice mediciones de impedancia de todos los electrodos antes de cada grabación para verificar el posicionamiento/conductividad adecuado según los electrodos. Utilice el botón de comprobación de impedancia en el escenario de cuatro canales para verificar cada nivel de impedancia del electrodo.
NOTA: La impedancia debe ser inferior a 5 k. - Registre los AB RA en condiciones de campo libre utilizando un solo altavoz (ancho de banda de frecuencia, por ejemplo, a 1-65 kHz) colocados 10 cm frente a la tribuna de los animales (el borde delantero del altavoz perpendicular al eje interaural del ratón). Asegúrese de que la posición de las orejas del cabezal/ratón del ratón sea la del micrófono de calibración, dependiendo de la distancia específica elegida entre el altavoz y el micrófono durante la calibración.
NOTA: En lugar de condiciones de campo libre, también se puede utilizar tubos para los oídos. Sin embargo, se realizan precauciones y pruebas especiales para determinar los SP en esta configuración. - Programar los protocolos de estímulo para los clics y las ráfagas de tono utilizando software autoprogramado o disponible comercialmente (ver la Tabla de Materiales). Los parámetros de estímulo individuales enumerados a continuación deben añadirse a la interfaz gráfica de usuario relacionada.
- Comience con la configuración de la entidad de estímulo de clic (es decir, un estímulo de duración de 100o con polaridad alterna [cambio entre condensación y rarefacción] y la energía sustancial definida. Utilice esta entidad de estímulo para analizar y determinar los umbrales de clic, la simetría ABR del oído izquierdo y derecho, las amplitudes ABR W (I - IV) y las latencias W (I - IV) más adelante.
- Inicie el software y utilice la ventana de configuración para agregar los parámetros de estímulo de clic. Haga clic en Ejecutar para ejecutar el protocolo.
- Continúe con la configuración de la segunda entidad de estímulo, que es una ráfaga de tono de 4,5 ms (pulso sinusoidal transitorio) de polaridad alterna con tiempos de subida y bajada De Hann de 1,5 ms cada uno (duración del tiempo de puerta/ramp). Considere una duración mínima de la ráfaga de tono de 3 ms, particularmente para las ráfagas de tono de baja frecuencia. Utilice este estímulo para analizar e identificar umbrales auditivos específicos de frecuencia en todos los genotipos.
- De forma similar al paso 4.6.2, utilice la ventana de configuración para agregar parámetros de estímulo de ráfaga de tono y haga clic en Ejecutar para ejecutar el protocolo (según lo indicado por el fabricante48).
- Para los estudios de ráfaga de tono, programe el rango de frecuencia adecuado que se probará en función de la cuestión científica (por ejemplo, de 1 a 42 kHz en pasos de 6 kHz). Asegúrese de que los rangos de frecuencia a aplicar cumplen con las capacidades técnicas del altavoz (en este caso, un altavoz magnético multicampo con un ancho de banda de frecuencia de 1-65 kHz para condiciones de campo libre o cerrado).
- Para promediar, establezca el número de estímulos acústicos secuenciales (clics o ráfagas de tono), por ejemplo, en 300x con una velocidad de 20 Hz.
- Aumente los SPL en pasos de 5 dB para los clics y los pasos de 10 dB para las ráfagas de tono, comenzando desde 0 dB hasta 90 dB (aumentando el modo SPL).
NOTA: En la literatura se han descrito los modos SPL crecientes y decrecientes. El tamaño del paso SPL podría adaptarse debido a cuestiones científicas.
- Determinar una duración de adquisición de datos ABR de 25 ms, comenzando con un período de referencia de 5 ms antes del inicio del estímulo acústico individual (línea de base pre-ABR) y superando una sección ABR de 10 ms por otra línea de base de 10 ms (línea base posterior a ABR) (Figurasuplementaria 1 ).
- Aplique una frecuencia de muestreo adecuada para la adquisición de datos ABR (por ejemplo, 24,4 kHz) y el filtro de paso de banda (paso alto: 300 Hz, paso bajo: 5 kHz) utilizando un filtro Butterworth de 6 polos. Active el filtro de muesca si es necesario.
NOTA: La frecuencia de muestreo y las características del filtro pueden adaptarse debido a los requisitos experimentales. - Transfiera las señales bioeléctricas resultantes registradas desde los electrodos subdérmicos a una etapa de la cabeza y más adelante a un preamplificador con amplificación adecuada (por ejemplo, 20 veces).
- Utilice un software de procesamiento de sistema ABR específico para coordinar el control de altavoces y la adquisición, procesamiento, promediación y administración de datos de ABR.
- Intente ejecutar los protocolos ABR completos (para los umbrales auditivos evocados por ráfagades de clics y tonos, la amplitud máxima y el análisis de latencia máxima, etc.) dentro de unos 45 min. Esto corresponde a la época de la narcosis profunda usando 100/10 mg de ketamina/xilazina intraperitoneal.
- Asegúrese de que la calibración, programación/ajustes para la presentación y adquisición de estímulos, ajustes de filtro, etc. funcionan según lo esperado antes de anestesiar al animal y realizar la grabación real.
5. Análisis ABR
- Análisis de umbral auditivo ABR con pulsación y tono evocado
- Realizar la detección automática de umbrales basada en publicaciones anteriores para evitar posibles incoherencias en la determinación del umbral ABR mediante inspección/estimación visual49,50,51,52.
- Defina tres ventanas de tiempo distintas (TW) para calcular la relación señal-ruido (SNR): TW1 (0-5 ms), TW2 (5-15 ms) y TW3 (15-25 ms) (Figurasuplementaria 1).
- Calcular la desviación estándar de ruido de la línea de base dentro de los dos TW distintos (es decir, TW1 y TW3) donde no se observan AEP. Este cálculo se puede hacer utilizando software autoprogramado.
- Calcule para cada medición SPL dentro de un registro ABR estableciendo tanto la media como la desviación estándar para los datos agrupados de TW1 y TW3.
- Restablezca todas las muestras de grabación individualmente por la media calculada correspondiente para eliminar cualquier desplazamiento de CC.
- Para la determinación del umbral auditivo, identifique el SPL más bajo (dB) en el que al menos un valor de amplitud de onda (WI-WIV) en la ventana de tiempo de respuesta ABR (TW2) superó el cuádruple de la desviación estándar calculada anteriormente.
NOTA: Si no se detectó ninguna onda ABR para el análisis de umbral de clic y frecuencia en el SPL máximo, se asigna un nivel de umbral nominal de 100 dB a la oreja.
- Análisis de latencia de onda y amplitud de onda ABR
- Llevar a cabo un enfoque basado en ondas usando el wavelet de sombrero mexicano para determinar la disposición temporal-secuencial de ondas positivas (p) (picos) así como las ondas negativas (n) (pits) usando un wavelet predeterminado por la transformación de wavelet continua (CWT) basada en algoritmo de coincidencia de patrones52 (Figura suplementaria 1).
- Matemáticamente, el CWT se representa de la siguiente manera53.
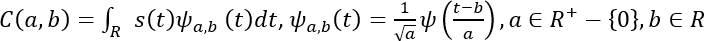
Aquí, s(t) es la señal, a es la escala, b es la traducción,el (t) es el wavelet de la madre, a, b(t) es el wavelet escalado y traducido, y C es la matriz 2D de coeficientes de onda.
- Matemáticamente, el CWT se representa de la siguiente manera53.
- Inicialmente, utilice la medición de 55 dB de cada ejecución ABR para identificar los mejores parámetros de escala para cada onda que se pasará al CWT, lo que resulta en tres clases: escalas 0.5-4 para todas las ondas n, 0.5-6 para todas las ondas p, y 0.5-12 para WIV ya que esto es el más amplio onda dentro de las muestras.
NOTA: El SPL de 55 dB se eligió ya que las ondas son generalmente más prominentes aquí y se pueden detectar de forma fiable. - Demuestre que todas las clases detectan de forma fiable la colocación temporal correcta de WI-WIV dentro de todas las mediciones de 55 dB.
- Para determinar ABR WI-WIV en el orden temporal preciso dentro de la medición de 55 dB, los picos p y n (pits) se identifican en una secuencia fija utilizando posiciones relativas de picos previamente identificados para limitar la ventana de tiempo de exploraciones posteriores.
- Una vez que los nueve picos se identifican a 55 dB, utilice los valores relacionados como puntos de partida para el marco de búsqueda temporal para las mediciones de presión sonora adyacentes (50 dB y 60 dB) antes de que se repita la identificación de los picos 1-9.
- De esta manera, determine los picos p y n de todos los niveles de dB (55-0 dB y 60-90 dB) si es posible. Una vez que el análisis de la onda ya no identifica un pico p y n, su disposición temporal se establece calculando el desplazamiento temporal del pico a cualquier otro pico identificado en el nivel de dB anterior.
- La aplicación del desplazamiento temporal a los picos a cualquier otro pico p y n dentro del nivel de decibelios actual da como resultado un máximo de ocho posiciones temporales determinadas para los picos indefinidos en los que la media se toma como la aproximación más cercana.
- Para evaluar la función de crecimiento de amplitud y la comparación de latencia de todas las ondas (WI-WIV), caracterizar las amplitudes máximas y las latencias medias de cada uno de los picos p dentro del marco de tiempo de los n picos relacionados.
- Compruebe visualmente todos los resultados basados en la herramienta de wavelet automática autoprogramada después y, si es necesario, excluya las ejecuciones individuales de ABR de las estadísticas si no cumplen los estrictos criterios de inclusión/calidad.
NOTA: Tanto en el análisis automatizado como en la inspección visual de los Abs, se recomienda un enfoque doble ciego.
- Llevar a cabo un enfoque basado en ondas usando el wavelet de sombrero mexicano para determinar la disposición temporal-secuencial de ondas positivas (p) (picos) así como las ondas negativas (n) (pits) usando un wavelet predeterminado por la transformación de wavelet continua (CWT) basada en algoritmo de coincidencia de patrones52 (Figura suplementaria 1).
6. Atención postoperatoria y tratamiento post-ABR
- Monitoree continuamente a los animales hasta que hayan recobrado la conciencia y sean capaces de mantener la recumbencia esternal.
- No devuelva un animal que haya sido sometido a grabaciones ABR a la compañía de otros animales hasta que se haya recuperado por completo.
- Inyectar carprofeno (ratón: 1x 5-10 mg/kg, por vía subcutánea; rata: 1x 2,5-5,0 mg/kg, por vía subcutánea) para el tratamiento postoperatorio del dolor.
NOTA: No se requiere un tratamiento del dolor de larga duración, ya que los electrodos de grabación ABR se insertan por vía subcutánea. - Postoperatoriamente, alimentar los pellets humedecidos con el fin de facilitar la toma de alimentos. Observe cuidadosamente los alimentos (15 g/100 g de peso corporal/día; 5 g/24 h) y el agua (15 ml/100 g de peso corporal/día; 5 ml/24 h) de consumo.
- Vigilar a los animales de cerca para el regreso de sus posturas y comportamiento normales.
NOTA: Aquí no se recomienda la administración sistémica de antibióticos como la enrofloxacina o la trimetoprim-sulfonamida, ya que la colocación de electrodos subdérmicos es de mínima invasividad. La aplicación de antibióticos debe restringirse a menos que se produzcan signos de inflamación local o generalizada. - Seguimiento de la recuperación postexperimental después de las grabaciones ABR mediante el control del peso corporal del animal.
Resultados
Las grabaciones ABR evocadas por ráfagas de tono y clic se pueden utilizar para evaluar las diferencias de umbral auditivo, la función de crecimiento de amplitud y la comparación de latencia. Los ABRs con evocados por clics en el modo de aumento de SPL se representan en la Figura 1 para los controles y dos líneas de ratón mutantes ejemplares que son deficientes para el canal Ca2+ con voltaje de tipo T de Cav3.2 (es decir, Cav
Discusión
Este protocolo proporciona una descripción detallada e integradora de cómo registrar las respuestas del tronco cerebral evocadas auditivas en ratones. Pone especial atención en el pretratamiento animal, la anestesia y los posibles factores de confunción metodológica. Estos últimos incluyen, entre otros, el género, la línea del ratón, la edad y las condiciones de vivienda. Cabe señalar que todos estos factores pueden tener un impacto en la pérdida auditiva neurosensorial y en los aspectos fundamentales del proc...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer a la Dra. Christina Kolb (Centro Alemán de Enfermedades Neurodegenerativas [DZNE]) y al Dr. Robert Stark (DZNE) por su asistencia en la cría de animales y el cuidado de la salud animal. Este trabajo fue apoyado financieramente por el Instituto Federal de Drogas y Dispositivos Médicos (Bundesinstitut f'r Arzneimittel und Medizinprodukte, BfArM, Bonn, Alemania).
Materiales
| Name | Company | Catalog Number | Comments |
| AEP/OAE Software for RZ6 (BioSigRZ software) | Tucker-Davis Technologies (TDT) | BioSigRZ | |
| Binocular surgical magnification microscope | Zeiss Stemi 2000 | 0000001003877, 4355400000000, 0000001063306, 4170530000000, 4170959255000, 4551820000000, 4170959040000, 4170959050000 | |
| Cages (Macrolon) | Techniplast | 1264C, 1290D | |
| Carprox vet, 50mg/ml | Virbac Tierarzneimittel GmbH | PZN 11149509 | |
| Cold light source | Schott KL2500 LCD | 9.705 202 | |
| Cotton tip applicators (sterile) | Carl Roth | EH12.1 | |
| Custom made meshed metal Faraday cage (stainless steel, 2 mm thickness, 1 cm mesh size) | custom made | custom made | |
| 5% Dexpanthenole (Bepanthen eye and nose creme) | Bayer Vital GmbH | PZN: 01578681 | |
| Disposable Subdermal stainless steel Needle electrodes, 27GA, 12mm | Rochester Electro-Medical, Inc. | S03366-18 | |
| Surgical drape sheets (sterile) | Hartmann | PZN 0366787 | |
| Ethanol, 70% | Carl Roth | 9065.5 | |
| 1/4'' Free Field Measure Calibration Mic Kit | Tucker-Davis Technologies (TDT) | PCB-378C0 | |
| Gloves (sterile) | Unigloves | 1570 | |
| Graefe Forceps-curved, serrated | FST | 11052-10 | |
| GraphPad Prism 6 Software, V6.07 | GraphPad Prism Software, Inc. | https://www.graphpad.com/ | |
| Heat-based surgical instrument sterilizer | FST | 18000-50 | |
| Homeothermic heating blanked | ThermoLux | 461265 / -67 | |
| Ketanest S (Ketamine), 25mg/ml | Pfizer | PZN 08707288 | |
| Ringer’s solution (sterile) | B.Braun | PZN 01471434 | |
| Matlab software | MathWorks, Inc. | https://de.mathworks.com/products/matlab.html | |
| Medusa 4-Channel Low Imped. Headstage | Tucker-Davis Technologies (TDT) | RA4LI | |
| Medusa 4-Channel Pre-Amp/Digitizer | Tucker-Davis Technologies (TDT) | RA4PA | |
| Microphone | PCB Pieztronics | 378C01 | |
| Multi Field Speaker- Stereo | Tucker-Davis Technologies (TDT) | MF1-S | |
| Oscilloscope | Tektronix | DPO3012 | |
| Optical PC1 express card for Optibit Interface) | Tucker-Davis Systems (TDT) | PO5e | |
| Askina Braucel pads (cellulose absorbet pads) | B.Braun | PZN 8473637 | |
| Preamplifier | PCB Pieztronics | 480C02 | |
| RZ6 Multi I/O Processor system (BioSigRZ) | Tucker-Davis Technologies (TDT) | RZ6-A-PI | |
| 0.9% saline (NaCl, sterile) | B.Braun | PZN:8609255 | |
| SigGenRZ software | Tucker-Davis Technologies (TDT) | https://www.tdt.com/ | |
| Software R (version 3.2.1) + Reshape 2 (Version 1.4.1) + ggplot 2 (version 1.0.1) + datatable (version 1.9.4), + gdata (version 2.13.3), + pastecs (version 1.3.18), + waveslim (version 1.7.5), + MassSpecWavelet (version 1.30.0) | The R Foundation, R Core Team 2015 | Open Source Software (freely distributable) | |
| Sound attenuating cubicle | Med Associates Inc. | ENV-018V | |
| Standard Pattern Forceps, 12cm and 14.5 cm length | FST | 11000-12, 11000-14 | |
| Leukosilk tape | BSN medical GmbH & Co. KG | PZN 00397109 | |
| Tissue Forceps- 1x2 Teeth 12 cm | FST | 11021-12 | |
| Uniprotect ventilated cabinet | Bioscape | THF3378 | |
| Ventilated cabinet | Tecniplast | 9AV125P | |
| Xylazine (Rompun), 2% | Bayer Vital GmbH | PZN 1320422 |
Referencias
- Sporns, O., Tononi, G., Kotter, R. The human connectome: A structural description of the human brain. PLOS Computational Biology. 1 (4), e42 (2005).
- Bebarova, M. Advances in patch clamp technique: towards higher quality and quantity. General Physiology and Biophysics. 31 (2), 131-140 (2012).
- Kornreich, B. G. The patch clamp technique: principles and technical considerations. Journal of Veterinary Cardiology. 9 (1), 25-37 (2007).
- Spira, M. E., Hai, A. Multi-electrode array technologies for neuroscience and cardiology. Nature Nanotechnology. 8 (2), 83-94 (2013).
- Obien, M. E., Deligkaris, K., Bullmann, T., Bakkum, D. J., Frey, U. Revealing neuronal function through microelectrode array recordings. Frontiers in Neuroscience. 8, 423 (2014).
- Heuschkel, M. O., Fejtl, M., Raggenbass, M., Bertrand, D., Renaud, P. A three-dimensional multi-electrode array for multi-site stimulation and recording in acute brain slices. Journal of Neuroscience Methods. 114 (2), 135-148 (2002).
- Kimiskidis, V. K. Transcranial magnetic stimulation (TMS) coupled with electroencephalography (EEG): Biomarker of the future. Reviews in Neurology. 172 (2), 123-126 (2016).
- Nunez, P. L. Toward a quantitative description of large-scale neocortical dynamic function and EEG. Behavioral Brain Science. 23 (3), 371-437 (2000).
- Lundt, A., et al. EEG Radiotelemetry in Small Laboratory Rodents: A Powerful State-of-the Art Approach in Neuropsychiatric, Neurodegenerative, and Epilepsy Research. Neural Plasticity. 2016, 8213878 (2016).
- Papazoglou, A., et al. Non-restraining EEG Radiotelemetry: Epidural and Deep Intracerebral Stereotaxic EEG Electrode Placement. Journal of Visualized Experiments. 112 (112), e54216 (2016).
- Weiergraber, M., Henry, M., Hescheler, J., Smyth, N., Schneider, T. Electrocorticographic and deep intracerebral EEG recording in mice using a telemetry system. Brain Research Brain Research Protocols. 14 (3), 154-164 (2005).
- Kallstrand, J., Nehlstedt, S. F., Skold, M. L., Nielzen, S. Lateral asymmetry and reduced forward masking effect in early brainstem auditory evoked responses in schizophrenia. Psychiatry Research. 196 (2-3), 188-193 (2012).
- Muller, R., et al. Automatic Detection of Highly Organized Theta Oscillations in the Murine EEG. Journal of Visualized Experiments. (121), e55089 (2017).
- Papazoglou, A., et al. Gender specific hippocampal whole genome transcriptome data from mice lacking the Cav2.3 R-type or Cav3.2 T-type voltage-gated calcium channel. Data in Brief. 12, 81-86 (2017).
- Papazoglou, A., et al. Gender-Specific Hippocampal Dysrhythmia and Aberrant Hippocampal and Cortical Excitability in the APPswePS1dE9 Model of Alzheimer's Disease. Neural Plasticity. 2016, 7167358 (2016).
- Papazoglou, A., et al. Motor Cortex Theta and Gamma Architecture in Young Adult APPswePS1dE9 Alzheimer Mice. PLOS ONE. 12 (1), e0169654 (2017).
- Siwek, M. E., et al. Altered theta oscillations and aberrant cortical excitatory activity in the 5XFAD model of Alzheimer's disease. Neural Plasticity. , 781731 (2015).
- Welch, T. M., Church, M. W., Shucard, D. W. A method for chronically recording brain-stem and cortical auditory evoked potentials from unanesthetized mice. Electroencephalography and Clinical Neurophysiology. 60 (1), 78-83 (1985).
- Church, M. W., Gritzke, R. Effects of ketamine anesthesia on the rat brain-stem auditory evoked potential as a function of dose and stimulus intensity. Electroencephalography and Clinical Neurophysiology. 67 (6), 570-583 (1987).
- van Looij, M. A., et al. Impact of conventional anesthesia on auditory brainstem responses in mice. Hearing Research. 193 (1-2), 75-82 (2004).
- Schomer, D. L., da Silva, F. L. . Niedermeyer's Electroencephalography: Basic Principles, Clinical Applications, and Related Fields. , (2011).
- De Cosmo, G., Aceto, P., Clemente, A., Congedo, E. Auditory evoked potentials. Minerva Anestesiology. 70 (5), 293-297 (2004).
- Rosburg, T. Auditory N100 gating in patients with schizophrenia: A systematic meta-analysis. Clinical Neurophysiology. 129 (10), 2099-2111 (2018).
- DiLalla, L. F., McCrary, M., Diaz, E. A review of endophenotypes in schizophrenia and autism: The next phase for understanding genetic etiologies. American Journal of Medical Genetics Part C Seminar in Medical Genetics. 175 (3), 354-361 (2017).
- Walsh, P., Kane, N., Butler, S. The clinical role of evoked potentials. Journal of Neurology, Neurosurgery and Psychiatry. 76 Suppl 2, ii16-ii22 (2005).
- Opgen-Rhein, C., Neuhaus, A., Urbanek, C., Dettling, M. New strategies in schizophrenia: impact of endophentotypes. Psychiatrische Praxis. 31 Suppl 2, S194-S199 (2004).
- Knipper, M., Van Dijk, P., Nunes, I., Ruttiger, L., Zimmermann, U. Advances in the neurobiology of hearing disorders: recent developments regarding the basis of tinnitus and hyperacusis. Progress in Neurobiology. 111, 17-33 (2013).
- Miller, C. A., Brown, C. J., Abbas, P. J., Chi, S. L. The clinical application of potentials evoked from the peripheral auditory system. Hearing Research. 242 (1-2), 184-197 (2008).
- Manouilenko, I., Humble, M. B., Georgieva, J., Bejerot, S. Brainstem Auditory Evoked Potentials for diagnosing Autism Spectrum Disorder, ADHD and Schizophrenia Spectrum Disorders in adults. A blinded study. Psychiatry Research. 257, 21-26 (2017).
- Talge, N. M., Tudor, B. M., Kileny, P. R. Click-evoked auditory brainstem responses and autism spectrum disorder: A meta-analytic review. Autism Research. 11 (6), 916-927 (2018).
- Hamed, S. A. The auditory and vestibular toxicities induced by antiepileptic drugs. Expert Opinion in Drug Safety. 16 (11), 1281-1294 (2017).
- Ismi, O., et al. The Effect of Methylphenidate on the Hearing of Children with Attention Deficit Hyperactivity Disorder. International Archive in Otorhinolaryngology. 22 (3), 220-224 (2018).
- Michna, M., et al. Cav1.3 (alpha1D) Ca2+ currents in neonatal outer hair cells of mice. Journal of Physiology. 553 (Pt 3), 747-758 (2003).
- Platzer, J., et al. Congenital deafness and sinoatrial node dysfunction in mice lacking class D L-type Ca2+ channels. Cell. 102 (1), 89-97 (2000).
- Willaredt, M. A., Ebbers, L., Nothwang, H. G. Central auditory function of deafness genes. Hearing Research. 312, 9-20 (2014).
- Yee, B. K., Singer, P. A conceptual and practical guide to the behavioural evaluation of animal models of the symptomatology and therapy of schizophrenia. Cell Tissue Research. 354 (1), 221-246 (2013).
- Fahey, J. R., Katoh, H., Malcolm, R., Perez, A. V. The case for genetic monitoring of mice and rats used in biomedical research. Mammalian Genome. 24 (3-4), 89-94 (2013).
- Hunsaker, M. R. Comprehensive neurocognitive endophenotyping strategies for mouse models of genetic disorders. Progress in Neurobiology. 96 (2), 220-241 (2012).
- Turner, J. G., Parrish, J. L., Hughes, L. F., Toth, L. A., Caspary, D. M. Hearing in laboratory animals: strain differences and nonauditory effects of noise. Computational Medicine. 55 (1), 12-23 (2005).
- Neumann, P. E., Collins, R. L. Genetic dissection of susceptibility to audiogenic seizures in inbred mice. Proceedings of the National Academy of Sciences of the United States of America. 88 (12), 5408-5412 (1991).
- Meier, S., Groeben, H., Mitzner, W., Brown, R. H. Genetic variability of induction and emergence times for inhalational anaesthetics. European Journal of Anaesthesiology. 25 (2), 113-117 (2008).
- Majewski-Tiedeken, C. R., Rabin, C. R., Siegel, S. J. Ketamine exposure in adult mice leads to increased cell death in C3H, DBA2 and FVB inbred mouse strains. Drug Alcohol Dependence. 92 (1-3), 217-227 (2008).
- Bonthuis, P. J., et al. Of mice and rats: key species variations in the sexual differentiation of brain and behavior. Frontiers in Neuroendocrinology. 31 (3), 341-358 (2010).
- Buckmaster, P. S., Haney, M. M. Factors affecting outcomes of pilocarpine treatment in a mouse model of temporal lobe epilepsy. Epilepsy Research. 102 (3), 153-159 (2012).
- Jonasson, Z. Meta-analysis of sex differences in rodent models of learning and memory: a review of behavioral and biological data. Neuroscience and Biobehavioral Reviews. 28 (8), 811-825 (2005).
- Prendergast, B. J., Onishi, K. G., Zucker, I. Female mice liberated for inclusion in neuroscience and biomedical research. Neuroscience and Biobehavioral Reviews. 40, 1-5 (2014).
- Ingham, N. J., Pearson, S., Steel, K. P. Using the Auditory Brainstem Response (ABR) to Determine Sensitivity of Hearing in Mutant Mice. Current Protocols in Mouse Biology. 1 (2), 279-287 (2011).
- . SigGenRZ Manual Available from: https://www.tdt.com/files/manuals/SigGenRZ_Manual.pdf (2012)
- Bogaerts, S., Clements, J. D., Sullivan, J. M., Oleskevich, S. Automated threshold detection for auditory brainstem responses: comparison with visual estimation in a stem cell transplantation study. BMC Neuroscience. 10, 104 (2009).
- Probst, F. J., et al. A point mutation in the gene for asparagine-linked glycosylation 10B (Alg10b) causes nonsyndromic hearing impairment in mice (Mus musculus). PLOS ONE. 8 (11), e80408 (2013).
- Alvarado, J. C., Fuentes-Santamaria, V., Gabaldon-Ull, M. C., Blanco, J. L., Juiz, J. M. Wistar rats: a forgotten model of age-related hearing loss. Frontiers in Aging Neuroscience. 6, 29 (2014).
- Du, P., Kibbe, W. A., Lin, S. M. Improved peak detection in mass spectrum by incorporating continuous wavelet transform-based pattern matching. Bioinformatics. 22 (17), 2059-2065 (2006).
- Daubechies, I. . Ten lectures on wavelets. , (1992).
- Pearson, J. D., et al. Gender differences in a longitudinal study of age-associated hearing loss. Journal of the Acoustical Society of America. 97 (2), 1196-1205 (1995).
- Murphy, M. P., Gates, G. A. Hearing Loss: Does Gender Play a Role?. Medscape Womens Health. 2 (10), 2 (1997).
- Henry, K. R. Males lose hearing earlier in mouse models of late-onset age-related hearing loss; females lose hearing earlier in mouse models of early-onset hearing loss. Hearing Research. 190 (1-2), 141-148 (2004).
- Ison, J. R., Allen, P. D., O’Neill, W. E. Age-related hearing loss in C57BL/6J mice has both frequency-specific and non-frequency-specific components that produce a hyperacusis-like exaggeration of the acoustic startle reflex. Journal of the Association for Research in Otolaryngology. 8 (4), 539-550 (2007).
- Zheng, Q. Y., Johnson, K. R., Erway, L. C. Assessment of hearing in 80 inbred strains of mice by ABR threshold analyses. Hearing Research. 130 (1-2), 94-107 (1999).
- Zhou, X., Jen, P. H., Seburn, K. L., Frankel, W. N., Zheng, Q. Y. Auditory brainstem responses in 10 inbred strains of mice. Brain Research. 1091 (1), 16-26 (2006).
- Lundt, A., et al. Cav3.2 T-Type Calcium Channels Are Physiologically Mandatory For The Auditory System. Neuroscience. , (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados