Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Acquisition de données et analyse dans brainstem Evoked Response Audiometry In Mice
Dans cet article
Résumé
L'audiométrie de réponse évoquée de tronc cérébral est un outil important dans la neurophysiologie clinique. De nos jours, l'audiométrie de réponse évoquée par le tronc cérébral est également appliquée dans la science fondamentale et les études précliniques impliquant des modèles d'animaux pharmacologiques et génétiques. Ici, nous fournissons une description détaillée de la façon dont les réponses auditives du tronc cérébral peuvent être enregistrées et analysées avec succès chez les souris.
Résumé
L'audiométrie de réponse évoquée de tronc cérébral (BERA) est d'importance centrale dans la neurophysiologie clinique. Comme d'autres techniques de potentiel évoqué (EP), telles que les potentiels évoqués visuellement (VEP) ou les potentiels évoqués somatosensoriels (SEP), les potentiels auditifs évoqués (AEP) sont déclenchés par la présentation répétitive de stimuli identiques, le réponse électroencéphalographique (EEG) dont la moyenne est par la suite moyenne ayant pour résultat des déviations positives (p) et négatives (n) distinctes. Chez l'homme, l'amplitude et la latence des pics individuels peuvent être utilisées pour caractériser les altérations de la synchronisation et de la vitesse de conduction dans les circuits neuronaux sous-jacents. Fait important, les PEA sont également appliqués dans la science fondamentale et préclinique pour identifier et caractériser la fonction auditive dans les modèles pharmacologiques et génétiques des animaux. Plus encore, des modèles animaux combinés à des tests pharmacologiques sont utilisés pour étudier les avantages potentiels dans le traitement de la perte auditive neurosensorielle (p. ex., déficits auditifs induits par l'âge ou le bruit). Ici, nous fournissons une description détaillée et intégrative de la façon d'enregistrer les réponses auditives du tronc cérébral (APR) chez les souris à l'aide d'application de clic et de tonalité-éclatement. Ce protocole met l'accent sur le logement pré-expérimental des animaux, l'anesthésie, l'enregistrement ABR, les processus de filtrage ABR, l'analyse automatisée de la fonction de croissance de l'amplitude basée sur les ondes et la détection de la latence.
Introduction
Un aspect central de la physiologie du cerveau est sa capacité à traiter l'information environnementale résultant en différentes sorties intrinsèques ou extrinsèques, telles que l'apprentissage, la mémoire, les réactions émotionnelles ou les réponses motrices. Diverses approches expérimentales et diagnostiques peuvent être utilisées pour caractériser la réactivité électrophysiologique des différents types de cellules neuronales ou des grappes/ensembles de neurones dans un circuit neuronal lié au stimulus. Ces techniques électrophysiologiques couvrent différentes dimensions spatiotemporales sur le micro-, le méso- et le macroscale1. Le niveau de microéchelle inclut la tension et les approches de pince actuelles dans différents modes de patch-clamp utilisant, par exemple, les neurones cultivés ou aiguement dissociés1. Ces techniques in vitro permettent la caractérisation des entités actuelles individuelles et leur modulation pharmacologique2,3. Un inconvénient essentiel, cependant, est le manque d'information systémique en ce qui concerne l'intégration et le traitement de l'information micro et macrocircuiterie. Cette déficience est partiellement surmontée par les techniques in vitro du méso-échelle, telles que les tableaux multiélectrodes qui permettent des enregistrements multiélectrodes extracellulaires simultanés non seulement dans les neurones cultivés, mais aussi dans les tranches de cerveau aigus4, 5. Considérant que les microcircuits peuvent être préservés dans les tranches de cerveau dans une mesure spécifique (par exemple, dans l'hippocampe), les interconnexions à longue portée sont généralement perdues6. En fin de compte, pour étudier les interconnexions fonctionnelles dans les circuits neuronaux, les techniques électrophysiologiques systémiques in vivo sur la macro-échelle sont la méthode de choix7. Ces approches comprennent, entre autres, des enregistrements EEG de surface (péridurales) et profonds (intracérébraux) qui sont réalisés chez les modèles humains et animaux1. Les signaux EEG sont principalement basés sur l'entrée synaptique synchronisée sur les neurones pyramidaux dans différentes couches corticales qui peuvent être inhibiteurs ou excitatoires en principe, malgré la prédominance générale de l'entrée excitatrice8. Lors de la synchronisation, les décalages postynaptiques excitatifs basés sur le potentiel dans les champs électriques extracellulaires sont résumés pour former un signal de force suffisante pour être enregistré sur le cuir chevelu à l'aide d'électrodes de surface. Notamment, un enregistrement détectable du cuir chevelu à partir d'une électrode individuelle nécessite l'activité de dix mille neurones pyramidaux et un armement complexe de dispositifs techniques et d'outils de traitement, y compris un amplificateur, des processus de filtrage (filtre à faible passage, filtre à passage élevé, filtre d'encoche) et électrodes ayant des propriétés spécifiques du conducteur.
Chez la plupart des espèces animales expérimentales (c.-à-d. les souris et les rats), l'approche eEG du cuir chevelu à base humaine n'est techniquement pas applicable, car le signal généré par le cortex sous-jacent est trop faible en raison du nombre limité de neurones pyramidaux synchronisés9, 10,11. Chez les rongeurs, les électrodes de surface (scalp) ou les électrodes subdermiques sont donc gravement contaminées par l'électrocardiogramme et surtout par des artéfacts électromyogrammes qui rendent impossibles les enregistrements EEGdehaute qualité 9,11, 12. Lorsque vous utilisez des souris et des rats en mouvement libre non anesthésiés, il est donc obligatoire d'enregistrer directement soit à partir du cortex par des électrodes épidurales, soit à partir des structures intracérébrales profondes afin d'assurer la connexion physique directe de la pointe de détection. de l'électrode de plomb/implantée aux amas neuronaux générateurs de signaux. Ces approches EEG peuvent être effectuées soit dans une configuration de système attaché de retenue ou en utilisant l'approche de télémétrie radio implantable non réinitialisable EEG9,10,11. Les deux techniques ont leurs avantages et inconvénients et peuvent être une approche valable dans la caractérisation qualitative et quantitative de la susceptibilité de saisie/activité de saisie, de la rythmique circadienne, de l'architecture de sommeil, de l'activité oscillatoire, et de la synchronisation, y compris l'analyse de temps-fréquence, l'analyse de source, etc.9,10,13,14,15,16,17.
Alors que les systèmes attachés et la télémétrie radio permettent d'enregistrer l'EEG dans des conditions de retenue/semi-réstraining ou de non-restraining, respectivement, les conditions expérimentales connexes ne correspondent pas aux exigences des enregistrements ABR. Cette dernière demande pour des stimuli acoustiques définis qui sont présentés de façon répétitive au fil du temps avec des positions définies d'un haut-parleur et d'animaux expérimentaux et des niveaux de pression sonore contrôlés (SPL). Ceci peut être réalisé soit par fixation de la tête dans des conditions de retenue ou après anesthésie18,19. Pour réduire le stress expérimental, les animaux sont normalement anesthésiés pendant l'expérimentation ABR, mais il faut considérer que l'anesthésie peut interférer avec les APR19,20.
En général, l'EEG est constitué de différentes fréquences dans une plage de tension de 50-100 V. Les fréquences de fond et les amplitudes dépendent fortement de l'état physiologique de l'animal expérimental. Dans l'état éveillé, les fréquences bêta et gamma avec amplitude inférieure prédominent. Lorsque les animaux deviennent somnolents ou s'endorment, des fréquences alpha, theta et delta (en) apparaissent, présentant une amplitude accrue de l'EEG21. Une fois qu'un canal sensoriel (p. ex., la voie acoustique) est stimulé, la propagation de l'information est médiée par l'activité neuronale à travers le système nerveux périphérique et central. Une telle stimulation sensorielle (par exemple, acoustique) déclenche ce qu'on appelle les EP ou les réponses évoquées. Notamment, les potentiels liés aux événements (ERP) sont beaucoup plus faibles en amplitude que l'EEG (c.-à-d. quelques microvolts seulement). Ainsi, tout ERP individuel basé sur un stimulus unique serait perdu contre le fond d'EEG de plus-amplitude. Par conséquent, un enregistrement d'un ERP nécessite l'application répétitive de stimuli identiques (par exemple, des clics dans les enregistrements ABR) et la moyenne subséquente pour éliminer toute activité de fond et d'artefacts EEG. Si les enregistrements ABR sont faits chez les animaux anesthésiés, il est facile d'utiliser des électrodes subdermiques ici.
Principalement, les PEA comprennent les PE à courte latence, qui sont normalement liés aux AAB ou À la BERA, et d'autres potentiels ultérieurs tels que les PE de midlatency (réponses de midllence [MLR]) et les EP à longue latence22. Fait important, la perturbation dans le traitement de l'information de l'information auditive est souvent une caractéristique centrale des maladies neuropsychiatriques (maladies démyélinisatrices, schizophrénie, etc.) et associée aux altérations du PEA23,24 ,25. Tandis que les investigations comportementales ne sont capables de révéler l'affaiblissement fonctionnel, les études d'AEP permettent l'analyse spatiotemporal précise du dysfonctionnement auditif lié aux structures neuroanatomiques spécifiques26.
Les ABR dès le début, la latence courte acoustique EPs sont normalement détectés sur l'application de clic modéré à élevé intense, et il peut se produire jusqu'à sept pics ABR (WI-WVII). Les ondes les plus importantes (WI-WV) sont liées aux structures neuroanatomiques suivantes : WI au nerf auditif (partie distale, dans l'oreille interne); WII au noyau cochléaire (partie proximale du nerf auditif, terminaison du tronc cérébral); WIII au complexe olivaire supérieur (SOC); WIV au lemniscus latéral (LL); WV à la terminaison du lemniscus latéral (LL) dans le colliculus inférieur (IC) sur le côté contralatéral27 (Figure supplémentaire 1). Il convient de noter que WII-WV sont susceptibles d'avoir plus d'une structure anatomique de la voie auditive ascendante qui y contribue. Notamment, la corrélation exacte des pics et des structures sous-jacentes du tractus auditif n'est pas encore entièrement clarifiée.
En audiologie, les APR peuvent être utilisés comme outil de dépistage et de diagnostic et pour la surveillance chirurgicale28,29. Il est plus important pour l'identification de la dysacusis, de l'hypacusis et de l'anacusis (p. ex., dans la perte auditive liée à l'âge, la perte auditive causée par le bruit, la perte auditive métabolique et congénitale, et la perte auditive asymétrique et les déficits auditifs dus à des malformations ou malformations, blessures et néoplasmes)28. Les APR sont également pertinents comme test de dépistage pour les enfants hyperactifs, ayant une déficience intellectuelle ou pour d'autres enfants qui ne seraient pas en mesure de répondre à l'audiométrie conventionnelle (p. ex., dans les maladies neurologiques/psychiatriques comme le TDAH, la SP, l'autisme, etc.29 , 30) et dans le développement et l'ajustement chirurgical des implants cochléaires28. Enfin, les APR peuvent fournir un aperçu précieux sur les effets secondaires ototoxiques potentiels des neuropsychopharmaceutiques, tels que les antiépileptiques31,32.
La valeur de la traduction des connaissances neurophysiologiques obtenues à partir de modèles de souris pharmacologiques ou transgéniques à l'homme a été démontrée dans de nombreux contextes, en particulier sur le niveau des ERP dans les paradigmes auditifs chez les souris et les rats33, 34,35. Un nouvel aperçu des peSO précoces altérés et des changements associés au traitement de l'information auditive chez les souris et les rats peut donc être traduit chez l'homme et est d'une importance centrale dans la caractérisation et l'endophenotypage de l'audit, neurologique, et neuropsychiatriques à l'avenir. Nous fournissons ici une description détaillée de la façon dont les APR peuvent être enregistrés et analysés avec succès chez la souris à des fins scientifiques, toxicologiques et pharmacologiques de base.
Protocole
Toutes les procédures animales ont été effectuées conformément aux directives du Conseil allemand des soins aux animaux et tous les protocoles ont été approuvés par le comité institutionnel local et national sur les soins aux animaux (Landesamt f'r Natur, Umwelt, und Verbraucherschutz, État Bureau de La Rhénanie-du-Nord-Westphalie, Département de la nature, de l'environnement et de la consommation [LANUV NRW], Allemagne). Les auteurs certifient en outre que toutes les expérimentations animales ont été menées conformément au National Institutes of Health Guide for the Care and Use of Laboratory Animals (NIH Publications No. 80-23) révisé en 1996 ou à la UK Animals (Scientific Procedures) Act 1986 et les lignes directrices connexes, ou la directive du Conseil des Communautés européennes du 24 novembre 1986 (86/609/CEE) et du 22 septembre 2010 (2010/63/UE). Des efforts spécifiques ont été faits pour réduire au minimum le nombre d'animaux utilisés et leur souffrance (3R [remplacement, réduction et raffinement]).
1. Animaux expérimentaux
-
Sélection d'animaux et d'espèces expérimentaux
- Effectuer des études ABR sur des modèles de rongeurs/rongeurs (c.-à-d. souris ou rats) qui répondent aux exigences de l'homologie, de l'isomorphisme et de la prévisibilité liées à une maladie humaine spécifique. Ceci est d'une importance particulière en termes d'aspects fondamentaux des neurosciences translationnelles.
REMARQUE : Considérez que les souches diverses disponibles de souris et de rats peuvent montrer des différences dans les caractéristiques physiologiques et pathophysiologiques de base36,37,38. Ces spécificités liées à la ligne de souris/rats doivent être prises en compte dans la planification expérimentale. - Considérez les altérations spécifiques de la physiologie et de la pharmacologie à la souris et au rat-souche qui pourraient avoir un impact sur les expériences électrophysiologiques (p. ex. sensibilités anesthésiques altérées, rythmique circadienne, susceptibilité [audiogénique] aux crises, âge, et le fond génétique)39,40,41,42.
- Inclure la stratification sexospécifique dans la conception de l'étude. Rappelez-vous que le cycle esturaire peut affecter gravement la susceptibilité anesthésique, la rythmique centrale, la dépendance circadienne, et l'activité de saisie (saisies auditives) et le traitement sensoriel (auditif) de l'information43,44 , 45. Ainsi, effectuer une analyse sexospécifique.
REMARQUE : Limiter aux souris mâles si la capacité financière et expérimentale est limitée, bien que divers paramètres neurophysiologiques des femelles normalement cyclistes ne semblent pas montrer une variabilité accrue par rapport aux mâles46.
- Effectuer des études ABR sur des modèles de rongeurs/rongeurs (c.-à-d. souris ou rats) qui répondent aux exigences de l'homologie, de l'isomorphisme et de la prévisibilité liées à une maladie humaine spécifique. Ceci est d'une importance particulière en termes d'aspects fondamentaux des neurosciences translationnelles.
-
Logement et manipulation d'animaux
- Loger des souris ou des rats dans des cages ventilées individuellement à l'intérieur d'une installation animale.
- Déplacez les animaux expérimentaux de l'établissement animalier vers des armoires ventilées situées dans des salles de laboratoire spéciales destinées à l'anesthésie, au placement d'électrodes ABR et aux enregistrements ABR.
- Assurez-vous que les animaux sont logés dans une armoire ventilée dans des conditions environnementales standard (c.-à-d. avec une température de 21 à 2 oC, 50 % à 60 % d'humidité relative et un cycle de lumière/obscurité conventionnel de 12/12 h). Permettre aux animaux de s'acclimater et de s'adapter à ce modèle circadien pendant au moins 14 jours avant l'expérimentation ultérieure.
- Utilisez des cages en polycarbonate transparentde de type II (26,7 cm x 20,7 cm x 14,0 cm, soit une superficie de 410 cm2) pour loger les souris en groupes de 3 à 4 et utilisez des cages en polycarbonate transparentde de type III (42,5 cm x 26,6 cm x 18,5 cm, soit une superficie de 800 cm2) pour les rats. Fournir un accès ad libitum à l'eau potable et aux granulés alimentaires standard.
- Évitez la séparation/isolement des animaux expérimentaux avant et après les enregistrements aBR car l'isolement peut exercer un stress intense affectant les résultats expérimentaux. Ainsi, placez les animaux de nouveau dans leur cage à la maison après l'anesthésie, le placement d'électrode d'ABR, et les enregistrements d'ABR.
- N'appliquez pas de conditions de logement ouvertes car elles sont sujettes à une variété d'inconvénients expérimentaux, en particulier dans les études auditives. Les armoires ventilées, au lieu de cela, protègent contre le stress acoustique avant et entre les procédures auditives expérimentales qui pourraient autrement mener à la perte d'audition neuro-sensorielle (par exemple, perte auditive induite par le bruit) et ainsi affecter des résultats.
- Utiliser des équipements sanitaires, anesthésiques et techniques spécifiques à la souris et aux rats afin que ni les souris ni les rats ne puissent sentir la présence de l'autre, car la perception sensorielle mutuelle d'espèces rivales peut donner lieu à des facteurs de confusion évitables dans les études.
2. Anesthésie de souris
- Effectuer l'anesthésie à l'aide d'anesthésiques injectables. Préparer une combinaison d'hydrochlorure de kétamine (dose de rongeur: 100 mg/kg) et d'hydrochlorure de xylazine (dose de rongeur: 10 mg/kg) dans la solution NaCl ou Ringer de 0,9% et injecter l'animal par voie intrapéritone en fonction de son poids corporel.
REMARQUE : La narcose par inhalation par l'intermédiaire de l'isoflurane n'est pas recommandée car la procédure ABR exige normalement une cabine atténuante de son et une cage de Faraday, ayant pour résultat des limitations spatiales dans la configuration d'enregistrement. Bien que de nombreux anesthésiques agissent sur le système NMDA et influencent évidemment les résultats de l'enregistrement ABR, une approche de restriction non anesthésique dans les enregistrements ABR n'est pas recommandée car les procédures de restriction sous conscience induisent un stress dramatique à l'animal, avec formation d'artefacts subséquentes graves dans les APR. - Observez attentivement les animaux pour la profondeur de l'anesthésie en effectuant un pincement de la queue, pincement du pied, et le suivi du taux de respiration (souris: 150-220 respirations / min). Vérifiez s'il y a un essoufflement possible et contrecarrent si nécessaire.
REMARQUE : Différentes lignées de souris ou modèles pharmacologiques de souris peuvent montrer différentes sensibilités à l'anesthésie. Il en va de même pour les modèles de souris mutantes. L'intubation endotrachéale n'est pas un must dans ce cadre expérimental et non recommandé. Comme l'intubation augmente le risque de traumatisme à la trachée et l'infection, l'avantage / risque d'intubation endotrachéale au cours de la procédure ABR est négatif.
3. Aspects généraux des arrangements périsiesthétic et de l'instrumentation
- Appliquer une chaleur supplémentaire pendant et après les enregistrements ABR à l'aide d'une couverture chauffante homéothermie pour maintenir la température du cœur du corps de l'animal. Maintenir ce dernier à 36,5-38,0 oC (98,6-100,4 oF).
REMARQUE : L'hypothermie est un facteur de risque chez les petits rongeurs en raison de leur rapport élevé de surface corporelle (surface du corps de la souris à 10,5 x (poids en g)2/3;surface du corps du rat à 10,5 x (poids en g)2/3) par rapport au volume corporel. - Couvrez les yeux de l'animal avec de l'onduleur artificiel à base de pétrole ou de 5 % de dexpanthenol pendant tout le processus d'enregistrement de l'ABR afin d'éviter la dessiccation cornéenne. Continuez cette procédure jusqu'à ce que le réflexe clignotant soit entièrement restauré.
- Stériliser les instruments expérimentaux (voir tableau des matériaux) à l'aide d'un autoclave ou désinfectant.
REMARQUE : L'utilisation d'un stérilisateur d'instrument chirurgical à base de chaleur avec des perles en verre est recommandée. - Pour le placement exact d'électrode ABR, utilisez un microscope de grossissement chirurgical binoculaire avec une source de lumière froide pour l'éclairage intense par l'intermédiaire des guides mobiles flexibles ou autoportants de lumière.
- Utilisez un manteau de laboratoire propre, un masque facial, un couvre-chef et des gants stériles pendant la manipulation et l'expérimentation expérimentales d'animaux.
REMARQUE : Les instruments et les fournitures optimaux peuvent varier d'un laboratoire à l'autre et doivent répondre à des normes propres au laboratoire et aux normes institutionnelles.
4. Enregistrements ABR
REMARQUE : Le protocole décrit ici est basé sur un système ABR disponible dans le commerce pour les enregistrements monaural et binaural. Il est important de noter que la question scientifique à traiter doit répondre aux spécifications techniques du système ABR utilisé. L'analyse ABR des enregistrements binaural, par exemple, peut être employée pour étudier le codage latéral des stimulus auditifs dans la voie auditive et pour étudier l'asymétrie latérale périphérique dans les maladies neuropsychiatriques.
- Effectuer un étalonnage des fréquences de stimulation chaque jour de l'enregistrement en plaçant un microphone connecté à un préamplificateur et au système de traitement (voir le Tableau des matériaux) à l'intérieur de la cabine d'atténuation du son à l'emplacement avec le bon l'orientation où l'oreille murine expérimentale sera positionnée.
- Activez le préamplificateur connecté au microphone au moins 5 minutes avant l'étalonnage pour permettre l'équilibre du système.
- Allumez l'oscilloscope.
- Placez le microphone connecté à un préamplificateur à l'intérieur de la cabine atténuante du son pour imiter l'oreille murine expérimentale.
- Ouvrez le logiciel de traitement et d'acquisition disponible sur le marché (voir le Tableau des matériaux).
- Sélectionnez le fichier Cal200K d'étalonnage dans le logiciel pour activer le mode calibrage-configuration et choisir les paramètres en fonction des conditions expérimentales.
- Utilisez le système de processeur pour exécuter la procédure d'étalonnage. Assurez-vous que les spécifications techniques du microphone et du haut-parleur en termes de limites SPL, gamme de fréquences et de distribution s'harmonisent.
- Sélectionnez et démarrez le protocole de stimulation par clic prédéfini.
- Exécuter un seul clic SPL (de préférence, le maximum SPL) pour vérifier que le spectre de stimuli sonores analysés par en ligne Fast Fourier Transformation (FFT) de l'oscilloscope correspond aux exigences (gamme d'énergie substantielle).
- Sélectionnez et démarrez le protocole de stimulation prédéfini de tonalité-éclatement dans la gamme d'intérêt (par exemple, 1-42 kHz).
- Confirmer le spectre de fréquence des stimuli de test acoustique enregistrés à l'aide d'un oscilloscope et d'un FFT en ligne.
REMARQUE : L'étalonnage quotidien du système et les fréquences de stimulation sont nécessaires pour garantir que les fréquences de stimulation et les SPL se situent dans des plages de travail acceptables.
- Placez la souris anesthésié à l'intérieur d'une cabine atténuante de son doublée de mousse acoustique.
REMARQUE : La cabine entière doit être recouverte d'une cage Faraday (métal maillé sur mesure ou commerciale) pour protéger les enregistrements ABR des interférences électriques externes et les protéger du bruit. - Pour l'enregistrement des potentiels auditifs sonores évoqués par le tronc cérébral, insérez des électrodes en acier inoxydable subdermiques au sommet, axiale de l'électrode pinnae (positive[] ] et ventrolatérale de la pinna droite ou gauche (électrode négative [-] l'oreille à mesurer. Pour les enregistrements binaural, placez les électrodes négatives à la fois à droite et à gauche pinnae. Placez l'électrode au sol à la hanche de l'animal (figuresupplémentaire 1).
- Avant l'insertion, formez une forme de crochet à l'extrémité de l'électrode en acier inoxydable de sorte que la fixation sous-dermique des électrodes soit garantie47.
- Effectuez des mesures d'impédance de toutes les électrodes avant chaque enregistrement afin de vérifier le positionnement et la conductivité des électrodes. Utilisez le bouton de contrôle d'impédance sur la scène à quatre canaux pour vérifier chaque niveau d'entrave à l'électrode.
REMARQUE : L'impédance doit être inférieure à 5 k. - Enregistrez les APR dans des conditions de champ libre à l'aide d'un seul haut-parleur (bande passante de fréquence, par exemple, à 1-65 kHz) placé à 10 cm en face de la tribune des animaux (le bord d'attaque du haut-parleur perpendiculaire à l'axe interaural de la souris). Assurez-vous que la position de la tête de souris / oreilles de souris est celle du microphone d'étalonnage, en fonction de la distance spécifique choisie entre le haut-parleur et le microphone pendant l'étalonnage.
REMARQUE : Au lieu des conditions de champ libre, le tube d'oreille peut également être employé. Cependant, des précautions et des tests spéciaux sont nécessaires pour déterminer les SPL dans ces paramètres. - Programmez les protocoles de stimulation pour les clics et les sauts de tonalité à l'aide d'un logiciel autoprogrammé ou disponible dans le commerce (voir le Tableau des matériaux). Les paramètres de stimulus individuels énumérés ci-dessous doivent être ajoutés à l'interface utilisateur graphique connexe.
- Commencez par la configuration de l'entité de stimulation du clic (c.-à-d., un stimulus de durée de 100 euros avec polarisation alternée [commutation entre condensation et rareté] et l'énergie substantielle définie. Utilisez cette entité de stimulus pour analyser et déterminer les seuils de clic, la symétrie ABR de l'oreille gauche et droite, les amplitudes ABR W (I - IV) et les latences W (I - IV) plus tard.
- Démarrez le logiciel et utilisez la fenêtre de configuration pour ajouter les paramètres de stimulus de clic. Cliquez sur Exécuter pour exécuter le protocole.
- Continuer avec la configuration de la deuxième entité de stimulus, qui est une rafale de tonalité de 4,5 ms (impulsion sinusoïdale transitoire) de polarité alternée avec l'élévation de l'enveloppe Hann et les temps de chute de 1,5 ms chacun (durée de la porte/rampe). Considérez une durée minimale d'éclatement de tonalité de 3 ms, en particulier pour les rafales de tonalité à basse fréquence. Utilisez ce stimulus pour analyser et identifier les seuils d'audition spécifiques à la fréquence dans tous les génotypes.
- Semblable à l'étape 4.6.2, utilisez la fenêtre de configuration pour ajouter des paramètres de stimulus de tonalité et cliquez sur Exécuter pour exécuter le protocole (comme indiqué par le fabricant48).
- Pour les études sur l'éclatement du tonalité, programmez la plage de fréquences appropriée à tester en fonction de la question scientifique (p. ex., de 1 à 42 kHz en étapes de 6 kHz). Assurez-vous que les plages de fréquence à appliquer répondent aux capacités techniques du haut-parleur (dans ce cas, un haut-parleur magnétique multi-champ avec une bande passante de fréquence de 1-65 kHz pour les conditions de champ libre ou fermé).
- Pour la moyenne, définir le nombre de stimuli acoustiques séquentiels (clics ou rafales de tonalité), par exemple, à 300x avec un taux de 20 Hz.
- Augmentez les SPL en 5 étapes dB pour les clics et 10 étapes dB pour les rafales de tonalité, à partir de 0 dB jusqu'à 90 dB (mode SPL en augmentation).
REMARQUE : Des modes croissants et décroissants de SPL ont été décrits dans la littérature. La taille de l'étape SPL peut être adaptée en raison de questions scientifiques.
- Déterminer une durée d'acquisition de données ABR de 25 ms, en commençant par une période de référence de 5 ms avant le début individuel du stimulus acoustique (ligne de base pré-ABR) et en dépassant une section ABR de 10 ms d'une autre ligne de base de 10 ms (ligne de base post-ABR) (figuresupplémentaire 1 ).
- Appliquer un taux d'échantillonnage approprié pour l'acquisition de données ABR (p. ex., 24,4 kHz) et le filtre bandpass (passage élevé : 300 Hz, faible passage : 5 kHz) à l'aide d'un filtre Butterworth à 6 pôles. Activez le filtre d'encoche si nécessaire.
REMARQUE : Le taux d'échantillonnage et les caractéristiques du filtre peuvent être adaptés en raison des exigences expérimentales. - Transférer les signaux bioélectriques qui en résultent des électrodes subdermiques à un stade de tête et plus loin vers l'avant à un préamplificateur avec une amplification appropriée (p. ex., 20 fois).
- Utilisez un logiciel de traitement de système ABR spécifique pour coordonner le contrôle des haut-parleurs et l'acquisition, le traitement, la moyenne et la gestion des données par ABR.
- Essayez d'exécuter l'ensemble des protocoles ABR (pour les seuils d'audition en rafale s'éclatement de clic et de tonalité, l'amplitude de pointe, et l'analyse de latence de pointe, etc.) dans un délai d'environ 45 minutes. Cela correspond à l'époque de la narcose profonde en utilisant 100/10 mg de kétamine/xylazine intrapéritone.
- Assurez-vous que l'étalonnage, la programmation/ajustements pour la présentation et l'acquisition de stimulus, les paramètres de filtre, etc. fonctionnent comme prévu avant d'anesthésier l'animal et d'effectuer l'enregistrement réel.
5. Analyse ABR
- Analyse du seuil d'audition ABR en rafale de clic et de tonalité
- Effectuer une détection automatisée des seuils basée sur des publications antérieures afin d'éviter les incohérences potentielles dans la détermination du seuil ABR par inspection visuelle/estimation49,50,51,52.
- Définir trois fenêtres temporelles distinctes (TW) pour calculer le rapport signal-bruit (SNR) : TW1 (0-5 ms), TW2 (5-15 ms) et TW3 (15-25 ms) (figuresupplémentaire 1).
- Calculer l'écart de la norme de bruit de la ligne de base à l'intérieur des deux TW distincts (c.-à-d. TW1 et TW3) où aucun AEP n'est observé. Ce calcul peut être fait à l'aide d'un logiciel autoprogrammé.
- Calculer pour chaque mesure SPL dans un enregistrement ABR définissant à la fois la moyenne et l'écart standard pour les données mises en commun de TW1 et TW3.
- Réinitialisez tous les échantillons d'enregistrement individuellement par la moyenne calculée correspondante pour supprimer tout décalage DC.
- Pour la détermination du seuil auditif, identifiez la plus faible SPL (dB) où au moins une valeur d'amplitude d'onde (WI-WIV) dans la fenêtre de temps de réponse ABR (TW2) dépassait le quadruple de l'écart type précédemment calculé.
REMARQUE : Si aucune onde ABR n'a été détectée pour l'analyse du seuil de clic et de fréquence au maximum DePL, un seuil nominal de 100dB est attribué à l'oreille.
- Analyse de l'amplitude des vagues ABR et de latence des vagues
- Mener une approche à base de vagues à l'aide de l'onde à chapeau mexicaine pour déterminer l'arrangement temporel-séquentiel des ondes positives (p) ondes (pics) ainsi que les ondes négatives (n) (pits) à l'aide d'un ondeparpar par défaut par la transformation continue des ondes (CWT) à base de algorithme de correspondance de motifs52 (Figure supplémentaire 1).
- Mathématiquement, le CWT est représenté comme suit53.
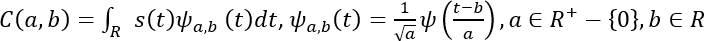
Ici, s(t) est le signal, a est l'échelle, b est la traduction, (t) est la mère wavelet, a, b(t) est l'onde à l'échelle et traduite, et C est la matrice 2D de coefficients d'ondoudre.
- Mathématiquement, le CWT est représenté comme suit53.
- Dans un premier temps, utilisez la mesure 55 dB de chaque course ABR pour identifier les meilleurs paramètres d'échelle pour chaque vague à passer à la CWT, ce qui se traduit par trois classes: échelles 0,5-4 pour toutes les ondes n, 0,5-6 pour toutes les ondes p, et 0,5-12 pour WIV car c'est le plus large ondule dans les échantillons.
REMARQUE: Le 55 dB SPL a été choisi que les vagues sont généralement les plus importants ici et peuvent être détectés de façon fiable. - Prouvez toutes les classes pour détecter de façonfiable la collocation temporelle correcte de W I-WIV dans toutes les 55 mesures dB.
- Pour déterminer ABR WI-WIV dans l'ordre temporel précis dans la mesure de 55 dB, les pics p et les n-pics (pits) sont identifiés dans une séquence fixe à l'aide de positions relatives de pics précédemment identifiés pour limiter la fenêtre de temps de scans ultérieurs.
- Une fois que les neuf pics sont identifiés à 55 dB, utilisez les valeurs connexes comme points de départ pour le cadre de recherche temporelle pour les mesures de pression sonore adjacentes (50 dB et 60 dB) avant que l'identification des pics 1-9 ne soit répétée.
- De cette façon, déterminer les pics p et n de tous les niveaux dB (55-0 dB et 60-90 dB) si possible. Une fois qu'un p- et n-pic n'est plus identifié par l'analyse d'onde, son arrangement temporel est fixé en calculant le décalage temporel du pic à n'importe quel autre pic identifié dans le niveau dB précédent.
- L'application du décalage temporel aux pics à tout autre p- et n-pic dans le niveau actuel de décibels entraîne un maximum de huit positions temporelles déterminées pour les pics non définis dont la moyenne est considérée comme l'approximation la plus proche.
- Pour évaluer la fonction de croissance de l'amplitude et la comparaison de latence de toutes les vagues (WI-WIV),caractériser les amplitudes maximales et les latences moyennes de chacun des p-pics dans le laps de temps des n-pics connexes.
- Vérifiez visuellement tous les résultats basés sur l'outil d'onde automatique autoprogrammé par la suite, et, si nécessaire, excluez les courses individuelles aBR des statistiques si elles ne répondent pas aux critères stricts d'inclusion/qualité.
REMARQUE : Dans l'analyse automatisée et l'inspection visuelle des APR, une approche à double insu est recommandée.
- Mener une approche à base de vagues à l'aide de l'onde à chapeau mexicaine pour déterminer l'arrangement temporel-séquentiel des ondes positives (p) ondes (pics) ainsi que les ondes négatives (n) (pits) à l'aide d'un ondeparpar par défaut par la transformation continue des ondes (CWT) à base de algorithme de correspondance de motifs52 (Figure supplémentaire 1).
6. Soins postopératoires et traitement post-ABR
- Surveillez continuellement les animaux jusqu'à ce qu'ils aient repris conscience et soient capables de maintenir la charge sternale.
- Ne retournez pas un animal qui a subi des enregistrements ABR à la compagnie d'autres animaux jusqu'à ce qu'il ait complètement récupéré.
- Injecter du carprofène (souris : 1x 5-10 mg/kg, sous-cutanée; rat : 1x 2,5-5,0 mg/kg, sous-cutané) pour un traitement de la douleur postopératoire.
REMARQUE : Le traitement de longue durée de douleur n'est pas exigé car les électrodes d'enregistrement d'ABR sont insérées sous-cutanée. - Postopératoirement, nourrir les granulés humidifiés afin de faciliter l'utilisation des aliments. Observez attentivement les aliments (15 g/100 g de poids corporel/jour; 5 g/24 h) et l'eau (15 ml/100 g de poids corporel/jour; 5 mL/24 h) de consommation.
- Surveillez les animaux de près pour le retour de leurs postures normales et le comportement.
REMARQUE : L'administration systémique des antibiotiques tels que l'enrofloxacine ou le trimethoprim-sulfonamide n'est pas recommandée ici, car le placement subdermique d'électrode est seulement d'invasivité minimale. L'application d'antibiotiques devrait être limitée à moins que des signes d'inflammation locale ou généralisée se produisent. - Récupération postexpérimentale de suivi après enregistrements d'ABR en contrôlant le poids corporel de l'animal.
Résultats
Les enregistrements ABR évoqués par clic et ton peuvent être utilisés pour évaluer les différences de seuil d'audition, la fonction de croissance de l'amplitude et la comparaison de latence. Les APR évoqués par clic dans le mode d'augmentation SPL sont représentés à la figure 1 pour les contrôles et deux lignes de souris mutantes exemplaires qui sont déficientes pour le canal Cav3.2 T-ty mat à barrière de tension Ca2 (c.-?...
Discussion
Ce protocole fournit une description détaillée et intégrative de la façon d'enregistrer les réponses auditives évoquées du tronc cérébral chez la souris. Il met l'accent sur le prétraitement des animaux, l'anesthésie et les facteurs de confusion méthodologiques potentiels. Ces derniers comprennent, entre autres, le sexe, la ligne de souris, l'âge et les conditions de logement. Il convient de noter que tous ces facteurs peuvent avoir un impact sur la perte auditive neurosensorielle et les aspects fondamentaux...
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les auteurs tiennent à remercier la Dre Christina Kolb (Centre allemand pour les maladies neurodégénératives (DZNE)) et le Dr Robert Stark (DZNE) pour leur aide dans l'élevage et les soins de santé animale. Ce travail a été soutenu financièrement par l'Institut fédéral des drogues et des dispositifs médicaux (Bundesinstitut f'r Arzneimittel und Medizinprodukte, BfArM, Bonn, Allemagne).
matériels
| Name | Company | Catalog Number | Comments |
| AEP/OAE Software for RZ6 (BioSigRZ software) | Tucker-Davis Technologies (TDT) | BioSigRZ | |
| Binocular surgical magnification microscope | Zeiss Stemi 2000 | 0000001003877, 4355400000000, 0000001063306, 4170530000000, 4170959255000, 4551820000000, 4170959040000, 4170959050000 | |
| Cages (Macrolon) | Techniplast | 1264C, 1290D | |
| Carprox vet, 50mg/ml | Virbac Tierarzneimittel GmbH | PZN 11149509 | |
| Cold light source | Schott KL2500 LCD | 9.705 202 | |
| Cotton tip applicators (sterile) | Carl Roth | EH12.1 | |
| Custom made meshed metal Faraday cage (stainless steel, 2 mm thickness, 1 cm mesh size) | custom made | custom made | |
| 5% Dexpanthenole (Bepanthen eye and nose creme) | Bayer Vital GmbH | PZN: 01578681 | |
| Disposable Subdermal stainless steel Needle electrodes, 27GA, 12mm | Rochester Electro-Medical, Inc. | S03366-18 | |
| Surgical drape sheets (sterile) | Hartmann | PZN 0366787 | |
| Ethanol, 70% | Carl Roth | 9065.5 | |
| 1/4'' Free Field Measure Calibration Mic Kit | Tucker-Davis Technologies (TDT) | PCB-378C0 | |
| Gloves (sterile) | Unigloves | 1570 | |
| Graefe Forceps-curved, serrated | FST | 11052-10 | |
| GraphPad Prism 6 Software, V6.07 | GraphPad Prism Software, Inc. | https://www.graphpad.com/ | |
| Heat-based surgical instrument sterilizer | FST | 18000-50 | |
| Homeothermic heating blanked | ThermoLux | 461265 / -67 | |
| Ketanest S (Ketamine), 25mg/ml | Pfizer | PZN 08707288 | |
| Ringer’s solution (sterile) | B.Braun | PZN 01471434 | |
| Matlab software | MathWorks, Inc. | https://de.mathworks.com/products/matlab.html | |
| Medusa 4-Channel Low Imped. Headstage | Tucker-Davis Technologies (TDT) | RA4LI | |
| Medusa 4-Channel Pre-Amp/Digitizer | Tucker-Davis Technologies (TDT) | RA4PA | |
| Microphone | PCB Pieztronics | 378C01 | |
| Multi Field Speaker- Stereo | Tucker-Davis Technologies (TDT) | MF1-S | |
| Oscilloscope | Tektronix | DPO3012 | |
| Optical PC1 express card for Optibit Interface) | Tucker-Davis Systems (TDT) | PO5e | |
| Askina Braucel pads (cellulose absorbet pads) | B.Braun | PZN 8473637 | |
| Preamplifier | PCB Pieztronics | 480C02 | |
| RZ6 Multi I/O Processor system (BioSigRZ) | Tucker-Davis Technologies (TDT) | RZ6-A-PI | |
| 0.9% saline (NaCl, sterile) | B.Braun | PZN:8609255 | |
| SigGenRZ software | Tucker-Davis Technologies (TDT) | https://www.tdt.com/ | |
| Software R (version 3.2.1) + Reshape 2 (Version 1.4.1) + ggplot 2 (version 1.0.1) + datatable (version 1.9.4), + gdata (version 2.13.3), + pastecs (version 1.3.18), + waveslim (version 1.7.5), + MassSpecWavelet (version 1.30.0) | The R Foundation, R Core Team 2015 | Open Source Software (freely distributable) | |
| Sound attenuating cubicle | Med Associates Inc. | ENV-018V | |
| Standard Pattern Forceps, 12cm and 14.5 cm length | FST | 11000-12, 11000-14 | |
| Leukosilk tape | BSN medical GmbH & Co. KG | PZN 00397109 | |
| Tissue Forceps- 1x2 Teeth 12 cm | FST | 11021-12 | |
| Uniprotect ventilated cabinet | Bioscape | THF3378 | |
| Ventilated cabinet | Tecniplast | 9AV125P | |
| Xylazine (Rompun), 2% | Bayer Vital GmbH | PZN 1320422 |
Références
- Sporns, O., Tononi, G., Kotter, R. The human connectome: A structural description of the human brain. PLOS Computational Biology. 1 (4), e42 (2005).
- Bebarova, M. Advances in patch clamp technique: towards higher quality and quantity. General Physiology and Biophysics. 31 (2), 131-140 (2012).
- Kornreich, B. G. The patch clamp technique: principles and technical considerations. Journal of Veterinary Cardiology. 9 (1), 25-37 (2007).
- Spira, M. E., Hai, A. Multi-electrode array technologies for neuroscience and cardiology. Nature Nanotechnology. 8 (2), 83-94 (2013).
- Obien, M. E., Deligkaris, K., Bullmann, T., Bakkum, D. J., Frey, U. Revealing neuronal function through microelectrode array recordings. Frontiers in Neuroscience. 8, 423 (2014).
- Heuschkel, M. O., Fejtl, M., Raggenbass, M., Bertrand, D., Renaud, P. A three-dimensional multi-electrode array for multi-site stimulation and recording in acute brain slices. Journal of Neuroscience Methods. 114 (2), 135-148 (2002).
- Kimiskidis, V. K. Transcranial magnetic stimulation (TMS) coupled with electroencephalography (EEG): Biomarker of the future. Reviews in Neurology. 172 (2), 123-126 (2016).
- Nunez, P. L. Toward a quantitative description of large-scale neocortical dynamic function and EEG. Behavioral Brain Science. 23 (3), 371-437 (2000).
- Lundt, A., et al. EEG Radiotelemetry in Small Laboratory Rodents: A Powerful State-of-the Art Approach in Neuropsychiatric, Neurodegenerative, and Epilepsy Research. Neural Plasticity. 2016, 8213878 (2016).
- Papazoglou, A., et al. Non-restraining EEG Radiotelemetry: Epidural and Deep Intracerebral Stereotaxic EEG Electrode Placement. Journal of Visualized Experiments. 112 (112), e54216 (2016).
- Weiergraber, M., Henry, M., Hescheler, J., Smyth, N., Schneider, T. Electrocorticographic and deep intracerebral EEG recording in mice using a telemetry system. Brain Research Brain Research Protocols. 14 (3), 154-164 (2005).
- Kallstrand, J., Nehlstedt, S. F., Skold, M. L., Nielzen, S. Lateral asymmetry and reduced forward masking effect in early brainstem auditory evoked responses in schizophrenia. Psychiatry Research. 196 (2-3), 188-193 (2012).
- Muller, R., et al. Automatic Detection of Highly Organized Theta Oscillations in the Murine EEG. Journal of Visualized Experiments. (121), e55089 (2017).
- Papazoglou, A., et al. Gender specific hippocampal whole genome transcriptome data from mice lacking the Cav2.3 R-type or Cav3.2 T-type voltage-gated calcium channel. Data in Brief. 12, 81-86 (2017).
- Papazoglou, A., et al. Gender-Specific Hippocampal Dysrhythmia and Aberrant Hippocampal and Cortical Excitability in the APPswePS1dE9 Model of Alzheimer's Disease. Neural Plasticity. 2016, 7167358 (2016).
- Papazoglou, A., et al. Motor Cortex Theta and Gamma Architecture in Young Adult APPswePS1dE9 Alzheimer Mice. PLOS ONE. 12 (1), e0169654 (2017).
- Siwek, M. E., et al. Altered theta oscillations and aberrant cortical excitatory activity in the 5XFAD model of Alzheimer's disease. Neural Plasticity. , 781731 (2015).
- Welch, T. M., Church, M. W., Shucard, D. W. A method for chronically recording brain-stem and cortical auditory evoked potentials from unanesthetized mice. Electroencephalography and Clinical Neurophysiology. 60 (1), 78-83 (1985).
- Church, M. W., Gritzke, R. Effects of ketamine anesthesia on the rat brain-stem auditory evoked potential as a function of dose and stimulus intensity. Electroencephalography and Clinical Neurophysiology. 67 (6), 570-583 (1987).
- van Looij, M. A., et al. Impact of conventional anesthesia on auditory brainstem responses in mice. Hearing Research. 193 (1-2), 75-82 (2004).
- Schomer, D. L., da Silva, F. L. . Niedermeyer's Electroencephalography: Basic Principles, Clinical Applications, and Related Fields. , (2011).
- De Cosmo, G., Aceto, P., Clemente, A., Congedo, E. Auditory evoked potentials. Minerva Anestesiology. 70 (5), 293-297 (2004).
- Rosburg, T. Auditory N100 gating in patients with schizophrenia: A systematic meta-analysis. Clinical Neurophysiology. 129 (10), 2099-2111 (2018).
- DiLalla, L. F., McCrary, M., Diaz, E. A review of endophenotypes in schizophrenia and autism: The next phase for understanding genetic etiologies. American Journal of Medical Genetics Part C Seminar in Medical Genetics. 175 (3), 354-361 (2017).
- Walsh, P., Kane, N., Butler, S. The clinical role of evoked potentials. Journal of Neurology, Neurosurgery and Psychiatry. 76 Suppl 2, ii16-ii22 (2005).
- Opgen-Rhein, C., Neuhaus, A., Urbanek, C., Dettling, M. New strategies in schizophrenia: impact of endophentotypes. Psychiatrische Praxis. 31 Suppl 2, S194-S199 (2004).
- Knipper, M., Van Dijk, P., Nunes, I., Ruttiger, L., Zimmermann, U. Advances in the neurobiology of hearing disorders: recent developments regarding the basis of tinnitus and hyperacusis. Progress in Neurobiology. 111, 17-33 (2013).
- Miller, C. A., Brown, C. J., Abbas, P. J., Chi, S. L. The clinical application of potentials evoked from the peripheral auditory system. Hearing Research. 242 (1-2), 184-197 (2008).
- Manouilenko, I., Humble, M. B., Georgieva, J., Bejerot, S. Brainstem Auditory Evoked Potentials for diagnosing Autism Spectrum Disorder, ADHD and Schizophrenia Spectrum Disorders in adults. A blinded study. Psychiatry Research. 257, 21-26 (2017).
- Talge, N. M., Tudor, B. M., Kileny, P. R. Click-evoked auditory brainstem responses and autism spectrum disorder: A meta-analytic review. Autism Research. 11 (6), 916-927 (2018).
- Hamed, S. A. The auditory and vestibular toxicities induced by antiepileptic drugs. Expert Opinion in Drug Safety. 16 (11), 1281-1294 (2017).
- Ismi, O., et al. The Effect of Methylphenidate on the Hearing of Children with Attention Deficit Hyperactivity Disorder. International Archive in Otorhinolaryngology. 22 (3), 220-224 (2018).
- Michna, M., et al. Cav1.3 (alpha1D) Ca2+ currents in neonatal outer hair cells of mice. Journal of Physiology. 553 (Pt 3), 747-758 (2003).
- Platzer, J., et al. Congenital deafness and sinoatrial node dysfunction in mice lacking class D L-type Ca2+ channels. Cell. 102 (1), 89-97 (2000).
- Willaredt, M. A., Ebbers, L., Nothwang, H. G. Central auditory function of deafness genes. Hearing Research. 312, 9-20 (2014).
- Yee, B. K., Singer, P. A conceptual and practical guide to the behavioural evaluation of animal models of the symptomatology and therapy of schizophrenia. Cell Tissue Research. 354 (1), 221-246 (2013).
- Fahey, J. R., Katoh, H., Malcolm, R., Perez, A. V. The case for genetic monitoring of mice and rats used in biomedical research. Mammalian Genome. 24 (3-4), 89-94 (2013).
- Hunsaker, M. R. Comprehensive neurocognitive endophenotyping strategies for mouse models of genetic disorders. Progress in Neurobiology. 96 (2), 220-241 (2012).
- Turner, J. G., Parrish, J. L., Hughes, L. F., Toth, L. A., Caspary, D. M. Hearing in laboratory animals: strain differences and nonauditory effects of noise. Computational Medicine. 55 (1), 12-23 (2005).
- Neumann, P. E., Collins, R. L. Genetic dissection of susceptibility to audiogenic seizures in inbred mice. Proceedings of the National Academy of Sciences of the United States of America. 88 (12), 5408-5412 (1991).
- Meier, S., Groeben, H., Mitzner, W., Brown, R. H. Genetic variability of induction and emergence times for inhalational anaesthetics. European Journal of Anaesthesiology. 25 (2), 113-117 (2008).
- Majewski-Tiedeken, C. R., Rabin, C. R., Siegel, S. J. Ketamine exposure in adult mice leads to increased cell death in C3H, DBA2 and FVB inbred mouse strains. Drug Alcohol Dependence. 92 (1-3), 217-227 (2008).
- Bonthuis, P. J., et al. Of mice and rats: key species variations in the sexual differentiation of brain and behavior. Frontiers in Neuroendocrinology. 31 (3), 341-358 (2010).
- Buckmaster, P. S., Haney, M. M. Factors affecting outcomes of pilocarpine treatment in a mouse model of temporal lobe epilepsy. Epilepsy Research. 102 (3), 153-159 (2012).
- Jonasson, Z. Meta-analysis of sex differences in rodent models of learning and memory: a review of behavioral and biological data. Neuroscience and Biobehavioral Reviews. 28 (8), 811-825 (2005).
- Prendergast, B. J., Onishi, K. G., Zucker, I. Female mice liberated for inclusion in neuroscience and biomedical research. Neuroscience and Biobehavioral Reviews. 40, 1-5 (2014).
- Ingham, N. J., Pearson, S., Steel, K. P. Using the Auditory Brainstem Response (ABR) to Determine Sensitivity of Hearing in Mutant Mice. Current Protocols in Mouse Biology. 1 (2), 279-287 (2011).
- . SigGenRZ Manual Available from: https://www.tdt.com/files/manuals/SigGenRZ_Manual.pdf (2012)
- Bogaerts, S., Clements, J. D., Sullivan, J. M., Oleskevich, S. Automated threshold detection for auditory brainstem responses: comparison with visual estimation in a stem cell transplantation study. BMC Neuroscience. 10, 104 (2009).
- Probst, F. J., et al. A point mutation in the gene for asparagine-linked glycosylation 10B (Alg10b) causes nonsyndromic hearing impairment in mice (Mus musculus). PLOS ONE. 8 (11), e80408 (2013).
- Alvarado, J. C., Fuentes-Santamaria, V., Gabaldon-Ull, M. C., Blanco, J. L., Juiz, J. M. Wistar rats: a forgotten model of age-related hearing loss. Frontiers in Aging Neuroscience. 6, 29 (2014).
- Du, P., Kibbe, W. A., Lin, S. M. Improved peak detection in mass spectrum by incorporating continuous wavelet transform-based pattern matching. Bioinformatics. 22 (17), 2059-2065 (2006).
- Daubechies, I. . Ten lectures on wavelets. , (1992).
- Pearson, J. D., et al. Gender differences in a longitudinal study of age-associated hearing loss. Journal of the Acoustical Society of America. 97 (2), 1196-1205 (1995).
- Murphy, M. P., Gates, G. A. Hearing Loss: Does Gender Play a Role?. Medscape Womens Health. 2 (10), 2 (1997).
- Henry, K. R. Males lose hearing earlier in mouse models of late-onset age-related hearing loss; females lose hearing earlier in mouse models of early-onset hearing loss. Hearing Research. 190 (1-2), 141-148 (2004).
- Ison, J. R., Allen, P. D., O’Neill, W. E. Age-related hearing loss in C57BL/6J mice has both frequency-specific and non-frequency-specific components that produce a hyperacusis-like exaggeration of the acoustic startle reflex. Journal of the Association for Research in Otolaryngology. 8 (4), 539-550 (2007).
- Zheng, Q. Y., Johnson, K. R., Erway, L. C. Assessment of hearing in 80 inbred strains of mice by ABR threshold analyses. Hearing Research. 130 (1-2), 94-107 (1999).
- Zhou, X., Jen, P. H., Seburn, K. L., Frankel, W. N., Zheng, Q. Y. Auditory brainstem responses in 10 inbred strains of mice. Brain Research. 1091 (1), 16-26 (2006).
- Lundt, A., et al. Cav3.2 T-Type Calcium Channels Are Physiologically Mandatory For The Auditory System. Neuroscience. , (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon