A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التعريفي وتوصيف ارتفاع ضغط الدم الرئوي في الفئران باستخدام نموذج نقص الأكسجة/SU5416
In This Article
Summary
يصف هذا البروتوكول تحريض ارتفاع ضغط الدم الرئوي (PH) في الفئران على أساس التعرض لنقص الأكسجة وحقن خصم مستقبلات VEGF. الحيوانات تطوير PH والبطين الأيمن (RV) تضخم بعد 3 أسابيع من بدء البروتوكول. كما يتم عرض توصيف النموذج الوظيفي والماورومتري.
Abstract
ارتفاع ضغط الدم الرئوي (PH) هو حالة فيزيائية مرضية، يحددها متوسط ضغط الشريان الرئوي الذي يتجاوز 25 مم زئبق في بقية، كما يتم تقييمه بواسطة قسطرة القلب الأيمن. يمكن أن تؤدي مجموعة واسعة من الأمراض إلى PH ، تختلف في مسبباتها ، علم الأنسجة ، العرض السريري ، التكهن ، والاستجابة للعلاج. على الرغم من التقدم الكبير الذي تحقق في السنوات الأخيرة، لا تزال PH مرضًا غير مشذب. يمكن أن يمهد فهم الآليات الأساسية الطريق لتطوير علاجات جديدة. النماذج الحيوانية هي أدوات بحثية مهمة لتحقيق هذا الهدف. وفي الوقت الراهن، هناك عدة نماذج متاحة لتلخيص PH. يصف هذا البروتوكول طراز PH ماوس اثنين. المحفزات لتطوير PH هي نقص الأكسجة وحقن SU5416، عامل نمو بطانة الأوعية الدموية (VEGF) مستقبلات الخصم. بعد ثلاثة أسابيع من بدء نقص الأكسجة/SU5416، والحيوانات تطوير إعادة عرض الأوعية الدموية الرئوية تقليد التغيرات الهسجية لوحظ في PH الإنسان (في الغالب المجموعة 1). يؤدي إعادة عرض الأوعية الدموية في الدورة الدموية الرئوية إلى إعادة عرض البطين الأيمن (RV). يتم وصف إجراءات قياس ضغط RV (باستخدام طريقة الصدر المفتوح) والتحليلات المورفوميترية للRV (عن طريق تشريح وزن كل من البطينين القلبي) والتقييمات النسيجية لإعادة عرض (سواء الرئية عن طريق تقييم إعادة عرض الأوعية الدموية والقلب عن طريق تقييم تضخم القلب والتليف RV). مزايا هذا البروتوكول هي إمكانية تطبيق سواء في نوع البرية وفي الفئران المعدلة وراثيا، وتنفيذ سهل نسبيا ومنخفض التكلفة، والتطور السريع لمرض الفائدة (3 أسابيع). القيود من هذه الطريقة هي أن الفئران لا تتطور النمط الظاهري الشديد وPH هو عكس عند العودة إلى normoxia. الوقاية، فضلا عن دراسات العلاج، يمكن بسهولة أن تنفذ في هذا النموذج، دون الحاجة إلى المهارات المتقدمة (بدلا من نماذج القوارض الجراحية).
Introduction
ارتفاع ضغط الدم الرئوي (PH) هو حالة فيزيائية مرضية، يتم تعريفها بواسطة ضغط متوسط الشريان الرئوي (PA) يتجاوز 25 مم زئبق في بقية، كما تم تقييمها بواسطة القسطرة القلب الأيمن1،2. هناك مجموعة متنوعة من الأمراض التي يمكن أن تؤدي إلى PH. وفي محاولة لتنظيم الظروف المرتبطة بال PH، تم وضع عدة نظم تصنيف. التصنيف السريري الحالي يصنف الأمراض المتعددة المرتبطة PH في 5 مجموعات مختلفة1. هذا التمييز له أهمية منذ مجموعات مختلفة من المرضى لديهم الأمراض التي تختلف في العرض السريري، وعلم الأمراض، والتكهن، والاستجابة للعلاج2. يلخص الجدول 1 التصنيف الحالي، المكمّل بالخصائص الهستوولوجية الأساسية لكل مرض.
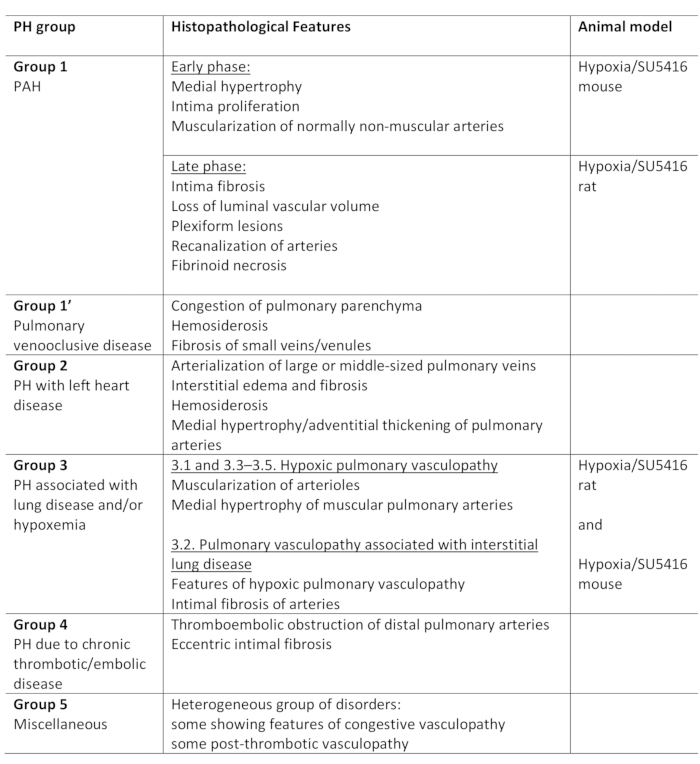
الجدول 1: نظرة عامة على التصنيف السريري لـ PH، إلى جانب السمات الهستوولوجية الرئيسية داخل المجموعات. ملاءمة بروتوكول نقص الأكسجة/SU5416 لنم تصميم PH. تم تعديل هذا الجدول من19. PH: ارتفاع ضغط الدم الرئوي، PAH: ارتفاع ضغط الدم الشرياني الرئوي
على الرغم من التقدم الكبير في علاج الأمراض المرتبطة بال PH ، لا يزال PH بدون علاج ، مع معدل وفيات لمدة 3 سنوات يتراوح بين 20 ٪ و 80 ٪3. وهذا يدل على الحاجة الملحة لفهم الآليات الأساسية للPH، وبعد ذلك، تطوير علاجات جديدة لمنع، وإبطاء التقدم، وعلاج المرض. النماذج الحيوانية ذات أهمية حاسمة لهذا النطاق. حاليا، هناك نماذج مختلفة لدراسة PH. ويحال القارئ المهتم إلى الاستعراضات الممتازة حول هذا الموضوع2,3,4. مع الأخذ في الاعتبار مجموعة متنوعة من الأمراض المؤدية إلى PH، فمن الواضح أن الظروف المتنوعة من PH الإنسان لا يمكن أن تكون ملخصة تماما في نموذج واحد. نماذج الحيوانات المتاحة يمكن تصنيفها في ط) ضرب واحد، ثانيا) ضربتين، iii) خروج المغلوب، و4) نماذج overexpression3. في نماذج ضرب واحد، يتم حث PH من قبل حافز واحد المرضية، في حين أن اثنين من ضرب نماذج الجمع بين اثنين من المحفزات المرضية مع هدف تحفيز PH أكثر شدة، وبالتالي تقليد أكثر عن كثب مرض الإنسان المعقدة. وإلى جانب الاختلافات المسببة، والنتيجة العديد من المحفزات في الاختلافات النمذجة PH التي تعتمد أيضا على الأنواع والخلفية الوراثية للحيوانات4.
واحدة من النماذج الأكثر شيوعا والقواة الكلاسيكية PH هو نموذج نقص الأكسجة المزمن2. ومن المعروف نقص الأكسجة للحث PH في البشر وكذلك في العديد من أنواع الحيوانات. نقص الأكسجة لديه ميزة كونه حافزا فيزيولوجيا لPH(الجدول 1). ومع ذلك ، في حين أن درجة نقص الأكسجة المستخدمة في تحفيز PH في القوارض هي أكثر حدة مما هي عليه في البشر ، فإن الإهانة الوحيدة (نقص الأكسجة) تؤدي فقط إلى شكل خفيف من إعادة عرض الأوعية الدموية. هذا لا يقلد شدة المرض البشري. إضافة ضرب الثانية، وحافز إضافي لتحفيز PH، وأظهرت نتائج واعدة: حقن SU5416 المركب للقوارض جنبا إلى جنب مع التحفيز نقص الأكسجة يدفع أكثر شدة PH النمط الظاهري2،5،6. SU5416 هو مثبط عامل النمو البطانية الوعائية (VEGF) مستقبلات-2. يمنع مستقبلات VEGF ويؤدي إلى موت الخلايا البطانية. تحت ظروف نقص الأكسجين ، وهذا يحفز انتشار مجموعة فرعية من الخلايا البطانية مقاومة لتخثر الدم. وعلاوة على ذلك, SU5416 يؤدي إلى انتشار الخلايا العضلية على نحو سلس. مزيج من هذه الآثار النتائج في إعادة عرض الأوعية الدموية الباثولوجي من الدورة الدموية الرئوية ويؤدي إلى ضغط السلطة الفلسطينية مرتفعة وإعادة عرض البطين الأيمن2,5,7. وقد وصفت النموذج الأول فيالفئران 6 وتطبيقها في وقت لاحق على الفئران4,5,7. نموذج الماوس معارض أقل شدة إعادة عرض الأوعية الدموية بالمقارنة مع الفئران. وعلاوة على ذلك، عندما عاد إلى normoxia، PH لا تزال تتقدم في الفئران، بينما في الفئران هو عكس جزئيا.
يصف البروتوكول التالي جميع الخطوات الخاصة بالنمذجة PH في الفئران باستخدام طريقة Hypoxia/SU5416 (التخطيط، الجدول الزمني، التنفيذ). بالإضافة إلى ذلك، يوصف توصيف النموذج في هذا البروتوكول: وظيفياً (من خلال قياس الضغط البطيني الأيمن (RV) باستخدام تقنية الصدر المفتوح)، بشكل مورفويرسيلي (عن طريق تشريح ووزنها على حد سواء البطينين الأيمن والأيسر)، وكذلك من الناحية النسيجية (عن طريق تقييم إعادة عرض الأوعية الدموية الرئوية، تضخم القلب البطين الأيمن والتليف).
يمكن للمحققين تنفيذ جميع الخطوات والأساليب الموصوفة في هذا البروتوكول بسهولة على أي مستوى من مستويات الخبرة. في حين أن القياسات الوظيفية للRV باستخدام تقنية الصدر المفتوح (الموصوفة هنا) ليست الطريقة القياسية الذهبية في هذا المجال ، فقد ميزة أنه يمكن تعلمها بسرعة وإعادة إنتاجها بدقة حتى من قبل تجربة أقل خبرة.
Protocol
قبل أي تجارب على الحيوانات الحصول على ترخيص لجنة رعاية الحيوان المؤسسية المحلية. وقد أجريت التجارب الحالية بعد موافقة اللجنة المؤسسية لرعاية واستخدام الحيوانات (IACUC) في كلية إيكان للطب في جبل سيناء.
1. PH التعريفي
- اعداد
- قبل البدء في الدراسة، التخطيط بعناية التصميم التجريبي. تأكد من أن الفئران تتعرض لنقص الأكسجة في نفس الوقت الذي يخضع فيه الحقنة SU5416 الأولى. ويرد في الشكل 1أمثال على التصميم التجريبي لحفز PH باستخدام طريقة نقص الأكسجة/SU5416. فئران التحكم تلقت فقط السيارة. لهذا النموذج, سيتم حقن SU5416 إلى الفئران مرة واحدة في الأسبوع لمدة 3 أسابيع متتالية.
- استخدم ثمانية إلى اثني عشر أسبوعًا من الفئران C57BL/6 لهذه الدراسة. منزل الحيوانات في 18-20 درجة مئوية في دورة 12-h ضوء الظلام. ضمان أن الغذاء والماء يمكن الوصول إليها الإعلانية libitum.
- وزن الحيوانات. تعيين لهم عشوائيا إلى كل مجموعة: نورموكسيا و Hypoxia/SU5416.
- إعداد غرفة نقص الأكسجة كما هو مبين في الشكل 1B. النيتروجين آمنة (N2) خزانات بالقرب من الغرفة. تعيين الأكسجين (O2)وحدة تحكم في نقطة من 10٪ O2. دع النظام يصل إلى حالة ثابتة.
- إعداد SU5416 للحقن (استخدام جرعة من 20 ملغ / كغ من وزن الجسم). SU5416 لا تذوب في حلول مائي; ولذلك، حل المبلغ المحسوب في 100 ميكرولتر DMSO8. على سبيل المثال، بالنسبة للماوس 25 غرام، فإن كمية SU5416 التي سيتم حقنها هي 0.5 ملغ مذابة في 100 ميكرولتر مذيب (DMSO). التركيز النهائي من SU5416 لهذا الماوس هو، لذلك، 5 ملغ / مل.
تنبيه: SU5416 هي مادة خطرة. اقرأ بعناية ورقة بيانات السلامة مصحوبة بالمنتج وتأكد من اتخاذ الاحتياطات الموصى بها عند التعامل مع هذه المادة. ارتداء قفازات واقية و (بالنسبة لأي حقن) استخدام حماية العين. يظهر التركيب الكيميائي لـ SU5416 في الشكل 1C.
ملاحظة: حساب فائض مناسب من الحل لتعويض حجم التي سوف تفقد أثناء الحقن (على سبيل المثال في الحقنة، والقارورة الخ). اعتمادا على حقنة المستخدمة، وحجم القتلى هو ما يقرب من 200 ميكرولتر. بالنسبة لمجموعة من 10 فئران، احسب جرعة ماوس 2. - إعداد الحقن للحقن. استخدام 1 مل الحقن مع 25 G × 5/8 "الإبر.
- SU5416 حقن تحت الجلد
- تقييد الحيوان. ضع الماوس على غطاء القفص للمساعدة في ضبط النفس. فهم الجلد وتشكيل خيمة موازية للعمود الفقري. تأكد من فهم الجزء الخلفي من الرأس بإحكام، لتجنب إصابة لدغة محتملة من قبل الماوس.
ملاحظة: وجود اثنين من المحققين يجعل الإجراء أسرع وأكثر دقة حيث يمكن للمرء أن يحمل الحيوان بينما يقوم الآخر بالحقن. - إدراج الإبرة تحت الجلد على الجناح في طية فضفاضة من الجلد. تأكد من إدخال الإبرة موازية للبشرة. تجنب اختراق جدار البطن.
- حقن محتوى الحقنة (100 ميكرولتر من SU5416 أو المركبة المذابة).
ملاحظة: من أجل تجنب التسرب بعد الولادة الكاملة، عقد الحقنة لمدة 10 s تقريبا وتدوير قليلا الإبرة تحت الجلد. - سحب الإبرة والعودة إلى قفص الحيوان. بعد حقن SU5416، ضع الأقفاص في غرفة نقص الأكسجة التهوية.
- تقييد الحيوان. ضع الماوس على غطاء القفص للمساعدة في ضبط النفس. فهم الجلد وتشكيل خيمة موازية للعمود الفقري. تأكد من فهم الجزء الخلفي من الرأس بإحكام، لتجنب إصابة لدغة محتملة من قبل الماوس.
- التعرض لنقص الأكسجة
- مراقبة التهوية مع مرور الوقت. تأكد من الحفاظ على 10٪ من إمدادات الأكسجين. الحفاظ على الحيوانات normoxia في غرفة نصف قابلة للغلق في 21٪ O2.
- تأكد من أن الغرف مجهزة بمستشعر أكسجين لقياس مستوى الأكسجين. تجنب فتح الغرف على نطاق واسع. لتنظيف وإضافة الطعام والماء فتح الغرف لمدة لا تزيد عن 20 دقيقة كل 3 أيام.
- تفقد الحيوانات يوميا. النظر في إشارات الإجهاد مثل piloerection أو فقدان كبير للوزن.
ملاحظة: الحيوانات تحت نقص الأكسجة/SU5416 ومن المتوقع أن انقاص وزنه5. وهذا مؤشر على تطور المرض. - كرر SU5416 حقن أسبوعيا لمدة 3 أسابيع متتالية (انظر الشكل 1ألف للحصول على نظرة عامة على التصميم التجريبي).
ملاحظة: يمكن أن يساعد تغيير موقع الحقن في تقليل تهيج الجلد.
2. توصيف وظيفية من قبل قياسات الضغط RV الغازية
- اعداد
ملاحظة: حدد نظام تخدير. يمكن استخدام التخدير القابل للحقن أو الاستنشاق. منذ جرعة زائدة طفيفة من التخدير عن طريق الحقن (وخاصة من الكيتامين / زيلازين أو pentobarbital) يمكن أن تؤثر بشكل كبير على وظيفة القلب، ويوصى استخدام التخدير المتطاير. من الأهمية بمكان استخدام نفس المخدر لجميع الفئران داخل الدراسة.- استخدام المبخر لضمان جرعة مخدر دقيقة لكل. الجرعة لisoflurane على النحو التالي: تحريض 3-4%, صيانة 1% مختلطة مع الأكسجين 100%.
ملاحظة: ارتداء معدات الحماية الشخصية وتجنب التنفس بخار. - إعداد وسادة التدفئة و / أو مصابيح الاحترار للحفاظ على درجة حرارة الجسم. إعداد مسبار درجة حرارة المستقيم لمراقبة درجة حرارة الجسم.
- ضمان التهوية المناسبة. إعداد جهاز التنفس الصناعي مسبقا. قم بإعداد موصل Y-tube وتحقق من وظيفة جهاز التنفس الصناعي باستخدام الوضع اليدوي. تأكد من أن الضغط الواح هو < 1 سم H2O لتجنب barotrauma. تعيين معدل التنفس في 110 أنفاس / دقيقة.
- حضّر أنبوبًا اُطرائيًا عن طريق قطع قسطرة داخل الأوعية الدموية 20 غ.
- إعداد الأدوات اللازمة: ملقط صغيرة، مقص، مرنة هوك الداخر، وكوتر السفينة، ومسحات القطن. على مسحة القطن ضبط صغيرة 25 G × 5 /8 "إبرة التي سيتم استخدامها لجعل ثقب صغير في البطين الأيمن.
- إعداد قسطرة الضغط، وحدة التحكم بحجم الضغط وبدء برنامج الحصول على البيانات. ضع قسطرة PV في أنبوب 15 مل مملوءة PBS في 37 درجة مئوية لمدة 15 دقيقة ومعايرة وفقا لبروتوكول الشركة المصنعة.
- من أجل التسريب و التثبيت للأعضاء، إعداد برنامج تلفزيوني ومحلول من 50٪ برنامج تلفزيوني / 50٪ أكتوبر. إعداد 2 × 10 mL الحقن (مع إبرة 25 G): واحد سوف تستخدم لضخ القلب والرئة مع برنامج تلفزيوني في الموقع والثانية لحقن OCT / برنامج تلفزيوني (50/50) حل لرئة العينة التي سيتم استخدامها لفحص الهيستولوجي.
- استخدام المبخر لضمان جرعة مخدر دقيقة لكل. الجرعة لisoflurane على النحو التالي: تحريض 3-4%, صيانة 1% مختلطة مع الأكسجين 100%.
- تنبيب
- وزن الماوس وتسجيل الحالة الصحية قبل التخدير.
- حث التخدير مع 3-4٪ isoflurane. تحقق من عمق التخدير عن طريق اختبار منعكس إصبع القدم قرصة: قرصة إصبع القدم من أحد الأطراف بحزم. إذا سحب الحيوان الطرف ، فهذا علامة على عدم كفاية التخدير.
- بعد تحريض التخدير، حلق الرقبة ومناطق الصدر.
- ضع الماوس على وسادة التدفئة. وضع مسبار درجة حرارة المستقيم لمراقبة درجة حرارة الجسم.
ملاحظة: الحفاظ على درجة حرارة الجسم له أهمية بالنسبة للقياسات الوظيفية. يجب أن تكون درجة حرارة الجسم حوالي 36.5-37 درجة مئوية. - باستخدام ملقط منحني إرفاق خيط خياطة إلى القاطعات العليا من الماوس، وتمتد وإصلاح لمنصة التدفئة مع الشريط الجراحي. تأمين أطراف الماوس باستخدام الأشرطة الجراحية.
- ل intubating الحيوان جعل شق صغير من حوالي 1 سم في الجلد عنق الرحم الوسط باستخدام مقص صغير.
ملاحظة: النوبات الفموية هي طريقة بديلة تتطلب المزيد من الخبرة. - مع قضيب القطن يميل فصل بصراحة الغدد اللعابية parotid و submandibular في المستوى المتوسط. هذا سوف يعرض العضلات الإفراط في القصبة الهوائية.
- قطع بعناية هذه العضلات تعريض القصبة الهوائية.
- مع مقص صغير جعل شق صغير بين الغضاريف القصبة الهوائية وإدراج أنبوب البطاية المعدة. أخرج الدليل المعدني للقسطرة داخل الأوعية الدموية.
- قم بتوصيل القسطرة بجهاز التنفس الصناعي. تحقق من موضع أنبوب القصبة الهوائية عن طريق نفخ الرئتين يدوياً بلطف. تأمين الموقف مع الشريط.
- الحفاظ على 1٪ ايزوفلوران التخدير طوال العملية.
- مراقبة بانتظام عمق التخدير عن طريق اختبار منعكس قرصة إصبع القدم. ضبط التخدير وفقا لذلك.
ملاحظة: معدل ضربات القلب الموصى به أثناء التجارب، تحت 1٪ من التخدير isoflurane، هو ما يقرب من 400 نبضة / دقيقة. الحفاظ على درجة حرارة الجسم والتخدير ضرورية للسيطرة على معدل ضربات القلب. يمكن أن يزيد من isoflurane خفض معدل ضربات القلب. ومع ذلك، يمكن تحقيق الانتعاش عن طريق خفض معدل isoflurane.
- قياسات الضغط RV (نهج الصدر المفتوح)
- مع مقص صغير أداء شق الجلد من حوالي 1 سم على عملية xiphoid والجزء العلوي من البطن. فصل الجلد الذي يغطي الصدر وجدار البطن من أرباع البطن العلوي: تبدأ في خط الوسط، وهد إلى xiphoid والتحرك بعناية جانبيا على كلا الجانبين. استخدام ثيرموكويتيري للسيطرة على النزيف.
ملاحظة: الهدف هو الحصول على تجويف الصدر من خلال جدار البطن. - افتح تجويف البطن وقم بقطع الحجاب الحاجز بعناية، مع الحرص على عدم إصابة القلب النابض أو الرئتين.
ملاحظة: الهدف هو فضح قمة والبطين الأيمن للقلب. التعرض الجيد وعرض القلب هي ذات أهمية حاسمة لوضع الصحيح من القسطرة. من المهم جدا تجنب النزيف طوال العملية. حتى التغييرات الصغيرة في حجم intravasal يمكن أن تغير الحمل من القلب الأيمن وتؤثر على المعلمات المسجلة. - إزالة بلطف الم pericardium باستخدام قضيب القطن يميل.
- قبل وضع قسطرة الضغط في القلب، أحضر القسطرة بجوار الماوس.
- باستخدام قضيب القطن المُعدّ مع الإبرة يصنع جرح طعنة في الجزء الصدّي من البطين الأيمن. قم بإزالة الإبرة بعناية وأدخل قسطرة الضغط في هذه الحفرة.
ملاحظة: يجب أن يعمل هذا بدون تطبيق القوة. في حال لم يكن ذلك ممكنا، حاول صنع ثقب جديد بالقرب من أول واحد من أجل تجنب إصابة طويلة من القلب. لا ينبغي إدخال الإبرة بعمق أكبر من حوالي 3 ملم. - أدخل قسطرة الضغط بالتوازي مع اتجاه البطين الأيمن، مع الطرف الذي يواجه الشريان الرئوي.
- شاهد تتبع موجة الضغط لضمان تحديد موضع القسطرة الصحيح. وقد ثبت تتبع الممثلين في الشكل 2.
- السماح لإشارة الضغط لتحقيق الاستقرار. وقفة التنفس والحصول على ما لا يقل عن 3 القياسات. في ما بين القياسات فرديّة يسمح الحيوان أن يكون تهوية.
- مرة واحدة يتم تسجيل جميع القياسات إزالة القسطرة ووضعها مرة أخرى في أنبوب تعبئة برنامج تلفزيوني في حمام الماء.
ملاحظة: بعد الانتهاء من التجربة، قم بتنظيف القسطرة وفقًا لتعليمات الشركة المصنعة.
- مع مقص صغير أداء شق الجلد من حوالي 1 سم على عملية xiphoid والجزء العلوي من البطن. فصل الجلد الذي يغطي الصدر وجدار البطن من أرباع البطن العلوي: تبدأ في خط الوسط، وهد إلى xiphoid والتحرك بعناية جانبيا على كلا الجانبين. استخدام ثيرموكويتيري للسيطرة على النزيف.
- القتل الرحيم وضخ الرئة
- عند الانتهاء من التجربة القتل الرحيم الماوس عن طريق exsanguination.
- افتح الصدر على نطاق واسع. باستخدام مقص، وقطع القص بأكمله وإيلاء الاهتمام بعدم إصابة القلب أو الرئتين.
- يجعل استخدام مقص القزحية شقًا صغيرًا في البطين الأيسر للسماح للدم بمغادرة الغرفة.
- ضع إبرة 25 G من حقنة تحتوي على 10 مل من PBS في البطين الأيمن وحقن محلول PBS حتى يتم تطهير الرئتين من الدم.
- بمجرد الانتهاء من هذه الخطوة، تأكد من القتل الرحيم عن طريق حصاد الأنسجة الحيوية (القلب والرئتين): قطع المرفقات الكافا والاههرية وإزالة القلب والرئتين في كتلة.
3- التوصيف المورفومي
- بعد إزالة القلب والرئتين مباشرة (الخطوة 2.4.5)، قم بعزل القلب وإزالة الأذينين. مع مقص تينوتومي منحني تشريح بعناية البطين الأيمن (RV) من البطين الأيسر (LV)، وترك الحاجز (S) مع البطين الأيسر. وزن RV وLV + S وحساب مؤشر فولتون = RV / LV + S(الشكل 3)5،9.
- خذ جزءًا من البطين الأيمن وضعه في قالب تضمين أكتوبر المعبأ مسبقًا. استخدم الجزء الآخر من البطين الأيمن لتحليل الحمض النووي الريبي و/أو البروتين. تجميد المفاجئة في الجليد الجاف وتخزينها في -80 درجة مئوية.
- استخدم مقص القزحية لعزل الرئتين عن القلب وأي أنسجة متبقية أخرى.
ملاحظة: لإعداد الرئتين، الضخ كما هو موضح أعلاه (الخطوات 2.4.3-2.4.5) له أهمية كبيرة. - المفاجئة تجميد جزء من الرئتين وتخزينها لRNA، استخراج البروتين أو غيرها من المقايسات.
- استخدم الجزء الآخر من الرئتين للتحليل النسيجي. لهذا الغرض، أدخل حقنة تحتوي على 50٪ برنامج تلفزيوني و 50٪ أكتوبر في قصبات من الفص المستخدم10،11. يمكن للمجرب أن يرى بسهولة أن الرئة يتم تضخيمها عندما يتم حقنة في الأنسجة.
- وضع هذه القطع من الرئة في القوالب المضمنة المعبأة مسبقا مع أكتوبر و المفاجئة تجميدها في الجليد الجاف. تخزين العينات في -80 درجة مئوية بعد تجميدها.
- إعداد 8 ميكرومتر أقسام من RV والرئة باستخدام جهاز التبريد. الهواء الجافة أقسام في درجة حرارة الغرفة لمدة 30 دقيقة.
- إصلاح الشرائح في درجة حرارة الغرفة باستخدام 10٪ شبهformaldehyde (PFA) لمدة 10 دقيقة.
ملاحظة: PFA هو مادة مسرطنة الإنسان المعروفة. تقليل مخاطر التعرض باستخدام غطاء أبخرة كيميائية، والإجراءات المناسبة ومعدات الحماية الشخصية. راجع ورقة بيانات سلامة المواد (MSDS) للحصول على مزيد من المعلومات. - تقييم إعادة عرض الأوعية الدموية من قبل هاماتوسلين / إيوسين تلطيخ
ملاحظة: أداء هيماوكسيلين / إيوسين تلطيخ من أجل تقييم التغيرات الهيكلية من القلب والأوعية الدموية إعادة عرض في الرئة (الشكل 3).- وصمة عار مع حل هيماوكسيلين لمدة 8 دقائق.
- شطف مع مياه الصنبور الجارية لمدة 5 دقائق تليها شطف سريع في الماء المقطر.
- شطف في EtOH 95٪ لمدة 1 دقيقة ووصمة مضادة في محلول إيوسين لمدة 1 دقيقة.
- الجفاف (80٪ الإيثانول 10-30 ق، 100 الإيثانول لمدة 1 دقيقة و 100٪ تولول لمدة 3 دقائق).
- جبل وتغطية مع غطاء. جفف الشرائح طوال الليل في درجة حرارة الغرفة.
ملاحظة: قد تكون الحلول المستخدمة في تلطيخ خطرة. تقليل مخاطر التعرض باستخدام غطاء أبخرة كيميائية، والإجراءات المناسبة ومعدات الحماية الشخصية. راجع MSDS للحصول على مزيد من المعلومات.
- تقييم التليف البطين الأيمن من قبل Picrosirius الأحمر تلطيخ
ملاحظة: في تلطيخ Picrosirius الأحمر، بيكروسريوس الأحمر، وهو حمض، يربط الكولاجين12. لذلك، يمكن استخدام هذا التلطخ لفحص النسيجية محتوى الكولاجين.- احتضان الشرائح في محلول بوين المُسخّن مسبقاً عند 58 درجة مئوية مقابل ساعة.
- اغسل الشرائح في مياه الصنبور الجارية لإزالة اللون الأصفر من الأقسام لمدة 10-15 دقيقة.
- وصمة عار في 0.1٪ الأخضر السريع لمدة 20 دقيقة في درجة حرارة الغرفة.
- شطف في 1٪ حمض الخليك لمدة 1 دقيقة.
- شطف في ماء الصنبور لمدة 5 دقائق.
- وصمة عار في 0.1٪ سيريوس الأحمر لمدة 30 دقيقة في درجة حرارة الغرفة تليها الجفاف في تولول.
تنبيه: قد تكون الحلول المستخدمة في التلطيخ خطرة. تقليل مخاطر التعرض باستخدام غطاء أبخرة كيميائية، والإجراءات المناسبة ومعدات الحماية الشخصية. راجع MSDS للحصول على مزيد من المعلومات.
- تقييم تضخم القلب من قبل WGA تلطيخ
ملاحظة: يمكن تقييم تضخم البطين الأيمن (RV) على المستوى الخلوي عن طريق إجراء Agglutinin Germ القمح (WGA) تلطيخ (الشكل 4).- إصلاح الشرائح في حل الأسيتون الباردة لمدة 15 دقيقة تليها 3 خطوات من الغسيل في برنامج تلفزيوني (5 دقائق لكل منهما).
- كتلة مع مصل الماعز 10٪ في محلول داكو لمدة 30 دقيقة في درجة حرارة الغرفة.
- احتضان الشرائح مع WGA: إضافة WGA 1:200 واحتضان لمدة 1 1/2 ساعة في 37 درجة مئوية في الظلام.
- غسل الشرائح ثلاث مرات مع برنامج تلفزيوني.
- احتضان الشرائح مع صبغة حمض نووي.
- غسل الشرائح ثلاث مرات مع برنامج تلفزيوني.
- لتركيب، وإزالة فائض من السائل وتطبيق تصاعد وسائل الإعلام و coverlip. جفف الشرائح لمدة ساعة في درجة حرارة الغرفة في الظلام واخزن عند 4 درجات مئوية.
ملاحظة: قد تكون الحلول المستخدمة في تلطيخ خطرة. تقليل مخاطر التعرض باستخدام غطاء أبخرة كيميائية، والإجراءات المناسبة ومعدات الحماية الشخصية. راجع MSDS للحصول على مزيد من المعلومات.
- إجراء الكيمياء المناعية للرئة إلى مزيد من تقييم الأوعية الدموية على وجه التحديد. على سبيل المثال، يمكن استخدام تلطيخ خلايا العضلات السلس لتقييم العضلات من الأوعية، في حين فون ويلبراند عامل التلطخ يمكن استخدامها لتصور التغيرات البطانية. هذه الطرق موصوفة في مكان آخر5.
النتائج
في هذا البروتوكول، ونحن وصف بالتفصيل إنشاء نموذج Hypoxia/SU5416 لتحفيز PH في الفئران. وعلاوة على ذلك، نحن تفاصيل جميع الخطوات اللازمة لإجراء تقييم الأوعية الدموية الرئوية والقلب في نهاية فترة المراقبة.
لمحة عامة عن التصميم التجريبي لهذا النموذج مبين في الشكل 1...
Discussion
يصف هذا البروتوكول كيفية نموذج PH في الفئران عن طريق الجمع بين اثنين من المحفزات المرضية: نقص الأكسجة المزمن وحقن SU5416 (نقص الأكسجة / SU5416)18. في محاولة لربط هذا النموذج الماوس مع حالة PH الإنسان، لا بد للمرء أن ننظر حتما في تصنيف PH الحالي، هو مبين في الجدول 1. وتتميز PH في جمي?...
Disclosures
ليس لدى أصحاب البلاغ ما يعلنونه.
Acknowledgements
وقد تم دعم هذا العمل من خلال منح من جمعية القلب الأمريكية (AHA-17SDG33370112 و 18IPA34170258) والمعاهد الوطنية للصحة المعاهد الوطنية للصحة K01 HL135474 إلى Y.S. O.B تم دعمها من قبل دويتشه هيرزستيفتونغ.
Materials
| Name | Company | Catalog Number | Comments |
| Acetic acid glacial | Roth | 3738.1 | |
| Acetone, Histology Grade | The Lab Depot | VT110D | |
| ADVantage Pressure-Volume System | Transonic | ADV500 | |
| Bouin's solution | Sigma | Ht10132 | |
| Cautery System | Fine Science Tools | 18000-00 | |
| Connection tubing and valves | |||
| Cotton-Tipped Applicators | Covidien | 8884541300 | |
| Coverslips, 24 x50 mm | Roth | 1871 | |
| Data Acquisition and Analysis | Emka | iox2 | |
| Direct Red 80 | Sigma | 365548-5G | |
| DMSO (Dimethyl Sulfoxide) | Sigma Aldrich | 276855 | |
| Dry ice | |||
| Dumont # 5 forceps | Fine Science Tools | 11251-10 | |
| Dumont # 7 Fine Forceps | Fine Science Tools | 11274-20 | |
| Embedding molds | Sigma Aldrich | E-6032 | |
| Eosin Solution Aqueous | Sigma | HT110216 | |
| Ethanol, laboratory Grade | Carolina Biological Supply Company | 861285 | |
| Fast Green FCF | Sigma | F7252-5G | |
| Fine scissors | Fine Science Tools | 14090-09 | |
| Goat Serum | invitrogen | 16210-064 | |
| Heating pad | Gaymar | T/Pump | |
| Hematoxylin 2 | Thermo Scientific | 7231 | |
| Hypoxic chamber | Biospherix | A30274P | |
| Induction chamber | DRE Veterinary | 12570 | |
| Intubation catheter (i.v. catheter SurFlash (20 G x 1") ) | Terumo | SR*FF2025 | |
| Iris scissors | Fine Science Tools | 14084-08 | |
| Isoflurane | Baxter | NDC-10019-360-40 | |
| Isoflurane vaporizer | DRE Veterinary | 12432 | |
| Mice (C57BL/6) | Charles River | ||
| Needles 25 G x 5/8" | BD | 305122 | |
| OCT | Tissue Tek | 4583 | |
| PBS (Phosphate Buffered Saline) | Corning | 21-031-CV | |
| Piric Acid- Saturated Solution 1.3 % | Sigma | P6744-1GA | |
| Pressure volume catheter | Transonic | FTH-1212B-4018 | |
| Retractor | Kent Scientific | SURGI-5001 | |
| Static oxygen Controller ProOx 360 | Biospherix | P360 | |
| SU 5416 | Sigma Aldrich | S8442 | |
| Surgical Suture, black braided silk, 5.0 | Surgical Specialties Corp. | SP116 | |
| Surgical tape | 3M | 1527-1 | |
| Syringe 10 ml | BD | 303134 | |
| Syringes with needle 1 ml | BD | 309626 | |
| Sytox Green Nuclein Acid Stain | Thermo Scientific | S7020 | |
| Tenotomy scissors | Pricon | 60-521 | |
| Toluol | Roth | 9558.3 | |
| Ventilator | CWE | SAR-830/P | |
| WGA Alexa Fluor | Thermo Scientific | W11261 | |
| Xylene | Roth |
References
- Galie, N., et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). European Heart Journal. 37 (1), 67-119 (2016).
- Stenmark, K. R., Meyrick, B., Galie, N., Mooi, W. J., McMurtry, I. F. Animal models of pulmonary arterial hypertension: the hope for etiological discovery and pharmacological cure. American Journal of Physiology-Lung Cell Molecular Physiology. 297 (6), 1013-1032 (2009).
- Maarman, G., Lecour, S., Butrous, G., Thienemann, F., Sliwa, K. A comprehensive review: the evolution of animal models in pulmonary hypertension research; are we there yet. Pulmonary Circulation. 3 (4), 739-756 (2013).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: problems and prospects. American Journal of Physiology-Lung Cell Molecular Physiology. 302 (10), 977-991 (2012).
- Ciuclan, L., et al. A novel murine model of severe pulmonary arterial hypertension. American Journal of Respiratory and Critical Care Medicine. 184 (10), 1171-1182 (2011).
- Taraseviciene-Stewart, L., et al. Inhibition of the VEGF receptor 2 combined with chronic hypoxia causes cell death-dependent pulmonary endothelial cell proliferation and severe pulmonary hypertension. FASEB Journal. 15 (2), 427-438 (2001).
- Vitali, S. H., et al. The Sugen 5416/hypoxia mouse model of pulmonary hypertension revisited: long-term follow-up. Pulmonary Circulation. 4 (4), 619-629 (2014).
- Breen, E. C., Scadeng, M., Lai, N. C., Murray, F., Bigby, T. D. Functional magnetic resonance imaging for in vivo quantification of pulmonary hypertension in the Sugen 5416/hypoxia mouse. Experimental Physiology. 102 (3), 347-353 (2017).
- Wang, Z., Schreier, D. A., Hacker, T. A., Chesler, N. C. Progressive right ventricular functional and structural changes in a mouse model of pulmonary arterial hypertension. Physiological Reports. 1 (7), 00184 (2013).
- Momcilovic, M., et al. Utilizing 18F-FDG PET/CT Imaging and Quantitative Histology to Measure Dynamic Changes in the Glucose Metabolism in Mouse Models of Lung Cancer. Journal of Visualized Experiment. (137), 57167 (2018).
- Guma, S. R., et al. Natural killer cell therapy and aerosol interleukin-2 for the treatment of osteosarcoma lung metastasis. Pediatric Blood Cancer. 61 (4), 618-626 (2014).
- Lattouf, R., et al. Picrosirius red staining: a useful tool to appraise collagen networks in normal and pathological tissues. Journal of Histochemistry and Cytochemistry. 62 (10), 751-758 (2014).
- Penumatsa, K. C., et al. Transglutaminase 2 in pulmonary and cardiac tissue remodeling in experimental pulmonary hypertension. American Journal of Physiology-Lung Cell Molecular Physiology. 313 (5), 752-762 (2017).
- Wang, Z., et al. Organ-level right ventricular dysfunction with preserved Frank-Starling mechanism in a mouse model of pulmonary arterial hypertension. Journal of Applied Physiology. 124 (5), 1244-1253 (2018).
- van de Veerdonk, M. C., Bogaard, H. J., Voelkel, N. F. The right ventricle and pulmonary hypertension. Heart Failure Reviews. 21 (3), 259-271 (2016).
- Emde, B., Heinen, A., Godecke, A., Bottermann, K. Wheat germ agglutinin staining as a suitable method for detection and quantification of fibrosis in cardiac tissue after myocardial infarction. European Journal of Histochemistry. 58 (4), 2448 (2014).
- Pena, S. D., Gordon, B. B., Karpati, G., Carpenter, S. Lectin histochemistry of human skeletal muscle. Journal of Histochemistry and Cytochemistry. 29 (4), 542-546 (1981).
- Bueno-Beti, C., Hadri, L., Hajjar, R. J., Sassi, Y. The Sugen 5416/Hypoxia Mouse Model of Pulmonary Arterial Hypertension. Methods in Molecular Biology. 1816, 243-252 (2018).
- Colvin, K. L., Yeager, M. E. Animal Models of Pulmonary Hypertension: Matching Disease Mechanisms to Etiology of the Human Disease. Journal of Pulmonary and Respiratory Medicine. 4 (4), (2014).
- Benza, R. L., et al. Predicting survival in pulmonary arterial hypertension: insights from the Registry to Evaluate Early and Long-Term Pulmonary Arterial Hypertension Disease Management (REVEAL). Circulation. 122 (2), 164-172 (2010).
- Jacob, S. W., Rosenbaum, E. E. The toxicology of dimethyl sulfoxide (DMSO). Headache. 6 (3), 127-136 (1966).
- Jacob, S. W., Wood, D. C. Dimethyl sulfoxide (DMSO). Toxicology, pharmacology, and clinical experience. American Journal of Surgery. 114 (3), 414-426 (1967).
- Abraham, D., Mao, L. Cardiac Pressure-Volume Loop Analysis Using Conductance Catheters in Mice. Journal of Visualized Experiment. (103), 52942 (2015).
- Ma, Z., Mao, L., Rajagopal, S. Hemodynamic Characterization of Rodent Models of Pulmonary Arterial Hypertension. Journal of Visualized Experiment. (110), 53335 (2016).
- Townsend, D. Measuring Pressure Volume Loops in the Mouse. Journal of Visualized Experiment. (111), 53810 (2016).
- Penumatsa, K. C., Warburton, R. R., Hill, N. S., Fanburg, B. L. CrossTalk proposal: The mouse SuHx model is a good model of pulmonary arterial hypertension. Journal of Physiology. 597 (4), 975-977 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved