Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Inducción y caracterización de la hipertensión pulmonar en ratones utilizando el modelo Hypoxia/SU5416
En este artículo
Resumen
Este protocolo describe la inducción de hipertensión pulmonar (PH) en ratones en función de la exposición a la hipoxia y la inyección de un antagonista del receptor VEGF. Los animales desarrollan PH e hipertrofia ventricular derecha (RV) 3 semanas después del inicio del protocolo. También se presenta la caracterización funcional y morfométrica del modelo.
Resumen
La hipertensión pulmonar (PH) es una afección fisiopatológica, definida por una presión arterial pulmonar media superior a 25 mm Hg en reposo, según lo evaluado por el cateterismo cardíaco derecho. Un amplio espectro de enfermedades puede conducir a PH, diferenciándose en su etiología, histopatología, presentación clínica, pronóstico y respuesta al tratamiento. A pesar de los avances significativos en los últimos años, la PH sigue siendo una enfermedad no curada. Comprender los mecanismos subyacentes puede allanar el camino para el desarrollo de nuevas terapias. Los modelos animales son importantes herramientas de investigación para lograr este objetivo. Actualmente, hay varios modelos disponibles para recapitular PH. Este protocolo describe un modelo PH de ratón de dos golpes. Los estímulos para el desarrollo de PH son la hipoxia y la inyección de SU5416, un antagonista del receptor del factor de crecimiento endotelial vascular (VEGF). Tres semanas después del inicio de la hipoxia/SU5416, los animales desarrollan remodelación vascular pulmonar imitando los cambios histopatológicos observados en el PH humano (predominantemente el Grupo 1). La remodelación vascular en la circulación pulmonar da como resultado la remodelación del ventrículo derecho (RV). Se describen en detalle los procedimientos para medir las presiones RV (utilizando el método torácico abierto), los análisis morfométricos de la RV (mediante la disección y el pesaje de ambos ventrículos cardíacos) y las evaluaciones histológicas de la remodelación (tanto pulmonar mediante la evaluación de la remodelación vascular como el cardíaco mediante la evaluación de la hipertrofia y la fibrosis de cardiomiocito RV). Las ventajas de este protocolo son la posibilidad de la aplicación tanto en ratones de tipo salvaje como en ratones genéticamente modificados, la implementación relativamente fácil y de bajo costo, y el rápido desarrollo de la enfermedad de interés (3 semanas). Las limitaciones de este método son que los ratones no desarrollan un fenotipo grave y el PH es reversible al regresar a la normoxia. La prevención, así como los estudios de terapia, se pueden implementar fácilmente en este modelo, sin la necesidad de habilidades avanzadas (a diferencia de los modelos de roedores quirúrgicos).
Introducción
La hipertensión pulmonar (PH) es una afección fisiopatológica, definida por una presión arterial pulmonar media (PA) superior a 25 mm Hg en reposo, según lo evaluado por el cateterismo cardíaco derecho1,2. Hay una variedad de enfermedades que pueden conducir a PH. En un intento de organizar las condiciones asociadas al PH, se han desarrollado varios sistemas de clasificación. La clasificación clínica actual clasifica las múltiples enfermedades asociadas al PH en 5 grupos diferentes1. Esta distinción es de importancia ya que varios grupos de pacientes tienen enfermedades que difieren en su presentación clínica, patología, pronóstico y respuesta al tratamiento2. La Tabla 1 resume la clasificación actual, complementada con las características histopatológicas básicas de cada enfermedad.
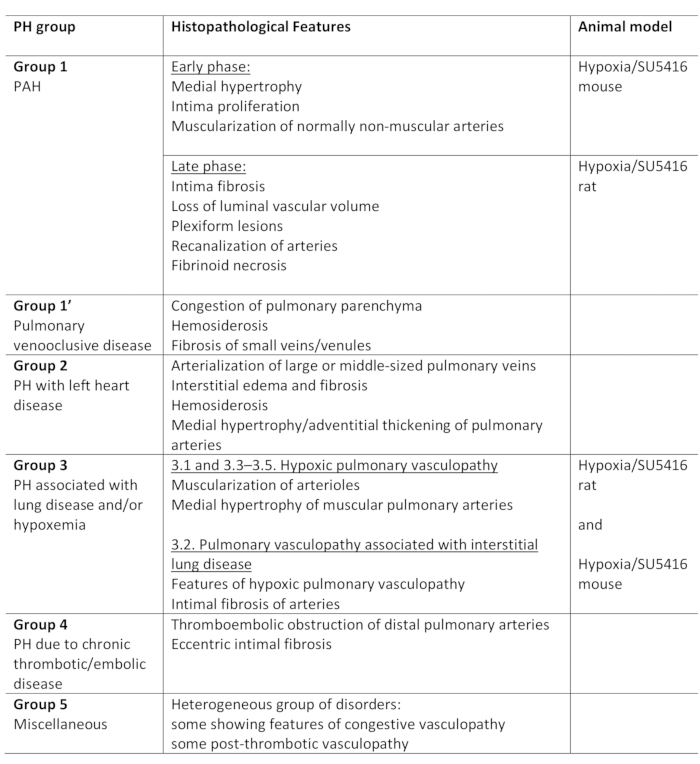
Tabla 1: Resumen de la clasificación clínica de PH, junto con las principales características histopatológicas dentro de los grupos. Adecuación del protocolo Hypoxia/SU5416 para el modelado PH. Esta tabla se ha modificado a partir de19. PH: Hipertensión pulmonar, HAP: Hipertensión arterial pulmonar
A pesar de los avances significativos en el tratamiento de las enfermedades asociadas al PH, el PH sigue sin cura, con una tasa de mortalidad de 3 años que oscila entre el 20% y el 80%3. Esto indica la necesidad imperiosa de comprender los mecanismos subyacentes de PH y, a partir de entonces, el desarrollo de nuevas terapias para prevenir, ralentizar la progresión y curar la enfermedad. Los modelos animales son de crucial importancia para este ámbito. Actualmente, existen varios modelos para estudiar PH. El lector interesado se refiere a las excelentes críticas sobre este tema2,3,4. Teniendo en cuenta la variedad de enfermedades que conducen a PH, es obvio que las diversas condiciones del PH humano no se pueden recapitular perfectamente en un modelo animal. Los modelos animales disponibles se pueden clasificar en i) single-hit, ii) two-hit, iii) knockout, y iv) overexpression modelos3. En los modelos de un solo golpe, ph es inducido por un solo estímulo patológico, mientras que los modelos de dos golpes combinan dos estímulos patológicos con el objetivo de inducir a PH más grave y por lo tanto imitar más estrechamente la compleja enfermedad humana. Además de las diferencias etiológicas, los diversos estímulos dan lugar a diferencias de modelado de PH que dependen también de la especie y el fondo genético de los animales4.
Uno de los modelos clásicos de roedores PH más utilizados es la hipoxia crónica modelo2. La hipoxia es conocida por inducir PH en humanos, así como en varias especies animales. La hipoxia tiene la ventaja de ser un estímulo fisiológico para PH (Tabla 1). Sin embargo, mientras que el grado de hipoxia utilizado para inducir PH en roedores es mucho más grave que en los seres humanos, el único insulto (hipoxia) conduce sólo a una forma leve de remodelación vascular. Esto no imita la gravedad de la enfermedad humana. La adición de un segundo golpe, un estímulo adicional para inducir PH, mostró resultados prometedores: la inyección del compuesto SU5416 a los roedores combinados con el estímulo hipoxico induce un fenotipo PH más grave2,5,6. SU5416 es un inhibidor del receptor-2 del factor de crecimiento endotelial vascular (VEGF). Bloquea los receptores VEGF y conduce a la apoptosis celular endotelial. En condiciones hipoxicas, esto estimula la proliferación de un subconjunto de células endoteliales resistentes a la apoptosis. Además, SU5416 conduce a la proliferación de células musculares lisas. La combinación de estos efectos da como resultado una remodelación vascular patológica de la circulación pulmonar y conduce a una presión patológica elevada y una remodelación ventricular derecha2,,5,,7. El modelo fue descrito por primera vez en ratas6 y más tarde aplicado a ratones4,,5,,7. El modelo de ratón presenta una remodelación vascular menos grave en comparación con las ratas. Además, cuando se vuelve a la normoxia, PH continúa progresando en ratas, mientras que en ratones es parcialmente reversible.
El protocolo siguiente describe todos los pasos para modelar PH en ratones mediante el método Hypoxia/SU5416 (planificación, cronología, ejecución). Además, la caracterización del modelo se describe en este protocolo: funcionalmente (midiendo invasivamente la presión ventricular derecha (RV) utilizando la técnica del pecho abierto), morfométricamente (diseccionando y pesando tanto los ventrículos derecho e izquierdo), como histológicamente (mediante la evaluación de la remodelación vascular pulmonar, la hipertrofia cardiomiomiocítica ventricular derecha y la fibrosis).
Todos los pasos y métodos descritos en este protocolo pueden ser fácilmente implementados por los investigadores en cualquier nivel de experiencia. Si bien las mediciones funcionales de la RV utilizando la técnica de pecho abierto (descrita aquí) no es el método estándar de oro en el campo, tiene la ventaja de que se puede aprender rápidamente y reproducir con precisión incluso por un experimentador menos experimentado.
Protocolo
Antes de cualquier experimentación animal obtener la autorización del comité institucional de cuidado de animales local. Los experimentos actuales se llevaron a cabo después de la aprobación por el Comité Institucional de Cuidado y Uso animal (IACUC) en la Escuela de Medicina de Icahn en el Monte Sinaí.
1. Inducción de PH
- Preparación
- Antes de comenzar el estudio, planifique cuidadosamente el diseño experimental. Asegúrese de que los ratones estén sometidos a hipoxia al mismo tiempo que la primera inyección SU5416. En la Figura 1Ase muestra un ejemplo del diseño experimental para inducir PH utilizando el método Hypoxia/SU5416. Los ratones de control sólo recibieron el vehículo. Para este modelo, SU5416 se inyectará a los ratones una vez por semana durante 3 semanas consecutivas.
- Utilice ratones C57BL/6 de ocho a doce semanas de edad para este estudio. Alberga a los animales a 18-20oC en un ciclo de luz-oscuridad de 12 horas. Asegúrese de que los alimentos y el agua sean accesibles ad libitum.
- Pesar a los animales. Asignarlos aleatoriamente a cada grupo: Normoxia e Hipoxia/SU5416.
- Prepare la cámara hipoxica como se muestra en la Figura 1B. Asegure los tanques de nitrógeno (N2)cerca de la cámara. Ajuste el controlador de oxígeno (O2)en un punto de 10% O2. Deje que el sistema alcance un estado estable.
- Preparar SU5416 para inyección (utilizar una dosis de 20 mg/kg de peso corporal). SU5416 no se disuelve en soluciones acuosas; por lo tanto, disolver la cantidad calculada en 100 l DMSO8. Por ejemplo, para un ratón de 25 g, la cantidad de SU5416 que se va a inyectar es de 0,5 mg disuelto en un disolvente de 100 g (DMSO). La concentración final de SU5416 para este ratón es, por lo tanto, 5 mg/ml.
ADVERTENCIA: SU5416 es un material peligroso. Lea atentamente la Ficha de datos de seguridad acompañada del producto y asegúrese de tomar las precauciones recomendadas al manipular esta sustancia. Use guantes protectores y (como para cualquier inyección) use protección para los ojos. La estructura química de SU5416 se muestra en la Figura 1C.
NOTA: Calcule un exceso adecuado de la solución para compensar el volumen que se perderá durante la inyección (por ejemplo, en la jeringa, el vial, etc.). Dependiendo de la jeringa utilizada, el volumen muerto es de aproximadamente 200 l. Para un grupo de 10 ratones, calcule un exceso de 2 dosis de ratón. - Prepare las jeringas para inyección. Utilice jeringas de 1 ml con agujas de 25 G x 5/8".
- Inyección subcutánea SU5416
- Retengan al animal. Coloque el ratón sobre la tapa de la jaula para ayudar a la sujeción. Agarre la piel y forme una tienda paralela a la columna vertebral. Asegúrese de agarrar a la parte posterior de la cabeza firmemente, para evitar la posible lesión por mordida por el ratón.
NOTA: La presencia de dos investigadores hace que el procedimiento sea más rápido y preciso, ya que uno puede sostener al animal mientras el otro realiza la inyección. - Inserte la aguja por vía subcutánea sobre el flanco en el pliegue suelto de la piel. Asegúrese de insertar la aguja paralela a la piel. Evite penetrar la pared abdominal.
- Inyectar el contenido de la jeringa (100 l de SU5416 disuelto o vehículo).
NOTA: Para evitar fugas después de la entrega completa, sostenga la jeringa durante aproximadamente 10 s y gire ligeramente la aguja debajo de la piel. - Retire la aguja y devuelva al animal a su jaula. Después de la inyección su5416, coloque las jaulas en la cámara de hipoxia ventilada.
- Retengan al animal. Coloque el ratón sobre la tapa de la jaula para ayudar a la sujeción. Agarre la piel y forme una tienda paralela a la columna vertebral. Asegúrese de agarrar a la parte posterior de la cabeza firmemente, para evitar la posible lesión por mordida por el ratón.
- Exposición a la hipoxia
- Supervise la ventilación con el tiempo. Asegúrese de mantener el 10% del suministro de oxígeno. Mantener a los animales de normoxia en una cámara semisellable en 21% O2.
- Asegúrese de que las cámaras estén equipadas con un sensor de oxígeno para medir el nivel de oxígeno. Evite la apertura extensiva de las cámaras. Para la limpieza y adición de alimentos y agua abrir las cámaras durante no más de 20 minutos cada 3 días.
- Inspeccione los animales diariamente. Considere señales de estrés como piloerección o pérdida significativa de peso.
NOTA: Se espera que los animales bajo Hipoxia/SU5416 pierdan peso5. Esto es un indicio de desarrollo de la enfermedad. - Repita la inyección de SU5416 semanalmente durante 3 semanas consecutivas (consulte la figura 1A para obtener una visión general del diseño experimental).
NOTA: Variar el lugar de la inyección puede ayudar a reducir las irritaciones de la piel.
2. Caracterización funcional por mediciones invasivas de presión RV
- Preparación
NOTA: Seleccione un régimen anestésico. Se pueden utilizar anestésicos inyectables o inhalables. Dado que una ligera sobredosis de anestésicos inyectables (especialmente de ketamina/ximilazina o pentobarbital) puede afectar significativamente la función cardíaca, se recomienda el uso de anestésicos volátiles. Es de gran importancia utilizar el mismo anestésico para todos los ratones dentro de un estudio.- Utilice un vaporizador para asegurar una dosis precisa de anestésicos por animal. La dosis de isoflurano es la siguiente: inducción 3-4%, mantenimiento 1% mezclado con 100% de oxígeno.
NOTA: Use equipo de protección personal y evite respirar el vapor. - Prepare una almohadilla de calentamiento y/o lámparas de calentamiento para mantener la temperatura corporal. Prepare una sonda de temperatura rectal para monitorear la temperatura corporal.
- Asegurar una ventilación adecuada. Prepare el respirador de antemano. Prepare el conector del tubo Y y compruebe la función del ventilador utilizando el modo manual. Asegúrese de que la presión inspiratoria es de <1 cm H2O para evitar el barotrauma. Ajuste la frecuencia respiratoria a 110 respiraciones/min.
- Prepare un tubo endotraqueal cortando un catéter intravascular de 20 G.
- Prepare los instrumentos necesarios: pequeños fórceps, tijeras, retractores de gancho elástico, cauterizador de recipientes y hisopos de algodón. En un hisopo de algodón, ajuste una pequeña aguja de 25 G x 5/8" que se utilizará para hacer una pequeña punción en el ventrículo derecho.
- Prepare el catéter de presión, la unidad de control de volumen de presión e inicie el software de adquisición de datos. Colocar el catéter fotovoltaico en un tubo de 15 ml lleno de PBS a 37 oC durante 15 minutos y calibrar de acuerdo con el protocolo del fabricante.
- Para la perfusión y fijación de los órganos, preparar PBS y una solución de 50% PBS / 50% OCT. Preparar 2 x 10 ml jeringas (con una aguja de 25 G): uno se utilizará para perfundar el corazón y el pulmón con PBS in situ y el segundo para inyectar la solución OCT / PBS (50/50) a la muestra pulmonar que se utilizará para su examen sutológico.
- Utilice un vaporizador para asegurar una dosis precisa de anestésicos por animal. La dosis de isoflurano es la siguiente: inducción 3-4%, mantenimiento 1% mezclado con 100% de oxígeno.
- Intubación
- Pesar el ratón y registrar el estado de salud antes de la anestesia.
- Inducir la anestesia con 3-4% de isoflurano. Compruebe la profundidad de la anestesia probando el reflejo del dedo del pie: pellizca el dedo del pie de una de las extremidades firmemente. Si el animal retira la extremidad, es un signo de anestesia insuficiente.
- Después de la inducción de la anestesia, afeite el cuello y las áreas torácicas.
- Coloque el ratón en la almohadilla calefactora. Coloque una sonda de temperatura rectal para monitorear la temperatura corporal.
NOTA: El mantenimiento de la temperatura corporal es importante para las mediciones funcionales. La temperatura corporal debe ser de aproximadamente 36,5-37 oC. - Usando fórceps curvos, conecte un hilo de sutura a los incisivos superiores del ratón, estire y fije a la almohadilla de calentamiento con cinta quirúrgica. Asegure las extremidades del ratón con cintas quirúrgicas.
- Para intubar el animal hacer una pequeña incisión de aproximadamente 1 cm en la piel cervical medial utilizando tijeras pequeñas.
NOTA: La intubación oral es un método alternativo que requiere más experiencia. - Con un aplicador de punta de algodón separar sin rodeos las glándulas salivales parótidas y submandibulares en el nivel medio. Esto expondrá los músculos que cubren la tráquea.
- Corte cuidadosamente estos músculos exponiendo la tráquea.
- Con tijeras pequeñas hacer una pequeña incisión entre los cartílagos traqueales e insertar el tubo endotraqueal preparado. Saque la guía metálica del catéter intravascular.
- Conecte el catéter al respirador. Verifique la posición del tubo traqueal inflando manualmente suavemente los pulmones. Fije la posición con cinta adhesiva.
- Mantener una anestesia de isoflurano del 1% durante todo el procedimiento.
- Controle regularmente la profundidad de la anestesia probando el reflejo de pellizcar del dedo del dedo del dedo del dedo del dedo del dedo del dedo del dedo. Ajuste la anestesia en consecuencia.
NOTA: La frecuencia cardíaca recomendada durante los experimentos, bajo anestesia de isoflurano al 1%, es de aproximadamente 400 latidos/min. El mantenimiento de la temperatura corporal y la anestesia son esenciales para controlar la frecuencia cardíaca. El exceso de isoflurano puede reducir la frecuencia cardíaca. Sin embargo, la recuperación se puede lograr reduciendo la tasa de isoflurano.
- Mediciones de presión RV (enfoque de pecho abierto)
- Con tijeras pequeñas realizar una incisión de la piel de aproximadamente 1 cm sobre el proceso de xifoide y la parte abdominal superior. Separa la piel que cubre el pecho y la pared abdominal de los cuadrantes abdominales superiores: comienza en la línea media, distal al xifoide y muévete cuidadosamente lateralmente por ambos lados. Use termocauterización para controlar el sangrado.
NOTA: El objetivo es tener acceso a la cavidad torácica a través de la pared abdominal. - Abra la cavidad abdominal y corte el diafragma cuidadosamente, teniendo cuidado de no dañar el corazón latiendo o los pulmones.
NOTA: El objetivo es exponer el ápice y el ventrículo derecho del corazón. Una buena exposición y visión del corazón son de crucial importancia para la correcta colocación del catéter. Es de gran importancia evitar el sangrado durante todo el procedimiento. Incluso pequeños cambios en el volumen intravasal pueden cambiar la carga del corazón derecho y afectar a los parámetros registrados. - Retire suavemente el pericardio con un aplicador con punta de algodón.
- Justo antes de colocar el catéter de presión en el corazón, lleve el catéter al lado del ratón.
- El uso del aplicador de punta de algodón preparado con la aguja produce una puñalada en la parte distal apical del ventrículo derecho. Retire con cuidado la aguja e inserte el catéter de presión en este orificio.
NOTA: Esto debería funcionar sin aplicar fuerza. En caso de que esto no sea posible, intente hacer un nuevo agujero cerca del primero con el fin de evitar lesiones prolongadas del corazón. La aguja no debe insertarse más profundamente que aproximadamente 3 mm. - Inserte el catéter de presión paralelo a la dirección del ventrículo derecho, con la punta hacia la arteria pulmonar.
- Observe el trazado de las ondas de presión para garantizar el posicionamiento correcto del catéter. Los seguimientos representativos se muestran en la Figura 2.
- Permita que la señal de presión se estabilice. Pausa las respiraciones y obtén al menos 3 mediciones. Entre las mediciones individuales permiten ventilar al animal.
- Una vez que se registren todas las mediciones, retire el catéter y colóquelo de nuevo en el tubo lleno de PBS en el baño de agua.
NOTA: Después de completar el experimento, limpie el catéter de acuerdo con las instrucciones del fabricante.
- Con tijeras pequeñas realizar una incisión de la piel de aproximadamente 1 cm sobre el proceso de xifoide y la parte abdominal superior. Separa la piel que cubre el pecho y la pared abdominal de los cuadrantes abdominales superiores: comienza en la línea media, distal al xifoide y muévete cuidadosamente lateralmente por ambos lados. Use termocauterización para controlar el sangrado.
- Eutanasia y perfusión pulmonar
- Al finalizar el experimento eutanasiar al ratón por exsanguinación.
- Abre el pecho ampliamente. Con tijeras, corte todo el esternón y preste atención para no herir el corazón o los pulmones.
- El uso de tijeras de iris hace una pequeña incisión en el ventrículo izquierdo para permitir que la sangre salga de la cámara.
- Coloque la aguja de 25 G de una jeringa que contenga 10 ml de PBS en el ventrículo derecho e inyecte la solución PBS hasta que los pulmones se despejen de sangre.
- Una vez completado este paso, confirmar la eutanasia mediante la cosecha de tejido vital (corazón y pulmones): cortar el cava y los accesorios aórticos y eliminar el corazón y los pulmones en bloque.
3. Caracterización morfométrica
- Inmediatamente después de extirpar el corazón y los pulmones (Paso 2.4.5), aísle el corazón y retire ambas aurículas. Con tijeras de tenotomía curvas diseccionar cuidadosamente el ventrículo derecho (RV) del ventrículo izquierdo (LV), dejando el tabique (S) con el ventrículo izquierdo. Pesar RV y LV+S y calcular el índice Fulton RV/LV+ S (Figura 3)5,9.
- Tome una parte del ventrículo derecho y colóquelo en un molde de incrustación precargada de OCT. Utilice la otra parte del ventrículo derecho para el análisis de ARN y/o proteínas. Enfrérquel en hielo seco y conservar a -80 oC.
- Usa tijeras de iris para aislar los pulmones del corazón y de cualquier otro tejido restante.
NOTA: Para la preparación de los pulmones, la perfusión como se describió anteriormente (Pasos 2.4.3-2.4.5) es de gran importancia. - Congela parte de los pulmones y guárdala para el ARN, la extracción de proteínas u otros ensayos.
- Utilice la otra parte de los pulmones para el análisis histológico. Para ello, inserte la jeringa que contenga 50% de PBS y 50% de PTU en un bronquio del lóbulo usado10,11. El experimentador puede ver fácilmente que el pulmón se infla cuando el contenido de la jeringa se perfunde en el tejido.
- Coloque estas piezas de pulmón en moldes de incrustación precargadas con OCT y congénelos en hielo seco. Almacene las muestras a -80 oC después de congelarse.
- Preparar secciones de 8 m de RV y pulmón utilizando una máquina de criostato. Seque al aire las secciones a temperatura ambiente durante 30 min.
- Fije los portaobjetos a temperatura ambiente utilizando 10% de paraformaldehído (PFA) durante 10 min.
NOTA: La PFA es un carcinógeno humano conocido. Reduzca el riesgo de exposición utilizando una campana de humos química, procedimientos adecuados y equipo de protección personal. Consulte la Ficha de datos de seguridad de materiales (MSDS) para obtener más información. - Evaluación de remodelación vascular por tinción de hematoxilina/eosina
Nota: Realizar tinción de hematoxilina/eosina para evaluar los cambios estructurales del corazón y la remodelación vascular en el pulmón (Figura 3).- Manchar con solución de Hematoxilina durante 8 min.
- Enjuagar con agua corriente del grifo durante 5 minutos seguido de un enjuague rápido en agua destilada.
- Enjuagar en 95% EtOH durante 1 min y contramanchar en la solución de Eosin durante 1 min.
- Deshidratar (80% Etanol 10-30 s, 100 Etanol durante 1 min y 100% Toluol durante 3 min).
- Monte y cubra con un cubreobjetos. Seque los portaobjetos durante la noche a temperatura ambiente.
NOTA: Las soluciones utilizadas para la tinción pueden ser peligrosas. Reduzca el riesgo de exposición utilizando una campana de humos química, procedimientos adecuados y equipo de protección personal. Refiera al MSDS para más información.
- Evaluación de la fibrosis ventricular derecha por Picrosirius Red Staining
NOTA: En el Picrosirius Red Staining, Picrosirius Red, que es ácido, se une al colágeno12. Por lo tanto, esta tinción se puede utilizar para un examen histológico del contenido de colágeno.- Incubar los portaobjetos en una solución de Bouin precalentada a 58oC durante 1 h.
- Lave los portaobjetos en agua corriente del grifo para eliminar el color amarillo de las secciones durante 10-15 min.
- Mancha en 0.1% Verde Rápido durante 20 min a temperatura ambiente.
- Enjuagar en 1% de ácido acético durante 1 min.
- Enjuagar en agua del grifo durante 5 min.
- Mancha en 0,1% de color rojo Sirius durante 30 min a temperatura ambiente seguido de deshidratación en Toluol.
ADVERTENCIA: Las soluciones utilizadas para la tinción pueden ser peligrosas. Reduzca el riesgo de exposición utilizando una campana de humos química, procedimientos adecuados y equipo de protección personal. Refiera al MSDS para más información.
- Evaluación de la hipertrofia de cardiomiocitos RV por WGA Staining
NOTA: La hipertrofia del ventrículo derecho (RV) a nivel celular se puede evaluar realizando una tinción de aglutinina de germen de trigo (WGA) (Figura 4).- Fijar las diapositivas en solución de acetona fría durante 15 minutos seguido de 3 pasos de lavado en PBS (5 min cada uno).
- Bloquear con 10% de suero de cabra en una solución de Dako durante 30 min a temperatura ambiente.
- Incubar los toboganes con WGA: Añadir WGA 1:200 e incubar durante 1 1/2 h a 37oC en la oscuridad.
- Lave los portaobjetos tres veces con PBS.
- Incubar los portaobjetos con un tinte de ácido nucleico.
- Lave los portaobjetos tres veces con PBS.
- Para el montaje, retire el exceso de líquido y aplique medios de montaje y un cubreobjetos. Seque los portaobjetos durante 1 hora a temperatura ambiente en la oscuridad y guárdelos a 4oC.
NOTA: Las soluciones utilizadas para la tinción pueden ser peligrosas. Reduzca el riesgo de exposición utilizando una campana de humos química, procedimientos adecuados y equipo de protección personal. Refiera al MSDS para más información.
- Realizar inmunoquímica del pulmón para evaluar aún más y específicamente la remodelación vascular. Por ejemplo, la tinción de células musculares lisas se puede utilizar para evaluar la musculación de los vasos, mientras que la tinción del factor von Willebrand se puede utilizar para visualizar los cambios endoteliales. Estos métodos se describen en otros lugares5.
Resultados
En este protocolo, se describe en detalle la creación del modelo Hypoxia/SU5416 para inducir PH en ratones. Además, detallamos todos los pasos necesarios para realizar una evaluación vascular y cardíaca pulmonar al final del período de observación.
En la Figura 1A 13,1414se muestra una visión general del diseño experimental de este modelo. Los ratones son sometidos a hipoxia normob...
Discusión
Este protocolo describe cómo modelar PH en ratones combinando dos estímulos patológicos: hipoxia crónica e inyección SU5416 (Hypoxia/SU5416)18. En un intento de correlacionar este modelo de ratón con la condición PH humana, inevitablemente se debe mirar la clasificación PH actual, que se muestra en el Cuadro 1. PH en casi todas las formas se caracteriza por vasoconstricción pulmonar y proliferación aberrante de células musculares endoteliales y lisas. Esto conduce a una...
Divulgaciones
Los autores no tienen nada que declarar.
Agradecimientos
Este trabajo fue apoyado por subvenciones de la Asociación Americana del Corazón (AHA- 17SDG33370112 y 18IPA34170258) y de los Institutos Nacionales de Salud NIH K01 HL135474 a Y.S. O.B fue apoyado por la Deutsche Herzstiftung.
Materiales
| Name | Company | Catalog Number | Comments |
| Acetic acid glacial | Roth | 3738.1 | |
| Acetone, Histology Grade | The Lab Depot | VT110D | |
| ADVantage Pressure-Volume System | Transonic | ADV500 | |
| Bouin's solution | Sigma | Ht10132 | |
| Cautery System | Fine Science Tools | 18000-00 | |
| Connection tubing and valves | |||
| Cotton-Tipped Applicators | Covidien | 8884541300 | |
| Coverslips, 24 x50 mm | Roth | 1871 | |
| Data Acquisition and Analysis | Emka | iox2 | |
| Direct Red 80 | Sigma | 365548-5G | |
| DMSO (Dimethyl Sulfoxide) | Sigma Aldrich | 276855 | |
| Dry ice | |||
| Dumont # 5 forceps | Fine Science Tools | 11251-10 | |
| Dumont # 7 Fine Forceps | Fine Science Tools | 11274-20 | |
| Embedding molds | Sigma Aldrich | E-6032 | |
| Eosin Solution Aqueous | Sigma | HT110216 | |
| Ethanol, laboratory Grade | Carolina Biological Supply Company | 861285 | |
| Fast Green FCF | Sigma | F7252-5G | |
| Fine scissors | Fine Science Tools | 14090-09 | |
| Goat Serum | invitrogen | 16210-064 | |
| Heating pad | Gaymar | T/Pump | |
| Hematoxylin 2 | Thermo Scientific | 7231 | |
| Hypoxic chamber | Biospherix | A30274P | |
| Induction chamber | DRE Veterinary | 12570 | |
| Intubation catheter (i.v. catheter SurFlash (20 G x 1") ) | Terumo | SR*FF2025 | |
| Iris scissors | Fine Science Tools | 14084-08 | |
| Isoflurane | Baxter | NDC-10019-360-40 | |
| Isoflurane vaporizer | DRE Veterinary | 12432 | |
| Mice (C57BL/6) | Charles River | ||
| Needles 25 G x 5/8" | BD | 305122 | |
| OCT | Tissue Tek | 4583 | |
| PBS (Phosphate Buffered Saline) | Corning | 21-031-CV | |
| Piric Acid- Saturated Solution 1.3 % | Sigma | P6744-1GA | |
| Pressure volume catheter | Transonic | FTH-1212B-4018 | |
| Retractor | Kent Scientific | SURGI-5001 | |
| Static oxygen Controller ProOx 360 | Biospherix | P360 | |
| SU 5416 | Sigma Aldrich | S8442 | |
| Surgical Suture, black braided silk, 5.0 | Surgical Specialties Corp. | SP116 | |
| Surgical tape | 3M | 1527-1 | |
| Syringe 10 ml | BD | 303134 | |
| Syringes with needle 1 ml | BD | 309626 | |
| Sytox Green Nuclein Acid Stain | Thermo Scientific | S7020 | |
| Tenotomy scissors | Pricon | 60-521 | |
| Toluol | Roth | 9558.3 | |
| Ventilator | CWE | SAR-830/P | |
| WGA Alexa Fluor | Thermo Scientific | W11261 | |
| Xylene | Roth |
Referencias
- Galie, N., et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). European Heart Journal. 37 (1), 67-119 (2016).
- Stenmark, K. R., Meyrick, B., Galie, N., Mooi, W. J., McMurtry, I. F. Animal models of pulmonary arterial hypertension: the hope for etiological discovery and pharmacological cure. American Journal of Physiology-Lung Cell Molecular Physiology. 297 (6), 1013-1032 (2009).
- Maarman, G., Lecour, S., Butrous, G., Thienemann, F., Sliwa, K. A comprehensive review: the evolution of animal models in pulmonary hypertension research; are we there yet. Pulmonary Circulation. 3 (4), 739-756 (2013).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: problems and prospects. American Journal of Physiology-Lung Cell Molecular Physiology. 302 (10), 977-991 (2012).
- Ciuclan, L., et al. A novel murine model of severe pulmonary arterial hypertension. American Journal of Respiratory and Critical Care Medicine. 184 (10), 1171-1182 (2011).
- Taraseviciene-Stewart, L., et al. Inhibition of the VEGF receptor 2 combined with chronic hypoxia causes cell death-dependent pulmonary endothelial cell proliferation and severe pulmonary hypertension. FASEB Journal. 15 (2), 427-438 (2001).
- Vitali, S. H., et al. The Sugen 5416/hypoxia mouse model of pulmonary hypertension revisited: long-term follow-up. Pulmonary Circulation. 4 (4), 619-629 (2014).
- Breen, E. C., Scadeng, M., Lai, N. C., Murray, F., Bigby, T. D. Functional magnetic resonance imaging for in vivo quantification of pulmonary hypertension in the Sugen 5416/hypoxia mouse. Experimental Physiology. 102 (3), 347-353 (2017).
- Wang, Z., Schreier, D. A., Hacker, T. A., Chesler, N. C. Progressive right ventricular functional and structural changes in a mouse model of pulmonary arterial hypertension. Physiological Reports. 1 (7), 00184 (2013).
- Momcilovic, M., et al. Utilizing 18F-FDG PET/CT Imaging and Quantitative Histology to Measure Dynamic Changes in the Glucose Metabolism in Mouse Models of Lung Cancer. Journal of Visualized Experiment. (137), 57167 (2018).
- Guma, S. R., et al. Natural killer cell therapy and aerosol interleukin-2 for the treatment of osteosarcoma lung metastasis. Pediatric Blood Cancer. 61 (4), 618-626 (2014).
- Lattouf, R., et al. Picrosirius red staining: a useful tool to appraise collagen networks in normal and pathological tissues. Journal of Histochemistry and Cytochemistry. 62 (10), 751-758 (2014).
- Penumatsa, K. C., et al. Transglutaminase 2 in pulmonary and cardiac tissue remodeling in experimental pulmonary hypertension. American Journal of Physiology-Lung Cell Molecular Physiology. 313 (5), 752-762 (2017).
- Wang, Z., et al. Organ-level right ventricular dysfunction with preserved Frank-Starling mechanism in a mouse model of pulmonary arterial hypertension. Journal of Applied Physiology. 124 (5), 1244-1253 (2018).
- van de Veerdonk, M. C., Bogaard, H. J., Voelkel, N. F. The right ventricle and pulmonary hypertension. Heart Failure Reviews. 21 (3), 259-271 (2016).
- Emde, B., Heinen, A., Godecke, A., Bottermann, K. Wheat germ agglutinin staining as a suitable method for detection and quantification of fibrosis in cardiac tissue after myocardial infarction. European Journal of Histochemistry. 58 (4), 2448 (2014).
- Pena, S. D., Gordon, B. B., Karpati, G., Carpenter, S. Lectin histochemistry of human skeletal muscle. Journal of Histochemistry and Cytochemistry. 29 (4), 542-546 (1981).
- Bueno-Beti, C., Hadri, L., Hajjar, R. J., Sassi, Y. The Sugen 5416/Hypoxia Mouse Model of Pulmonary Arterial Hypertension. Methods in Molecular Biology. 1816, 243-252 (2018).
- Colvin, K. L., Yeager, M. E. Animal Models of Pulmonary Hypertension: Matching Disease Mechanisms to Etiology of the Human Disease. Journal of Pulmonary and Respiratory Medicine. 4 (4), (2014).
- Benza, R. L., et al. Predicting survival in pulmonary arterial hypertension: insights from the Registry to Evaluate Early and Long-Term Pulmonary Arterial Hypertension Disease Management (REVEAL). Circulation. 122 (2), 164-172 (2010).
- Jacob, S. W., Rosenbaum, E. E. The toxicology of dimethyl sulfoxide (DMSO). Headache. 6 (3), 127-136 (1966).
- Jacob, S. W., Wood, D. C. Dimethyl sulfoxide (DMSO). Toxicology, pharmacology, and clinical experience. American Journal of Surgery. 114 (3), 414-426 (1967).
- Abraham, D., Mao, L. Cardiac Pressure-Volume Loop Analysis Using Conductance Catheters in Mice. Journal of Visualized Experiment. (103), 52942 (2015).
- Ma, Z., Mao, L., Rajagopal, S. Hemodynamic Characterization of Rodent Models of Pulmonary Arterial Hypertension. Journal of Visualized Experiment. (110), 53335 (2016).
- Townsend, D. Measuring Pressure Volume Loops in the Mouse. Journal of Visualized Experiment. (111), 53810 (2016).
- Penumatsa, K. C., Warburton, R. R., Hill, N. S., Fanburg, B. L. CrossTalk proposal: The mouse SuHx model is a good model of pulmonary arterial hypertension. Journal of Physiology. 597 (4), 975-977 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados