Method Article
توصيف البروتينات حسب الحجم والاستبعاد الكروماتوغرافيا المقترنة بتشتت الضوء متعدد الزوايا (SEC-MALS)
In This Article
Summary
يصف هذا البروتوكول الجمع بين الفصل اللوني استبعاد حجم مع تشتت الضوء متعدد الزوايا (SEC-MALS) للتوصيف المطلق للبروتينات والمجمعات في الحل. يحدد SEC-MALS الوزن الجزيئي وحجم البروتينات النقية، وoligomers الأصلية، وcomplexes اللاتروكومبسيس والبروتينات المعدلة مثل البروتينات السكرية.
Abstract
الكروماتوغرافيا التحليلية للاستبعاد من الحجم (SEC)، التي يشيع استخدامها لتحديد الوزن الجزيئي للبروتينات ومجمعات البروتين البروتين في الحل، هو تقنية نسبية تعتمد على حجم الانتقاص من التحليلات لتقدير الجزيئات الوزن. عندما لا يكون البروتين كروياً أو يخضع لتفاعلات عمود غير مثالية، يكون منحنى المعايرة المستند إلى معايير البروتين غير صحيح، والوزن الجزيئي المحدد من حجم الإلوتين غير صحيح. تشتت الضوء متعدد الزوايا (MALS) هو تقنية مطلقة تحدد الوزن الجزيئي للحقن في الحل من المعادلات المادية الأساسية. يشكل الجمع بين لجنة الأوراق المالية والبورصة للانفصال مع MALS للتحليل وسيلة متعددة الاستخدامات وموثوق بها لتوصيف حلول نوع واحد أو أكثر من أنواع البروتين بما في ذلك مونومرات، أو oligomers الأصلية أو المجاميع، وcomplexes غير متجانسة. وبما أن القياس يتم في كل حجم من وحدات الإنتاج، يمكن أن تحدد لجنة الأوراق المالية والبورصة -MALS ما إذا كانت ذروة الإلاتينغ متجانسة أو غير متجانسة وتميز بين توزيع الوزن الجزيئي الثابت مقابل التوازن الديناميكي. تحليل البروتينات المعدلة مثل البروتينات السكرية أو البروتينات الدهنية، أو المتشابهة مثل البروتينات الغشاء المنظفات القابلة للذوبان، من الممكن أيضا. وبالتالي، SEC-MALS هو أداة حاسمة للكيميائي البروتين الذي يجب أن تؤكد الخصائص الفيزيائية الحيوية وسلوك الحل للجزيئات المنتجة للبحوث البيولوجية أو التكنولوجية الحيوية. هذا البروتوكول لSEC-MALS يحلل الوزن الجزيئي وحجم مونومرات البروتين النقي والمجاميع. وتشكل البيانات التي تم الحصول عليها أساسا ً لمزيد من التحليلات التي تجريها لجنة الأوراق المالية والبورصة، بما في ذلك تحليلات المجمعات والبروتينات السكرية والبروتينات الغشائية المربوطة بالسطحي.
Introduction
تحليل موثوق من الوزن الجزيئي (ميغاواط) من البروتينات في الحل ضروري للبحوث الجزيئية الحيوية1،2،3،4. تحليل ميغاواط يعلم العالم إذا تم إنتاج البروتين الصحيح وإذا كان مناسبا للاستخدام في مزيد من التجارب5,6. كما هو موضح على مواقع الويب من شبكات البحوث البروتين P4EU7 و ARBRE-Mobieu8، يجب أن تميز مراقبة جودة البروتين ليس فقط نقاء المنتج النهائي، ولكن أيضا حالتها القلة، والتجانس، والهوية، والتشكل، ةيلالما ةيلالما ةيلالما ةيلالما ةيلالما ةيلالما ةيلالما ةيلالما ةيلا
قياس ميغاواط في حل غير التشويه يحدد شكل البروتين الموجود في بيئة مائية، سواء أحادية أو قلة. بينما ل كثير بروتينات الهدف أن ينتج الشكل [مونومر], لأخرى [أليغومر] خاصّة أهليّ طبيعيّ مفتاح إلى نشاط أحيائيّة9,10,11,12. غير مرغوب فيه أيضا ً في الأوليغومرات والمجاميع غير الأصلية، وستؤدي إلى عيوب في التحديد الهيكلي عن طريق التصوير البلوري، أو الرنين المغناطيسي النووي ( NMR) أو تشتت الأشعة السينية بزاوية صغيرة، فضلا عن القطع الأثرية أو عدم الدقة في الاختبارات الوظيفية إلى قياس القياس الكمي بواسطة قياس المعايرة المعايرة بالتحليل الكيميائي أو بلازمون سطح ية2،13.
في حالة العلاج الحيوي مثل الأجسام المضادة أحادية النسيلة (mAbs)، يخدم تحليل ميغاواط القائم على الحل غرضًا مماثلًا لمراقبة الجودة وتوصيف المنتج. المجاميع المفرطة والشظايا تدل على منتج غير مستقر غير مناسب للاستخدام البشري. تتطلب الوكالات التنظيمية توصيف دقيق، ليس فقط من الجزيء العلاجي ولكن أيضا التحلل المحتملة التي قد تكون موجودة في المنتج النهائي14،15،16،17.
بعض الطرق الأكثر انتشارا لتحليل البروتين ميغاواط هي كبريتات الصوديوم الصوديوم بولي أكريلاميد هلام الكهربائي (SDS-PAGE)، الكهربيالشعر الشعري (CE)، الصفحة الأصلية، قياس الطيف الكتلي (MS)، حجم استبعاد الكروماتوغرافيا (SEC) والتحليلية [أوك] [أوك]). ومن بين هذه الاستراتيجيات، لا يتم تنفيذ نظام الـ SDS-PAGE وCE وMS في الحالة الأصلية ويؤدي عادة إلى انفصال الأوليغومرات والمجاميع، وبالتالي فهي غير مناسبة لتحديد الأوليغومير الأصلي أو تحديد المجاميع. على الرغم من أن الصفحة الأصلية لا، من الناحية النظرية، والحفاظ على الدولة الأصلية، في تجربتنا من الصعب تحسين لكثير من البروتينات، والنتائج ليست موثوقة جدا. AUC، سواء عن طريق سرعة الترسيب أو توازن الترسيب، هو كمية ويمكن تحديد ميغاواط من المبادئ الأولى، ولكنها مرهقة جدا، مما يتطلب الكثير من العمل اليدوي والخبرة الهامة في تفسير البيانات، ووقت التجربة الطويلة و آلة مكلفة جدا.
SEC التحليلية هو طريقة كمية وقوية نسبيا، وبسيطة تفصل بين الجزيئات أثناء التدفق من خلال عمود معبأة. يتم تقديم مبادئ وتطبيقات لجنة الأوراق المالية والبورصة بشكل جيد في العديد من الاستعراضات18،19،20 وفي كتيب "حجم الفصلي استبعاد : المبادئ والأساليب"21. الاختلافات في الاحتفاظ بسبب كميات مختلفة من الوقت الذي يقضيه في نشر داخل وخارج المسام في المرحلة الثابتة قبل التخلص من نهاية العمود. ينشأ الفروق (اسميا) من ال [كمّر] وانتشار [كمّولس] من الجزيئات22. يتم بناء منحنى المعايرة باستخدام سلسلة من الجزيئات المرجعية، التي تتعلق بميغاواط الجزيء إلى حجم الأوتيون. للبروتينات، والجزيئات المرجعية عموما حسن ة، والبروتينات الكروية التي لا تتفاعل مع العمود عن طريق شحنة أو بقايا سطح ية. يتم قياس حجم الأوتيون مع كاشف امتصاص الأشعة فوق البنفسجية (UV). إذا كان معامل انقراض الأشعة فوق البنفسجية معروف ًا ًًا غالباً ما يُحسب من تسلسل الكتلة الإجمالية للبروتين يمكن أن يتم أيضاً أن يتم كُناً لها.
وتجدر الإشارة إلى أن تحليل وزارة الطاقة من قبل لجنة الأوراق المالية والبورصة يعتمد على افتراضين رئيسيين فيما يتعلق بالبروتينات التي يجب وصفها: 1) أنها تشترك مع المعايير المرجعية نفس التطابق وحجم معين (وبعبارة أخرى، نفس العلاقة بين خصائص الانتشار و ميغاواط) و 2) مثل المعايير المرجعية، فإنها لا تتفاعل مع العمود إلا من قبل خصائص الsteric- أنها لا تلتزم التعبئة العمود عن طريق تهمة أو التفاعلات hydrophobic. وتؤدي الانحرافات عن هذه الافتراضات إلى إبطال منحنى المعايرة وتؤدي إلى تحديدات خاطئة لميغاواط. هذا هو الحال بالنسبة للبروتينات المختلة جوهريا التي لديها كبير ستوكس radii بسبب مناطقها واسعة غير منظم23،24 أو غير كروية / تجمعات oligomeric الخطية10. البروتينات الغليكوزيلاتيد عموما سيكون أكبر دائرة نصف قطرها ستوكس من شكل غير glycosylated، حتى عندما تؤخذ كتلة الكربوهيدرات المضافة في الاعتبار19. البروتينات الغشاء المنظفات الذوبان العود بشكل مختلف عن البروتينات المعايرة لأن الإلتوائية من لجنة الأوراق المالية والبورصة يعتمد على الحجم الإجمالي للبتيدات المنظفات والدهون المعقدة بدلا من حالة oligomeric وكتلة الضرس من البروتين25 ،26. الكيمياء العمود، والشروط ومؤشر حأ والملح تؤثر جميعها على كميات البروتينات مع المخلفات السطحية المشحونة أو المسعورة27،28.
لجنة الأوراق المالية والبورصة يصبح أكثر تنوعا وموثوق بها لتحديد MW عندما جنبا إلى جنب مع متعدد الزاوية تشتت الضوء (MALS) ومؤشر الانكسار التفاضلية (DRI) كاشفات3و4و11و29، 30,31,32. يحدد كاشف DRI التركيز على أساس التغير في مؤشر الانكسار الحل بسبب وجود الكمالية. يقيس كاشف MALS نسبة الضوء المتناثر بمؤشر في زوايا متعددة بالنسبة لشعاع الليزر الحادث. وهذه الأداة، المعروفة مجتمعة باسم SEC-MALS، تحدد ميغاواط بشكل مستقل عن وقت الأوتيل حيث يمكن حساب ميغاواط مباشرة من المبادئ الأولى باستخدام المعادلة 1،
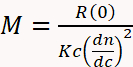 (1)
(1)
حيث M هو الوزن الجزيئي للشفير، R(0) انخفاض نسبة رايلي (أي كمية الضوء المتناثرة من قبل الاختزال نسبة إلى كثافة الليزر) التي يحددها كاشف MALS واستقراء إلى زاوية صفر، ج تركيز الوزن الذي يحدده كاشف الأشعة فوق البنفسجية أو dRI، dn/dc زيادة مؤشر الانكسار من الشعال (أساسا الفرق بين مؤشر الانكسار من اليافَر والمخزن المؤقت)، وK ثابت بصري يعتمد على خصائص النظام مثل الطول الموجي والمذيبات معامل الانكسار29.
في SEC-MALS، يستخدم عمود SEC فقط لفصل الأنواع المختلفة في الحل بحيث تدخل MALS وخلايا كاشف التركيز بشكل فردي. وقت الاحتفاظ الفعلي ليس له أهمية للتحليل إلا بقدر ما يحل جيدا أنواع البروتين. ومعايرة الأدوات مستقلة عن العمود ولا تعتمد على المعايير المرجعية. ومن ثم، يعتبر المجلس الأعلى للتعليم ومكافحة الفقد في البحر وسيلة "مطلقة" لتحديد ميغاواط من المعادلات المادية الأساسية. إذا كانت العينة غير متجانسة وغير منفصلة تماما عن طريق العمود، فإن القيمة المقدمة في كل حجم الإلوتين سيكون متوسط وزن الجزيئات في كل حجم الإلوتين التي تتدفق من خلال خلية التدفق في شريحة الوقت، حوالي 75 μL.
ومن خلال تحليل التباين الزاوي لكثافة التشتت، يمكن للـMALS أيضا ً تحديد حجم (الجذر- متوسط المربع نصف القطر، Rg)للجزيئات الكبيرة والجسيمات النانوية ذات الشعاع الهندسي الأكبر من حوالي 12.5 نانومتر29. وبالنسبة للأنواع الصغيرة مثل البروتينات الأحادية وoligomers، يمكن إضافة وحدة دينامية لتشتت الضوء (DLS) إلى أداة MALS من أجل قياس الرادي الهيدروديناميكية من 0.5 نانومتر وما فوق33.
في حين أن تحليل تركيز الأشعة فوق البنفسجية أو DRI قد يوفر قيمة ج في مكافئ 1، ويفضل استخدام DRI لسببين: 1) DRI هو كاشف تركيز عالمي، ومناسبة لتحليل الجزيئات مثل السكريات أو السكريات التي لا تحتوي على الأشعة فوق البنفسجية الكروموفور34; و 2) الاستجابة للتركيز dn / DC من جميع البروتينات النقية تقريبا في العازلة مائي هو نفسه إلى داخل واحد أو اثنين في المئة (0.185 مل / ز)35، لذلك ليس هناك حاجة لمعرفة معامل انقراض الأشعة فوق البنفسجية.
استخدام SEC-MALS في أبحاث البروتين واسعة النطاق جدا. التطبيقات الأكثر شيوعا حتى الآن هي تحديد ما إذا كان البروتين النقي هو أحادي أو القلة ودرجةالقلة، وتقييم المجاميع 3،10،11،17، 37 3737, 36 31,36 . القدرة على القيام بذلك للبروتينات الغشاء المنظفات القابلة للذوبان التي لا يمكن أن تتميز بالوسائل التقليدية هي ثمينة بشكل خاص، وقد نشرت بروتوكولات مفصلة لهذا31،39،40 , 41 , 42 , 43. وتشمل التطبيقات الشائعة الأخرى تحديد درجة التعديل بعد الترجمة وتعدد التشتت من بروتين سكري، والبروتينات الدهنية ومماثلة متقارنة4،31،44 , 45 , 46 , 47; تشكيل (أو عدم وجود) والقياس المطلق (على عكس نسبة stoichiometric) من المجمعات غير المتجانسة بما في ذلك البروتين والبروتين وحمض النوى والبروتين السكريات مجمعات24،46، 48,49,50,51,52. تحديد توازن مونومر-dimer تفكك ثابت49،53،54؛ وتقييم التطابق البروتين55،56. ما وراء البروتينات، SEC-MALS لا تقدر بثمن لوصف الببتيدات57،58، والبوليمرات الطبيعية غير المتجانسة على نطاق واسع مثل الهيبارين59 وشيتوسان60،61، صغيرة الفيروسات62 ومعظم أنواع البوليمرات الاصطناعية أو المصنعة63,64,65,66. ويمكن الاطلاع على مراجع مستفيضة في المؤلفات67 وعلى الإنترنت (في http://www.wyatt.com/bibliography).
هنا، نقدم بروتوكولاً قياسياً لتشغيل وتحليل تجربة SEC-MALS. يتم تقديم ألبومين مصل البقر (BSA) كمثال لفصل وتوصيف مونومرات البروتين وoligomers. يحدد بروتوكول BSA بعض الثوابت النظام التي تعمل كأساس لمزيد من التحليلات SEC-MALS بما في ذلك تلك المجمعات والبروتينات السكرية والبروتينات الغشاءية السطحية.
نلاحظ أنه يمكن إجراء SEC-MALS باستخدام معيار عالية الأداء الكروماتوغرافيا السائلة (HPLC) أو البروتين السريع السائل الكروماتوغرافيا (FPLC) المعدات من العديد من البائعين. يصف هذا البروتوكول استخدام نظام FPLC الموجود عادة في المختبرات التي تنتج البروتينات للبحث والتطوير (انظر جدول المواد). قبل تشغيل البروتوكول، كان ينبغي تركيب نظام FPLC، وأجهزة الكشف MALS وDRI، جنبا إلى جنب مع حزم البرامج الخاصة بهم للتحكم، والحصول على البيانات وتحليل هات التعليمات الخاصة بالمصنعين وأي ثابت المعايرة المطلوبة أو إعدادات أخرى تم إدخالها في البرنامج. يجب وضع مرشح مضمن بين المضخة وحاقن مع الغشاء المائي، 0.1 ميكروم المسام المثبتة.
Protocol
1- إعداد النظام
- توصيل MALS وDRI كاشفات المصب للكشف عن الأشعة فوق البنفسجية FPLC. تجاوز جهاز كشف درجة الوَس والموصلية حيث أنها ستضيف كمية كبيرة للكشف عن الأشعة فوق البنفسجية وكاشفات الأشعة فوق البنفسجية وأجهزة الكشف عن الأشعة الماصية. استخدام أنابيب الشعرية من 0.25 مم i.d. من العمود إلى وبين أجهزة الكشف، و0.75 mm i.d. الأنابيب الشعرية على إخراج أجهزة الكشف إلى النفايات أو جمع الكسور.
- التأكد من أن الاتصالات إشارة اللازمة بين FPLC وأجهزة الكشف قد أنشئت، بما في ذلك الناتج التناظرية من كاشف الأشعة فوق البنفسجية إلى المدخلات التناظرية MALS، والإخراج الرقمي من FPLC إلى حقن تلقائي MALS، عن طريق صندوق الإدخال/الإخراج في FPLC.
- قم بتركيب عمود تحليلي مناسب من الـ SEC يغطي نطاق تجزئة يتراوح بين 20 كيلو دينار و500 كيلو دينار على الأقل. تحقق من معلومات المنتج لتحديد ما إذا كان العمود مناسبًا لمجموعة من الخصائص الأخرى للعينة والمرحلة المتنقلة.
2. إعداد العازلة، و الخصبة النظام بين عشية وضحاها والتحقق من النظافة
- باستخدام الكواشف HPLC الصف، وإعداد 1 L من الفوسفات المخزنة المالحة مع 50-100 m كلوريد الصوديوم. قم بتصفية المخزن المؤقت إلى 0.1 ميكرومتر باستخدام فلتر بوليثير بوليثير أو ما شابه ذلك. قم بتصفية أول 50-100 مل من العازلة إلى زجاجة النفايات والتخلص منها، من أجل القضاء على الجسيمات من المرشحات الجافة، ثم قم بتصفية الباقي إلى زجاجة نظيفة معقمة تم غسلها جيداً مع المياه المصفاة ومنزوعة الانبعاثات والمغطاة لمنعها الغبار من الدخول.
ملاحظة: يمكن استخدام مذيبات المرحلة المتنقلة الأخرى مثل العازلة تريس إذا البروتينات الإضافية التي يتم حلها بشكل تفضيلي في تلك المذيبات لتحليلها. - تدفق بين عشية وضحاها بمعدل تدفق 0.5 مل /دقيقة، أو كما أوصى بها الشركة المصنعة للعمود، لتوازن العمود في المخزن المؤقت وإزالة الجسيمات. استخدم وضع التدفق المستمر لـ FPLC وتأكد من عدم توقف التدفق حتى اكتمال كافة عمليات تشغيل SEC-MALS.
- ضع خلية تدفق DRI في وضع التطهير أثناء تدفق بين عشية وضحاها. قم بإيقاف تشغيل الإزالة قبل بدء تشغيل العينة.
- عند بدء تدفق، تدريجيا منحدر معدل التدفق لمنع "العمود سفك" تأثير (أو إطلاق الجسيمات) الناجمة عن تغير مفاجئ في الضغط في العمود.
- إذا كان من المعروف أن النظام مستقر تماما وخالية من الجسيمات، وفي التوازن مع المرحلة المتنقلة المطلوبة، استبدال تدفق بين عشية وضحاها مع أقصر، 2-3 ساعة دافق.
- تحقق من نظافة النظام من خلال التنصت على أنابيب المصب من العمود للإفراج عن الجسيمات المتراكمة ومراقبة الإشارة في كاشف 90 درجة على شاشة اللوحة الأمامية للأداة MALS. تحقق من أن الضوضاء من الذروة إلى الذروة لا تزيد عن 50-100 μV.
- إجراء حقنة "فارغة" للتحقق من أن حاقن نظيفة من الجسيمات. "فارغة" هو ببساطة المخزن المؤقت تشغيل، أعدت في قارورة جديدة، معقمة.
- إذا كان ذروة الجسيمات لا يزيد عن 1 مل في الحجم ولا أكثر من 5 mV فوق خط الأساس، ثم النظام جاهز للعينات. وإلا، قم بإجراء حقن فارغة إضافية حتى تنظيف، أو إجراء الصيانة لتنظيف حاقن.
3. إعداد وتحميل العينة
- إعداد ما لا يقل عن 200 ميكرولتر من BSA في 1-2 ملغ / مل في المخزن المؤقت SEC.
ملاحظة: لمنع هطول الأمطار، لا ينبغي أبدا أن يذوب في المياه النقية BSA. - قم بتصفية البروتين إلى 0.02 ميكرومتر باستخدام فلتر طرف الحقنة.
- تجاهل أول بضع قطرات من filtrate من أجل القضاء على الجسيمات من المرشحات الجافة.
- وبدلاً من ذلك، تقوم بالطرد المركزي للعينة عند 000 10 x غرام لمدة 15 دقيقة لتمكين هطول الكميات غير القابلة للذوبان والجسيمات الكبيرة الأخرى.
- حقن 100 ميكرولتر من الحل BSA في حلقة.
ملاحظة: هذا هو الكمية الموصى بها من المواد، ويمكن حقن أكثر أو أقل وفقا لظروف العينة مثل الاستقرار أو التوافر. كمية البروتين المطلوبة لكل حقنة تختلف عكسيا مع الوزن الجزيئي - ضعف كتلة البروتين هناك حاجة إذا كان الوزن الجزيئي هو 33 kDa، أو نصف ذلك من BSA.
4- إعداد برنامج MALS
- فتح جديد | تجربة من الأسلوب في قائمة البرامج MALS وحدد الأسلوب عبر الإنترنت من مجلد أساليب النظام "تشتت الضوء". إذا كان جهاز كشف DLS موجود، حدد الأسلوب عبر الإنترنت من "تشتت الضوء" | مع QELS المجلد.
- في المقطع التكوين، قم بتعيين معلمات نموذج ومرحلة متنقلة.
- في طريقة العرض "مضخة عام" تعيين معدل التدفق إلى ذلك المستخدم في FPLC.
- في طريقة العرض مضخة عام، فرع المذيبات، حقل الاسم، حدد PBS.
- في طريقة العرض حاقن، نموذج فرع، أدخل اسم BSA، وتعيين dn/dc = 0.185 (القيمة القياسية للبروتينات غير المعدلة)، A2 = 0، ومعامل الأشعة فوق البنفسجية انقراض = 0.667 مل / (ملغ سم).
ملاحظة: بالنسبة للبروتينات الأخرى، يمكن العثور على معامل التخلص من الأشعة فوق البنفسجية280 نانومتر في الأدب أو حسابها من تسلسلها باستخدام مختلف أدوات البرمجيات المجال العام.
- في المقطع إجراءات ، طريقة عرض "مجموعة أساسية" ، حدد مربع الاختيار المشغل على إدخال تلقائي وتعيين مدة التشغيل إلى 70 دقيقة بحيث يتم جمع البيانات للإدخال الكامل حتى إجمالي حجم نفاذية من SEC يتم الوصول إلى العمود.
ملاحظة: قد تختلف الكمية اللازمة من الوقت مع معدل تدفق العمود - 35 دقيقة من جمع مطلوب لمعيار 7.8 مم × 300 ملم HPLC-SEC عمود في 0.5 مل /دقيقة. - ابدأ التجربة في برنامج MALS بالنقر على الزر تشغيل. وسوف تبدأ قراءة البيانات بعد تلقي إشارة النبض من جهاز FPLC عن طريق كاشف MALS.
- صفر إشارة dri بالنقر فوق زر Autozero على اللوحة الأمامية للصك.
5. إعداد برنامج FPLC
- أدخل اسم البروتين والتشغيل في برنامج FPLC، في الدليل | تنفيذ التعليمات اليدوية | تعيين علامة.
- تبديل صمام الحقن من الحمل اليدوي إلى حقن تحت مسار التدفق | صمام حقن.
- تضمين إشارة نبض ة إدخال نبض ة 0.5 s تحت صندوق الإدخال/الأو | نبض الرقمية خارج. سيؤدي ذلك إلى جمع البيانات في برنامج MALS.
6. حقن العينة في حلقة. انقر فوق تنفيذ في برنامج FPLC لبدء تشغيل التجربة.
7. تحليل بيانات BSA الخاصة بـ SEC-MALS
- إجراء تحليل، خطوة بخطوة، تحت قسم الإجراءات في برنامج MALS.
- تحقق من ظهور القمم، في نفس حجم الوحدة تقريباً في الأشعة فوق البنفسجية وMALS وRI، عن طريق التحقق من طريقة العرض "المجموعة الأساسية".
- في طريقة العرض الأساسية، حدد خط الأساس لجميع الإشارات (جميع أجهزة الكشف LS، والأشعة فوق البنفسجية وDRI). وينبغي تحديد خطوط الأساس للإشارة إلى مستوى المذيب النقي، الأفضل الممتد من جانب واحد من قمم العينة إلى الأخرى.
- في عرض القمم، حدد القمم التي سيتم تحليلها بالنقر فوق الماوس وسحبه. حدد 50% من كل قمة. أولاً حدد قمة مونومر ('الذروة 1') ثم قمة الخافت ('الذروة 2'). تحقق من القيم الصحيحة dn/dc = 0.185 ومعامل الأشعة فوق البنفسجية 280 نانومتر = 0.667 لBSA تحت كل ذروة.
- تنفيذ ذروة المحاذاة، والتصحيح توسيع نطاق وإجراءات التطبيع.
ملاحظة: عادة ما يتم معايرة طريقة SEC-MALS بشكل دوري لمحاذاة الذروة وتوسيع النطاق وتطبيع أجهزة الكشف الزاوي إلى كاشف 90 درجة باستخدام بروتين أحادي التشتت مع نصف قطر الدوران RG < 10 نانومتر مثل BSA مونومر. في هذا المثال، يخدم BSA على حد سواء كجزيء المعايرة وهو في حد ذاته موضوع تحليل ميغاواط.- في الإجراءات | عرض محاذاة، حدد المنطقة الوسطى من القمم عن طريق النقر على والسحب الماوس، انقر فوق محاذاة الإشارات ثم موافق.
- في الإجراءات | توسيع نطاق عرض، واختيار المركزية 50٪ من ذروة مونومر. تأكد من تحديد كاشف RI كأداة مرجعية، ثم انقر فوق أداء صالح وتطبيق لمطابقة إشارات الأشعة فوق البنفسجية وLS إلى إشارة RI.
- قم بالتكبير إلى القمم للتحقق من تداخلها بشكل وثيق جدًا داخل الوسط 50-70%، ثم انقر فوق موافق.
- إذا كان التداخل غير مثالي، (قد يكون من الضروري أن) تنفيذ تناسب و "تطبيق" مرة أو مرتين أخرى حتى التداخل ممتازة.
- في الإجراءات | طريقة عرض التسوية، حدد الذروة 1، أدخل 3.0 نانومتر كقيمة Rg، انقر فوق تسوية ثم موافق.
- في الإجراءات | الكتلة الضلّي وRg من وجهة نظر MALS، استعراض البيانات لتحديد أي، إن وجدت، زوايا الكشف ينبغي أن يتم إلغاء تحديد من التحليل بسبب الضوضاء المفرطة. عادة، ستكون هذه الزوايا السفلية التي تتناثر فيها جزيئات الغبار كثافة عالية نسبياً. حدد الشرائح الفردية داخل القمم من الرسم البياني على اليمين وعرض الاعتماد الزاوي من معكوس انخفاض نسبة رايلي في الرسم البياني على اليسار. إذا كانت الزوايا الدنيا (وأحياناً الأعلى) تحيد بشكل مستمر بشكل كبير عن الملاءمة، فألغ تحديدها من القائمة الموجودة أسفل العرض.
- عرض الرسم البياني للنتائج في طريقة عرض الرسم البياني السهل. حدد كتلة مولامن القائمة المنسدلة العرض في أعلى النافذة. استخدم Ctrl + انقر واسحب للتكبير في منطقة الذروة.
- عرض نتائج الكتلة الضرسية المجدولة النهائية لذروة المونومر والقاتمة في النتائج | تقرير (ملخص) عرض تحت ذروة النتائج | لحظات الكتلة مولار (غرام / مول) | ميغاواط. يتم الإبلاغ عن النقاء تحت نتائج الذروة | الكسر الكتلي (%)
ملاحظة: تظهر أيضا لحظات أخرى كتلة الضرس; هذه عادة ما تكون ذات الصلة إلى البوليمرات غير المتجانسة، ولكن ليس للبروتينات مع أحجام منفصلة. يمكن تضمين العديد من النتائج الأخرى التي تنتجها البرمجيات في التقرير مثل نسبة استرداد الكتلة (جزء من البروتين الذي يُشار إليه عن طريق كاشف التركيز بالنسبة للكمية التي يتم حقنها)، وإحصاءات الذروة، وتعدد التشتت،وR g وR ح لحظات، الخ. وعندما تقدم مقاييس عدم اليقين، تعكس دقة القيمة المذكورة استنادا إلى الضوضاء في سلسلة القياس، ولا ينبغي اعتبارها تمثل الدقة. وتتوقف الدقة الحقيقية للقيم المبلغ عنها على عوامل مختلفة مثل دقة قيم معامل الزوال ومعامل الزوال، ومعايرة الآلات، وما إلى ذلك. - من القائمة ملف، حدد حفظ كأسلوب وحفظ بيانات BSA تحليلها كطريقة قياسية للقياسات المستقبلية لجميع أنواع البروتينات. وسيتم في التحليل ترحيل بارامترات التطبيع وتوسيع النطاق اتُرِد َتَرَد َلُرَسَة َ لـ BSA.
النتائج
الشكل 1أ،ب يظهر أن ثلاثة أشكال من القلة من BSA: مونومر، خافت وتريمر، كانت منفصلة بشكل جيد على عمود مسام 200 Å مع قرار خط الأساس من مونومر وخافت، في حين أن الشكل 2a يبين أن الفصل على عمود مسام 75 تحقيق جيدة مونومر، ديمر القرار. وقد أدرج المثال الأخير لتوضيح النتيجة "السيئة"؛ هذه الاختلافات في الفصل للعمودين قد، في الواقع، أن يتوقع وفقا لنطاقات فصل الشركة المصنعة المذكورة. لا يتم فصل التشذيب بشكل كامل عن العمد والعجولومرات الأعلى لا يتم فصلها بشكل جيد عن التشذيب وبعضها البعض. الشكل 2b هو مثال على إشارة تشتت الضوء الصاخبة مع الجسيمات الموجودة في جميع أنحاء كروماتوغرام، مما يحول دون دقة تحديد ميغاواط.
ومن الآن فصاعدا نركز على الشكل 1ب. والأحادي، الذي يُشار إليه بـ 13.8 مل، يعرض كتلة مولس متوسط الوزن MW من 64.1 ± 0.4 كدا التي تحددها MALS ونصف قطرها هيدروديناميكي Rح من 3.54 ± 0.01 نانومتر. هذه النتائج هي في اتفاق مع كتلة تسلسل وشعاع هيدروديناميكية معروفة من BSA، 66.4 kDA و 3.5 نانومترعلى التوالي68،إلى داخل الدقة المعتادة من SEC-MALS، 5٪ 3،69. وأظهرت الباهت، التي تبلغ قيمتها 12 مل، قيمة Mw قدرها 127 ± 1 كدأ التي حددتها MALS-كما هو متوقع، ضعف قيمة مونومر إلى داخل الدقة التجريبية وR h من 5.68 ± 0.06 نانومتر. ولوحظ أيضا ذروة التشذيب في 11 مل مع Mw من 194 ± 9 kDa التي تحددها MALS، ثلاثة أضعاف من مونومر إلى ضمن الدقة التجريبية، كما هو متوقع. R h من التشذيب لا يمكن تحديدها بسبب كثافة منخفضة من إشارة DLS.
نقاط الكتلة الضرسية المحسوبة عبر ذروة مونومر موحدة إلى داخل 2-5%، مما يدل على التجانس. ليس من غير المألوف العثور على الكتف زائدة مع كتلة ضرس في نطاق 38-50 كدا، المقابلة لشظايا BSA70. نقاط الكتلة الضرسية عبر قمم الديمريك وتريمريك ليست موحدة، مما يدل على عدم التجانس. قمة خافت غير متجانسة إلى حد ما بسبب آثار التشذيب التي تنزف في ذروة خافت، وذروة التشذيب غير متجانسة بسبب co-elution من oligomers أعلى سيئة الحل.
مستوى الإشارة إلى الضوضاء من ذروة مونومر مقبول تماما في جميع الإشارات الثلاث، أكثر من 100:1، كما هو ذروة خافت مع إشارة إلى الضوضاء من 40: 1. مناطق كروماتوغرام وراء قمم البروتين مسطحة، مع استثناءات من ذروة بسبب الجسيمات بالقرب من مجموع الاستبعاد (الفراغ) حجم في تتبع LS وذروة الملح (إيجابية) وذروة الهواء المذاب (السلبية) في تتبع DRI، بالقرب من نفاذية مجموع حجم. وتتم الإشارة إلى هذه في الشكل 1أ.
ويمكن أيضا حساب مستوى النقاء في تجربة لجنة الأوراق المالية والبورصة وMALS: يمثل الجزء الكتلي من ذروة أحادية المستوى في التقرير النسبة المئوية لنقاء النموذج الأحادي. وبالنسبة لممون BSA، فإن النقاء المحسوب هو 88%.
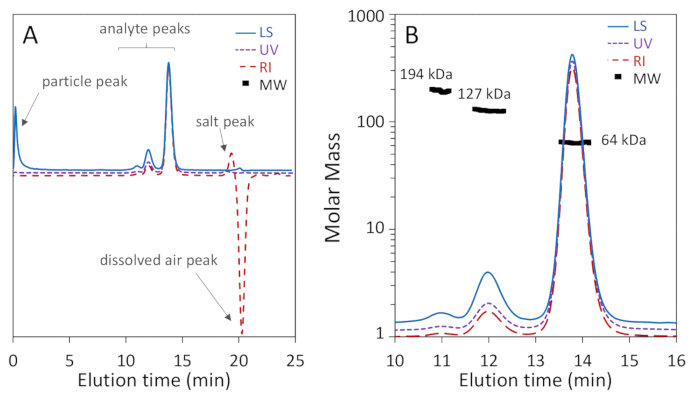
الشكل 1 تحليل تحليل سي سي-مالس لألبومين مصل البقر (BSA) باستخدام عمود 200 مسام- استبعاد حجم. يتم تطبيع آثار كروماتوغرام إلى ذروة مونومر وإزاحة للوضوح. (أ) يتم الإشارة إلى القطع الأثرية الشائعة التي يمكن تجاهلها، بما في ذلك ذروة الجسيمات بالقرب من بداية إشارة تشتت الضوء وكذلك الملح وقمم الهواء المذاب بالقرب من إجمالي حجم نفاذية في إشارة مؤشر الانكسار. (ب) والكروماتوغرام معارض ممتازة فصل مونومر-dimer-تريمر والضوء تشتت إشارة معارض عالية إشارة إلى الضوضاء. وتميز قيم المونومر وثنائي اتوى ميجاواط التجانس العالي. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
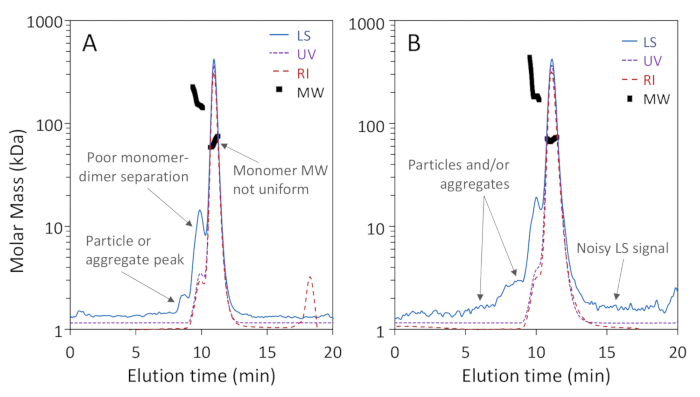
الشكل 2 أمثلة على تحليلات SEC-MALS ذات الجودة المنخفضة. يتم تطبيع آثار كروماتوغرام إلى ذروة مونومر وإزاحة للوضوح. (أ) عدم كفاية الفصل في عمود استبعاد حجم المسام 75 ألف؛ لا يتم فصل ذروة الجسيمات بين 8-9 دقيقة بشكل جيد من البروتينات. (ب) تتجلى نسبة الإشارة إلى الضوضاء غير الكافية والجسيمات الواسعة المجاورة للبروتينات في إشارة تشتت الضوء . الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
وقد وفرت تجربة SEC-MALS فصل جيد من مونومر، خافت وتقليم، والنتائج الكمية للجماهير الضرس والأحجام الهيدروديناميكية من كل ذروة. وهذا بدوره يحدد ويميز بوضوح كل نوع موجود، فضلا عن تحديد كمية النقاء. عادة ما تكون النتائج التي تم الحصول عليها دقيقة إلى داخل 5٪، ودقيقة وقابلة للتكرار إلى داخل 1-2٪3،69. وهذا المستوى من الدقة والتكرار يجعل من الممكن التمييز بثقة بين الأنواع التي قد تكون قريبة من ميغاواط، طالما أنها مفصولة من قبل لجنة الأوراق المالية والبورصة (قد تتداخل جزئيا داخل نفس الذروة). فوائد مراقبة جودة البروتين والتوصيف البيولوجي الفيزيائي الأساسي واضحة.
التحقق من عدم وجود جسيمات مهم جدا ً بالنسبة للقياسات الحساسة والقابلة للتكرار SEC-MALS. تظهر قمم الجسيمات عموماً كإشارات MALS كبيرة غير مصحوبة بإشارات قابلة للمقارنة للأشعة فوق البنفسجية أو إشارات RI. وينبغي أن تكون المرحلة المتنقلة والعينة معدة بعناية للقضاء على هذه الجزيئات. استخدام الكواشف HPLC الصف أو أفضل، والترشيح من المرحلة المتنقلة وتخفيف العازلة إلى 0.1 - 0.2 ميكرومتر (قبل غسل مرشح للقضاء على الجسيمات التي هي موجودة دائما على الأغشية الجافة)، وصيانة زجاجات المرحلة المتنقلة غير نظيفة وغيرها من الأواني الزجاجية ل يوصى بإزالة الجسيمات والمجاميع التي قد تكون تراكمت عند توقف التدفق أو عند وجود عمود غير مُستخدَم. وينبغي تصفية العينة إلى أصغر حجم المسام التي لا تزيل المواد ذات الأهمية، وعادة ما لا يزيد عن 0.1 ميكرومتر، وإذا أمكن، 0.02 ميكرومتر. إذا كان المرشح يسد بسرعة، قد تكون العينة الطرد المركزي، وتصفيتها في مراحل من حجم المسام تنازلي، و / أو إعادة تنقية. عندما يتم الحفاظ على النظم باستمرار مع عالية الجودة، ومرحلة جديدة وتصفيتها المتنقلة، ويمنع صدمات العمود، والعينات نظيفة ولا تلتزم العمود، والقياسات لن تظهر الضوضاء الجسيمات المذكورة أعلاه، وسوف توفر بيانات عالية الجودة.
MALS هو agnostic إلى المخازن المؤقتة SEC نموذجية للبروتينات; العديد من أنظمة عازلة أخرى إلى جانب PBS يمكن استخدامها لتحسين الفصل والاستقرار، بما في ذلك مجموعة متنوعة من سواغ71. كما أن هذه التعليمات لا تعرف أي ما هو في العمود المحدد الذي ينبغي اختياره للفصل والاسترداد على النحو الأمثل. الشواغل الرئيسية للسواغ فيما يتعلق التحليل هي تغييرات كبيرة في مؤشر الانكسار، مما يؤدي إلى تعديل مؤشر الانكسار محددة زيادة dn/dc، وسواغ التي تمتص 280 نانومتر عند الحاجة إلى تحليل الأشعة فوق البنفسجية. على سبيل المثال، أرجينين هو سواغ مشتركة الحد من التجميع التي يمكن أن تؤثر بشكل كبير على dn / DC من البروتين نموذجي، حتى جلبه إلى النظام السلبي (بروتين مع DN السلبية / DC لا يزال يمكن تحليلها من قبل SEC-MALS إذا dn / يتم تحديد العاصمة تجريبيا، ولكن إذا DN / DC = 0 كثافة الضوء المتناثرة من قبل البروتين سوف تكون فارغة وتحليل ميغاواط سيكون من المستحيل). يناقش موضوع قيم dn/dc للبروتينات باستفاضة من قبل Zhao وآخرون35 حيث يظهر أنه بالنسبة للحواجز المائي القياسية، فإن الغالبية العظمى من البروتينات غير المعدلة تقع ضمن 2-3% من القيمة القياسية (0.185 أو 0.186 مل/ز عند = 660 نانومتر) ، على الرغم من البروتينات أدناه ~ 10 kDa هي أكثر متغيرة، وهناك عدد قليل من الأنواع التي قد ترتفع إلى 0.21 مل / ز.
وكانت ملامح ميغاواط عبر قمم أحادية BSA وخافت في البيانات المقدمة على حد سواء متجانسة تماما إلى داخل 2% أو أقل, مما يدل على الأنواع أحادية التشتت. وقد تنشأ قيم ميغاواط غير موحدة عبر ذروة من عدم التجانس أو التحليل غير السليم. على وجه الخصوص، يمكن أن ينتج عن عدم تطبيق تصحيح توسيع النطاق بشكل صحيح. أما بالنسبة للبروتينات الأخرى، فيمكن أن ينشأ أيضاً عن توازن ديناميكي بين مونومرات وأوليغومرات، حيث تعتمد نسبة مونومر إلى oligomer وبالتالي على تركيز الذروة (لا يظهر BSA هذا السلوك وغالباً ما يستخدم كعينة تحكم للتحقق من معلمات توسيع النطاق الصحيح). إن ملف MW الذي يختلف من المؤدي إلى الحافة التالية ولا يتغير مع تركيز العينة هو نموذجي لتوزيع أنواع الوزن الجزيئي التي يتم حلها جزئياً من قبل لجنة الأوراق المالية والبورصة. تختلف مصادر التوزيعات غير المتجانسة على ما يبدو عن طريق حقن كميات إجمالية مختلفة من البروتين- التوزيع مع التوازن الديناميكي ولكن ليس مع توزيع ثابت أو تصحيح توسيع نطاق غير صحيح.
ونظرا للقيود المذكورة أعلاه، فإن لجنة الأوراق المالية والبورصة ليست مناسبة لمختلف المهام. وهي ليست مناسبة لتحليل عينات الخام؛ وينبغي أن تكون العينات جيدا-- تنقية من قبل التقارب القياسية وأساليب تلميع. ليس لديها دقة كافية أو حل السلطة لتحديد المسوخ والمتغيرات من البروتين أو ماب مع نفس أو كتلة قريبة جدا، ولا يمكن استخدامها مع اليايات التي لا تلم من أو منفصلة على عمود SEC، على الرغم من أنه في الآونة الأخيرة قد ثبت أن تبادل اليون ه أو عكس المرحلة الكروماتوغرافيا يمكن الجمع بين مع MALS لفصل وتمييز الأنواع التي لم يتم حلها من قبل لجنة الأوراق المالية والبورصة72،73،74. وحيثما تكون كميات البروتين مقيدة بشدة، قد لا يكون من الممكن أن يكون من الممكن أن يكون من الممكن أن يكون من الممكن أن يكون من الممكن أن يكون من الممكن أن يكون من الممكن أن يكون من الممكن أن يكون من الضروري أن يكون هناك ما بين 10 و200 ميكروغرام 3، بل قد يتطلب نظام FPLC أكثر من ذلك، حيث يبلغ قطر الأنابيب الداخلي أكثر من 0.25 مم؛ ومع ذلك، يمكن تحليل كميات أصغر من قبل UHPLC-SEC-MALS. البروتينات غير المستقرة للغاية التي تجمع عند مقدمة لمرحلة المحمول ليست مناسبة لتحليل SEC-MALS، على الرغم من أن تحسين العازلة باستخدام تشتت الضوء الديناميكي خارج الخط قد تتغلب على هذه المشكلة75.
وعلى الرغم من الجهد الإضافي الذي تنطوي عليه لجنة الأوراق المالية والبورصة، فإنه لا يقدر بثمن لبحوث البروتين ويستخدم على نطاق واسع من قبل المجتمعات الأكاديمية والصيدلانية الحيوية. بالإضافة إلى توصيف مونومرات، oligomers والمجاميع كما هو موضح في البروتوكول أعلاه، يمكن أن تميز SEC-MALS البروتينات المعدلة مثل البروتينات السكرية (تحديد ميغاواط من البروتين ومكونات الغليكان بشكل فردي)، السطحي- أو بروتينات الغشاء القابلة للدهن (تحديد ميجاوات من البروتين ومكونات الذوبان بشكل فردي)، وتجمعات البروتين مثل الجزيئات الشبيهة بالفيروس، والبروتين والبروتينات ومجمعات الأحماض النووية البروتينية، السكريات، بروتين السكاريد مقترن، الببتيدات والعديد من الجزيئات الحيوية الأخرى.
Disclosures
DS هو موظف في شركة وايت للتكنولوجيا، التي تستخدم منتجات MALS في هذا البروتوكول. AT هو موظف في شركة Danyel للتكنولوجيا الحيوية، وهو موزع للأدوات Wyatt MALS وAKTA FPLC.
Acknowledgements
نشكر الدكتور تسافي دانييلي (مركز وولفسون للبيولوجيا الهيكلية التطبيقية، الجامعة العبرية) على المشورة والتعاون. كما نشكر شركة Daniel Biotech Ltd. (Rehovot, Israel) على المساعدة وإقامة نظام التحليل FPLC-MALS المستخدم في هذه الدراسة.
Materials
| Name | Company | Catalog Number | Comments |
| AKTA pure | GE Healthcare | 29-0182-26 | fast protein liquid chromatograph (FPLC) |
| AKTA UNICORN | GE Healthcare | FPLC control software | |
| ASTRA | Wyatt Technology | MALS data acquisition and analysis software | |
| Bovine serum albumine (purity >97%) | Sigma | A1900 | analyte |
| DAWN or miniDAWN | Wyatt Technology | WH2 or WTREOS | multi-angle light scattering (MALS) detector |
| Increase 200 10/300 | GE Healthcare | size exclusion column, 200 Å pores, 10 mm i.d., 300 mm length | |
| Optilab | Wyatt Technology | WTREX | differential refractive index (RI) detector |
| Sodium chloride NaCl | Sigma | 71382 | HPLC grade NaCl |
| Stericup bottle top filter polyether sulfone 0.1 µm 1000 mL | Millipore | SCVPU11RE | mobile phase filter |
| Whatman Anotop 10 syringe filter 0.02 µm | GE Healthcare | 6809-1002 | sample filter |
| Whatman Anotop 10 syringe-tip filter, 0.1 µm pore, 10 mm diameter | GE Healthcare | 6809-1012 | sample filter |
| Whatman Anotop 25 syringe filter 0.1 µm | GE Healthcare | 6809-2012 | mobile phase filter |
| WyattQELS | Wyatt Technology | WIQ | dynamic light scattering detector |
References
- Acton, T. B., et al. Robotic cloning and Protein Production Platform of the Northeast Structural Genomics Consortium. Methods in Enzymology. 394, 210-243 (2005).
- Acton, T. B., et al. Preparation of protein samples for NMR structure, function, and small-molecule screening studies. Methods in Enzymology. 493, 21-60 (2011).
- Folta-Stogniew, E., Williams, K. R. Determination of molecular masses of proteins in solution: Implementation of an HPLC size exclusion chromatography and laser light scattering service in a core laboratory. Journal of Biomolecular Technology. 10 (2), 51-63 (1999).
- Kendrick, B. S., Kerwin, B. A., Chang, B. S., Philo, J. S. Online size-exclusion high-performance liquid chromatography light scattering and differential refractometry methods to determine degree of polymer conjugation to proteins and protein-protein or protein-ligand association states. Analytical Biochemistry. 299 (2), 136-146 (2001).
- Hughes, C. S., Longo, E., Phillips-Jones, M. K., Hussain, R. Quality control and biophysical characterisation data of. Data Brief. 14, 41-47 (2017).
- Muthurajan, U., et al. In Vitro Chromatin Assembly: Strategies and Quality Control. Methods in Enzymology. 573, 3-41 (2016).
- P4EU. . Protein Quality Standard PQS. , (2019).
- Arbre Mobieu. . Guidelines on Protein Quality Control. , (2019).
- Bowman, A., et al. The histone chaperones Vps75 and Nap1 form ring-like, tetrameric structures in solution. Nucleic Acids Research. 42 (9), 6038-6051 (2014).
- Bowman, G. R., et al. Oligomerization and higher-order assembly contribute to sub-cellular localization of a bacterial scaffold. Molecular Microbiology. 90 (4), 776-795 (2013).
- Folta-Stogniew, E. Oligomeric states of proteins determined by size-exclusion chromatography coupled with light scattering, absorbance, and refractive index detectors. Methods in Molecular Biology. 328, 97-112 (2006).
- Vieux, E. F., Wohlever, M. L., Chen, J. Z., Sauer, R. T., Baker, T. A. Distinct quaternary structures of the AAA+ Lon protease control substrate degradation. Proceedings of the National Academy of Sciences of the United States of America. 110 (22), E2002-E2008 (2013).
- Group, N.S.. . use of SEC-MALS in crystallization QC. , (2018).
- Ahrer, K., Buchacher, A., Iberer, G., Josic, D., Jungbauer, A. Analysis of aggregates of human immunoglobulin G using size-exclusion chromatography, static and dynamic light scattering. Journal of Chromatography A. 1009 (1-2), 89-96 (2003).
- Narhi, L. O., Schmit, J., Bechtold-Peters, K., Sharma, D. Classification of protein aggregates. Journal of Pharmaceutical Sciences. 101 (2), 493-498 (2012).
- Spiess, C., et al. Bispecific antibodies with natural architecture produced by co-culture of bacteria expressing two distinct half-antibodies. Nature Biotechnology. 31 (8), 753-758 (2013).
- Philo, J. S. A critical review of methods for size characterization of non-particulate protein aggregates. Current Pharmaceutical Biotechnology. 10 (4), 359-372 (2009).
- Stellwagen, E. Gel filtration. Methods in Enzymology. 463, 373-385 (2009).
- Burgess, R. R. A brief practical review of size exclusion chromatography: Rules of thumb, limitations, and troubleshooting. Protein Expression and Purification. 150, 81-85 (2018).
- Striegel, A. M., Yau, W. W., Kirkland, J. J., Bly, D. D. . Modern Size-Exclusion Liquid Chromatography. , (2009).
- GE Healthcare. . Size Exclusion Chromatography: Principles and Methods. , (2014).
- Uliyanchenko, E. Size-exclusion chromatography-from high-performance to ultra-performance. Analytical and Bioanalytical Chemistry. 406 (25), 6087-6094 (2014).
- Dunker, A. K., Silman, I., Uversky, V. N., Sussman, J. L. Function and structure of inherently disordered proteins. Current Opinion in Structural Biology. 18 (6), 756-764 (2008).
- Hsiao, H. H., Nath, A., Lin, C. Y., Folta-Stogniew, E. J., Rhoades, E., Braddock, D. T. Quantitative characterization of the interactions among c-myc transcriptional regulators FUSE, FBP, and FIR. Biochemistry. 49 (22), 4620-4634 (2010).
- Hayashi, Y., Takagi, T., Maezawa, S., Matsui, H. Molecular weights of alpha beta-protomeric and oligomeric units of soluble (Na+, K+)-ATPase determined by low-angle laser light scattering after high-performance gel chromatography. Biochimica et Biophysica Acta. 748 (2), 153-167 (1983).
- Folta-Stogniew, E. J. Macromolecular Interactions: Light Scattering. Encyclopedia of Life Sciences. , (2009).
- Hong, P., Koza, S., Bouvier, E. S. P. Size-Exclusion Chromatography for the Analysis of Protein Biotherapeutics and their Aggregates. Journal of Liquid Chromatography and Related Technology. 35 (20), 2923-2950 (2012).
- Chakrabarti, A. Separation of Monoclonal Antibodies by Analytical Size Exclusion Chromatography. Antibody Engineering. , (2018).
- Wyatt, P. J. Light scattering and the absolute characterization of macromolecules. Analytica Chimica Acta. 272, (1993).
- Takagi, T. Application of low-angle laser light scattering detection in the field of biochemistry: review of recent progress. Journal of Chromatography A. 506, 51-63 (1990).
- Wen, J., Arakawa, T., Philo, J. S. Size-exclusion chromatography with on-line light-scattering, absorbance, and refractive index detectors for studying proteins and their interactions. Analytical Biochemistry. 240 (2), 155-166 (1996).
- Mogridge, J. Using light scattering to determine the stoichiometry of protein complexes. Methods in Molecular Biology. 1278, 233-238 (2015).
- Larkin, M., Wyatt, P. J. Light-Scattering Techniques and their Application to Formulation and Aggregation Concerns. Formulation and Process Development Strategies for Manufacturing Biopharmaceuticals. , (2010).
- Wolfender, J. L. HPLC in Natural Product Analysis: The Detection Issue. Planta Medica. 75 (07), 719-734 (2009).
- Zhao, H., Brown, P. H., Schuck, P. On the distribution of protein refractive index increments. Biophysical Journal. 100, (2011).
- Serebryany, E., Folta-Stogniew, E., Liu, J., Yan, E. C. Homodimerization enhances both sensitivity and dynamic range of the ligand-binding domain of type 1 metabotropic glutamate receptor. FEBS Letters. 590 (23), 4308-4317 (2016).
- Arakawa, T., Wen, J. Size-exclusion chromatography with on-line light scattering. Current Protocols in Protein Science. Chapter 20, Unit 20.6 (2001).
- Müller, R., et al. High-resolution structures of the IgM Fc domains reveal principles of its hexamer formation. Proceedings of the National Academy of Sciences. 110 (25), 10183-10188 (2013).
- Slotboom, D. J., Duurkens, R. H., Olieman, K., Erkens, G. B. Static light scattering to characterize membrane proteins in detergent solution. Methods. 46 (2), 73-82 (2008).
- Miercke, L. J., Robbins, R. A., Stroud, R. M. Tetra detector analysis of membrane proteins. Current Protocols in Protein Science. 77, 1-30 (2014).
- Gimpl, K., Klement, J., Keller, S. Characterising protein/detergent complexes by triple-detection size-exclusion chromatography. Biological Procedures Online. 18 (1), 4 (2016).
- Korepanova, A., Matayoshi, E. D. HPLC-SEC characterization of membrane protein-detergent complexes. Current Protocols in Protein Science. Chapter 29, 1-12 (2012).
- Roy, A., Breyton, C., Ebel, C. Analytical Ultracentrifugation and Size-Exclusion Chromatography Coupled with Light Scattering for Characterization of Membrane Proteins in Solution. Membrane Proteins Production for Structural Analysis. , (2014).
- Hastie, K. M., et al. Crystal structure of the prefusion surface glycoprotein of the prototypic arenavirus LCMV. Nature Structural & Molecular Biology. 23 (6), 513-521 (2016).
- Pallesen, J., et al. Structures of Ebola virus GP and sGP in complex with therapeutic antibodies. Nature Microbiology. 1 (9), 16128 (2016).
- Micoli, F., Adamo, R., Costantino, P. Protein Carriers for Glycoconjugate Vaccines: History, Selection Criteria, Characterization and New Trends. Molecules. 23 (6), (2018).
- Li, J., et al. Characterizing the Size and Composition of Saposin A Lipoprotein Picodiscs. Analytical Chemistry. 88 (19), 9524-9531 (2016).
- Crichlow, G. V., et al. Dimerization of FIR upon FUSE DNA binding suggests a mechanism of c-myc inhibition. EMBO Journal. 27 (1), 277-289 (2008).
- Kapoor, N., Gupta, R., Menon, S. T., Folta-Stogniew, E., Raleigh, D. P., Sakmar, T. P. Nucleobindin 1 is a calcium-regulated guanine nucleotide dissociation inhibitor of G{alpha}i1. Journal of Biological Chemistry. 285 (41), 31647-31660 (2010).
- Pirruccello, M., Swan, L. E., Folta-Stogniew, E., De Camilli, P. Recognition of the F&H motif by the Lowe syndrome protein OCRL. Nature Structural & Molecular Biology. 18 (7), 789-795 (2011).
- Lockyer, K., Gao, F., Derrick, J. P., Bolgiano, B. Structural correlates of carrier protein recognition in tetanus toxoid-conjugated bacterial polysaccharide vaccines. Vaccine. 33 (11), 1345-1352 (2015).
- Steinbach, T., Wurm, F. R. Degradable Polyphosphoester-Protein Conjugates: "PPEylation" of Proteins. Biomacromolecules. 17 (10), 3338-3346 (2016).
- Das, S., Stivison, E., Folta-Stogniew, E., Oliver, D. Reexamination of the role of the amino terminus of SecA in promoting its dimerization and functional state. Journal of Bacteriology. 190 (21), 7302-7307 (2008).
- Reshetnyak, A. V., et al. The strength and cooperativity of KIT ectodomain contacts determine normal ligand-dependent stimulation or oncogenic activation in cancer. Molecular Cell. 57 (1), 191-201 (2015).
- Zambelli, B., et al. a Chaperone in the Urease Assembly Process, Is an Intrinsically Unstructured GTPase That Specifically Binds Zn2+. Journal of Biological Chemistry. 280 (6), 4684-4695 (2005).
- Ren, X., et al. Hybrid Structural Model of the Complete Human ESCRT-0 Complex. Structure. 17 (3), 406-416 (2009).
- Moriarty, D. F., Fiorillo, C., Miller, C., Colón, W. A truncated peptide model of the mutant P61A FIS forms a stable dimer. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1774 (1), 78-85 (2007).
- la Garza, C. E., Miranda-Hernández, M. P., Acosta-Flores, L., Pérez, N. O., Flores-Ortiz, L. F., Medina-Rivero, E. Analysis of therapeutic proteins and peptides using multiangle light scattering coupled to ultra high performance liquid chromatography. Journal of Separation Science. 38 (9), 1537-1543 (2015).
- Beirne, J., Truchan, H., Rao, L. Development and qualification of a size exclusion chromatography coupled with multiangle light scattering method for molecular weight determination of unfractionated heparin. Analytical and Bioanalytical Chemistry. 399 (2), 717-725 (2011).
- Wang, W., et al. A new green technology for direct production of low molecular weight chitosan. Carbohydrate Polymers. 74 (1), 127-132 (2018).
- Kaderli, S., et al. A novel biocompatible hyaluronic acid-chitosan hybrid hydrogel for osteoarthrosis therapy. International Journal of Pharmaceutics. 483 (1-2), 158-168 (2015).
- Porterfield, J. Z., Zlotnick, A. A Simple and General Method for Determining the Protein and Nucleic Acid Content of Viruses by UV Absorbance. Virology. 407 (2), 281-288 (2010).
- Podzimek, S. The use of GPC coupled with a multiangle laser light scattering photometer for the characterization of polymers. On the determination of molecular weight, size and branching. Journal of Applied Polymer Science. 54 (1), 91-103 (1994).
- Podzimek, S., Vlcek, T., Johann, C. Characterization of branched polymers by size exclusion chromatography coupled with multiangle light scattering detector. I. Size exclusion chromatography elution behavior of branched polymers. Journal of Applied Polymer Science. 81 (7), 1588-1594 (2001).
- Podzimek, S. Importance of Multi-Angle Light Scattering in Polyolefin Characterization. Macromolecular Symposia. 330 (1), 81-91 (2013).
- Tarazona, M. P., Saiz, E. Combination of SEC/MALS experimental procedures and theoretical analysis for studying the solution properties of macromolecules. Journal of Biochemical and Biophysical Methods. 56 (1), 95-116 (2003).
- Minton, A. P. Recent applications of light scattering measurement in the biological and biopharmaceutical sciences. Analytical Biochemistry. 501, 4-22 (2016).
- Hirayama, K., Akashi, S., Furuya, M., Fukuhara, K. Rapid confirmation and revision of the primary structure of bovine serum albumin by ESIMS and frit-FAB LC/MS. Biochemical and Biophysical Research Communications. 173 (2), 639-646 (1990).
- Zhu, H., Ownby, D. W., Riggs, C. K., Nolasco, N. J., Stoops, J. K., Riggs, A. F. Assembly of the gigantic hemoglobin of the earthworm Lumbricus terrestris. Roles of subunit equilibria, non-globin linker chains, and valence of the heme iron. The Journal of biological chemistry. 271 (47), 30007-30021 (1996).
- Peters, T., Feldhoff, R. C. Fragments of bovine serum albumin produced by limited proteolysis. Isolation and characterization of tryptic fragments. Biochemistry. 14 (15), 3384-3391 (1975).
- Lebendiker, M., Danieli, T. Production of prone-to-aggregate proteins. FEBS Letters. 588 (2), 236-246 (2014).
- Amartely, H., Avraham, O., Friedler, A., Livnah, O., Lebendiker, M. Coupling Multi Angle Light Scattering to Ion Exchange chromatography (IEX-MALS) for protein characterization. Scientific Reports. 8 (1), 6907 (2018).
- Astafieva, I. V., Eberlein, G. A., John Wang, Y. Absolute on-line molecular mass analysis of basic fibroblast growth factor and its multimers by reversed-phase liquid chromatography with multi-angle laser light scattering detection. Journal of Chromatography A. 740 (2), 215-229 (1996).
- Onsberg, M., Øgendal, L. H., Jensen, M. L., Howells, L. B., Andersen, B., Bjerrum, M. J. Light scattering coupled with reversed phase chromatography to study protein self-association under separating conditions. Journal of Chromatography B. 938, 60-64 (2013).
- Kim, Y., et al. High-throughput protein purification and quality assessment for crystallization. Methods. 55 (1), 12-28 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved