Method Article
אפיון של חלבונים לפי גודל כרומטוגרפיה הדרה מצמידים לפיזור אור רב זווית (SEC-דוליטל)
In This Article
Summary
פרוטוקול זה מתאר את השילוב של כרומטוגרפיה של החרגת מהגודל עם פיזור אור רב זווית (SEC-דוליטל) לאפיון מוחלט של חלבונים ומכלולי מערכות בתמיסה. SEC-דוליטל קובע את המשקל המולקולרי והגודל של חלבונים טהורים, מקומיים מקוריים, הטרוקומנים וחלבונים משתנים כגון גליקורופטינס.
Abstract
הוצאה אנליטית של כרומטוגרפיה (SEC), המשמשת בדרך כלל לקביעת המשקל המולקולרי של חלבונים ומכלולי חלבון חלבון בתמיסה, היא טכניקה יחסית המסתמכת על הנפח הגדול של האנליטה להערכת מולקולרית שקל. כאשר החלבון אינו כדורי או עובר אינטראקציות עמודה שאינן אידיאליות, עקומת הכיול המבוססת על תקני חלבונים אינה חוקית, והמשקל המולקולרי שנקבע מעוצמת הקול אינו נכון. רב זווית פיזור אור (דוליטל) היא טכניקה מוחלטת הקובעת את המשקל המולקולרי של אנליטה בפתרון משוואות פיזיות בסיסיות. השילוב של שניה להפרדה עם דוליטל לניתוח מהווה אמצעים מגוונים ומהימנים לאפיון פתרונות של מיני חלבון אחד או יותר, כולל מונמרים, מקומיים או אגרגטים, והטרוקומנים. מאז המדידה מבוצעת על כל נפח הימנעות, SEC-דוליטל יכול לקבוע אם שיא משחררי הוא הומוגנית או הטרוגנית ומבחינים בין התפלגות קבועה במשקל מולקולרי לעומת שיווי משקל דינאמי. ניתוח של חלבונים שהשתנו כגון גליקורופנס או ליפופרוטאינים, או שערי מעלה כגון חלבונים ממברנות הממברנה, מסיסות, הוא גם אפשרי. מכאן, SEC-דוליטל הוא כלי קריטי עבור כימאי החלבון אשר חייב לאשר את המאפיינים ביופיזיים והתנהגות פתרון של מולקולות המיוצרים למחקר ביולוגי או ביולוגי. פרוטוקול זה עבור SEC-דוליטל מנתח את המשקל המולקולרי ואת הגודל של חלבון טהור ונומרים ואגרגטים. הנתונים שנרכשו לשמש בסיס לניתוח נוסף שניה-דוליטל כולל אלה של מכלולי, גליקורופנס וחלבונים ממברנה מאוגד הממברנה.
Introduction
ניתוח אמין של משקל מולקולרי (MW) של חלבונים בפתרון חיוני למחקר ביוקולקולרי1,2,3,4. ה-MW ניתוח מודיע למדען אם החלבון הנכון הופק ואם הוא מתאים לשימוש בניסויים נוספים5,6. כפי שמתואר באתרי האינטרנט של רשתות מחקר חלבונים P4EU7 ו arbre-Mobieu8, בקרת איכות חלבון חייב לאפיין לא רק את הטוהר של המוצר הסופי, אלא גם המדינה oligomeric שלה, הומוגניות, הזהות, הקונפורמציה, מבנה, שינויים שלאחר תרגום ותכונות אחרות.
MW מדידה בפתרון בלתי מסונכרן מזהה את צורת החלבון הקיים בסביבה ימית, אם monomeric או oligomeric. בעוד חלבונים רבים המטרה היא לייצר את הטופס monomeric, עבור אחרים מקומי מסוים אוליגומר הוא המפתח לפעילות ביולוגית9,10,11,12. Oligomers אחרים ואגרגטים שאינם מקומיים הם בלתי רצויים ויובילו פגמים בקביעת מבנית על ידי קריסטלוגרפיה, תהודה מגנטית גרעינית (nmr) או קטן זווית רנטגן פיזור, כמו גם חפצים או אי-דיוקים בבחני פונקציונלי ל כריכת כריכה על ידי איזותרמי טיטור calorimetry או פני השטח תהודה2,13.
במקרה של biotherapeutics כגון נוגדנים חד-שבטיים (mAbs), ניתוח MW מבוסס פתרון משמש מטרה דומה של בקרת איכות ואפיון המוצר. אגרגטים מופרזים ושברים מצביעים על מוצר לא יציב שאינו מתאים לשימוש אנושי. סוכנויות רגולטוריות דורשות אפיון קפדני, לא רק של המולקולה הטיפולית אלא גם degradants פוטנציאלי שעשוי להיות נוכח במוצר הסופי14,15,16,17.
כמה מהשיטות הנפוצות ביותר לניתוח מגוואט חלבונים הם נתרן dodecyl סולפט פוליאקרילמיד ג'ל לג (SDS-PAGE), אלקטרופורזה קפילר (לסה נ), עמוד יליד, ספקטרומטר מסה (MS), גודל כרומטוגרפיה (שניות) ואנליטי (אוק). אלה, SDS-PAGE, CE ו-MS אינם מתבצעים במצב מקורי ובדרך כלל להוביל לדיסוציאציה של oligomers ואגרגטים, ומכאן הם לא מתאימים לקביעת oligיומר יליד או כימות האגרגטים. למרות עמוד יליד, תיאורטית, לשמור על מדינה מקורית, בניסיון שלנו זה קשה למטב עבור חלבונים רבים, ותוצאות אינן אמינות מאוד. אוק, בין אם על ידי מהירות המשקעים או שיווי משקל, הוא כמותי והוא יכול לקבוע MW מן העקרונות הראשונים, אבל זה די מסורבל, המחייב עבודה ידנית רבה ומומחיות משמעותית בפענוח נתונים, זמן ניסוי ארוך ו כלי מאוד יקר.
אנליטי SEC הוא שיטה כמותית וחזקה יחסית, המפרידה בין קרו במהלך הזרימה בטור ארוז. העקרונות והיישומים של שניות מוצגים היטב במספר ביקורות18,19,20 ובמדריך "גודל כרומטוגרפיה: עקרונות ושיטות"21. ההבדלים בשמירה נובע מכמויות שונות של זמן שהושקע בפיזור והחוצה של הנקבוביות בשלב הנייח לפני שהתחמק מסוף הטור. ההבדלים נובעים (באופן כלשהו) מן הגדלים היחסיים ומקדמי דיפוזיה של המולקולות22. עקומת כיול בנויה באמצעות סדרה של מולקולות התייחסות, הנוגעים MW של המולקולה לנפח הימנעות. עבור חלבונים, מולקולות הייחוס הם בדרך כלל מתנהגים היטב, חלבונים כדורי שאינם מתקשרים עם העמודה באמצעות המטען או שאריות פני המים הידרופובי. נפח החומקת נמדד בגלאי ספיגה אולטרה-סגול (UV). אם מקדם הכחדה UV ידוע מחושב לעתים קרובות מתוך הרצף-החלבון שיא המסה הכוללת עשויה להיות גם כימות.
בעיקר, הניתוח של MW על ידי שניה מסתמך על שתי הנחות מרכזיות לגבי החלבונים שיש לאפיין: 1) הם חולקים עם תקני הייחוס את אותו החיבור ואמצעי האחסון הספציפי (במילים אחרות, אותו קשר בין מאפייני דיפוזיה ו MW) ו-2) כמו תקני הייחוס, הם אינם מתקשרים עם הטור למעט מאפייני אפקט סטרי-הם אינם מקפידים על הטור הארוז באמצעות מטען או אינטראקציות הידרופוביות. סטיות מהנחות אלה מפסול את עקומת הכיול ומובילות לדטרמינציות שגויות של MW. זהו המקרה עבור חלבונים בלתי מובנים מבחינה מיסודה, כי יש רדיקי סטוקס גדול בשל האזורים הנרחבים שלהם מובנה23,24 או שאינם כדוריים/ליניארי מכלולים oligomeric10. חלבונים גליססיללי בדרך כלל יש רדיוס של סטוקס גדול יותר מאשר הטופס הלא גליססילנטי, גם כאשר מסת הפחמימות שנוספו נלקח בחשבון19. אבקת ממברנה מסיסות חלבונים elute באופן שונה מאשר כיול חלבונים כי שלהם הימנעות מ-SEC תלוי בגודל הכולל של הקומפלקס polypeptide-אבקת שומנים ולא המדינה oligomeric ומיסה טוחנת של החלבון25 ,26. כימיה עמודה, pH ומצבי מלח כולם משפיעים על כמויות של חלבונים עם שאריות משטח טעון או הידרופובי27,28.
שניות הופך הרבה יותר תכליתי ואמין עבור קביעת MW כאשר בשילוב עם פיזור אור מרובה זווית (דוליטל) ואינדקס השבירה הדיפרנציאלי (dRI) גלאי3,4,11,29, .30,31,32 גלאי dRI קובע את הריכוז על בסיס השינוי במדד השבירה פתרון עקב נוכחות של האנליטה. גלאי דוליטל מודד את הפרופורציה של אור מפוזר על ידי אנליטה לזוויות מרובות ביחס קרן לייזר האירוע. מכשור זה, המכונה שניה-דוליטל, קובע כי ה-MW אינו תלוי בזמן הימנעות, מכיוון ש-MW ניתן לחישוב ישירות מהעקרונות הראשונים באמצעות משוואה 1,
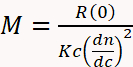 1
1
כאשר M הוא המשקל המולקולרי של האנליטה, R (0) היחס ריילי מופחת (כלומר, כמות האור הפזורים על ידי האנליטה ביחס לעוצמת הלייזר) נקבע על ידי גלאי דוליטל ולאחר זווית אפס, c ה ריכוז משקל נקבע על-ידי הגלאי UV או dRI, dn/dc הדרגה מדד השבירה של האנליטה (ביסודו של דבר ההבדל בין מדד השבירה של אנליטה ואת המאגר), ו K קבוע אופטי התלוי ב מאפייני מערכת כגון אורך הגל ואת מדד השבירה הממס29.
ב-SEC-דוליטל, העמודה SEC משמשת אך ורק להפרדת המינים השונים בתמיסה, כך שייכנסו לתאים הדוליטל וגלאי הריכוז בנפרד. לזמן ההחזקה בפועל אין משמעות לניתוח למעט עד כמה הוא פותר את מיני החלבון. הכלים מכוילים בנפרד מהעמודה ואינם נשענים על תקני ייחוס. לפיכך, SEC-דוליטל נחשב שיטת ' מוחלטים ' לקביעת MW של משוואות פיזיות בסיסיות. אם המדגם הוא הטרוגנית ולא מופרדים לחלוטין על ידי העמודה, אז את הערך המסופק על כל אמצעי האחסון משקל יהיה ממוצע המשקל של המולקולות בכל אמצעי אחסון מופרסים הזורם דרך תא הזרימה לכל פרוסת זמן, כ 75 μL.
על ידי ניתוח של וריאציה זוויתי של עוצמת פיזור, דוליטל יכול גם לקבוע את גודל (השורש-ממוצע רדיוס, Rg) של קרו ו חלקיקים עם רדיוס גיאומטרי גדול יותר מאשר 12.5 ננומטר29. עבור מינים קטנים יותר כגון חלבונים monomeric ו oligomers, פיזור אור דינמי (DLS) מודול ניתן להוסיף למכשיר דוליטל כדי למדוד רדיודינמיקה הידרודינמית מ 0.5 ננומטר ומעלה33.
בעוד או UV או בניתוח הריכוז dRI עשוי לספק את הערך של c ב Eq .1, השימוש dri הוא המועדף על שתי סיבות: 1) dRI הוא גלאי ריכוז אוניברסלי, מתאים ניתוח מולקולות כגון סוכרים או פוליסכרידים שאינם מכילים UV כרומפור34; ו 2) את תגובת הריכוז dn/dc של כמעט כל החלבונים טהור במאגר מימית הוא זהה בתוך אחד או שניים אחוזים (0.185 mL/g)35, כך שאין צורך לדעת את מקדם הכחדה UV.
השימוש ב-SEC-דוליטל בחקר החלבונים הוא נרחב למדי. בהרבה היישומים הנפוצים ביותר הם לבסס אם חלבון מטוהר הוא monomeric או oligomeric ואת מידת oligomeriזציה, והערכת אגרגטים3,10,11,17, 31,36,37,38. את היכולת לעשות זאת עבור חלבונים ממברנה הקרום מסיסות, כי לא ניתן לאפיין את האמצעים המסורתיים הוא היקר במיוחד, ופרוטוקולים מפורטים עבור זה פורסמו31,39,40 , 41 , 42 , 43. יישומים נפוצים אחרים כוללים את מידת השינוי הפוסט-טרנסליטיות והפולידיזטיות של גליקופרוטאין, ליפופרוטאינים ושערי מעלה דומים4,31,44 , 45 , 46 , 47; היווצרות (או העדר) ו סטויכיומטריה מוחלטים (בניגוד ליחס סטויכולמטרי) של הטרוקומפלקסי כולל חלבון חלבון, חלבון-גרעין חומצות וחלבון-מתחמים רב-סוכר24,46, 48,49,50,51,52; קביעת שיווי האיזון של המונומר-דימר קבוע49,53,54; והערכת מערך חלבון55,56. מעבר חלבונים, SEC-דוליטל הוא רב ערך לאפיון של פפטידים57,58, פולימרים טבעיים הטרוגנית בהרחבה כגון heparins59 ו chitosans60,61, קטן וירוסים62 ורוב סוגי פולימרים סינתטיים או מעובד63,64,65,66. ניתן למצוא ביבליוגרפיה נרחבת בספרות67 ובאינטרנט (ב-http://www.wyatt.com/bibliography).
כאן, אנו מציגים פרוטוקול סטנדרטי להפעלה וניתוח של ניסוי של SEC-דוליטל. סרום (BSA) מוצג כדוגמה להפרדה ולאפיון של מונומרים ואולימרים חלבון. פרוטוקול BSA קובע קבועי מערכת מסוימים המשמשים כבסיס לניתוח נוסף של שניה-דוליטל, כולל אלה של מכלולי מערכות, גליקורופונים וחלבונים ממברנות מאוגדים.
אנו מודעים לכך ש-SEC-דוליטל עשוי להתבצע באמצעות כרומטוגרפיה נוזלית בעלת ביצועים גבוהים (בדיקות) או מהירות כרומטוגרפיה נוזלית של חלבון (FPLC) מספקים רבים. פרוטוקול זה מתאר את השימוש במערכת FPLC הנפוצה במעבדות היוצרות חלבונים למחקר ופיתוח (ראו טבלת חומרים). לפני הפעלת הפרוטוקול, מערכת FPLC, דוליטל ו-dRI גלאי צריך להיות מותקן, יחד עם חבילות תוכנה בהתאמה שלהם עבור שליטה, רכישת נתונים וניתוח לכל הוראות היצרנים וכל קבועי כיול המחויבים או הגדרות אחרות שהוזנו לתוכנה. מסנן מוטבע צריך להיות ממוקם בין המשאבה ומזרק עם הידרופיפילית, ממברנה הנקבוביות 0.1 יקרומטר מותקן.
Protocol
1. הכנת המערכת
- חבר את גלאי דוליטל ו-dRI במורד הזרם של גלאי UV של FPLC. לעקוף את גלאי pH ומוליכות מאז הם יוסיפו נפח משמעותי בין גלאי UV ו דוליטל. השימוש צינורות קפילר של 0.25 מ ל זיהוי מתוך הטור אל ובין הגלאים, ו 0.75 מילימטר הקפילר אבובים על הפלט של גלאי כדי לבזבז או השבר אספן.
- ודא שחיבורי האותות הנחוצים בין ה-FPLC והגלאים הוקמו, כולל פלט אנלוגי מגלאי ה-UV לקלט אנלוגי דוליטל, ופלט דיגיטלי מ-FPLC ל-דוליטל Autoinject, באמצעות תיבת הקלט/פלט של FPLC.
- התקן את עמודת השניות האנליטית המתאימה המכסה טווח משבר של לפחות 20 kDa עד 500 kDa. בדוק את פרטי המוצר כדי לקבוע אם העמודה מתאימה לטווח של MW, pH ומאפיינים אחרים של הדגם והשלב הנייד.
2. הכנת מאגר, מועך את המערכת לילה ובדיקת ניקיון
- שימוש בריאגנטים לציון, להכין 1 L של פוספט מאגור מלוחים עם 50-100 מ"מ הנאל. לסנן את המאגר כדי 0.1 יקרומטר באמצעות מסנן פוליאטר sulfone העליון בקבוק או דומה. מסננים את 50-100 mL הראשון של מאגר לבקבוק פסולת ולהשליך, כדי למנוע חלקיקים מן המסננים היבשים, ולאחר מכן לסנן את השארית לבקבוק נקי, סטרילי כי כבר שטף ביסודיות עם מסוננים, מים מוכי הכתיר למנוע אבק מלהיכנס
הערה: ממיסים שלב ניידים אחרים כגון מאגר טריס ניתן להשתמש אם חלבונים נוספים כי הם מעדיפים מומס אלה ממיסים הם להיות מנותח. - ריקון לילה בקצב זרימה של 0.5 mL/min, או מומלץ אחרת על ידי יצרן העמודה, כדי לספק את העמודה במאגר ולהסיר חלקיקים. השתמש במצב הזרימה הרציפה של fplc וודא שזרימת הזרם אינה מפסיקה עד להשלמת כל הפעלת ה-SEC-דוליטל.
- הצב את תא הזרימה dRI במצב ניקוי במהלך הריקון לילה. כבה את הניקוי לפני הפעלת המדגם.
- כאשר מתחילים את הסומק, השיפוע בהדרגה את קצב הזרימה כדי למנוע "שפיכת עמודה" אפקט (או שחרור של חלקיקים) הנגרמת על ידי שינוי פתאומי של לחץ בעמודה.
- אם המערכת ידועה לחלוטין יציב ונטול חלקיקים, ובשיווי משקל עם השלב הנייד הרצוי, להחליף את הסומק לילה עם קצר, 2-3 h סומק.
- בדוק את ניקיון המערכת על ידי הקשה בקלות על אבובים במורד הטור לשחרר חלקיקים שהצטברו והתבוננות האות 90 ° גלאי על התצוגה הקדמית של המכשיר דוליטל. ודא כי רעש שיא לשיא הוא לא יותר מ 50-100 μV.
- לבצע הזרקה "ריק" כדי לוודא כי מזרק נקי של חלקיקים. "ריק" הוא פשוט מאגר פועל, מוכן בבקבוקון טרי, סטרילי.
- אם שיא החלקיקים הוא לא יותר מ 1 mL בנפח ולא יותר 5 mV מעל הבסיסית, אז המערכת מוכנה לדגימות. אחרת, לבצע זריקות ריקות נוספות עד נקי, או לבצע תחזוקה כדי לנקות את ההזרקה.
3. הכנת וטעינת המדגם
- הכן לפחות 200 μL של BSA ב-1-2 mg/mL במאגר SEC.
הערה: כדי למנוע משקעים, על BSA לא להיות מומס במים טהורים. - לסנן את החלבון עד 0.02 יקרומטר באמצעות מסנן מזרק-tip.
- התעלם מהטיפות הראשונות של פילטרט כדי למנוע חלקיקים מהמסננים היבשים.
- לחלופין, צנטריפוגה את המדגם ב 10,000 x g עבור 15 דקות כדי לאפשר משקעים של אגרגטים לא מסיסים וחלקיקים גדולים אחרים.
- הכנס 100 μL של פתרון BSA לתוך הלולאה.
הערה: מדובר בכמות החומר המומלצת, וניתן להזריק יותר או פחות בהתאם לנסיבות המדגם, כגון יציבות או זמינות. כמות החלבון הדרושה לכל זריקה משתנה במידה מולקולרית עם משקל מולקולרי-פי שניים ממסת החלבון הרבה יותר נדרשת אם המשקל המולקולרי הוא 33 kDa, או חצי מזה של BSA.
4. הכנת תוכנת דוליטל
- פתח חדש | התנסה משיטה בתפריט התוכנה דוליטל ובחר את השיטה המקוונת מהתיקיה ' שיטות מערכת פיזור אור '. אם קיים גלאי DLS, בחר את השיטה המקוונת מפיזור האור | באמצעות תיקיית QELS .
- במקטע התצורה , הגדר פרמטרים של הדוגמה והשלב הנייד.
- בתצוגת המשאבה הכללית , קבע את קצב הזרימה לשימוש ב-fplc.
- בתצוגת המשאבה הכללית , בענף הממס, בשדה שם , בחר באפשרות PBS.
- בתצוגת מזרק , בענף לדוגמה, הזן את השם כ- bsaוהגדר dn/dc = 0.185 (הערך הסטנדרטי עבור חלבונים שאינם מוגדרים כרגע), A2 = 0, ומקדם הכחדה של UV = 0.667 mL/(mg-cm).
הערה: עבור חלבונים אחרים, מקדם ההשמדה של UV280 ננומטר עשוי להימצא בספרות או מחושב מתוך הרצף שלה באמצעות כלים ציבוריים-דומיין שונים.
- במקטע ההליכים , תצוגת אוסף בסיסי , בחר בגורם המפעיל של תיבת הסימון באפשרות הכנסה אוטומטית והגדר את משך ההפעלה ל - 70 דקות כך שהנתונים ייאספו עבור כל הנתונים עד לקבלת נפח החדירות הכולל של ה-SEC עמודה מתמלאת.
הערה: כמות הזמן הנחוצה עשויה להשתנות עם קצב העמודים והזרימה-35 דקות של אוסף נדרשות עבור תקן של 7.8 mm x 300 מ"מ מסוג המנה-שניה ב0.5 mL/min. - הפעל את הניסוי בתוכנת דוליטל על-ידי לחיצה על לחצן הפעלה. זה יתחיל לקרוא את הנתונים לאחר קבלת אות הדופק ממכשיר FPLC דרך גלאי דוליטל.
- אפס את האות dRI על-ידי לחיצה על לחצן Autozero בלוח הקדמי של המכשיר.
5. הכנת תוכנת FPLC
- הכנס את שם החלבון ואת ההפעלה בתוכנת FPLC, באופן ידני | בצע הוראות ידניות | . הגדר סימן
- החלף את שסתום ההזרקה מטעינה ידנית כדי להזריק תחת נתיב זרימה | . שסתום הזרקה
- כלול אות פעימה על-ידי הוספת פעימה של 0.5 מתחת לתיבת I/O | . הדופק הדיגיטלי החוצה פעולה זו תפעיל את איסוף הנתונים בתוכנת דוליטל.
6. הכנס את המדגם ללולאה. לחץ על ביצוע בתוכנת FPLC כדי להפעיל את הניסוי.
7. ניתוח נתונים של SEC-דוליטל BSA
- בצע ניתוח, צעד אחר צעד, תחת סעיף ההליכים בתוכנת דוליטל.
- ודא שפסגות מופיעות, בקירוב אותו אמצעי האחסון ב-UV, דוליטל ו-RI, על -ידי בדיקת תצוגת האוסף הבסיסי.
- בתצוגה בסיסית , הגדר תוכנית בסיסית עבור כל האותות (כל גלאי LS, UV ו-dRI). יש להגדיר את התוכניות הבסיסיות כדי לציין את רמת הממס הטהורה, העדיפה מתיחה מצד אחד של פסגות המדגם לאחר.
- בתצוגת פסגות , להגדיר את הפסגות להיות מנותח על ידי לחיצה וגרירה של העכבר. בחר במרכז 50% של כל פסגה. בחר תחילה את פסגת המונומר (' שיא 1 ') ולאחר מכן את הפסגה דיימר (' שיא 2 '). בדוק את הערכים הנכונים של dn/dc = 0.185 ו-UV 280 מקדם הכחדה ננומטר = 0.667 עבור bsa תחת כל שיא.
- ביצוע יישור שיא, תיקון הרחבת הרצועות ותהליכי נורמליזציה.
הערה: בדרך כלל, שיטת SEC-דוליטל מכוילים מעת לעת ליישור השיא, הרחבת הלהקה ונורמליזציה של הגלאים הפינתיים לגלאי ה-90 ° באמצעות חלבון חד-ממדי עם רדיוס של מ< 10 ננומטר כגון bsa מונומר. בדוגמה זו, BSA משמש גם כמולקולה הכיול והוא עצמו הנושא של ניתוח MW.- בהליכים | תצוגת יישור , בחר את האזור המרכזי של הפסגות על-ידי לחיצה וגרירה של העכבר, לחץ על ישר אותות ולאחר מכן על אישור.
- בהליכים | תצוגת הרחבת הרצועה, בחרו במרכז 50% מפסגת המונעומר. ודא שגלאי ה-RI מצוין ככלי העזר, ולאחר מכן לחץ על בצע התאמה ולאחר מכן החל על התאם אותות UV ו-LS לאות RI.
- התקרבות אל הפסגות כדי לוודא שהן חופפות באופן מאוד מקרוב בתוך המרכז 50-70%, ולאחר מכן לחץ על אישור.
- אם החפיפה אינה מושלמת, (ייתכן שיהיה צורך בכך) לבצע את ההתאמה ואת ' החל ' פעם אחת או פעמיים, עד שחפיפת החפיפה תהיה מצוינת.
- בהליכים | תצוגת נורמליזציה , בחר באפשרות ' מרב 1 ', הזן 3.0 nm כערך Rg , לחץ על הלחצן ' נרמל '.
- בהליכים | מיסה טוחנת ו Rg מ דוליטל , לסקור את הנתונים כדי לקבוע אילו, אם בכלל, זוויות זיהוי צריך להיות מסומנת מהניתוח עקב רעש מוגזם. בדרך כלל, אלה יהיו הזוויות הנמוכות שבהן חלקיקי האבק מפזרים עוצמה גבוהה יחסית. בחרו פרוסות בודדות בתוך הפסגות מהגרף שמשמאל והצג את התלות הזוויתית של היחס ההופכי של ריילי מופחת בגרף שמשמאל. אם הזוויות הנמוכות ביותר (ולעיתים הגבוהות ביותר) מסטות מאוד מההתאמה, בטלו את הבחירה בהן מהרשימה שבתחתית התצוגה.
- הצג את גרף התוצאות בתצוגה Easi graph . בחר מאסה טוחנת מתוך הרשימה הנפתחת של הצג בחלק העליון של החלון. השתמש ב-Ctrl + לחיצה וגרור כדי להגדיל את התצוגה באזור השיא.
- הצג את התוצאות הסופיות של המסה הסופית במשקל טוחנת עבור המונמר ופסגות דיימר בתוצאות | תצוגת דוח (תקציר) תחת תוצאות שיא | רגעים המוניים מולרי (ג'/מול) | . בסדר, מגוואט הטוהר מדווח תחת תוצאות שיא | שבר מסה (%)
הערה: רגעים אחרים של המוני הטוחנת מוצגים גם הם; אלה רלוונטיים בדרך כלל לפולימרים הטרוגנית, אך לא לחלבונים בעלי גדלים בדידים. תוצאות רבות אחרות המיוצרים על ידי התוכנה ניתן לכלול בדוח כגון התאוששות אחוז המוני (שבריר של חלבון שהתחמק דרך גלאי הריכוז ביחס לסכום הוזרק), הסטטיסטיקות שיא, פולידיפיטיות, Rg ו Rh רגעים, וכו '. כאשר היא מסופקת, מידות חוסר הוודאות משקפות את הדיוק של הערך שצוטט על בסיס הרעש בתוך סדרת המדידה ואין להתייחס אליה כמייצג את הדיוק. הדיוק האמיתי של הערכים המדווחים תלוי בגורמים שונים כגון הדיוק של ערכי dn/dc ומקדם הכחדה, כיול כלי מכשירים וכו '. - בתפריט קובץ , בחר שמירה כפעולת שירות ושמור את נתוני bsa שנותחו כשיטה סטנדרטית עבור מדידות עתידיות של כל סוגי החלבונים. הנורמליזציה ופרמטרי הרחבת הרצועה הנקבעים עבור BSA, ייסחבו בניתוח.
תוצאות
איור 1a, b להראות כי שלושה צורות oligomeric של bsa: מונומר, דיימר ו trimer, היו מופרדים היטב על הטור הנקבובית 200 Å עם הרזולוציה הבסיסית של מונומר ו דיימר, בעוד איור 2a מראה כי הפרדה בעמודה 75 Å הנקבובית לא השיג החלטה טובה של מונומר-דימר. הדוגמא האחרונה נכללה בכדי להמחיש תוצאה "עלובה"; הבדלים אלה בהפרדה בין שתי העמודות עשויים, למעשה, להיות צפויים בהתאם לטווחי ההפרדה האמורים של היצרן. הטרימר אינו מופרד לחלוטין מהדימר והאולימרים הגבוהים אינם מופרדים היטב מהטרימר ומהשני. איור 2b הוא דוגמה לאות פיזור אור רועש עם חלקיקים הנמצאים ברחבי כרומואטוגרם, אשר מונע הגדרה מדויקת של MW.
מעתה ואילך אנו מתמקדים באיור 1b. המונומר, אשר חומק ב 13.8 mL, מציג משקל ממוצע טוחנת המסה Mw של 64.1 ± 0.4 kda נקבע על ידי דוליטל ו הידרודינמי רדיוס Rh של 3.54 ± 0.01 nm. תוצאות אלה הם בהסכם עם המסה רצף ומוכר רדיוס הידרודינמי של bsa, 66.4 kda ו 3.5 nm בהתאמה68, כדי בתוך הדיוק הרגיל של שניה-דוליטל, 5%3,69. Dimer, אשר חומק על 12 mL, הציגו ערך Mw של 127 ± 1 kda נקבע על ידי דוליטל-כצפוי, פעמיים זה של המונומר בתוך דיוק ניסיוני-ו Rh של 5.68 ± 0.06 nm. פסגת trimer נצפתה גם ב 11 מ ל עם Mw של 194 ± 9 kda נקבע על ידי דוליטל, פי שלוש של המונומר בתוך דיוק ניסיוני, כצפוי. ר h של trimer לא יכול להיקבע בשל האינטנסיביות הנמוכה של האות DLS.
נקודות המסה הטוחנת שחושבו על פני פסגת המונומר הן אחידה לתוך 2-5%, ומציינות הומוגניות. זה לא יוצא דופן למצוא כתף נגרר עם מיסה טוחנת בטווח של 38-50 kDa, המתאים שברי BSA70. המסה הטוחנת מעבר לdimeric ולפסגות הtrimeric לא אחיד, מעיד על טרוגניות. הפסגה דיימר הוא הטרוגנית במקצת עקב עקבות של trimer כי דימום לתוך שיא דיימר, ואת השיא trimer הוא הטרוגנית בשל הימנעות מתוך שיתוף גרוע יותר oligomers גבוה.
האות לרעש של שיא המונומר הוא מקובל למדי בכל שלושת האותות, מעל 100:1, כמו שיא דיימר עם האות אל הרעש של 40:1. אזורים chromatogram מעבר לפסגות החלבון הם שטוחים, עם חריגים של שיא בשל החלקיקים ליד כולל הוצאה לאור (void) בעקבות LS ו (חיובית) המלח שיא ו (שלילי) מומס האוויר השיא במעקב dRI, ליד החדירות הכולל אמצעי אחסון. אלה מצביעים באיור 1a.
ניתן לחשב את רמת הטוהר גם בניסוי SEC-דוליטל: שבר מסה של פסגת monomeric בדו ח מייצג את אחוז הטוהר של הטופס monomeric. עבור BSA monomer, הטוהר מחושב הוא 88%.
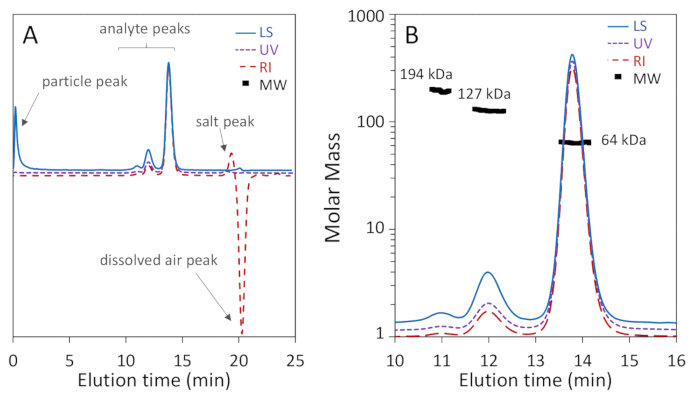
איור 1 : שניה-דוליטל ניתוח של אלבומין סרום של שור (BSA) באמצעות 200 Å בגודל של הנקבובית עמודה-הדרה. עקבות כרומאטוגרמה מנורמלות לפסגת המונומר ולהסטה לבהירות. (א) חפצים משותפים שניתן להתעלם מהם מצביעים, כולל פסגת חלקיקים ליד תחילת האות פיזור האור, כמו גם מלח ופסגות מומס אוויר ליד נפח החדירות הכולל באות מדד השבירה. (ב) הכרוטוגרמה מציגה הפרדה מצוינת של מונומר-דימר-טריימר ואות פיזור האור מציג אות-לרעש גבוה. ערכי המונומר ודימר MW מציגים הומוגניות גבוהה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
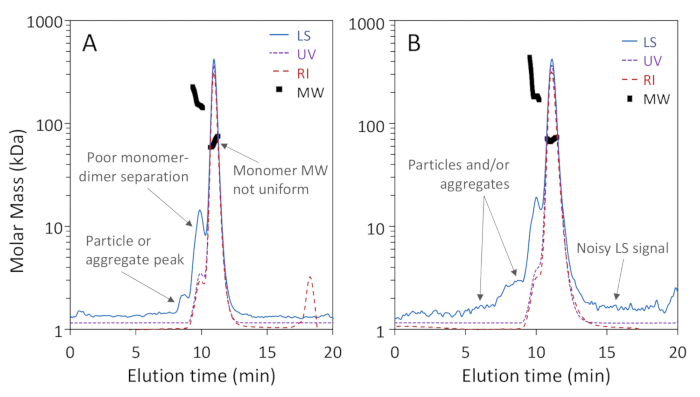
איור 2 : דוגמאות לניתוחי שניה-דוליטל באיכות נמוכה. עקבות כרומאטוגרמה מנורמלות לפסגת המונומר ולהסטה לבהירות. (א) הפרדה מספקת על טור הדרה 75 Å בגודל של נקבובית; שיא חלקיק בין 8-9 דקות אינו מופרד היטב מן החלבונים. (ב) יחס אות לרעש לקוי וחלקיקים נרחבים הסמוכים לחלבונים גלויים באות פיזור האור (LS). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
הניסוי SEC-דוליטל סיפק הפרדה טובה של המונומר, דימר וטרימר, ותוצאות כמותיים להמונים הטוחנת ולמידות ההידרודינמיות של כל פסגה. זה בתורו מזהה בבירור ומאפיין כל מין נוכח, כמו גם לכמת את הטוהר. בדרך כלל התוצאות שהתקבלו מדויקות בתוך 5%, ומדויק לשחזור בתוך 1-2%3,69. רמה זו של דיוק ויכולת החזרה מאפשרת להבחין בביטחון בין מינים שעשויים להיות קרובים ב-MW, כל עוד הם מופרדים על-ידי SEC (עשוי לחפוף חלקית בתוך אותה הפסגה). היתרונות לבקרת איכות החלבונים ואפיון הביופיזיקלי היסודיים גלויים לעין.
אימות העדר החלקיקים חשוב למדי עבור מדידות רגישות, לשחזור שניה-דוליטל. פסגות חלקיקים מופיעים בדרך כלל כאותות דוליטל גדולים ליווי על-ידי אותות UV או RI דומים. השלב הנייד והמדגם צריך להיות מוכן בקפידה כדי לחסל חלקיקים כאלה. שימוש בטיפול בחומרים ריאגנטים או טוב יותר, סינון של שלב נייד ודילול מאגר כדי 0.1-0.2 יקרומטר (טרום שטיפת הפילטר כדי למנוע חלקיקים שנמצאים תמיד על הקרומים היבשים), תחזוקה של בקבוקי השלב הנייד הנקי במיוחד וכלי זכוכית אחרים עבור SEC-דוליטל ומרחיב טור מורחב תחת זרימה (כדי להסיר חלקיקים ואגרגטים שייתכן שהצטברו כאשר זרם הופסק או עמודה לא בשימוש) מומלצים כולם. המדגם צריך להיות מסונן לגודל הנקבוביות הקטן ביותר שאינו מסיר את החומר המעניין, בדרך כלל לא גדול יותר 0.1 יקרומטר, ובמידת האפשר, 0.02 יקרומטר. אם המסנן מקבל את הקבקבים במהירות, המדגם עשוי להיות centrifuged, מסונן בשלבים של גודל נקבובית יורד ו/או מטוהר מחדש. כאשר מערכות מתוחזקים בעקביות עם באיכות גבוהה, טרי ומסונן השלב הנייד, הזעזועים טור מנועים, דגימות נקיות לא לדבוק בעמודה, המידות לא יציג את הרעש חלקיקים לעיל יספק נתונים באיכות גבוהה.
דוליטל הוא אגנוסטי מאגרי שניה טיפוסיים עבור חלבונים; מערכות רבות אחרות מאגר מלבד PBS ניתן להשתמש כדי לייעל הפרדה ויציבות, כולל מגוון של ילוי71. דוליטל הוא גם אגנוסטי לעמודה הספציפית, אשר יש לבחור להפרדה אופטימלית והתאוששות. החששות העיקריים של ילוי לגבי הניתוח הם שינויים משמעותיים במדד השבירה, המוביל לשינוי של מדד השבירה הספציפי להגדיל dn/dc, ו ילוי כי לקלוט 280 ננומטר כאשר הניתוח UV נדרש. לדוגמה, ארגינין הוא מצבור שכיח לצמצום excipient כי יכול להשפיע באופן דרמטי את dn/dc של חלבון אופייני, אפילו להביא אותו למשטר שלילי (חלבון עם dn שלילית /dc יכול עדיין להיות מנותח על ידי שניה-דוליטל if dn/ dc נקבע במידה מדעית, אך אם dn/dc = 0 עוצמת האור המבוזרת על-ידי החלבון תהיה NULL וניתוח MW יהיה בלתי אפשרי). הנושא של ערכי dn/dc עבור חלבונים נדון בהרחבה על-ידי ז'או ואח '35 היכן שהוא מראה כי עבור מאגרים סטנדרטיים מימית, הרוב המכריע של חלבונים שלא התבצעה שינה בתוך 2-3% הערך הסטנדרטי (0.185 או 0.186 mL/g ב = 660 nm) , למרות חלבונים מתחת ~ 10 kDa הם משתנים יותר, ויש כמה זנים שיכולים ללכת גבוה כמו 0.21 mL/g.
פרופילי ה-MW בנתונים המוצגים הינם הומוגניות לחלוטין בתוך 2% או פחות, המציינים מינים חד-מונטניים. ערכי MW שאינם אחידים לאורך שיא עשויים לנבוע מניתוח טרוגניות או לא תקין. במיוחד, פרופיל BSA MW שהוא קמור (' חיוך ') או קמור (' grimace ייס ') עלול לגרום לא להחיל בצורה נכונה את תיקון הרחבת הרצועות. עבור חלבונים אחרים, פרופיל קמור עשוי לנבוע גם משיווי משקל דינאמי בין ונומרים ו-oligomers, שם היחס של המונומר לאולימר-ומכאן ערך MW לכאורה-תלוי בריכוז שיא (bsa אינו מפגין התנהגות זו והוא משמש לעתים קרובות כדוגמת בקרה כדי לאמת פרמטרים נכונים של הרחבת הרצועות). פרופיל MW המשתנה מהקצה המוביל לקצה הנגרר ואינו משתנה באמצעות ריכוז לדוגמה, אופייני להפצת מינים מולקולריים שנפתרו באופן חלקי על-ידי SEC. שיווי משקל דינאמי מתבלט בקלות מהשני מקורות של הפצות בלתי הומוגנית כנראה על ידי הזרקת כמויות מוחלטת של חלבון שונים-ההתפלגות תשתנה עם שיווי משקל דינאמי אך לא עם התפלגות קבועה או תיקון הרחבת הלהקה שגויה.
בהינתן האילוצים המתוארים לעיל, SEC-דוליטל אינו מתאים למשימות שונות. היא אינה מתאימה לניתוח של דגימות גולמי; הדגימות צריכות להיות מטוהרים היטב על ידי שיטות זיקה וליטוש סטנדרטיות. אין לו דיוק מספיק או לפתור את הכוח כדי לזהות מוטציות ומשתנים של חלבון או mAb עם המסה זהה או קרוב מאוד, ולא ניתן להשתמש עם אנליטים שאינם מופרדים או נפרד על עמודת SEC, אם כי לאחרונה הוכח כי יון-exchang e או בשלב הפוך כרומטוגרפיה ניתן לשלב עם דוליטל להפריד ולאפיין מינים שאינם נפתרים על ידי שניה72,73,74. כאשר כמויות חלבונים הם מוגבל באופן חמור, SEC-דוליטל יכול להיות לא ריאלי מאז זה בדרך כלל דורש 10-200 μg3 ואפילו יותר עשוי להידרש על ידי מערכת fplc עם הקוטר הפנימי של אבובים גדול מ 0.25 מ"מ; עם זאת, ניתן לנתח כמויות קטנות יותר על-ידי UHPLC-SEC-דוליטל. חלבונים בלתי יציבים מאוד כי לצבור בעת המבוא לשלב הנייד אינם מתאימים לניתוח SEC-דוליטל, למרות אופטימיזציה מאגר באמצעות פיזור אור דינמי בלתי מקוון עלול להתגבר על בעיה זו75.
למרות המאמץ הנוסף ש-SEC-דוליטל מבקש, הוא רב-ערך לחקר החלבונים ומשמש בהרחבה על ידי הקהילות האקדמיות והביופרמקולוגיה. בנוסף לאפיון של monomers, oligomers ואגרגטים כפי שמתואר בפרוטוקול לעיל, SEC-דוליטל יכול לאפיין חלבונים שהשתנו כגון גליקורופטנס (קביעת מגוואט של החלבון ו גליקן רכיבים בנפרד), מפעילי-או השומנים-מסיסות חלבונים ממברנה (קביעת מגוואט של החלבון ו מסיסות רכיבים בנפרד), חלבון הרכבות כגון חלקיקים כמו וירוס, חלבונים חלבון חלבון חלבון-גרעין מכלולי חומצות, פוליסכרידים, . פפטידים וbiomacromolecules רבים אחרים
Disclosures
DS הוא עובד של חברת ויאט טכנולוגיה, אשר מוצרי דוליטל מנוצלים בפרוטוקול זה. AT הוא עובד של Danyel ביוטכנולוגיה, מפיץ של וויאט דוליטל ו AKTA FPLC מכשירים.
Acknowledgements
אנו מודים לד ר צחי דניאלי (מרכז וולפסון לביולוגיה מבנית יישומית, האוניברסיטה העברית) לייעוץ ושיתופי פעולה. אנחנו גם מודים לדניאל ביוטכנולוגיה בע מ (רחובות, ישראל) לסיוע ולהקמת מערכת FPLC אנליטית-דוליטל מנוצל במחקר זה.
Materials
| Name | Company | Catalog Number | Comments |
| AKTA pure | GE Healthcare | 29-0182-26 | fast protein liquid chromatograph (FPLC) |
| AKTA UNICORN | GE Healthcare | FPLC control software | |
| ASTRA | Wyatt Technology | MALS data acquisition and analysis software | |
| Bovine serum albumine (purity >97%) | Sigma | A1900 | analyte |
| DAWN or miniDAWN | Wyatt Technology | WH2 or WTREOS | multi-angle light scattering (MALS) detector |
| Increase 200 10/300 | GE Healthcare | size exclusion column, 200 Å pores, 10 mm i.d., 300 mm length | |
| Optilab | Wyatt Technology | WTREX | differential refractive index (RI) detector |
| Sodium chloride NaCl | Sigma | 71382 | HPLC grade NaCl |
| Stericup bottle top filter polyether sulfone 0.1 µm 1000 mL | Millipore | SCVPU11RE | mobile phase filter |
| Whatman Anotop 10 syringe filter 0.02 µm | GE Healthcare | 6809-1002 | sample filter |
| Whatman Anotop 10 syringe-tip filter, 0.1 µm pore, 10 mm diameter | GE Healthcare | 6809-1012 | sample filter |
| Whatman Anotop 25 syringe filter 0.1 µm | GE Healthcare | 6809-2012 | mobile phase filter |
| WyattQELS | Wyatt Technology | WIQ | dynamic light scattering detector |
References
- Acton, T. B., et al. Robotic cloning and Protein Production Platform of the Northeast Structural Genomics Consortium. Methods in Enzymology. 394, 210-243 (2005).
- Acton, T. B., et al. Preparation of protein samples for NMR structure, function, and small-molecule screening studies. Methods in Enzymology. 493, 21-60 (2011).
- Folta-Stogniew, E., Williams, K. R. Determination of molecular masses of proteins in solution: Implementation of an HPLC size exclusion chromatography and laser light scattering service in a core laboratory. Journal of Biomolecular Technology. 10 (2), 51-63 (1999).
- Kendrick, B. S., Kerwin, B. A., Chang, B. S., Philo, J. S. Online size-exclusion high-performance liquid chromatography light scattering and differential refractometry methods to determine degree of polymer conjugation to proteins and protein-protein or protein-ligand association states. Analytical Biochemistry. 299 (2), 136-146 (2001).
- Hughes, C. S., Longo, E., Phillips-Jones, M. K., Hussain, R. Quality control and biophysical characterisation data of. Data Brief. 14, 41-47 (2017).
- Muthurajan, U., et al. In Vitro Chromatin Assembly: Strategies and Quality Control. Methods in Enzymology. 573, 3-41 (2016).
- P4EU. . Protein Quality Standard PQS. , (2019).
- Arbre Mobieu. . Guidelines on Protein Quality Control. , (2019).
- Bowman, A., et al. The histone chaperones Vps75 and Nap1 form ring-like, tetrameric structures in solution. Nucleic Acids Research. 42 (9), 6038-6051 (2014).
- Bowman, G. R., et al. Oligomerization and higher-order assembly contribute to sub-cellular localization of a bacterial scaffold. Molecular Microbiology. 90 (4), 776-795 (2013).
- Folta-Stogniew, E. Oligomeric states of proteins determined by size-exclusion chromatography coupled with light scattering, absorbance, and refractive index detectors. Methods in Molecular Biology. 328, 97-112 (2006).
- Vieux, E. F., Wohlever, M. L., Chen, J. Z., Sauer, R. T., Baker, T. A. Distinct quaternary structures of the AAA+ Lon protease control substrate degradation. Proceedings of the National Academy of Sciences of the United States of America. 110 (22), E2002-E2008 (2013).
- Group, N.S.. . use of SEC-MALS in crystallization QC. , (2018).
- Ahrer, K., Buchacher, A., Iberer, G., Josic, D., Jungbauer, A. Analysis of aggregates of human immunoglobulin G using size-exclusion chromatography, static and dynamic light scattering. Journal of Chromatography A. 1009 (1-2), 89-96 (2003).
- Narhi, L. O., Schmit, J., Bechtold-Peters, K., Sharma, D. Classification of protein aggregates. Journal of Pharmaceutical Sciences. 101 (2), 493-498 (2012).
- Spiess, C., et al. Bispecific antibodies with natural architecture produced by co-culture of bacteria expressing two distinct half-antibodies. Nature Biotechnology. 31 (8), 753-758 (2013).
- Philo, J. S. A critical review of methods for size characterization of non-particulate protein aggregates. Current Pharmaceutical Biotechnology. 10 (4), 359-372 (2009).
- Stellwagen, E. Gel filtration. Methods in Enzymology. 463, 373-385 (2009).
- Burgess, R. R. A brief practical review of size exclusion chromatography: Rules of thumb, limitations, and troubleshooting. Protein Expression and Purification. 150, 81-85 (2018).
- Striegel, A. M., Yau, W. W., Kirkland, J. J., Bly, D. D. . Modern Size-Exclusion Liquid Chromatography. , (2009).
- GE Healthcare. . Size Exclusion Chromatography: Principles and Methods. , (2014).
- Uliyanchenko, E. Size-exclusion chromatography-from high-performance to ultra-performance. Analytical and Bioanalytical Chemistry. 406 (25), 6087-6094 (2014).
- Dunker, A. K., Silman, I., Uversky, V. N., Sussman, J. L. Function and structure of inherently disordered proteins. Current Opinion in Structural Biology. 18 (6), 756-764 (2008).
- Hsiao, H. H., Nath, A., Lin, C. Y., Folta-Stogniew, E. J., Rhoades, E., Braddock, D. T. Quantitative characterization of the interactions among c-myc transcriptional regulators FUSE, FBP, and FIR. Biochemistry. 49 (22), 4620-4634 (2010).
- Hayashi, Y., Takagi, T., Maezawa, S., Matsui, H. Molecular weights of alpha beta-protomeric and oligomeric units of soluble (Na+, K+)-ATPase determined by low-angle laser light scattering after high-performance gel chromatography. Biochimica et Biophysica Acta. 748 (2), 153-167 (1983).
- Folta-Stogniew, E. J. Macromolecular Interactions: Light Scattering. Encyclopedia of Life Sciences. , (2009).
- Hong, P., Koza, S., Bouvier, E. S. P. Size-Exclusion Chromatography for the Analysis of Protein Biotherapeutics and their Aggregates. Journal of Liquid Chromatography and Related Technology. 35 (20), 2923-2950 (2012).
- Chakrabarti, A. Separation of Monoclonal Antibodies by Analytical Size Exclusion Chromatography. Antibody Engineering. , (2018).
- Wyatt, P. J. Light scattering and the absolute characterization of macromolecules. Analytica Chimica Acta. 272, (1993).
- Takagi, T. Application of low-angle laser light scattering detection in the field of biochemistry: review of recent progress. Journal of Chromatography A. 506, 51-63 (1990).
- Wen, J., Arakawa, T., Philo, J. S. Size-exclusion chromatography with on-line light-scattering, absorbance, and refractive index detectors for studying proteins and their interactions. Analytical Biochemistry. 240 (2), 155-166 (1996).
- Mogridge, J. Using light scattering to determine the stoichiometry of protein complexes. Methods in Molecular Biology. 1278, 233-238 (2015).
- Larkin, M., Wyatt, P. J. Light-Scattering Techniques and their Application to Formulation and Aggregation Concerns. Formulation and Process Development Strategies for Manufacturing Biopharmaceuticals. , (2010).
- Wolfender, J. L. HPLC in Natural Product Analysis: The Detection Issue. Planta Medica. 75 (07), 719-734 (2009).
- Zhao, H., Brown, P. H., Schuck, P. On the distribution of protein refractive index increments. Biophysical Journal. 100, (2011).
- Serebryany, E., Folta-Stogniew, E., Liu, J., Yan, E. C. Homodimerization enhances both sensitivity and dynamic range of the ligand-binding domain of type 1 metabotropic glutamate receptor. FEBS Letters. 590 (23), 4308-4317 (2016).
- Arakawa, T., Wen, J. Size-exclusion chromatography with on-line light scattering. Current Protocols in Protein Science. Chapter 20, Unit 20.6 (2001).
- Müller, R., et al. High-resolution structures of the IgM Fc domains reveal principles of its hexamer formation. Proceedings of the National Academy of Sciences. 110 (25), 10183-10188 (2013).
- Slotboom, D. J., Duurkens, R. H., Olieman, K., Erkens, G. B. Static light scattering to characterize membrane proteins in detergent solution. Methods. 46 (2), 73-82 (2008).
- Miercke, L. J., Robbins, R. A., Stroud, R. M. Tetra detector analysis of membrane proteins. Current Protocols in Protein Science. 77, 1-30 (2014).
- Gimpl, K., Klement, J., Keller, S. Characterising protein/detergent complexes by triple-detection size-exclusion chromatography. Biological Procedures Online. 18 (1), 4 (2016).
- Korepanova, A., Matayoshi, E. D. HPLC-SEC characterization of membrane protein-detergent complexes. Current Protocols in Protein Science. Chapter 29, 1-12 (2012).
- Roy, A., Breyton, C., Ebel, C. Analytical Ultracentrifugation and Size-Exclusion Chromatography Coupled with Light Scattering for Characterization of Membrane Proteins in Solution. Membrane Proteins Production for Structural Analysis. , (2014).
- Hastie, K. M., et al. Crystal structure of the prefusion surface glycoprotein of the prototypic arenavirus LCMV. Nature Structural & Molecular Biology. 23 (6), 513-521 (2016).
- Pallesen, J., et al. Structures of Ebola virus GP and sGP in complex with therapeutic antibodies. Nature Microbiology. 1 (9), 16128 (2016).
- Micoli, F., Adamo, R., Costantino, P. Protein Carriers for Glycoconjugate Vaccines: History, Selection Criteria, Characterization and New Trends. Molecules. 23 (6), (2018).
- Li, J., et al. Characterizing the Size and Composition of Saposin A Lipoprotein Picodiscs. Analytical Chemistry. 88 (19), 9524-9531 (2016).
- Crichlow, G. V., et al. Dimerization of FIR upon FUSE DNA binding suggests a mechanism of c-myc inhibition. EMBO Journal. 27 (1), 277-289 (2008).
- Kapoor, N., Gupta, R., Menon, S. T., Folta-Stogniew, E., Raleigh, D. P., Sakmar, T. P. Nucleobindin 1 is a calcium-regulated guanine nucleotide dissociation inhibitor of G{alpha}i1. Journal of Biological Chemistry. 285 (41), 31647-31660 (2010).
- Pirruccello, M., Swan, L. E., Folta-Stogniew, E., De Camilli, P. Recognition of the F&H motif by the Lowe syndrome protein OCRL. Nature Structural & Molecular Biology. 18 (7), 789-795 (2011).
- Lockyer, K., Gao, F., Derrick, J. P., Bolgiano, B. Structural correlates of carrier protein recognition in tetanus toxoid-conjugated bacterial polysaccharide vaccines. Vaccine. 33 (11), 1345-1352 (2015).
- Steinbach, T., Wurm, F. R. Degradable Polyphosphoester-Protein Conjugates: "PPEylation" of Proteins. Biomacromolecules. 17 (10), 3338-3346 (2016).
- Das, S., Stivison, E., Folta-Stogniew, E., Oliver, D. Reexamination of the role of the amino terminus of SecA in promoting its dimerization and functional state. Journal of Bacteriology. 190 (21), 7302-7307 (2008).
- Reshetnyak, A. V., et al. The strength and cooperativity of KIT ectodomain contacts determine normal ligand-dependent stimulation or oncogenic activation in cancer. Molecular Cell. 57 (1), 191-201 (2015).
- Zambelli, B., et al. a Chaperone in the Urease Assembly Process, Is an Intrinsically Unstructured GTPase That Specifically Binds Zn2+. Journal of Biological Chemistry. 280 (6), 4684-4695 (2005).
- Ren, X., et al. Hybrid Structural Model of the Complete Human ESCRT-0 Complex. Structure. 17 (3), 406-416 (2009).
- Moriarty, D. F., Fiorillo, C., Miller, C., Colón, W. A truncated peptide model of the mutant P61A FIS forms a stable dimer. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1774 (1), 78-85 (2007).
- la Garza, C. E., Miranda-Hernández, M. P., Acosta-Flores, L., Pérez, N. O., Flores-Ortiz, L. F., Medina-Rivero, E. Analysis of therapeutic proteins and peptides using multiangle light scattering coupled to ultra high performance liquid chromatography. Journal of Separation Science. 38 (9), 1537-1543 (2015).
- Beirne, J., Truchan, H., Rao, L. Development and qualification of a size exclusion chromatography coupled with multiangle light scattering method for molecular weight determination of unfractionated heparin. Analytical and Bioanalytical Chemistry. 399 (2), 717-725 (2011).
- Wang, W., et al. A new green technology for direct production of low molecular weight chitosan. Carbohydrate Polymers. 74 (1), 127-132 (2018).
- Kaderli, S., et al. A novel biocompatible hyaluronic acid-chitosan hybrid hydrogel for osteoarthrosis therapy. International Journal of Pharmaceutics. 483 (1-2), 158-168 (2015).
- Porterfield, J. Z., Zlotnick, A. A Simple and General Method for Determining the Protein and Nucleic Acid Content of Viruses by UV Absorbance. Virology. 407 (2), 281-288 (2010).
- Podzimek, S. The use of GPC coupled with a multiangle laser light scattering photometer for the characterization of polymers. On the determination of molecular weight, size and branching. Journal of Applied Polymer Science. 54 (1), 91-103 (1994).
- Podzimek, S., Vlcek, T., Johann, C. Characterization of branched polymers by size exclusion chromatography coupled with multiangle light scattering detector. I. Size exclusion chromatography elution behavior of branched polymers. Journal of Applied Polymer Science. 81 (7), 1588-1594 (2001).
- Podzimek, S. Importance of Multi-Angle Light Scattering in Polyolefin Characterization. Macromolecular Symposia. 330 (1), 81-91 (2013).
- Tarazona, M. P., Saiz, E. Combination of SEC/MALS experimental procedures and theoretical analysis for studying the solution properties of macromolecules. Journal of Biochemical and Biophysical Methods. 56 (1), 95-116 (2003).
- Minton, A. P. Recent applications of light scattering measurement in the biological and biopharmaceutical sciences. Analytical Biochemistry. 501, 4-22 (2016).
- Hirayama, K., Akashi, S., Furuya, M., Fukuhara, K. Rapid confirmation and revision of the primary structure of bovine serum albumin by ESIMS and frit-FAB LC/MS. Biochemical and Biophysical Research Communications. 173 (2), 639-646 (1990).
- Zhu, H., Ownby, D. W., Riggs, C. K., Nolasco, N. J., Stoops, J. K., Riggs, A. F. Assembly of the gigantic hemoglobin of the earthworm Lumbricus terrestris. Roles of subunit equilibria, non-globin linker chains, and valence of the heme iron. The Journal of biological chemistry. 271 (47), 30007-30021 (1996).
- Peters, T., Feldhoff, R. C. Fragments of bovine serum albumin produced by limited proteolysis. Isolation and characterization of tryptic fragments. Biochemistry. 14 (15), 3384-3391 (1975).
- Lebendiker, M., Danieli, T. Production of prone-to-aggregate proteins. FEBS Letters. 588 (2), 236-246 (2014).
- Amartely, H., Avraham, O., Friedler, A., Livnah, O., Lebendiker, M. Coupling Multi Angle Light Scattering to Ion Exchange chromatography (IEX-MALS) for protein characterization. Scientific Reports. 8 (1), 6907 (2018).
- Astafieva, I. V., Eberlein, G. A., John Wang, Y. Absolute on-line molecular mass analysis of basic fibroblast growth factor and its multimers by reversed-phase liquid chromatography with multi-angle laser light scattering detection. Journal of Chromatography A. 740 (2), 215-229 (1996).
- Onsberg, M., Øgendal, L. H., Jensen, M. L., Howells, L. B., Andersen, B., Bjerrum, M. J. Light scattering coupled with reversed phase chromatography to study protein self-association under separating conditions. Journal of Chromatography B. 938, 60-64 (2013).
- Kim, Y., et al. High-throughput protein purification and quality assessment for crystallization. Methods. 55 (1), 12-28 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved