Method Article
Boyutlar-dışlama kromatografi ile çok açılı ışık saçılmasına bağlı proteinlerin karakterizasyonu (SEC-,)
Bu Makalede
Özet
Bu protokol, proteinleri ve kompleksleri çözelti mutlak karakterize etmek için çok açılı ışık saçılma (SEC-,) ile boyut dışlama Kromatografi kombinasyonu açıklar. SEC-, saf proteinler, yerli oligomerler, heterokompleksleri ve glikoproteinler gibi değiştirilmiş proteinlerin molekül ağırlığını ve boyutunu belirler.
Özet
Çözümde proteinler ve protein-protein kompleksler moleküler ağırlığı belirlenmesi için yaygın olarak kullanılan analitik boyut-dışlama Kromatografi (SEC), moleküler tahmin etmek için analitin elüsyon hacmine dayanan bir göreli tekniktir Ağırlık. Protein globüler değil veya ideal olmayan sütun etkileşimleri giderse, protein standartlarına dayalı kalibrasyon eğrisi geçersiz ve elüsyon hacmine göre belirlenen moleküler ağırlık yanlıştır. Çok açılı ışık saçılma (Iler) temel fiziksel denklemlerden çözüm bir analitin moleküler ağırlığını belirleyen mutlak bir tekniktir. Bir ya da daha fazla protein türünün monomerler, yerli oligomerler veya agrega ve heterokompleksleri gibi çözümlerini karakterize etmek için, bir veya daha fazla proteinin analizini yapmak için çok yönlü, güvenilir bir araç teşkil eder. Ölçüm her bir elüsyon hacminde gerçekleştirildiği için, SEC-bir tepe homojen veya heterojen olup olmadığını belirleyebilir ve sabit moleküler ağırlık dağılımı ile dinamik denge arasında ayrım yapabilir. Glikoproteinler veya lipoproteinler gibi değiştirilmiş proteinlerin analizi veya deterjan-çözünen membran proteinleri gibi Konjugat da mümkündür. Bu nedenle, SEC-AKILER biyolojik veya biyoteknolojik araştırmalar için üretilen moleküllerin Biyofizik özelliklerini ve çözüm davranışlarını onaylamalıdır protein kimyager için kritik bir araçtır. Bu protokol, sn-erleri için moleküler ağırlığı ve saf protein monomerlerin ve agregaların boyutunu analiz eder. Elde edilen veriler, kompleksleri, glikoproteinler ve yüzeyfakan bağlı membran proteinlerinin de dahil olduğu daha fazla SEC-akleri analizleri için temel olarak hizmet vermektedir.
Giriş
Moleküler ağırlığı (MW) çözeltinin güvenilir Analizi Biomoleküler araştırma için gereklidir1,2,3,4. MW analizi, doğru proteinin üretildiğini ve daha fazla deney5,6' da kullanılmak üzere uygun olup olmadığını bilim adamını bilgilendirir. Protein araştırma ağları P4EU7 ve Arbre-Mobieu8web sitelerinde açıklandığı gibi, protein kalite kontrolü son ürünün saflığını değil, aynı zamanda Oligomerik devlet, homojenlik, kimlik, konformasyon, karakterize etmelidir yapı, post-çeviri değişiklikleri ve diğer özellikleri.
Non-denaturing çözüm MW ölçümü, sulu bir ortamda mevcut olan protein şeklini tanımlar, ister monomerik veya Oligomerik. Birçok protein için hedef monomerik formu üretmek için ise, diğerleri için belirli bir yerli oligomer biyolojik aktivite anahtarı9,10,11,12. Diğer oligomerler ve yerli olmayan agregalar istenmeyen ve kristal allography, nükleer manyetik rezonans (NMR) veya küçük açı X-ışını saçılma ile yapısal belirlenmesi kusurları yol açacaktır, yanı sıra işlevsel asder içinde eserler veya yanlışlıklar İzotermik titrasyon kalorimetri veya yüzey plasmon rezonansı ile bağlayıcı ölçmek2,13.
Monoklonal antikorlar (mAbs) gibi bioterapötik durumlarda, çözüm bazlı MW analizi, kalite kontrol ve ürün karakterizasyonu benzer bir amaçla hizmet vermektedir. Aşırı toplamları ve parçaları insan kullanımı için uygun olmayan kararsız bir ürünün göstergesidir. Düzenleyici ajanslar, sadece terapötik molekülü değil, aynı zamanda nihai üründe14,15,16,17' de mevcut olabilecek potansiyel parçalanmalar için de dikkatli niteliklere ihtiyaç duyar.
Protein MW analizi için en yaygın yöntemlerin bazıları sodyum Dodesil sülfat Poliakrilamid jel elektroforez (SDS-Page), kapiller Elektroforez (CE), yerli sayfa, kütle spektrometresi (MS), boyut-dışlama Kromatografi (SEC) ve analitik (AUC). Bunlar, sds-page, CE ve MS yerel eyalette gerçekleştirilmez ve genellikle oligomerler ve toplamalar ayrışma yol, bu nedenle yerli oligomer belirlemek için uygun değildir veya toplamları ölçülmesi. Yerel sayfa olsa da, teorik olarak, yerel durumu korumak, bizim deneyimimizde birçok protein için optimize etmek zordur, ve sonuçları çok güvenilir değildir. AUC, sedimentasyon hızı veya sedimentasyon dengesine göre, nicel ve ilk ilkelerden MW belirleyebilir, ancak oldukça hantal, çok manuel işçilik ve veri yorumlama önemli uzmanlık gerektiren, uzun deney süresi ve bir çok pahalı bir araçtır.
Analitik SEC, paketlenmiş bir sütundan akış sırasında makromolekülleri ayıran nicel ve nispeten sağlam, basit bir yöntemdir. Sn 'nin ilkeleri ve uygulamaları,18,19,20 ve el kitabında "boyut dışlama Kromatografi: ilkeler ve Yöntemler"21' de çeşitli incelemeler sunulmaktadır. Saklama farklılıkları, sütunun sonundan itibaren çıkmadan önce sabit fazda gözenekleri içine ve dışına diffelik harcanan zaman farklı miktarlarda kaynaklanmaktadır. Farklılıklar, moleküllerin göreli boyutları ve difüzyon katsayıları22' den (nominally) ortaya çıkar. Bir kalibrasyon eğrisi bir dizi referans molekül kullanılarak inşa edilir, molekülü MW ile ilgili hacim için. Protein için, referans moleküller genellikle iyi davranan, şarj veya hidrofobik yüzey kalıntıları ile sütun ile etkileşime girmiyor küresel proteinler. Elüsyon hacmi bir ultraviyole (UV) emici dedektörü ile ölçülür. UV tükenme katsayısı biliniyorsa-genellikle serisinden hesaplanır-protein tepe toplam kitle de Quant, olabilir.
Özellikle, sn tarafından MW Analizi karakterize edilecek proteinler ile ilgili iki önemli varsayıma dayanır: 1) onlar referans standartları ile aynı konformasyon ve belirli hacim (diğer bir deyişle, difüzyon özellikleri arasındaki aynı ilişki ile paylaşmak ve MW) ve 2) referans standartları gibi, onlar sterik özellikleri dışında sütun ile etkileşim yok-onlar ücret veya hidrofobik etkileşimler ile ambalaj sütun uymayan. Bu varsayımlardan sapmalar kalibrasyon eğrisini geçersiz kılar ve hatalı MW belirlemeler için yol açar. Bu durum, geniş yapısal olmayan bölgeleri23,24 veya küresel olmayan/doğrusal Oligomerik montajları10nedeniyle büyük Stokes yarıçapları olan kendinden düzensiz proteinler içindir. Glycosylated proteinleri genellikle daha büyük bir Stokes yarıçaplı olmayan glycosylated formu, katma karbonhidrat kütlesi dikkate alındığında bile19. Deterjan-çözünen membran proteinleri kalibrasyon proteinlerinden farklı olarak elute, çünkü SEC 'den gelen elüsyonu, Oligomerik devlet ve proteinlerin molar kütlesi yerine polipeptid-deterjan-lipidler kompleksinin toplam boyutuna bağlıdır25 ,26. Sütun kimyası, pH ve tuz koşulları, şarj edilen veya hidrofobik yüzey kalıntıları olan proteinlerin elüsyon hacimlerini etkileyen27,28.
SEC, çok açılı ışık saçılması (iyonlarla) ve diferansiyel refraktif Endeks (DRI) dedektörleri3,4,11,29ile kombine edildiğinde MW belirlenmesi için çok daha çok yönlü ve güvenilir hale gelir 30,31,32. Bir DRI dedektörü, analitin varlığı nedeniyle çözelti kırılma indeksinde değişiklik temelinde konsantrasyon belirler. Bir oransal dedektör, bir analit tarafından olay Lazer ışınına göre birden fazla açıyla dağılmış ışık oranını ölçer. Toplu olarak SEC-eriler olarak bilinen bu enstrümantasyon, MW 'ın denklem 1 ' i kullanarak ilk ilkelerden doğrudan hesaplanacağı için,,
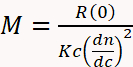 1
1
Burada M analitin molekül ağırlığı, R (0) azaltılmış Rayleigh oranı (örn., lazer yoğunluğuna göre analit tarafından dağınık ışık miktarı), oranlı Dedektör tarafından belirlenen ve sıfır açısına kadar ekstrapole, c UV veya DRI dedektörü, DN/DC tarafından belirlenen ağırlık konsantrasyonu analitin refraktif endeks artışı (aslında analit ve tampon kırılma indeksi arasındaki fark), ve K bağlı bir optik sabit dalga boyu ve solvent refraktif endeksi gibi sistem özellikleri29.
SEC sütunlarında, SEC sütunu sadece çeşitli türleri çözümde ayırmak için kullanılır, böylece onlar, onlar ve konsantrasyon dedektörü hücrelerini bireysel olarak girecekler. Gerçek saklama süresi, protein türlerini ne kadar iyi çözdüğü dışında analiz için hiçbir önemi yoktur. Aletler sütundan bağımsız olarak kalibre edilir ve referans standartlarına güvenmez. Bu nedenle, SEC-, temel fiziksel denklemlerden MW belirlenmesi için bir ' mutlak ' yöntem olarak kabul edilir. Numune heterojen ve tamamen sütun tarafından ayrılmaz ise, her bir elüsyon hacminde sağlanan değer, zaman dilimi başına akış hücresinden akan her bir elüsyon hacmine ait bir ağırlık ortalaması olacaktır, yaklaşık 75 μL.
Saçılma yoğunluğunun açısal varyasyonunun analizine göre, melezler aynı zamanda makromoleküllerin boyutunu (root-Mean-kare yarıçapı, Rg) ve yaklaşık 12,5 Nm29' dan daha büyük geometrik yarıçapı olan nanopartikülleri de belirleyebilir. Monomerik proteinler ve oligomerler gibi küçük türler için, 0,5 Nm 'den33' e kadar hidrodinamik yarıçapları ölçmek için,, bir dinamik ışık saçılma (DLS) modülü,,,, bir dinamiği eklenebilir.
UV veya DRI konsantrasyon Analizi EQ. 1 ' de c değerini sağlayabilir Iken, DRI kullanımı iki nedenden dolayı tercih edilir: 1) DRI bir UV içermeyen şekerler veya polisakkaritler gibi molekülleri analiz etmek için uygun bir evrensel konsantrasyon dedektörü, kromofor34; ve 2) sulu tampon neredeyse tüm saf proteinlerin konsantrasyon yanıtı DN/DC bir veya iki yüzde içinde aynıdır (0,185 ml/g)35, bu nedenle UV yok olma katsayısı bilmek gerek yoktur.
Protein araştırmalarında SEC-, ve kullanımı oldukça geniştir. En yaygın uygulamalar tarafından saf bir protein monomerik veya Oligomerik ve oligomerizasyon derecesi olup olmadığını kurmak ve toplamları değerlendirmek3,10,11,17, 31,36,37,38. Bu nedenle, geleneksel araçlarla karakterize edilemez deterjan-çözünen membran proteinleri için bunu yapma yeteneği özellikle ödüllü ve ayrıntılı protokoller Bu yayınlandı31,39,40 , 41 , 42 , 43. diğer ortak uygulamalar arasında, post-translasyonel modifikasyon ve glikoprotein, lipoproteinler ve benzer Konjugat polikikitiğinin derecesi kurulması4,31,44 , 45 , 46 , 47; protein-protein, protein-nüklik asit ve protein-polisakkarid kompleksleri gibi heterokompleksleri oluşumu (veya eksikliği) ve mutlak stoichiometri (stoichiometrik oranı aksine)24,46, 48,49,50,51,52; monomer-dimer denge dağılma sabiti belirlenmesi49,53,54; ve protein konformasyonu55,56değerlendirmek. Proteinlerin ötesinde, SEC-lidler peptitler57,58, heparin içeren59 ve chitosans gibi geniş heterojen Doğal polimerler karakterizasyonu için paha biçilemez60,61, küçük virüsler62 ve sentetik veya işlenmiş polimerler çoğu türleri63,64,65,66. Literatürde kapsamlı bir bibliyografya67 ve çevrimiçi (http://www.Wyatt.com/Bibliography adresinde) bulunabilir.
Burada, bir SEC-bir deneyi çalıştırmak ve analiz etmek için standart bir protokol sunuyoruz. Sığır serum albümin (BSA), protein monomerlerin ve oligomerin ayrımı ve karakterizasyonu için bir örnek olarak sunulmuştur. BSA protokolü, kompleksleri, glikoproteinler ve yüzeyfakan bağlı membran proteinlerinin de dahil olduğu daha fazla SEC-, daha fazla analiz için temel olarak hizmet veren belirli sistem sabitlerini belirler.
SEC-orların birçok satıcıdan gelen standart yüksek performanslı sıvı kromatografi (HPLC) veya hızlı protein sıvı kromatografi (FPLC) donanımları kullanılarak gerçekleştirilebilecek olduğunu unutmayın. Bu protokol, araştırma ve geliştirme için proteinler üreten laboratuvarlarda yaygın olarak bulunan bir FPLC sisteminin kullanımını açıklar (bkz. malzeme tablosu). Protokol çalıştırmadan önce, FPLC sistemi,,, ve DRI dedektörleri yüklü olmalıdır kontrol için ilgili yazılım paketleri ile birlikte, veri edinme ve analiz üretici talimatları başına ve herhangi bir gerekli kalibrasyon sabitler veya diğer ayarları yazılıma girilen. Pompa ile enjektör arasında hidrofilik, 0,1 μm gözenek membran takılı bir satır içi filtre yerleştirilmelidir.
Protokol
1. sistemin hazırlanması
- FPLC 'nin UV dedektörünün aşağı yönde olan, en ileri ve DRI dedektörleri. PH ve iletkenlik dedektörlerini atlayarak UV ve likit dedektörleri arasında önemli interdedektör hacmi ekleyecekler. 0,25 mm kimlik ve dedektörler arasında sütun ve 0,75 mm kimliği kapiller boru Dedektör atık veya kesir toplayıcı çıkış üzerinde kapiller tüp kullanın.
- FPLC ve dedektörler arasındaki gerekli sinyal bağlantılarının, UV dedektöründen, FPLC 'nin ı/O kutusu üzerinden, FPLC 'den, IFO 'ya ait analog giriş
- En az 20 kDa 500 kDa için bir fraksiyonlama aralığını kapsayan uygun bir analitik SEC sütun yükleyin. Sütun MW, pH ve örnek ve mobil faz diğer özellikleri için uygun olup olmadığını belirlemek için ürün bilgilerini kontrol edin.
2. tampon hazırlama, sistem gece ve temizlik kontrol gezinirler
- HPLC dereceli reaktifler kullanarak, 50-100 mM NaCl ile 1 L fosfat-tamponlu tuz hazırlayın. Arabellek filtre 0,1 μm bir şişe üst polither Sülfone filtre veya benzer kullanarak. Filtre ilk 50-100 mL tampon bir atık şişe ve atmak, Kuru filtreleri partikülleri ortadan kaldırmak için, ve sonra filtre ile iyice yıkanmış temiz, steril bir şişe geri kalanı filtreleyin, de-iyonize su ve önlemek için kaplı toz girme.
Not: Tris tampon gibi diğer mobil faz çözücüler, bu çözücülerde tercihen çözünen ek proteinler analiz edilmelidir. - Gece içinde bir akış hızında Flush 0,5 ml/min, ya da aksi takdirde sütun üreticisi tarafından önerilen, arabellek sütununda doğrultma ve partikülleri kaldırmak için. FPLC 'nin sürekli akış modunu kullanın ve tüm sec-, tüm çalışır tamamlanıncaya kadar akış durmadığından emin olun.
- DRI akış hücresini gece Temizleme sırasında Temizleme moduna yerleştirin. Örnek çalışmadan başlamadan önce temizleme özelliğini kapatın.
- Zaman Flush başlangıcı, kademeli olarak "sütun dökülme" efekti (veya partiküllerin serbest bırakılması) sütun basıncı ani bir değişiklik neden önlemek için akış hızını rampa.
- Sistem oldukça istikrarlı ve partikül içermeyen olduğu bilinmektedir ve istenilen mobil faz ile denge içinde, gece floş daha kısa, 2-3 h Flush ile değiştirin.
- Birikmiş partikülleri serbest bırakmak ve en az 90 ° dedektöründe,,,,,,,,,,,,, kontrol etmek için sütun aşağı doğru hafifçe dokunarak sistem temizliği denetleyin. Zirve-to-Peak gürültüsünün 50-100 μV 'den fazla olmadığını doğrulayın.
- Enjektör partiküllerin temiz olduğunu doğrulamak için bir ' boş ' enjeksiyon gerçekleştirin. Bir ' boş ' sadece çalışan tampon, taze, steril bir şişede hazırlanır.
- Parçacık tepe hacmi 1 mL 'den fazla ve taban çizgisi yukarıda 5 mV daha fazla ise, sistem örnekleri için hazırdır. Aksi takdirde, temiz kadar ek boş enjeksiyonları gerçekleştirin veya enjektör temizlemek için bakım gerçekleştirin.
3. numune hazırlama ve yükleme
- SEC arabelleğinde 1-2 mg/mL 'de en az 200 μL BSA hazırlayın.
Not: yağış önlemek için, BSA asla saf suda çözünmelidir. - Proteini 0,02 μm ' ye enjektör ucu filtresi kullanarak filtreleyin.
- Kuru filtrelerden partikülleri ortadan kaldırmak için filtratın ilk birkaç damlasını atın.
- Alternatif olarak, numune Santrifüjü 10.000 x g 'de 15 dakika boyunca çözünemez agrega ve diğer büyük partiküllerin yağışında sağlar.
- 100 μL BSA çözüm döngü içine enjekte.
Not: Bu malzeme önerilen miktardır ve daha fazla veya daha az kararlılık veya kullanılabilirlik gibi örnek koşullara göre enjekte olabilir. Enjeksiyon başına gerekli protein miktarı molekül ağırlığı ile ters değişir-molekül ağırlığı 33 kDa, ya da yarısı BSA ise iki kat daha fazla protein kütlesi gereklidir.
4. ya da bu yazılımın hazırlanması
- Yeni açık | Ileri yazılım menüsündeki yöntemden deneme ve ışık saçılma sistemi yöntemleri klasöründen çevrimiçi yöntemi seçin. Eğer bir DLS dedektörü varsa, ışık Saçılmaktan Online yöntemi seçin | QELS klasörü ile .
- Yapılandırma bölümünde, örnek ve mobil aşamanın parametrelerini ayarlayın.
- Genel pompa görünümünde, FPLC 'de kullanılan akış hızını ayarlayın.
- Genel pompa görünümünde, solvent dalı, ad alanında PBS'yi seçin.
- Enjektör görünümünde, örnek şube, adı BSAolarak girin ve DN/DC = 0,185 (değiştirilmemiş PROTEINLER için Standart değer), a2 = 0 ve UV tükenme katsayısı = 0,667 ml/(mg-cm) ayarlayın.
Not: diğer proteinler Için, UV280 nm yok olma katsayısı literatürde bulunabilir veya çeşitli kamu etki alanı yazılım araçlarını kullanarak dizisinden hesaplanır.
- Yordamlar bölümünde, temel koleksiyon görünümü, Otomatik enjekte ÜZERINE onay kutusunu seçin ve sn 'nin toplam nüfuz hacmine kadar verilerin tüm elüsyon için toplanması için 70 dk olarak çalıştırma süresini ayarlayın sütuna ulaşıldı.
Not: gerekli süre sütun ve akış hızına göre değişebilir-35 min. 7,8 mm x 300 mm HPLC-SEC sütun için 0,5 mL/dak 'da toplama gereklidir. - Çalıştır düğmesini tıklatarak, deniler yazılımında deneyi başlatın. Bu, FPLC aletinden ZSSS dedektörü üzerinden nabız sinyalini aldıktan sonra verileri okumaya başlayacaktır.
- Aracın ön panelindeki Autozero düğmesini tıklatarak DRI sinyalini sıfırlamak.
5. FPLC yazılımının hazırlanması
- Proteinin adını ve FPLC yazılımında koşmak, manuel | Manuel talimatları yürütme | İşareti ayarlayın.
- Akış yolu altında enjekte etmek için manuel yük enjeksiyon valfi geçiş | Enjeksiyon valfi.
- I/O kutusu altında 0,5 s nabız ekleyerek bir darbe sinyali dahil | Pulse dijital çıkış. Bu.
6. numune döngüye enjekte edilir. Deneme çalışmasını başlatmak için FPLC yazılımında Yürüt seçeneğini tıklatın.
7. SEC-, BSA verilerinin analizi
- Bir analiz gerçekleştirin, adımlar altında
- Temel koleksiyon görünümünü kontrol ederek ZIRVELERIN UV, eriler ve RI 'daki yaklaşık olarak aynı elüsyon hacminde göründüğünü doğrulayın.
- Taban çizgisi görünümünde, tüm sinyaller için temel tanımla (tüm ls DEDEKTÖRLERI, UV ve DRI). Taban çizgileri, numune zirvelerinin bir tarafına diğerine kadar uzanan, saf solvent seviyesini belirtmek için tanımlanmalıdır.
- Zirveler görünümünde, fareyi tıklatarak ve sürükleyerek analiz edilecek zirveleri tanımlayın. Her zirvede merkezi% 50 seçin. Önce monomer zirve (' Peak 1 ') ve sonra dimer zirve (' Peak 2 ') seçin. DN/DC doğru değerleri doğrulayın = 0,185 ve UV 280 nm yok olma katsayısı = 0,667 BSA için her tepe altında.
- Üst hizalama, bant genişletme düzeltmesi ve normalleştirme yordamları gerçekleştirin.
Not: normal olarak SEC-, en yüksek hizalama, bant genişletilmesi ve açısal dedektörlerin normalleşmesi için periyodik olarak kalibre edilir 90 ° dedektörünün yarıçapı ile bir Monodisperse protein kullanarak Gyration Rg < 10 Nm gibi BSA Monomer. Bu örnekte BSA hem kalibrasyon molekülü hem de MW analizinin konusu olarak hizmet vermektedir.- Yordamlarda | Hizalama görünümü, fareyi tıklatarak ve sürükleyerek zirvelerin merkezi bölgesini seçin, sinyalleri Hizala ve ardından Tamam'ı tıklatın.
- Yordamlarda | Bant genişletilmesi görünümü, monomer zirvesine ait merkezi% 50 seçin. RI dedektörünün referans enstrümanolarak belirtildiğinden emin olun, ardından Sığdır 'ı tıklayın ve IR SINYALINE UV ve ls sinyalleri ile eşleşecek şekilde uygulayın .
- Merkezi 50-70% içinde çok yakından çakışıyor doğrulamak için doruklarına yakınlaştırma, sonra Tamam' ı tıklatın.
- Örtüşme mükemmel değilse, (Bu gerekli olabilir) uyum gerçekleştirmek ve örtüşme mükemmel olana kadar "Uygula" bir veya iki kez daha.
- Yordamlarda | Normalleştirme görünümü, tepe 1 ' i seçin, Rg değeri olarak 3,0 Nm girin, sonra ok Normalleştir 'i tıklatın.
- Yordamlarda | Molar Mass ve RG ,, herhangi bir algılama açıları aşırı gürültü nedeniyle analiz seçilmelidir hangi belirlemek için verileri gözden geçirin. Tipik olarak, bunlar, toz partiküllerinin nispeten yüksek bir yoğunluğa dağılacağı alt açıları olacaktır. Sağdaki grafikte zirveler içinde bireysel dilimleri seçin ve soldaki grafikte ters azaltılmış Rayleigh oranı açısal bağımlılığı görüntüleyin. En düşük (ve bazen en yüksek) açıları tutarlı bir şekilde büyük ölçüde sapmaya, sonra görünümün altındaki listeden seçimini kaldırın.
- EASI Graph görünümünde sonuçların grafiğini görüntüleyin. Pencerenin üst kısmındaki ekran açılır penceresinden molar kütlesi öğesini seçin. CTRL tuşunu basılı tutarak tepe bölgesini yakınlaştırmak için tıklayın ve sürükleyin.
- Sonuçların monomer ve dimer zirveleri için son tablo ağırlık-ortalama molar kitle sonuçlarını görüntüleyin | En yüksek sonuçlar altında rapor (Özet) görünümü | Molar kitle anları (g/mol) | MWiçin. Saflık en yüksek sonuçlar altında rapor edilir | Kütle fraksiyonu (%).
Not: diğer molar kitle anları da gösterilir; Bunlar genellikle heterojen polimerlerle ilgilidir, ancak ayrık boyutlarda olan proteinlere değil. Yazılım tarafından üretilen diğer birçok sonuç, yüzde kitle kurtarma (enjekte edilen miktara göre konsantrasyon dedektörü aracılığıyla elüe protein Kesir), en yüksek istatistik, polydispersity, Rg gibi raporda yer alabilir ve Rh Moments, vb. Belirtildiğinde, belirsizlik ölçümleri, ölçüm serisi içindeki gürültüye dayalı olarak gösterilen değerin hassasiyetini yansıtır ve doğruluğu temsil etmek için kabul edilmemelidir. Bildirilen değerlerin gerçek doğruluğu, sağlanan DN/DC ve yok olma katsayısı değerlerinin, enstrüman kalibrasyonunun vb. doğruluğu gibi çeşitli faktörlere bağlıdır. - Dosya menüsünden, Yöntem olarak kaydet 'i seçin ve analiz edilen BSA verilerini her türlü proteinin gelecekteki ölçümleri için standart bir yöntem olarak kaydedin. BSA için belirlenen normalleştirme ve bant genişletme parametreleri analizinde yapılacaktır.
Sonuçlar
Şekil 1a, b göstermek bu üç Oligomerik formları BSA: monomer, dimer ve trimer, iyi ayrılmış olduğunu 200 å gözenek sütun temel çözünürlüğü ile monomer ve Dimer, iken Şekil 2a gösterir ayrılması bir 75 Å gözenek sütun iyi monomer-dimer çözünürlüğü elde etmek. İkinci örnek "kötü" bir sonuç göstermek için eklenmiştir; Bu iki sütun için ayrılık farklılıkları, aslında, üreticinin belirtilen ayrım aralıkları göre beklenebilir. Trimer tamamen dimer ve daha yüksek oligomerler ayrı değil iyi trimer ve birbirlerinden ayrılmış değildir. Şekil 2B , doğru MW tespitini engelleyen kromatogram boyunca bulunan partiküllerle gürültülü ışık saçılma sinyalinin bir örneğidir.
Bundan sonra Şekil 1B'ye odaklanıyoruz. 13,8 mL 'de elenen monomer, bir ağırlık ortalama molar kütle Mw sergiler 64,1 ± 0,4 kDa tarafından belirlenen Iler ve hidrodinamik yarıçapı Rh ile 3,54 ± 0,01 Nm. Bu sonuçlar sıra kütle ve BSA, 66,4 kDa ve 3,5 Nm sırasıyla68, SEC-, 5%3,69her zamanki doğruluğu içinde su çapı bilinen hidrodinamik yarıçapı ile anlaşmaktadır. 12 mL 'de kullanılan Dimer, bir Mw değerini 127 ± 1 kDa ile belirlenerek, beklendiği gibi, monomer 'nin deneysel hassasiyette iki katı ve 5,68 ± 0,06 nm Rh 'dir . Trimer zirve de görüldü 11 mL ile Mw 194 ± 9 kDa tarafından belirlenen, üç kez bu monomer içinde deneysel hassasiyet içinde, beklendiği gibi. R DLS sinyalinin düşük yoğunluğu nedeniyle trimer h belirlenemedi.
Monomer zirvesinde hesaplanan molar kütle puanları homojenliği gösteren% 2-5 içinde üniformalı. 38-50 kDa aralığında molar kütle ile bir sondaki omuz bulmak için alışılmadık değildir, BSA parçacıkları70karşılık gelen. Dimerik ve Trimerik dorukların genelinde molar kitle noktaları, heterojenlik göstergesi üniforma değildir. Dimer zirvesinde dimer zirvesine kanama trimer izleri nedeniyle biraz heterojen, ve trimer zirvesinde kötü çözülen yüksek oligomerlerin Co-elution nedeniyle heterojen.
Monomer zirvesinde sinyal-gürültü seviyesi, 100:1 üzerinden, 40:1 ' in sinyal-gürültü ile dimer zirve olduğu gibi, her üç sinyalde oldukça kabul edilebilir. Protein zirvelerinin ötesinde kromatogram bölgeleri, LS izindeki toplam dışlama (void) hacminin yakınındaki partiküller ve (pozitif) tuz zirvesinde ve DRI izlemede (negatif) çözünmüş hava zirvesinde, toplam nüfuz edilene yakın olan bir zirve istisnası ile düz Birim. Bunlar Şekil 1a'da işaret edilir.
Saflık düzeyi de bir SEC-ERILER denemesinde hesaplanabilir: raporda monomerik zirvenin kütle fraksiyonu monomerik formun saflık yüzdesini temsil eder. BSA monomer için hesaplanan saflık% 88 ' dir.
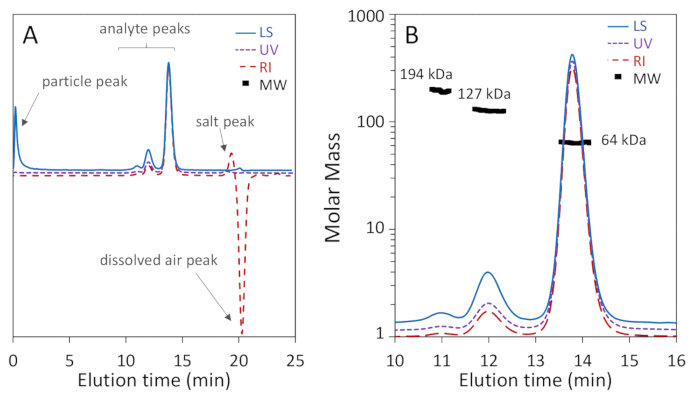
Şekil 1 : Bir 200 Å gözenek boyutu-dışlama sütunu kullanarak Sığır serum albümin (BSA) SEC-EMILER analizi. Kromatogram izleri monomer zirvesine normalleştirilmiş ve netlik için ofset. (A) göz ardı edilebilir yaygın eserler, refraktif indeks sinyalinde toplam nüfuz hacmi yakın tuz ve çözünmüş hava doruklarının yanı sıra ışık saçılma sinyalinin başlangıcına yakın bir parçacık zirve de dahil olmak üzere işaret edilir. (B) kromatogram mükemmel monomer-dimer-trimer ayrımı sergiler ve ışık saçılma sinyali yüksek sinyal-gürültü sergiler. Monomer ve dimer MW değerleri yüksek homojenliği sergiler. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
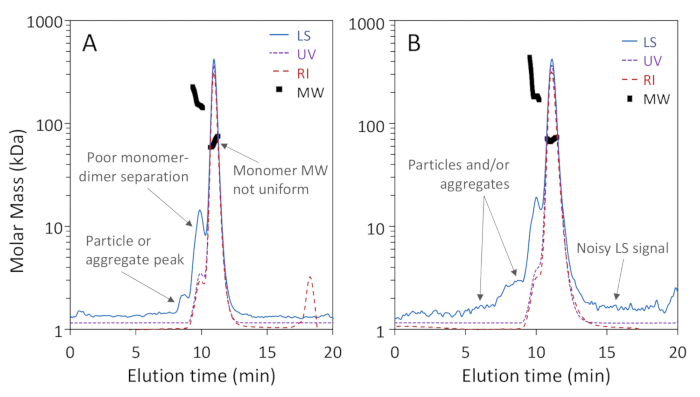
Şekil 2 : Düşük kalıtelı sec-bir analiz örnekleri. Kromatogram izleri monomer zirvesine normalleştirilmiş ve netlik için ofset. (A) 75 üzerinde yetersiz ayırma Å gözenek boyutu dışlama sütunu; 8-9 dk arasında bir parçacık tepe proteinleri iyi ayrılmış değildir. (B) yetersiz sinyal-gürültü oranı ve proteinlere bitişik geniş parçacıklar ışık saçılma (ls) sinyalinde belirgindir. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
Tartışmalar
SEC-nler deneyi, her zirvenin molar kitleleri ve hidrodinamik boyutları için monomer, dimer ve trimer iyi ayrım ve nicel sonuçlar sağladı. Bu sırayla açıkça tanımlar ve her tür mevcut karakterize, yanı sıra saflık ölçülme. Elde edilen sonuçlar genellikle% 5 ' in içinde doğrudur ve 1-2%3,69içinde kesin ve tekrarlanabilecektir. Bu hassasiyet ve tekrarlanabilirlik seviyesi, SEC ile ayrıldığı sürece (aynı zirvede kısmen çakışabilir), MW 'da yakın olabilecek türler arasında güvenle ayırt edilmesini mümkün kılar. Protein kalite kontrolü ve temel Biyofizik karakterizasyonu için faydaları belirgindir.
Partiküllerin yokluğunda doğrulama hassas, tekrarlanabilen SEC-, ölçümleri için oldukça önemlidir. Parçacık zirveleri genellikle benzer UV veya RI sinyalleri eşliğinde büyük ilikler sinyalleri olarak görünür. Bu tür partikülleri ortadan kaldırmak için mobil faz ve numune dikkatle hazırlanmalıdır. HPLC dereceli reaktifler veya daha iyi kullanım, mobil faz ve seyreltme tamponunun 0,1-0,2 μm ' ye filtrasyon (Kuru membranlarda her zaman bulunan parçacıkları ortadan kaldırmak için filtreyi ön yıkama), ekstra temiz mobil faz şişeleri ve diğer cam ürünleri SEC-, akış altında genişletilmiş sütun dengelemesinden (parçacıklar ve akış durduruldu veya kullanımda olmayan bir sütun birikmiş olabilir toplamları kaldırmak için) tüm önerilir. Örnek ilgi malzemesi kaldırmaz en küçük gözenek boyutuna filtre edilmelidir, genellikle hiçbir büyük 0,1 μm ve, mümkünse, 0,02 μm. Filtre hızlı bir şekilde tıkarsa, örnek santrifüclü olabilir, azalan gözenek boyutu aşamalarında filtre ve/veya yeniden temizlendi. Sistemler sürekli olarak yüksek kaliteli, taze ve filtrelenmiş mobil faz ile korunur, sütun şokları engellenir, numuneler temiz ve sütuna uymaz, ölçümler yukarıda belirtilen partikül gürültüsünü göstermez ve yüksek kaliteli veri.
Ozonlar için proteinler için tipik SEC tamponları agnostik; PBS 'nin yanı sıra diğer birçok tampon sistemi,71çeşitli yardımcı maddeler dahil olmak üzere ayrım ve istikrarı optimize etmek için kullanılabilir. En iyi ayırma ve kurtarma için seçilmelidir belirli sütun, aynı zamanda agnostik vardır. Analiz ile ilgili temel endişeler, refraktif indeksdeki önemli değişiklikler, özel refraktif endeks artışı DN/DC'nin DEĞIŞTIRILMESI ve UV analizine ihtiyaç duyulduğunda 280 nm 'yi absorbe eden uyarılılar. Örneğin, arginin tipik bir proteinin DN/DC 'sini önemli ölçüde etkileyebilen, negatif rejime (negatif DN/DC Ile bir protein hala sec-, Eğer DN/ DC ampirik olarak belirlenir, ancak DN/DC = 0 protein tarafından dağınık ışık yoğunluğu null olacaktır ve MW Analizi imkansız olacaktır). Proteinlerin DN/DC değerlerinin konusu, Zhao ve al.35 tarafından kapsamlı bir şekilde tartışılmaktadır, bu standart sulu tamponlar için, değiştirilmemiş proteinlerin büyük çoğunluğu standart değerin% 2-3 ' inde (0,185 veya 0,186 mL/g = 660 Nm) içinde düşer. , ~ 10 kDa altında proteinler daha değişken olmasına rağmen, ve 0,21 mL/g gibi yüksek gidebilir birkaç tür vardır.
Sunulan verilerdeki BSA monomer ve dimer doruklarına karşı MW profilleri, Monodisperse türlerini gösteren,% 2 veya daha az içinde oldukça homojen oldu. Bir zirve genelinde olmayan Tekdüzen MW değerleri heterojenlik veya uygunsuz analiz ortaya çıkabilir. Özellikle, konkav (' Smile ') veya konveks (' Grimace ') olan bir BSA MW profili, bant genişletilmesi düzeltmesinin doğru şekilde uygulanmasının neden olabilir. Diğer proteinler için, bir konveks profili de monomer ve oligomerler arasında dinamik denge ortaya çıkabilir, nerede oligomer için monomerlerin oranı-ve dolayısıyla belirgin MW değeri-en yüksek konsantrasyona bağlıdır (BSA bu davranışı sergiler ve genellikle kullanılır doğru bant genişletilmesi parametrelerini doğrulamak için bir denetim örneği olarak). Bir MW profili, sondaki kenarına önde gelen değişir ve örnek konsantrasyon ile değişmez bir moleküler ağırlık türlerinin kısmen SEC tarafından çözülür dağılımı tipik bir. dinamik denge kolayca diğerine ayırt edilir farklı toplam miktarlarda protein enjekte ederek görünüşte homojen olmayan dağılımlar kaynakları-dağıtım dinamik denge ile değişir, ancak sabit bir dağılım veya yanlış bant genişletme düzeltmesi ile değişecektir.
Yukarıda açıklanan kısıtlamalar göz önüne alındığında, SEC-, çeşitli görevler için uygun değildir. Ham numunelerin analizi için uygun değildir; numuneler standart benzeşimi ve parlatma yöntemleri ile iyi bir şekilde temizleşmiş olmalıdır. Bu yeterli doğruluk ya da aynı veya çok yakın kütle ile bir protein veya mAb mutantlar ve türevleri tanımlamak için güç çözme yok, ve ya da bir SEC sütununda ayrı elute olmayan analitler ile kullanılamaz, son zamanlarda bu iyon-Exchang gösterildi e veya ters fazlı kromatografi, SEC72,73,74tarafından çözülmeyen türleri ayırmak ve karakterize etmek için, iyonlar ile birleştirilebilir. Protein miktarlarının ciddi olarak kısıtlı olduğu durumlarda, SEC-, genellikle 10-200 μg3 gerektirdiğinden ve daha fazla 0,25 mm 'den büyük olan boru iç çapı olan BIR FPLC sistemi tarafından gerekli olabilir, çünkü sn-, mümkün olmayabilir; Ancak, daha küçük miktarlarda UHPLC-sn-mallar tarafından analiz edilebilir. Mobil faza giriş üzerine toplanan son derece kararsız proteinler, sn-illerin analizi için uygun değildir, ancak arabellek Optimizasyonu off-line dinamik ışık saçılma kullanarak bu sorunu75üstesinden gelebilir.
SN. illerin gerektirdiği ek çabaya rağmen, protein araştırması için paha biçilmez ve akademik ve biyofarmakösel topluluklar tarafından yaygın olarak kullanılmaktadır. Yukarıdaki protokolde açıklandığı gibi monomerlerin, oligomerlerin ve toplamaların karakterizasyonu ek olarak, SEC-, glikoproteinler gibi değiştirilmiş proteinleri karakterize edebilir (tek başına protein ve glikcan bileşenlerinin MW belirleme), yüzey-veya lipid-çözünür membran proteinleri (bireysel olarak protein ve çözünen bileşenleri MW belirlenmesi), virüs benzeri parçacıklar, protein-protein ve protein-nüklik asit kompleksleri, polizakkaritler gibi protein montajları, protein-polisakkarid Konjugat, peptidler ve diğer birçok biomacromolekül.
Açıklamalar
DS, bu protokolde, ki bu protokol içinde kullanılan Wyatt Technology Corporation 'ın bir çalışanı. AT, Wyatt malların ve AKTA FPLC cihazlarının distribütörü olan danyel Biotech 'in bir çalışanı.
Teşekkürler
Dr. Tsafi Danieli 'ye (Wolfson uygulamalı yapısal biyoloji Merkezi, Ibranice Üniversitesi) tavsiye ve işbirliği için teşekkür ederiz. Ayrıca, bu çalışmada kullanılan analitik FPLC-zıtlar sisteminin yardımı ve kurulması için Daniel Biotech Ltd. ' ye (Rehovot, Israil) teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| AKTA pure | GE Healthcare | 29-0182-26 | fast protein liquid chromatograph (FPLC) |
| AKTA UNICORN | GE Healthcare | FPLC control software | |
| ASTRA | Wyatt Technology | MALS data acquisition and analysis software | |
| Bovine serum albumine (purity >97%) | Sigma | A1900 | analyte |
| DAWN or miniDAWN | Wyatt Technology | WH2 or WTREOS | multi-angle light scattering (MALS) detector |
| Increase 200 10/300 | GE Healthcare | size exclusion column, 200 Å pores, 10 mm i.d., 300 mm length | |
| Optilab | Wyatt Technology | WTREX | differential refractive index (RI) detector |
| Sodium chloride NaCl | Sigma | 71382 | HPLC grade NaCl |
| Stericup bottle top filter polyether sulfone 0.1 µm 1000 mL | Millipore | SCVPU11RE | mobile phase filter |
| Whatman Anotop 10 syringe filter 0.02 µm | GE Healthcare | 6809-1002 | sample filter |
| Whatman Anotop 10 syringe-tip filter, 0.1 µm pore, 10 mm diameter | GE Healthcare | 6809-1012 | sample filter |
| Whatman Anotop 25 syringe filter 0.1 µm | GE Healthcare | 6809-2012 | mobile phase filter |
| WyattQELS | Wyatt Technology | WIQ | dynamic light scattering detector |
Referanslar
- Acton, T. B., et al. Robotic cloning and Protein Production Platform of the Northeast Structural Genomics Consortium. Methods in Enzymology. 394, 210-243 (2005).
- Acton, T. B., et al. Preparation of protein samples for NMR structure, function, and small-molecule screening studies. Methods in Enzymology. 493, 21-60 (2011).
- Folta-Stogniew, E., Williams, K. R. Determination of molecular masses of proteins in solution: Implementation of an HPLC size exclusion chromatography and laser light scattering service in a core laboratory. Journal of Biomolecular Technology. 10 (2), 51-63 (1999).
- Kendrick, B. S., Kerwin, B. A., Chang, B. S., Philo, J. S. Online size-exclusion high-performance liquid chromatography light scattering and differential refractometry methods to determine degree of polymer conjugation to proteins and protein-protein or protein-ligand association states. Analytical Biochemistry. 299 (2), 136-146 (2001).
- Hughes, C. S., Longo, E., Phillips-Jones, M. K., Hussain, R. Quality control and biophysical characterisation data of. Data Brief. 14, 41-47 (2017).
- Muthurajan, U., et al. In Vitro Chromatin Assembly: Strategies and Quality Control. Methods in Enzymology. 573, 3-41 (2016).
- P4EU. . Protein Quality Standard PQS. , (2019).
- Arbre Mobieu. . Guidelines on Protein Quality Control. , (2019).
- Bowman, A., et al. The histone chaperones Vps75 and Nap1 form ring-like, tetrameric structures in solution. Nucleic Acids Research. 42 (9), 6038-6051 (2014).
- Bowman, G. R., et al. Oligomerization and higher-order assembly contribute to sub-cellular localization of a bacterial scaffold. Molecular Microbiology. 90 (4), 776-795 (2013).
- Folta-Stogniew, E. Oligomeric states of proteins determined by size-exclusion chromatography coupled with light scattering, absorbance, and refractive index detectors. Methods in Molecular Biology. 328, 97-112 (2006).
- Vieux, E. F., Wohlever, M. L., Chen, J. Z., Sauer, R. T., Baker, T. A. Distinct quaternary structures of the AAA+ Lon protease control substrate degradation. Proceedings of the National Academy of Sciences of the United States of America. 110 (22), E2002-E2008 (2013).
- Group, N.S.. . use of SEC-MALS in crystallization QC. , (2018).
- Ahrer, K., Buchacher, A., Iberer, G., Josic, D., Jungbauer, A. Analysis of aggregates of human immunoglobulin G using size-exclusion chromatography, static and dynamic light scattering. Journal of Chromatography A. 1009 (1-2), 89-96 (2003).
- Narhi, L. O., Schmit, J., Bechtold-Peters, K., Sharma, D. Classification of protein aggregates. Journal of Pharmaceutical Sciences. 101 (2), 493-498 (2012).
- Spiess, C., et al. Bispecific antibodies with natural architecture produced by co-culture of bacteria expressing two distinct half-antibodies. Nature Biotechnology. 31 (8), 753-758 (2013).
- Philo, J. S. A critical review of methods for size characterization of non-particulate protein aggregates. Current Pharmaceutical Biotechnology. 10 (4), 359-372 (2009).
- Stellwagen, E. Gel filtration. Methods in Enzymology. 463, 373-385 (2009).
- Burgess, R. R. A brief practical review of size exclusion chromatography: Rules of thumb, limitations, and troubleshooting. Protein Expression and Purification. 150, 81-85 (2018).
- Striegel, A. M., Yau, W. W., Kirkland, J. J., Bly, D. D. . Modern Size-Exclusion Liquid Chromatography. , (2009).
- GE Healthcare. . Size Exclusion Chromatography: Principles and Methods. , (2014).
- Uliyanchenko, E. Size-exclusion chromatography-from high-performance to ultra-performance. Analytical and Bioanalytical Chemistry. 406 (25), 6087-6094 (2014).
- Dunker, A. K., Silman, I., Uversky, V. N., Sussman, J. L. Function and structure of inherently disordered proteins. Current Opinion in Structural Biology. 18 (6), 756-764 (2008).
- Hsiao, H. H., Nath, A., Lin, C. Y., Folta-Stogniew, E. J., Rhoades, E., Braddock, D. T. Quantitative characterization of the interactions among c-myc transcriptional regulators FUSE, FBP, and FIR. Biochemistry. 49 (22), 4620-4634 (2010).
- Hayashi, Y., Takagi, T., Maezawa, S., Matsui, H. Molecular weights of alpha beta-protomeric and oligomeric units of soluble (Na+, K+)-ATPase determined by low-angle laser light scattering after high-performance gel chromatography. Biochimica et Biophysica Acta. 748 (2), 153-167 (1983).
- Folta-Stogniew, E. J. Macromolecular Interactions: Light Scattering. Encyclopedia of Life Sciences. , (2009).
- Hong, P., Koza, S., Bouvier, E. S. P. Size-Exclusion Chromatography for the Analysis of Protein Biotherapeutics and their Aggregates. Journal of Liquid Chromatography and Related Technology. 35 (20), 2923-2950 (2012).
- Chakrabarti, A. Separation of Monoclonal Antibodies by Analytical Size Exclusion Chromatography. Antibody Engineering. , (2018).
- Wyatt, P. J. Light scattering and the absolute characterization of macromolecules. Analytica Chimica Acta. 272, (1993).
- Takagi, T. Application of low-angle laser light scattering detection in the field of biochemistry: review of recent progress. Journal of Chromatography A. 506, 51-63 (1990).
- Wen, J., Arakawa, T., Philo, J. S. Size-exclusion chromatography with on-line light-scattering, absorbance, and refractive index detectors for studying proteins and their interactions. Analytical Biochemistry. 240 (2), 155-166 (1996).
- Mogridge, J. Using light scattering to determine the stoichiometry of protein complexes. Methods in Molecular Biology. 1278, 233-238 (2015).
- Larkin, M., Wyatt, P. J. Light-Scattering Techniques and their Application to Formulation and Aggregation Concerns. Formulation and Process Development Strategies for Manufacturing Biopharmaceuticals. , (2010).
- Wolfender, J. L. HPLC in Natural Product Analysis: The Detection Issue. Planta Medica. 75 (07), 719-734 (2009).
- Zhao, H., Brown, P. H., Schuck, P. On the distribution of protein refractive index increments. Biophysical Journal. 100, (2011).
- Serebryany, E., Folta-Stogniew, E., Liu, J., Yan, E. C. Homodimerization enhances both sensitivity and dynamic range of the ligand-binding domain of type 1 metabotropic glutamate receptor. FEBS Letters. 590 (23), 4308-4317 (2016).
- Arakawa, T., Wen, J. Size-exclusion chromatography with on-line light scattering. Current Protocols in Protein Science. Chapter 20, Unit 20.6 (2001).
- Müller, R., et al. High-resolution structures of the IgM Fc domains reveal principles of its hexamer formation. Proceedings of the National Academy of Sciences. 110 (25), 10183-10188 (2013).
- Slotboom, D. J., Duurkens, R. H., Olieman, K., Erkens, G. B. Static light scattering to characterize membrane proteins in detergent solution. Methods. 46 (2), 73-82 (2008).
- Miercke, L. J., Robbins, R. A., Stroud, R. M. Tetra detector analysis of membrane proteins. Current Protocols in Protein Science. 77, 1-30 (2014).
- Gimpl, K., Klement, J., Keller, S. Characterising protein/detergent complexes by triple-detection size-exclusion chromatography. Biological Procedures Online. 18 (1), 4 (2016).
- Korepanova, A., Matayoshi, E. D. HPLC-SEC characterization of membrane protein-detergent complexes. Current Protocols in Protein Science. Chapter 29, 1-12 (2012).
- Roy, A., Breyton, C., Ebel, C. Analytical Ultracentrifugation and Size-Exclusion Chromatography Coupled with Light Scattering for Characterization of Membrane Proteins in Solution. Membrane Proteins Production for Structural Analysis. , (2014).
- Hastie, K. M., et al. Crystal structure of the prefusion surface glycoprotein of the prototypic arenavirus LCMV. Nature Structural & Molecular Biology. 23 (6), 513-521 (2016).
- Pallesen, J., et al. Structures of Ebola virus GP and sGP in complex with therapeutic antibodies. Nature Microbiology. 1 (9), 16128 (2016).
- Micoli, F., Adamo, R., Costantino, P. Protein Carriers for Glycoconjugate Vaccines: History, Selection Criteria, Characterization and New Trends. Molecules. 23 (6), (2018).
- Li, J., et al. Characterizing the Size and Composition of Saposin A Lipoprotein Picodiscs. Analytical Chemistry. 88 (19), 9524-9531 (2016).
- Crichlow, G. V., et al. Dimerization of FIR upon FUSE DNA binding suggests a mechanism of c-myc inhibition. EMBO Journal. 27 (1), 277-289 (2008).
- Kapoor, N., Gupta, R., Menon, S. T., Folta-Stogniew, E., Raleigh, D. P., Sakmar, T. P. Nucleobindin 1 is a calcium-regulated guanine nucleotide dissociation inhibitor of G{alpha}i1. Journal of Biological Chemistry. 285 (41), 31647-31660 (2010).
- Pirruccello, M., Swan, L. E., Folta-Stogniew, E., De Camilli, P. Recognition of the F&H motif by the Lowe syndrome protein OCRL. Nature Structural & Molecular Biology. 18 (7), 789-795 (2011).
- Lockyer, K., Gao, F., Derrick, J. P., Bolgiano, B. Structural correlates of carrier protein recognition in tetanus toxoid-conjugated bacterial polysaccharide vaccines. Vaccine. 33 (11), 1345-1352 (2015).
- Steinbach, T., Wurm, F. R. Degradable Polyphosphoester-Protein Conjugates: "PPEylation" of Proteins. Biomacromolecules. 17 (10), 3338-3346 (2016).
- Das, S., Stivison, E., Folta-Stogniew, E., Oliver, D. Reexamination of the role of the amino terminus of SecA in promoting its dimerization and functional state. Journal of Bacteriology. 190 (21), 7302-7307 (2008).
- Reshetnyak, A. V., et al. The strength and cooperativity of KIT ectodomain contacts determine normal ligand-dependent stimulation or oncogenic activation in cancer. Molecular Cell. 57 (1), 191-201 (2015).
- Zambelli, B., et al. a Chaperone in the Urease Assembly Process, Is an Intrinsically Unstructured GTPase That Specifically Binds Zn2+. Journal of Biological Chemistry. 280 (6), 4684-4695 (2005).
- Ren, X., et al. Hybrid Structural Model of the Complete Human ESCRT-0 Complex. Structure. 17 (3), 406-416 (2009).
- Moriarty, D. F., Fiorillo, C., Miller, C., Colón, W. A truncated peptide model of the mutant P61A FIS forms a stable dimer. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1774 (1), 78-85 (2007).
- la Garza, C. E., Miranda-Hernández, M. P., Acosta-Flores, L., Pérez, N. O., Flores-Ortiz, L. F., Medina-Rivero, E. Analysis of therapeutic proteins and peptides using multiangle light scattering coupled to ultra high performance liquid chromatography. Journal of Separation Science. 38 (9), 1537-1543 (2015).
- Beirne, J., Truchan, H., Rao, L. Development and qualification of a size exclusion chromatography coupled with multiangle light scattering method for molecular weight determination of unfractionated heparin. Analytical and Bioanalytical Chemistry. 399 (2), 717-725 (2011).
- Wang, W., et al. A new green technology for direct production of low molecular weight chitosan. Carbohydrate Polymers. 74 (1), 127-132 (2018).
- Kaderli, S., et al. A novel biocompatible hyaluronic acid-chitosan hybrid hydrogel for osteoarthrosis therapy. International Journal of Pharmaceutics. 483 (1-2), 158-168 (2015).
- Porterfield, J. Z., Zlotnick, A. A Simple and General Method for Determining the Protein and Nucleic Acid Content of Viruses by UV Absorbance. Virology. 407 (2), 281-288 (2010).
- Podzimek, S. The use of GPC coupled with a multiangle laser light scattering photometer for the characterization of polymers. On the determination of molecular weight, size and branching. Journal of Applied Polymer Science. 54 (1), 91-103 (1994).
- Podzimek, S., Vlcek, T., Johann, C. Characterization of branched polymers by size exclusion chromatography coupled with multiangle light scattering detector. I. Size exclusion chromatography elution behavior of branched polymers. Journal of Applied Polymer Science. 81 (7), 1588-1594 (2001).
- Podzimek, S. Importance of Multi-Angle Light Scattering in Polyolefin Characterization. Macromolecular Symposia. 330 (1), 81-91 (2013).
- Tarazona, M. P., Saiz, E. Combination of SEC/MALS experimental procedures and theoretical analysis for studying the solution properties of macromolecules. Journal of Biochemical and Biophysical Methods. 56 (1), 95-116 (2003).
- Minton, A. P. Recent applications of light scattering measurement in the biological and biopharmaceutical sciences. Analytical Biochemistry. 501, 4-22 (2016).
- Hirayama, K., Akashi, S., Furuya, M., Fukuhara, K. Rapid confirmation and revision of the primary structure of bovine serum albumin by ESIMS and frit-FAB LC/MS. Biochemical and Biophysical Research Communications. 173 (2), 639-646 (1990).
- Zhu, H., Ownby, D. W., Riggs, C. K., Nolasco, N. J., Stoops, J. K., Riggs, A. F. Assembly of the gigantic hemoglobin of the earthworm Lumbricus terrestris. Roles of subunit equilibria, non-globin linker chains, and valence of the heme iron. The Journal of biological chemistry. 271 (47), 30007-30021 (1996).
- Peters, T., Feldhoff, R. C. Fragments of bovine serum albumin produced by limited proteolysis. Isolation and characterization of tryptic fragments. Biochemistry. 14 (15), 3384-3391 (1975).
- Lebendiker, M., Danieli, T. Production of prone-to-aggregate proteins. FEBS Letters. 588 (2), 236-246 (2014).
- Amartely, H., Avraham, O., Friedler, A., Livnah, O., Lebendiker, M. Coupling Multi Angle Light Scattering to Ion Exchange chromatography (IEX-MALS) for protein characterization. Scientific Reports. 8 (1), 6907 (2018).
- Astafieva, I. V., Eberlein, G. A., John Wang, Y. Absolute on-line molecular mass analysis of basic fibroblast growth factor and its multimers by reversed-phase liquid chromatography with multi-angle laser light scattering detection. Journal of Chromatography A. 740 (2), 215-229 (1996).
- Onsberg, M., Øgendal, L. H., Jensen, M. L., Howells, L. B., Andersen, B., Bjerrum, M. J. Light scattering coupled with reversed phase chromatography to study protein self-association under separating conditions. Journal of Chromatography B. 938, 60-64 (2013).
- Kim, Y., et al. High-throughput protein purification and quality assessment for crystallization. Methods. 55 (1), 12-28 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır