Method Article
다각형 광 산란에 결합된 크기 배제 크로마토그래피에 의한 단백질의 특성 (SEC-MALS)
요약
이 프로토콜은 용액에서 단백질과 복합체의 절대 특성화를 위한 다각형 광 산란(SEC-MALS)과 크기 배제 크로마토그래피의 조합을 설명합니다. SEC-MALS는 순수 단백질, 토착 올리고머, 이종 복합체 및 당단백질과 같은 변형 된 단백질의 분자량과 크기를 결정합니다.
초록
용액에서 단백질및 단백질 단백질 복합체의 분자량을 결정하는 데 일반적으로 사용되는 분석 크기 배제 크로마토그래피(SEC)는 분석물의 용출 량에 의존하여 분자를 추정하는 상대적인 기술입니다. 무게. 단백질이 구형이 아니거나 이상적이지 않은 컬럼 상호작용을 겪는 경우, 단백질 표준에 기초한 교정 곡선은 유효하지 않으며 용출 부피에서 결정된 분자량이 올바르지 않습니다. 다중 각도 광 산란(MALS)은 기본 물리적 방정식에서 솔루션내 의 해액의 분자량을 결정하는 절대 기술입니다. 분석을 위해 MALS와 분리를 위한 SEC의 조합은 단량체, 토착 올리고머 또는 응집체 및 이종 복합체를 포함한 하나 이상의 단백질 종의 솔루션을 특성화하기 위한 다재다능하고 신뢰할 수 있는 수단을 구성합니다. SEC-MALS는 각 용출 부피에서 측정이 수행되기 때문에 용출 피크가 균질한지 아니면 이질적인지 확인하고 고정 분자량 분포와 동적 평형을 구별할 수 있습니다. 당단백질 또는 지단백질과 같은 변형된 단백질, 또는 세제 용해막 단백질과 같은 접합체의 분석도 가능합니다. 따라서, SEC-MALS는 생물학적 또는 생명 공학 적 연구를 위해 생산 된 분자의 생물 물리학적 특성 및 용액 거동을 확인해야하는 단백질 화학자를위한 중요한 도구입니다. SEC-MALS용 이 프로토콜은 순수 단백질 단량체 및 응집체의 분자량과 크기를 분석합니다. 취득한 데이터는 복합체, 당단백질 및 계면활성제 결합 막 단백질을 포함하여 추가 SEC-MALS 분석을 위한 기초역할을 합니다.
서문
용액에 있는 단백질의 분자량 (MW)의 믿을 수있는 분석은 생물 분자 연구 1,2,3,4를위해 필수적입니다. MW 분석은 정확한 단백질이 생성되었는지, 그리고 추가 실험5,6에사용하기에 적합한지 과학자에게 알려줍니다. 단백질 연구 네트워크 P4EU7 및 ARBRE-Mobieu8의웹 사이트에 설명된 바와 같이, 단백질 품질 관리는 최종 제품의 순도뿐만 아니라 올리고머 상태, 균질성, 정체성, 형태, 구조, 번역 후 수정 및 기타 속성.
비변성 용액에서의 MW 측정은 단조체 또는 올리고머 여부에 관계없이 수성 환경에 존재하는 단백질의 형태를 식별합니다. 많은 단백질에 대한 목표는 단조로운 형태를 생산하는 것이지만, 다른 사람들에게는 특정 네이티브올리고머가 생물학적 활성 9,10,11,12의핵심이다. 다른 올리고머 및 비 네이티브 골재는 바람직하지 않으며 결정학, 핵 자기 공명 (NMR) 또는 작은 각도 X 선 산란뿐만 아니라 기능 분석의 유물 또는 부정확성에 의한 구조적 결정에 결함을 초래할 것입니다. 등온 적정 열량 계열 또는 표면 플라스몬 공명2,13에의한 결합을 정량화한다.
단일클론 항체(mAbs)와 같은 바이오 치료제의 경우, 솔루션 기반 MW 분석은 품질 관리 및 제품 특성화와 유사한 목적을 제공합니다. 과도한 응집체와 파편은 사람의 사용에 적합하지 않은 불안정한 제품을 나타냅니다. 규제 기관은 치료 분자뿐만 아니라 최종 제품14,15,16,17에존재할 수 있는 잠재적 인 분해제뿐만 아니라 신중한 특성화를 요구합니다.
단백질 MW를 분석하기위한 가장 광범위한 방법 중 일부는 나트륨 도데실 황산폴리아크릴아미드 젤 전기 영동 (SDS-PAGE), 모세관 전기 영동 (CE), 네이티브 PAGE, 질량 분석법 (MS), 크기 배제 크로마토그래피 (SEC) 및 분석 초원심분리(AUC)를 이들 중, SDS-PAGE, CE 및 MS는 네이티브 상태에서 수행되지 않으며 전형적으로 올리고머 및 골재의 해리로 이어지므로 네이티브 올리고머를 결정하거나 정량화 집계에 적합하지 않습니다. 네이티브 PAGE는 이론적으로 기본 상태를 유지하지만, 우리의 경험에서 많은 단백질을 최적화하기가 어렵고 결과는 매우 신뢰할 수 없습니다. 침전 속도 또는 침전 평형에 의한 AUC는 정량적이며 첫 번째 원칙에서 MW를 결정할 수 있지만 매우 번거롭기 때문에 데이터 해석, 긴 실험 시간 및 매우 비싼 악기.
분석 SEC는 포장된 컬럼을 통해 흐르는 동안 거대 분자를 분리하는 정량적이고 비교적 견고하며 간단한 방법입니다. SEC의 원칙과 응용 프로그램은 잘 여러 리뷰18,19,20 및 핸드북 "크기 제외 크로마토그래피 : 원칙과 방법"21에 제시된다 . 보유의 차이는 컬럼의 끝에서 용출하기 전에 고정된 단계에서 기공 안팎으로 확산되는 데 소요된 시간의 다른 양때문입니다. 그 차이는분자(22)의상대적 크기 및 확산 계수로부터 (명목상으로) 발생한다. 보정 곡선은 분자의 MW를 용출 부피에 관한 일련의 기준 분자를 사용하여 구성됩니다. 단백질의 경우, 기준 분자는 일반적으로 잘 행동, 전하 또는 소수성 표면 잔기를 통해 컬럼과 상호 작용하지 않는 구형 단백질. 용출 부피는 자외선(UV) 흡광도 검출기로 측정됩니다. UV 소멸 계수가 공지된 경우-단백질 피크 총 질량도 정량화될 수 있다.
특히, SEC에 의한 MW 분석은 특징이 될 단백질에 관한 두 가지 주요 가정에 의존합니다: 1) 그들은 기준 표준과 동일한 형태 및 특정 부피 (즉, 확산 특성 과 동일한 관계) MW) 및 2) 기준 표준과 마찬가지로, 그들은 입체 적 특성을 제외하고 컬럼과 상호 작용하지 않습니다 - 그들은 전하 또는 소수성 상호 작용에 의해 열 패킹을 준수하지 않습니다. 이러한 가정으로부터의 편차는 교정 곡선을 무효화하고 잘못된 MW 판정으로 이어집니다. 이는 그들의 광범위한 비정형 영역23,24 또는 비구형/선형 올리고머 어셈블리(10)로 인해 큰 스토크스 반경을가지는 본질적으로 무질서한 단백질의 경우이다. 글리코실화된 단백질은 일반적으로 추가된 탄수화물 덩어리가19를고려하는 경우에도 비당화 형태보다 더 큰 스토크스 반경을 가질 것이다. SEC로부터의 용출은 단백질25의 올리고머 상태와 어금니 덩어리가 아닌 폴리펩티드-세제-지질 복합체의 총 크기에 의존하기 때문에 세제-용해막 단백질은 교정 단백질과 다르게 용출됩니다. ,26. 컬럼 화학, pH 및 염 조건은 모두 충전 된 또는 소수성 표면 잔류물을 가진 단백질의 용출 볼륨에 영향을 미칩니다27,28.
SEC는 다중 각도 광 산란 (MALS) 및 차동 굴절률 (dRI) 검출기 3,4,11,29와결합 할 때 MW 결정을위한 훨씬 더 다재다능하고 신뢰할 수있게됩니다. 30,31,32. dRI 검출기는 어액의 존재로 인한 용액 굴절률의 변화에 따라 농도를 결정합니다. MALS 검출기는 분석체에 의해 산란된 빛의 비율을 입사 레이저 빔에 비해 여러 각도로 측정합니다. SEC-MALS로 통칭되는 이 계측은 MW가 방정식 1을 사용하여 첫 번째 원리에서 직접 계산할 수 있기 때문에 용출 시간과 독립적으로 MW를 결정합니다.
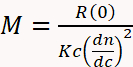 ⑴
⑴
여기서 M은 분석물의 분자량, R(0) 감소된 레일리 비(즉, 레이저 강도에 비해 분석체에 의해 산란된 빛의 양)가 MALS 검출기에 의해 결정되고 0으로 추정되고, c UV 또는 dRI 검출기에 의해 결정된 중량 농도, dn/dc는 타액화의 굴절률 증분(기본적으로 포액화와 완충액의 굴절률 의 차이) 및 K에 의존하는 광학 상수 파장 및 용매 굴절률29와같은 시스템 특성.
SEC-MALS에서 SEC 컬럼은 다양한 종을 용액으로 분리하여 MALS 및 농도 검출기 셀에 개별적으로 진입하도록 만 사용됩니다. 실제 체류 시간은 단백질 종을 얼마나 잘 해결하는지를 제외하고는 분석에 아무런 의미가 없습니다. 계측기는 컬럼과 독립적으로 보정되며 기준 표준에 의존하지 않습니다. 따라서 SEC-MALS는 기본 물리적 방정식에서 MW 결정을 위한 '절대' 방법으로 간주됩니다. 샘플이 컬럼에 의해 완전히 분리되지 않은 경우, 각 용출 부피에서 제공되는 값은 시간 슬라이스당 유동 셀을 통해 흐르는 각 용출 부피에서 분자의 중량 평균, 약 75 μL이 될 것이다.
산란 강도의 각 변동을 분석함으로써, MALS는 또한 약 12.5 nm29보다큰 기하학적 반경을 가진 거대 분자 및 나노 입자의 크기(근평균 제곱 반경, Rg)를 결정할 수 있다. 단일성 단백질 및 올리고머와 같은 작은 종의 경우, 0.5 nm 및 최대33의유체 역학 적 반경을 측정하기 위해 동적 광 산란 (DLS) 모듈을 MALS 계측기에 첨가 할 수 있습니다.
UV 또는 dRI 농도 분석은 Eq. 1에서 c의 값을 제공할 수 있지만, dRI의 사용은 두 가지 이유로 선호됩니다: 1) dRI는 UV를 포함하지 않는 당 또는 다당류와 같은 분자를 분석하는 데 적합한 범용 농도 검출기입니다. 염색체34; 및 2) 수성 완충제의 거의 모든 순수 단백질의 농도 반응 dn/dc는 1~2% 이내(0.185 mL/g)35이므로UV 소멸 계수를 알 필요가 없다.
단백질 연구에 SEC-MALS의 사용은 매우 광범위하다. 지금까지 가장 일반적인 응용 프로그램은 정제 된 단백질이 단모성 또는 올리고머릭인지 및 올리고머화의 정도인지를 확립하고 응집체3,10,11,17, 31,36,37,38. 전통적인 수단으로는 특성화할 수 없는 세제 용해막 단백질에 대해 그렇게 할 수 있는 능력은 특히 소중하며, 이를 위한 상세한 프로토콜은31,39,40에 발표되었습니다. , 41세 , 42세 , 43. 다른 일반적인 응용 프로그램은 당단백질, 지단백질 및 유사한 접합체의 번역 후 수정 및 다분산의 정도를 확립 포함4,31,44 , 45세 , 46세 , 47; 단백질 단백질, 단백질 핵산 및 단백질 다당류 복합체를 포함하는 이종 복합체의 형성(또는 부족) 및 절대 화학조량계(stoichiometric 비율과 반대)24,46, 48,49,50,51,52; 단량체-디머 평형 해리 상수49,53,54; 및 단백질 형태 평가55,56. 단백질을 넘어, SEC-MALS는 펩티드57,58,헤파린59 및 키토산60,61,작은 과 같은 광범위하게 이질적인 천연 폴리머의 특성화에 매우 중요합니다. 바이러스62 및 합성 또는 가공 폴리머의 대부분의 유형63,64,65,66. 광범위한 참고 문헌은 문헌67과 온라인 (http://www.wyatt.com/bibliography)에서 찾을 수 있습니다.
여기서는 SEC-MALS 실험을 실행하고 분석하기 위한 표준 프로토콜을 제시합니다. 소 혈청 알부민 (BSA)은 단백질 단량체 및 올리고머의 분리 및 특성화에 대한 예로 제시된다. BSA 프로토콜은 복합체, 당단백질 및 계면활성제 결합 막 단백질을 포함한 추가 SEC-MALS 분석을 위한 기초역할을 하는 특정 시스템 상수를 결정합니다.
우리는 SEC-MALS가 많은 공급 업체에서 표준 고성능 액체 크로마토그래피 (HPLC) 또는 빠른 단백질 액체 크로마토그래피 (FPLC) 장비를 사용하여 수행 될 수 있음을 유의하십시오. 이 프로토콜은 연구 및 개발을 위한 단백질을 생산하는 실험실에서 흔일반적으로 발견되는 FPLC 시스템의 사용을 설명합니다(재료 표참조). 프로토콜을 실행하기 전에 FPLC 시스템, MALS 및 dRI 검출기를 제조업체의 지침및 필요한 교정 상수에 따른 제어, 데이터 수집 및 분석을 위한 해당 소프트웨어 패키지와 함께 설치해야 합니다. 또는 소프트웨어에 입력 된 다른 설정. 인라인 필터는 0.1 μm 기공 멤브레인이 설치된 펌프와 인젝터 사이에 배치되어야 합니다.
프로토콜
1. 시스템의 준비
- FPLC의 UV 검출기의 MALS 및 dRI 검출기를 다운스트림에 연결합니다. UV 검출기와 MALS 검출기 사이에 상당한 간 검출기 부피를 추가하므로 pH 및 전도도 검출기를 우회합니다. 컬럼에서 검출기 사이로 0.25 mm 즉, 검출기 출력에 0.75 mm 즉, 모세관 튜브를 사용하여 폐기물 또는 분획 수집기를 사용합니다.
- UV 검출기에서 MALS 아날로그 입력에 이르는 아날로그 출력, FPLC의 I/O 박스를 통해 FPLC에서 MALS 자동 주입까지의 디지털 출력을 포함하여 FPLC와 검출기 간의 필요한 신호 연결이 설정되었는지 확인합니다.
- 최소 20 kDa ~ 500 kDa의 분획 범위를 포함하는 적합한 분석 SEC 컬럼을 설치합니다. 제품 정보를 확인하여 컬럼이 샘플 및 이월 상에서 MW, pH 및 기타 특성 범위에 적합한지 확인합니다.
2. 버퍼의 준비, 밤새 시스템을 무성화하고 청결을 확인
- HPLC 등급 시약을 사용하여 50 - 100 mM NaCl로 인산염 완충 식염수 1 L을 준비합니다. 병 상판 폴예터 설폰 필터 등을 사용하여 완충을 0.1 μm로 필터링합니다. 건식 필터에서 미립자를 제거하기 위해 폐병에 버퍼의 처음 50-100 mL을 필터링하고 폐기한 다음, 나머지는 여과된 탈이온수로 철저히 세척한 깨끗하고 멸균된 병으로 여과하여 방지합니다. 먼지가 들어오지 않습니다.
참고: Tris 완충제와 같은 다른 이동상 용매는 이러한 용매에 우선적으로 용해되는 추가 단백질을 분석하는 경우에 사용될 수 있다. - 버퍼의 컬럼을 평형화하고 미립자를 제거하기 위해 컬럼 제조업체에서 권장하는 대로 0.5mL/min의 유량으로 하룻밤 동안 플러시하십시오. FPLC의 연속 흐름 모드를 사용하고 모든 SEC-MALS 실행이 완료될 때까지 흐름이 멈추지 않도록 합니다.
- 하룻밤 플러시 동안 퍼지 모드에 dRI 흐름 셀을 배치합니다. 샘플 실행을 시작하기 전에 제거를 끕니다.
- 플러시를 시작할 때, 컬럼의 급격한 압력 변화로 인한 "컬럼 흘리기" 효과(또는 입자 의 방출)를 방지하기 위해 유량을 서서히 램프합니다.
- 시스템이 매우 안정적이고 입자가 없는 것으로 알려져 있고 원하는 이상과 평형 상태인 경우, 하룻밤 플러시를 더 짧은 2-3시간 플러시로 교체하십시오.
- 컬럼의 튜브 다운스트림을 가볍게 눌러 축적된 입자를 방출하고 MALS 계측기의 전면 패널 디스플레이에서 90° 검출기의 신호를 관찰하여 시스템 청결도를 확인합니다. 피크 대 피크 노이즈가 50 -100 μV 이하인지 확인합니다.
- '빈' 주입을 수행하여 인젝터가 입자가 깨끗한지 확인합니다. '공백'은 단순히 실행 버퍼이며, 신선하고 멸균 된 바이알로 준비됩니다.
- 파티클 피크가 부피가 1mL 이하이고 기준선보다 5mV 를 초과하지 않으면 시스템이 시료에 사용할 준비가 된 것입니다. 그렇지 않으면 깨끗할 때까지 추가 빈 주사를 수행하거나 유지 보수를 수행하여 인젝터를 청소하십시오.
3. 샘플 준비 및 로딩
- SEC 버퍼에서 1-2 mg/mL에서 BSA의 최소 200 μL을 준비하십시오.
참고 : 강수량을 방지하기 위해, BSA는 순수한 물에 용해되어서는 안된다. - 주사기 팁 필터를 사용하여 단백질을 0.02 μm로 필터링합니다.
- 건조 필터에서 입자를 제거하기 위해 여과액의 처음 몇 방울을 폐기하십시오.
- 또는, 10,000 x g에서 15분 동안 샘플을 원심분리하여 비수용성 응집체 및 기타 큰 입자의 침전을 가능하게 한다.
- BSA 용액의 100 μL을 루프에 주입합니다.
참고: 이것은 권장되는 양의 물질이며, 안정성 또는 가용성과 같은 샘플의 상황에 따라 다소 주입될 수 있습니다. 주사 당 필요한 단백질의 양은 분자량과 반대로 변화합니다 - 분자량이 33 kDa인 경우 단백질 질량의 두 배, 또는 BSA의 절반.
4. MALS 소프트웨어 의 준비
- 신규 오픈 | MALS 소프트웨어 메뉴에서 방법에서 실험하고 라이트 산란 시스템 방법 폴더에서 온라인 방법을 선택합니다. DLS 검출기가 있는 경우 라이트 산란에서 온라인 방법을 선택합니다 | QELS 폴더.
- 구성 섹션에서 샘플 및 모바일 단계의 매개 변수를 설정합니다.
- 일반 펌프 뷰에서 유량을 FPLC에 사용된 흐름으로 설정합니다.
- 일반 펌프 뷰에서 용매 분기, 이름 필드, PBS를선택합니다.
- 인젝터 뷰에서 샘플 분기는 이름을 BSA로입력하고 dn/dc = 0.185(수정되지 않은 단백질의 표준 값), A2 = 0 및 UV 소멸 계수 = 0.667mL/(mg-cm)을 설정합니다.
참고: 다른 단백질의 경우, UV280 nm 소멸 계수는 문헌에서 발견되거나 다양한 퍼블릭 도메인 소프트웨어 도구를 사용하여 서열로부터 계산될 수 있다.
- 절차 섹션에서 기본 컬렉션 보기에서 자동 주입에서 트리거 확인란을 선택하고 실행 기간을 70분으로 설정하여 SEC의 총 투과 볼륨까지 전체 용출에 대한 데이터가 수집되도록 합니다. 열에 도달합니다.
참고: 필요한 시간은 컬럼 및 유량에 따라 달라질 수 있습니다 - 0.5 mL/min에서 표준 7.8mm x 300mm HPLC-SEC 컬럼에 35분의 수집이 필요합니다. - 실행 버튼을 클릭하여 MALS 소프트웨어에서 실험을 시작합니다. MALS 검출기를 통해 FPLC 계측기로부터 펄스 신호를 수신한 후 데이터를 읽기 시작합니다.
- 기기의 전면 패널에서 자동 제로 버튼을 클릭하여 dRI 신호를 제로합니다.
5. FPLC 소프트웨어 준비
- 단백질의 이름과 FPLC 소프트웨어에 설명서에 실행 설명서 삽입 | 수동 지침 실행 | 표시를 설정합니다.
- 사출 밸브를 수동 하중에서 유량 경로 에서 주입으로 전환 | 사출밸브.
- I/O 박스 아래에 0.5s 펄스를 삽입하여 펄스 신호를 포함 | 펄스 디지털 아웃. 이렇게 하면 MALS 소프트웨어에서 데이터 수집이 트리거됩니다.
6. 샘플을 루프에 주입합니다. FPLC 소프트웨어에서 실행을 클릭하여 실험 실행을 시작합니다.
7.SEC-MALS BSA 데이터 분석
- MALS 소프트웨어의 절차 섹션에서 단계별로 분석을 수행합니다.
- 기본 컬렉션 보기를 확인하여 UV, MALS 및 RI에서 거의 동일한 용출 볼륨에서 피크가 나타나는지 확인합니다.
- 기준선 보기에서 모든 신호(모든 LS 검출기, UV 및 dRI)에 대한 기준선을 정의합니다. 기준선은 샘플 피크의 한쪽에서 다른 쪽으로 스트레칭하는 것이 바람직한 순수 용매의 수준을 나타내기 위해 정의되어야 합니다.
- 피크 뷰에서 마우스를 클릭하고 드래그하여 분석할 피크를 정의합니다. 각 피크의 중앙 50%를 선택합니다. 먼저 단량체 피크('피크 1')를 선택한 다음 이량체 피크('피크 2')를 선택합니다. 각 피크 에서 BSA에 대한 dn / dc = 0.185 및 UV 280 nm 소멸 계수의 올바른 값을 확인합니다.
- 피크 정렬, 대역 확대 보정 및 정규화 절차를 수행합니다.
참고: 일반적으로 SEC-MALS 방법은 BSA와 같은 반경 Rg < 10 nm의 단분산 단백질을 사용하여 90° 검출기로 의 한정 계열, 밴드 확대 및 정상화를 위해 주기적으로 보정됩니다. 모노 머. 이 예에서, BSA는 교정 분자로서 역할을 하며 그 자체가 MW 분석의 대상이 된다.- 절차 | 정렬보기, 클릭하고 마우스를 드래그하여 피크의 중앙 영역을 선택, 다음 확인을 정렬을 클릭합니다.
- 절차 | 밴드 확대보기, 단량체 피크의 중앙 50 %를 선택합니다. RI 검출기가 참조 계측기로지정되어 있는지 확인한 다음 맞춤 수행을 클릭하고 적용하여 UV 및 LS 신호를 RI 신호에 일치시킵니다.
- 피크를 확대하여 중앙 50-70% 내에서 매우 밀접하게 겹치는지 확인한 다음 확인을 클릭합니다.
- 겹침이 완벽하지 않은 경우, (필요할 수도 있음) 적합을 수행하고 중첩이 우수할 때까지 한두 번 더 "적용"합니다.
- 절차 | 정규화 뷰를 선택하고 피크 1을 선택하고 Rg 값으로 3.0 nm을 입력한 다음 정규화를 클릭합니다.
- 절차 | MALS 뷰에서 어금니 질량 및 Rg를 검토하여 과도한 노이즈로 인해 분석에서 검출 각도를 선택 해제해야 하는지 결정합니다. 일반적으로, 이들은 먼지 입자가 상대적으로 높은 강도를 산란하는 낮은 각도가 될 것입니다. 오른쪽 그래프에서 피크 내의 개별 슬라이스를 선택하고 왼쪽 그래프에서 역 감소 레일리 비율의 각도 의존도를 봅니다. 가장 낮은 각도(때로는 가장 높은 각도)가 맞춤에서 일관되게 벗어나면 뷰 맨 아래에 있는 목록에서 선택 해제합니다.
- EASI 그래프 보기에서 결과 그래프를 봅니다. 창 상단의 디스플레이 드롭다운에서 어금니 질량을 선택합니다. Ctrl + 클릭 하고 드래그를 사용하여 피크 영역을 확대합니다.
- 결과에서 단량체 및 디머 피크에 대한 최종 표에 기재된 중량 평균 어금니 질량 결과 보기 | 피크 결과 아래의 보고서(요약) 보기 | 어금니 질량 모멘트(g/mol) | Mw. 순도는 피크 결과에 따라 보고됩니다 | 질량 분수(%).
참고 : 다른 대구 대금 질량 모멘트도 표시됩니다. 이들은 일반적으로 이기종 중합체에 관련, 그러나 개별적인 크기를 가진 단백질에 아닙니다. 소프트웨어에 의해 생성된 많은 다른 결과는 백분율 질량 회수(주입된 양에 비해 농도 검출기를 통해 용출된 단백질의 분율), 피크 통계, 다분산성, Rg와 같은 보고서에 포함될 수 있다. R H 모멘트 등 제공된 경우, 불확실성 측정은 측정 시리즈 내의 노이즈를 기반으로 인용된 값의 정밀도를 반영하며 정확도를 나타내는 것으로 간주해서는 안 됩니다. 보고된 값의 실제 정확도는 제공된 dn/dc 및 소멸 계수 값, 계측기 교정 등과 같은 다양한 요인에 따라 달라집니다. - 파일 메뉴에서 방법으로 저장을 선택하고 모든 유형의 단백질을 향후 측정을 위한 표준 방법으로 분석된 BSA 데이터를 저장합니다. BSA에 대해 결정된 정규화 및 대역 확대 매개변수는 분석에서 이월됩니다.
결과
그림 1a, b는 BSA의 세 가지 올리고머 형태가 단량체, 디머 및 트리머, 단량체 및 디머의 기준 선해상도로 200 Å 기공 컬럼에서 잘 분리된 반면, 그림 2a는 75 Å 기공 컬럼에서 분리되지 않았다는 것을 보여줍니다. 좋은 단량체 분해능을 달성할 수 있습니다. 후자의 예는 "불량" 결과를 설명하기 위해 포함되었습니다. 두 열에 대한 분리의 이러한 차이는 제조업체의 명시된 분리 범위에 따라 실제로 예상될 수 있습니다. 트리머는 이량체로부터 완전히 분리되지 않고 높은 올리고머는 트리머와 서로 잘 분리되지 않습니다. 그림 2b는 정확한 MW 측정을 배제하는 크로마토그램 전체에 입자가 존재하는 시끄러운 광 산란 신호의 예입니다.
이제부터 우리는 그림 1b에초점을 맞춥니다. 13.8 mL에서 용출된 단량체는, 3.54±0.01 nm의 MALS 및 유체역학적 반경 Rh에 의해 결정된 64.1±0.4 kDa의 중량 평균 몰 질량 Mw를 나타낸다. 이들 결과는 SEC-MALS의 통상적인 정확도 내에서 BSA, 66.4 kDa 및 3.5 nm 각각 6.5 nm의 서열 질량 및 공지된 유체역학 적 반경과 일치하며, 5%3,69. 12 mL에서 용출된 이량체는, MALS에 의해 결정된 127±1 kDa의 Mw 값을 나타내었으며, 단량체의 2배의 실험 정밀도 및 Rh 5.68±0.06 nm 이내로 판정하였다. 트리머 피크는 또한 11 mL에서 194±9 kDa의 Mw로 MALS에 의해 결정되었으며, 모노머의 3배의 실험 정밀도 내에서 예상대로 관찰되었다. R (것)에 트리머의 h는 DLS 신호의 낮은 강도로 인해 결정될 수 없습니다.
단량체 피크에 걸쳐 계산된 어금니 질량 점은 균질성을 나타내는 2-5% 이내로 균일합니다. BSA 단편70에해당하는 38-50 kDa의 범위에서 어금니 질량을 가진 후행 어깨를 찾는 것은 드문 일이 아닙니다. 디메릭 및 트리메릭 피크를 가로지르는 어금니 질량 점은 균일하지 않으며 이질성을 나타냅니다. 이량체 피크는 디머 피크로 출혈하는 트리머의 흔적으로 인해 다소 이질적이며, 트리머 피크는 잘못 해결된 높은 올리고머의 공동 용출로 인해 이질적이다.
단량체 피크의 신호 대 잡음 수준은 신호 대 잡음 40:1의 디머 피크와 마찬가지로 100:1 이상의 세 신호 에서 모두 허용됩니다. 단백질 피크를 넘어 크로마토그램 영역은 평평하며, LS 트레이스의 총 배제(void) 부피에 의한 피크를 제외하고는 dRI 트레이스에서 (양수) 염수 피크와 (음수) 용존 공기 피크를 총 투과에 가깝게 볼륨. 그림 1a에서지적됩니다.
순도 수준은 또한 SEC-MALS 실험에서 계산될 수 있다: 보고서에서 단모성 피크의 질량 분율은 단모체 형태의 순도백분율의 백분율을 나타낸다. BSA 단량체의 경우 계산된 순도는 88%입니다.
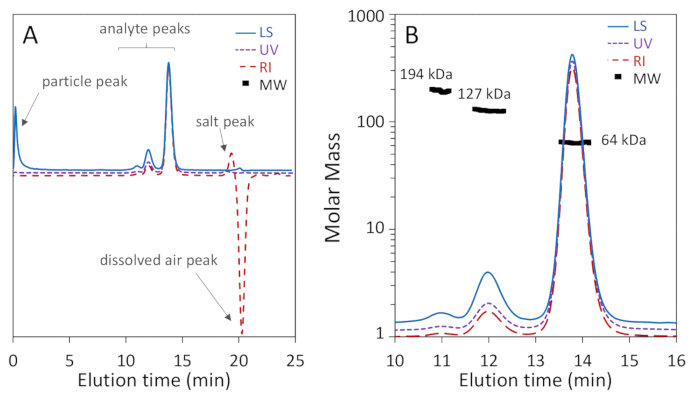
그림 1 : 200 Å 기공 크기 배제 컬럼을 사용하여 소 혈청 알부민(BSA)의 SEC-MALS 분석. 크로마토그램 트레이스는 단량체 피크로 정규화되고 명확성을 위해 오프셋됩니다. (A) 무시할 수 있는 일반적인 아티팩트는 광 산란 신호의 시작 부분에 가까운 입자 피크뿐만 아니라 굴절률 신호의 총 투과 량 근처의 염 및 용존 공기 피크를 포함한다고 지적된다. (B) 크로마토그램은 우수한 단량체-디머-트리머 분리를 나타내고 광 산란 신호는 높은 신호 대 잡음을 나타낸다. 단량체 및 이량MW 값은 높은 균질성을 나타낸다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
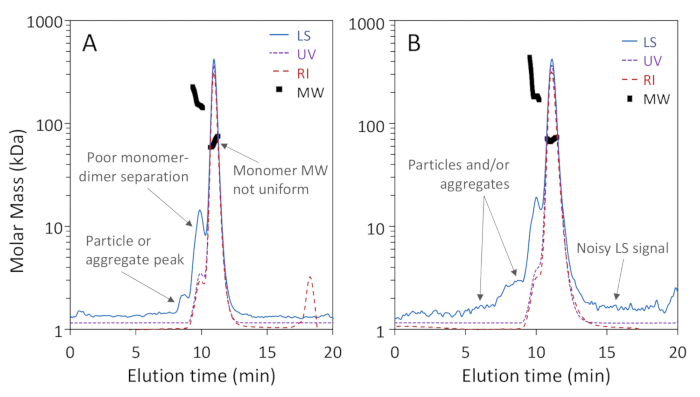
그림 2 : 저품질 SEC-MALS 분석의 예. 크로마토그램 트레이스는 단량체 피크로 정규화되고 명확성을 위해 오프셋됩니다. (a) 75 Å 기공 크기 배제 컬럼상의 부적절한 분리; 8 -9 분 사이의 입자 피크는 단백질과 잘 분리되지 않습니다. (b) 단백질에 인접한 부적절한 신호 대 잡음 비 및 광 입자는 광 산란(LS) 신호에서 명백하다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
SEC-MALS 실험은 각 피크의 어금니 질량 및 유체 역학 크기에 대한 단량체, 이량체 및 트리머 및 정량적 결과를 양호하게 분리했습니다. 이것은 차례로 명확하게 식별하고 존재하는 각 종을 특성화, 뿐만 아니라 순도를 정량화. 일반적으로 얻어진 결과는 5% 이내로 정확하며, 1-2%3,69이내로 정확하고 반복가능하다. 이러한 수준의 정밀도와 반복성은 SEC에 의해 분리되어 있는 한 MW에서 가까운 종을 자신 있게 구별할 수 있게 합니다(동일한 피크 내에서 부분적으로 겹칠 수 있음). 단백질 품질 관리 및 기본적인 생물 물리학 특성에 대 한 혜택은 명백하다.
민감하고 반복 가능한 SEC-MALS 측정에는 미립자 부재를 확인하는 것이 매우 중요합니다. 입자 피크는 일반적으로 유사한 UV 또는 RI 신호를 동반하지 않고 큰 MALS 신호로 나타납니다. 이러한 입자를 제거하기 위해 이면 상과 샘플을 신중하게 준비해야 합니다. HPLC 등급 시약 또는 더 나은, 0.1 - 0.2 μm에 이동상 및 희석 버퍼의 여과 (항상 건조 막에 존재하는 입자를 제거하기 위해 필터를 사전 세척), 엑스트라 클린 이동상 병 및 기타 유리 제품의 유지 보수 SEC-MALS 및 흐름 중 확장된 열 평형(흐름이 중지되거나 열이 사용되지 않을 때 누적되었을 수 있는 미립자 및 집계를 제거하기 위해) 모두 권장됩니다. 샘플은 관심 물질을 제거하지 않는 가장 작은 기공 크기로 여과되어야하며, 일반적으로 0.1 μm보다 크지 않고 가능하면 0.02 μm입니다. 필터가 빠르게 막히면 샘플을 원심 분리, 내림차순 기공 크기 의 단계로 필터링 및 / 또는 재 정제 될 수 있습니다. 시스템이 고품질, 신선 및 여과 된 이상으로 일관되게 유지되는 경우, 컬럼 충격이 방지되고, 샘플이 깨끗하고 컬럼에 부착되지 않는 경우, 측정은 상기 미립자 노이즈를 나타내지 않으며 제공 할 것입니다. 고품질 데이터를 수집할 수 있습니다.
MALS는 단백질에 대한 일반적인 SEC 버퍼에 불가지론적입니다. PBS 외에 많은 다른 버퍼 시스템은 다양한 부형제(71)를 포함하는분리 및 안정성을 최적화하는데 사용될 수 있다. MALS는 또한 최적의 분리 및 복구를 위해 선택해야 하는 특정 컬럼에 구애받지 않습니다. 분석과 관련된 부형제에 대한 주요 관심사는 굴절률의 중요한 변화로 인해 특정 굴절률 증분 dn/dc및UV 분석이 필요할 때 280nm를 흡수하는 부형제의 변형으로 이어집니다. 예를 들어, 아르기닌은 일반적인 단백질의 dn/dc에 극적으로 영향을 미칠 수 있는 일반적인 응집 감소 부형제이며, 심지어 부정적인 정권에 영향을 미칠 수 있습니다(음의 dn/dc를 가진 단백질은 여전히 SEC-MALS에 의해 분석될 수 있습니다/ dc는 경험적으로 결정되지만 dn / dc = 0이면 단백질에 의해 산란된 빛의 강도가 null이되고 MW 분석이 불가능합니다. 단백질에 대한 dn/dc 값의 주제는 Zhao et al.35에 의해 광범위하게 논의되며, 표준 수성 완충제의 경우 대부분의 수정되지 않은 단백질이 표준 값의 2-3% 이내(0.185 또는 0.186 mL/g = 660 nm)에 속하는 것으로 나타났습니다. , ~ 10 kDa 이하의 단백질은 더 가변적이지만, 0.21 mL / g만큼 높을 수있는 몇 가지 종이 있습니다.
제시된 데이터에서 BSA 단량체 및 이량체 피크에 걸친 MW 프로파일은 모두 2% 이내로 매우 균일하여 단분산 종을 나타낸다. 피크에 걸쳐 비균일 MW 값은 이질성 또는 부적절한 분석으로 인해 발생할 수 있습니다. 특히, 오목 ('미소') 또는 볼록 ('grimace')인 BSA MW 프로파일은 밴드 확대 보정을 올바르게 적용하지 않아 발생할 수 있습니다. 다른 단백질의 경우, 볼록 한 프로필은 단량체와 올리고머 사이의 동적 평형에서 발생할 수 있습니다, 여기서 올리고머에 단량체의 비율 - 따라서 명백한 MW 값 - 피크 농도에 따라 달라집니다 (BSA는이 동작을 나타내지 않으며 종종 사용된다 제어 샘플로 올바른 밴드 확대 매개 변수를 확인합니다). 선행에서 후행 가장자리까지 다양하고 시료 농도로 변하지 않는 MW 프로파일은 SEC에 의해 부분적으로 해결되는 분자량 종의 분포의 전형입니다. 단백질의 다른 총 양을 주입하여 명백하게 불균일 한 분포의 소스 - 분포는 동적 평형에 따라 다르지만 고정 분포 또는 잘못된 대역 확대 보정으로는 변하지 않습니다.
위에서 설명한 제약 조건을 감안할 때 SEC-MALS는 다양한 작업에 적합하지 않습니다. 원유 샘플 분석에는 적합하지 않습니다. 샘플은 표준 친화성 및 연마 방법에 의해 잘 정제되어야한다. 그것은 동일하거나 매우 가까운 질량으로 단백질 또는 mAb의 돌연변이체 및 변이체를 식별하기에 충분한 정확도 또는 해결 능력을 가지고 있지 않으며, SEC 열에서 용해하거나 분리되지 않는 분석하고 사용할 수 없습니다, 그러나 최근에는 이온 exchang 것으로 나타났습니다 전자 또는 역상 크로마토그래피는 MALS와 결합되어 SEC 72,73,74에의해 해결되지 않은 종을 분리하고 특성화 할 수 있습니다. 단백질 양이 심하게 제한되는 경우, SEC-MALS는 일반적으로 10 - 200 μg 3을 필요로하기 때문에 실현 가능하지 않을 수 있으며, 더 많은 튜브 내경이 0.25 mm보다 큰 FPLC 시스템에 의해 요구될 수 있습니다; 그러나, 더 작은 양은 UHPLC-SEC-MALS에 의해 분석될 수 있습니다. 이동상에 도입시 응집되는 매우 불안정한 단백질은 SEC-MALS 분석에 적합하지 않지만, 오프라인 동적 광 산란을 이용한 완충최적화는 이러한 문제를 극복할 수 있다75.
SEC-MALS가 수반하는 추가 노력에도 불구하고 단백질 연구에 매우 중요하며 학술 및 바이오 제약 커뮤니티에서 광범위하게 사용됩니다. SEC-MALS는 상기 프로토콜에 설명된 바와 같이 단량체, 올리고머 및 응집체의 특성화 외에도 당단백질(단백질 및 글리칸 성분의 MW를 개별적으로 결정함), 계면활성제 또는 지질 용해 막 단백질 (단백질 및 용해제 성분의 MW를 개별적으로 결정), 바이러스 와 같은 입자, 단백질 단백질 및 단백질 핵산 복합체, 다당류, 단백질 다당류 접합체, 펩티드 및 기타 많은 생체 거대 분자.
공개
DS는 와이엇 테크놀로지 코퍼레이션의 직원으로, MALS 제품이 이 프로토콜에 활용됩니다. AT는 와이엇 말스와 AKTA FPLC 계측기의 유통업체인 다야엘 생명공학의 직원입니다.
감사의 말
Tsafi Danieli 박사(히브리 대학교 응용 구조 생물학 울프슨 센터)에게 조언과 협력에 감사드립니다. 우리는 또한 다니엘 생명 공학 주식 회사 (Rehovot, 이스라엘) 이 연구에 활용 된 분석 FPLC-MALS 시스템의 도움과 설립에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| AKTA pure | GE Healthcare | 29-0182-26 | fast protein liquid chromatograph (FPLC) |
| AKTA UNICORN | GE Healthcare | FPLC control software | |
| ASTRA | Wyatt Technology | MALS data acquisition and analysis software | |
| Bovine serum albumine (purity >97%) | Sigma | A1900 | analyte |
| DAWN or miniDAWN | Wyatt Technology | WH2 or WTREOS | multi-angle light scattering (MALS) detector |
| Increase 200 10/300 | GE Healthcare | size exclusion column, 200 Å pores, 10 mm i.d., 300 mm length | |
| Optilab | Wyatt Technology | WTREX | differential refractive index (RI) detector |
| Sodium chloride NaCl | Sigma | 71382 | HPLC grade NaCl |
| Stericup bottle top filter polyether sulfone 0.1 µm 1000 mL | Millipore | SCVPU11RE | mobile phase filter |
| Whatman Anotop 10 syringe filter 0.02 µm | GE Healthcare | 6809-1002 | sample filter |
| Whatman Anotop 10 syringe-tip filter, 0.1 µm pore, 10 mm diameter | GE Healthcare | 6809-1012 | sample filter |
| Whatman Anotop 25 syringe filter 0.1 µm | GE Healthcare | 6809-2012 | mobile phase filter |
| WyattQELS | Wyatt Technology | WIQ | dynamic light scattering detector |
참고문헌
- Acton, T. B., et al. Robotic cloning and Protein Production Platform of the Northeast Structural Genomics Consortium. Methods in Enzymology. 394, 210-243 (2005).
- Acton, T. B., et al. Preparation of protein samples for NMR structure, function, and small-molecule screening studies. Methods in Enzymology. 493, 21-60 (2011).
- Folta-Stogniew, E., Williams, K. R. Determination of molecular masses of proteins in solution: Implementation of an HPLC size exclusion chromatography and laser light scattering service in a core laboratory. Journal of Biomolecular Technology. 10 (2), 51-63 (1999).
- Kendrick, B. S., Kerwin, B. A., Chang, B. S., Philo, J. S. Online size-exclusion high-performance liquid chromatography light scattering and differential refractometry methods to determine degree of polymer conjugation to proteins and protein-protein or protein-ligand association states. Analytical Biochemistry. 299 (2), 136-146 (2001).
- Hughes, C. S., Longo, E., Phillips-Jones, M. K., Hussain, R. Quality control and biophysical characterisation data of. Data Brief. 14, 41-47 (2017).
- Muthurajan, U., et al. In Vitro Chromatin Assembly: Strategies and Quality Control. Methods in Enzymology. 573, 3-41 (2016).
- P4EU. . Protein Quality Standard PQS. , (2019).
- Arbre Mobieu. . Guidelines on Protein Quality Control. , (2019).
- Bowman, A., et al. The histone chaperones Vps75 and Nap1 form ring-like, tetrameric structures in solution. Nucleic Acids Research. 42 (9), 6038-6051 (2014).
- Bowman, G. R., et al. Oligomerization and higher-order assembly contribute to sub-cellular localization of a bacterial scaffold. Molecular Microbiology. 90 (4), 776-795 (2013).
- Folta-Stogniew, E. Oligomeric states of proteins determined by size-exclusion chromatography coupled with light scattering, absorbance, and refractive index detectors. Methods in Molecular Biology. 328, 97-112 (2006).
- Vieux, E. F., Wohlever, M. L., Chen, J. Z., Sauer, R. T., Baker, T. A. Distinct quaternary structures of the AAA+ Lon protease control substrate degradation. Proceedings of the National Academy of Sciences of the United States of America. 110 (22), E2002-E2008 (2013).
- Group, N.S.. . use of SEC-MALS in crystallization QC. , (2018).
- Ahrer, K., Buchacher, A., Iberer, G., Josic, D., Jungbauer, A. Analysis of aggregates of human immunoglobulin G using size-exclusion chromatography, static and dynamic light scattering. Journal of Chromatography A. 1009 (1-2), 89-96 (2003).
- Narhi, L. O., Schmit, J., Bechtold-Peters, K., Sharma, D. Classification of protein aggregates. Journal of Pharmaceutical Sciences. 101 (2), 493-498 (2012).
- Spiess, C., et al. Bispecific antibodies with natural architecture produced by co-culture of bacteria expressing two distinct half-antibodies. Nature Biotechnology. 31 (8), 753-758 (2013).
- Philo, J. S. A critical review of methods for size characterization of non-particulate protein aggregates. Current Pharmaceutical Biotechnology. 10 (4), 359-372 (2009).
- Stellwagen, E. Gel filtration. Methods in Enzymology. 463, 373-385 (2009).
- Burgess, R. R. A brief practical review of size exclusion chromatography: Rules of thumb, limitations, and troubleshooting. Protein Expression and Purification. 150, 81-85 (2018).
- Striegel, A. M., Yau, W. W., Kirkland, J. J., Bly, D. D. . Modern Size-Exclusion Liquid Chromatography. , (2009).
- GE Healthcare. . Size Exclusion Chromatography: Principles and Methods. , (2014).
- Uliyanchenko, E. Size-exclusion chromatography-from high-performance to ultra-performance. Analytical and Bioanalytical Chemistry. 406 (25), 6087-6094 (2014).
- Dunker, A. K., Silman, I., Uversky, V. N., Sussman, J. L. Function and structure of inherently disordered proteins. Current Opinion in Structural Biology. 18 (6), 756-764 (2008).
- Hsiao, H. H., Nath, A., Lin, C. Y., Folta-Stogniew, E. J., Rhoades, E., Braddock, D. T. Quantitative characterization of the interactions among c-myc transcriptional regulators FUSE, FBP, and FIR. Biochemistry. 49 (22), 4620-4634 (2010).
- Hayashi, Y., Takagi, T., Maezawa, S., Matsui, H. Molecular weights of alpha beta-protomeric and oligomeric units of soluble (Na+, K+)-ATPase determined by low-angle laser light scattering after high-performance gel chromatography. Biochimica et Biophysica Acta. 748 (2), 153-167 (1983).
- Folta-Stogniew, E. J. Macromolecular Interactions: Light Scattering. Encyclopedia of Life Sciences. , (2009).
- Hong, P., Koza, S., Bouvier, E. S. P. Size-Exclusion Chromatography for the Analysis of Protein Biotherapeutics and their Aggregates. Journal of Liquid Chromatography and Related Technology. 35 (20), 2923-2950 (2012).
- Chakrabarti, A. Separation of Monoclonal Antibodies by Analytical Size Exclusion Chromatography. Antibody Engineering. , (2018).
- Wyatt, P. J. Light scattering and the absolute characterization of macromolecules. Analytica Chimica Acta. 272, (1993).
- Takagi, T. Application of low-angle laser light scattering detection in the field of biochemistry: review of recent progress. Journal of Chromatography A. 506, 51-63 (1990).
- Wen, J., Arakawa, T., Philo, J. S. Size-exclusion chromatography with on-line light-scattering, absorbance, and refractive index detectors for studying proteins and their interactions. Analytical Biochemistry. 240 (2), 155-166 (1996).
- Mogridge, J. Using light scattering to determine the stoichiometry of protein complexes. Methods in Molecular Biology. 1278, 233-238 (2015).
- Larkin, M., Wyatt, P. J. Light-Scattering Techniques and their Application to Formulation and Aggregation Concerns. Formulation and Process Development Strategies for Manufacturing Biopharmaceuticals. , (2010).
- Wolfender, J. L. HPLC in Natural Product Analysis: The Detection Issue. Planta Medica. 75 (07), 719-734 (2009).
- Zhao, H., Brown, P. H., Schuck, P. On the distribution of protein refractive index increments. Biophysical Journal. 100, (2011).
- Serebryany, E., Folta-Stogniew, E., Liu, J., Yan, E. C. Homodimerization enhances both sensitivity and dynamic range of the ligand-binding domain of type 1 metabotropic glutamate receptor. FEBS Letters. 590 (23), 4308-4317 (2016).
- Arakawa, T., Wen, J. Size-exclusion chromatography with on-line light scattering. Current Protocols in Protein Science. Chapter 20, Unit 20.6 (2001).
- Müller, R., et al. High-resolution structures of the IgM Fc domains reveal principles of its hexamer formation. Proceedings of the National Academy of Sciences. 110 (25), 10183-10188 (2013).
- Slotboom, D. J., Duurkens, R. H., Olieman, K., Erkens, G. B. Static light scattering to characterize membrane proteins in detergent solution. Methods. 46 (2), 73-82 (2008).
- Miercke, L. J., Robbins, R. A., Stroud, R. M. Tetra detector analysis of membrane proteins. Current Protocols in Protein Science. 77, 1-30 (2014).
- Gimpl, K., Klement, J., Keller, S. Characterising protein/detergent complexes by triple-detection size-exclusion chromatography. Biological Procedures Online. 18 (1), 4 (2016).
- Korepanova, A., Matayoshi, E. D. HPLC-SEC characterization of membrane protein-detergent complexes. Current Protocols in Protein Science. Chapter 29, 1-12 (2012).
- Roy, A., Breyton, C., Ebel, C. Analytical Ultracentrifugation and Size-Exclusion Chromatography Coupled with Light Scattering for Characterization of Membrane Proteins in Solution. Membrane Proteins Production for Structural Analysis. , (2014).
- Hastie, K. M., et al. Crystal structure of the prefusion surface glycoprotein of the prototypic arenavirus LCMV. Nature Structural & Molecular Biology. 23 (6), 513-521 (2016).
- Pallesen, J., et al. Structures of Ebola virus GP and sGP in complex with therapeutic antibodies. Nature Microbiology. 1 (9), 16128 (2016).
- Micoli, F., Adamo, R., Costantino, P. Protein Carriers for Glycoconjugate Vaccines: History, Selection Criteria, Characterization and New Trends. Molecules. 23 (6), (2018).
- Li, J., et al. Characterizing the Size and Composition of Saposin A Lipoprotein Picodiscs. Analytical Chemistry. 88 (19), 9524-9531 (2016).
- Crichlow, G. V., et al. Dimerization of FIR upon FUSE DNA binding suggests a mechanism of c-myc inhibition. EMBO Journal. 27 (1), 277-289 (2008).
- Kapoor, N., Gupta, R., Menon, S. T., Folta-Stogniew, E., Raleigh, D. P., Sakmar, T. P. Nucleobindin 1 is a calcium-regulated guanine nucleotide dissociation inhibitor of G{alpha}i1. Journal of Biological Chemistry. 285 (41), 31647-31660 (2010).
- Pirruccello, M., Swan, L. E., Folta-Stogniew, E., De Camilli, P. Recognition of the F&H motif by the Lowe syndrome protein OCRL. Nature Structural & Molecular Biology. 18 (7), 789-795 (2011).
- Lockyer, K., Gao, F., Derrick, J. P., Bolgiano, B. Structural correlates of carrier protein recognition in tetanus toxoid-conjugated bacterial polysaccharide vaccines. Vaccine. 33 (11), 1345-1352 (2015).
- Steinbach, T., Wurm, F. R. Degradable Polyphosphoester-Protein Conjugates: "PPEylation" of Proteins. Biomacromolecules. 17 (10), 3338-3346 (2016).
- Das, S., Stivison, E., Folta-Stogniew, E., Oliver, D. Reexamination of the role of the amino terminus of SecA in promoting its dimerization and functional state. Journal of Bacteriology. 190 (21), 7302-7307 (2008).
- Reshetnyak, A. V., et al. The strength and cooperativity of KIT ectodomain contacts determine normal ligand-dependent stimulation or oncogenic activation in cancer. Molecular Cell. 57 (1), 191-201 (2015).
- Zambelli, B., et al. a Chaperone in the Urease Assembly Process, Is an Intrinsically Unstructured GTPase That Specifically Binds Zn2+. Journal of Biological Chemistry. 280 (6), 4684-4695 (2005).
- Ren, X., et al. Hybrid Structural Model of the Complete Human ESCRT-0 Complex. Structure. 17 (3), 406-416 (2009).
- Moriarty, D. F., Fiorillo, C., Miller, C., Colón, W. A truncated peptide model of the mutant P61A FIS forms a stable dimer. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1774 (1), 78-85 (2007).
- la Garza, C. E., Miranda-Hernández, M. P., Acosta-Flores, L., Pérez, N. O., Flores-Ortiz, L. F., Medina-Rivero, E. Analysis of therapeutic proteins and peptides using multiangle light scattering coupled to ultra high performance liquid chromatography. Journal of Separation Science. 38 (9), 1537-1543 (2015).
- Beirne, J., Truchan, H., Rao, L. Development and qualification of a size exclusion chromatography coupled with multiangle light scattering method for molecular weight determination of unfractionated heparin. Analytical and Bioanalytical Chemistry. 399 (2), 717-725 (2011).
- Wang, W., et al. A new green technology for direct production of low molecular weight chitosan. Carbohydrate Polymers. 74 (1), 127-132 (2018).
- Kaderli, S., et al. A novel biocompatible hyaluronic acid-chitosan hybrid hydrogel for osteoarthrosis therapy. International Journal of Pharmaceutics. 483 (1-2), 158-168 (2015).
- Porterfield, J. Z., Zlotnick, A. A Simple and General Method for Determining the Protein and Nucleic Acid Content of Viruses by UV Absorbance. Virology. 407 (2), 281-288 (2010).
- Podzimek, S. The use of GPC coupled with a multiangle laser light scattering photometer for the characterization of polymers. On the determination of molecular weight, size and branching. Journal of Applied Polymer Science. 54 (1), 91-103 (1994).
- Podzimek, S., Vlcek, T., Johann, C. Characterization of branched polymers by size exclusion chromatography coupled with multiangle light scattering detector. I. Size exclusion chromatography elution behavior of branched polymers. Journal of Applied Polymer Science. 81 (7), 1588-1594 (2001).
- Podzimek, S. Importance of Multi-Angle Light Scattering in Polyolefin Characterization. Macromolecular Symposia. 330 (1), 81-91 (2013).
- Tarazona, M. P., Saiz, E. Combination of SEC/MALS experimental procedures and theoretical analysis for studying the solution properties of macromolecules. Journal of Biochemical and Biophysical Methods. 56 (1), 95-116 (2003).
- Minton, A. P. Recent applications of light scattering measurement in the biological and biopharmaceutical sciences. Analytical Biochemistry. 501, 4-22 (2016).
- Hirayama, K., Akashi, S., Furuya, M., Fukuhara, K. Rapid confirmation and revision of the primary structure of bovine serum albumin by ESIMS and frit-FAB LC/MS. Biochemical and Biophysical Research Communications. 173 (2), 639-646 (1990).
- Zhu, H., Ownby, D. W., Riggs, C. K., Nolasco, N. J., Stoops, J. K., Riggs, A. F. Assembly of the gigantic hemoglobin of the earthworm Lumbricus terrestris. Roles of subunit equilibria, non-globin linker chains, and valence of the heme iron. The Journal of biological chemistry. 271 (47), 30007-30021 (1996).
- Peters, T., Feldhoff, R. C. Fragments of bovine serum albumin produced by limited proteolysis. Isolation and characterization of tryptic fragments. Biochemistry. 14 (15), 3384-3391 (1975).
- Lebendiker, M., Danieli, T. Production of prone-to-aggregate proteins. FEBS Letters. 588 (2), 236-246 (2014).
- Amartely, H., Avraham, O., Friedler, A., Livnah, O., Lebendiker, M. Coupling Multi Angle Light Scattering to Ion Exchange chromatography (IEX-MALS) for protein characterization. Scientific Reports. 8 (1), 6907 (2018).
- Astafieva, I. V., Eberlein, G. A., John Wang, Y. Absolute on-line molecular mass analysis of basic fibroblast growth factor and its multimers by reversed-phase liquid chromatography with multi-angle laser light scattering detection. Journal of Chromatography A. 740 (2), 215-229 (1996).
- Onsberg, M., Øgendal, L. H., Jensen, M. L., Howells, L. B., Andersen, B., Bjerrum, M. J. Light scattering coupled with reversed phase chromatography to study protein self-association under separating conditions. Journal of Chromatography B. 938, 60-64 (2013).
- Kim, Y., et al. High-throughput protein purification and quality assessment for crystallization. Methods. 55 (1), 12-28 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유