Method Article
جيل من الورم الليفي الفا Synuclein المكونة مسبقا من مونومرات واستخدامها في فيفو
In This Article
Summary
والهدف من هذه المادة هو الخطوط العريضة للخطوات اللازمة لتوليد الفيفيلز من مونوميريك الفا-synuclein ، ومراقبه الجودة اللاحقة ، واستخدام ألياف الليفية التي تم تشكيلها في الجسم المجري.
Abstract
استخدام في الجسم الفيفو الفا synuclein بريفورماين (α-syn PFF) نموذج من اعتلال النواة تكتسب شعبيه بين الباحثين تهدف إلى نموذج مرض باركنسون داء النيونوستريفاتال وانحطاط القرنية. توحيد الجيل α-syn PFF وفي تطبيق الجسم الحيوي أمر بالغ الاهميه من أجل ضمان متسقة وقويه α syn الامراض. هنا ، نقدم بروتوكولا مفصلا لتوليد ألياف الليفية من مونواريك α-syn ، وخطوات التحكم في الجودة بعد الحقن ، والمعلمات المقترحة للحقن الجراحي العصبي الناجح لل α-syn الغدد الصم في الفئران أو الفئران. بدءا من موحودي α-syn ، يحدث الليفي علي مدي فتره حضانة لمده 7 أيام اثناء الاهتزاز في ظروف العازلة الأمثل ، والتركيز ، ودرجه الحرارة. يتم تقييم التحكم في الجودة بعد التشكيل الليفي من خلال وجود ألياف الليفية القابلة للتكوير عن طريق فحص الترسب ، وتكوين اميلويد في الفيفيلز مع فحص ثيوفلافين T ، والتصور المجهري الكترون للفيفيلز. في حين ان التحقق من صحة ناجحه باستخدام هذه المقايسات ضروري للنجاح ، فانها ليست كافيه لضمان سيتم البذور الشوائب α-syn في الخلايا العصبية ، كما ينبغي اختبار هذا النشاط التجميع من كل دفعه PFFS في ثقافة الخلية أو في الأفواج الحيوانية الرائدة. قبل الاستخدام ، يجب ان تكون الفحوصات بالرنين الضوئي تحت ظروف قياسيه بدقه ، تليها الفحص باستخدام المجهر الكتروني أو تشتت الضوء الديناميكي لتاكيد أطوال الفيريل ضمن نطاق الحجم الأمثل ، مع متوسط طول 50 نانومتر. ويمكن بعد ذلك أضافه PFFs إلى وسائل الاعلام الثقافة الخلية أو استخدامها في الحيوانية. علم الامراض التي يمكن كشفها عن طريق المناعية ل α-syn (بسينون ؛ سيرين 129) هو واضح أيام أو أسابيع في وقت لاحق في ثقافة الخلية ونماذج القوارض ، علي التوالي.
Introduction
مرض باركنسون (PD) ويتميز في المقام الأول بعد الوفاة من قبل اثنين من السمات المرضية الرئيسية: علي نطاق واسع والتقدمي الفا synuclein (α-syn) علم الامراض ، وانحطاط نيجروسترياتال. بعد الحقن في الفئران البرية أو الفئران ، α-syn ألياف الليفية بريفورميد (pffs) الحث علي التراكم التدريجي لل α-syn المرضية ، والتي يمكن ان تؤدي إلى انحطاط طويل الأمد من المكونات السوداء التي الخلايا العصبية الدوبامين (snpc) علي مدي العديد من أشهر ، فضلا عن العجز حسي1،2،3،4،5،6. وتتعرض الخلايا العصبية للفينيات α-syn ، اما عن طريق الحقن المباشر داخل المخ أو أضافه إلى وسائل الاعلام من الخلايا العصبية المستزرعة. عندما يتم أخذها في الخلايا العصبية ، والقانون pffs إلى "البذور" تشكيل الشوائب من خلال القولبة ، وتراكم α-syn الذاتية في الشوائب الفوسفروتيلاتيد1،7،8، 9-الآن تتضمن الشوائب خصائص متشابهة لأجساد لوي: تحتوي علي α-syn الفوسفارلاتيد في سيرين 129 (بسينون) ، اوبيكويتين ، و p62 ؛ تمتلك الهياكل الرباعية اميلويد كما هو مبين مع تلطيخ ثيوفلافين الايجابيه ؛ ومقاومه ل بروتيداز ك الهضم1،3،5،7،8،9،10،11، 12-الآن يؤدي التعرض pff إلى تكوين α-syn في المرحلة الابتدائية وبعض الخلايا العصبية الخلده في الثقافة ، فضلا عن الفئران والجرذان والرئيسيات غير البشرية في فيفو1،2،3،4، 5،6،7،8،9،13. من المهم ان نلاحظ ان الخلايا العصبية الدقيقة لن تؤدي إلى تكوين الفا syn في جميع نماذج ثقافة الخلية وبعض الخلايا العصبية مثقف سوف البذور أفضل من غيرها.
ومن السمات الهامه الأخرى للنموذج المجري α-syn PFF المراحل المرضية المتسلسلة المتميزة التي تظهر علي مدي عده أشهر. في القوارض, بعد حقن إينتراسترياتال, الفا-syn التضمين تشكيل قمم عموما داخل SNpc والعديد من المناطق القشرية في غضون 1-2 أشهر. ويلي هذا التراكم الذروة بواسطة الضمور ال≈ 2-4 أشهر في وقت لاحق1,3,5. هذه المراحل المرضية متميزة توفر للباحثين المنصة التي لدراسة وتطوير الاستراتيجيات التي 1) إنقاص α-syn التجميع ، 2) واضحة شكلت بالفعل الشوائب α-syn ، و/أو 3) منع الضمور العصبي اللاحقة. نموذج PFF يقدم مزايا متميزة وعيوب بالمقارنة مع السمية العصبية ، المعدلة وراثيا ، وناقلات الفيروسية توسط α-syn نماذج التعبير الفوقي كما سبق مراجعتها6. وينبغي تحديد النموذج أو النهج الذي سيتخذه النموذج الأنسب الذي يناسب السؤال الذي يطرحه المحققون.
علي الرغم من ان نموذج PFF قد استخدمت بنجاح من قبل العديد من المختبرات ، لا تزال هناك مجموعات التي شهدت عدم الاتساق مع توليد الفيفيلز وإنتاج متسقة α-syn الامراض14. أمثله من التناقضات تتراوح بين التي تنتج القليل أو لا الامراض α-syn ، دفعه لكفاءة البذر دفعه ، وحتى فشل الفيفيلز لتشكيل. التالي ، فان توحيد الجيل α-syn PFF وفي تطبيق الجسم الحيوي أمر بالغ الاهميه من أجل السماح لتفسيرات دقيقه فيما يتعلق بتاثير التدخلات العلاجية الجديدة. يحدد البروتوكول التالي الخطوات المطلوبة لتوليد الوحدات الخاصة من مونومرات α-syn ، ومراقبه الجودة في المختبر من PFFs شكلت مره واحده ، سونيكيشن وقياس PFFs قبل الاستخدام ، واقتراحات لتسهيل ناجحه في حقن الجسم الاصطناعي من في الفئران أو الفئران.
Protocol
وقد تمت الموافقة علي جميع الطرق التي تنطوي علي الحيوانية من قبل جامعه ولاية ميشيغان المؤسسية لرعاية الماشية واستخدام اللجنة (IACUC).
1-تشكيل ألياف الليفية المكونة سلفا من مونومرات (الشكل 1)
- ذوبان مونومرات α-synuclein علي الجليد ، وأعاده التعليق بلطف عن طريق تحريك الأنبوب ، والطرد المركزي في 15,000 x g ل 10 دقيقه في 4 درجه مئوية.
ملاحظه: يجب ان يكون مونومر α-syn وضعت خصيصا لليفي. مونومرات المؤتلف يمكن شراؤها من المصادر التجارية أو التي تم إنشاؤها بواسطة بروتوكولات في الموقع4,9,14,15. إذا تم شراؤها من مصادر تجاريه ، يجب ان يذكر المنتج ان مونومر α-syn هو خصيصا لتوليد الفيفيلز. بغض الذكر إذا تم شراء مونومرات أو إنشاؤها في الموقع ، يجب ان يتم تنفيذ خطوات مراقبه الجودة المبينة أدناه مع كل دفعه لضمان تشكيل الفيفيلز وسوف البذور بكفاءة قبل استخدامها في التجارب. - نقل ماده طافي إلى نظيفه 1.5 mL أنبوب الطرد المركزي الصغير وتسجيل المبلغ المنقول.
ملاحظه: كن حذرا لتجنب بيليه ، والتي ، إذا كانت موجودة ، وسوف تكون صغيره. - قياس تركيز البروتين من ماده طافي المنقولة اما عن طريق اختبار حمض bicinchoninic القياسية (bca) ، أو قياس الامتصاص في 280 نانومتر مع مقياس الطيف الطيفي الحجمي.
ملاحظه: فحص BCA ليست دقيقه لقياس محدده α-syn ويمكن ان تسفر عن نتائج تبالغ في تقدير تركيز البروتين. ونتيجة لذلك ، فان قياس الامتصاص عند 280 نانومتر هو الطريقة الموصي بها لتحديد تركيز البروتين.- لقياس مع فحص BCA ، اتبع البروتوكولات BCA القياسية وأداء مع ثلاثه مخففات مختلفه من مونومر α-syn. المخففات المقترحة هي 1:25 ، 1:50 ، 1:100.
- لقياس مع طريقه A280 ، فارغه القارئ مع معقم 1x الفوسفات دولبيكو المحلول الملحي المخزنة (dPBS) دون الكالسيوم والمغنيسيوم ، مع تركيز الملح من حوالي 100 مم كلوريد الصوديوم ، ومجموعه الأس الهيدروجيني 7.0-7.3 (جدول المواد).
- أضافه 2 μL من عينه للقارئ وقراءه الامتصاص في 280 nm.
- استخدام قانون البيره لامبرت لتحديد تركيز مونومرات.

ملاحظه: ε معامل الانقراض للإنسان α-syn هو 5,960 M-1سم-1 والماوس α-syn هو 7,450 m1سم-1. يقاس طول المسار بالسم. ويقدر الوزن الجزيئي لل α-syn (14 ده) علي افتراض 1 دا = 1 غرام/مول.
- تمييع مونومرات مع 1x dPBS إلى تركيز نهائي من 5 ملغ/مل. استخدم المعادلة أدناه لحساب مقدار 1x dPBS المضافة لتمييع مونومرات.

ملاحظه: كافة التركيزات في mg/mL ، ووحدات التخزين في μL. يجب ان يتم تنفيذ التخفيفات مونومر مع 1x dPBS. يجب ان يكون الحجم الإجمالي المستخدم لتوليد ألياف الليفية بين 100 و 500 μL لتحقيق نتائج الليفية القابلة للتكرار. - دوامه لفتره وجيزة لخلط ، وأجهزه الطرد المركزي لجمع كل السائل في الجزء السفلي من الأنبوب. Aliquot مونومرات لمقارنه مراقبه الجودة مع الفيفيلز كما هو مبين في الخطوات 1.8.1-1.8.4.
- استخدام أنبوب القفل أو الشمع/فيلم من البلاستيك (جدول المواد) لتامين غطاء أنبوب ميكروالطرد المركزي مغلقه.
- وضع أنبوب في ثيرموميكسير المدارية مع غطاء لمده 7 أيام في 37 درجه مئوية ، وتهتز في 1,000 RPM (جدول المواد).
ملاحظه: في نهاية 7 أيام ، يجب ان تظهر محتويات الأنبوب turbid. يجب ان يكون لثيرموميكسير غطاء لمنع تشكيل التكثيف علي أغطيه الأنبوب. - نفض الغبار برفق الأنبوب لأعاده التعليق الليفي α-syn. اليكووت الفيفيلز لخطوات مراقبه الجودة التالية كما هو مبين في الخطوات 1.8.1-1.8.4.
ملاحظه: يمكن تخزين الفيفيلز لخطوات مراقبه الجودة في RT بين عشيه وضحيها.- Aliquot 6 μL لفحص الترسيب.
- Aliquot 5 μL لفحص ملزمه ثيوفلافين T.
- Aliquot 2 μL لنقل المجهر الكترون لتصور الفيريل.
- Aliquot علي الأقل 10 μL لفحص اندوتوكسين.
ملاحظه: بالنسبة لفحص اندوتوكسين ، يتم استخدام التجارية Limulus Amebocyte Lysate (LAL) ، وفقا لتعليمات الشركة المصنعة (جدول المواد). يجب ان تكون مستويات اندوتوكسين ≤ 0.5 اندوتوكسين الوحدات/مل للفيفيلز. ويمكن استخدام مجموعه أزاله السموم الداخلي إذا لم يتم استيفاء هذا المعيار.
- الحبوب المتبقية والمخزن. للتخزين علي المدى الطويل (12-18 أشهر) ، وتجميد بسرعة علي الجليد الجاف ، وتخزين في-80 درجه مئوية.
ملاحظه: يعتمد المبلغ إلى قسامه علي التطبيق المطلوب المتلقيين للمعلومات. في الجسم الذي يستخدم عاده يتطلب المزيد من ألياف الليفية في تركيزات اعلي من الاستخدام في المختبر ، وينبغي التخطيط لاحجام قسامه وفقا لذلك. يجب تخزين الفيفيلز في الخلف من الفريزر لمنع الضرر من التجميد المحتمل/ذوبان الجليد. يمكن إيقاف البروتوكول مؤقتا هنا.
2-فحص الترسيب
- في أنبوب صغير نظيفه الطرد المركزي ، أضافه 6 μL من PFF إلى 54 μL من dPBS لتخفيف الفيفيلز 1:10 ، و ماصه pipet-x لخلط.
- في أنبوب منفصل ، أضافه 6 μL من مونومر إلى 54 μL من dPBS كعنصر تحكم اضافيه.
- عينات الطرد المركزي في 10,000 x g لمده 30 دقيقه في RT ونقل ماده طافي إلى أنبوب الطرد المركزي نظيفه.
- أضافه 60 μL من dPBS إلى المتبقية بيليه ودوامه لأعاده التعليق.
- أضافه 30 μL من المخزن المؤقت عينه 3x (140 μL من 50 ٪ الجلسرين/0.1 ٪ بروموفينول الأزرق ، 40 μL من 10 ٪ SDS ، و 20 μL من β-mercaptoethanol) إلى كل أنبوب ودوامه لخلط.
- احتضان عينات في 100 درجه مئوية لمده 10 دقيقه والسماح لتبرد لمده 5 دقائق علي الجليد.
- استخدام كبريتات الصوديوم دوديسيل القياسية-بولياكريلاميد هلام الكهربائي (SDS-PAGE) بروتوكول لفصل البروتين عن طريق الكتلة. استخدم سلم البروتين مع النطاق الذي يتضمن 14 ده (حجم النطاق المتوقع لمونوميريك α-syn).
- نقل الهلام إلى طبق تلطيخ وتغطيه هلام مع كوماسي الأزرق وصمه عار (0.1 ٪ كوماسي الأزرق الرائع ، 20 ٪ الميثانول من حيث الحجم ، و 10 ٪ حمض الخليك من حيث الحجم في ddH2س). احتضان لمده 3 ساعات في RT اثناء الاهتزاز.
- صب قباله كوماسي الأزرق وصمه عار وأضافه ما يكفي من destain (50 ٪ الميثانول بالحجم ، و 10 ٪ حمض الخليك من حيث الحجم في ddH2س) لتغطيه هلام. احتضان لمده 30 دقيقه في RT اثناء الاهتزاز.
- اسكبي الخليط وكرري الخطوة التالية حتى يصبح الجل واضحا والنطاقات مرئية.
- اغسل الهلام 3 مرات لمده 5 دقائق لكل منها عن طريق الاهتزاز في ddH2O وصوره الهلام.
3. المجهر الكترون انتقال لتصور الفيريل
- تزن 20 ملغ من خلات اليورانيل في أنبوب الطرد المركزي الصغير وأضافه 1 مل من ddH2O لجعل محلول مائي 2 ٪. دوامه حتى خلات اليورانيل هو في الحل ، والسماح للجلوس بين عشيه وضحيها.
ملاحظه: يجب اجراء خلات اليورانيل اليوم قبل اعداد عينات لنقل المجهر الكترون. التعرض للضوء أو الانفعالات يمكن ان يسبب خلات اليورانيل ليعجل ، علي هذا النحو ، يجب ان يغطي الأنبوب الذي يحتوي علي محلول خلات اليورانيل في رقائق ألومنيوم ، وابقي في مكان مظلم ، وليس اهتزت بعد خلات اليورانيل هو في الحل. - أضافه 2 μL من PFF إلى 98 μL من dPBS لتخفيف الفيفيلز 1:50 ، ومن ثم ماصه pipet-x لخلط.
- اعداد الشمع نظيفه/فيلممن البلاستيك (الجدول من المواد) غطت السطح (حوالي 50 مم × 50 مم) علي مقاعد البدلاء اعلي. علي الشمع النظيف/فيلم من البلاستيك (جدول المواد) ، أضافه ما يلي (الشكل2).
- أضافه 4 × 10 μL قطرات من ddH2O.
- أضافه 1 × 10 μL قطره من الفيفيلز المخفف أو عينه المونومر.
- أضافه 2 × 10 μL قطرات من 2 ٪ خلات اليورانيل.
- استخدام ملقط غرامه يميل للتقاط formvar/الكربون المغلفة ، شبكه النحاس شبكه الكترون المجهر المجهري (جدول المواد).
ملاحظه: تاكد من التقاط الشبكة فقط عن طريق الحافة ، وتجنب جزء شبكه في المركز (الشكل 2ا). إذا كانت الملقط تلمس الشبكة ، فان الفيلم المغلف بالكربون سيكون معطوبا ، مما يجعل التصوير في تلك المنطقة من الشبكة أمرا مستحيلا. - تعويم الشبكة formvar/الكربون المغلفة الجانب (الجانب لامعه) أسفل علي القطرة الاولي من ddH2س. استخدم الملقط برفق للاحتفاظ بالشبكة والضغط لأسفل لضمان ان يكون السطح المطلي بأكمله علي اتصال مع ddh2o. السماح للشبكة تعويم لمده دقيقه واحده.
- التقاط الشبكة ، ودون لمس جزء شبكه من الشبكة ، والفتيل بعيدا ddH2O مع ورقه فلتر.
- تعويم الشبكة علي النحو الوارد أعلاه علي القطرة الثانية من ddH2س ل 1 دقيقه والفتيل بعيدا ddh2س.
- تعويم الشبكة علي قطره من الفيفيلز المخفف لمده دقيقه واحده والفتيل بعيدا الزائدة علي النحو الوارد أعلاه.
- تعويم الشبكة علي القطرة الاولي من خلات اليورانيل لمده دقيقه واحده والفتيل بعيدا الزائدة.
- تعويم الشبكة علي القطرة الثانية من خلات اليورانيل لمده دقيقه واحده ، الفتيل بعيدا الزائدة.
- تعويم الشبكة علي النحو الوارد أعلاه علي القطرة الثالثة من ddH2o لفتره وجيزة والفتيل بعيدا ddh2.
- تعويم الشبكة علي النحو الوارد أعلاه علي القطرة الرابعة من ddH2o لفتره وجيزة والفتيل بعيدا ddh2س ، ويجري التاكد من أزاله الكثير من ddh2س قدر الإمكان.
- نقل إلى مربع الشبكة للتخزين حتى التصوير.
ملاحظه: يجب ان تجف الشبكات لمده 5 دقائق علي الأقل قبل التصوير. يمكن ان تكون الشبكات غير المسنين لمده سنه علي الأقل بعد التحضير ، وينبغي ان تبقي في بيئة جافه.
4. ثيوفلافين T المقايسة
- في أنبوب الطرد المركزي الصغير نظيفه ، أضافه 5 μL من PFF إلى 245 μL من dPBS لتخفيف الفيفيلز 1:50 ، و ماصه pipet-x لخلط.
- أضافه 250 μL من dPBS إلى أنبوب الطرد المركزي الصغير منفصلة لتكون بمثابه عنصر تحكم سلبي.
- أضافه 5 μL من مونومر إلى 245 μL من dPBS لتكون بمثابه عنصر تحكم المونومر.
- أضافه 250 μL من ثيوفلافين T في العازلة الجليسين (25 μM ثيوفلافين T ، 100 mM الجليسين ، 1 ٪ تريتون X-100 ، pH 8.5) لكل عينه ومزيج بلطف.
- Pipet 2 ونسخ متماثلة ، 200 μL لكل منهما ، إلى لوحه سوداء 96 جيدا. الحفاظ علي لوحه في الظلام لمنع الرشح الضوئي.
- احتضان ل 1 ح في RT وقراءه لوحه باستخدام الاثاره من 450 نانومتر والانبعاثات من 510 nm.
ملاحظه: ستتقلب قراءات ثيوفلافين T مع مرور الوقت. يجب قراءه العينات في نفس وقت الحضانة. إذا رغبت في ذلك ، يمكن ان تؤخذ قراءات متعددة خلال الحضانة ساعة ورسمها علي مر الزمن.
5. سونيكيشن من α-synuclein ألياف الليفية بريفورماين
تحذير: يتم اجراء sonicator وجميع الخطوات سونيكيشن في غطاء الثقافة لمنع التعرض للفيفيلز التي قد ايرووليسيزي خلال سونيكيشن. يجب علي الموظفين الذين يؤدون الخطوات سونيكيشن ارتداء معدات الحماية الشخصية ، بما في ذلك القفازات ، وحماية الملابس في شكل معطف المختبر ، ودرع الوجه في حين sonicating. ويمكن تقليل خطر التعرض ليفي بواسطة سونينج مع sonicator القرن كوب ، مما يسمح للأنبوب التي تحتوي علي الفيفيلز ان تبقي مغلقه خلال سونيكيشن.
ملاحظه: المعلمات سونيكيشن الأمثل من الفيفيلز تعتمد علي نموذج sonicator المستخدمة. لهذا السبب ، فان بعض التحسين يجب ان يتم تنفيذها لضمان ألياف الليفية هي الحجم الصحيح. ويمكن الاطلاع علي sonicator المستخدمة في جدول المواد والمعلمات المبينة تستند إلى النتائج السابقة مع هذا النموذج من sonicator. المعلمات أدناه سوف تعمل ل 2-4 ميكروغرام/μL من PFFs في 200-400 μL من الحل. يجب ان يتم اجراء اختبار سونيكيشن مع الصك وتحليلها لضمان تحقيق النتائج المرجوة قبل استخدام PFFs في التجارب.
- نعلق مسبار قطرها 3.2 مم (جدول المواد) إلى المحول ، وتعيين معلمات sonicator كما هو مبين أدناه في الخطوة 5.1.1-5.1.3.
- تعيين السعه إلى 30 ٪.
- تعيين النبض إلى 01 01 (1 s علي; 1 ق قباله).
- تعيين الوقت إلى 0:01:00.
ملاحظه: 1 دقيقه من نبض يعادل 60 البقول ، وهذا النموذج من sonicator (جدول المواد) سوف تتوقف تلقائيا. مع غيرها من نماذج sonicator ، وسوف تحتاج إلى عدد من البقول ان تحسب.
- يذوب الفيفيلز في RT ويخفف مع dPBS معقمه في غطاء الثقافة.
ملاحظه: واضح 0.6 mL أنبوب ميكروالطرد المركزي يعمل بأفضل سونيكيشن وتركيز الفيريل النهائي يعتمد علي الاستخدام المقصود. النتائج التمثيلية المعروضة هي من تركيز الفيريل النهائي من 4 ميكروغرام/μL. - مسح المسبار من sonicator مع انسجه المختبر المبللة مع 70 ٪ الايثانول لتنظيف المسبار. دمج غيض من التحقيق في ddH2س والنبض 10 مرات لمزيد من تنظيف المسبار ، ومن ثم يمسح الجافة مع انسجه المختبر.
- ضع طرف المسبار في أنبوب الفيفيلز المخفف ، وضع الطرف في الجزء السفلي من الأنبوب.
- سوكاتي ل60 النبضات (1 s علي; 1 ق قباله). تحريك المسبار صعودا وهبوطا خلال كل نبضه لضمان ان جميع ألياف الليفية في السائل هي sonicated. ونظيفه.
- بعد 60 البقول ، وأزاله المسبار من PFFs ، وأضافه 2 μL من PFFS إلى 98 μL من dPBS في أنبوب الطرد المركزي نظيفه لتخفيف الفيفيلز 1:50 لقياس الفيريل سوكاتاتيد بواسطة المجهر الكتروني.
ملاحظه: من الناحية المثالية ، يجب قياس مجموعه فرعيه صغيره من ألياف الليفية قبل الحقن في الجسم المجري وقياس أكثر شمولا من الفيفيلز التي يتم اجراؤها عندما يسمح الوقت. - بعد سونيكيشن ، لفتره وجيزة الطرد المركزي PFFs ل 1 s في 2,000 x g لجمع كل السائل قباله الجانبين من الأنبوب.
تنبيه: إذا أصبح الأنبوب ساخنا علي اللمس ، فتوقف عن المرور بعد 30 نبضه ، وانتظر لمده دقيقه واحده ، وقم بالنقر علي النبضات الثلاثين النهائية.
ملاحظه: بينما السونار ، والحفاظ علي غيض التحقيق نحو الجزء السفلي من السائل في بداية كل نبضه ، قريبه جدا من الجزء العلوي من السائل سوف يسبب فقدان العينة. - دمج غيض التحقيق في 1 ٪ SDS ونبض 10 مرات لتنظيف المسبار. أزاله غيض من SDS ، ودمج في ddH2س والنبض 10 مرات.
- امسح المسبار بانسجه المختبر المبللة ب70% الايثانول ، ثم امسح المسبار بنسيج المختبر الجاف. افصل المسبار من المحول والمخزن.
- مسح جميع الأسطح في غطاء محرك الأرض مع 1 ٪ SDS ، تليها 70 ٪ الايثانول.
ملاحظه: يتم استخدام محلول SDS 1 ٪ لفك ألياف الليفية والأسطح النظيفة والمعدات16.
6. المجهر الكترون انتقال لقياس ألياف الليفية سوناتيد
ملاحظه: إذا لم يكن المجهر الكتروني ممكنا ، يمكن استخدام فحص حركيه ثيوفلافين T ، وتشتت الضوء الديناميكي كاجراءات غير مباشره لكفاءة البذر وحجم الفيريل4،14.
- اعداد العينات باستخدام البروتوكول من قسم "المجهر الكتروني لتصور الفيريل" أعلاه.
- استخدام المجهر الكترون الإرسال للتقاط صوره من الفيفيلز من 6 إلى 10 فتحات الشبكة المختلفة.
ملاحظه: يجب ان تكون الصور عاليه بما يكفي من التكبير لقياس ألياف الليفية ، ولكن منخفضه بما يكفي لتصور العديد من الفيفيلز في وقت واحد. وينبغي ان يكون التكبير النهائي من حوالي 75 ، 000x كافيه. - قياس طول مجموعه فرعيه صغيره من ما لا يقل عن 25 من الفيفيلز قبل استخدام ألياف الليفية في التجربة.
ملاحظه: يمكن عاده اجراء هذه القياسات باستخدام برامج التصوير المرتبطة بالمجهر. بالنسبة للتحقق السريع ، يجب علي الشخص الذي يتم قياسه تحديد الفيفيلز التمثيلية وحساب متوسط الحجم. وينبغي ان متوسط طول الفيريل حوالي 50 نانومتر أو اقل ، مع قياس أكثر دقه لمتابعه. - قياس أطوال 500 + ألياف الليفية للحصول علي نتائج أكثر شمولا.
ملاحظه: يمكن استخدام برامج التصوير المرتبطة بالمجهر لقياسات الفيريل. بدلا من ذلك ، يمكن فتح الصور وقياس الفيفيلز باستخدام برنامج معالجه الصور ، وذلك باستعمال شريط المقياس المرتبط بكل صوره كمرجع للحجم لمقارنه أطوال الفيريل.
7-اعداد محاقن الابر الزجاجية المخصصة للحقن المجسم (الشكل 3)
- أضافه ما يقرب من 10 مل من كاشف السيليكون (جدول المواد) إلى الكاس 50 ml نظيفه.
- وضع أنابيب الشعرية الزجاج (طول 54 مم ؛ القطر الخارجي: 0.86 مم ؛ القطر الداخلي 0.59 مم) عموديا في الكاس من كاشف السيليكون والسماح للعمل الشعرية لرسم الكاشف السيليكون يصل الأنبوب من خلال فتح أنبوب اقل المغمورة في كاشف السيليكون.
- Pipet كاشف السيليكون اضافيه في فتح أنبوب العلوي الذي لا مغمورة في كاشف السيليكون لملء تماما أنبوب الشعرية الزجاج.
- أزاله الأنابيب الشعرية من كاشف السيليكون ولطخه نهايات مفتوحة من الأنابيب علي منشفه ورقيه لأزاله الكاشف السيليكون في الأنابيب. السماح للأنابيب الشعرية لتجف لمده 8 ساعات علي الأقل.
- وضع أنبوب الشعرية الزجاجية سيلينوزيد في ساحبه ابره الزجاج (جدول المواد).
- بدوره علي عنصر التدفئة والسماح للوزن المرفقة لتمتد أنبوب الشعرية الزجاجية ساخنه.
- قطع أنبوب الشعرية الزجاجية المسحوبة مع مقص في أنحف نقطه في الوسط وأزاله ابره الزجاج من ساحبه ابره الزجاج.
ملاحظه: الابره المسحوبة الداخلية والخارجية ينبغي ان تكون تقريبا 80 و 100 μm ، علي التوالي. ويمكن اجراء الابر الزجاجية متعددة في وقت واحد وتخزينها حتى علي استعداد لنعلق علي حقنه زجاجيه مع ابره معدنيه المرفقة (جدول المواد). - قطع طول الأنابيب يتقلص التفاف (متوسط القطر الداخلي 0.021 "ومتوسط سمك الجدار 0.001") إلى ما يقرب من 40 ملم مع مقص. الشريحة التفاف يتقلص علي ابره معدنيه من 10 μL حقنه مشطوف (جدول المواد).
- استخدام لهب مفتوح للحرارة والتمسك التفاف يتقلص إلى الابره في حين تناوب الابره لتطبيق الحرارة بالتساوي.
- حرك الطرف الأكبر من الابره الزجاجية المسحوبة بعناية علي الابره المعدنية للحقن.
- قطع طول الأنابيب يتقلص التفاف (متوسط القطر الداخلي 0.036 "ومتوسط سمك الجدار 0.005") إلى ما يقرب من 40 ملم مع مقص والشريحة بعناية علي ابره الزجاج لتتداخل قاعده ابره الزجاج وابره معدنيه من حقنه (جدول المواد). استخدام لهب مفتوح لتسخين التفاف يتقلص لتامين ابره الزجاج إلى ابره معدنيه.
- أضافه طبقه اضافيه من التفاف يتقلص لتامين ابره الزجاج. قطع طول الأنابيب يتقلص التفاف (متوسط القطر الداخلي 0.044 "ومتوسط سمك الجدار 0.005") إلى ما يقرب من 40 ملم مع مقص والشريحة بعناية علي ابره الزجاج لتتداخل قاعده ابره الزجاج وابره معدنيه من حقنه (جدول المواد). استخدام لهب مفتوح لتسخين التفاف يتقلص لتامين ابره الزجاج إلى ابره معدنيه.
- تقليم ابره الزجاج مع مقص بحيث غيض هو ما يقرب من 8 ملم طويلة.
ملاحظه: يجب ان تكون الابره طويلة بما يكفي لاستهداف مناطق الدماغ المطلوبة (الطول المطلوب يعتمد علي الإحداثيات الظهرية/البطنية). - استخدام الخطوات 7.14.1-7.14.3 لاختبار الابره لضمان عدم وجود تسرب وهناك تدفق كاف علي حد سواء في سحب وصرف السائل من ابره الزجاج.
- أملا حقنه بسعة 1 مل مع ابره قياس 26 مرفقه مع dH2س.
- قم بازاله المكبس المعدني من حقنه الابره الزجاجية المخصصة وادخل ابره الحقنه المملوءة بالابر2س في قاعده الحقنه. استخدم الضغط للتخلص من الابره الزجاجية2س. افحص واجهه الابره الزجاجية والابره المعدنية للكشف عن التسريبات وتاكد من ثبات تدفق2س.
ملاحظه: إذا لزم الأمر ، يمكن ان تكون قلصت ابره الزجاج لزيادة سهوله التدفق وطبقات اضافيه من يتقلص التفاف وأضاف لتصحيح اي تسرب من قاعده ابره الزجاج. - ملء أنبوب الطرد المركزي مع dH2س. استخدام حقنه ابره الزجاج مخصصه لرسم في dh2س. فحص الابره لتاكيد يتم أخذ السائل في حقنه وانه لا توجد فقاعات.
ملاحظه: إذا كان هناك فقاعات أو dH2س لا يتم رسمها في الابره ، وتقليم الابره يمكن ان تساعد في تخفيف الضغط.
- بعناية مخزن حقنه مع الابر الزجاجية المرفقة في صناديق حقنه حتى الحاجة إلى العمليات الجراحية.
- استخدام أساليب الجراحة الفراغية القياسية لتسليم إينتراسترياتال من PFFs في الإحداثيات الأمثل في الفئران (موقع واحد: AP + 0.2 mm و ML + 2.0 mm من bregma ، DV-2.6 mm من دورا) أو في الفئران (موقعين: AP + 1.6 mm و ML + 2.0 mm من bregma ، DV-4.0 من دورا. AP + 0.1 mm و ML + 4.2 mm من bregma ، DV-5.0 من دورا)1،14،17.
ملاحظه: وقد استخدمت هذه الإحداثيات في C57BL6/C3H الفئران والفئران فيشر 344. عند استخدام سلالات أخرى ، يجب تحسين الإحداثيات.
النتائج
يبدا توليد الفيفيلز من مونومرات α-syn بتحديد تركيز مونومرات. ويمكن استخدام كل من فحص BCA وقياس الامتصاص عند 280 نانومتر (A280) لقياس محتوي البروتين ؛ نتائج فحص BCA ، ومع ذلك ، اقترح تركيز اعلي من الأسلوب A280. وكانت المشتقات من الماوس α-syn مونومير قيمه BCA 14.05 ± 0.22 و A280 من 8.05 ± 0.03 ميكروغرام/μL (الشكل 1). المثل ، فان الشركات المشتقة من الإنسان α-syn مونومر يبدو أيضا انها في تركيز اعلي ، مع قيمه BCA 12.95 ± 0.38 و A280 من 7.83 ± 0.05 ميكروغرام/μL (الشكل 1). قياسات A280 هي محدده ل α-syn استنادا إلى ادراج معاملات الانقراض واستخدمت هذه النتائج لتمييع مونومرات قبل الحضانة 7 أيام.
قبل الحضانة ، كان السائل الذي يحتوي علي مونومرات α-syn واضحا ، ولكن يجب ان يظهر عكرا بعد تشكيل الفيريل. وأكد الفحص مع المجهر الكترون انتقال وجود الفيفيلز طويلة ، وقياس 10-20 nm واسعه (الشكل 4). المقارنة ، كانت مونومرات α-syn بالبالكاد مرئية مع عدم وجود شكل ملحوظ واضح (الشكل 4). مع التاكيد البصري للهياكل لييفي ، والتشكيل اميلويد من ألياف الليفية هو الميزة التالية لل PFFs التي ينبغي ان تؤكد باستخدام ثيوفلافين T المقايسة. ثيوفلافين T المعروضات المعززة فلوري عندما ملزمه اميلويد. التالي ، تشير زيادة اشاره الفلورسنت من العينات وجود اميلويد. علي سبيل المثال ، أنتجت ثيوفلافين في dPBS اشاره من 3,287 ± 580 وحدات الفلورسنت النسبية (RFU) ، والماوس α-syn مونومر أنتجت اشاره من 4,174 ± 158 RFU ، وأنتجت الماوس PFFs اشاره من 59,754 ± 6,224 RFU (الشكل 5). في المقارنة ، أنتجت الإنسان α-syn مونومر اشاره مماثله من 4,158 ± 105 RFU إلى الماوس مونومر ، وأنتجت PFFs الإنسان اشاره اعلي من 1,235,967 ± 113,747 RFU بالمقارنة مع الماوس PFFs (الشكل 5). لتقييم وجود ألياف الليفية القابلة للبلان ، تم اجراء فحص الترسيب. الفيفيلز سوف بيليه مع طرد. في كل من الماوس وعينات pff البشرية ، يجب ان يكون كسر سوبرناتانت المزيد من البروتين في بيليه من ماده طافي (الشكل 6). وعلي النقيض من ذلك ، كانت غالبيه البروتين من الماوس والمونومرات البشرية موجودة في supernatant ، مع القليل من الحاضر في بيليه (الشكل 6). مع الموجودة بشكل واضح بواسطة المجهر الكترون ، والهياكل اميلويد الحالية ، والتكوير الليفي ، مرت PFFs جميع في خطوات مراقبه الجودة في المختبر.
وكانت كل من الماوس والإنسان pffs سونيكاتيد لإنتاج بفس من أطوال مناسبه لبذر α-syn الشوائب4,18. تم تخفيف PFFs إلى التركيز المطلوب من 4 ميكروغرام/μL و sonicated. قبل الجراحة مباشره ، تم تصوير 25 من ألياف الليفية التمثيلية بواسطة المجهر الكتروني وقياسها للتحقق من حجم الفيريل. الماوس سونيكاتيد قياس 48.8 ± 3.1 nm ، في حين ان الإنسان pffs يقاس 52.1 ± 4.4 nm في الطول ؛ كان [بفس] من كلا أنواع لذلك الطول مناسبه (50 [نم] أو اقل) ان يحث [بذر كتيفيتي]. كشفت دراسة أكثر شمولا لحوالي 500 ألياف الليفية متوسط طول وطول توزيع الفيفيلز الماوس سونيكاتيد. وكان متوسط طول 44.4 ± 0.6 nm ، مع 86.6 ٪ من PFFs قياس 60 نانومتر أو اقل (الشكل 4). المقارنة ، بلغ متوسط ال55.9 البشرية ± 1.1 نانومتر بنسبه 69.6 في المائة من المؤشرات التي تقيس 60 نانومتر أو اقل (الشكل 4).
بعد حقن إينتراسترياتال من الفئران الفارهة في الجرذان كما هو موضح سابقا3,5, تم تجهيز سلسله من أقسام الانسجه في 2 أشهر بعد الجراحة, عندما يتم التعرف علي عدد من تضمين الخلايا العصبية التي تحتوي علي الذروة في SNpc ، لتاكيد الشوائب α-syn فوسفوفورلاتيد5. تضمين الخلايا العصبية التي تحمل ، كما هو مبين من مناعي تلطيخ ل بسينون (الأجسام المضادة في جدول المواد) موجودة داخل snpc (الشكل 7) ، فضلا عن مناطق أخرى في جميع انحاء الدماغ التي inعصبيه الشريطية (الامامي نواه حاسة الشم ، المحرك ، التخثر ، الكمثري ، القلفة ، الحسية الجسدية ، entorhinal ، والرؤوس المعزولة ، اللوزة ، الشريطية)1،3،4،5،19. هذه الشوائب تقاسم خصائص مماثله مع الهيئات لوي ، مثل ملزمه ثيوفلافين S ، ومقاومه من إجمالي α-syn إلى بروتينيه K (الشكل 7) ، كما هو مبين من قبل تلطيخ مناعي (الأجسام المضادة و بروتيداز k في جدول المواد) . تاكيد البذر داخل الدماغ يشير إلى انه قد تم تمرير السيطرة علي الجودة في الجسم الآخر ، والارصفه من pffs المجمدة سابقا وحفظها من نفس الدفعة قد تكون سونيكاتيد تحت معلمات متطابقة ، مع أطوال المصادق عليها ، في تجارب أكبر.

الشكل 1 . طرق لتوليد الحبوب α-syn. الخطوط العريضة للخطوات اللازمة لإنتاج الفيفيلز من مونومرات α-syn. مونومرات هي طرد لمده 10 دقيقه (15,000 x g، في 4 °c). يتم نقل supernatant إلى أنبوب نظيف ويتم تحديد تركيز البروتين اما عن طريق الامتصاص في 280 نانومتر ، أو فحص BCA. يظهر الرسم البياني التركيزات من مونومرات α-syn البشرية والفاره. تشير الاعمده إلى وسائل المجموعة ، وتمثل أشرطه الخطا الخطا القياسي ± 1 لهذا المتوسط. بعد تحديد تركيز البروتين ، يتم تخفيف مونومرات α-syn ، لفتره وجيزة فورتيكسد وحضنت ل 37 درجه مئوية لمده 7 أيام ، في حين تهتز علي خلاط المداري تعيين في 1,000 RPM. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.

الشكل 2 . طرق تلطيخ لنقل المجهر الكترون. رسم تخطيطي لتلطيخ السلبية لمجهر الكترون. ا) الصور التي تصور شبكات عينه المجهر الكترون. الشبكة لديها الجانب مملة أو الخفيفة والجانب لامعه أو مظلمة. الجانب لامعه/الظلام هو المغلفة مع فيلم دعم formvar/الكربون. ب) توضيح الاجراء تلطيخ. يتم تعويم الشبكة لامعه/الجانب المظلم لأسفل علي القطرة الاولي من ddH2س لمده دقيقه واحده والفائض هو الأشرار بعيدا مع ورقه فلتر. وتتكرر هذه العملية مع القطرة الثانية من ddH2o ، المخففة pffs أو مونومرات ، وقطرين من خلات اليورانيل ، وقطرين اضافيه من ddh2O. قد يتم تخزين الشبكات في مربع الشبكة حتى الذين يعانون من الوهن. شريط مقياس = 3 ملم. الرجاء النقر هنا لعرض نسخه أكبر من هذا الرقم.

الشكل 3 . الجمعية من المحاقن الزجاج المخصصة ابره. رسم تخطيطي للخطوات المطلوبة لتجميع ابره الزجاج المرفقة المحاقن. يتم سحب الأنابيب الشعرية الزجاجية السيليكون وقطع في الوسط لإنتاج الابر الزجاجية. ويستخدم يتقلص التفاف الأنابيب لاعداد ابره معدنيه وتشكيل ختم الداخلية عندما يتم انزلق ابره الزجاج علي ابره معدنيه. يتم أضافه طبقتين إضافيتين من أنابيب اللف اليتقلص التي تتداخل مع قاعده الابره الزجاجية والابره المعدنية علي التوالي ويتم تطبيق الحرارة لتامين الابره الزجاجية وتشكل ختم محكم الغلق بالماء. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
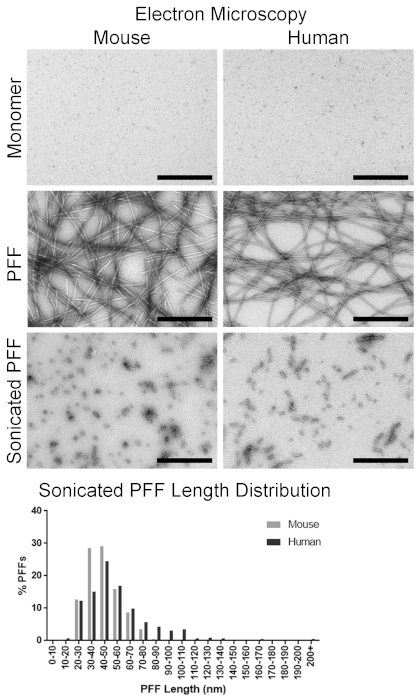
الشكل 4 . التصور من مونومرات α-syn و α-syn الفيفيلز عن طريق المجهر الكترون الإرسال. الرسوم البيانية التمثيلية لمونومرات α-syn وألياف الليفية. اللوحات العلوية: الماوس والإنسان α-syn مونومر. لوحات الأوسط: الماوس طول كامل والإنسان α-syn PFFs. اللوحات السفلية: الماوس والإنسان α-syn PFFs بعد سونيكيشن. الرسم البياني السفلي: توزيع الماوس الرنان وأطوال الإنسان α-syn PFF. شريط مقياس = 500 نانومتر. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.

الشكل 5 . تاكيد من [اميلويد] بني ب ثيوفلافين [ت] فحص. قياس اشاره الفلورسنت من الماوس والإنسان α-syn مونومر وعينات PFF. اليسار: النتائج من الماوس α-syn مونومرات و α-syn PFFs. الحق: النتائج من مونومرات α-syn الإنسان و α-syn PFFs. يتم عرض عنصر تحكم سالب dPBS في كل رسم بياني. ويتم التعبير عن جميع القياسات كوحدات فلورية نسبيه (RFU). تشير الاعمده إلى وسائل المجموعة ، وتمثل أشرطه الخطا الخطا القياسي ± 1 لهذا المتوسط. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.

الشكل 6 . فحص الترسيب للحصول علي الصور من الهلام الملون كوماسي. وتبلغ الفرق المعروضة حوالي 14 كيلو ده استنادا إلى سلم البروتين. اليسار: الماوس مونومر و PFFs. الحق: مونومرات البشرية و PFFs. بالنسبة لجميع عينات المونومر و pff ، يتم عرض البيليه المعاد تعليقه (P) و ماده طافي (S). يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
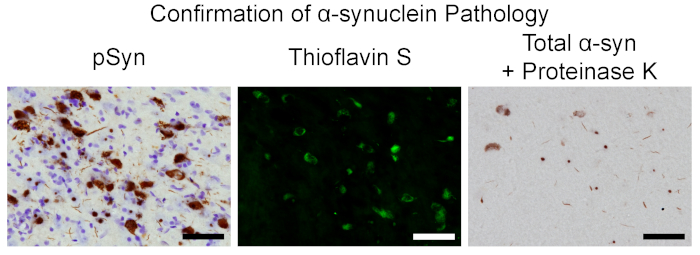
الشكل 7 . ملامح من الشوائب في نموذج الفئران تاكيد α-syn الامراض. الرسومات البيانية التمثيلية من العناصر السوداء التي في 2 أشهر بعد الحقن. اليسار: الخلايا العصبية التي تحتوي علي بسينون والملطخة مع البنفسج كريريل. الأوسط: ثيوفلافين S الخلايا العصبية الايجابيه. الحق: α-syn التي تحتوي علي شوائب مقاومه للبروتين K. شريط مقياس = 50 μm. الرجاء النقر هنا لعرض نسخه أكبر من هذا الرقم.
Discussion
إنتاج α-syn PFFs قادره علي بذر الخلايا العصبية والتي تؤدي إلى الشوائب مثل الجسم لوي يعتمد علي عوامل متعددة وخطوات. والعامل الحاسم هو ان مونومرات المستخدمة لتوليد ألياف الليفية تحتاج إلى ان تصاغ خصيصا لالفيسيليشن4،9،14،15. إذا لم يتم وضع مونومرات لليفي ، قد لا تشكل الفيفيلز أو الفيفيلز التي لا تشكل قد لا تنتج α-syn علم الامراض. المثل ، فان العازلة التي مونومرات هي أيضا في التاثير علي ألياف الليفية. علي هذا النحو ، للحصول علي أفضل النتائج ، يجب ان يكون تركيز الملح حوالي 100 مم كلوريد الصوديوم ودرجه الحموضة بين 7.0 و 7.3. الخطوة الاوليه التي تقدم التغير هي الطريقة التي يتم بها تحديد محتوي البروتين الاولي ، مع القياس في A280 من المرجح ان تنتج نتائج أكثر دقه التالي هي الطريقة المفضلة. التباين في تركيز البروتين يمكن ان يقلل من فعاليه عمليه الفيسيليشن ، فضلا عن تغيير تركيز PFF المفترضة المستخدمة في التجارب. كلاهما يمكن ان يؤدي إلى انخفاض في كفاءه البذر والتباين دفعه بين التجارب.
ستؤكد الخطوات الاوليه لمراقبه الجودة السمات الحاسمة لل PFFs ، علي وجه التحديد ان لديهم التشكيل الليفي (المجهر الكترون) ، وتحتوي علي هياكل اميلويد (ثيوفلافين T الفحص) ، وهي التكوير (الترسيب المقايسة). من المهم ان نلاحظ ان نتائج الفحص ثيوفلافين T سوف تتقلب مع الوقت وليست مقياسا مباشرا لكميه الهياكل اميلويد الحاضر ، بدلا من ذلك ، يجب ان تستخدم المقايسة ثيوفلافين T فقط كمؤشر علي وجود هياكل اميلويد داخل العينة. وعاده ما يستخدم ثيوفلافين T في اختبارات في المختبر ، مثل الفحص المذكور أعلاه لإظهار الفيفيلز تحتوي علي هياكل اميلويد. بدلا من ذلك ، يتم استخدام ثيوفلافين S في الانسجه للكشف عن الهياكل اميلويد ، كما هو مبين في الشكل 7. في ما يتعلق ب ال ترسيب فحص, يبدي النتيجات فقط ان ال [بفس] يكون أسست غالبا في الكسر [بليتبل]. كما يتم تشغيل العينات في ظروف التعتيم ، وهي فرقه واحده بارزه من حوالي 14 كده ، وحجم α-syn مونومرات ، موجودة علي الهلام. وهذا علي عكس النطاقات المتعددة الموجودة في الأوزان الجزيئية العالية التي من المتوقع مع PFFs إذا تم استخدام هلام الأصلي أو غير ديكاترينغ. وأخيرا ، فان النجاح في اجتياز جميع هذه الخطوات الاوليه لمراقبه الجودة لا يضمن النشاط البذر α-syn التضمين. ولهذا السبب ، ينبغي استخدام تجارب استزراع الخلايا أو مجموعه صغيره من الحيوانية المحقونة جراحيا لاختبار فعاليه ال PFFs قبل استخدامها في تجارب أكبر.
صوتنه هو خطوه حاسمه في عمليه وسوف تختلف المعلمات اعتمادا علي نموذج sonicator المستخدمة. يجب تطبيق المعلمات صوتنه والتحقق منها لإظهار ان شظايا PFF قصيرة قد تم إنتاجها. وقد تحمل حجم الفيريل علي البذر ، مع أقصر البذر الفيفيلز أكثر كفاءه. علي الرغم من أقصر البذور الفيفيلز أكثر كفاءه ، وهذا التاثير الهضاب وطول pff الأمثل هو تقريبا 50 nm4،18. ومن المهم أيضا عدم الإفراط في النظر في العينات وفضح الحرارة المفرطة ، لان هذا قد يقلل من كفاءه البذر. وينبغي اختبار هذه pffs سونيكاتيد لفعالية في ثقافة الخلايا الصغيرة أو في التجارب المجرية قبل استخدامها في التجارب علي نطاق أوسع. كما دورات سونيكيشن مختلفه لديها القدرة علي إدخال التباين, وينبغي التخطيط لمجموعات العلاج التجريبي وفقا لذلك.
عند تقديم pffs في فيفو ، وتوطين موقع (ق) الحقن والمبلغ الإجمالي pffs المستخدمة يمكن ان تؤثر علي عدد من الخلايا العصبية التي سوف تتطور الشوائب ، فضلا عن مدي الضمور العصبي7،14. الإحداثيات في البروتوكول توفر مكانا للبدء ، ولكن ينبغي اختبارها داخل المختبر لضمان المنطقة المستهدفة المرجوة يطور α-syn علم الامراض قبل استخدامها في التجارب علي نطاق واسع. إذا رغبت في ذلك ، تتبع صبغ أو الخرز الفلورسنت يمكن استخدامها كوسيلة لاختبار الاستهداف الإقليمي قبل استخدام PFFs. يختلف مقدار pffs المستخدمة في الجسم المجري بين المجموعات ، مع معظم المجموعات باستخدام ما مجموعه بين 5 إلى 20 ميكروغرام من pffs في واحد أو مقسمه بين اثنين من مواقع الحقن1،2،3،4،5 , 6 , 7 , 14. كما ان عدد من مواقع الحقن ، وموقع مواقع الحقن ، وكميه من الحقن المحقونة يمكن ان تؤثر علي نتائج وتطور اعتلال النواة ، وينبغي ان توصف نتائج المصب من المعلمات المستخدمة قبل استخدام النموذج اختبار التدخلات المحتملة أو فحص السمات الزمنيه للنموذج.
عند اختيار نموذج لاستخدامه لاختبار التداوي أو دراسة تطور المرض ، يجب اختيار النموذج المستخدم للاجابه علي أفضل الاسئله المطروحة. ليس كل النماذج سوف تمتلك بعض ملامح المرض من PD ، أو تقديم الإطار الزمني اللازم لاختبار التدخلات المحتملة. ويلخص نموذج PFF السمات الرئيسية لل PD ، مثل علم الامراض α-syn والضمور العصبي ، ويمكن ان يؤدي إلى إعاقات حركيه متواضعة. يقدم النموذج دوره زمنيه يمكن التنبؤ بها ومطوله ، حيث تشكل الشوائب أشهر قبل الضمور العصبي. وهذا يسمح للباحثين بفحص واستغلال المراحل المختلفة خلال التطور المطول لاعتلال النواة. ومن المتوقع ان يكون الاستخدام الحالي والمستقبلي للنموذج العام مفيدا في دراسة تطور المرض وتطور العلاجات الجديدة.
Disclosures
جوزيف باترسون ، كلفن لوك ، وكاريل Sortwell تشارك حاليا في الترتيبات التعاقدية مع مؤسسه مايكل j. فوكس لمراقبه الجودة المواد α-syn التي ولدتها بروتيتوس ، وشركه Coauthor نيكول بولينسكي ، هو موظف من مايكل j. فوكس المؤسسة ، التي تعاقدت مع بروتيتوس ، وشركه لإنتاج α-syn مونومر. المؤلفون المشاركون ميغان دافي ، لورا فولبيكلي-دالي ، ونيكولاس كنعان ليس لديهم شيء للكشف عنه.
Acknowledgements
وقد دعم هذا البحث بمنح من مؤسسه مايكل جي فوكس ، والمعهد الوطني للاضطرابات العصبية والسكتة الدماغية (NS099416) ومعهد ويستون الدماغ.
Materials
| Name | Company | Catalog Number | Comments |
| 1x Dulbecco’s phosphate buffered saline | Thermo Fisher (Gibco) | 14190144 | |
| Anti-alpha-synuclein (phosphorylated at serine 129) antibody | Abcam | AB184674 | |
| Anti-alpha-synuclein antibody | Abcam | AB15530 | |
| Bicinchonic acid | Thermo Fisher (Pierce) | PI23228 | |
| Clear Medical Shrink Tubing (0.036" inner diameter) | Nordson Medical | 103-0143 | |
| Clear Medical Shrink Tubing (0.044" inner diameter) | Nordson Medical | 103-0296 | |
| Copper sulfate | Thermo Fisher (Pierce) | PI23224 | |
| Eppendorf ThermoMixer C | Eppendorf | 2231000574 | |
| Eppendorf ThermoTop heated lid | Eppendorf | 5308000003 | |
| Formvar/Carbon coated electron microscopy grids | Eletron Microscopy Sciences | FCF300-Cu | |
| Glass capillary tube (0.53 mm outer diameter; 0.09 mm inner diameter; 54 mm length) | Drummond | 22-326223 | |
| Glass needle puller | Narishige | PC-10 | |
| Hamilton syringe | Hamilton | 80000 | |
| Human alpha-synuclein monomer to generate preformed fibrils | Proteos | RP-003 | |
| Mouse alpha-synuclein monomer to generate preformed fibrils | Proteos | RP-009 | |
| Orange Medical Shrink Tubing (0.021" inner diameter) | Nordson Medical | 103-0152 | |
| Parafilm M | Sigma-Aldrich | P7543 | |
| Proteinase K | Invitrogen | 25530015 | |
| Qsonica 3.2 mm tip | Qsonica | 4422 | |
| Qsonica Q125 sonicator | Qsonica | Q125 | |
| Thioflavin S | Sigma-Aldrich | T1892 | |
| Thioflavin T | EMD Millipore | 596200 | |
| ToxinSensor Chromogenic LAL Endotoxin Assay Kit | Genscript | L00350C | |
| Uranyl acetate | Eletron Microscopy Sciences | 22400 |
References
- Luk, K. C., et al. Pathological alpha-synuclein transmission initiates Parkinson-like neurodegeneration in nontransgenic mice. Science. 338, 949-953 (2012).
- Luk, K. C., et al. Molecular and Biological Compatibility with Host Alpha-Synuclein Influences Fibril Pathogenicity. Cell Reports. 16, 3373-3387 (2016).
- Paumier, K. L., et al. Intrastriatal injection of pre-formed mouse alpha-synuclein fibrils into rats triggers alpha-synuclein pathology and bilateral nigrostriatal degeneration. Neurobiology of Disease. 82, 185-199 (2015).
- Abdelmotilib, H., et al. alpha-Synuclein fibril-induced inclusion spread in rats and mice correlates with dopaminergic Neurodegeneration. Neurobiology of Disease. 105, 84-98 (2017).
- Duffy, M. F., et al. Lewy body-like alpha-synuclein inclusions trigger reactive microgliosis prior to nigral degeneration. Journal of Neuroinflammation. 15, 129(2018).
- Duffy, M. F., et al. Quality Over Quantity: Advantages of Using Alpha-Synuclein Preformed Fibril Triggered Synucleinopathy to Model Idiopathic Parkinson's Disease. Frontiers in Neuroscience. 12, 621(2018).
- Luk, K. C., et al. Exogenous alpha-synuclein fibrils seed the formation of Lewy body-like intracellular inclusions in cultured cells. Proceedings of the National Academy of Sciences of the United States of America. 106, 20051-20056 (2009).
- Volpicelli-Daley, L. A., et al. Exogenous alpha-synuclein fibrils induce Lewy body pathology leading to synaptic dysfunction and neuron death. Neuron. 72, 57-71 (2011).
- Volpicelli-Daley, L. A., Luk, K. C., Lee, V. M. Addition of exogenous alpha-synuclein preformed fibrils to primary neuronal cultures to seed recruitment of endogenous alpha-synuclein to Lewy body and Lewy neurite-like aggregates. Nature Protocols. 9, 2135-2146 (2014).
- Kuusisto, E., Salminen, A., Alafuzoff, I. Ubiquitin-binding protein p62 is present in neuronal and glial inclusions in human tauopathies and synucleinopathies. Neuroreport. 12, 2085-2090 (2001).
- Neumann, M., et al. Misfolded proteinase K-resistant hyperphosphorylated alpha-synuclein in aged transgenic mice with locomotor deterioration and in human alpha-synucleinopathies. The Journal of Clinical Investigation. 110, 1429-1439 (2002).
- Li, J. Y., et al. Characterization of Lewy body pathology in 12- and 16-year-old intrastriatal mesencephalic grafts surviving in a patient with Parkinson's disease. Movement disorders : official journal of the Movement Disorder Society. 25, 1091-1096 (2010).
- Shimozawa, A., et al. Propagation of pathological alpha-synuclein in marmoset brain. Acta Neuropathologica Communications. 5, 12(2017).
- Polinski, N. K., et al. Best Practices for Generating and Using Alpha-Synuclein Pre-Formed Fibrils to Model Parkinson's Disease in Rodents. Journal of Parkinson's Disease. 8, 303-322 (2018).
- Fares, M. B., et al. Induction of de novo alpha-synuclein fibrillization in a neuronal model for Parkinson's disease. Proceedings of the National Academy of Sciences of the United States of America. 113, 912-921 (2016).
- Fenyi, A., Coens, A., Bellande, T., Melki, R., Bousset, L. Assessment of the efficacy of different procedures that remove and disassemble alpha-synuclein, tau and A-beta fibrils from laboratory material and surfaces. Scientific Reports. 8, 10788(2018).
- Geiger, B. M., Frank, L. E., Caldera-Siu, A. D., Pothos, E. N. Survivable stereotaxic surgery in rodents. Journal of Visualized Experiments. , (2008).
- Tarutani, A., et al. The Effect of Fragmented Pathogenic alpha-Synuclein Seeds on Prion-like Propagation. Journal of Biological Chemistry. 291, 18675-18688 (2016).
- Wall, N. R., De La Parra, M., Callaway, E. M., Kreitzer, A. C. Differential innervation of direct- and indirect-pathway striatal projection neurons. Neuron. 79, 347-360 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved