Method Article
モノマーからのαシヌクレイン予備型フィブリルの生成と生体内での使用
要約
本稿の目的は、単量体α-シヌクレインからのフィブリルの生成に必要なステップ、その後の品質管理、およびインビボで予備成形されたフィブリルの使用について概説することである。
要約
Synucleinopathy の in vivo α-シヌクレイン予備型フィブリル (α-syn プッ) モデルの使用は、パーキンソン病 synucleinopathy および nigrostriatal 変性のモデル化を目指す研究者の間で人気を集めている。Α-syn プッ生成および in vivo アプリケーションの標準化は、一貫性のある堅牢なα syn 病理を確保するために重要です。ここでは、単量体α-syn、fibrilization 後の品質管理手順、およびラットまたはマウスへのα-syn サイズの脳神経外科注射の成功のためのパラメータを示唆する詳細なプロトコルを紹介します。単量体α syn から始めて、fibrilization は、最適なバッファー条件、濃度、および温度で振とうしながら7日間のインキュベーション期間にわたって発生します。Fibrilization の品質管理は、沈降アッセイによる pelletable 細線維の存在、チオフラビン T アッセイによるフィブリル内のアミロイド立体構造の形成、および線維の電子顕微鏡可視化によって評価される。これらのアッセイを用いて成功した検証は成功のために必要であるのに対し、各プッバッチの凝集活性は細胞培養またはパイロット動物コホートにおいてテストされるべきであることを保証するには十分ではないサイズ。使用する前に、サイズは正確に標準化された条件下で超音波処理する必要があり、次に電子顕微鏡または動的光散乱を用いた検査によって、フィブリル長が最適なサイズ範囲内にあり、平均長さが 50 nm であることを確認します。サイズは、細胞培養培地に添加したり、動物に使用することができます。リン酸化α− syn (psyn; セリン 129) について免疫染色によって検出可能な病理は、それぞれ細胞培養およびげっ歯類モデルにおいて数日後に明らかである。
概要
パーキンソン病 (PD) は、主に、2つの主要な病理学的特徴である、広範で進行性のα-シヌクレイン (α-syn) 病理、および nigrostriatal 変性を特徴とする。野生型マウスまたはラットへの注入に続いて、α− syn 予備化フィブリル (サイズ) は、病理学的α− syn の進行性の蓄積を誘導し、これは、黒質パルスの長期変性をもたらす可能性があるや (SNpc) ドーパミンニューロンの多くの過程でヶ月、sensorimotor 赤字1、2、3、4、5、6。ニューロンは、直接脳内注射を介して、または培養ニューロンの培地に添加することによって、α-syn 線維に曝露される。サイズがニューロンに取り込まれると、サイズは、テンプレートを介して介在物の形成を「シード」し、リン酸化介在物1、7、8に内因性α-syn の蓄積を行う。 9.含まれるものは、レビー小体と同様の特性を持ちます: セリン 129 (pSyn)、ユビキチン、p62 でのα-syn リン酸化を含む。ポジティブなチオフラビン染色で示されているように、アミロイドの第四紀構造を有する。そしてプロテイナーゼ K の消化力1、3、5、7、8、9、10、11に対して抵抗がある、 12です。プッ曝露は、培養中の一次および一部の不死化ニューロンにおけるα− syn 含有形成につながり、ならびにマウス、ラット、およびインビボでの非ヒト霊長類1、2、3、4、 5、6、7、8、9、13。サイズはすべての細胞培養モデルにおいてα-syn 含有形成につながらず、一部の培養ニューロンは他のものよりも優れた種子であることに注意することが重要です。
In vivo α-syn プッモデルのもう一つの重要な特徴は、数ヶ月にわたって出現する別個の逐次病理学的段階である。げっ歯類では、intrastriatal 注射に続いて、α− syn 封入形成は、一般に、1-2 ヶ月以内に SNpc および多くの皮質領域内でピークになる。この凝集ピークに続く nigrostriatal 変性≈2-4 ヶ月後1,3,5.これらの異なる病理学的段階は、1) α-syn 凝集を減少させ、2) すでに形成したα-syn 介在物、および/または 3) 後続の神経変性を防止する戦略を研究し開発するプラットフォームを研究者に提供する。プッモデルは、neurotoxicant、トランスジェニック、およびウイルスベクター媒介α− syn 過剰発現モデルと比較して、以前に確認された6のような明確な利点および欠点を提供する。どのモデルまたはどのアプローチを取るかの選択は、調査者が尋ねている質問に最も適したモデルによって決定されるべきです。
プッモデルは多くの実験室によって首尾よく利用されたが、まだグループが生成フィブリルとの矛盾を経験し、一貫したα-syn 病理学14を作り出す。サイズからの不整合の例としては、α syn 病理をほとんどまたはまったく生成しない、バッチシード効率にバッチ処理する、さらには形成するフィブリルの障害が挙げられる。したがって、新しい治療介入の影響に関する正確な解釈を可能にするためには、α-syn プッ生成およびインビボアプリケーションの標準化が重要である。以下のプロトコルは、α syn モノマーからのサイズの生成に必要なステップを概説し、一旦形成されたサイズのインビトロ品質制御、使用前のサイズの超音波処理および測定、およびインビボ注入の成功を促進するための提案ラットまたはマウスにサイズ。
プロトコル
動物を含むすべての方法は、ミシガン州立大学組織動物ケア・ユース委員会 (IACUC) によって承認されています。
1. モノマーからのαシヌクレイン予備繊維の形成 (図 1)
- シヌクレインモノマーを氷上で解凍し、チューブをフリックして優しく再懸濁、4° c で10分間 15000 x gで遠心分離します。
注: α-syn モノマーは、fibrilization のために特別に配合されなければなりません。組換えモノマーは、商業的供給源から購入するか、またはサイト4、9、14、15のプロトコルによって生成することができる。商業的な供給源から購入された場合、製品は、α-syn モノマーが特にフィブリルの生成のためにあることを明記しなければならない。モノマーが現場で購入または生成されているかどうかにかかわらず、以下に概説する品質管理手順は、フィブリルが形成され、実験に使用する前に効率的に種子を確実にするために、各バッチで実行する必要があります。 - 上清をきれいな 1.5 mL マイクロ遠心チューブに移し、移された量を記録してください。
注: ペレットを避けるように注意してください (存在する場合は、小さくなります)。 - 標準的な bicinchoninic 酸アッセイ (BCA) のいずれかによって転写された上清のタンパク質濃度を測定するか、microvolume 分光光度計で 280 nm の吸光度を測定する。
注: BCA アッセイは、α-syn の特定の測定値としては正確ではなく、過大評価タンパク質濃度の結果を得ることができます。その結果、280 nm での吸光度を測定することは、タンパク質濃度を決定するために推奨される方法です。- BCA アッセイで測定するには、標準の BCA プロトコルに従い、α-syn モノマーの3つの異なる希釈を行う。推奨希釈濃度は、1:25、1:50、および1:100 です。
- A280 法で測定するには、カルシウムとマグネシウムを含まない滅菌1x ダルベッコ改変のリン酸緩衝生理食塩水 (dPBS) を用いて、約 100 mM NaCl の塩濃度と pH 範囲 7.0-7.3 (材料表) をブランクにします。
- 2μ l のサンプルをリーダに加え、280 nm の吸光度を読み取ります。
- ビール・ランバート法を用いてモノマーの濃度を測定する。

注: ヒトα syn の吸光係数εは、5960 M-1cm-1 であり、マウスα-syn については 7450 m1cm-1 です。層厚は cm 単位で測定されます。α-syn (14 kDa) の分子量は 1 Da = 1 g/mol と仮定して推定される。
- 1倍 dPBS のモノマーを 5 mg/mL の最終濃度に希釈します。以下の式を使用して、モノマーを希釈するために追加された 1x dPBS の量を計算します。

注: すべての濃度は mg/mL で、容積はμ l である。モノマー希釈は 1x dPBS で行う必要があります。細線維を生成するために使用される総容積は、再現性の fibrilization 結果を達成するために100と500μ l の間でなければならない。 - 簡単に混合するために渦し、チューブの底部にあるすべての液体を収集するために遠心分離する。ステップ 1.8.1-1.8.4 で示されているようなフィブリルとの品質管理比較のためのアリコートモノマー。
- チューブロックまたはワックス/プラスチックフィルム (材料表) を使用して、マイクロ遠心チューブの蓋を閉じて固定します。
- 37° c で7日間の蓋をした軌道リアルタイムアッセイモニタリングにチューブを置き、1000 RPM で振盪する (材料のテーブル)。
注: 7 日の終わりに、チューブの内容が濁って表示されるはずです。リアルタイムアッセイモニタリングは管のふたの凝縮の形成を防ぐためにふたを備えなければならない。 - 慎重にチューブをフリックして、α-syn 線維を再懸濁します。ステップ1.8.1 −1.8.4 に示されるような以下の品質管理ステップのためのアリコートフィブリル。
注: 品質管理ステップのためのフィブリルは一晩 RT で保存することができます。- 沈降アッセイ用のアリコート6μ l。
- チオフラビン T 結合アッセイ用のアリコート5μ l。
- フィブリル化のための透過電子顕微鏡用アリコート2μ l。
- アリコートは、エンドトキシンアッセイのために少なくとも10μ l を測定する。
注: エンドトキシンアッセイでは、市販のリムルス Amebocyte ライセート (ラル) が使用されており、製造元の指示 (資料の表) に従います。エンドトキシンのレベルは、フィブリルのために≤0.5 エンドトキシン単位/mL でなければなりません。この基準が満たされていない場合、エンドトキシン除去キットを使用することができます。
- 残りのフィブリルとアリコートを保存します。長期保管 (12-18 ヶ月) の場合は、ドライアイスを急速に凍結し、-80 ° c で保管してください。
注: アリコートの量は、目的の下流アプリケーションによって異なります。インビボでの使用は、典型的には、インビトロでの使用よりも高い濃度でより多くのフィブリルを必要とし、そしてアリコート体積はそれに応じて計画されるべきである。フィブリルは、潜在的な凍結/融解の損傷を防ぐために、冷凍庫の背部の方に保存する必要があります。プロトコルはここで一時停止することができます。
2. 沈降アッセイ
- きれいなマイクロ遠心チューブで、プッを1:10 希釈するために dPBS の54μ l の6μ l を添加し、pipet を混合する。
- 別の管で、付加的な制御として dPBS の54μ l に単量体の6つのμ l を加えなさい。
- RT で30分間 1万 x gでサンプルを遠心分離し、上澄みをきれいなマイクロ遠心チューブに移します。
- 残りのペレットに60μ l の dPBS を加え、再懸濁に渦をかけます。
- 30μ l の3x サンプルバッファー (140 μ l の 50% グリセロール/0.1% ブロモフェノール、40μ l の 10% SDS、および20μ l のβ-メルカプトエタノール) を各チューブと渦に加えて混ぜる。
- 100° c で10分間サンプルをインキュベートし、氷上で5分間冷却することができます。
- タンパク質を質量別に分離するために、標準ナトリウムドデシル硫酸-ポリアクリルアミドゲル電気泳動 (SDS-PAGE) プロトコルを使用してください。14 kDa (単量体α syn に期待されるサイズのバンド) を含む範囲のプロテインラダーを使用します。
- ゲルを染色皿に移し、クマシーブルーステインでジェルを覆います (0.1% クマシーブリリアントブルー、20% メタノール量、および 10% 酢酸 ddH2)。振とうしながら3時間、RT でインキュベートします。
- クマシーブルーの汚れを注ぎ、ゲルを覆うのに十分な脱色 (容積によって 50% のメタノールおよびddH のボリュームによって 10% 酢酸) を加えてください。RT で30分間インキュベートしながら振盪します。
- 脱色をオフに注ぎ、ゲルが明確になり、バンドが表示されるまで、脱色ステップを繰り返します。
- DdH2O で振盪することにより、それぞれ5分間ゲルを3回洗浄し、ゲルを画像化する。
3. フィブリル化可視化のための透過型電子顕微鏡
- マイクロ遠心チューブ中の酢酸ウラニルの 20 mg を量り、2% 水溶液を作るために ddH2O の1ml を加えます。ウラニル酢酸が溶液中になるまで渦をし、一晩座ることを許可します。
注: 酢酸ウラニルは、透過電子顕微鏡用サンプルを調製する前の日に行う必要があります。光または攪拌への暴露は、酢酸ウラニルを沈殿させることができ、そのように、ウラニル酢酸溶液を含む管は、アルミニウム箔で覆われ、暗い場所に保たれるべきであり、酢酸ウラニルが溶液中になった後に振盪しない。 - プッの98μ l に2μ l を加えて dPBS を1:50 希釈し、pipet を混合する。
- ベンチトップにきれいなワックス/プラスチックフィルム (材料表) カバーされた表面 (約 50 mm x 50 mm) を準備します。クリーンワックス/プラスチックフィルム (材料表) に、以下を追加します (図 2)。
- DdH2O の 4 x 10 μ l の滴を加えてください。
- 希釈したフィブリルまたはモノマー試料の 1 x 10 μ l 滴を添加する。
- 酢酸ウラニル 2% の 2 x 10 μ l 滴を加えます。
- 微細な鉗子を使用して、formvar/炭素被覆、メッシュ銅透過電子顕微鏡観察グリッド (材料表) をピックアップします。
注: エッジによってグリッドが選択されるようにして、中央のメッシュ部分を避けてください (図 2A)。鉗子がメッシュを触ると、formvar/カーボンコートフィルムが破損し、グリッドのその領域での撮像が不可能になる。 - グリッド formvar/カーボンコーティングされた側 (光沢のある側) を ddH の最初の一滴に浮かべます。ピンセットを優しく使用してグリッドを保持し、コーティングされた表面全体が ddH2o に接触するように押し込みます。グリッドを1分間フローティングさせます。
- グリッドをピックアップし、グリッドのメッシュ部分に触れることなく、フィルタ紙で ddH2O を離れてウィック。
- DdH2o の2番目のドロップの上のようにグリッドを1分間、ddH2o を遠ざけます。
- 上のように1分間の希釈したフィブリルの滴の上にグリッドを浮かべて、余分に離れてください。
- 分のウラニル酢酸の最初の滴にグリッドを浮かべて、余分なものを遠ざけます。
- 1分間酢酸ウラニルの2番目の滴にグリッドをフロート、余分を離れてウィック。
- DdH2o の3番目のドロップで上記のようにグリッドを短くし、ddH2o を離れてウィックします。
- DdH2o の4番目のドロップで上記のようにグリッドを簡単にフロートさせると、ddH2o を離れてウィックし、できるだけ ddH2o を削除することを確認します。
- イメージングまで保存するためのグリッドボックスに転送します。
注: グリッドは、イメージングの前に少なくとも5分間乾燥する必要があります。グリッドは、調製後少なくとも1年のために撮像することができ、乾燥した環境で保存する必要があります。
4. チオフラビン T アッセイ
- 清潔なマイクロ遠心管では、プッの245μ l に5μ l を加えて dPBS を1:50 希釈し、pipet を混ぜます。
- 別のマイクロ遠心チューブに250μ l の dPBS を加えて、ネガティブコントロールとして機能させる。
- DPBS の245μ l に5μ l のモノマーを加えて、モノマー制御として機能させる。
- チオフラビン T に250μ l のグリシン緩衝液 (25 μ m チオフラビン T、100 mM グリシン、1% トリトン X-100、pH 8.5) を各サンプルに加え、軽く混ぜる。
- Pipet 2 反復、それぞれ200μ l、黒96ウェルプレートに入れます。光退色を防ぐために、プレートを暗闇の中に保管してください。
- RT で1時間インキュベートし、450 nm の励起と 510 nm の発光を使用してプレートを読み取ります。
注: チオフラビン T の測定値は時間とともに変動します。サンプルは、同じインキュベーション時間で読み取る必要があります。必要に応じて、1時間のインキュベーション中に複数の測定値を取得し、時間をかけてプロットすることができます。
5. α-シヌクレイン予備繊維の超音波処理
注意: sonicator とすべての超音波処理ステップは、超音波処理中に aerosolize することができるフィブリルへの暴露を防止するために、培養フードで実行されます。超音波処理手順を実行する要員は、手袋、白衣の形で衣類の保護、および超音波処理するしながら、顔の盾を含む、個人的な保護具を着用しなければなりません。フィブリル曝露のリスクは、カップホーン sonicator で超音波処理するすることによって低減することができ、フィブリルを含むチューブを超音波処理中に閉じたままにすることができる。
注: フィブリルの最適な超音波処理パラメータは、使用される sonicator のモデルに依存しています。このため、フィブリルが正しいサイズであることを保証するために、いくつかの最適化を行う必要があります。使用される sonicator は材料のテーブルで見つけられ、概説される変数は sonicator のこのモデルとの前の結果に基づいている。以下のパラメータは、200-400 μ l のサイズμ g/μ l の溶液で2-4 動作します。測定器とのテスト超音波処理を行い、所望の結果が実験でサイズの使用前に達成されることを確実にするために分析されるフィブリルが必要です。
- 3.2 mm の直径のプローブ (材料のテーブル) をコンバーターに取り付け、ステップ 5.1.1-5.1.3 で以下に示すように、sonicator パラメータを設定します。
- 振幅を 30% に設定します。
- パルスを 01 01 に設定します (1 s オン、1 s off)。
- 時間を0:01:00 に設定します。
注: パルスの1分は60パルスに相当し、このモデルの sonicator (材料表) は自動的に停止します。他の sonicator モデルでは、パルスの数を数える必要があります。
- RT での dPBS を融解し、培養フード中で無菌の溶液で希釈する。
注: 明確な 0.6 mL マイクロ遠心チューブは、超音波処理に最適で、最終のフィブリル濃度は使用目的によって異なります。示された代表的な結果は、最終のフィブリル濃度が4μ g/μ l である。 - 70% エタノールで湿らせたラボ組織で sonicator のプローブを拭き取り、プローブをクリーニングします。プローブの先端を ddH の2O とパルスに10回沈めて、さらにプローブをきれいにしてから、ラボ組織で拭いて乾かします。
- プローブ先端を希釈したフィブリルのチューブに入れ、チューブの底面に先端を置きます。
- 60パルスのための超音波処理 (1 s on; 1 s オフ)。各パルスの間にプローブを上下に動かして、液体中のすべてのフィブリルが超音波処理されるようにします。きれいで
- 60の脈拍の後、サイズからのプローブを取り外し、電子顕微鏡によって超音波処理によるフィブリル測定のためのプッフィブリル1:50 をきれいなマイクロ遠心管で dPBS の98μ l に添加した。
注: 理想的には、フィブリルの小さなサブセットは、インビボ注入の前に測定されるべきであり、時間が許すときに行われるフィブリルのより包括的な測定である。 - 超音波処理した後、簡単にチューブの側面からすべての液体を収集するために 2000 x gで 1 s のためにサイズを遠心分離します。
注意: チューブが接触して熱くなる場合は、30パルスの後に超音波処理するを停止し、1分間待ってから、最後の30パルスの超音波処理を待ちます。
注: 超音波処理する中、プローブ先端を各パルスの開始時に液体の底部に向けておくと、液体の上部に近すぎるとサンプルが失われます。 - プローブ先端を 1% SDS に沈め、10回パルスしてプローブをクリーニングします。先端を SDS から取り出し、ddH2O に沈めて10回パルスします。
- 70% のエタノールで湿らせたラボ組織でプローブを拭いてから、プローブを乾いたラボ組織で拭きます。プローブをコンバーターおよびストアから切り離します。
- フード内のすべての表面を 1% SDS で拭き、70% のエタノールを続けます。
注: 1% SDS 溶液を使用して、フィブリルと清浄な表面および装置16を解離させる。
超音波処理されたフィブリルの測定のための透過電子顕微鏡
注: 電子顕微鏡検査が実現可能でない場合、チオフラビン T 動力学アッセイ、および動的光散乱は、播種効率およびフィブリルサイズ4、14の間接的な測定として使用できます。
- 上記の「フィブリル化のための電子顕微鏡検査」セクションのプロトコルを使用してサンプルを準備します。
- 透過型電子顕微鏡を使用して、6〜10種類の格子開口部からフィブリルの像を撮影する。
注: 画像は、フィブリルを測定するのに十分な倍率であるべきであるが、複数のフィブリルを同時に可視化するには十分低い。最終的な倍率は約75倍で十分です。 - 実験においてフィブリルを使用する前に少なくとも25個のフィブリルの小さなサブセットの長さを測定する。
注: これらの測定は、典型的には、顕微鏡に関連する画像化ソフトウェアを使用して行うことができる。迅速な検証のために、測定者は、代表的な細線維を選択し、平均サイズを計算する必要があります。フィブリルの長さは平均約 50 nm 以下で、より正確な測定を行います。 - より包括的な結果のために 500 + フィブリルの長さを測定します。
注: 顕微鏡に関連するイメージングソフトウェアは、フィブリルの測定に使用することができます。あるいは、画像処理ソフトウェアを用いて測定することができ、フィブリルは、各画像に関連付けられたスケールバーをサイズ基準として用いて、フィブリル化長さを比較することができる。
7. 定位注射用のカスタムガラス針シリンジの調製 (図 3)
- 清浄な 50 mL ビーカーに約10ml の siliconizing 試薬 (材料表) を加えます。
- ガラスキャピラリーチューブ (長さ 54 mm、外径: 0.86 mm、内径 0.59 mm) を siliconizing 試薬のビーカーに垂直に配置し、毛管作用で siliconizing 試薬をチューブ上に沈めて下部チューブ開口部を貫通させます。siliconizing 試薬。
- Pipet は、siliconizing 試薬に沈められていない上部管開口部に追加の siliconizing 試薬を注入して、ガラス毛細管を完全に充填します。
- Siliconizing 試薬から毛細管を取り出し、ペーパータオルでチューブの開いた端を拭き取り、チューブ内の siliconizing 試薬を除去します。毛管管は少なくとも8時間乾燥させることを許可しなさい。
- ガラスの針の引き手にシリコン処理のガラス毛細管を置きます (材料のテーブル)。
- 加熱素子をオンにし、付属の重量は、加熱されたガラス毛細管を伸ばすことができます。
- 中央の最も薄い点ではさみで引っ張られたガラス毛細管をカットし、ガラス針の引き手からガラス針を取り外します。
注: 引っ張られた針の内径と外径は、それぞれ約80と100μ m でなければなりません。複数のガラス針を一度に作ることができ、付属の金属製の針 (材料のテーブル) とガラス注射器に取り付ける準備が整うまで保存されます。 - シュリンクラップチューブの長さ (平均内径 0.021 "と平均壁厚 0.001") をはさみで約 40 mm にカットします。シュリンクラップを10μ l のベベルしたシリンジ (材料のテーブル) の金属製の針の上にスライドさせます。
- 針を回転させながら均一に熱を加えるために、開いた炎を使用して、ニードルにシュリンクラップを加熱して接着します。
- 引っ張られたガラス針の大きい方の端を、シリンジの金属製の針に注意深くスライドさせます。
- シュリンクラップチューブ (平均内径 0.036 "と平均壁厚 0.005") をはさみで約 40 mm に切り、ガラス針の上を慎重にスライドさせて、ガラス針とシリンジの金属針の付け根に重なるようにします (表材料)。開いた炎を使用してシュリンクラップを加熱し、ガラス針を金属製の針に固定します。
- ガラスの針を固定するためにシュリンクラップの追加の層を追加します。シュリンクラップチューブ (平均内径 0.044 "と平均壁厚 0.005") をはさみで約 40 mm に切り、ガラス針の上を慎重にスライドさせて、ガラス針とシリンジの金属針の付け根に重なるようにします (表材料)。開いた炎を使用してシュリンクラップを加熱し、ガラス針を金属製の針に固定します。
- 先端が約 8 mm の長さになるようにはさみでガラスの針をトリム。
注: 針は、所望の脳領域を標的とするのに十分な長さである必要があります (必要な長さは、背/腹部の座標に依存します)。 - 漏出がないことを保障するために針をテストするのにステップ 7.14.1-7.14.3 を使用し、ガラス針からの液体の引き出しおよび分配の両方に十分な流れがある。
- 付属の26ゲージニードル付き1Ml のシリンジを dH2O で満たします。
- カスタムのガラス製ニードル注射器から金属プランジャーを取り外し、dH2O 充填シリンジの針をシリンジのベースに挿入します。ガラスニードルから dH2O を吐出する圧力をかけます。ガラス針と金属製針の界面に漏れがないか点検し、安定した dH2O の流れを確認します。
注: 必要に応じて、ガラス針をトリムして流れの容易さを高め、ガラス針の基部からの漏れをパッチするためにシュリンクラップの追加の層を追加することができます。 - マイクロ遠心チューブに dH2o を充填します。カスタムガラスニードルシリンジを使用して、dh2o で描画します。注射器に液体が取り込まれ、気泡がないことを確認するために針を点検する。
注: 泡または dH2O が針に引かれていない場合、針をトリミングすることは圧力を軽減するのを助けることができます。
- 手術のために必要になるまでシリンジに付属のガラス針で注射器を慎重に保管してください。
- 標準的な stereotaxic 手術法を使用して、マウスの最適化された座標 (1 つの部位: AP + 0.2 mm および ML + intrastriatal から bregma、DV-2.6 mm から硬膜から 2.0 mm)、またはラット (2 つの部位: bregma からの AP + 1.6 mm および ML + 2.0 mm、DV-4.0 から硬膜;AP + 0.1 mm および ML + bregma から 4.2 mm、硬膜からの DV-5.0)1、14、17。
注: これらの座標は、C57BL6/C3H マウスおよび Fischer 344 ラットで使用されています。他のひずみを使用する場合は、座標を最適化する必要があります。
結果
Α− syn モノマーからのフィブリルの生成は、モノマーの濃度を決定することから始まる。BCA アッセイと 280 nm (A280) での吸光度測定はどちらもタンパク質含有量の測定に使用できます。しかし、BCA アッセイの結果は、A280 法よりも高い濃度であることが示唆された。マウスα-syn モノマー由来のサイズは、BCA 値が14.05 ±0.22、A280 が8.05 ±0.03 μ l であった (図 1)。同様に、ヒトα-syn モノマーに由来するサイズも、12.95 ±0.38 の BCA 値および7.83 ±0.05 μ g/μ l の A280 で、より高濃度であるように見えた (図 1)。A280 の測定値は、消光係数を含めることに基づいてα syn に固有であり、これらの結果は、7日間のインキュベーションの前にモノマーを希釈するために使用されました。
インキュベーションに先立って、α− syn モノマーを含む液体は明らかであったが、フィブリル形成後に濁って現れるはずである。透過型電子顕微鏡による検査では、長いフィブリルの存在を確認し、10-20 の幅を測定した (図 4)。比較して、α-syn モノマーはほとんど認識できない形状で見えました (図 4)。フィブリル状構造の目視確認により、フィブリルのアミロイド立体構造は、チオフラビン T アッセイを用いて確認すべきサイズの次の特徴である。チオフラビン T は、アミロイドへの結合時に蛍光を増強する。したがって、サンプルからの蛍光シグナルの増加は、アミロイドの存在を示す。一例として、dPBS におけるチオフラビンは、3287±580の相対蛍光単位 (RFU) の信号を生成し、マウスα− syn モノマーは4174± 158 RFU のシグナルを生成し、マウスサイズは59754± 6224 RFU のシグナルを生成した (図 5)。これと比較して、ヒトα-syn モノマーは、マウスモノマーに対して4158± 105 RFU の同様のシグナルを生成し、ヒトサイズはマウスサイズと比較して1235967± 113747 RFU の高いシグナルを生成した (図 5)。Pelletable 細線維の存在を評価するために、沈降アッセイを行った。フィブリルは遠心分離でペレットになる。マウスとヒトのプッ試料の両方において、上清分は、上清よりもペレット中により多くのタンパク質を有するべきである (図 6)。対照的に、マウスおよびヒトモノマーからのタンパク質の大部分は、上清中に存在し、ペレット中にはほとんど存在しない (図 6)。電子顕微鏡によって目に見えて存在するサイズでは、アミロイド構造が存在し、フィブリルが pelletable、サイズはすべてのインビトロ品質管理ステップを通過した。
マウスとヒトのサイズの両方を超音波処理して、α-syn 介在物4,18に播種するための適切な長さのサイズを生成した。サイズを4μ g/μ l の所望の濃度に希釈し、超音波処理した。手術直前に、25個の代表的なフィブリルを電子顕微鏡によって画像化し、そのフィブリルサイズをスポットチェックするように測定した。超音波処理されたマウスサイズは48.8 ± 3.1 nm を測定したが、人間のサイズは52.1 ± 4.4 nm の長さを測定した。従って両方の種のサイズは、播種活性を誘導するのに適切な長さ (50 nm 以下) であった。約500の細線維のより包括的な検査は、超音波処理されたマウスフィブリルの平均長さおよび長さ分布を明らかにした。平均の長さは44.4 ± 0.6 nm であり、86.6% のサイズは 60 nm 以下を測定した (図 4)。比較して、ヒトサイズ平均55.9 ± 1.1 nm の 69.6% のサイズを 60 nm 以下で測定した (図 4)。
超音波処理したマウスサイズの intrastriatal 注射の後、先に述べたようにラットを3、5、手術後2ヶ月で加工した一連の組織切片を、ニューロンを含む封入数がピークすることが知られている。SNpc を、リン酸化α− syn 介在物5の確認のために。PSyn (物質表中の抗体) に対する免疫組織化学的染色によって示されている封入軸受ニューロンは、SNpc (図 7) 内に存在しており、線条体を innervate する脳全体の他の領域 (前方嗅覚核、運動、帯状、piriform、prelimbic、つかさどる、entorhinal、および島皮質、扁桃体、線条体)1、3、4、5、19。これらの介在物は、免疫組織化学的染色 (抗体とプロテイナーゼ K の材料表) によって示されるように、チオフラビン S の結合、総α-syn の抵抗、プロテイナーゼ K (図 7) などのレビー小体と類似した特性を共有します。.脳内での播種の確認は、インビボでの品質管理が合格したことを示し、そして以前に凍結し、同じバッチから保存されたサイズのアリコートは、同一のパラメータの下で超音波処理することができ、長さは、より大きな実験で検証した。

図 1.Α− syn 線維の生成のための方法。Α-syn モノマーからフィブリルを製造するために必要な工程の概略モノマーは10分間遠心分離されます (15000 x g、4° c で)。上清は、清潔なチューブに移し、タンパク質濃度は、280 nm での吸光度、または BCA アッセイによって決定される。グラフはヒトおよびマウスα− syn モノマーからの濃度を示す。列はグループ平均を示し、誤差バーは平均の±1標準誤差を表します。タンパク質濃度が決定された後、α− syn モノマーを希釈し、37° c のために簡単にボルテックスしして7日間インキュベートし、1000 RPM で設定された軌道ミキサ上で振盪した。この図の大規模なバージョンを表示するには、ここをクリックしてください。

図 2.透過型電子顕微鏡の染色方法。電子顕微鏡検査のための陰性染色の図。A)電子顕微鏡標本の格子を描写するイメージ。グリッドは、鈍いまたは明るい側面と光沢のあるまたは暗い側面を持っています。光沢のある/暗い側面は formvar/カーボンサポートフィルムによって塗られる。B)染色手順の図。グリッドは、1分間 ddH の最初のドロップで光沢のある/暗い側面を下に浮かべており、過剰は、フィルタ紙で離れて邪悪です。このプロセスは、ddH の2番目のドロップで繰り返され、サイズまたはモノマーの希釈、酢酸ウラニルの2滴、および ddH2O の2つの追加の滴が、画像化されるまでグリッドボックスに格納され得る。スケールバー = 3 mmこの図の大きなバージョンを表示するには、ここをクリックしてください。

図 3.カスタムガラス針シリンジの組み立て。ガラス針付属シリンジを組み立てるために必要な工程の図。シリコン処理ガラスの毛管管は引っ張られ、ガラス針を作り出すために中間で切られる。シュリンクラップチューブは、金属製の針を準備し、ガラスの針が金属の針にスライドしたときに内側のシールを形成するために使用されます。ガラスの針と金属の針の基部に重なるシュリンクラップチューブの2つの追加の層を連続して添加し、熱を加えてガラスの針を固定し、水の詰まったシールを形成します。この図の大規模なバージョンを表示するには、ここをクリックしてください。
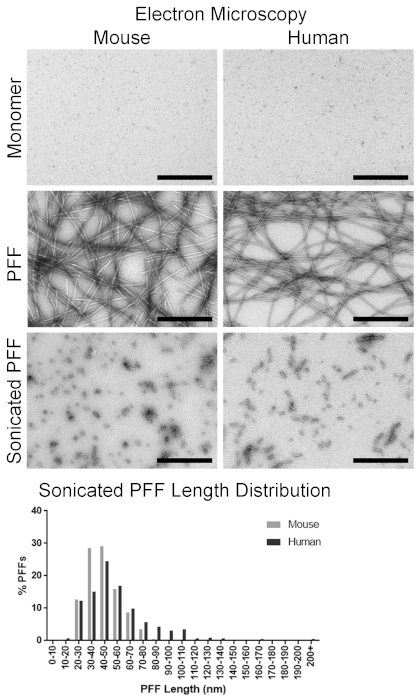
図 4.透過型電子顕微鏡によるα syn モノマーおよびα-syn 線維の可視化Α-syn モノマーおよびフィブリルの代表的な顕微鏡写真。トップパネル: マウスとヒトα-syn モノマー。ミドルパネル: 全長マウスとヒトα-syn サイズパネル: 超音波処理後のマウスとヒトα-syn サイズ。ボトムグラフ: 超音波処理したマウスおよびヒトα-syn プッの分布。スケールバー = 500 nm。この図の大規模なバージョンを表示するには、ここをクリックしてください。

図 5.チオフラビン T アッセイによるアミロイド構造の確認マウスおよびヒトα-syn モノマーおよびプッサンプルからの蛍光シグナルの測定左: マウスα-syn モノマーとα-syn サイズからの結果。右: ヒトα syn モノマーおよびα-syn サイズの結果DPBS ネガティブコントロールが各グラフに表示されます。すべての測定値は、相対蛍光単位 (RFU) で表されます。列はグループ平均を示し、誤差バーは平均の±1標準誤差を表します。この図の大規模なバージョンを表示するには、ここをクリックしてください。

図 6.Pelletable α-synの沈降アッセイ。クマシー染色されたゲルからの画像.示されているバンドは蛋白質の梯子に基づいておよそ 14 kDa にある。左: マウスのモノマーとサイズ。右: ヒトモノマーおよびサイズ。すべてのモノマーおよびプッ試料について、再懸濁ペレット (P) および上清 (S) が示されている。この図の大規模なバージョンを表示するには、ここをクリックしてください。
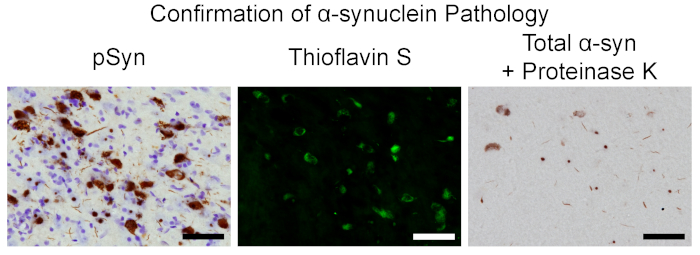
図 7.Α-syn 病理を確認するラットモデルにおける介在物の特徴黒質の顕微鏡写真の代表者は、注射後2ヶ月でやした。左: pSyn と対比染色を含むニューロンクレシルバイオレットバイオレット.中央: チオフラビン S 陽性ニューロン.右: プロテイナーゼの K. スケールバーに対して抵抗力がある (α) syn を含んでいる介在物 = 50 μ m。こちらをクリックして、この図の大規模なバージョンをご覧ください。
ディスカッション
サイズを播種し、レビー小体のような介在物に導くことができるα syn の生産は、複数の要因とステップに依存しています。重要な要因は、フィブリルを生成するために使用されるモノマーが fibrilization4、9、14、15に特異的に処方される必要があることである。モノマーが fibrilization のために製剤化されていない場合、フィブリルは形成しないか、または形成するフィブリルがα-syn 病理を産生しないことがある。同様に、モノマーが有する緩衝液もまた、fibrilization に影響を及ぼす。そのため、最良の結果を得るためには、塩濃度はおよそ 100 mM NaCl で、pH は 7.0 ~ 7.3 とする必要があります。変動性を導入する最初のステップは、初期タンパク質含有量が決定される方法であり、A280 での測定はより正確な結果を生み出す可能性が高いため、好ましい方法である。タンパク質濃度の不一致は、fibrilization プロセスの有効性を低下させるだけでなく、実験で使用した仮定したプッ濃度を変更することができます。どちらも、実験間の播種効率とバッチ変動の減少につながる可能性があります。
初期の品質管理手順では、特に線維性構造 (電子顕微鏡法)、アミロイド構造 (チオフラビン T アッセイ) を含む、サイズの重要な機能を確認し、pelletable (沈降アッセイ) です。チオフラビン T アッセイの結果は、時間とともに変動し、現在存在するアミロイド構造の量を直接測定するものではないことに注意することが重要であり、むしろ、チオフラビン T アッセイは、内部におけるアミロイド構造の存在の指標としてのみ使用されるべきである。サンプル。チオフラビン T は、典型的には、上記のアッセイなどのインビトロアッセイにおいて、アミロイド構造を含むフィブリルを示すために使用される。あるいは、チオフラビン S は、図 7に示すように、組織内でアミロイド構造を検出するために使用される。沈降アッセイに関して、結果は、サイズが主として pelletable フラクション内に見出されることのみを示す。サンプルが変性条件で実行されると、約 14 kDa、α syn モノマーのサイズの単一の著名なバンドがゲル上に存在します。これは、天然または非変性ゲルが使用された場合にサイズで期待される、より高い分子量に存在する複数のバンドとは異なります。最後に、これらすべての初期品質管理手順を成功させることは、α-syn 包含播種活性を保証するものではありません。このため、細胞培養実験または外科的に注射された動物の小さなコホートを使用して、より大きな実験で使用する前にサイズの有効性を試験する必要があります。
超音波処理は、プロセスの重要なステップであり、パラメータは、使用される sonicator のモデルに応じて異なります。超音波処理パラメータは、短いプッフラグメントが生成されたことを示すために適用し、検証する必要があります。フィブリル径は播種にも影響を及ぼし、より短繊維の播種がより効率的になる。より短いフィブリル種がより効率的になるが、この効果プラトーおよび最適なプッ長さはおよそ 50 nm4、18である。また、サンプルを過度に超音波処理したり、過剰な熱にサイズを露出させたりしないことが重要であり、これにより播種効率が低下する可能性があります。これらの超音波処理可能なサイズは、より大規模な実験に使用する前に小細胞培養またはインビボ実験における有効性について試験されるべきである。異なる超音波処理セッションは、可変性を導入する可能性を持っているように、実験治療グループはそれに応じて計画する必要があります。
生体内でサイズを送達する場合、注射部位 (複数可) の局在化および使用される全量サイズは、神経変性の程度と同様に、介在物を発症するニューロンの数7、14に影響を及ぼし得る。プロトコルの座標は開始する場所を提供しますが、大規模な実験で使用する前に、目的のターゲット領域がα syn 病理を開発するようにラボ内でテストする必要があります。所望であれば、追跡染料または蛍光ビーズは、サイズを使用する前に、地域ターゲティングをテストする方法として使用することができます。インビボで使用されるサイズの量は、グループ間で異なるが、ほとんどのグループは、1、2、3、4、5のいずれかに分けて5〜20μ g のサイズの合計を使用する。,6,7,14. 注射部位の数、注射部位の位置、および注入されたサイズの量が、synucleinopathy の結果および進行に影響を与えることができるように、使用するパラメータの下流の結果は、モデルを使用する前に特徴付けられるべきである潜在的な介入をテストするか、モデルの時間的特徴を調べます。
治療や病気の進行を研究するために使用するモデルを選択するとき, 使用されるモデルは、質問に最適な答えを選択する必要があります。.すべてのモデルが PD の特定の疾患の特徴を持っている、または潜在的な介入をテストするために必要とされる時間枠を提供しません。プッモデル含むは、α syn 病理や神経変性などの PD の主な特徴を有し、適度な運動障害を引き起こす可能性があります。このモデルは、予測可能で長期にわたる時間経過を提供しており、これは神経変性の数か月前に形成されます。これにより、研究者は synucleinopathy の長引く進行を通してさまざまなフェーズを調査し、活用することができます。モデル全体の現在および将来の使用は、疾患の進行および新規治療法の開発の研究において有益であると期待されている。
開示事項
ジョセフ・パターソン、ケルビン・ Luk、キャリル Sortwell は現在、マイケル j. フォックス財団との契約交渉に関与しています Proteos, Inc. 共著者ニコール・ Polinski によって生成されたα-syn 材料, マイケル・ J ・フォックスの従業員であります財団は、α-syn モノマーを製造するために Proteos、Inc. を契約しています。共同編集者ミーガン・ダフィー、ローラ・ Volpicelli ・デイリー、ニコラス・ Kanaan は何も開示することがない。
謝辞
本研究は、マイケル・ J ・フォックス財団、国立神経疾患・脳卒中研究所 (NS099416)、ウェストン脳研究所の助成金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 1x Dulbecco’s phosphate buffered saline | Thermo Fisher (Gibco) | 14190144 | |
| Anti-alpha-synuclein (phosphorylated at serine 129) antibody | Abcam | AB184674 | |
| Anti-alpha-synuclein antibody | Abcam | AB15530 | |
| Bicinchonic acid | Thermo Fisher (Pierce) | PI23228 | |
| Clear Medical Shrink Tubing (0.036" inner diameter) | Nordson Medical | 103-0143 | |
| Clear Medical Shrink Tubing (0.044" inner diameter) | Nordson Medical | 103-0296 | |
| Copper sulfate | Thermo Fisher (Pierce) | PI23224 | |
| Eppendorf ThermoMixer C | Eppendorf | 2231000574 | |
| Eppendorf ThermoTop heated lid | Eppendorf | 5308000003 | |
| Formvar/Carbon coated electron microscopy grids | Eletron Microscopy Sciences | FCF300-Cu | |
| Glass capillary tube (0.53 mm outer diameter; 0.09 mm inner diameter; 54 mm length) | Drummond | 22-326223 | |
| Glass needle puller | Narishige | PC-10 | |
| Hamilton syringe | Hamilton | 80000 | |
| Human alpha-synuclein monomer to generate preformed fibrils | Proteos | RP-003 | |
| Mouse alpha-synuclein monomer to generate preformed fibrils | Proteos | RP-009 | |
| Orange Medical Shrink Tubing (0.021" inner diameter) | Nordson Medical | 103-0152 | |
| Parafilm M | Sigma-Aldrich | P7543 | |
| Proteinase K | Invitrogen | 25530015 | |
| Qsonica 3.2 mm tip | Qsonica | 4422 | |
| Qsonica Q125 sonicator | Qsonica | Q125 | |
| Thioflavin S | Sigma-Aldrich | T1892 | |
| Thioflavin T | EMD Millipore | 596200 | |
| ToxinSensor Chromogenic LAL Endotoxin Assay Kit | Genscript | L00350C | |
| Uranyl acetate | Eletron Microscopy Sciences | 22400 |
参考文献
- Luk, K. C., et al. Pathological alpha-synuclein transmission initiates Parkinson-like neurodegeneration in nontransgenic mice. Science. 338, 949-953 (2012).
- Luk, K. C., et al. Molecular and Biological Compatibility with Host Alpha-Synuclein Influences Fibril Pathogenicity. Cell Reports. 16, 3373-3387 (2016).
- Paumier, K. L., et al. Intrastriatal injection of pre-formed mouse alpha-synuclein fibrils into rats triggers alpha-synuclein pathology and bilateral nigrostriatal degeneration. Neurobiology of Disease. 82, 185-199 (2015).
- Abdelmotilib, H., et al. alpha-Synuclein fibril-induced inclusion spread in rats and mice correlates with dopaminergic Neurodegeneration. Neurobiology of Disease. 105, 84-98 (2017).
- Duffy, M. F., et al. Lewy body-like alpha-synuclein inclusions trigger reactive microgliosis prior to nigral degeneration. Journal of Neuroinflammation. 15, 129 (2018).
- Duffy, M. F., et al. Quality Over Quantity: Advantages of Using Alpha-Synuclein Preformed Fibril Triggered Synucleinopathy to Model Idiopathic Parkinson's Disease. Frontiers in Neuroscience. 12, 621 (2018).
- Luk, K. C., et al. Exogenous alpha-synuclein fibrils seed the formation of Lewy body-like intracellular inclusions in cultured cells. Proceedings of the National Academy of Sciences of the United States of America. 106, 20051-20056 (2009).
- Volpicelli-Daley, L. A., et al. Exogenous alpha-synuclein fibrils induce Lewy body pathology leading to synaptic dysfunction and neuron death. Neuron. 72, 57-71 (2011).
- Volpicelli-Daley, L. A., Luk, K. C., Lee, V. M. Addition of exogenous alpha-synuclein preformed fibrils to primary neuronal cultures to seed recruitment of endogenous alpha-synuclein to Lewy body and Lewy neurite-like aggregates. Nature Protocols. 9, 2135-2146 (2014).
- Kuusisto, E., Salminen, A., Alafuzoff, I. Ubiquitin-binding protein p62 is present in neuronal and glial inclusions in human tauopathies and synucleinopathies. Neuroreport. 12, 2085-2090 (2001).
- Neumann, M., et al. Misfolded proteinase K-resistant hyperphosphorylated alpha-synuclein in aged transgenic mice with locomotor deterioration and in human alpha-synucleinopathies. The Journal of Clinical Investigation. 110, 1429-1439 (2002).
- Li, J. Y., et al. Characterization of Lewy body pathology in 12- and 16-year-old intrastriatal mesencephalic grafts surviving in a patient with Parkinson's disease. Movement disorders : official journal of the Movement Disorder Society. 25, 1091-1096 (2010).
- Shimozawa, A., et al. Propagation of pathological alpha-synuclein in marmoset brain. Acta Neuropathologica Communications. 5, 12 (2017).
- Polinski, N. K., et al. Best Practices for Generating and Using Alpha-Synuclein Pre-Formed Fibrils to Model Parkinson's Disease in Rodents. Journal of Parkinson's Disease. 8, 303-322 (2018).
- Fares, M. B., et al. Induction of de novo alpha-synuclein fibrillization in a neuronal model for Parkinson's disease. Proceedings of the National Academy of Sciences of the United States of America. 113, 912-921 (2016).
- Fenyi, A., Coens, A., Bellande, T., Melki, R., Bousset, L. Assessment of the efficacy of different procedures that remove and disassemble alpha-synuclein, tau and A-beta fibrils from laboratory material and surfaces. Scientific Reports. 8, 10788 (2018).
- Geiger, B. M., Frank, L. E., Caldera-Siu, A. D., Pothos, E. N. Survivable stereotaxic surgery in rodents. Journal of Visualized Experiments. , (2008).
- Tarutani, A., et al. The Effect of Fragmented Pathogenic alpha-Synuclein Seeds on Prion-like Propagation. Journal of Biological Chemistry. 291, 18675-18688 (2016).
- Wall, N. R., De La Parra, M., Callaway, E. M., Kreitzer, A. C. Differential innervation of direct- and indirect-pathway striatal projection neurons. Neuron. 79, 347-360 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved