Method Article
Generation von Alpha-Synuclein vorgeformten Fibrillen aus Monomers und Einsatz In Vivo
In diesem Artikel
Zusammenfassung
Das Ziel dieses Artikels ist es, die Schritte zu skizzieren, die für die Herstellung von Fibrillen aus monomem Alpha-Synuclein, anschließende Qualitätskontrolle und die Verwendung der vorgeformten Fibrillen in vivo erforderlich sind.
Zusammenfassung
Die Verwendung des in vivo alpha-synuclein vorgebildeten Fibril-Modells der Synucleinopathie gewinnt an Popularität bei Forschern, die darauf abzielen, die Parkinson-Krankheit Synucleinopathie und nigrostratorische Degeneration zu modellieren. Die Standardisierung der α-syn PFF Generation und in vivo-Anwendung ist entscheidend, um eine konsistente, robuste α-syn Pathologie zu gewährleisten. Hier stellen wir ein detailliertes Protokoll zur Erzeugung von Fibrillen aus monomerischem α-syn vor, nach der Fibrilisierung Qualitätskontrolle, und schlagen Parameter für eine erfolgreiche neurochirurgische Injektion von α-syn PFFs in Ratten oder Mäuse vor. Beginnend mit der monomeren α-syn erfolgt die Fibrilisierung über eine 7-tägige Inkubationszeit, während sie bei optimalen Pufferbedingungen, Konzentration und Temperatur schüttelt. Die Qualitätskontrolle nach der Fibrilisierung wird durch das Vorhandensein von pelletablen Fibrillen durch Sedimentationsuntersucht, die Bildung von Amyloid-Konformation in den Fibrillen mit einem Thioflavin-T-Test und die elektronenmikroskopische Visualisierung der Fibrillen bewertet. Während eine erfolgreiche Validierung mit diesen Assays für den Erfolg notwendig ist, reichen sie nicht aus, um zu garantieren, dass PFFs α-syn-Einschlüsse in Neuronen abbauen, da eine solche Aggregataktivität jeder PFF-Serie in der Zellkultur oder in Pilottierkohorten getestet werden sollte. Vor der Anwendung müssen PFFs unter exakt standardisierten Bedingungen sonicated werden, gefolgt von einer Untersuchung mittels Elektronenmikroskopie oder dynamischer Lichtstreuung zur Bestätigung von Faserlängen, die sich in einem optimalen Größenbereich mit einer durchschnittlichen Länge von 50 nm befinden. PFFs können dann in Zellkulturmedien aufgenommen oder bei Tieren verwendet werden. Die Pathologie, die durch Immunfärbung für phosphorylierte α-syn (psyn; serine 129) nachweisbar ist, ist Tage oder Wochen später in der Zellkultur bzw. in Nagetiermodellen erkennbar.
Einleitung
Die Parkinson-Krankheit (PD) ist in erster Linie durch zwei wichtige pathologische Merkmale gekennzeichnet: Die weit verbreitete und fortschreitende Alpha-Synuclein-Pathologie (α-syn) und die nigrostriatale Degeneration. Nach der Injektion in Wildtier-Mäuse oder Ratten führen α-syn vorgeformte Fibrillen (PFFs) zu einer fortschreitenden Anhäufung von pathologischen α-syn, die zu einer langwierigen Degeneration von substantia nigra pars compacta (SNpc) Dopamin-Neuronen im Laufe vieler Monate, sowie sensorimotorische Defizite1,2,3, 4, 5,6. Neuronen sind α-syn Fibrils ausgesetzt, entweder über direkte intrazerebrale Injektion oder in die Medien kultivierter Neuronen. Wenn die PFFs in die Neuronen aufgenommen werden, wirken die PFFs, um die Bildung von Einschlüssen durch Templation und Ansammlung von endogenen α-syn in phosphorylierte Einschlüsse 1,7, 8 zu"sägen," 9. September Die Inklusion hat ähnliche Eigenschaften wie Lewy-Körper: Das Enthalten von α-syn Phosphorylierung bei Serine 129 (pSyn), Ubiquitin und p62; besitzen amyloide Quarzstrukturen, wie sie bei der positiven Thioflavin-Färbung gezeigt werden; Und sind resistent gegen ProteinaseK Verdauung 1,3, 5,7, 8, 9, 10,11, 12. Die PFR-Exposition führt zu einer α-syn-Inklusionsbildung in primären und einigen verewigten Neuronen in der Kultur,sowie von Mäusen, Ratten und nicht-menschlichen Primaten in vivo1,2,3,4, 5,6,7,8, 9,13. Es ist wichtig zu beachten, dass PFFs nicht zu α-syn-Inklusionsbildung in allen Zellkulturmodellen führen werden und einige kultivierte Neuronen besser säen als andere.
Ein weiteres wichtiges Merkmal des in vivo α-syn PFF Modells sind die unterschiedlichen sequenziellen pathologischen Phasen, die über mehrere Monate hinweg auftreten. Bei Nagetieren, die nach einer intrastriatalen Injektion folgen, erreicht die α-syn-Inklusionsbildung in der Regel innerhalb der SNpc und vieler kortikaler Regionen innerhalb von 1-2 Monaten. Auf diese Aggregationshöhepitze folgt eine nigrostriatale Degeneration, die 2-4 Monate später1,3,5. Diese unterschiedlichen pathologischen Stadien bieten den Forschern die Plattform, mit der sie Strategien untersuchen und entwickeln können, die 1) die α-Syn-Aggregation verringern, 2) klare, bereits gebildete α-Syn-Einschlüsse, and/oder 3) eine nachfolgende Neurodegeneration verhindern. Das PFF-Modell bietet deutliche Vor-und Nachteile im Vergleich zu neurotoxicanten, transgenen und viralen Vektorvermittelungsmodellen, die α-syn überexpression sind, wie zuvor überprüft6. Die Wahl, welches Modell oder welcher Ansatz gewählt werden soll, sollte nach welchem Modell am besten zu der Frage passen, die die Ermittler stellen.
Obwohl das PFF-Modell von vielen Labors erfolgreich genutzt wurde, gibt es immer noch Gruppen, die Ungereimtheiten bei der Erzeugung von Fibrillen und der Herstellung einer konsistenten α-Syn Pathologie erlebt haben 14. Beispiele für Ungereimtheiten reichen von PFFs, die wenig oder gar keine α-Syn-Pathologie produzieren, bis hin zur Stapelsaat-Effizienz und sogar von der Formbildung von Fibrillen. Daher ist die Standardisierung der α-syn PFF Generation und in vivo-Anwendung entscheidend, um genaue Interpretationen der Auswirkungen neuartiger therapeutischer Interventionen zu ermöglichen. Das folgende Protokoll skizziert die Schritte, die für die Generierung von PFFs aus α-syn-Monomeren, die In-vitro-Qualitätskontrolle der einmal gebildeten PFFs, die Sonisierung und Messung der PFFs vor der Verwendung, und Vorschläge, um erfolgreiche in vivo Injektion von zu erleichtern PFFs in Ratten oder Mäuse.
Protokoll
Alle Methoden, bei denen es um Tiere geht, wurden vom Institutional Animal Care and Use Committee der Michigan State University (IACUC) genehmigt.
1. Bildung von α-Synuclein vorgeformten Fibrillen aus Monomeren (Abbildung 1)
- Tauwetter α-Synuclein-Monomere auf Eis, sanft wieder aufleben, indem Sie das Rohr flecken, und Zentrifuge bei 15.000 x g für 10 min bei 4 ° C.
NOTE: Der α-syn Monomer muss speziell für die Fibrilisierung formuliert werden. Rekombinante Monomere können aus kommerziellen Quellen erworben oder durch Protokolle auf der Website4,9,14,15generiert werden. Wenn das Produkt aus kommerziellen Quellen gekauft wird, muss es angeben, dass der α-syn Monomer speziell für die Erzeugung von Fibrillen bestimmt ist. Unabhängig davon, ob die Monomere vor Ort gekauft oder generiert werden, sollten die unten beschriebenen Qualitätskontrollschritte mit jeder Charge durchgeführt werden, um sicherzustellen, dass sich Fibrillen gebildet haben und vor der Verwendung in Experimenten effizient Samen. - Übertragen Sie supernatant auf ein sauberes 1,5 ml Mikrozentrifugenrohr und notieren Sie die übertragene Menge.
Hinweis: Achten Sie darauf, das Pellet zu meiden, das, wenn vorhanden, klein sein wird. - Messen Sie die Proteinkonzentration des übertragenen Supernatants entweder mit einem Standard-Bicinchoninsäure-Test (BCA) oder messen Sie die Absorbierung mit einem Mikrovolumenspektrophotometer bei 280 nm.
Hinweis: Der BCA-Test ist nicht so genau für die spezifische Messung von α-syn und kann zu Ergebnissen führen, die die Proteinkonzentration überschätzen. Daher ist die Messung der Absorbierung mit 280 nm die empfohlene Methode zur Bestimmung der Proteinkonzentration.- Um mit dem BCA-Test zu messen, folgen Sie den Standard-BCA-Protokollen und führen Sie mit drei verschiedenen Verdünnungen von α-syn Monomer aus. Die empfohlenen Verdünnungen sind 1:25, 1:50 und 1:100.
- Um mit der A280-Methode zu messen, blanken Sie den Leser mit sterilen 1x Dulbeccos Phosphat-gepufferten Saline (dPBS) ohne Kalzium und Magnesium, mit einer Salzkonzentration von ca. 100 mM NaCl und pH-Bereich 7,0-7.3 (Materialtisch).
- Fügen Sie dem Leser 2 μL Probe hinzu und lesen Sie die Absorbierung bei 280 nm.
- Verwenden Sie das Beer-Lambert-Gesetz, um die Konzentration der Monomere zu bestimmen.

Hinweis: Aussterbchenkoeffizient für die menschliche α-syn ist 5,960 M-1cm-1 und für die Maus α-syn 7,450 M1cm- 1. Die Pathlänge wird in cm gemessen. Das Molekulare Gewicht von α-syn (14 kDa) wird unter der Annahme 1 Da = 1 g/mol geschätzt.
- Die Monomere mit 1x dPBS auf eine Endkonzentration von 5 mg/mL verdünnen. Verwenden Sie die unten stehende Gleichung, um die Menge von 1x dPBS zu berechnen, die hinzugefügt wird, um die Monomere zu verdünnen.

Hinweis: Alle Konzentrationen sind in mg/mL, und Volumina in μL. Monomer-Verdünnungen sollten mit 1x dPBS durchgeführt werden. Das Gesamtvolumen, das für die Herstellung von Fibrillen verwendet wird, sollte zwischen 100 und 500 μL liegen, um reproduzierbare Fibrilisierungsergebnisse zu erzielen. - Kurz Wirbel mischen, und Zentrifuge, um alle Flüssigkeit am Boden der Röhre zu sammeln. Aliquot-Monomere für den Qualitätskontrollvergleich mit Fibrillen, wie sie in Schritten 1.8.1-1.8.4 angegeben sind.
- Verwenden Sie ein Schlauchschloss oder eine Wachs/Kunststofffolie (Materialtafel), um den Mikrozentrifugenrohrdeckel zu sichern.
- Legen Sie die Röhre in einen orbitalen Thermomixer mit einem Deckel für 7 Tage bei 37 ° C, schüttelt bei 1.000 U/min (Tabelle der Materialien).
Hinweis: Am Ende der 7 Tage sollte der Inhalt der Röhre trüben erscheinen. Der Thermomixer muss einen Deckel haben, um Kondensationsbildung an den Rohrdeckeln zu verhindern. - Die Röhre sanft umkippten, um die α-syn Fibrils wieder zu beleben. Aliquiot-Fibrillen für die folgenden Qualitätssicherungsschritte, wie sie in Schritten 1.8.1-1.8.4 angegeben sind.
Hinweis: Fibrillen für Qualitätssicherungsschritte können über Nacht bei RT gelagert werden.- Aliquot 6 μL für den SedimentationAssay.
- Aliquot 5 μL für den thioflavin T Bindungsuntergang.
- Aliquot 2 μL für die Transmissionselektronenmikroskopie zur Fibril-Visualisierung.
- Aliquot mindestens 10 μL für den Endotoxin-Test.
Hinweis: Für Endotoxin-Antengang wird nach Herstellerangaben (Materialtabelle) ein kommerzieller Limulus Amebocyte Lysate (LAL) verwendet. Die Endotoxin-Werte sollten für die Fibrillen bei 0,5 Endotoxin units/mL liegen. Ein Endotoxin-Entfernungs-Kit kann verwendet werden, wenn dieses Kriterium nicht erfüllt ist.
- Aliquot die restlichen Fibrillen und Speicher. Für die Langzeitlagerung (12-18 Monate), schnell auf Trockeneis einfrieren und bei-80 ° C aufbewahren.
Hinweis: Der Betrag für Aliquot hängt von der gewünschten nachgelagerten Anwendung ab. In vivo benötigt der Einsatz in der Regel mehr Fibrillen in höheren Konzentrationen als in vitro, und Aliquot-Mengen sollten entsprechend geplant werden. Die Fregale sollten auf der Rückseite des Gefriergerätes gelagert werden, um Schäden durch potentielle Gefrier-/Tauwetter zu verhindern. Das Protokoll kann hier pausiert werden.
2. Sedimentationstest
- In einem sauberen Mikrozentrifugenrohr, fügen Sie 6 μL von PFF auf 54 μL von dPBS, um Fibrillen 1:10 zu verdünnen, und Pipet zu mischen.
- In einem separaten Rohr 6 μL Monomer auf 54 μL dPBS als zusätzliche Steuerung hinzufügen.
- Zentrifugenproben mit 10.000 x g für 30 min bei RT und übertragen das Supernatant in ein sauberes Mikrozentrifugenrohr.
- Fügen Sie 60 μL dPBS in das restliche Pellet und den Wirbel ein, um sie wieder zu verteilen.
- Fügen Sie jedem Rohr und Wirbel 30 μL von 3x-Probenpuffer (140 μL von 50% Glycerol/0,1% Bromophenol blau, 40 μL von 10% SDS und 20 μL von β-Mercaptoethanol) zu jedem Rohr und Wirbel hinzu, um sie zu mischen.
- Proben bei 100 ° C für 10 min einbauen und 5 Minuten auf Eis abkühlen lassen.
- Verwenden Sie ein Standard-Natriumdodeyl-Sulfat-Polyacrylamid-Gel-Elektrophorese (SDS-PAGE), um Eiweiß nach Masse zu trennen. Verwenden Sie eine Proteinleiter mit einem Bereich, der 14 kDa (das Größe Band für monomere α-syn erwartet).
- Das Gel in eine Färbeschale geben und das Gel mit Coomassie blauer Flecken bedecken (0,1% Coomassie brillantes Blau, 20% Methanol nach Volumen und 10% Essigsäure nach Volumen in ddH2 O). Inkubieren Sie 3 Stunden bei RT beim Schütteln.
- Den Coomassie-blauen Fleck abgießen und genügend Entfleck (50% Methanol nach Volumen und 10% Essigsäure nach Volumen in ddH2 O)hinzufügen, um das Gel zu bedecken. Inkubieren Sie 30 Minuten bei RT beim Schütteln.
- Abgießen Sie destain und wiederholen Sie den Ablagerschritt, bis das Gel klar ist und Bänder sichtbar sind.
- Waschen Sie das Gel 3 mal für je 5 min, indem Sie in ddH2O schütteln und das Gel abbilden.
3. Getrieberekonen-Mikroskopie zur Fibril-Visualisierung
- 20 mg Haranyl-Acetat in einem mikrozentrifugen Rohr wiegen und 1 mL ddH2 O hinzufügen, um eine 2% wässrige Lösung zu machen. Wirbel, bis das Uranyl-Acetat in Lösung ist, und über Nacht sitzen lassen.
Hinweis: Uranylacetat sollte am Tag vor der Vorbereitung von Proben für die Transmissionselektronenmikroskopie hergestellt werden. Die Licht-oder Agitation kann dazu führen, dass das Uranyl-Acetat ausfällt, da das Rohr, das die Urankl-Acetatlösung enthält, mit Aluminiumfolie bedeckt sein sollte, an einem dunklen Ort aufbewahrt wird und nicht geschüttelt wird, nachdem das Uranyl-Acetat in Lösung ist. - Fügen Sie 2 μL von PFF bis 98 μL von dPBS hinzu, um Fibrillen 1:50 zu verdünnen, und dann pipet zu mischen.
- Bereiten Sie eine saubere Wachs/Kunststofffolie (Materialliste) auf der Sitzbank vor. Auf der sauberen Wax/Plastikfolie (Materialtabelle) wird folgendes hinzugefügt (Abbildung 2).
- Fügen Sie 4 x 10 μL Tropfen von ddH2 O.
- 1 x 10 μL Tropfen verdünnte Fibrillen oder Monomer-Probe hinzufügen.
- 2 x 10 μL Tropfen von 2% Uranyl-Acetat hinzufügen.
- Verwenden Sie fein gekippte Zangen, um ein formvar/Carbon beschichtetes, gezahnte Kupfer-Transmissionselektronenmikroskopie-Gitter (Materialliste) aufzunehmen.
Hinweis: Achten Sie darauf, das Gitter nur am Rand zu nehmen und so den Netzteil in der Mitte zu vermeiden (Abbildung2A). Wenn die Zange das Netz berühren, wird die formvar/carbon beschichtete Folie beschädigt, was eine Bildgebung in diesem Bereich des Gitters unmöglich macht. - Schwimmen Sie die Gitterformvar/Carbon-Blickseite (glänzende Seite) auf den ersten TropfenvonddH 2 O. Lassen Sie das Gitter für 1 Minute schweben.
- Nehmen Sie das Gitter auf, und ohne den Netzteil des Gitters zu berühren, wickeln Sie das ddH2 O mitFilterpapier weg.
- Schweben Sie das Gitter wie oben auf dem zweiten Tropfen von ddH2 O für1 min und wickeln Sie die ddH2 O.
- Schweben Sie das Gitter auf dem Tropfen der verdünnten Fibrillen für 1 Minute und docken Sie den Überschuss wie oben.
- Schwimmen Sie das Gitter auf dem ersten Tropfen Uranyl Acetat für 1 Minute und wickeln Sie den Überschuss weg.
- Schwimmen Sie das Gitter auf dem zweiten Tropfen Uranyl Acetat für 1 Minute, Docht weg den Überschuss.
- Schweben Sie das Gitter wie oben auf dem dritten Tropfen von ddH2 O kurzund wickeln Sie die ddH2 O.
- Schweben Sie das Gitter wie oben auf dem vierten Tropfen von ddH2 O kurzund wickeln Sie die ddH2 O weg, wobei sicher, so viel ddH2 O wiemöglich zu entfernen.
- Überführung in eine Gitterbox zur Lagerung bis zur Bildgebung.
Achtung: Die Gitter sollten mindestens 5 Minuten trocknen, bevor sie abgebildet werden. Gitter können mindestens ein Jahr nach der Vorbereitung abgebildet werden und sollten in einer trockenen Umgebung gehalten werden.
4. Thioflavin T assay
- In einem sauberen Mikrozentrifugenrohr, fügen Sie 5 μL PFF auf 245 μL dPBS, um Fibrillen 1:50 zu verdünnen, und pipet zu mischen.
- 250 μL dPBS in ein separates Mikrozentrifugenrohr geben, um als Negativsteuerung zu dienen.
- Fügen Sie 5 μL Monomer zu 245 μL dPBS hinzu, um als Monomersteuerung zu dienen.
- 250 μL Thioflavin T in den Glycin-Puffer (25 μM Thioflavin T, 100 mM Glycin, 1% Triton X-100, pH 8.5) zu jeder Probe geben und vorsichtig mischen.
- Pipet 2 Replikate, je 200 μL, in eine schwarze 96-Brunnenplatte. Halten Sie die Platte in der Dunkelheit, um die Photobleaching zu verhindern.
- Inkubieren Sie für 1 h bei RT und lesen Sie die Platte mit einer Anregung von 450 nm und einer Emission von 510 nm.
NOTE: Thioflavin T Messwerte werden im Laufe der Zeit schwanken. Proben sollten zur gleichen Inkubationszeit gelesen werden. Auf Wunsch können während der Stundeninkubation mehrere Messwerte durchgeführt und im Laufe der Zeit gezeichnet werden.
5. Sonikerung von α-Synuclein vorgeformten Fibrillen
CAUTION: Der Soundator und alle Schalldämpfer werden in einer Kulturhaube durchgeführt, um eine Exposition gegenüber Fibrillen zu verhindern, die während der Sonisierung aufferosieren können. Das Personal, das die Schalldritter durchführt, sollte beim Klangladen persönliche Schutzausrüstung tragen, darunter Handschuhe, Kleiderschutz in Form eines Labormantels und ein Gesichtsschild. Das Risiko einer Fibril-Exposition kann durch die Sonisierung mit einem Becher-Horn-Konicator reduziert werden, so dass das Schlauch, das Fibrillen enthält, während der Schalldämmung geschlossen bleibt.
Hinweis: Optimale Schallbildungsparameter von Fibrillen sind abhängig vom Modell des verwendeten Schallzaubers. Aus diesem Grund müssen einige Optimierungen durchgeführt werden, um sicherzustellen, dass Fibrillen die richtige Größe haben. Der verwendete Schallkörper ist in der Materialtabelle zu finden und die skizzierten Parameter basieren auf den bisherigen Ergebnissen dieses Modells des Schallzägers. Die folgenden Parameter funktionieren für 2-4 μg/μL von PFFs in 200-400 μL Lösung. Die Testsonisierung mit dem Instrument sollte durchgeführt und Fibrils analysiert werden, um sicherzustellen, dass die gewünschten Ergebnisse vor dem Einsatz von PFFs in Experimenten erzielt werden.
- Befestigen Sie eine Sonde miteinem Durchmesser von 3,2 mm am Konverter und setzen Sie die Schalldämpfer, wie unten in Schritt 5.1.1-5.1.3 angegeben.
- Die Amplitude auf 30% einstellen.
- Setzen Sie den Puls auf 01 01 (1 s auf; 1 s aus).
- Setzen Sie die Zeit auf 0:01:00.
Hinweis: 1 Minute Pulsierung entspricht 60 Impulsen, und dieses Modell des Soundators (Tabelle der Materialien) wird automatisch gestoppt. Bei anderen Schalliger-Modellen wird die Anzahl der Pulse gezählt werden müssen.
- Tauen Sie Fibrillen bei RT und verdünnen Sie mit sterilen dPBS in einer kulturellen Haube.
Hinweis: Eine klare 0,6 mL Mikrozentrifugenröhre eignet sich am besten für die Sonication und die endgültige Fibrilkonzentration hängt von der beabsichtigten Verwendung ab. Die gezeigten Ergebnisse stammen aus einer Endfibril-Konzentration von 4 μg/μL. - Die Sonde des Schallzägers mit einem Laborgewebe dämpfen mit 70% Ethanol abwischen, um die Sonde zu reinigen. Die Spitze der Sonde in ddH 2 O eintauchen und 10 Mal pulsieren, um die Sondeweiterzu reinigen, und dann mit einem Laborgewebe trocknen.
- Die Sondenspitze in das Rohr der verdünnten Fibrillen legen und die Spitze am Boden des Rohres positionieren.
- Sonicate für 60 Pulse (1 s on; 1 s off). Bewegen Sie die Sonde während eines Pulses nach oben und unten, um sicherzustellen, dass alle Fibrillen in der Flüssigkeit sonicated sind. Und sauber.
- Nach 60 Impulsen die Sonde aus den PFFs entfernen und 2 μL PFF auf 98 μL von dPBS in einem sauberen Mikrozentrifugenrohr hinzufügen, um Fibrillen 1:50 für die klangliche Fibril-Messung durch Elektronenmikroskopie zu verdünnen.
Hinweis: Idealerweise sollte vor der Vivo-Injektion eine kleine Untermenge von Fibrillen und eine umfassendere Messung von Fibrillen gemessen werden, wenn es die Zeit erlaubt. - Nach der Schalldauflage kurz Zentrifuge PFFs für 1 s bei 2.000 x g, um alle Flüssigkeit von den Seiten der Röhre zu sammeln.
CAUTION: Wenn das Rohr heiß wird, stoppen Sie die Sonisierung nach 30 Pulsen, warten Sie 1 min, und klanglich auf die letzten 30 Pulse.
Hinweis: Während der Sondierung, halten Sie die Sondenspitze nach unten der Flüssigkeit zu Beginn eines jeden Pulses, zu nah an der Oberseite der Flüssigkeit wird Probenverlust verursachen. - Die Sondenspitze in 1% SDS tauchen und 10 Mal pulsieren, um die Sonde zu reinigen. Entfernen Sie die Spitze aus den SDS, tauchen Sie in ddH2 O undPuls 10 Mal.
- Die Sonde mit einem mit 70% Ethanol gedämpften Laborgewebe abwischen und dann mit einem trockenen Laborgewebe abwischen. Die Sonde vom Konverter lösen und speichern.
- Alle Oberflächen in der Haube mit 1% SDS abwischen, gefolgt von 70% Ethanol.
Hinweis: Die 1% SDS-Lösung wird verwendet, um Fasern zu trennen und Oberflächen und Geräte16 zureinigen.
6. Transmissionselektronenmikroskopie zur Messung von klangierten Fibrillen
Hinweis: Ist eine Elektronenmikroskopie nicht machbar, kann ein Thioflavin-T-Kinetics-Test und eine dynamische Lichtstreuung als indirekte Maßnahmen der Aussaateffizienz und der Fibrilgröße4,14eingesetztwerden.
- Bereiten Sie Proben mit dem Protokoll aus dem Abschnitt "Elektronenmikroskopie zur Fibril-Visualisierung" vor.
- Verwenden Sie ein Transmissionselektronenmikroskop, um ein Bild von Fibrillen von 6 bis 10 verschiedenen Gitteröffnungen zu nehmen.
Hinweis: Bilder sollten eine ausreichend hohe Vergrößerung sein, um Fibrillen zu messen, aber niedrig genug, um mehrere Fibrillen gleichzeitig zu visualisieren. Eine endgültige Vergrößerung von ca. 75.000 x sollte ausreichen. - Messen Sie die Länge einer kleinen Untermenge von mindestens 25 Fibrillen, bevor Sie Fibrillen in einem Experiment verwenden.
Hinweis: Diese Messungen können typischerweise mit der mit dem Mikroskop verbundenen Bildbearbeitungssoftware durchgeführt werden. Für die schnelle Validierung sollte die Messung der Person repräsentative Fibrillen auswählen und die durchschnittliche Größe berechnen. Die Fibril-Länge sollte im Durchschnitt etwa 50 nm oder weniger sein, wobei eine genauere Messung folgen sollte. - Messen Sie die Längen von + 500 Fibrillen für umfassendere Ergebnisse.
Hinweis: Die mit dem Mikroskop verbundene Bildgebungssoftware kann für Fibril-Messungen verwendet werden. Alternativ können Bilder geöffnet und Fibrillen mit Bildbearbeitungssoftware gemessen werden, wobei die Skalenleiste, die mit jedem Bild verbunden ist, als Größenreferenz verwendet wird, mit der man die Fibrillängen vergleichen kann.
7. Zubereitung von speziellen Glasnadelspritzen für stereotaktische Injektionen (Abbildung 3)
- Etwa 10 ml Silikonreagenz (Materialtabelle) zu einem sauberen 50 mL-Becher geben.
- Die Glaskapillarrohre (Länge 54 mm; Außendurchmesser: 0,86 mm; Innendurchmesser 0,59 mm) senkrecht in den Becher des Silikonreagenzes legen und die Kapillarwirkung erlauben, das Silikon-Reagenz durch die untere Rohröffnung, die in die Silikonisieren Reagenz.
- Zusätzliches Silikonreagenz in die obere Röhrenöffnung piptieren, das nicht in Silikonreagenz untergetaucht ist, um das Glaskapillarrohr vollständig zu füllen.
- Entfernen Sie die Kapillarrohre aus dem Silikonreagenz und bellen Sie die offenen Enden der Rohre auf ein Papiertuch, um Silikon-Reagenz in den Rohren zu entfernen. Kapillarrohre mindestens 8 Stunden trocknen lassen.
- Legen Sie einen silikonisierten Kapillarrohr in einen Glasnadelzieher (Materialtisch).
- Schalten Sie das Heizelement ein und lassen Sie die angeschlossenen Gewichte das beheizte Glaskapillarrohr dehnen.
- Schneiden Sie das gezogene Glaskapillarrohr mit einer Schere an der dünnsten Stelle in der Mitte und entfernen Sie die Glasnadel aus dem Glasnadelzieher.
Hinweis: Der gezogene Nadelinnen-und Außendurchmesser sollte etwa 80 bzw. 100 μm betragen. Mehrere Glasnadeln können auf einmal hergestellt und gelagert werden, bis sie bereit sind, an einer Glasspritze mit angehängter Metallnadel (Materialtabelle) befestigt zu werden. - Schneiden Sie die Länge der Schrumpfwickelschläuche (durchschnittlicher Innendurchmesser 0,21 "und durchschnittliche Wanddicke 0,001") auf ca. 40 mm mit einer Schere. Schieben Sie die Schrumpffolie über die Metallnadel einer 10 μL abgeschrägten Spritze (Materialtabelle).
- Verwenden Sie eine offene Flamme, um die Schrumpffolie zu erhitzen und an der Nadel zu kleben, während Sie die Nadel drehen, um die Wärme gleichmäßig aufzutragen.
- Das größere Ende der gezogenen Glasnadel vorsichtig über die Metallnadel der Spritze gleiten.
- Schneiden Sie die Länge der Schrumpfwickelschläuche (durchschnittlicher Innendurchmesser 0,36 "und durchschnittliche Wanddicke 0,005") auf ca. 40 mm mit einer Schere und gleiten Sie vorsichtig über die Glasnadel, um die Basis der Glasnadel und die Metallnadel der Spritze zu überlagern (Tabelle der Materialien). Verwenden Sie eine offene Flamme, um die Schrumpffolie zu erhitzen, um die Glasnadel an der Metallnadel zu befestigen.
- Fügen Sie eine zusätzliche Schicht Schrumpffolie hinzu, um die Glasnadel zu sichern. Schneiden Sie die Länge der Schrumpfwickelschläuche (durchschnittlicher Innendurchmesser 0,44 "und durchschnittliche Wanddicke 0,005") auf ca. 40 mm mit einer Schere und gleiten Sie vorsichtig über die Glasnadel, um die Basis der Glasnadel und die Metallnadel der Spritze zu überlagern (Tabelle der Materialien). Verwenden Sie eine offene Flamme, um die Schrumpffolie zu erhitzen, um die Glasnadel an der Metallnadel zu befestigen.
- Die Glasnadel mit einer Schere bestreuen, so dass die Spitze ca. 8 mm lang ist.
Hinweis: Die Nadel muss lang genug sein, um die gewünschten Hirnregionen anzuvisieren (die benötigte Länge ist abhängig von den dorsal/ventralen Koordinaten). - Verwenden Sie Schritte 7.14.1-7.14.3, um die Nadel zu testen, um sicherzustellen, dass es keine Lecks und es gibt einen ausreichenden Fluss sowohl beim Abziehen als auch beim Abgeben von Flüssigkeit aus der Glasnadel.
- Füllen Sie eine 1 mL-Spritze mit einer angehängten 26 Spurennadel mit dH2 O.
- Entfernen Sie den Metallkolben aus der angepassten Glasnadelspritze und legen Sie die Nadel der dH2O gefüllten Spritze in die Unterseite der Spritze. Wenden Sie Druck auf dH2 O ausder Glasnadel. Überprüfen Sie die Schnittstelle der Glasnadel und der Metallnadel auf Lecks und bestätigen Sie einen gleichmäßigen dH2O-Flow.
Hinweis: Bei Bedarf kann die Glasnadel getrimmt werden, um die Strömungsfreundlichkeit zu erhöhen, und zusätzliche Schrumpfschichten, die hinzugefügt werden, um alle Lecks von der Basis der Glasnadel zu flicken. - Füllen Sie ein mikrozentrifuge Rohr mit dH2O. Verwenden Sie die benutzerdefinierte Glasnadelspritze, um in die dH2 O zuziehen. Inspizieren Sie die Nadel, um die Flüssigkeit zu bestätigen, wird in die Spritze aufgenommen und dass es keine Blasen.
Achtung: Wenn es Blasen gibt oder dH 2 Onichtin die Nadel gezogen wird, kann das Schneiden der Nadel helfen, den Druck zu verringern.
- Spritze mit angehängten Glasnadeln vorsichtig in den Spritzenboxen aufbewahren, bis sie für Operationen benötigt werden.
- Verwenden Sie Standard-Maststereotax-Chirurgie-Methoden für die intrastriatale Lieferung von PFFs bei optimierten Koordinaten bei Mäusen (eine Website: AP + 0,2 mm und ML + 2,0 mm von bregma, DV-2,6 mm von dura) oder in Ratten (zwei Standorte: AP + 1,6 mm und ML + 2,0 mm von bregma, DV-4.0 von dura; AP + 0,1 mm und ML + 4,2 mm von bregma, DV-5.0 von dura)1,14,17.
Hinweis: Diese Koordinaten wurden bei C57BL6/C3H-Mäusen und Fischer 344 Ratten eingesetzt. Bei anderen Stämmen sollten Koordinaten optimiert werden.
Ergebnisse
Die Generation der Fibrillen aus α-syn-Monomeren beginnt mit der Bestimmung der Konzentration der Monomere. Sowohl der BCA-Test als auch die Messung der Absorbierung mit 280 nm (A280) können zur Messung des Proteingehalts verwendet werden; Die BCA-Untersuchungsergebnisse deuteten jedoch auf eine höhere Konzentration als die A280-Methode hin. PFFs, die von der Maus, dem α-syn Monomer, abgeleitet werden, hatten einen BCA-Wert von 14.05 ± 0,22 und einen A280 von 8,05 ± 0,03 μg/μL (Abbildung 1). Ebenso schienen auch PFFs, die von menschlichen α-syn-Monomern abgeleitet wurden, mit einem BCA-Wert von 12,95 ± 0,38 und einem A280 von 7,83 ± 0,05 μg/μL (Abbildung1) zu sein. Die A280-Messungen sind spezifisch für α-syn, basierend auf der Einbeziehung der Aussterbekoeffizienten, und diese Ergebnisse wurden verwendet, um die Monomere vor der 7-tägigen Inkubation zu verdünnen.
Vor der Brutzeit war die Flüssigkeit, die die α-syn-Monomere enthielt, klar, sollte aber nach der Fibrilbildung trüb erscheinen. Die Untersuchung mit der Transmissionselektronenmikroskopie bestätigte das Vorhandensein von langen Fibrillen, die 10-20 nm breit sind (Abbildung 4). Im Vergleich dazu waren die α-syn-Monomere kaum sichtbar, ohne dass eine erkennbare Form erkennbar war (Abbildung4). Mit der visuellen Bestätigung der fibrillaren Strukturen ist die Amyloid-Konformation der Fibrillen das nächste Merkmal von PFFs, die mit einem Thioflavin T-Assay bestätigt werden sollten. Thioflavin T zeigt eine erhöhte Fluoreszenz, wenn sie an Amyloid gebunden ist; So zeigt ein erhöhtes fluoreszierendes Signal aus den Proben das Vorhandensein von Amyloid. Zum Beispiel erzeugte Thioflavin in dPBS ein Signal von 3,287 ± 580 relativen Leuchtstoffanlagen (RFU), Maus-α-syn Monomer erzeugte ein Signal von 4.174 ± 158 RFU, und Maus-PFFs erzeugten ein Signal von 59,754 ± 6,224 RFU (Abbildung5). Im Vergleich dazu erzeugte der menschliche α-syn Monomer ein ähnliches Signal von 4.158 ± 105 RFU zu Mausmonomer, und menschliche PFFs erzeugten ein höheres Signal von 1.235,967 ± 113,747 RFU im Vergleich zu Maus-PFFs (Abbildung5). Um das Vorhandensein von pelletablen Fibrillen zu beurteilen, wurde ein Sedimentations-Test durchgeführt. Fibrillen werden mit Zentrifugation pflügeln. Sowohl bei der Maus als auch bei den PFF-Proben des Menschen sollte der übernatante Anteil mehr Eiweiß im Pellet haben als der Supernatant(Abbildung6). Im Gegensatz dazu war der größte Teil des Proteins aus Maus und menschlichen Monomeren im Supernatant vorhanden, mit wenig vorhanden im Pellet (Abbildung6). Mit den PFFs, die durch die Elektronenmikroskopie sichtbar sind, die Amyloidstrukturen vorhanden sind und die Fibrillen pelletable sind, haben sie alle In-vitro-Qualitätskontrollschritte durchlaufen.
Sowohl die Maus als auch die menschlichen PFFs wurden für die Herstellung von PFFs in entsprechender Länge für die Aussaat von α-syn-Einschlüssen 4,18hergestellt. Die PFFs wurden auf die gewünschte Konzentration von 4 μg/μL und sonicated ausgedünnt. Unmittelbar vor der Operation wurden 25 repräsentative Fibrillen durch die Elektronenmikroskopie abgebildet und gemessen, um die Fibrilgröße zu überprüfen. Die klangvoll gemessene Maus-PFFs wurden 48,8 ± 3,1 nm gemessen, während die menschlichen PFFs 52,1 ± 4,4 nm Länge gemessen haben; PFFs beider Arten waren daher die entsprechende Länge (50 nm oder weniger), um die Saataktivität zu induzieren. Eine umfassendere Untersuchung von etwa 500 Fibrillen ergab die durchschnittliche Längen-und Längenverteilung der sonicated Mausfibrillen. Die durchschnittliche Länge betrug 44,4 ± 0,6 nm, wobei 86,6% der PFFs 60 nm oder weniger groß waren (Abbildung 4). Im Vergleich dazu lagen die menschlichen PFFs im Schnitt bei 55,9 ± 1,1 nm mit 69,6% der PFFs mit 60 nm oder weniger (Abbildung 4).
Nach intrastriataler Injektion von klangierten Maus-PFFs in Ratten, wie zuvor beschrieben 3, 5, wurde eine Reihe von Gewebeabschnitten bei 2 Monaten nach der Operation verarbeitet, wenn die Zahl der Inklusionsenthaling-Neuronen bekanntermaßen in der Die SNpc, für die Bestätigung der phosphorylierten α-syn Einschlüsse5. Inklusionsstoff-Neuronen, wie durch immunhistochemische Färbung für pSyn (Antikörper in Tabelle der Materialien) angegeben sind in der SNpc (Abbildung7), sowie andere Regionen im gesamten Gehirn, die das Striatum (vor olfaktorischer Kern, Motor, Kingulle, Piriform, Vorläu-Bisch, somatosensorische, entorhinale, und isolierte Kortikel, Amygdala, Striatum)1,3,4, 5,19. Diese Einschlüsse haben ähnliche Eigenschaften mit Lewy-Körpern, wie die Bindung von Thioflavin S und die Resistenz von totalem α-syn gegen ProteinaseK(Abbildung 7), wie die immunhistochemische Färbung (Antikörper und Proteinase K in derMaterialtabelle) zeigt. . Die Bestätigung der Aussaat im Gehirn deutet darauf hin, dass die in vivo Qualitätskontrolle bestanden wurde, und Aliquots von PFFs, die zuvor eingefroren und von der gleichen Charge gerettet wurden, können unter identischen Parametern, mit validierter Länge, in größeren Experimenten beschossen werden.

Bild 1 . Methoden zur Erzeugung von α-syn Fibrillen. Skizzieren Sie die Schritte, die für die Herstellung von Fibrillen aus α-syn-Monomeren erforderlich sind. Monomere sind 10 min zentrifugiert (15.000 x g, bei 4 ° C). Supernatant wird auf ein sauberes Rohr übertragen und die Proteinkonzentration wird entweder durch die Absorbierung bei 280 nm oder durch einen BCA-Test bestimmt. Grafik zeigt Konzentrationen von menschlichen und Maus α-syn Monomere. Spalten zeigen die Gruppenmittel an, Fehlenstangen stellen ± 1 Standardfehler des Mittels dar. Nachdem die Proteinkonzentration bestimmt ist, werden die α-syn-Monomere verdünnt, kurz veredelt und für 37 ° C für 7 Tage inkubiert, während sie auf einem Orbitalmischer bei 1.000 U/min schütteln. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Bild 2 . Stapelmethoden für die Transmissionselektronenmikroskopie. Diagramm der negativen Färbung für die Elektronenmikroskopie. A) Bilder, die die Elektronenmikroskopie darstellen. Das Gitter hat eine langweilige oder helle Seite und eine glänzende oder dunkle Seite. Die Schiny/dunkle Seite ist mit einer formvar/Carbon-Stützfolie beschichtet. B) Illustration des Färbeverfahrens. Das Gitter wird auf dem ersten Tropfen von ddH2 O für 1 Minuteschwebt und der Überschuss wird mit Filterpapier weggeschaltet. Der Prozess wird mit dem zweiten Tropfen von ddH2 O,verdünnten PFFs oder Monomeren, zwei Tropfen Uranyl-Acetat und zwei zusätzlichen Tropfen von ddH 2 O.Gitter können in einem Gitterkasten gespeichert werden, bis sie abgebildet sind. Skalierbalken = 3 mm.

Bild 3 . Montage von eigenen Glasnadelspritzen. Diagramm der Stufen, die für die Montage von Glasnadel mit Spritzen erforderlich sind. Silikonkapillarrohre werden in der Mitte gezogen und geschnitten, um Glasnadeln zu erzeugen. Schrumpffolien werden zur Vorbereitung der Metallnadel und zur Bildung einer inneren Dichtung verwendet, wenn die Glasnadel auf die Metallnadel geschoben wird. Zur Sicherung der Glasnadel werden zwei zusätzliche Schrumpfschläuche hinzugefügt, die den Sockel der Glasnadel und die Metallnadel überlappen und Wärme auftragen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
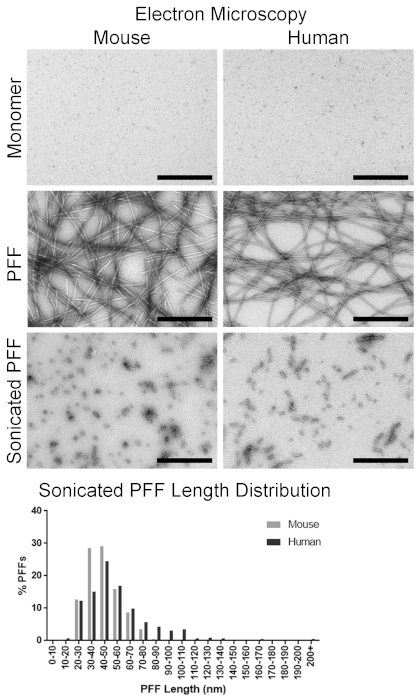
Bild 4 . Visualisierung von α-syn Monomeren und α-syn Fibrillen durch Transmissionselektronenmikroskopie. Repräsentative Mikrographen von α-syn Monomeren und Fibrillen. Top-Panels: Maus und Mensch α-syn Monomer. Mittlere Panels: Volle Länge Maus und menschliche α-syn PFFs. Unten Panels: Maus und menschliche α-syn PFFs nach der Sonisierung. Bottom-Grafik: Verteilung der klangierten Maus und der menschlichen α-syn PFF-Längen. Skalierbalken = 500 nm. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Bild 5 . Bestätigung der Amyloidstrukturen durch thioflavin T Assay. Messung des Fluoreszenzsignals von Maus und menschlichen α-syn Monomer und PFF Proben. Links: Ergebnisse von Mäuse-α-syn Monomeren und α-syn PFFs. Rechts: Ergebnisse von menschlichen α-syn Monomeren und α-syn PFFs. In jedem Diagramm wird eine dPBS-Negativsteuerung angezeigt. Alle Messungen werden als relative Leuchtstoffeinheiten (RFU) ausgedrückt. Spalten zeigen die Gruppenmittel an, Fehlenstangen stellen ± 1 Standardfehler des Mittels dar. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Bild 6 . Sedimentations-Test für pelletable α-syn. Bilder von Coomassie gefärbten Gelen. Die gezeigten Bänder liegen bei etwa 14 kDa auf Basis der Proteinleiter. Links: Mausmonomer und PFFs. Rechts: Menschliche Monomere und PFFs. Für alle Monomer und PFF-Proben werden die wiederbelebten Pellets (P) und supernatant (S) angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
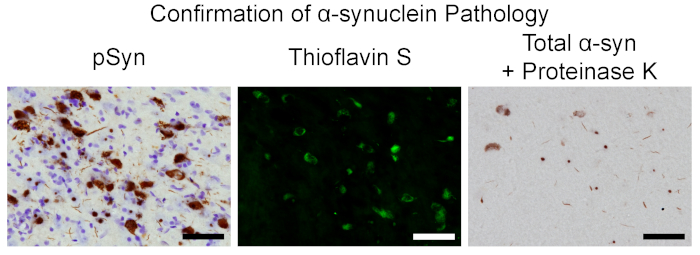
Bild 7 . Merkmale der Einschlüsse im Rattenmodell, das die α-syn Pathologie bestätigt. Repräsentative Mikrographen aus der substantia nigra pars compacta bei 2 Monaten Nachinjektion. Links: Neuronen, die pSyn enthalten und mit Cresylviolett kontrastiert werden. Mitte: Thioflavin S positive Neuronen. Rechts: α-syn-haltige Einschlüsse, die gegen Proteinase K. Scale bar = 50 μm resistent sind.
Diskussion
Die Produktion von α-syn PFFs, die in der Lage sind, Neuronen zu säen und zu Lewy körperähnlichen Einschlüssen zu führen, ist von mehreren Faktoren und Schritten abhängig. Ein entscheidender Faktor ist, dass die Monomere, die zur Herstellung von Fibrillen verwendet werden, speziell für die Fibrilisierung4,9, 14,15formuliertwerden müssen. Wenn die Monomere nicht für die Fibrilisierung formuliert sind, dürfen sich die Fibrillen nicht bilden, oder die Fibrillen, die sich bilden, dürfen keine α-syn-Pathologie erzeugen. Ebenso beeinflusst der Puffer, in dem sich die Monomere befinden, auch die Fibrilisierung. Für die besten Ergebnisse sollte die Salzkonzentration bei etwa 100 mM NaCl und pH zwischen 7,0 und 7,3 liegen. Ein erster Schritt, der eine Variabilität einführt, ist die Methode, bei der der anfängliche Proteingehalt ermittelt wird, wobei die Messung bei A280 wahrscheinlich genauere Ergebnisse liefert und somit die bevorzugte Methode ist. Die Diskrepanz in der Proteinkonzentration kann die Wirksamkeit des Fibrilisierungsprozesses verringern und die in Experimenten verwendete PFF-Konzentration verändern. Beides könnte zu einer Verringerung der Aussaateffizienz und der Chargenvariante zwischen den Experimenten führen.
Erste Qualitätskontrollmaßnahmen bestätigen die kritischen Merkmale der PFFs, insbesondere, dass sie eine fibrilläre Konformation haben (Elektronenmikroskopie), Amyloid-Strukturen (Thioflavin T Assay) enthalten und pektierbar sind (Sedimentations-Assay). Es ist wichtig zu beachten, dass die Ergebnisse des Thioflavin T-Tests mit der Zeit schwanken und nicht direkt gemessen werden, wie viele Amyloidstrukturen vorhanden sind, sondern dass der Thioflavin T-Test nur als Indikator für die Präsenz von Amyloidstrukturen innerhalb verwendet werden sollte. Die Probe. Thioflavin T wird typischerweise in In-vitro-TAssays verwendet, wie zum Beispiel in dem oben erwähnten Test, um zu zeigen, dass die Fibrils Amyloid-Strukturen enthalten. Alternativ wird Thioflavin S im Gewebe verwendet, um Amyloidstrukturen zu erkennen, wie in Abbildung7 gezeigt. Was den Sedimentationsuntersuchungen betrifft, so zeigen die Ergebnisse nur, dass die PFFs überwiegend im pelletablen Bruchteil zu finden sind. Da die Proben unter Denaturierungsbedingungen laufen, ist auf den Gelen ein einziges markantes Band von etwa 14 kDa, die Größe der α-syn-Monomere, vorhanden. Dies ist im Gegensatz zu den verschiedenen Bändern, die bei höheren molekularen Gewichten vorhanden sind, die mit PFFs zu erwarten wären, wenn ein einheimisches oder nicht-denaturierendes Gel verwendet würde. Schließlich garantiert das erfolgreiche Durchlaufen all dieser ersten Schritte zur Qualitätskontrolle keine α-syn-Inklusionseinnahme. Aus diesem Grund sollten Zellkultur-Experimente oder eine kleine Kohorte von chirurgisch injizierten Tieren verwendet werden, um die Wirksamkeit der PFFs zu testen, bevor sie in größeren Experimenten eingesetzt werden.
Die Sonikerung ist ein entscheidender Schritt in diesem Prozess, und die Parameter werden je nach Modell des verwendeten Soundators unterschiedlich sein. Sonication Parameter müssen angewendet und überprüft werden, um zu zeigen, dass kurze PFF-Fragmente produziert wurden. Die Fasergröße hat das Tragen auf die Aussaat, wobei die kürzeren Fibrillen effizienter sind. Obwohl kürzeres Fasersaat effizienter ist, wirkt dieser Effekt plateaus und die optimale PFF-Länge beträgt ca. 50 nm4,18. Es ist auch wichtig, die Proben nicht zu überklonieren und die PFFs übermäßiger Hitze auszusetzen, da dies die Aussaateffizienz verringern kann. Diese klanglichen PFFs sollten vor dem Einsatz in größeren Experimenten auf Wirksamkeit in der Kleinzellkultur oder in vivo-Experimenten getestet werden. Da verschiedene Sonikerungssitzungen das Potenzial haben, Variabilität einzuführen, sollten experimentelle Behandlungsgruppen entsprechend geplant werden.
Bei der Lieferung von PFFs in vivo kann die Lokalisierung der Injektionsstelle (n) und der Gesamtmenge der verwendeten PFFs die Anzahl der Neuronen beeinflussen, die Einschlüsse entwickeln werden, sowie den Umfang der Neurodegeneration7,14. Die Koordinaten im Protokoll bieten einen Startplatz, sollten aber im Labor getestet werden, um sicherzustellen, dass die gewünschte Zielregion vor dem Einsatz in Großversuchen die α-syn Pathologie entwickelt. Auf Wunsch können Tracking-Farbstoffe oder fluoreszierende Perlen als Möglichkeit verwendet werden, regionale Zielscheiben vor der Verwendung von PFFs zu testen. Die Menge der PFFs, die in vivo verwendet werden, variiert zwischen den Gruppen, wobei die meisten Gruppen insgesamt 5 bis 20 μg PFFs an einem oder auf zwei Injektionsstellen 1,2, 3,4, 5aufgeteilthaben. , 6 , 7 , 14. Da die Anzahl der Injektionsstellen, die Lage der Injektionsstellen und die Menge der injizierten PFFs Ergebnisse und das Fortschreiten der Synucleinopathie beeinflussen können, sollten die nachgelagerten Ergebnisse der verwendeten Parameter vor der Verwendung des Modells charakterisiert werden, um Mögliche Eingriffe testen oder zeitliche Merkmale des Modells untersuchen.
Bei der Auswahl eines Modells, das für die Prüfung von Therapeutika oder das Studium der Krankheitsfortschritte verwendet werden soll, sollte das verwendete Modell ausgewählt werden, um die gestellte Frage am besten zu beantworten. Nicht alle Modelle werden bestimmte Krankheitsmerkmale von PD besitzen oder den Zeitrahmen bieten, der für die Erprobung potenzieller Interventionen erforderlich ist. Das PFF-Modell rekapituliert wichtige Merkmale von PD, wie die α-syn Pathologie und Neurodegeneration, und kann zu bescheidenen motorischen Beeinträchtigungen führen. Das Modell bietet einen vorhersehbaren und langwierigen Zeitverlauf, bei dem sich Einschlüsse Monate vor der Neurodegeneration bilden. Dies ermöglicht es den Forschern, die verschiedenen Phasen während des langwierigen Fortschritts der Synucleinopathie zu untersuchen und zu nutzen. Die aktuelle und zukünftige Nutzung des Modells insgesamt wird voraussichtlich von Vorteil für die Erforschung des Fortschritts von Krankheiten und die Entwicklung neuer Therapien sein.
Offenlegungen
Joseph Patterson, Kelvin Luk und Caryl Sortwell sind derzeit an vertraglichen Vereinbarungen mit der Michael J. Fox Foundation zur Qualitätskontrolle von Material zur Qualitätskontrolle beteiligt, das von Proteos, Inc. Coauthor Nicole Polinski, erzeugt wurde, ist Mitarbeiterin des Michael J. Fox. Foundation, die Proteos, Inc. mit der Herstellung von α-syn Monomer beauftragt hat. Die Coautoren Megan Duffy, Laura Volpicelli-Daley und Nicholas Kanaan haben nichts zu verraten.
Danksagungen
Unterstützt wurde diese Forschung durch Stipendien der Michael J. Fox Foundation, des National Institute of Neurological Disorders and Stroke (NS099416) und des Weston Brain Institute.
Materialien
| Name | Company | Catalog Number | Comments |
| 1x Dulbecco’s phosphate buffered saline | Thermo Fisher (Gibco) | 14190144 | |
| Anti-alpha-synuclein (phosphorylated at serine 129) antibody | Abcam | AB184674 | |
| Anti-alpha-synuclein antibody | Abcam | AB15530 | |
| Bicinchonic acid | Thermo Fisher (Pierce) | PI23228 | |
| Clear Medical Shrink Tubing (0.036" inner diameter) | Nordson Medical | 103-0143 | |
| Clear Medical Shrink Tubing (0.044" inner diameter) | Nordson Medical | 103-0296 | |
| Copper sulfate | Thermo Fisher (Pierce) | PI23224 | |
| Eppendorf ThermoMixer C | Eppendorf | 2231000574 | |
| Eppendorf ThermoTop heated lid | Eppendorf | 5308000003 | |
| Formvar/Carbon coated electron microscopy grids | Eletron Microscopy Sciences | FCF300-Cu | |
| Glass capillary tube (0.53 mm outer diameter; 0.09 mm inner diameter; 54 mm length) | Drummond | 22-326223 | |
| Glass needle puller | Narishige | PC-10 | |
| Hamilton syringe | Hamilton | 80000 | |
| Human alpha-synuclein monomer to generate preformed fibrils | Proteos | RP-003 | |
| Mouse alpha-synuclein monomer to generate preformed fibrils | Proteos | RP-009 | |
| Orange Medical Shrink Tubing (0.021" inner diameter) | Nordson Medical | 103-0152 | |
| Parafilm M | Sigma-Aldrich | P7543 | |
| Proteinase K | Invitrogen | 25530015 | |
| Qsonica 3.2 mm tip | Qsonica | 4422 | |
| Qsonica Q125 sonicator | Qsonica | Q125 | |
| Thioflavin S | Sigma-Aldrich | T1892 | |
| Thioflavin T | EMD Millipore | 596200 | |
| ToxinSensor Chromogenic LAL Endotoxin Assay Kit | Genscript | L00350C | |
| Uranyl acetate | Eletron Microscopy Sciences | 22400 |
Referenzen
- Luk, K. C., et al. Pathological alpha-synuclein transmission initiates Parkinson-like neurodegeneration in nontransgenic mice. Science. 338, 949-953 (2012).
- Luk, K. C., et al. Molecular and Biological Compatibility with Host Alpha-Synuclein Influences Fibril Pathogenicity. Cell Reports. 16, 3373-3387 (2016).
- Paumier, K. L., et al. Intrastriatal injection of pre-formed mouse alpha-synuclein fibrils into rats triggers alpha-synuclein pathology and bilateral nigrostriatal degeneration. Neurobiology of Disease. 82, 185-199 (2015).
- Abdelmotilib, H., et al. alpha-Synuclein fibril-induced inclusion spread in rats and mice correlates with dopaminergic Neurodegeneration. Neurobiology of Disease. 105, 84-98 (2017).
- Duffy, M. F., et al. Lewy body-like alpha-synuclein inclusions trigger reactive microgliosis prior to nigral degeneration. Journal of Neuroinflammation. 15, 129(2018).
- Duffy, M. F., et al. Quality Over Quantity: Advantages of Using Alpha-Synuclein Preformed Fibril Triggered Synucleinopathy to Model Idiopathic Parkinson's Disease. Frontiers in Neuroscience. 12, 621(2018).
- Luk, K. C., et al. Exogenous alpha-synuclein fibrils seed the formation of Lewy body-like intracellular inclusions in cultured cells. Proceedings of the National Academy of Sciences of the United States of America. 106, 20051-20056 (2009).
- Volpicelli-Daley, L. A., et al. Exogenous alpha-synuclein fibrils induce Lewy body pathology leading to synaptic dysfunction and neuron death. Neuron. 72, 57-71 (2011).
- Volpicelli-Daley, L. A., Luk, K. C., Lee, V. M. Addition of exogenous alpha-synuclein preformed fibrils to primary neuronal cultures to seed recruitment of endogenous alpha-synuclein to Lewy body and Lewy neurite-like aggregates. Nature Protocols. 9, 2135-2146 (2014).
- Kuusisto, E., Salminen, A., Alafuzoff, I. Ubiquitin-binding protein p62 is present in neuronal and glial inclusions in human tauopathies and synucleinopathies. Neuroreport. 12, 2085-2090 (2001).
- Neumann, M., et al. Misfolded proteinase K-resistant hyperphosphorylated alpha-synuclein in aged transgenic mice with locomotor deterioration and in human alpha-synucleinopathies. The Journal of Clinical Investigation. 110, 1429-1439 (2002).
- Li, J. Y., et al. Characterization of Lewy body pathology in 12- and 16-year-old intrastriatal mesencephalic grafts surviving in a patient with Parkinson's disease. Movement disorders : official journal of the Movement Disorder Society. 25, 1091-1096 (2010).
- Shimozawa, A., et al. Propagation of pathological alpha-synuclein in marmoset brain. Acta Neuropathologica Communications. 5, 12(2017).
- Polinski, N. K., et al. Best Practices for Generating and Using Alpha-Synuclein Pre-Formed Fibrils to Model Parkinson's Disease in Rodents. Journal of Parkinson's Disease. 8, 303-322 (2018).
- Fares, M. B., et al. Induction of de novo alpha-synuclein fibrillization in a neuronal model for Parkinson's disease. Proceedings of the National Academy of Sciences of the United States of America. 113, 912-921 (2016).
- Fenyi, A., Coens, A., Bellande, T., Melki, R., Bousset, L. Assessment of the efficacy of different procedures that remove and disassemble alpha-synuclein, tau and A-beta fibrils from laboratory material and surfaces. Scientific Reports. 8, 10788(2018).
- Geiger, B. M., Frank, L. E., Caldera-Siu, A. D., Pothos, E. N. Survivable stereotaxic surgery in rodents. Journal of Visualized Experiments. , (2008).
- Tarutani, A., et al. The Effect of Fragmented Pathogenic alpha-Synuclein Seeds on Prion-like Propagation. Journal of Biological Chemistry. 291, 18675-18688 (2016).
- Wall, N. R., De La Parra, M., Callaway, E. M., Kreitzer, A. C. Differential innervation of direct- and indirect-pathway striatal projection neurons. Neuron. 79, 347-360 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten