Method Article
Поколение альфа-нуклеин предварительно сформированные фибриллы из мономеров и использовать в естественных условиях
В этой статье
Резюме
Цель этой статьи состоит в том, чтобы наметить шаги, необходимые для генерации фибриллы от мономерные альфа-нуклеин, последующего контроля качества, и использование предварительно фибриллы в естественных условиях.
Аннотация
Использование в естественных условиях альфа-нуклеин предварительно сформированных фибрил (а-Син PFF) модель синуминатии набирает популярность среди исследователей, направленных на модель болезни Паркинсона нуклеопатии и нигростриатальной дегенерации. Стандартизация поколения а-Син PFF и применения в естественных условиях имеет решающее значение для того, чтобы обеспечить последовательную, надежную а-Син патологии. Здесь мы представляем подробный протокол для генерации фибрилилл из мономерные, а после-фибриллизации шаги контроля качества, и предложил параметры для успешной нейрохирургической инъекции с-Син ПХФ в крыс или мышей. Начиная с мономерные а-Син, фибриллизации происходит в течение 7-дневного инкубационного периода при встряхивании в оптимальных буферных условиях, концентрации и температуры. Контроль качества после фибриллизации определяется наличием фиброидных фибрилл через седиментации, формирование амилоидных конформации в фибриллами с помощью анализа Тиофлавин т, а электронно-микроскопической визуализации фибрилилл. В то время как успешная проверка с использованием этих анализов необходима для достижения успеха, их недостаточно для гарантии того, что в нейроне будут посевной паф-Син, так как такое агрегирование активности каждой партии pffs должно быть протестировано в клеточной культуре или в пилотных когортах животных. Перед использованием, ПХФ должны быть sonicated при точно стандартизированных условиях, после экспертизы с использованием электронной микроскопии или динамического рассеяния света для подтверждения длины фибрил находятся в пределах оптимального диапазона размеров, со средней длиной 50 Нм. После этого можно добавлять в клеточные носители культуры или использовать их в животных. Патология, обнаруживаемые иммуноокрашивания для фосфорилированных а-Син (псин; Серин 129), является очевидной дней или недель спустя в клеточных культур и грызунов моделей, соответственно.
Введение
Болезнь Паркинсона (PD) характеризуется в первую очередь посмертно двумя основными патологическими особенностями: широко распространенной и прогрессивной альфа-нуклеин-патологией (а-Син) и нигростриатальной дегенерацией. После инъекции в дикие мыши или крысы, а-Син преформируются фибриллы (Pффы) индуцируют прогрессивное накопление патологического а-Син, что может привести к затяжной дегенерации субстанции Нигра Парс Компакта (SNpc) дофаминовых нейронов в течение многих месяцев, а также сенсомоторных дефицитов1,2,3,4,5,6. Нейроны подвергаются воздействию а-Син фибриллы, либо через прямой внутримозговой инъекции или добавлены к средствам массовой информации культивируемых нейронов. Когда pффы взяты в нейроны, пафы действуют, чтобы "семя" формирование включений через шаблонирование, и накопление эндогенного а-Син в фосфорилированных включений1,7,8, 9. в Включения имеют сходные свойства с телами Леви: содержащие а-Син фосфорилированные в Серине 129 (Псин), убиквитин и P62; обладают амилоидных четвертичных структур, как показано с положительным окрашивание Тиофлавин; и устойчивы к протеиназы к пищеварению1,3,5,7,8,9,10,11, 12. PFF воздействия приводит к а-Син формирование включения в начальной и некоторые увековечены нейронов в культуре, а также мышей, крыс, и не-человека приматов в естественных условиях1,2,3,4, 5,6,7,8,9,13. Важно отметить, что Pффс не приведет к формированию «а-Син» во всех моделях клеточных культур, а некоторые культивированные нейроны будут лучше, чем другие.
Еще одной важной особенностью в естественных условиях-Син PFF модель различных последовательных патологических фаз, которые возникают в течение нескольких месяцев. У грызунов, следующих внутрирасторопиальной инъекции, образование «а-Син» обычно достигает пика в рамках SNpc и многих корковых областей в течение 1-2 месяцев. Этот агрегированный пик сопровождается нигростриатальной дегенерацией ≈ 2-4 месяцев спустя1,3,5. Эти различные патологические этапы предоставляют исследователям платформу для изучения и разработки стратегий, которые 1) уменьшают агрегацию, 2) ясно уже сформированные-Син включения, и/или 3) предотвращают последующее нейродегенерацию. Модель PFF предлагает различные преимущества и недостатки по сравнению с нейротоксикант, трансгенные и вирусные векторные опосредованные модели, как ранее рассмотренные6. Выбор, какую модель или подход принять должны определяться, какая модель лучше всего подходит вопрос следователи просят.
Хотя модель PFF успешно используется во многих лабораториях, есть еще группы, которые испытали несоответствия с генерирования фибриллы и производство последовательной а-Син патологии14. Примеры несоответствий варьируются от ПХФ, которые производят мало или вообще не патологию-Син, партию к пакетной эффективности посева, и даже провал фибрилилл в форме. Таким образом, стандартизация поколения но-Син PFF и в естественных условиях применения имеет решающее значение для того, чтобы обеспечить точное толкование в отношении воздействия новых терапевтических вмешательств. В следующем Протоколе излагаются шаги, необходимые для генерации ПХФ от а-Син мономеров, в пробирке контроля качества из ПХФ когда-то формируется, УЗИ и измерение Pффс до использования, и предложения для облегчения успешного в естественных условиях инъекции В крыс или мышей.
протокол
Все методы, связанные с животными, были одобрены Мичиганским государственным университетом по уходу за животными и Комитетом по его применению (ИКУК).
1. формирование-нунуклеин, предварительно сформированных фибриллами из мономеров (рис. 1)
- Оттепель-нунуклеин мономеров на льду, мягко ресуспензируем, щелкая трубку, и центрифуга на 15 000 x g для 10 мин при температуре 4 °c.
Примечание: а-Син мономер должны быть специально сформулированы для фибролизации. Рекомбинантные мономеры могут быть приобретены из коммерческих источников или генерируются протоколами на сайте4,9,14,15. При купленной из коммерческих источников, продукт должен заявить, что а-Син мономер специально для генерации фибрилилл. Независимо от того, если мономеры покупаются или генерируются на сайте, контроль качества шаги, изложенные ниже, должны быть выполнены с каждой партии для обеспечения фибриллы сформировали и будет семян эффективно до использования в экспериментах. - Передача супернатант чистой трубки микроцентрифуги 1,5 ml и записывать количество переданных.
Примечание: Будьте осторожны, чтобы избежать гранул, которые, если присутствуют, будет небольшим. - Измерьте концентрацию белка перенесенно супернатант либо стандартный биинхонгиновой кислоты анализа (ДСС), или измерения поглощения на 280 Нм с микротома спектрофотометра.
Примечание: анализ ДСС не так точен для конкретного измерения а-Син и может дать результаты завышения концентрации белка. В результате, измерение абсорбционные на 280 Нм является рекомендуемым методом для определения концентрации белка.- Чтобы измерить с помощью анализа ДСС, следуйте стандартным протоколам ДСС и выполните три различных разведения а-Син мономера. Предлагаемые разведений являются 1:25, 1:50 и 1:100.
- Для измерения с методом A280, пустой читатель с стерильным 1x Дульбекко в фосфатов физиологический раствор (dPBS) без кальция и магния, с концентрацией соли примерно 100 mM навл, и рН диапазоне 7-7.3 (таблица материалов).
- Добавьте 2 мкл образца к читателю и прочитайте впитывающее устройство на 280 Нм.
- Используйте закон Бир-Ламберта для определения концентрации мономеров.

Примечание: Коэффициент вымирания ε для человека-Син составляет 5 960 м-1см-1 , а для мыши а-Син-7 450 м1см-1. Длина Патта измеряется в сантиметре. Молекулярная масса а-Син (14 кДа) оценивается при условии 1 Da = 1 г/моль.
- Развести мономеры с 1x dPBS до конечной концентрации 5 мг/мл. Используйте уравнение ниже, чтобы вычислить количество 1x dPBS добавил разбавить мономеров.

Примечание: все концентрации в mg/mL, и объемы в мкл. Моомер разведения должны быть выполнены с 1x dPBS. Общий объем, используемый для генерирования фибрилл, должен быть между 100 и 500 мкл для достижения воспроизводимых результатов фибрилизации. - Кратко вихрь смешивать, и центрифуга, чтобы собрать все жидкости в нижней части трубки. Aliquot мономеры для сравнения контроля качества с фибриллами, как указано в шагах 1.8.1-1.8.4.
- Использование трубки замок или воск/пластиковая пленка (таблица материалов) для обеспечения микроцентрифуги крышка трубки закрыта.
- Поместите трубку в орбитальном сермомиксер с крышкой в течение 7 дней при температуре 37 ° c, встряхивая при 1 000 оборотов в минуту (таблица материалов).
Примечание: в конце 7 дней, содержимое трубки должно появиться мутное. Сермомиксер должно иметь крышку для того чтобы предотвратить образование конденсации на крышках пробки. - Аккуратно Флик трубку, чтобы ресуспензируем-Син фибриллы. Aliquot фибрилилл для следующих шагов контроля качества, как указано в шагах 1.8.1-1.8.4.
Примечание: Фибрилс для контроля качества шаги могут храниться в РТ на ночь.- Aliquot 6 мкл для седиментации.
- Aliquot 5 мкл для связывания анализа Тиофлавин т.
- Aliquot 2 мкл для просвечивающей электронной микроскопии для визуализации фиброза.
- Aliquot не менее 10 мкл для эндотоксина анализа.
Примечание: для эндотоксинового анализа используется коммерческий Лимлус амебоцит (Лал), следуя инструкциям производителя (таблица материалов). Эндотоксин уровни должны быть не 0,5 эндотоксина единиц/мл для фибрилилл. Комплект эндотоксин удаления может быть использован, если этот критерий не будет достигнута.
- Aliquot оставшиеся фибриллы и хранить. Для долгосрочного хранения (12-18 месяцев), быстро заморозить на сухой лед, и хранить при температуре-80 ° c.
Примечание: сумма к Алиготе зависит от желаемого нисходящего применения. В естественных условиях использования обычно требует более фибриллы в более высоких концентрациях, чем в пробирке использования, и Алиготе объемы должны быть запланированы соответствующим образом. Фибриллы должны храниться в задней части морозильника, чтобы предотвратить повреждение от потенциального замораживания/оттаивания. Протокол может быть приостановлен здесь.
2. седименосно-анализ
- В чистой микроцентрифуге трубки, добавить 6 мкл из PFF до 54 мкл dpbs разбавить фибриллы 1:10, и пипетки перемешать.
- В отдельной трубке добавьте 6 мкл мономера к 54 мкл dPBS в качестве дополнительного элемента управления.
- Образцы центрифуг в 10 000 x g за 30 минут на RT и перенесем супернатант в чистую микроцентрифугу.
- Добавить 60 мкл dPBS в оставшиеся гранулы и вихря к ресуспензируем.
- Добавить 30 мкл образца буфера 3x (140 мкл 50% гвентол/0,1% брофеннол синий, 40 мкл 10% СДД и 20 мкл б-меркаптоэтанола) для каждой трубки и вихря перемешать.
- Инкубации образцов на 100 ° c в течение 10 мин и дать остыть в течение 5 минут на льду.
- Используйте стандартный натрий додекино сульфат-полиакриламида гель электрофорез (СДД-PAGE) протокол к отдельным белка по массе. Используйте белковую лестницу с диапазоном, который включает в себя 14 kDa (размер группы ожидается для мономерные а-Син).
- Перенесите гель в окрашивание посуды и покройте гель с голубым пятном Комасси (0,1% блестящего синего, 20% метанола по объему и 10% ацететической кислоты по объему в ddH2O). Инкубировать для 3 ч на RT при встряхивании.
- Вылейте синее пятно Комасси и добавьте достаточно Дестан (50% метанола по объему и 10% ацететической кислоты по объему в ddH2O), чтобы покрыть гель. Инкубировать в течение 30 минут на RT при встряхивании.
- Слейте Дестан и повторите шаг, пока гель ясно и полос видны.
- Вымойте гель 3 раза в течение 5 минут каждый встряхивая в ddH2O и изображение геля.
3. просвечивающей электронно-микроскопии для визуализации фибрил
- Взвесьте 20 мг уранилом ацетата в пробирке микроцентрифуги и добавьте 1 мл ddH2O, чтобы сделать 2%-ное решение. Вихрь, пока уранилом ацетат находится в растворе, и позволяют сидеть на ночь.
Примечание: Уранилом ацетат должен быть сделан за день до подготовки образцов для просвечивающей электронной микроскопии. Воздействие света или агитации может привести к уранилом ацетата в осадок, как таковой, трубка, содержащая уранилом ацетата решение должно быть покрыто алюминиевой фольгой, хранится в темном месте, и не встряхивают после уранилом ацетат находится в растворе. - Добавить 2 мкл от PFF до 98 мкл dpbs, чтобы разбавить фибриллы 1:50, а затем пипетки перемешать.
- Подготовьте чистую восковую/пластическую пленку (таблицу материалов) покрыл поверхность (приблизительно 50 mm x 50 mm) на верхней части стенда. На чистом Воске/пластиковой пленке (таблица материалов) добавьте следующую (рис. 2).
- Добавьте 4 x 10 мкл капель ddH2O.
- Добавьте 1 х 10 мкл капли разбавленного фибриллы или мономера образца.
- Добавьте 2 x 10 мкл капель 2% уранилом ацетата.
- Используйте тонкой наконечником щипцы, чтобы забрать форвар/углерод покрытием, сетка меди сетки электронной микроскопии сетки (таблица материалов).
Примечание: Убедитесь, что только подобрать сетку по краю, избегая сетки часть в центре (рис. 2а). Если щипцы коснуться сетки, форвар/углерод покрытием пленка будет повреждена, делая изображения в этой области сетки невозможно. - Поплавок сетки форвар/углерод покрытием стороне (блестящая сторона) вниз на первой капли ddH2O. аккуратно Используйте щипцы для удержания сетки и нажмите вниз, чтобы обеспечить всю поверхность покрытия находится в контакте с DDH2O. Дайте сетке плавать в течение 1 мин.
- Выберите вверх сетку, и без касатьться части сетки сетки, фитиль прочь ddH2O с фильтровальной бумагой.
- Поплавок сетки, как выше, на второй капли ddH2o в течение 1 мин и фитиль от DDH2o.
- Поплавок сетки на каплю разбавленной фибриллы в течение 1 мин и фитиль от избыточного как выше.
- Поплавок сетки на первой капли уранилом ацетата за 1 мин и фитиль от избытка.
- Поплавок сетки на второй капли уранилом ацетата за 1 мин, фитиль от избытка.
- Поплавок сетки, как выше, на третьей капли ddH2o кратко и фитиль от DDH2o.
- Поплавок сетки, как выше, на четвертой капли ddH2o кратко и фитиль от DDH2o, будучи уверенным, чтобы удалить столько DDH2o насколько это возможно.
- Перенос в поле сетки для хранения до визуализации.
Примечание: сетки должны высохнуть в течение по крайней мере 5 минут до визуализации. Сетки могут быть запечатлена, по крайней мере, через год после подготовки и должны храниться в сухом окружении.
4. Тиофлавин т анализ
- В чистой микроцентрифуге трубки, добавить 5 мкл PFF до 245 мкл dpbs, чтобы разбавить фибриллы 1:50, и пипетки смешивать.
- Добавить 250 мкл dPBS в отдельную трубку микроцентрифуги, чтобы служить негативным контролем.
- Добавьте 5 мкл мономера к 245 мкл dPBS, чтобы служить в качестве элемента управления момера.
- Добавьте 250 мкл тиофлавина т в буфере глицина (25 мкм Тиофлавин т, 100 mM глицин, 1% тритон X-100, pH 8,5) на каждый образец и аккуратно перемешайте.
- Pipet 2 реплицирует, 200 мкл каждый, в черный 96 хорошо пластины. Держите тарелку в темноте, чтобы предотвратить фотоотбеливание.
- Инкубировать для 1 ч в РТ и читать пластины с помощью возбуждения 450 нм и выбросы 510 нм.
Примечание: Тиофлавин T чтений будет колебаться с течением времени. Образцы должны быть прочитаны в то же время инкубации. При желании можно принимать множественные показания в течение часа инкубации и нанесены с течением времени.
5. УЗИ-нунуклеин предварительно сформированных фибриллами
Осторожно: sonicator и все ультразвуки шаги выполняются в культе культуры для предотвращения контакта с фибриллами, которые могут аэрозольизировать во время сонофикации. Персонал, выполняющий шаги по сонофикации, должен носить средства индивидуальной защиты, включая перчатки, защиту одежды в форме лабораторного Пальто и лицевой щит при sonicating. Риск воздействия фибрила может быть уменьшен путем sonicating с sonicating чашку рога, позволяя трубку, содержащую фибриллы, чтобы оставаться закрытыми во время сонофикации.
Примечание: оптимальные параметры ультразвука фибриллятора зависят от используемой модели sonicator. По этой причине, некоторые оптимизации должны быть выполнены для обеспечения фибриллы являются правильный размер. Sonicator используется можно найти в таблице материалов и параметры, изложенные основаны на предыдущих результатах с этой моделью sonicator. Приведенные ниже параметры будут работать на 2-4 мкг/мкл в 200-400 мкл раствора. Тест сонофикации с инструментом должны быть выполнены и фибриллы проанализированы, чтобы обеспечить желаемые результаты достигаются до использования Pффс в экспериментах.
- Прикрепите зонд диаметром 3,2 мм (таблица материалов) к конвертору и установите параметры sonicator, как указано ниже в шаге 5.1.1-5.1.3.
- Установите амплитуду до 30%.
- Установите пульс до 01 01 (1 s на; 1 s выкл).
- Установите время до 0:01:00.
Примечание: 1 мин пульсирующий приравнивается к 60 импульсов, и эта модель sonicator (таблица материалов) остановится автоматически. С другими моделями sonicator необходимо будет подсчитать количество импульсов.
- Оттепель фибриллы на RT и разбавить стерильных dPBS в культурный капюшон.
Примечание: четкая микроцентрифуга 0,6 mL лучше всего подходит для ультразвука и окончательная концентрация фибрила зависит от предполагаемого использования. Репрезентативные результаты представлены с окончательной концентрации фибрила 4 мкг/мкл. - Протрите зонд sonicator с лабораторией ткани смоченной с 70% этанола для очистки зонда. Погрузите кончик зонда в ddH2O и 10 раз импульса для дальнейшего очистки зонда, а затем протрите сухой с лабораторной тканью.
- Поместите наконечник датчика в трубку разбавленной фибриллы, и положение наконечник в нижней части трубки.
- Sonicate для 60 импульсов (1 s на; 1 s выкл). Переместите зонд вверх и вниз во время каждого импульса, чтобы гарантировать, что все фибриллы в жидкости sonicated. и чистым.
- После 60 импульсов, удалите зонд из ПХФ, и добавить 2 мкл из pffs для 98 мкл dPBS в чистой микроцентрифуге трубки для разбавления фибриллы 1:50 для sonicated измерения фибрил по электронной микроскопии.
Примечание: в идеале, небольшое подмножество фибриллы должны быть измерены до в естественных условиях инъекции и более полное измерение фибриллы выполняется, когда позволяет время. - После ультразвука, кратко центрифуги для 1 s в 2 000 x g собрать все жидкости с сторон трубки.
Осторожно: Если трубка становится горячей на ощупь, стоп sonicating после 30 импульсов, подождите 1 мин, и sonicating для окончательного 30 импульсов.
Примечание: в то время как sonicating, держать наконечник зонда к нижней части жидкости в начале каждого импульса, слишком близко к верхней части жидкости вызовет потерю образца. - Погрузите наконечник зонда в 1% СДС и пульс 10 раз, чтобы очистить зонд. Удалите наконечник из СДД, погрузите в ddH2O и пульс 10 раз.
- Протрите зонд с тканью лаборатории смоченной с 70% этанола, а затем протрите зонд с сухой лабораторной ткани. Отсоедините зонд от конвертера и храните.
- Протрите вниз все поверхности капюшона с 1% СДВ, а затем 70% этанола.
Примечание: 1% решение СДВ используется для отмежеваться фибриллами и чистыми поверхностями и оборудованием16.
6. просвечивающей электронной микроскопии для измерения sonicated фибриллы
Примечание: Если электронная микроскопия не представляется возможным, Тиофлавин т кинетика анализа и динамического рассеяния света могут быть использованы в качестве косвенных мер эффективности посева и фибрил размер4,14.
- Подготовьте образцы с помощью протокола из раздела «электронная микроскопия для визуализации фибрила».
- Используйте электроэлектронный Микроскоп, чтобы взять изображение фибрилилл от 6 до 10 различных отверстий сетки.
Примечание: изображения должны быть достаточно высоким увеличением для измерения фибриллы, но достаточно низко, чтобы визуализировать несколько фибрилилл одновременно. Окончательное увеличение примерно в 75 000 x должно быть достаточным. - Измерьте длину небольшого подмножества, по крайней мере, 25 фибрилилл до использования фибрилилл в эксперименте.
Примечание: эти измерения обычно могут выполняться с помощью программного обеспечения для визуализации, связанного с микроскопом. Для быстрой проверки, человек измерения должны выбрать представитель фибриллы и рассчитать средний размер. Длина фибрила должна в среднем около 50 Нм или менее, с более точным измерением, чтобы следовать. - Измерьте длину 500 + фибрилилл для более полных результатов.
Примечание: программное обеспечение для визуализации, связанное с микроскопом, можно использовать для измерений фибрил. Кроме того, изображения могут быть открыты и фибриллы измеряется с помощью программного обеспечения для обработки изображений, с использованием шкалы масштаба, связанные с каждым изображением как размер ссылки, с которой сравнить длины фибрил.
7. Приготовление пользовательских стеклянных шприцов для стереотаксической инъекции (рис. 3)
- Добавьте приблизительно 10 мл реагента (таблица материалов) в чистую 50 ml-стакан.
- Поместите стеклянные трубки для капилляров (длина 54 мм; Наружный диаметр: 0,86 мм; внутренний диаметр 0,59 мм) вертикально в стакан реагента силизизации и позвольте действию капилляра нарисовать силиконизируют реагента вверх по трубе через нижнюю трубу, открывакоторой погружают в силизизации реагента.
- Pipet дополнительных силиконизизации реагента в верхней трубе открытия, которые не погружаются в силаконизации реагента, чтобы полностью заполнить стеклянную трубу капилляра.
- Удалите трубы из капилляра от реагента силизизации и промокните открытые концы труб на бумажном полотенце, чтобы удалить реагент силизизации в трубах. Разрешить трубы капилляра высохнуть, по крайней мере 8 часов.
- Поместите силиконового стекла капилляра трубки в стеклянные иглы съемник (таблица материалов).
- Включите нагревательный элемент и дайте прикрепленным весам растягивать трубку с подогревом стеклянной капилляры.
- Вырезать вытащил стекла капилляра трубки с ножницами в самой тонкой точке в середине и снимите стеклянную иглу из съемника стекла иглы.
Примечание: вытянул иглу внутренний и наружный диаметр должен быть приблизительно 80 и 100 мкм, соответственно. Множественные стеклянные иглы могут быть сделаны в одно время и храниться до тех пор, пока готовы приложить к стеклянной шприц с прикрепленной металлической иглой (таблица материалов). - Вырезать длину термоусадочной трубы (средний внутренний диаметр 0,021 "и средняя толщина стены 0,001") до примерно 40 мм с ножницами. Сдвиньте термоусадочную пленку над металлической иглой из 10 мкл скошенный шприц (таблица материалов).
- Использование открытого пламени для обогрева и придерживаться термоусадочную пленку на иглу при вращении иглы для применения тепла равномерно.
- Слайд больший конец вытащил стеклянную иглу тщательно над металлической иглой шприца.
- Вырезать длину термоусадочной трубы (средний внутренний диаметр 0,036 "и средняя толщина стены 0,005") до примерно 40 мм с ножницами и тщательно скользить по стеклянной иглой перекрывают основание стеклянной иглы и металлической иглы шприца (Таблица Материалы). Используйте открытое пламя, чтобы нагреть термоусадочную пленку для обеспечения стеклянной иглы металлической иглой.
- Добавьте дополнительный слой термоусадочная упаковка, чтобы закрепить стеклянную иглу. Вырезать длину термоусадочной трубы (средний внутренний диаметр 0,044 "и средняя толщина стены 0,005") до примерно 40 мм с ножницами и тщательно скользить по стеклянной иглой перекрывают основание стеклянной иглы и металлической иглы шприца (Таблица Материалы). Используйте открытое пламя, чтобы нагреть термоусадочную пленку для обеспечения стеклянной иглы металлической иглой.
- Обрежьте стеклянную иглу ножницами так, чтобы кончик был примерно 8 мм длиной.
Примечание: игла должна быть достаточно длинной, чтобы ориентироваться на желаемые участки мозга (необходимая длина зависит от спинной/брюшной координат). - Используйте шаги 7.14.1-7.14.3 для проверки иглы для обеспечения есть нет утечек и есть достаточный поток как в снятии и дозирования жидкости из стекла иглы.
- Заполните 1 мл шприца с прикрепленной 26-калибровочной иглой с dH2O.
- Удалите металлический поршень из пользовательского шприца из стекла иглы и вставьте иглу dH2O заполненный шприц в основание шприца. Нанесите давление, чтобы обойтись dH2O от стеклянной иглы. Осмотрите интерфейс стеклянной иглы и металлической иглы для утечек и подтвердите устойчивый dH2O Flow.
Примечание: при необходимости, стеклянная игла может быть обрезана, чтобы увеличить легкость потока и дополнительные слои термоусадочная упаковка добавлена для исправления любых утечек из базы стеклянной иглы. - Заполните пробирку микроцентрифуги с dH2o. Используйте пользовательский стеклянный шприц иглы для рисования в DH2o. Осмотрите иглу, чтобы убедиться, что жидкость берется в шприц и что нет пузырьков.
Примечание: если есть пузыри или dH2O не втягивается в иглу, обрезки иглы может помочь смягчить давление.
- Осторожно Храните шприц с прикрепленными стеклянными иголками в коробках шприцов, пока не потребуется операция.
- Применяют стандартные стерепотаксические методы хирургии для внутригосударственной доставки ПХФ на оптимизированные координаты у мышей (один участок: AP + 0,2 мм и мл + 2,0 мм от брегмы, DV-2,6 мм из твердой оболочки) или у крыс (два участка: AP + 1,6 мм и мл + 2,0 мм от брегмы, DV-4,0 из твердой оболочки; AP + 0,1 mm и ML + 4,2 mm от брегмы, DV-5,0 от Дура)1,14,17.
Примечание: эти координаты были использованы в C57BL6/C3H мышей и Фишер 344 крыс. При использовании других штаммов, координаты должны быть оптимизированы.
Результаты
Генерация фибрилилл от а-Син мономеров начинается с определения концентрации мономеров. И анализ ДСС и Измерение поглощения на 280 Нм (A280) могут быть использованы для измерения содержания белка; результаты анализа ДСС, однако, предложил более высокую концентрацию, чем метод A280. Pффы, полученные из мыши а-Син мономер, имели значение ДСС 14,05 ± 0,22 и A280 8,05 ± 0,03 мкг/мкл (рис. 1). Аналогичным образом, и, как представляется, Pффы, полученные от человека-Син-мономера, также находятся в более высокой концентрации, при этом значение ДСС составляет 12,95 ± 0,38 и A280 7,83 ± 0,05 мкг/мкл (рис. 1). Измерения A280 специфики для синки, основанные на включении коэффициентов вымирания, и эти результаты использовались для разбавления мономеров до 7-дневной инкубации.
До инкубации жидкость, содержащая а-Син мономеры, была ясна, но должна была появиться мутной после образования фибрила. Обследование с помощью просвечивающей электронной микроскопии подтвердило наличие длинных фибрилилл, измеряющих ширину 10-20 Нм (рис. 4). Для сравнения, а-Син мономеров едва заметны без видимых видимых форм (рис.4). С визуальным подтверждением Фибриллярные структуры, амилоидных конформации фибриллы является следующая особенность ПХФ, которые должны быть подтверждены с помощью анализа Тиофлавин т. Тиофлавин т экспонатов расширенной флуоресценции, когда связывание с амилоида; Таким образом, увеличенный флуоресцентный сигнал из образцов указывает на наличие амилоида. В качестве примера, Тиофлавин в dPBS произвел сигнал 3 287 ± 580 относительных флуоресцентных единиц (RFU), мышь а-Син мономер произвел сигнал 4 174 ± 158 RFU, и мыши Pффы произвели сигнал 59 754 ± 6 224 RFU (Рисунок 5). В сравнении, человеческий-Син мономер произвел аналогичный сигнал 4 158 ± 105 RFU мыши мономер, и человека Pффс произвел более высокий сигнал 1 235 967 ± 113 747 RFU по сравнению с мышью (рис. 5). Для оценки наличия фибрилл гранулами был выполнен седиментации. Фибрилл будет гранулы с центрифугирования. В обеих образцах мыши и человека PFF, супернатант фракция должна иметь больше белка в грануле, чем супернатант (Рисунок 6). В отличие от этого, большинство белка из мыши и человека мономеров присутствовал в supernatant, с небольшим настоящее время в грануле (рис. 6). С ОПС, явно присутствующих с помощью электронной микроскопии, амилоидных структур настоящее, и фибриллы гранулированное, ПХФ прошли все в пробирке контроля качества шаги.
И мышь, и человеческий ПФС были sonicated для производства ПХФ соответствующей длины для посева а-Син включения4,18. Pффы были разбавлены нужной концентрацией 4 мкг/мкл и sonicated. Непосредственно перед операцией 25 представительские фибриллы были запечатлена электронной микроскопии и измерены для точечный проверки размера фибрила. В sonicated мышь Pффы измеряется 48,8 ± 3,1 Нм, в то время как человеческий pффс измеряется 52,1 ± 4,4 Нм в длину; В связи с этим оба вида имели соответствующую длину (50 Нм или менее) для индуцирования посевной активности. Более полное обследование примерно 500 фибриллы показало среднюю длину и длину распределения sonicated мыши фибриллы. Средняя длина составляла 44,4 ± 0,6 Нм, при этом 86,6% от количества ПФС размером 60 Нм или меньше (рис. 4). В сравнении, людские Pффы усреднили 55,9 ± 1,1 нм с 69,6% из pффов измеряя 60 Нм или более менее (Диаграмма 4).
После внутривпрыскивания инъекции sonicated мыши pффс в крыс, как описано ранее3,5, ряд разделов ткани были обработаны в 2 месяца после операции, когда число включения содержащие нейроны, как известно, пик в SNpc, для подтверждения фосфорилированных а-Син включений5. Включение нейронов, как указано иммуногистолихимического окрашивания для Псин (антитела в таблице материалов) присутствуют в рамках SNPC (рис.7), а также других регионов по всему мозгу, который иннерпировать стриатума (передняя обонятельные ядра, мотор, поясная, грушевидная, прелимбическая, соматосенсорной, entorhinal, и островные, миндалины, стриатум)1,3,4,5,19. Эти включения имеют сходные свойства с телами Леви, такими как связывание Тиофлавин с, и устойчивость общего "а-Син" к протеиносе к (рис. 7), как показано на иммуногистолихимическое окрашивание (антитело и протеиназы к в таблице материалов) . Подтверждение посева в головном мозге указывает на контроль качества в естественных условиях был принят, и аликвотов ранее замороженных и сохраненных из той же партии может быть sonicated при идентичных параметрах, с длинами проверены, в больших экспериментах.

Рисунок 1 . Методы для генерации фибрилл-Син. Наброски шагов, необходимых для изготовления фибрилилл из-Син мономеров. Мономеры центрифугиются в течение 10 мин (15 000 х г, при температуре 4 °c). Supernatant переносится на чистую трубку и концентрация белка определяется либо абсорбционные на 280 Нм, или анализ ДСС. Диаграмма показывает концентрацию от человека и мыши а-Син мономеров. Столбцы указывают на группу средств, ошибки баров представляют ± 1 Стандартная ошибка среднего. После того, как концентрация белка определена, а-Син мономеры разбавляют, кратко vortexed и инкубировали для 37 ° c в течение 7 дней, в то время как встряхивания на орбитальный смеситель установлен на 1 000 оборотов в минуту. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.

Рисунок 2 . Окрашивание методов для просвечивающей электронной микроскопии. Схема негативного окрашивания для электронной микроскопии. A) изображения, изображающие сетки образца электронной микроскопии. Сетка имеет тускловатую или легкую сторону и блестящую или темную сторону. Блестящая/темная сторона покрыта пленкой поддержки форвар/углерода. B) Иллюстрация окраски процедуры. Сетка плыла блестящая/темная сторона вниз на первой капли ddH2O в течение 1 мин и избыток злой покончить с фильтровальной бумагой. Процесс повторяется со второй каплей ddH2o, разведенных ПХФ или мономеров, две капли уранилом ацетата, и две дополнительные капли DDH2O. сетки могут храниться в окне сетки до изображения. Шкала планка = 3 мм. пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.

Рисунок 3 . Сборка пользовательских стеклянных шприцев иглы. Схема шагов, необходимых для сборки стеклянных игл прилагается шприцы. Силиконизированные стеклянные трубы капилляров вытягиваны и отрезаны в середине для того чтобы произвести стеклянные иглы. Термоусадочная упаковка труб используется для подготовки металлической иглы и образуют внутреннюю печать, когда стеклянная игла скользила на металлическую иглу. Два дополнительных слоя труб термоусадочной обертки, которые перекрывают основание стеклянной иглы и металлической иглы последовательно добавляются и нагреваются для обеспечения стеклянной иглы и образуют герметичную печать. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.
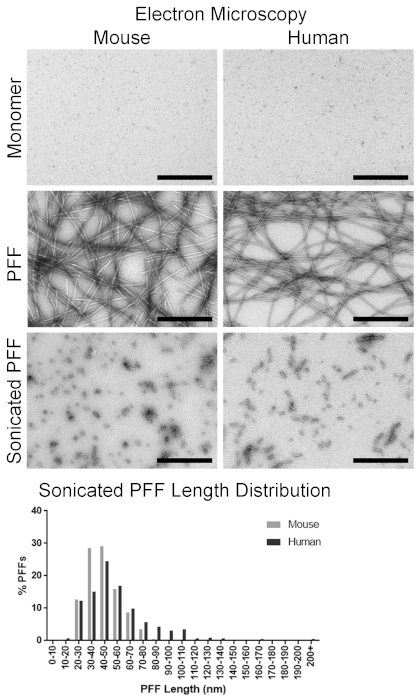
Рисунок 4 . Визуализация-Син мономеров и а-Син фибрилс через просвечивающей электронной микроскопии. Репрезентативные микрографы-Син мономеров и фибриллы. Верхние панели: мышь и человек-Син-мономер. Средние панели: полная длина мыши и человека-Син Pффы. нижние панели: мышь и человеческий-Син после сонофикации. Нижний граф: распределение sonicated мыши и человека-Син длины PFF. Шкала планка = 500 Нм. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.

Рисунок 5 . Подтверждение амилоидных структур с помощью анализа тиофлавина т. Измерение флуоресцентного сигнала от мыши и человека-Син мономера и образцов PFF. Слева: результаты от мыши, а-Син мономеров и а-Син. Справа: результаты от человека-Син мономеров и а-Син. Отрицательный контроль dPBS показан на каждом графике. Все измерения выражены как относительные флуоресцентные единицы (RFU). Столбцы указывают на группу средств, ошибки баров представляют ± 1 Стандартная ошибка среднего. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.

Рисунок 6 . Анализ седиментации для пелотаблицы а -н-Син. изображения из когсси окрашиваются в гели. Показанные полосы находятся примерно в 14 kDa на основе белковой лестницы. Слева: мышонок момер и ПХФ. Справа: мономеры и Pффы человека. Для всех момер и образцов PFF показаны ресуспендирован гранулы (P) и супернатант (S). Пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.
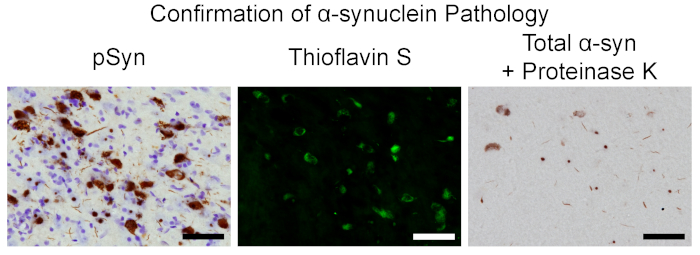
Рисунок 7 . Особенности включения в модель крысы, подтверждающие патологию а-Син. Представительные микрографы из черной субстанции Нигра Парс Компакта на 2 месяца после инъекции. Слева: нейроны, содержащие Псин и противные cresyl фиалки. Средний: Тиофлавин S положительных нейронов. Справа: а-Син-содержащие включения, устойчивые к протеинезе к. Шкала планка = 50 мкм. пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.
Обсуждение
Производство с-Син, способных посевных нейронов и ведущих к Леви тела типа включений зависит от нескольких факторов и шагов. Важнейшим фактором является то, что мономеры, используемые для генерации фибрилилл, должны быть специально сформулированы для фибролизации4,9,14,15. Если мономеры не сформулированы для фибролизации, фибриллы не могут образовываться или фибриллы, которые образуют форму, могут не образовывать патологию-Син. Аналогичным образом, буфер, в котором мономеры также оказывают влияние на фибриллизации. Таким образом, для наилучшего результата концентрация соли должна быть примерно 100 мм и pH между 7,0 и 7,3. Первоначальный шаг, который вводит изменчивость является метод, при котором начальное содержание белка определяется, с измерением на A280 вероятно, для получения более точных результатов и, следовательно, является предпочтительным методом. Несоответствие концентрации белка может снизить эффективность процесса обработки, а также изменить предполагающие концентрацию PFF, используемые в экспериментах. Оба могут привести к снижению эффективности посева и пакетной вариации между экспериментами.
Первоначальные шаги контроля качества подтверждают критические особенности ПХФ, в частности, что они имеют фибриллярной конформации (электронная микроскопия), содержат амилоидные структуры (Тиофлавин т-анализ), и гранулирует (осаждения). Важно отметить, что результаты анализа Тиофлавин т будет колебаться со временем и не являются прямым показателем количества амилоидных структур настоящее время, скорее, Тиофлавин т анализ должен использоваться только в качестве индикатора амилоидных структур присутствие в течение образца. Тиофлавин т, как правило, используется в пробирке анализов, таких, как вышеупомянутый анализ, чтобы показать фибриллы содержат амилоидные структуры. Альтернативно, Тиофлавин S используется в тканях для обнаружения амилоидных структур, как показано на рисунке 7. Что касается седиментации, то результаты показывают только то, что ПХФ находятся преимущественно в фракции гранулитаблицы. По мере того как пробы запускаются в условиях денатурирующих, на гелях присутствует одна видная полоса приблизительно 14 кДа, размером с-Син мономеров. Это в отличие от нескольких полос присутствуют на высших молекулярных весов, которые можно было бы ожидать с Pффс, если родной или не денатурирующих гель был использован. И наконец, успешное прохождение всех этих первоначальных этапов контроля качества не гарантирует включение в него посевной активности. Для этой причины, эксперименты культуры клетки или малая когорта хирургически-впрыснутого животных должны быть использованы для того чтобы испытать эффективность Pффов перед пользой в более больших экспериментах.
Ультразвука является решающим шагом в процессе и параметры будут отличаться в зависимости от модели sonicator используется. Параметры сонофикации должны быть применены и проверены, чтобы показать, что короткие фрагменты PFF были произведены. Размер фибрила имеет подшипник на посеве, с более коротким посева фибрилилл более эффективно. Хотя короткие фибрилл семян более эффективно, этот эффект плато и оптимальной длины PFF составляет около 50 Нм4,18. Кроме того, важно не более-sonicate образцов и подвергать ПХФ к чрезмерному нагреву, так как это может уменьшить эффективность посева. Эти sonicated ПХФ должны быть проверены на эффективность в небольших клеточных культуры или в естественных условиях эксперименты перед использованием в больших масштабах экспериментов. Поскольку различные сеансы сонофикации имеют потенциал для внедрения изменчивости, экспериментальные группы по лечению должны быть запланированы соответствующим образом.
При доставке ПХФ в естественных условиях, локализация места инъекции (s) и общее количество используемых pффов может повлиять на количество нейронов, которые будут развиваться включений, а также степень нейродегенерации7,14. Координаты в протоколе обеспечивают место для начала, но должны быть проверены в лаборатории для обеспечения желаемого целевого региона развивается патология-Син до использования в крупномасштабных экспериментов. При желании, отслеживание красителя или флуоресцентные шарики могут быть использованы как способ тестирования регионального таргетинга перед использованием Pффс. Количество ПХФ, используемых в естественных условиях варьируется между группами, с большинством групп, использующих в общей сложности от 5 до 20 мкг ПФС на один или разделены между двумя инъекцией сайтов1,2,3,4,5 , 6 , 7 , 14. по мере того как число участков инъекции, местоположение мест инъекции и количество вводящих в действие ПХФ могут иметь результаты и прогрессирование синуклеопатии, в нисходящих исходам используемых параметров следует охарактеризовать до использования модели для протестировать потенциальные вмешательства или изучить временные особенности модели.
При выборе модели для использования для тестирования терапии или изучения прогрессирования заболевания, модель, используемая должны быть выбраны, чтобы наилучшим образом ответить на вопрос. Не все модели будут обладать определенными заболеваниями PD, или предлагать временные рамки, необходимые для тестирования потенциальных вмешательств. Модель PFF повторяет ключевые особенности PD, такие как патология-Син и нейродегенерация, и может приводить к незначительным двигательные нарушения. Модель предлагает предсказуемое и длительное время-курс, где включения образуют за несколько месяцев до нейродегенерации. Это позволяет исследователям исследовать и эксплуатировать различные фазы во время длительного прогрессирования синуклеопатии. Текущее и будущее использование модели в целом, как ожидается, будет полезным в изучении прогрессирования заболевания и развития новых методов лечения.
Раскрытие информации
Джозеф Паттерсон, Кельвин люк и Кэрил Сортвелл в настоящее время участвуют в договорных соглашениях с Фондом Майкла Джея Фокса по контролю качества, который генерируется Протеос, Inc. соавтор Николь Полински, является сотрудником Майкла Джея Фокса Фонд, который заключил контракт с Протеос, Inc. для производства а-Син мономера. Коавторы Меган Даффи, Лаура Вольпицелли-Дейли, и Николас Канаан нечего раскрывать.
Благодарности
Это исследование было поддержано грантами Фонда Майкла Джея Фокса, национального института неврологических расстройств и инсульта (NS099416) и Уэстона Института мозга.
Материалы
| Name | Company | Catalog Number | Comments |
| 1x Dulbecco’s phosphate buffered saline | Thermo Fisher (Gibco) | 14190144 | |
| Anti-alpha-synuclein (phosphorylated at serine 129) antibody | Abcam | AB184674 | |
| Anti-alpha-synuclein antibody | Abcam | AB15530 | |
| Bicinchonic acid | Thermo Fisher (Pierce) | PI23228 | |
| Clear Medical Shrink Tubing (0.036" inner diameter) | Nordson Medical | 103-0143 | |
| Clear Medical Shrink Tubing (0.044" inner diameter) | Nordson Medical | 103-0296 | |
| Copper sulfate | Thermo Fisher (Pierce) | PI23224 | |
| Eppendorf ThermoMixer C | Eppendorf | 2231000574 | |
| Eppendorf ThermoTop heated lid | Eppendorf | 5308000003 | |
| Formvar/Carbon coated electron microscopy grids | Eletron Microscopy Sciences | FCF300-Cu | |
| Glass capillary tube (0.53 mm outer diameter; 0.09 mm inner diameter; 54 mm length) | Drummond | 22-326223 | |
| Glass needle puller | Narishige | PC-10 | |
| Hamilton syringe | Hamilton | 80000 | |
| Human alpha-synuclein monomer to generate preformed fibrils | Proteos | RP-003 | |
| Mouse alpha-synuclein monomer to generate preformed fibrils | Proteos | RP-009 | |
| Orange Medical Shrink Tubing (0.021" inner diameter) | Nordson Medical | 103-0152 | |
| Parafilm M | Sigma-Aldrich | P7543 | |
| Proteinase K | Invitrogen | 25530015 | |
| Qsonica 3.2 mm tip | Qsonica | 4422 | |
| Qsonica Q125 sonicator | Qsonica | Q125 | |
| Thioflavin S | Sigma-Aldrich | T1892 | |
| Thioflavin T | EMD Millipore | 596200 | |
| ToxinSensor Chromogenic LAL Endotoxin Assay Kit | Genscript | L00350C | |
| Uranyl acetate | Eletron Microscopy Sciences | 22400 |
Ссылки
- Luk, K. C., et al. Pathological alpha-synuclein transmission initiates Parkinson-like neurodegeneration in nontransgenic mice. Science. 338, 949-953 (2012).
- Luk, K. C., et al. Molecular and Biological Compatibility with Host Alpha-Synuclein Influences Fibril Pathogenicity. Cell Reports. 16, 3373-3387 (2016).
- Paumier, K. L., et al. Intrastriatal injection of pre-formed mouse alpha-synuclein fibrils into rats triggers alpha-synuclein pathology and bilateral nigrostriatal degeneration. Neurobiology of Disease. 82, 185-199 (2015).
- Abdelmotilib, H., et al. alpha-Synuclein fibril-induced inclusion spread in rats and mice correlates with dopaminergic Neurodegeneration. Neurobiology of Disease. 105, 84-98 (2017).
- Duffy, M. F., et al. Lewy body-like alpha-synuclein inclusions trigger reactive microgliosis prior to nigral degeneration. Journal of Neuroinflammation. 15, 129(2018).
- Duffy, M. F., et al. Quality Over Quantity: Advantages of Using Alpha-Synuclein Preformed Fibril Triggered Synucleinopathy to Model Idiopathic Parkinson's Disease. Frontiers in Neuroscience. 12, 621(2018).
- Luk, K. C., et al. Exogenous alpha-synuclein fibrils seed the formation of Lewy body-like intracellular inclusions in cultured cells. Proceedings of the National Academy of Sciences of the United States of America. 106, 20051-20056 (2009).
- Volpicelli-Daley, L. A., et al. Exogenous alpha-synuclein fibrils induce Lewy body pathology leading to synaptic dysfunction and neuron death. Neuron. 72, 57-71 (2011).
- Volpicelli-Daley, L. A., Luk, K. C., Lee, V. M. Addition of exogenous alpha-synuclein preformed fibrils to primary neuronal cultures to seed recruitment of endogenous alpha-synuclein to Lewy body and Lewy neurite-like aggregates. Nature Protocols. 9, 2135-2146 (2014).
- Kuusisto, E., Salminen, A., Alafuzoff, I. Ubiquitin-binding protein p62 is present in neuronal and glial inclusions in human tauopathies and synucleinopathies. Neuroreport. 12, 2085-2090 (2001).
- Neumann, M., et al. Misfolded proteinase K-resistant hyperphosphorylated alpha-synuclein in aged transgenic mice with locomotor deterioration and in human alpha-synucleinopathies. The Journal of Clinical Investigation. 110, 1429-1439 (2002).
- Li, J. Y., et al. Characterization of Lewy body pathology in 12- and 16-year-old intrastriatal mesencephalic grafts surviving in a patient with Parkinson's disease. Movement disorders : official journal of the Movement Disorder Society. 25, 1091-1096 (2010).
- Shimozawa, A., et al. Propagation of pathological alpha-synuclein in marmoset brain. Acta Neuropathologica Communications. 5, 12(2017).
- Polinski, N. K., et al. Best Practices for Generating and Using Alpha-Synuclein Pre-Formed Fibrils to Model Parkinson's Disease in Rodents. Journal of Parkinson's Disease. 8, 303-322 (2018).
- Fares, M. B., et al. Induction of de novo alpha-synuclein fibrillization in a neuronal model for Parkinson's disease. Proceedings of the National Academy of Sciences of the United States of America. 113, 912-921 (2016).
- Fenyi, A., Coens, A., Bellande, T., Melki, R., Bousset, L. Assessment of the efficacy of different procedures that remove and disassemble alpha-synuclein, tau and A-beta fibrils from laboratory material and surfaces. Scientific Reports. 8, 10788(2018).
- Geiger, B. M., Frank, L. E., Caldera-Siu, A. D., Pothos, E. N. Survivable stereotaxic surgery in rodents. Journal of Visualized Experiments. , (2008).
- Tarutani, A., et al. The Effect of Fragmented Pathogenic alpha-Synuclein Seeds on Prion-like Propagation. Journal of Biological Chemistry. 291, 18675-18688 (2016).
- Wall, N. R., De La Parra, M., Callaway, E. M., Kreitzer, A. C. Differential innervation of direct- and indirect-pathway striatal projection neurons. Neuron. 79, 347-360 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены