Method Article
تصوير المشبك المناعي البشري
* These authors contributed equally
In This Article
Summary
صور هذا البروتوكول كلا من تشكيل المشبك المناعي وحركه المرور المستقطبة اللاحقة نحو المشبك المناعي. وشكلت الاقترانات الخلوية بين خليه راجي الفائقة النبض (التي تعمل كخليه لتقديم مستضد) واستنساخ Jurkat (بوصفها المساعد المستجيب T اللمفاوية).
Abstract
والغرض من هذه الطريقة هو توليد المشبك المناعي (IS) ، مثالا علي اقتران خليه إلى خليه شكلتها خليه تقديم مستضد (APC) والخلية اللمفاوية T (Th) المساعد ، ولتسجيل الصور المقابلة للمراحل الاولي من هو تشكيل واحداث الاتجار اللاحقة (التي تحدث في APC وفي الخلية ث). وسوف تؤدي هذه الاحداث في نهاية المطاف إلى إفراز الاستقطاب في IS. في هذا البروتوكول ، طعنت خلايا Jurkat مع المكورات العنقودية المعوية E (انظر)-نبض الخلايا الراجي كما تم استخدام نموذج المشبك الخلية ، وذلك بسبب التقارب من هذا النظام التجريبي إلى الواقع البيولوجي (Th خليه APC الاقترانات متشابك). وينطوي النهج المعروض هنا علي اقتران الخلية بالخلية ، والحصول علي الفواصل الزمنيه ، والمجهر الفلوري الواسع النطاق (البعثة) ، تليها معالجه الصور (التفكيك بعد الاستحواذ). وهذا يحسن نسبه الاشاره إلى الضوضاء (الاستخبارات) من الصور ، ويعزز الدقة الزمنيه ، ويسمح لاكتساب متزامنة من عده فلوروتشروميس في الناشئة الاقترانات متشابك ويقلل من التبييض فلوري. الاضافه إلى ذلك ، يتم مطابقه البروتوكول بشكل جيد مع بروتوكولات تثبيت الخلية نقطه النهاية (بارافورمالدهيد ، الأسيتون أو الميثانول) ، والتي من شانها ان تسمح مزيد من تلطيخ المناعي والتحليلات. هذا البروتوكول هو أيضا متوافق مع المسح الضوئي بالليزر المجهر البؤري (LSCM) وغيرها من التقنيات المجهرية الدولة من بين الفن. كتحذير رئيسيه, فقط ان [ت] [سل-APC] حدود (يدعي [س] واجات) ان كان في ال يصح 90 ° زاوية إلى البؤرة طائره علي طول ال [ز-اكسيس] استطاع كنت بشكل صحيح [ايمسن] وحللت. توجد نماذج تجريبية أخرى تبسط التصوير في البعد Z وتحليلات الصور التالية ، ولكن هذه الطرق لا تحاكي السطح المعقد وغير المنتظم لناقله APC ، وقد تروج للتفاعلات غير الفسيولوجية في ال IS. التالي ، فان النهج التجريبي المستخدم هنا مناسب للإنتاج ولمواجهه بعض التعقيدات البيولوجية التي تحدث في المعرض.
Introduction
والهدف الرئيسي من هذه الطريقة هو توليد المشبك المناعي (IS) الخلية إلى الخلية التي شكلتها خلايا العرض مستضد (APC) النبضي مع المولدات الخارقة انظر والخلية الثالثة المستجيب ، ولتسجيل الصور المقابلة للمراحل الاولي من تكوين المشبك المناعي واحداث الاتجار اللاحقة (التي تحدث في APC والخلية ث) ، والتي في نهاية المطاف سوف تؤدي إلى إفراز الاستقطاب في IS. إنشاء من قبل الخلايا الليمفاوية T عند ربط مستقبلات الخلية الخاصة بهم (TCR) للمستضدات المنضمة إلى mhc-II علي APC ينظم الحيوية للغاية ، طيع والحرجة التي تشارك في الاستجابات المناعية الخاصة مستضد ، الخلطيه والخلوية1،2. يتم تعريف is بواسطة تشكيل معقده التنشيط الجزيئية الخاصة (smac) نمط يتميز بعمليه أعاده تنظيم الاكتين3. علي IS البناء من الخلايا الليمفاوية T مع APC ، والاستقطاب من الحويصلات سيكريتوري نحو IS يبدو متورطا في إفراز الاستقطاب في الفجوة متشابك. ويبدو ان هذه اليه المركزة تزود الجهاز المناعي بشكل لا لبس فيه بحيله منظمه بطريقه رائعه لتعزيز فعاليه الأدوار الحاسمة التي تقوم بها الخلايا اللمفاوية التائية ، مع تقليل التحفيز غير المحدد للخلايا المارة ، وقتل الخلايا المستهدفة غير ذات الصلة ، والانتحار عن طريق التنشيط4.
نتيجة لل IS يختلف علي طبيعة كل من اللمفاوية T و APC. الاتصال متشابك من الخلايا العشر (عاده الخلايا + +) مع APC عرض المرتبطة antigen إلى MHC-II تنتج تنشيط الخلية T (إفراز السايسيسين ، والانتشار ، وما إلى ذلك) ، وفي بعض الحالات ، المبرمج عن طريق AICD4. للخلايا اللمفاوية T السامة (CTLs) (أساسا CD8 + الخلايا) التفاعل مع APC تقديم مستضد المرتبطة MHC-I ، تختلف النتيجة علي ما قبل التحفيز ام لا من CTLs مع مستضد. وهكذا ، CTLs ساذجه تحديد المجمعات antigen-MHC-I علي APC هي "تستعد" لتدمير الخلايا المستهدفة والانقسام. تستعد ctls أيضا إنشاء الاشتباكات العصبية مع الخلايا المستهدفة (اي الخلايا المصابة بالفيروسات أو الخلايا السرطانية) التي تنتج مستضد خليه خاصه الاباده5,6.
إفراز الاستقطاب من التماثيل في المشبك المناعي هو مجال النامية والتحدي من البحوث المعنية في الاستجابات المناعية ذات الصلة7. وقد ثبت ان الهيئات متعددة الحويصلات (mvb) تحمل الحويصلات داخل ألومنيوم (ilvs) تجربه النقل المستقطب نحو IS8,9 (فيديو 1) علي تحفيز TCR مع مستضد. الانصهار من هذه mvb في غشاء متشابك يدفع بهم التحبيب والإفراج عن ilvs كما exosomes إلى المشقوق متشابك8,10. يحدث هذا في IS التي شكلتها الخلايا من النوع الذي تم تحديه مع الخلايا الراجية انظر المغلفة سوبرمستضد التي تعمل باسم APC11، وحفزت TCRاللمفاويات اللمفية ، وتستعد ctls. وهكذا ، فان الاشتباكات العصبية التي قدمتها الخلايا Jurkat تشكل نموذجا قيما لدراسة الاستقطاب سيكريتوري حركه المرور من exosomes. الاضافه إلى ذلك ، أظهرت عده عقود من التحقيق ان العديد من الرؤى الاساسيه في الإشارات TCR جاءت من الدراسات مع تحويل خطوط الخلايا التائية ، وفي الواقع أفضل المعروفة من هذه النظم نموذج هو الكريات البيضاء الخلايا البيضاء T-خليه خط12.
وينتج تشكيل التطوير الكامل العديد من النتائج البيولوجية الحاسمة ، بما في ذلك تنشيط الخلايا العشر ، وتفعيل CTLs الساذجة أو قتل الخلايا المستهدفة بواسطة CTLs الجاهزة ، باستثناء انرجي أو AICD5. ولذلك ، هناك نوعين رئيسيين من سيكريتوري يتم تاسيسها من قبل الخلايا الليمفاوية T التي تؤدي في متنوعة جدا ، ولكن الحرجة بالمثل ، وظائف المناعي المستجيب1،6،13. من ناحية ، و IS من تستعد الخلايا الليمفاوية السامة للخلايا (CTLs) يدفع الاستقطاب السريع (تتراوح بين ثوان إلى بضع دقائق) من حبيبات الليتيك (تسمي "سيكريتوري lysosomes تماثيل") نحو IS. التحبيب من حبيبات التحللي يحفز إفراز تثقيب و granzymes إلى المشقوق متشابك14، والتي هي جزيئات الموالية ابوتوتيك. ال يفرز يثقب و [غرزيميس] في وقت لاحق يحث قتل من الخلايا مستهدفه15,16. Ctls تطوير الاشتباكات العصبية المؤقتة ، وتستمر لبضع دقائق فقط ، كما يتم قتل الخلايا المستهدفة3،17. هذا هو علي الأرجح بسبب الظرف ان المهمة CTL الأمثل يتطلب الاتصال السريع والمؤقت من أجل توزيع أكبر عدد ممكن من الضربات المميتة إلى العديد من الخلايا المستهدفة3,17. وعلي النقيض من ذلك ، فان الخلايا اللمفاوية الليمفاوية ، مثل زنزانات jurkat ، تولد مستقره وطويلة الأمد (من 10-30 دقيقه حتى ساعات) ، لان هذا يبدو ضروريا لكل من الإفراز الاتجاهي والمتواصل لتحفيز السايتوكينات3،17. كما يتم تضمين السايتوكينات في حويصلات سيكريتوري وبعضها (اي ، IL-2 ، IFN-γ) تجربه النقل المستقطب إلى IS17 وإفراز. واحده من السمات الاساسيه لل IS هو تشكيل الاتصالات الاستكشافية والضعيفة وعابره بين الخلية T و APC (فيديو 1) التي قد تنتج تفاعلا اقوي وإنشاء IS ناضجه ، شريطه ان يحدد TCR المجمعات antigen-mhc المتشابهة وان يتم تاسيس اتصالات التحفيز المشترك المناسبة5. كل من بداية الاتصالات الاوليه وتاسيس ناضجه ، منتجه تماما ، هي بطبيعتها العشوائية ، والعمليات السريعة وغير المتزامنة5،18. وعلاوة علي ذلك ، هناك تردد نادر في إنشاء الاقترانات من الخلية إلى الخلية19، والتي قد تشكل تحديا لتقنيات التصوير (يرجى الرجوع إلى أقسام النتائج والمناقشة).
ومن التحديات الرئيسية الأخرى في دراسة الاستقطاب في مركز التنظيم المجهري (MTOC) والحبيبات التي تفرزها الخلايا اللمفاوية التائية ان العملية برمتها سريعة (من ثوان إلى بضع دقائق) ، لا سيما في CTLs. النظر إلى هذه الحقائق ، واجهت معظم النهج المبكرة استراتيجية النقطة النهائية التي تختلط فيها الخلايا APC/المستهدفة واللمفاويات التائية بصوره مشتركه ومتقاربة بطرد السرعة المنخفضة ، لصالح الإنشاء المترافق بين الخلايا ، المحتضن لعده دقائق نقل من [متك] [و/ور] حويصلات [سيكريتوري] نحو ال [س]20. وهذا النهج له حدودان هامه: لم يتم التوصل إلى بيانات حيه عن الاتجار بالبشر وتم الحصول علي مستويات عاليه من الاستقطاب لحبيبات MTOC/سيكريتوري ، ربما بسبب الطابع العشوائي لمؤسسه IS18. وعلاوة علي ذلك ، اي ارتباط بين المحفزة TCR ، الاحداث الإشارات الاوليه (اي ، يرتفع الكالسيوم داخل الخلايا ، أعاده التنظيم الاكتين) والاستقطاب الحويصلة الإفراز إشكاليه للتحقيق. التالي ، فان الاحكام الحتمية للتصوير المناسب لل IS في الخلايا الحية تجتمع لتعزيز التجسيد المقارن بين الخلايا ، لمزامنة جيل ال IS ، وعند الإمكان ، لضمان إنشاء الاقتران الخلوي في حقول XY المجهر المحددة ومواضع Z. وقد وضعت عده استراتيجيات لتجنب كل هذه المشاكل. ومن الخارج عن نطاق هذه الورقة شرح هذه الأساليب وفوائدها ونقاط ضعفها. يرجى الرجوع إلى الاستعراضات المنشورة سابقا معالجه هذه النقاط الهامه1،4،5،21.
الحقيقة التي ادلي بها الخلايا الليمفاوية Th هي طويلة الأمد ، والظرف الذي في الخلايا الليمفاوية ال MTOC ، اللمفاوية التي تحتوي علي حبيبات سيكريتوري و MVB تاخذ من عده دقائق تصل إلى ساعات للتحرك وقفص الاتهام لل IS22 يجعل TH-APC هو مرشح مثالي للتصوير باستخدام البروتوكول الموصوف هنا.
Protocol
1. اعداد الشرائح للانضمام إلى خلايا الراجي
- أضافه 150 μl من الفيبرونكتين جنيني (100 ميكروغرام/مل) لكل بئر إلى 8 شريحة microwell الغرفة (الشريحة البلاستيكية أسفل الغرفة) واحتضانه لمده 30 دقيقه إلى 1 ح في 37 درجه مئوية. وهذا الركيزة التصاق تسمح للربط من الخلايا راجي إلى أسفل جيدا (الخطوة 2) ، وتشكيل المعيشة الاقتران مع خلايا Jurkat (الخطوة 4) الخلايا ، والتقاط المجهر الزمني الفاصل (الخطوة 6) ، ومتوافق أيضا بعد ذلك مع اختياري بارافورمالدهيد (PFA) التثبيت (الخطوة 7).
ملاحظه: لتثبيت الأسيتون ، استخدم الشرائح الزجاجية السفلية للغرفة وبولي-L-ليسين (20 ميكروغرام/مل) بدلا من الفيبرونكتين ، بما ان الأسيتون يذوب البلاستيك. الشريحة 8 microwell الغرفة (1 سم2 حسنا ، 300 μl حجم الحد الأقصى) أو ما يعادلها هو شكل مرن ومناسب. - يستنشق فيبرونكتين باستخدام ماصه التلقائي 200 μL ويغسل كل بئر مع 200 μL من تلفزيوني لمده 2 دقيقه مع اهتزاز لطيف. كرر هذا الغسيل مره أخرى. يمكن تخزين الشريحة غرفه في هذه المرحلة مع تلفزيوني لمده 1-2 أسابيع في 4 ° c.
2. التصاق الخلايا راجي إلى الشرائح الغرفة و 7-امينو-4-كلوموثيلكومارين (CMAC) وضع العلامات
- نقل 10 مل من متموج (1-2 x 106 خلايا/مل) قبل الثقافة من الخلايا راجي إلى 15 مل, V-أسفل أنبوب. تخلط جيدا واستخدام 10 μL لحساب الخلايا في غرفه نيوبوير أو ما يعادلها.
- طرد مركزي الخلايا المتبقية في 300 x g لمده 5 دقائق في درجه حرارة الغرفة. يستنشق والتخلص من سوبرناتانت.
- أعاده التعليق برفق بيليه الخلية في المتوسطة الدافئة ثقافة كامله (RPMI 1640 تستكمل مع 10 ٪ FCS ، 2 مم الجلوتامين ، 10 مم HEPES ، 100 U/mL البنسلين ، و 100 ميكروغرام/مل ستربتومايسين) بتركيز 106 خلايا/مل. استخدم المعادلة الواردة أدناه:
([] الاوليx vالاولي = []النهائي x vالنهائي) ، حيث []الاولي يمثل تركيز الخلية الاوليه ، vالاولي = الحجم الاولي من تعليق الخلية ، []النهائي = تركيز الخلية النهائية ، vالنهائي = الحجم النهائي للتعليق الخلية.
ملاحظه: اعتمادا علي تركيز الخلية من ثقافة البداية ، فمن الممكن لجمع المزيد من الخلايا من الحاجة ولكن من المهم الحفاظ علي الخلايا المتبقية في الثقافة (37 درجه مئوية) حتى نهاية التجربة من أجل منع المشاكل المحتملة (انظر الخطوة 2.6). - تسميه الخلايا راجي للسماح للتعرف عليها خلال تشكيل المترافق متشابك. في هذه التجربة ، 7-امينو-4-كلوموثيلكومارين (CMAC) يتم تنفيذ وضع العلامات في الخطوة 2-4.
- انقل العدد المطلوب من خلايا الراجي في الوسط الثقافي إلى أنبوب 2 مل. ل 8 الشريحة microwell الغرفة ، وهناك حاجه إلى ما مجموعه 1.6 مل من تعليق الخلية (200 μL لكل بئر).
- أضافه CMAC إلى تركيز نهائي من 10 μM. الحفاظ علي الخلايا في الظلام عن طريق تغطيه أنبوب مع رقائق ألومنيوم منذ CMAC حساسة للضوء. 200 μL التي تحتوي علي 2 × 105 الخلايا راجي مطلوبه لكل 1 سم2 جيدا. التالي ، إذا كان من الضروري اعداد 8 ابار ، 1.6 x 106 خلايا راجي مطلوبه.
ملاحظه: وصفت الخلايا راجي مع خليه تعقب الأزرق (CMAC ، الاثاره UV والانبعاثات الزرقاء) يميزها عن الخلايا العشر عندما تتشكل الاقترانات متشابك. هذا الصبغ متوافق مع المثبتات PFA والأسيتون ويسمح مزيد من الإجراءات المناعية. في محاولة لتجنب المعرض الخفيفة. وسم خلايا راجي في بركه مع CMAC تليها أعاده التعليق قبل التصاق خلايا الراجي إلى شرائح الغرفة المغلفة fibronectin يضمن الوسم متجانسة من الخلايا راجي مع CMAC بين الآبار المختلفة.
- أعاده التعليق الخلايا الملونة CMAC و ، بعد الطموح من تلفزيوني في الشريحة الغرفة من الخطوة 1.2 ، نقل 200 μL من تعليق الخلية إلى كل بئر من الشرائح المغلفة fibronectin الغرفة التي أعدت في الخطوة 1.1-1.2. احتضان الشريحة الغرفة في 37 درجه مئوية ، 5 ٪ CO2 لمده 30 دقيقه-1 ساعة.
ملاحظه: والتصاق والوسم CMAC تحدث في وقت واحد في هذه الخطوة ، وهذا يوفر الوقت. يرجى العلم ان خلايا راجي سوف الرواسب بسرعة والحذر يحتاج إلى اتخاذها للحفاظ علي تركيز متجانس في تعليق الخلية قبل البذر. ليس من الضروري غسل CMAC في هذه المرحلة من قبل طرد ، لان CMAC الغسيل سيتم بسهوله أكبر في الخطوة 2.7 (عندما يتم التزام بالفعل الخلايا راجي المسمي إلى الشرائح الغرفة). منذ CMAC موجود في تعليق الخلية في الزائدة الكبيرة ، والخلفية الزرقاء الفلورية عاليه جدا للتمييز بين الخلايا الزرقاء الملونة. تحقق خليه CMAC الفلورية في الخطوة 2.7 بعد غسل CMAC. - تاكد من التزام بخلايا راجي أسفل الآبار عن طريق الاهتزاز اللطيف للشرائح الغرفة علي المجهر. تاكد من ان الخلايا عرض الفجوات بين بعضها البعض وليست متموج (الشكل 1، اللوحة الوسطي). 50-60% من التقاء الخلايا مناسب.
- إذا كانت معظم الخلايا بكفاءة التمسك الشريحة الغرفة وتلاحظ اي ثغرات الخلية ، وغسل كل بئر مع المتوسطة الدافئة كامله وأعاده تعليق المتوسطة مع ماصه pipet-x التلقائي 200 μL لفصل الزائدة الخلية. تحقق التقاء بعد كل خطوه أعاده التعليق.
- إذا كانت الخلايا لا تلتزم ، كرر خطوه التصاق مره أخرى وزيادة التصاق الوقت و/أو رقم الخلية.
ملاحظه: فمن الممكن ان تتوقف هنا ، احتضان الشريحة الغرفة في 37 درجه مئوية ، 5 ٪ CO2 بين عشيه وضحيها (O/N) ، والاستمرار في البروتوكول في اليوم التالي. يرجى تاكيد في اليوم التالي ان الخلايا راجي لا تزال ملتزمه والمسمي CMAC باستخدام المجهر الفلوري.
- اغسل كل بئر مره أخرى بعناية مع RPMI الدافئة المكملة للقضاء علي CMAC الزائدة والتحقق من الانبعاثات الزرقاء مع المجهر مضان (الشكل 1).
ملاحظه: لتجنب استخدام النفط الغمر (لزجه ولزجه) وارتفاع أهداف النفط الفتحة العددية ، بعيده جدا (اي ، 20x أو 40x) الأهداف يمكن استخدامها للتحقق بسرعة وضع العلامات CMAC باستخدام المجهر مضان.
3. نبض CMAC — المسمية الخلايا الراجي مع مكورات انتيتوكسين E
- أضافه مكورات انتيتوكسين E (انظر ، 1 ميكروغرام/مل) لكل بئر. SEE يستطيع كنت بسهوله خففت في خليه ثقافة وسط (يعمل حل في 100 ميكروغرام/مل) من ال SEE مخزون مجمد (1 [مغ/مل] في [ببس]). استخدام 2 μL من الحل 100x العمل لكل microwell 200 μL.
تحذير: استخدام قفازات لهذه الخطوة والتخلص من غيض المستخدمة في مربع الخطر البيولوجي. - احتضان الشريحة الغرفة في 37 درجه مئوية ، 5 ٪ CO2 لمده 30 دقيقه علي الأقل. يستمر تاثير SEE علي الأقل 3-4 h.
ملاحظه: يمكن أضافه SEE إلى الآبار في نقاط زمنيه مختلفه عند الحاجة ، إذا كانت الإعدادات الفاصلة الزمنيه المميزة مخططه (الخطوة 5) و/أو اعتمادا علي نقطه البداية لتجارب نقطه النهاية (الخطوة 6).
4. اعداد خلايا الجوكات
- استخدام ثقافة المتنامية سابقا من الخلايا Jurkat (1-2 x 106 خلايا/مل) لهذه التجربة. استخدام الخلايا من قارورة الثقافة القياسية أو من التحويل السابقة بعد البروتوكولات الكهربية القياسية ، كما هو موضح سابقا23. وسوف تسمح العدوى من خلايا Jurkat التصور الفاصل الزمني لحركه المرور من حبيبات سيكريتوري في الخلايا الحية. علي سبيل المثال ، عندما يتم التعبير عن CD63 (علامة MVB) ويمكن تسجيل حركه الحويصلات المزينة بالCD63 (فيديو 1).
- مراقبه الخلايا تحت المجهر النقيض المرحلة. إذا كان هناك فائض من الخلايا الميتة (> 20-30 ٪) لاحظت, ينجز [فينول] كثافة تدرج طرد يستعمل بروتوكولات معياريه24, ان يزيل الفائض من خلايا ميتة (خلايا ميتة يبدي كثافة [هيغر] من [ليفينغ سل]) قبل ان يستعمل (رايت نقاشه).
- نقل الخلايا إلى أنبوب 15 مل ، V-أسفل أنبوب ، واستخدام 10 μL للعد باستخدام الكريات الدموية.
- طرد مركزي الخلايا المتبقية كما هو موضح في الخطوة 2.2. التخلص من الخلايا الفائقة وأعاده تعليقها بنفس تركيز خلايا راجي (1 × 106/مل) باستخدام الثقافة الطازجة والدافئة المتوسطة. اتبع الخطوات 2.2-2.3.
- الحفاظ علي خلايا Jurkat في الثقافة (37 درجه مئوية ، 5 ٪ CO2) اثناء انتظار الخطوة 4.
ملاحظه: في الخيار الثاني (التحويل) ، فان عدد الخلايا الحية سيكون اقل بكثير مما كانت عليه في الأول. التالي ، خذ بالاعتبار استخدام مستوي اعلي لثقافة خليه البدء من أجل الحصول علي خلايا كافيه للتجربة. من 10 × 106 jurkat الخلايا في الكهربية كوفيت والتحويل ، فقط 2-4 x 106 الخلايا jurkat سوف البقاء علي قيد الحياة بعد 48 h من الانتقال وبعض هذه الخلايا ستضيع خلال الخطوة ficoll. التالي ، فان واحده من الكهرباء كوفيت كافيه عموما للطعن في الخلايا الراجية التي تم التقيد بها من 8 ابار صغيره (1.6 × 106 خلايا جوركات المطلوبة).
5. الزرع المشترك لخلايا الراجي والجوكات
- خذ الشرائح الغرفة التي تحتوي علي المسمي CMAC ، انظر نبض ، انضم الراجي الخلايا من الحاضنة من الخطوة 3.2. فانه ليس من الضروري لغسل CMAC في هذه المرحلة منذ ذلك الحين تم القيام به سابقا في الخطوة 2.7.
- يستنشق بعناية الوسط الثقافة من كل بئر ، واحدا تلو الآخر ، من زاوية واحده من البئر باستخدام ماصه التلقائي 200 μL. لا تدع المتوسطة في البئر تجف تماما.
- علي الفور استبدال المتوسطة مع 200 μL من أعاده تعليق الخلايا Jurkat في ثقافة الخلية المتوسطة (1 × 106/مل) أعدت في الخطوة 4.5. إذا تم تنفيذ التصوير الفاصل الزمني ، انتقل إلى الخطوة 6 مباشره بعد هذه الخطوة ، منذ خلايا Jurkat تميل إلى الرواسب وشكل الاقترانات متشابك بسرعة كبيره. للراحة ، والميكروويلس التي تحتوي علي انظر نبضي ، انضم الراجي الخلايا التي لا تتلقي البذر مع الخلايا Jurkat في هذه المرحلة ينبغي الحفاظ عليها مع ثقافة الخلية المتوسطة حتى التحدي اللاحق مع الخلايا Jurkat. وهذا سيسمح بمرونة التحدي اللاحقة مع الخلايا Jurkat لفتره اضافيه الفاصل الزمني أو عكس الحركية, النهج التجريبية نقطه نهاية.
- إذا كان سيتم تنفيذ الفاصل زمني ، انتقل بسرعة إلى الخطوة 6. وهذا ينطوي علي الثقافة المشتركة ل 1-2 h علي المرحلة المجهر حاضنه أو ما يعادلها في 37 درجه مئوية ، 5 ٪ CO2 للسماح تشكيل المترافق متشابك والحصول علي صوره في وقت واحد. إذا كان تحليل نقطه النهاية ، ولكن لا يوجد فاصل زمني ، هو متوقع التحقق من تشكيل المقارن بعد فتره الثقافة المشتركة باستخدام المجهر (كما في الشكل 1) قبل إصلاح الخلايا (الخطوة 7).
6. الوقت الفاصل بين التصوير الناشئة التصريفات متشابك
- اعداد المجهر وغرفه الحضانة قبل التصوير. للحصول علي المثال الموضح في الفيديو 1 ، يتم عرض إعدادات المجهر التفصيلي في الشكل 2.
ملاحظه: إذا تم التخطيط لتجربه الفاصل الزمني ، يجب اعداد جميع إعدادات المجهر ومكملاته (غرفه ثقافة الخلية المحيطة ، الخ) قبل أضافه تعليق Jurkat إلى الشريحة مع خلايا الراجي الملتصقة. يتم وصف الخطوات التالية لمجهر تجاري (جدول المواد). ومع ذلك ، يمكن استخدام اي المجهر الفلورية مقلوب مجهزه حاضنه ثقافة الخلية.- استخدام المجهر مع 60x الغمر النفط ، والفتحة العددية عاليه عند تصوير حركه المرور المستقطبة.
- تاكد من تشغيل نظام التركيز التلقائي وضبط الازاحه للتركيز علي خلايا الراجي المنضمة إلى السطح السفلي. يرجى الرجوع إلى الشكل 1 والفيديو 1 والفيديو 2.
- بعد Jurkat أضافه إلى كل بئر تحتوي علي الخلايا الراجي الانضمام في الخطوة 5.3 ، حدد بسرعة الشريحة microwell الغرفة علي الساخنة قبل تسخينها (1-2 h) المجهر مرحله الحاضنة (اي OKOlab) وحدد بعض المواقف XY مع المجهر ، والحقول التي هو من المرجح ان يسجل تشكيل الناشئة التي ادلي بها ، علي سبيل المثال ، خليه Jurkat-المتحولة التي تقع في تركيز المجهر.
- استخدام حاضنه مرحله ما قبل تسخين المجهر لأنه لوحظ ان مرحله درجه الحرارة استقرت تحافظ علي استقرار X ، Y ، Z المواقف. معايير لحقل XY مريحه هي: الخلايا التي تركز بشكل جيد وغير متموج راجي (اي ، وعرض الفجوات بين الخلايا) ووجود خلايا Jurkat المنقولة (وهذا يمكن التحقق من خلال الجمع بين النفاذيه والاشعه فوق البنفسجية أو قنوات GFP). سوف الخلايا jurkat الرواسب بسرعة كبيره (بضع دقائق) علي الشريحة الغرفة ، وفرص للصورة الناشئة الاشتباكات العصبية سوف تنخفض مع الوقت (الشكل 1). فمن الممكن اما لإنهاء التجربة بعد الفاصل الزمني المحدد أو المضي قدما إلى الخطوة 7 وإصلاح الاقتران للمناعة اللاحقة والتحليلات.
ملاحظه: فمن الممكن لتحديد ما يصل إلى 16 حقول المجهر مختلفه من ما يصل إلى 4 ميكروويلس مختلفه للحصول علي المتزامنة ، متعددة الوقت الفاصل الزمني الاستحواذ مع الدقة الزمنيه المناسبة (1-2 دقيقه لكل اطار). يعتمد التحديد علي كلا من العدد والكثافة (التي تؤثر علي معرض الكاميرا) لفلوروتشروميس المتنوعة التي يجب ان تكون غير محدده (معتمده علي عدد البروتينات الفلورية التي تم التعبير عنها ، باستثناء CMAC). طريقه واحده لزيادة معدل الإطار هو تسجيل للقناه CMAC في واحد فقط من كل "ن" الإطارات الزمنيه ل GFP (اي ، n = 8 ، كما هو مبين في الشكل 2) ، حيث يتم التزام الخلايا راجي إلى أسفل جيدا ولا تتحرك بسهوله كخلايا jurkat. الاضافه إلى ذلك ، وهذا يعود بالنفع علي بقاء الخلية ، لان التعرض للضوء الاشعه فوق البنفسجية المتكررة قد يضر الخلايا. في محاولة لضبط معدل الإطار الزمني إلى 1 اطار كل 1 دقيقه أو اقل (اي ، 20 ثانيه لكل اطار في الفيديو 1، الشكل 2) منذ الاستقطاب mvb يستغرق بضع دقائق إلى ساعات لإكمال. المجهر مجهزه بمحركات التحصين الموسع-مضان البرج والمناسبة الفرقة-تمرير فلوري المرشحات أو ما يعادلها ضرورية لأداء هذا التقاط متعدد القناات.
7. تشكيل نقطه نهاية الاقتران متشابك والتثبيت
- إذا تم التخطيط لتجربه نقطه نهاية فقط (1-2 ساعة الحاضنة للسماح تشكيل التقارن متشابك هو المناسب) ، احتضان الشريحة الغرفة في 37 درجه مئوية ، 5 ٪ CO2 ل 1-2 h. التحقق من تشكيل التقارن بعد فتره الثقافة (كما في الشكل 1) ، وبعد ذلك ، وإصلاح الاقتران مع الأسيتون أو PFA (التثبيت سوف تعتمد علي المستضدات والأجسام المضادة لاستخدامها في المناعي اللاحق). في هذه الحالة لا تتطلب الحضانة حاضنه مرحله المجهر. يرجى الرجوع إلى الفيديو 3 للحصول علي مثال.
- لإصلاح الخلايا ، وغسل البئر عن طريق اهتزاز لطيف مع RPMI الدافئة (37 درجه مئوية) المتوسطة دون FCS (الزلال من المصل قد يعجل مع تثبيت الأسيتون). يستنشق وأضافه 200 μL من PFA أو الأسيتون قبل المبردة لكل بئر. احتضان غرفه الشريحة في درجه حرارة الغرفة (RT) أو علي الجليد ، علي التوالي ، لمده 20 دقيقه.
ملاحظه: لتثبيت الأسيتون ، قبل البرد الأسيتون في-20 درجه مئوية وقبل البرد الشريحة الغرفة في 4 درجه مئوية. قم بازاله الاغطيه البلاستيكية عند استخدام الأسيتون لإصلاح الخلايا المستزرعة في الشرائح الزجاجية السفلية بالبئر. - غسل كل بئر مرتين مع تلفزيوني وأضافه 200 μL من محلول التبريد (تلفزيوني ، 50 mM NH4Cl). احتضان الغرفة الشريحة في 4 درجه مئوية.
ملاحظه: في هذه المرحلة يمكن ان الشريحة غرفه البقاء لمده شهر واحد علي الأقل في 4 درجه مئوية قبل تنفيذ بروتوكول المناعي ، كما هو موضح8. يمنع الغطاء التبخر.
8. معالجه الصور
- أداء الصورة بعد الاستحواذ (اي التفكيك أو ما يعادلها ، جدول المواد) من سلسله الفاصل الزمني و/أو الصور الثابتة للخلايا المثبتة. (ب) التفكيك باستخدام برامجيات ملائمة (اي باستعمال الخيار البصري "الميداني الواسع" في Huygens) والمعلمات البصرية الصحيحة. [ديفولكايشن] يتطلب للصورة يعالج من ال يقاس نقطه انتشار وظيفة ([بسف]) من المجهر4.
- بدلا من ذلك ، استخدم البرنامج لحساب PSF المثالية عن طريق التحميل التلقائي للمعلمات البصرية المدرجة بين البيانات الوصفية من ملفات المجهر. وتتالف هذه المعلمات البصرية من الطول الموجي الفلوروكروم ، ومؤشر الانكسار ، والفتحة العددية للهدف ، وتقنيه التصوير (التركيز البؤري ، والمجال الواسع ، وما إلى ذلك). 4-
- وفي وقت لاحق ، يستخدم برنامج التصوير ال PSF وخوارزميات التفكيك المتنوعة (مثل QMLE و CMLE في برنامج Huygens) في عمليه الحساب التراكمي خطوه بخطوه ، والتي يمكن تصور نتائجها بشكل مستمر وإيقافها (أو استئنافها) عند الحاجة من قبل المستخدم. في هذه المرحلة يمكن للمستخدم تغيير عدد تلافيف و/أو اشاره إلى نسبه الضوضاء واستئناف تفكيك. يعمل برنامج التفكيك بشكل جيد مع سلسله الفاصل الزمني (X, Y, T) (فيديو 2) و z-مكدسات (x, y, z) (فيديو 3). اندمجت القناات [ديفولوتد] كان فيما بعد إلى ال [كمك], قناه خام, بما ان [سيتوسيوليك], فلوروتشروميس منتشرة لا يحسن ب [ديفولكايشن]4,9.
النتائج
لقد تابعنا البروتوكول الموصوف من أجل توليد المشبك المناعي لجهاز Jurkat-راجي وللصورة الصحيحة للمراحل المبكرة من تشكيل IS. وكان هدفنا هو تحسين النهج المبكرة20 التي اتبعت سابقا لدراسة الاستقطاب من mtoc وآلات سيكريتوري نحو IS. واستندت هذه النهج علي استراتيجية نقطه النهاية التي لم تسمح بتصوير تشكيل IS أو الاحداث المبكرة متشابك, منذ في هذه الاستراتيجيات هو تشكيل إلزاميه وقعت في بيليه من الخلايا المختلطة, طرد, ولكن ليس علي المجهر. تم تصميم البروتوكول الخاص بنا لتجنب هذا التحذير الرئيسي ، لان النهج كان يستند إلى استخدام تركيز الخلية المناسب (الخطوات 2 و 3) ، لصالح تشكيل الخلية إلى الخلية هو الاقتران علي الشرائح المجهر الغرفة الخاصة (8 الشريحة الصغرى بئر الغرفة) ، التي شنت علي حاضنه مرحله ما قبل تسخين المجهر ( هذه الاستراتيجية التحريض علي تشكيل IS ، في وقت واحد إلى التقاط الصور الفاصلة الزمنيه (فيديو 1).
يمثل الشكل 1 الاقترانات التي تم الحصول عليها بعد البروتوكول (الخطوة 5.2). تمثل الصورة الإطار الأول من تجربه تمثيليه وفاصل زمني. 2 × 105 تم أضافه خلايا الراجي و 2 × 105 خلايا jurkat إلى 1 سم2 جيدا. تظهر اللوحة العلوية قناه النفاذيه ، وتتكون اللوحة الوسطي من قناه CMAC (الزرقاء) (الخلايا راجي) ، وتظهر اللوحة السفلي كلا من النفاذيه بالاضافه إلى القناات المدمجة CMAC. السهام الصفراء تسميه بعض الاقترانات متشابك ، كمرجع ، في حين تشير الأسهم الخضراء الاقترانات متشابك التي ادلي بها خليه Jurkat والعديد من الخلايا راجي (الاقتران المعقدة). انخفاض تركيزات الخلية (105 أو اقل الخلايا في 1 سم2 جيدا) سوف التفاف علي تشكيل الاقترانات الخلوية المعقدة ، ولكن قد لا يكون هناك ما يكفي من الخلايا التي تستحضر للتحليل اللاحق لحركه الاستقطاب (انظر أدناه) ، وهذا بدوره سوف تنخفض أيضا فرص العثور علي والصورة الناشئة الاقترانات متشابك.
يمثل الشكل 2 لقطات الشاشة المقابلة لمعلمات التصوير المستخدمة في التقاط المتزامن لفلوروتشروميسين المختلفين (cmac و GFP-CD63) باستخدام البرامج المناسبة (مثل نيكون NIS_AR) في تجربه الفاصل الزمني التمثيلي المقابلة للفيديو 1.
الفيديو 1 (الخلايا العصبية المناعية ، الخام) يمثل اللمفاوية الليمفاوية T التعبير عن CD63 (علامة من الهيئات متعددة الخلايا-mvb ، الحويصلات الخضراء) وتشكيل المشبك المزدوج بين زنزانة 1 jurkat و 2 الراجي الخلية الموسومة مع cmac ، في الأزرق (واحد منهم يخضع لأحاطه). تم تسجيل الحركة في وقت واحد من MVB داخل الخلية Jurkat نحو المناطق المشبك (التقاط معدل الإطار = 1 الإطار كل 20 ثانيه ل GFP-CD63 ؛ سرعه استنساخ الفيديو = 2 إطارات في s). وقد تم الحصول علي الاقترانات المتشابكة والتي اتبعت البروتوكول الموصوف أعلاه (الخطوة 6.2) ، والتي سمحت بتصوير الاشتباكات العصبية الناشئة (الفيديو 1). وقد اجري التقاط المتزامن لقناتي CD63 و CMAC الفلوريتين باستخدام برنامج مناسب (اي ، المركز الجديد ، جدول المواد). يمثل الفيديو البيانات الاوليه من تجربه الممثل والفاصل الزمني. تم تعريف نظام التركيز التلقائي بازاحه مناسبه فيما يتعلق بخلايا راجي المتجهة إلى أسفل الزجاج ، لضمان التركيز الثابت علي طول التجربة.
الفيديو 2 (الوصلات العصبية المناعية ، بعد تفكيك) يتوافق مع الفيديو 1، ولكن تم تنفيذ تفكيك الصور القناة CD63 الفلورية من خلال استخدام البرمجيات المناسبة لتفكيك (اي huygens) ، وذلك باستخدام "حقل واسع" الخيار البصري والمعلمات البصرية المناسبة (الخطوة 8). وقد أدمجت هذه القناة الحلزونية في وقت لاحق في القناة الاوليه CMAC. ومن الواضح ان تحسين كل من نسبه الاشاره إلى الضوضاء وحده الصورة. وقد أجريت عمليه التفكيك بعد الاكتساب ، علي النحو المبين أعلاه. للحصول علي تفاصيل محدده فيما يتعلق ببرنامج التفكيك الحلزوني ، يرجى الرجوع إلى4.
الفيديو 3 (المشبك المناعي ، بعد تحديد وتلطيخ المناعي) يمثل z-المكدس (z-الخطوة الحجم = 0.8 μm ، 5 إطارات) من الملحق IS ثابته بعد الخطوة 6 من البروتوكول (تثبيت الأسيتون). بعد التثبيت ، تم تنفيذ المناعي بعد البروتوكولات القياسية25 باستخدام phسبائك لتصور F-actin (الأخضر) ، ومكافحه CD63 لتصور mvb (أرجواني) ، ومكافحه γ-الأنابيب لتصور mtoc (الأحمر). CMAC (الأزرق) تسمي خليه الراجي. وفي وقت لاحق ، تم تصوير المترافق بواسطة النقش والعديد من القناات التي تم تفكيكها باستخدام الخيار البصري "الميداني الواسع" والمعلمات البصرية المناسبة (الخطوة 7). وتم دمج القناات المفككة لاحقا في القناة الاوليه ، كما هو مبين في اللوحات المختلفة (CMAC بالاضافه إلى النقل العابر ، CMAC plus Phallodin ، CMAC plus المضادة لCD63 و CMAC زائد المضادة لγ ، علي التوالي). السهم الأبيض تسميات المشبك ، في حين تسميات السهم الأخضر MVB والسهم الأصفر تسمي MTOC. وقد تم شرح القياس الكمي المفصل لاستقطاب MVB و MTOC في مكان آخر25.
وينطوي النهج المعروض هنا علي تكوين تصريفات من الخلية إلى الخلية ، وفي الوقت نفسه ، الحصول علي الفاصل الزمني بواسطة المجهر الفلوري الواسع النطاق (WFFM) ، تليها معالجه الصور (التفكيك بعد الاستحواذ). هذا التكتيك تحسين نسبه الاشاره إلى الضوضاء (الاستخبارات) من الصور ، وتعزيز القرار الزمني ، وسمح الاستحواذ متزامنة لعده فلوروتشروميس في الناشئة الاقترانات متشابك4. الاضافه إلى ذلك ، يتم مطابقه البروتوكول بشكل جيد مع أساليب تثبيت الخلية اللاحقة لنقطه النهاية (بارافورمالدهيد ، الأسيتون أو الميثانول) ، مما يسمح بمزيد من تلطيخ المناعة والتحليلات25 (فيديو 3). هذا البروتوكول هو أيضا متوافق مع المسح الضوئي بالليزر المجهر البؤري وغيرها من التقنيات المجهرية الدولة من بين الفن.
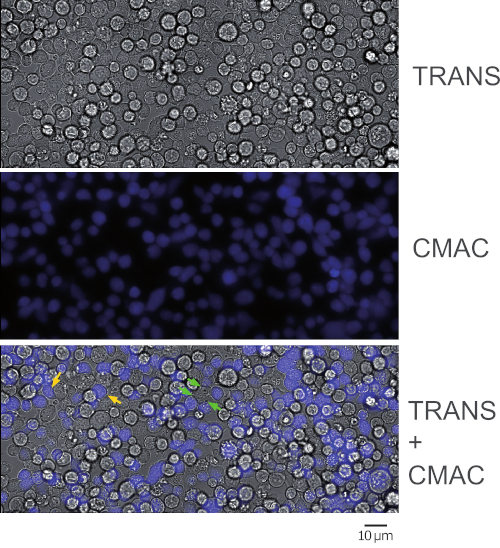
الشكل 1: تمثيل مجال المجهر مزدوج الحجم من التصريفات متشابك. تمثل الصورة الإطار الأول من تجربه ممثل وفاصل زمني بعد البروتوكول. تظهر اللوحة العلوية قناه النفاذيه ، وقناه CMAC الخاصة باللوحة الوسطي (خلايا راجي) واللوحة السفلية علي حد سواء القناات المدمجة. الأسهم الصفراء تسميه بعض الاقترانات متشابك ، كمرجع. الأسهم الخضراء تشير إلى اقتران متشابك معقده (اي خليه Jurkat إنشاء الاشتباكات العصبية مع أكثر من خليه راجي). القبض مع 40x EWD (0.6 NA) الهدف. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
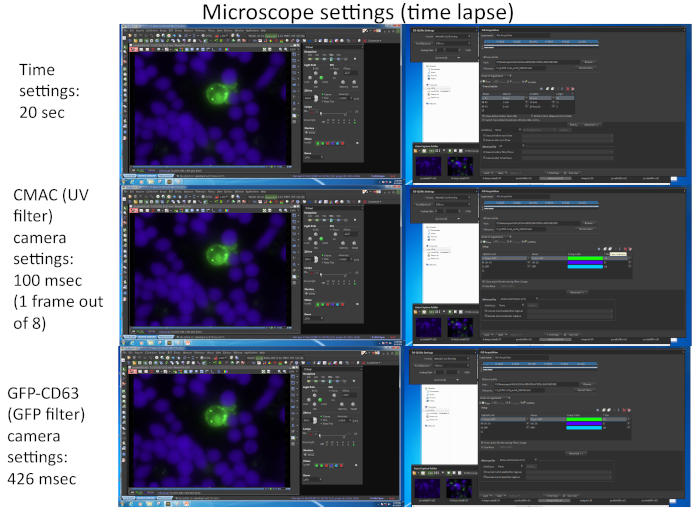
الشكل 2: إعدادات المجهر الفاصل الزمني. تتطابق الصورة مع العديد من لقطات الشاشة المقابلة لمعلمات التصوير المستخدمة في التقاط المتزامن لفلوروتشروميسين المختلفين (CMAC و GFP-CD63) باستخدام البرامج المناسبة (مثل نيكون NIS_AR) في تجربه الفاصل الزمني التمثيلي المقابلة للفيديو 1. تم التقاط كل اطار لقناه CD63 كل 20 ثانيه. تم التقاط اطار واحد فقط لقناه الاشعه فوق البنفسجية من ثمانيه إطارات لقناه GFP من أجل الحفاظ علي سلامه الخلايا علي طول التجربة. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
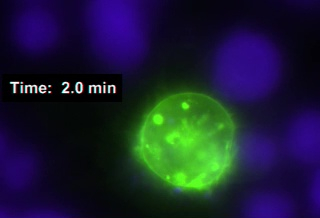
فيديو 1: العصبية المناعية التي ادلي بها خليه Jurkat التعبير عن CD63 ، البيانات الخام. [راجي] [ب] خلايا يوصف مع خليه تعقبت زرقاء ([كمك], [بلو]) كان ينبض مع [ك] ل 30 [مين] و [جوسكت] مع [جوركات] خلايا يبدي [غب-CD638 ] كان شكلت. وتم التقاط الهفوات الزمنيه المقابلة لقناات CD63 و CMAC (20 ثانيه لكل اطار ؛ سرعه استنساخ الفيديو = 2 إطارات في الثانية) ويظهر مثال تمثيلي. القبض مع 60x خطه APO (1.4 NA) الهدف. يرجى النقر هنا لمشاهده هذا الفيديو (انقر بزر الماوس الأيمن للتحميل).
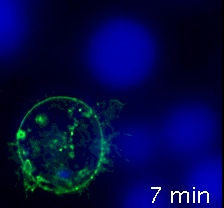
فيديو 2: العصبية المناعية التي ادلي بها خليه Jurkat التعبير عن CD63 ، بعد تفكيك. نفس الفيديو 1، ولكن تم تفكيك الصور باستخدام برنامج تفكيك. ومن الواضح ان نسبه الاشاره إلى الضوضاء المحسنة والحده المحسنة ، بسبب التخلص من الملوثات من التركيز الفلوري. يرجى النقر هنا لمشاهده هذا الفيديو (انقر بزر الماوس الأيمن للتحميل).
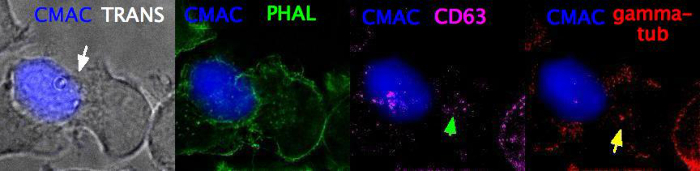
فيديو 3: ثابت ومناعي مناعي المشبك. تظهر الصورة ممثلا ثابتا للمتقارن المتشابكة بعد الخطوة 7 من البروتوكول والمناعي اللاحق. CMAC (الأزرق) تسميات الخلايا راجي ، النفاذيه (ترانس) لإظهار التقارن متشابك (السهم الأبيض) ، والتسميات Phمسبوكه F-actin (الأخضر) ، والمضادة لCD63 تسميات MVB (الأرجواني ، السهم الأخضر) والمضادة لγ--أنابيب التسميات MTOC وقد تم تصوير هذه القناات بالنقش والتفكيك والدمج كما هو مبين. يتضمن الفيديو المكدس Z (حجم z-الخطوة = 0.8 μm ، 5 إطارات). السهم الأبيض تسميات منطقه الاتصال متشابك ، في حين ان السهم الأخضر تسميات MVB والسهم الأصفر تسمي MTOC. يرجى النقر هنا لمشاهده هذا الفيديو (انقر بزر الماوس الأيمن للتحميل).
Discussion
والحد من هذا البروتوكول هو ان ليس كل الاشتباكات العصبية سوف تكون موجهه بشكل مثالي عمودي علي المحور البصري. باستخدام هذه التقنية ، لا توجد طريقه للتنبؤ و/أو التاثير علي الاتجاه المثالي لتصوير المشبك المناعي. لحل هذه المشكلة ، ونحن استبعاد من التحليلات اللاحقة جميع الاشتباكات العصبية التي تم التقاطها عشوائيا انه في النهاية لا تستوفي المعايير المثالية. هذه الاشتباكات العصبية ، بما فيه الكفاية ، ليست متكررة جدا. ومع ذلك ، فمن الممكن التفاف علي هذا القيد باستخدام العديد من النهج التجريبية4.
ويمكن قياس الإفراج عن CD63 الاستقطاب (التحبيب) بواسطة تقنيات تكميليه أخرى مثل تلطيخ سطح الخلية من CD63 (CD63 أعاده التوطين إلى سطح الخلية) في الخلايا الحية (غير ثابته وليست تتخلل) ، بعد الخطوة 6 ، والغسيل والتثبيت اللاحقة ، كما هو مبين سابقا8. الاضافه إلى ذلك ، CD63 الإفراج عن exosomes تماثيل8،9 و exosomes القياس الكمي من قبل جسيمات متناهي تتبع التحليلات9،25 يمكن ان يؤديها. هذه النهج هي بالتاكيد متوافقة مع البروتوكول الخاص بنا ، شريطه ان يتم تنفيذ التثبيت بعد المناعي سطح الخلية من الخلايا الحية.
لقد وجدنا العدد المثالي من الخلايا (ل 1 سم2 جيدا في الشريحة 8-بئر الغرفة) هو 4 × 105 خلايا (2 × 105 خلايا راجي و 2 × 105 jurkat الخلايا) لأنها تلتزم بكفاءة إلى الجزء السفلي من البئر. ربط الكفاءة إلى البلاستيك (باستخدام الفيبروكتين) ، أو أسفل الزجاج (باستخدام بولي-L-يسين) ميكروروليدس ليست عاده مشكله. وقد تؤدي الأرقام الأعلى للخلايا إلى عدم وجود فجوات بين الخلايا الملتصقة ، ومن ثم الاقترانات المتشابكة المعقدة (الشكل 1) ؛ كلا الحالتين غير مرغوب فيها عند الاقتران خليه إلى خليه واحده تحتاج إلى ان تكون في العمر ، علي سبيل المثال ، MTOC أو التجارب الاستقطاب الحبيبية سيكريتوري. انخفاض عدد الخلايا قد يقلل من فرص العثور علي الاقتران ، وخاصه عندما يتم تحدي الخلايا Jurkat المقسمة مع APC لتوليد الاشتباكات العصبية. يرجى ملاحظه اننا لاحظنا ان حاضنه مرحله درجه الحرارة استقرت في مكان علي المجهر X/Y المرحلة قبل بداية البروتوكول (اي ، 1-2 h مقدما لتحقيق الاستقرار في المرحلة/المجهر الاعداد) يحافظ علي مستقره X ، Y ، Z المعلمات ، وهو أمر حاسم للتصوير السليم. سيعوض نظام التركيز التلقائي في نهاية المطاف الاختلافات Z الصغيرة.
عندما تستخدم بعض تقنيات المحولات الجينية مثل الكهربية للتعبير عن بروتينات تشيريك الفلورسنت (اي CD63) في المستنسخات Jurkat (فيديو 1) ، قد يموت جزء كبير من الخلايا بعد الكهربية. وهذا يمكن ان يكون مشكله لأنه علي الرغم من ان الخلايا الميتة لا تشكل الاشتباكات العصبية ، وعندما تكون في الزائدة علي الخلايا الحية ، التي تحولت ، فانها قد تتداخل مع تشكيل التصريفات التي ادلي بها الخلايا الحية ث. لقد وجدنا ان القضاء الدقيق علي الخلايا الميتة من الثقافات المقطوعة باستخدام متوسط التدرج الكثافة التالية البروتوكولات القياسية قبل خطوه تشكيل المرافقة يمكن ان تزيد في الواقع فرص لصوره بشكل صحيح الاقتران. الاضافه إلى ذلك ، انخفاض كفاءه التحويل (< 20 ٪) يمكن ان يكون تحذيرا مهما لان هذا ، جنبا إلى جنب مع كفاءه تشكيل المقارن المعتدل (حوالي 60 ٪)25، سوف يقلل من احتمال العثور علي الاقترانات التي ادلي بها الخلايا المحولة. هذه ليست مشكله عندما يتم استخدام الخلايا غير المحولة للحصول علي التصريفات في التجارب نقطه النهاية والتثبيت اللاحقة. الشرائح 8 microwell الغرفة متوافقة مع البروتوكولات المناعية التقليدية. وهذا يزيد من مرونة البروتوكول المذكور أعلاه لأغراض مختلفه. التثبيت مع الأسيتون يمكن ان يكون مشكله في الاعتبار عند استخدام الشرائح الغرفة مع الآبار البلاستيكية القاع. ومع ذلك ، هناك متاحه تجاريا 8 microwell الشرائح المجهر الغرفة التي تحتوي علي قيعان الزجاج ، والتي هي متوافقة مع تثبيت الأسيتون. قم بازاله الاغطيه البلاستيكية عند استخدام الأسيتون لإصلاح الخلايا المستزرعة في 8 شرائح الحجرة الزجاجية السفلية الصغيرة.
فمن المستحسن ان يتم تجهيز المجهر مع المرحلة XY الميكانيكية ، والمحركات برج التحصين الموسع-فلوري ونظام التركيز التلقائي (علي سبيل المثال ، نظام التركيز المثالي) أو ملاحق ما يعادلها. عندما يتطلب الاستحواذ المتعدد الآبار25، فان نظام التركيز التلقائي سيضمن التركيز الثابت علي طول التجربة. وتشير التجربة السابقة إلى انه من خلال إنشاء أزاحه التركيز المناسبة علي خلايا راجي ، قد يتم تعويض كل من حركه الخلايا التائية (الفيديو 1) وحركات شريحة المرحلة/الغرفة المجهر في التجارب المتعددة النقاط XY. هذا هو في الواقع مريحه للتقاط الفاصل الزمني المتعدد البئر.
وقد استخدمت كاميرا باللونين الأسود والأبيض ، والملونة والمبردة المشحونة إلى جانب (الجهاز) ولكن الحساسية العالية ، مضان العلمية التكميلية المعادن أكسيد أشباه الموصلات (sCMOS) الكاميرا هو مرغوب فيه ، لان هذا سوف يقلل من مرات التعرض للكاميرا ، مرات التعرض الكاميرا القصيرة التي استخدمناها (الترتيب شكل 100 مللي ثانيه إلى 500 مللي ثانيه) مع مصراع التلقائي مضان يسمح التقاط الفاصل الزمني لفترات طويلة (تصل إلى 24 ساعة) مع دقه الوقت المناسب (1 اطار في الدقيقة الواحدة أو اقل ، لمده تصل إلى 16 XY المواقف) المرحلة اليه يسمح متعدد نقطه (XY) التقاط ويزيد من فرصه للعثور علي وصوره الناشئة والنامية الاشتباكات العصبية في الاتجاه المثالي ، ولكن أيضا يسمح اكتساب الصورة في الشرائح الغرفة المتعددة عندما استنساخ Jurkat مختلفه تحتاج إلى ان تكون في وقت واحد مترافق25. الفتحة العددية العالية للهدف (اي 60x ، 1.4) ضرورية من أجل الحصول علي أفضل النتائج عند تحليل حركه المرور من حبيبات سيكريتوري.
الراجي-انظر-Jurkat يشكل نموذجا المشبك المناعي الراسخة التي تم استخدامها من قبل عدد لا يحصي من الباحثين منذ ان وصفت أصلا11. لقد قمنا بتكييف بروتوكولنا لهذا النموذج من أجل صوره صحيحه في المراحل المبكرة من تشكيل IS. وكان هدفنا هو تحسين النهج المبكرة20 التي اتبعت سابقا لدراسة الاستقطاب من mtoc وآلات سيكريتوري نحو IS. ومن اللافت ان الاقترانات المصنوعة من هذا البروتوكول تنتج F-actin أعاده التنظيم في المشبك ، وتكوين SMAC الكنسي ، في الوقت ذاته إلى حركه المرور المستقطبة MVB25. وتم أيضا تحليل هذه الاحداث الحاسمة والتحقق من صحتها بواسطة المجهر البؤري25.
يتواجد فروق حركيه في حركه مرور مستقطبه بين أنواع مختلفه من [هو]. علي سبيل المثال ، يتم النقل المستقطب لحبيبات الليتيك من CTLs في ثوان معدودة أو دقائق قليله جدا ، في حين ان العديد من الحويصلات المحتوية علي السايسيسيني من الخلايا اللمفاوية التائية تاخذ من دقائق تصل إلى عده ساعات حتى النهاية. يجب ان تؤخذ هذه الاختلافات الزمنيه في الاعتبار مسبقا ، من أجل تصميم أفضل استراتيجية واختيار النهج الأكثر ملاءمة التجريبية والتصوير ، لأنه بالنسبة لبعض الصور الحيلة (اي المسح بالليزر المجهر البؤري (LSCM)) ، يمكن ان يكون الوقت عاملامقيدالان وقت التقاط هو اعلي بكثير من وهذا ليس قيدا عندما يستخدم المجهر الفلوري الواسع النطاق (WFFM) كما هو موصوف في البروتوكول أعلاه. منذ في ctls ، والاستقطاب من mtoc نحو المشبك يدوم سوي بضع دقائق3،6،17، الحالة الخاصة المختلفة-من المجهر الفن النهج المختلفة لتلك الموصوفة هنا (ولكن إيواء القرار المكانية والزمانيه اعلي) ضرورية من أجل صوره صحيحه هذه نقاط الاشتباك العصبي26،27، أساسا هذه عاليه الاستبانة, ويمكن أيضا استخدام النهج الجديدة للتصوير العصبية التي ادلي بها الخلايا الليمفاوية Th, علي الرغم من الأسباب الاقتصادية و/أو اللوجستية (اي, المعدات الاساسيه اللازمة لبعض من هذه التقنيات التصوير يكلف 6-7 مرات أكثر من واحد وصفها هنا) يمكن ان تشكل بالتاكيد حقيقة ان يتم التي ادلي بها اللمفاويات Th هي طويلة الأمد ، والظرف الذي في الخلايا الليمفاوية ال MTOC ، اللمفاويات التي تحتوي علي إفراز الحويصلات و MVB تاخذ من عده دقائق تصل إلى ساعات لنقل وقفص الاتهام إلى IS22، يجعل هذا البروتوكول هو الأمثل ، ونهج بأسعار معقول
وتشكل البعثة ، بالاقتران مع تفكيك الصورة بعد اكتسابها ، نهجا مثيرا للاهتمام ولا تدعم هذه الاستراتيجية الأسباب الاقتصادية فحسب. ويمكن تحسين القرار الفقراء المتاصله في المحور Z (التحذير الأكثر اهميه من هذه التقنية) باستخدام ما بعد الاستحواذ صوره تفكيك4 (قارن الفيديو 1 مع الفيديو 2). وتستخدم عمليه التفكيك طريقه معالجه الصور المستندة إلى الحساب ، والتي يمكن ان تحسن نسبه الاشاره إلى الضوضاء ودقه الصورة والتباين27 حتى 2 مره ، وصولا إلى 150-100 نانومتر في محور XY و 500 نانومتر في المحور Z4.
استخدام الحساسية العالية ، وسرعه قراءات عاليه ومجموعه ديناميكية واسعه ، والكاميرات الجديدة الفلورية sCMOS تحسين نوعيه الصور وسوف تقلل من التبييض فلوري. تسمح المرونة التي يوفرها بروتوكول اقتران الخلية بالخلية الموصوف هنا بالجمع بين النهج الخلوي الموصوف مع العديد من تقنيات المجهر الفني ، سواء في الخلايا الحية ولكن أيضا في الخلايا الثابتة ، والنتيجة المتوقعة سيحسن بالفعل معرفتنا بالمشبك المناعي.
علي الرغم من اننا قد نفذت والتحقق من صحة البروتوكول باستخدام سهله التعامل معها ، وخطوط الخلايا الراسخة ، والمحتمل ان النهج قد يسمح التصور للتفاعلات الفسيولوجية أكثر عندما يتم استخدام خلايا T الابتدائية وأنواع مختلفه من الخلايا العرض مستضد (مثل الخلايا الجذعية من الضام)5 في هذا السياق ، تم تمديد هذا البروتوكول أيضا والتحقق من صحتها باستخدام superantigen (سيب)-نابض الماوس EL-4 خط الخلية المستخدمة APC ، لتحدي الماوس الابتدائية T اللمفاويات9. في الواقع اللمفاويات الاوليه T ، CTLs علي وجه الخصوص ، وقدمت المزيد من الاتصالات القصيرة الأجل والحيوية متشابك (انظر الفيديو التكميلي 8 في المرجع9) لأولئك الذين ينظر اليهم مع نموذج انظر-راجي وجوركات. يمكن ان ينظر إلى تنوع وسائط الاتصال متشابك أفضل للتفاعلات الاساسيه T-الخلية مع الخلايا الجذعية أو الخلايا B في معادلات الانسجه في المختبر ثنائي الابعاد التي يمكن أيضا تسجيلها وتحليلها باستخدام هذا البروتوكول. الاضافه إلى ذلك ، وبصرف الفضل عن المستضدات ، يمكن استخدام هذه التقنية لصوره أنواع أخرى من الاشتباكات العصبية. علي سبيل المثال ، يمكن استخدامه في نموذج الخلية T المحورة وراثيا ، مستضد محدده ، علي سبيل المثال باستخدام ovalbumin محدده murine OT1/OT2 النظام أو عن طريق التحويل من الخلايا T مع مستقبلات الخلايا T مستضد محدده. وهذا يفتح عددا لا يحصي من الإمكانيات التجريبية للمستقبل القريب.
Disclosures
ولا يعلن أصحاب البلاغ عن اي تضارب في المصالح.
Acknowledgements
ونحن نعترف بجميع أعضاء المختبر السابقين والحاضرين علي مساهمتهم السخية. وقد دعم هذا العمل بمنح من الوزارة الاسبانيه للاقتصاد والمنافسة (MINECO) ، والخطة الوطنية للبحوث Científica (SAF2016-77561 إلى M.I. ، التي منحت جزئيا بتمويل من الاتحاد الأوروبي). نحن نعترف كليه الطب (UAM) و Departamento de أوديوفيسواليس من كليه الطب لدعمهم والتسهيلات المقدمة لإنتاج الفيديو. نحن نعترف بان نيكون-أوروبا للدعم التقني والنظري المستمر والرائع. الوصول المجاني إلى هذه المقالة برعاية نيكون.
Materials
| Name | Company | Catalog Number | Comments |
| Camera Nikon DS-QI1MC | Nikon | MQA11550 | Cooled Camera Head |
| CMAC | ThermoFisher Scientific | C2110 | Cell tracker blue |
| JURKAT cells | ATCC | ATCC TIB-152 | Effector T lymphocytes |
| μ-Slide 8 well ibiTreat, μ-Slide 8 well Glass-Bottom | IBIDI | Cat.No: 80826, 80827 | Cell culture and cell imaging supports |
| Microscope NIKON Eclipse Ti-E | Nikon | NIKON Eclipse Ti-E | Wide-field fluorescence, fully-motorized microscope equipped with Perfect Focus System (PFS) option |
| Microscope Stage Incubator with 3-channel manual gas mixer and gas bubbler/ humidity module | OKOLAB | H201-NIKON-TI-S-ER | Cell culture atmosphere |
| Raji Cells | ATCC | ATCC CCL-86 | APC |
| RPMI medium GIBCO | ThermoFisher Scientific | 21875034 | Culture medium |
| Streptococcus Enterotoxin E (SEE) | Toxin Technology, Inc | EP404 | Bacterial Toxin |
| Software Huygens Essential | SVI | Huygens Essential | Image Deconvolution software |
| Software ImageJ | NIH | Image J | Image software |
| Software Nikon NIS-AR | Nikon | NIS-Elements AR | Image capture and analysis software |
References
- Fooksman, D. R., et al. Functional anatomy of T cell activation and synapse formation. Annual Review of Immunology. 28, 79-105 (2010).
- de la Roche, M., Asano, Y., Griffiths, G. M. Origins of the cytolytic synapse. Nature Reviews. Immunology. 16, 421-432 (2016).
- Griffiths, G. M., Tsun, A., Stinchcombe, J. C. The immunological synapse: a focal point for endocytosis and exocytosis. The Journal of Cell Biology. 189, 399-406 (2010).
- Calvo, V., Izquierdo, M. Imaging Polarized Secretory Traffic at the Immune Synapse in Living T Lymphocytes. Frontiers in Immunology. 9, 684 (2018).
- Friedl, P., den Boer, A. T., Gunzer, M. Tuning immune responses: diversity and adaptation of the immunological synapse. Nature Reviews. Immunology. 5, 532-545 (2005).
- Xie, J., Tato, C. M., Davis, M. M. How the immune system talks to itself: the varied role of synapses. Immunological Reviews. 251, 65-79 (2013).
- Colombo, M., Raposo, G., Théry, C. Biogenesis, Secretion, and Intercellular Interactions of Exosomes and Other Extracellular Vesicles. Annual Review of Cell and Developmental Biology. 30, 255-289 (2014).
- Alonso, R., et al. Diacylglycerol kinase alpha regulates the formation and polarisation of mature multivesicular bodies involved in the secretion of Fas ligand-containing exosomes in T lymphocytes. Cell Death & Differentiation. 18, 1161-1173 (2011).
- Mazzeo, C., Calvo, V., Alonso, R., Merida, I., Izquierdo, M. Protein kinase D1/2 is involved in the maturation of multivesicular bodies and secretion of exosomes in T and B lymphocytes. Cell Death & Differentiation. 23, 99-109 (2016).
- Mittelbrunn, M., et al. Unidirectional transfer of microRNA-loaded exosomes from T cells to antigen-presenting cells. Nature Communications. 2, 282 (2011).
- Montoya, M. C., et al. Role of ICAM-3 in the initial interaction of T lymphocytes and APCs. Nature Immunology. 3, 159-168 (2002).
- Abraham, R. T., Weiss, A. Jurkat T cells and development of the T-cell receptor signalling paradigm. Nature Reviews. Immunology. 4, 301-308 (2004).
- Huse, M., Quann, E. J., Davis, M. M. Shouts, whispers and the kiss of death: directional secretion in T cells. Nature Immunology. 9, 1105-1111 (2008).
- Peters, P. J., et al. Cytotoxic T lymphocyte granules are secretory lysosomes, containing both perforin and granzymes. The Journal of Experimental Medicine. 173, 1099-1109 (1991).
- Vignaux, F., et al. TCR/CD3 coupling to Fas-based cytotoxicity. The Journal of Experimental Medicine. 181, 781-786 (1995).
- de Saint Basile, G., Menasche, G., Fischer, A. Molecular mechanisms of biogenesis and exocytosis of cytotoxic granules. Nature Reviews. Immunology. 10, 568-579 (2010).
- Huse, M. Microtubule-organizing center polarity and the immunological synapse: protein kinase C and beyond. Frontiers in Immunology. 3, 235 (2012).
- Yi, J., et al. Centrosome repositioning in T cells is biphasic and driven by microtubule end-on capture-shrinkage. The Journal of Cell Biology. 202, 779-792 (2013).
- Jang, J. H., et al. Imaging of Cell-Cell Communication in a Vertical Orientation Reveals High-Resolution Structure of Immunological Synapse and Novel PD-1 Dynamics. Journal of Immunology. 195, 1320-1330 (2015).
- Kupfer, A., Singer, S. J. Cell biology of cytotoxic and helper T cell functions: immunofluorescence microscopic studies of single cells and cell couples. Annual Review of Immunology. 7, 309-337 (1989).
- Dustin, M. L., Depoil, D. New insights into the T cell synapse from single molecule techniques. Nature Reviews. Immunology. 11, 672-684 (2011).
- Dustin, M. L. Supported bilayers at the vanguard of immune cell activation studies. Journal of Structural Biology. 168, 152-160 (2009).
- Jambrina, E., et al. Calcium influx through receptor-operated channel induces mitochondria-triggered paraptotic cell death. The Journal of Biological Chemistry. 278, 14134-14145 (2003).
- Fuss, I. J., Kanof, M. E., Smith, P. D., Zola, H. Isolation of whole mononuclear cells from peripheral blood and cord blood. Current Protocols in Immunology. , 1 (2009).
- Herranz, G., et al. Protein Kinase C delta Regulates the Depletion of Actin at the Immunological Synapse Required for Polarized Exosome Secretion by T Cells. Frontiers in Immunology. 10, 851 (2019).
- Ritter, A. T., et al. Actin depletion initiates events leading to granule secretion at the immunological synapse. Immunity. 42, 864-876 (2015).
- Combs, C. A., Shroff, H. Fluorescence Microscopy: A Concise Guide to Current Imaging Methods. Current Protocols in Neuroscience. 79, (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved