Method Article
הדמיה של הסינפסה החיסונית של האדם
* These authors contributed equally
In This Article
Summary
בפרוטוקול זה מתמונות הן את המערך האימונוולוגי והן את תנועת הפרשה המקוטב הבאה לעבר הסינפולוגית החיסונית. שערי מעלה הסלולר נוצרו בין תא הסופר-אנטיגן פעמו של ראג'י (מתנהג כמו תא אנטיגן המציג) ו שיבוט ג'ורקאט (מתנהג כמו מסייע לימפוציטים T לימפופן).
Abstract
מטרת השיטה היא ליצור סינפולוגית (is), דוגמה של הקונאולוגי תא הנוצר על ידי תא אנטיגן המציג (APC) ו מסייע העוזר לימפוציטים (Th) תא, ו להקליט את התמונות המתאימות לשלבים הראשונים של ה הוא היווצרות ואירועים הסחר הבאים (המתרחשים הן בנגמ ו בתא Th). אירועים אלה יובילו בסופו של דבר לפרשה מקוטבית ב-IS. בפרוטוקול זה, התאים ג'ורקאט התיגר עם בידור של סטיילוקוקוס E (ראה)-פעמו תאים כמודל תא סינפסה היה בשימוש, בגלל הקירבה של המערכת הניסיונית הזאת למציאות הביולוגית (Th תא-APC השערים הסינפטית). הגישה המוצגת כאן כוללת הקוניוגתא אל התא, רכישת זמן, רכישה, מיקרוסקופ פלואורסצטור רחב (WFFM) ואחריו עיבוד תמונה (לאחר הרכישה פירוק). זה משפר את היחס אות לרעש (SNR) של התמונות, משפר את הרזולוציה הטמפורלית, מאפשר את הרכישה מסונכרן של מספר fluorochromes המתעוררים השערים סינפטיות ומקטין הלבנת זריחה. בנוסף, הפרוטוקול הוא מותאם היטב עם נקודת הקצה פרוטוקולים הקיבעון תא (פאראפורמלדהיד, אצטון או מתנול), אשר יאפשרו החיסונית נוספת של כתמים וניתוחים. פרוטוקול זה תואם גם עם מיקרוסקופ מיקוד לייזר (LSCM) וטכניקות אחרות של מיקרוסקופ חדיש. כמו אזהרה הראשי, רק אלה הגבולות תא T-APC (המכונה ממשקים) שהיו בדיוק 90 ° זווית למישור המוקד לאורך ציר Z יכול להיות מדומה ומנותח כראוי. מודלים ניסיוניים אחרים קיימים המקלים על הדמיה בממד Z ובניתוח התמונה שלהלן, אך גישות אלה אינן מחקות את המשטח המורכב והלא סדיר של APC, ועשויים לקדם אינטראקציות לא פיזיולוגיות ב-IS. לפיכך, הגישה הניסיונית המשמשת כאן מתאימה להתרבות ולהתמודדות עם כמה מורכבויות ביולוגיות המתרחשות ב-IS.
Introduction
המטרה העיקרית של השיטה היא ליצור הסינפולוגית (IS) תא אל התא שערים שנוצרו על ידי תא אנטיגן המציג (APC) פעמו עם ראה superantigens ו מהווה מבנה של תא, ולרשום את התמונות המתאימות לשלבים הראשונים של היווצרות הסינפולוגית ואירועי הסחר הבאים (המתרחשים גם בנגמ ש ובתא Th), שבסופו של דבר יוביל לפרשה מקוטמת ב-IS. הקמתה של הוא על ידי לימפוציטים על הכריכה של קולטן התא שלהם (tcr) כדי אנטיגנים המאוגדים mhc-II על הנגמ מארגנת מופע דינמי מאוד, נזיל וקריטי מעורב אנטיגן ספציפי, הומוסר הסלולר תגובות החיסון1,2. Is מוגדר על ידי היווצרות של מורכבים סופרא מולקולרית ולקולרית הפעלה מורכבת (smac) דפוס המאופיינת בתהליך התארגנות מחודש3. בבנייה על ידי לימפוציטים T עם APC, הקיטוב של הסוד ושלפוחיות לקראת הוא נראה מעורב הפרשה מקוטב בפער סינפטית. מכונות ממוקדות זה נראה בלתי פוסק לספק את המערכת החיסונית עם התכסיס מוסדר להפליא כדי לשפר את היעילות של תפקידים הפרשה קריטית של לימפוציטים T, תוך הפחתת לא ספציפי, cytokine-בוררויות הגירוי של תאים העובר, הריגת תאייעד לא רלוונטייםהתאבדות האפוטוטית באמצעות מוות תאים ההפעלה המושרה (
התוצאה של IS משתנה על אופיו של לימפוציט T ו APC. המגע הסינפטית של תאים Th (בדרך כלל CD4 + תאים) עם APC מציג אנטיגן משויך MHC-II מייצרת את ההפעלה של התא T (הפרשה cy, התפשטות, וכו ') ו, במקרים מסוימים, אפופטוזיס באמצעות AICD4. עבור לימפוציטים T ציטוטוקסיים (CTLs) (בעיקר CD8 + תאים) אינטראקציה עם ה-APC הצגת אנטיגן המשויכים MHC-I, התוצאה שונה על גירוי מראש או לא של ה-CTLs עם אנטיגן. לפיכך, ה-CTLs התמים מזהה אנטיגן-MHC-I מתחמים על APC הם "מוכן" כדי להרוס את תאי היעד ואת הפער. בנוסף להקים את הסינפסות עם תאי היעד (כלומר, תאים הנגועים בווירוסים או בתאי גידול) בהפקת השמדה תא ספציפית אנטיגן5,6.
הפרשה המקוטמת של האקזומים בסינפולוגית היא אזור פיתוח ומאתגר של מחקר המעורב בתגובות החיסון הרלוונטיות7. זה הוכח כי גופים multivesicular (mvb) נושאת intraluminal ושלפוחיות (ilvs) ניסיון התחבורה מקוטב לקראת IS8,9 (וידאו 1) על גירוי tcr עם אנטיגן. המיזוג של אלה mvb בקרום סינפטית מעורר שלהם degranulation ושחרורו של ilvs כמו אקסוזומים על שסוע סינפטית8,10. זה מתרחש בנוי על ידי ה-סוג התאים ג'ורקאט שהיו מאותגרים עם ראה superantigen מצופה תאים ראג'י מתנהג כמו APC11, tcr-מגורה CD4+ Lymphoblasts, ו-ctls מוכן. לפיכך, הסינפסות שנעשו על ידי התאים הג'ורקאט מהווים מודל חשוב לחקר התנועה הפרשה המקוטב של אקסוזומים. בנוסף, מספר עשורים של חקירה הראו כי תובנות בסיסיות רבות לתוך איתות TCR הגיעו מחקרים עם קווי T-cell השתנה, ואכן הידוע ביותר של מערכות אלה מודל הוא לוקמיה בבית T-cell קו12.
היווצרות של מפותחת מייצרת מספר תוצאות ביולוגיות מכריע, כולל הפעלת תאים Th, הפעלה של CTLs נאיבי או להרוג תא היעד על ידי מוכן, מלבד anergy או AICD5. לכן, ישנם שני סוגים עיקריים של הפרשה הוקמה על ידי לימפוציטים T כי התוצאה מגוונת מאוד, אבל באופן דומה, החיסונית מתפקדת פונקציות1,6,13. מצד אחד, הוא מ לימפוציטים T מטוציטוטית (CTLs) מעורר קיטוב מהיר (החל משניות עד כמה דקות) של גרגירים ליטיים (נקרא "הפרשה ליזוזומים") לקראת IS. הדגרציות של הגרגירים הליטיים מעורר את הפרשת הנקבים ואת הגרזיזים לחריץ הסינפטית14, שהם מולקולות פרו-אפוטוטיות. הניקובים המופרשים והגרזים לאחר מכן יגרמו להרג של תאי היעד15,16. , לאורך מספר דקות בלבד. כאשר תאי המטרה נרצחים3,17 זה כנראה בגלל הנסיבות כי המשימה האופטימלית של CTL דורש קשר מהיר וזמני על מנת להפיץ כמו שביתות קטלני רבים ככל האפשר לתאי יעד רבים3,17. לעומת זאת, לימפוציטים Th כגון תאים של ג'ורקאט ליצור יציב, ארוך עומד הוא (מ 10-30 דקות עד שעות), שכן זה נראה הכרחי הן הפרשה כיוונית ובלתי פוסקת של מגרה ציטוקינים3,17. ציטוקינים הם גם מוקפים הפרשה שלפוחיות וחלקם (כלומר, IL-2, IFN-γ) ניסיון הובלה מקוטב ל17 והפרשה. אחד המאפיינים החיוניים של IS היא היווצרות של הקשר גישוש, חלש וחולף בין התא T ו APC (וידאו 1) אשר עשוי לייצר אינטראקציה חזקה יותר הקמתה של בוגרת, מתן כי tcr מזהה את מתחמי אנטיגן-mhc המתאים ושיתוף התקשרויות שכונתיות מבוססים5. הן ההתחלה של המגעים הראשוניים והקמתה של בוגרת, פרודוקטיבי לחלוטין, הם תהליכים סטוכסטיים, מהירים ואסינכרוניים מיסודם5,18. יתרה מזאת, יש תדר נדיר ביצירת שערי מעלה תא אל התא19, אשר עשוי להוות אתגר עבור טכניקות הדמיה (עיין בסעיפים תוצאות ודיון).
אתגר עיקרי נוסף בבדיקת הקיטוב של מרכז המיקרו-כדורית (MTOC) וגרגרי הפרשה ב לימפוציטים T הוא כי התהליך כולו הוא מהיר (שניות עד כמה דקות), במיוחד ב-CTLs. בהתחשב בעובדות האלה, הגישות המוקדמות ביותר להתמודד עם נקודת קצה אסטרטגיה שבה APC/היעד תאים לימפוציטים T מעורבים במשותף והתכנס על ידי מהירות נמוכה צנטריפוגה, כדי לטובת היצירה המשלים תא לתא, מודב במשך כמה דקות, קבוע ולאחר מכן הוערך עבור העתקת MTOC ו/או הפרשת שלפוחיות לעבר IS20. גישה זו יש שתי מגבלות משמעותיות: לא הושגו נתונים הסחר התוסס ורמות גבוהות של רקע mtoc/הפרשה בגרגרים קיטוב הושגו, כנראה בשל האופי סטוכסטי של הקמתה18. יתר על כן, כל מתאם בין tcr-מגורה, הראשונית האירועים איתות (כלומר, הסידן תאיים עולה, אקטין התארגנות מארגון) ו שלפוחית הסוד קיטוב הוא בעייתי לחקור. לפיכך, הוראות הכרחי לדימות מתאים של ה-it בתאי החיים משתלבים כדי לשפר את החומריות התא לתאים, כדי לסנכרן את הדור של IS ו, במידת האפשר, כדי להבטיח את הקמתה של שערי מעלה הסלולר במיקרוסקופ מוגדר XY שדות ו Z תנוחות. מספר אסטרטגיות פותחו על מנת למנוע את כל הבעיות הללו. זה מחוץ לטווח של הנייר הזה כדי להסביר את השיטות האלה, היתרונות שלהם ואת החולשות. עיין בסקירות שפורסמו בעבר בהתמודדות עם נקודות חשובות אלה1,4,5,21.
העובדה כי הוא עשה על ידי לימפוציטים לאורך זמן, ואת הנסיבות כי ב לימפוציטים Th MTOC, lymphokine-המכיל בגרגרים הפרשה MTOC לקחת מתוך כמה דקות עד שעות כדי לעבור ולעגן את זה22 עושה את TH-APC הוא מועמד אידיאלי לדימות באמצעות הפרוטוקול המתואר כאן.
Protocol
1. הכנת שקופיות כדי לדבוק תאים ראג'י
- הוסף 150 μL של fibronectin (100 μg/mL) לשקופית קאמרית 8 למיקרוגל (שקופית קאמרית בתחתית הפלסטיק) ו-דגירה אותו עבור 30 דקות עד 1 h ב 37 ° c. המצע הדבקה זה יאפשר את הכריכה של תאים של ראג'י לתחתית היטב (שלב 2), היווצרות של שערי מחייה חיים עם התאים האלה (שלב 4) תאים, ו לכידת זמן ללכוד מיקרוסקופ (שלב 6), והוא גם תואם לאחר מכן עם הקיבעון האופציונלי הפרפורמלדהיד (שלב 7).
הערה: לקיבוע אצטון, שימוש בתחתית זכוכית שקופיות קאמרית פולי-L-ליזין (20 μg/mL) במקום fibronectin, מאז אצטון לפזר פלסטיק. 8 שקופית קאמרית למיקרוגל (1 ס"מ2 ובכן, 300 μl מקסימום נפח) או שווה ערך הוא פורמט גמיש והולם. - מפחית את fibronectin באמצעות מ200 μL אוטומטי הצינורות ולשטוף כל טוב עם 200 μL של PBS עבור 2 דקות עם טלטול עדין. . חזור על הכביסה עוד פעם אחת שקופית קאמרית ניתן לאחסן בשלב זה עם PBS עבור 1-2 שבועות ב 4 ° c.
2. הדבקת תאים של ראג'י לשקופיות קאמרית ו -7-אמינו 4-כלורומארין (CMAC) תיוג
- העברה 10 מ ל של confluent (1-2 x 106 תאים/mL) טרום התרבות של התאים של ראג'י ל 15 מ ל, צינור V-תחתון. מערבבים היטב ולהשתמש 10 μL כדי לספור את התאים על החדר של נויבאואר או שווה ערך.
- צנטריפוגה את התאים הנותרים ב 300 x g עבור 5 דקות בטמפרטורת החדר. . מנושף ומוותר על הסופרנטאנט
- השעיית מחדש בעדינות את הגלולה בתא בינונית תרבותית מלאה חם (RPMI 1640 שיושלם עם 10% FCS, 2 מ ג גלוטמין, 10 מ"מ HEPES, 100 U/mL פניצילין, ו 100 μg/mL סטרפטומיצין) בריכוז של 106 תאים/ml. השתמש במשוואה הנתונה להלן:
([] הראשוניתx vהראשונית = []סופי x vהסופי), שם []הראשונית מייצגת ריכוז התא הראשוני, Vהראשונית = נפח ראשוני של השעיית התא, []הסופי = ריכוז התא הסופי, vהסופי = הנפח הסופי של ההשעיה התא.
הערה: בהתאם לריכוז התא של התרבות ההתחלתית, ניתן לאסוף יותר תאים מאשר נחוצים, אך חשוב לשמור על התאים הנותרים בתרבות (37 ° c) עד לסיום הניסוי כדי למנוע בעיות פוטנציאליות (ראה שלב 2.6). - סמן תאים ראג'י כדי לאפשר זיהוי שלהם במהלך המערך המשלים סינפטית. בניסוי זה, 7-אמינו 4-כלורומארין (CMAC) תיוג מבוצעת בשלב 2.4.2.
- העבר את המספר הנדרש של תאים ראג'י במדיום התרבות לצינור 2 מ ל. עבור 8 שקופית קאמרית למיקרוגל, סך של 1.6 mL של השעיית התא נדרש (200 μL לכל טוב).
- הוסף CMAC לריכוז סופי של 10 μM. לשמור את התאים בחושך על ידי כיסוי הצינור עם רדיד אלומיניום מאז CMAC הוא רגיש בהיר. 200 μL מכיל 2 x 105 תאים ראג'י נדרשים לכל 1 ס מ2 טוב. כך, אם 8 בארות צריך להיות מוכן, 1.6 x 106 תאים ראג'י נדרשים.
הערה: תיוג תאים ראג'י עם עוקב תאים כחול (CMAC, עירור UV ופליטת כחול) מבדיל אותם מתאי Th כאשר שערי מעלה סינפטית נוצרות. הצבע הזה תואם עם מספרי הבלומגון ואצטון ומאפשר הליכים אימונופלסטיים נוספים. . נסה להימנע מתערוכות אור תיוג של תאים ראג'י בבריכה עם CMAC ואחריו מחדש לפני הדבקה של תאים ראג'י אל השקופיות הקאמרית מצופה fibronectin מבטיח את התיוג הומוגנית של תאים ראג'י עם CMAC בין בארות שונות.
- השהה מחדש את התאים המוכתמים של CMAC ולאחר שאיפתו של ה-PBS בשקופית הקאמרית משלב 1.2., העברה 200 μL של השעיית התא לכל באר של שקופיות הקאמרית המצופות של fibronectin שהוכנו בשלב 1.1-1.2. מודטה את השקופית הקאמרית ב 37 ° c, 5% CO2 עבור 30 דקות-1 h.
הערה: הדבקה ו-CMAC התיוג יהיה בו להתרחש בשלב זה וזה חוסך זמן. אנא שימו לב כי תאים ראג'י יהיה משקע במהירות וזהירות צריך להילקח כדי לשמור על ריכוז הומוגנית בתא ההשעיה לפני זריעה. אין צורך לשטוף CMAC בשלב זה על ידי צנטריפוגה, מאז כביסה CMAC יהיה בקלות רבה יותר לעשות בשלב 2.7 (כאשר התאים המסומנים התווית ראג'י כבר מודבקת את השקופיות קאמרית). מאז CMAC נוכח השעיית התא עודף גדול, הרקע הכחול פלואורסצנטית גבוה מדי כדי להבדיל את התאים מוכתם כחול. בדוק תאים פלואורסצנטית CMAC בשלב 2.7 לאחר כביסה CMAC. - ודא כי התאים ראג'י הם בתחתית הבארות על ידי טלטול עדין של השקופיות הקאמרית על המיקרוסקופ. ודא שהתאים מציגים מרווחים זה מזה ואינם מתאימים (איור 1, הלוח האמצעי). 50-60% ממפגש התאים מתאים.
- אם רוב התאים ביעילות לדבוק שקופית קאמרית לא פערים תא הם נצפו, לשטוף כל באר עם בינונית להשלים חם להשעות מחדש את המדיום עם 200 μL אוטומטי pipet לנתק עודפי תאים. בדוק את המפגש אחרי כל צעד מחדש.
- אם התאים אינם נצמדים, חזור על שלב הדבקה שוב והגדל את זמן הדבקה ו/או מספר התאים.
הערה: ניתן לעצור כאן, לחלל את השקופית הקאמרית ב 37 ° c, 5% CO2 לילה (O/N), ולהמשיך עם הפרוטוקול למחרת. נא לאשר את היום הבא שתאי ראג'י יישארו מסומנים ו-CMAC מתויג באמצעות מיקרוסקופ זריחה.
- לשטוף כל היטב שוב בזהירות עם חם בתוספת RPMI לחסל CMAC עודף ולבדוק פליטה כחולה עם מיקרוסקופ פלואורסצנטית (איור 1).
הערה: כדי למנוע את השימוש בשמן טבילה (דביק וצמיגי) ומטרות גבוהות של שמן צמצם מספריים, מרחק רב במיוחד (כלומר, 20x או 40x) מטרות ניתן להשתמש כדי לבדוק במהירות CMAC תיוג באמצעות מיקרוסקופ פלואורסצנטית.
3. דופק CMAC — שכותרתו תאים ראג'י עם סטייללוקוקו בידור E
- הוסף לכולם את הרעל E (ראה, 1 μg/mL) לכל באר. לראות יכול להיות מדולל בנוחות בינונית תרבות התא (פתרון עבודה ב 100 μg/mL) מן המניות ראה קפוא (1 מ"ג/mL ב PBS). השתמש ב-2 μL של פתרון העבודה של 100x לכל 200 μL למיקרוגל.
זהירות: השתמש בכפפות לשלב זה והיפטר מהקצה המשמש לתוך הקופסה החוצה. - שקופית קאמרית ב 37 ° c, 5% CO2 עבור לפחות 30 דקות. האפקט SEE נמשך לפחות 3-4 h.
הערה: ניתן להוסיף לבארות בנקודות זמן שונות בעת הצורך, אם מתוכננות כיוונוני זמן נפרדים (שלב 5) ו/או בהתאם לנקודת זמן ההתחלה עבור ניסויי נקודת הסיום (שלב 6).
4. הכנת התאים הג'ורקאט
- השתמש בתרבות הגדלה בעבר של התאים של ג'ורקאט (1-2 x 106 תאים/mL) לניסוי זה. השתמש בתאים מבקבוקון תרבות רגיל או מתוך העברה קודמת בעקבות פרוטוקולי אלקטרופורציה סטנדרטית, כפי שמתואר בעבר23. התרגום של התאים הג'ורקאט יאפשר ויזואליזציה של הזמן לפקיעה של התנועה של גרגרי הפרשה בתאי החיים. למשל, כאשר GFP-CD63 (סמן של MVB) מתבטא את התנועה של GFP-CD63-שלפוחיות מעוצבות ניתן להקליט (וידאו 1).
- צפו בתאים שמתחת למיקרוסקופ בניגוד לפאזה. אם עודף תאים מתים (> 20-30%) הם נצפו, לבצע הדרגתי צפיפות צנטריפוגה באמצעות פרוטוקולים סטנדרטיים24, כדי לחסל את עודפי התאים המתים (תאים מתים מוצג צפיפות גבוהה יותר מאשר תאים חיים) לפני השימוש (ראה דיון).
- העבר את התאים לשפופרת של 15 מ"ל, צינור V-תחתון, והשתמש ב-10 μL לספירה באמצעות הימוציטומטר.
- צנטריפוגה את התאים הנותרים כפי שמתואר בשלב 2.2. להיפטר supernatant ולהשעות מחדש את התאים באותו ריכוז כמו תאים של ראג'י (1 x 106/mL) באמצעות מדיום התרבות טרי, חם. בצע את שלבים 2.2-2.3.
- שמרו על התאים בתרבות (37 ° c, 5% CO2) תוך כדי המתנה לשלב 4.
הערה: באפשרות השנייה, מספר התאים החיים יהיה נמוך בהרבה מאשר בפעם הראשונה. לפיכך, שקול להשתמש בנפח התחלה גבוהה יותר של תרבות התא כדי לקבל מספיק תאים עבור הניסוי. מ 10 x 106 התאים הקובט לאלקטרופורציה לחשמל והעברה, רק 2-4 x 106 תאים שישרדו לאחר 48 h של העברה וכמה תאים אלה יאבדו במהלך השלב של ficoll. כך, קובט אלקטרופורציה אחד הוא בדרך כלל מספיק כדי לאתגר את התאים הדבקה לראות פעמו מ 8 בארות מיקרו (1.6 x 106 התאים האחרים בתאי החשמל הדרושים).
5. שיתוף משותף של ראג'י וג'ורקאט תאים
- קחו את השקופיות הקאמרית המכילות את התאים המסומנים ב-CMAC, לראות פעמו, מחוץ לחממה משלב 3.2. אין צורך לשטוף את CMAC בשלב זה מאז זה נעשה בעבר בשלב 2.7.
- מנושף בקפידה את המדיום התרבותי של כל באר, אחד אחד, מפינה אחת של הבאר באמצעות ה200 האוטומטי μL של צנרת. אל תתנו למדיום בתוך הבאר להתייבש לחלוטין.
- מיד להחליף את המדיום עם 200 μL של השעיית תאים מחדש של ג'ורקאט במדיום התרבות התא (1 x 106/mL) הכין בשלב 4.5. אם הדמיה בזמן ההדמיה מבוצעת, ללכת לשלב 6 מיד לאחר שלב זה, מאז התאים של ג'ורקאט נוטים למשקעים וליצור שערים סינפטיות במהירות רבה. לנוחיותכם, המיקרוגל המכיל את התאים לראות-פעמו, שאינם מקבלים זריעה עם התאים של ג'ורקאט בשלב זה יש לשמור עם המדיום התרבותי של התאים עד להמשך האתגר עם התאים הבאים. זה יאפשר באופן גמיש את האתגר הבא עם התאים הג'ורקאט לפקיעה זמן נוסף או הפוך קינטי, נקודת קצה גישות ניסיוני.
- אם הפקיעה בזמן הולך להתבצע, המשך במהירות לשלב 6. זה כרוך תרבות שיתוף עבור 1-2 h על החממה בשלב המיקרוסקופ או שווה ערך ב 37 ° c, 5% CO2 כדי לאפשר את היווצרות המשלים סינפטית ורכישת תמונה סימולטני. אם ניתוח נקודת הסיום, אך אין השגות בזמן, הוא מחושב לבדוק את המערך המשלים לאחר תקופת התרבות המשותף באמצעות המיקרוסקופ (כמו באיור 1) לפני תיקון התאים (שלב 7).
6. פקיעה בזמן הדמיה של שערי מעלה סינפטית המתעוררים
- הכינו את המיקרוסקופ ואת חדר הדגירה לפני ההדמיה. לדוגמה המוצגת ב-Video 1, הגדרות המיקרוסקופיה המפורטות מוצגות באיור 2.
הערה: אם הניסוי הפקיעה בזמן מתוכנן, כל הגדרות המיקרוסקופ ומשלים (תא התרבות הסביבה, וכו ') צריך להיות מוכן לפני הוספת ההשעיה של ג'ורקאט לשקופית הקאמרית עם תאים הדבק ראג'י. השלבים הבאים מתוארים עבור מיקרוסקופ מסחרי (טבלת חומרים). עם זאת, כל מיקרוסקופ הפוך פלואורסצנטית מצויד חממה תרבות התא ניתן להשתמש.- השתמש במיקרוסקופ עם טבילה בשמן 60x, פתח מספרי גבוה כאשר הדמיה תנועה מקוטב.
- ודא שמערכת המיקוד האוטומטית מופעלת וכוונן את ההיסט כדי למקד את התאים של ראג'י המאוגדים למשטח התחתון. עיין באיור 1, וידאו 1 ווידאו 2.
- לאחר התוספת של ג'ורקט לכל הטוב המכיל את התאים הדמנקים בשלב 5.3, במהירות לאתר את השקופית הקאמרית של המיקרוגל על החממה המחוממת (1-2 h) הבמה (כלומר, OKOlab) ולבחור כמה תנוחות XY עם המיקרוסקופ, שדות שבו הוא כנראה להקליט המתעוררים היא היווצרות שנעשו על ידי, למשל, תא של משקע של ג'ורקאט הנופל לתוך המוקד המיקרוסקופ.
- השתמש בחממה מחוממת מראש בשלב המיקרוסקופ מאז נצפתה כי בשלב הטמפרטורה מיוצב שומר יציבה X, Y, Z עמדות. הקריטריונים לשדה XY נוח הם: תאים ממוקדים ושאינם משולבים בשיטת ראג'י (כלומר, הצגת פערים בין התאים) והימצאות תאים של ג'ורקאט (ניתן לבדוק זאת באמצעות שילוב משדר וערוצי UV או GFP). התאים הג'ורקאט משקעים מהר מאוד (מספר דקות) בשקופית הקאמרית, והסיכוי שהסינפסות המתעוררים לתמונה תקטין את הזמן (איור 1). זה אפשרי או לסיים את הניסוי לאחר הזמן מוגדר לשגות או להמשיך שלב 7 ולתקן את שערי הבצומים לניתוח החיסונית הבאים וניתוחים.
הערה: ניתן לבחור עד 16 שדות מיקרוסקופ שונים מתוך עד 4 המיקרוגל שונים עבור בו, multi-היטב השגה הזמן רכישה עם ברזולוציה הטמפורלית הנכונה (1-2 דקות לכל מסגרת). המגבלה מסתמכת הן מספר ועוצמה (המשפיעים על התערוכה המצלמה) של fluorochromes מגוונת כדי להיות מצולם (תלוי במספר החלבונים המבוטא פלורסנט, מלבד CMAC). אחת הדרכים כדי להגדיל את קצב המסגרת היא הקלטה עבור ערוץ CMAC רק אחד מתוך כל "n" מסגרות הזמן עבור GFP (כלומר, n = 8, כפי שמוצג באיור 2), מאז התאים ראג'י הם דבקה התחתון היטב לא לזוז בקלות כמו התאים של ג'ורקאט. בנוסף, זה לתועלת הכדאיות התא, מאז חשיפה תכופים אור UV עלול לגרום נזק לתאים. נסה להתאים את קצב מסגרת הזמן ל 1 מסגרת כל 1 דקה או פחות (כלומר, 20 s לכל מסגרת בווידאו 1, איור 2) מאז הקיטוב של mvb לוקח כמה דקות עד שעות כדי להשלים. מיקרוסקופ מצויד הצריח ממונע-פלואורסצנטית מוטורי הלהקה המתאימה לעבור מסננים פלואורסצנטית או שווי ערך נחוצים כדי לבצע לכידת רב-ערוצי זה.
7. נקודת קצה היווצרות של שערי מעלה סינפטית וקיבעון
- אם מתוכננת רק ניסוי נקודת קצה (1-2 שעות דגירה כדי לאפשר היווצרות המשלים סינפטית מתאים), שקופית קאמרית ב 37 ° c, 5% CO2 עבור 1-2 h. בדוק היווצרות המשלים לאחר תקופת התרבות (כמו באיור 1) ו, לאחר מכן, לתקן את השערים עם אצטון או בלוניים (הקיבעון יהיה תלוי אנטיגנים ונוגדנים כדי לשמש את הimmunofluorescence הבאים). במקרה זה הדגירה אינה דורשת חממה בשלב המיקרוסקופ. נא עיין בסרטון וידאו 3 לקבלת דוגמה.
- כדי לתקן את התאים, לשטוף את הבאר על ידי טלטול עדין עם RPMI חמים (37 ° c) בינונית ללא FCS (אלבומין מן הסרום עשוי לזרז עם הקיבעון אצטון). משף ומוסיפים 200 μL של לייט או אצטון מקורר לכל טוב. מכפולת את השקופית הקאמרית בטמפרטורת החדר (RT) או על הקרח, בהתאמה, עבור 20 דקות.
הערה: לקיבוע אצטון, הרגיע מראש את אצטון ב-20 ° c ומלא הרגיע את השקופית הקאמרית ב -4 ° c. להסיר מכסים פלסטיים כאשר אצטון משמש כדי לתקן את התאים מתורבתים ב 8 היטב שקופיות החדר בתחתית הזכוכית. - לשטוף כל היטב פעמיים עם PBS ולהוסיף 200 μL של הפתרון הקוצ'ינג (PBS, 50 mM NH4Cl). הכנס את שקופית החדר ב -4 ° c.
הערה: בשלב זה, השקופית הקאמרית יכולה להישאר לפחות חודש אחד ב -4 ° c לפני ביצוע הפרוטוקול האימונולואוורנציה, כמתואר8. המכסה מונע אידוי.
8. עיבוד תמונה
- בצע פירוק תמונה לאחר הרכישה (כלומר הויגנס מנתח או שווה ערך, טבלת חומרים) של סדרות זמן ו/או תמונות סטילס של תאים קבועים. לפירוק באמצעות תוכנה מתאימה (כלומר, באמצעות האפשרות האופטית "שדה רחב" בהוגנס) והפרמטרים האופטיים הנכונים. הטיפול בעיבוד התמונה של פונקציית התפשטות הנקודה הנמדדת (PSF) של המיקרוסקופ4.
- לחילופין, השתמש בתוכנה כדי לחשב את PSF האידאלית על ידי טעינה אוטומטית של הפרמטרים האופטיים הכלולים בין המטא-נתונים מתוך קבצי המיקרוסקופ. אלו פרמטרים אופטיים מהווים אורך גל fluorochrome, שבירה אינדקס, צמצם מספרי של המטרה, ואת טכניקת ההדמיה (confocal וקד, שטח רחב, וכו ') ד.
- לאחר מכן, התוכנה הדמיה משתמשת PSF ואלגוריתמים מגוונים מגוונות (כלומר, QMLE ו-CMLE בתוכנה Huygens) בשלב אחר שלב מצטבר, חישוב תהליך, אשר התוצאות שלהם יכול להיות ברציפות דמיינו ונעצר (או חידש) כאשר נדרש על ידי המשתמש. בשלב זה המשתמש יכול לשנות את מספר הconvolutions ו/או האות ליחס הרעש ולחדש את השינוי. תוכנת הפירוק עובדת היטב עם סדרת הקפיצה בזמן (X, Y, T) (וידאו 2) ו-Z-ערימות (x, y, Z) (וידאו 3). הערוצים לפירוק מוזגו לאחר מכן ל-cmac, ערוץ raw, מאז ציטוסולג, מפזר fluorochromes לא לשפר על ידי פירוק4,9.
תוצאות
עקבנו אחר הפרוטוקול המתואר כדי ליצור את העיר החיסונית של ג'ורקאט-ראג'י ולדמות כראוי את השלבים המוקדמים של היווצרות. המטרה שלנו היתה לשפר את הגישות המוקדמות20 בעבר ללמוד את הקיטוב של mtoc ואת מכונות הפרשה לקראת IS. גישות אלה התבססו על האסטרטגיה נקודת הסיום, כי לא אפשרו הדמיה של היווצרות היא או האירועים הראשונים סינפטיות, מאז באסטרטגיות אלה החלה היווצרות החובה על הגלולה של תאים מעורבים, centrifuged, אבל לא על מיקרוסקופ. הפרוטוקול שלנו נועד למנוע את האזהרה העיקרית הזאת, מאז הגישה התבססה על השימוש בריכוז התא המתאים (שלבים 2 ו-3), כדי להעדיף את היווצרות של תא אל התא הוא מעלה השערים על שקופיות החדר מיקרוסקופ משלו (8 מיקרו היטב שקופית קאמרית), רכוב על החממה מחומם מראש אסטרטגיה זו מעוררת את היווצרות, במקביל ללכידת ההדמיה בזמן (וידאו 1).
איור 1 מייצג את מצופני המוח הסינפטיים-ראג'י שהושגו בעקבות הפרוטוקול (שלב 5.2). התמונה מייצגת את המסגרת הראשונה מניסוי של נציג, מעידה בזמן. 2 x 105 תאים ראג'י ו 2 x 105 תאים ג'ורקאט נוספו 1 ס מ2 טוב. החלונית העליונה מציגה ערוץ המעבר, הפאנל האמצעי מורכב מערוץ CMAC (כחול) (תאים של ראג'י), והחלונית התחתונה מציגה גם השראות וערוצים ממוזגים של CMAC. חיצים צהובים לתייג כמה שערים סינפטית, כהתייחסות, ואילו חיצים ירוקים מצביעים על שערי מראות סינפטית שנעשו על ידי תא אחד של ג'ורקאט ומספר תאים של ראג'י (שערי מעלה מורכבים). הפחתת ריכוזי תאים (10 או פחות תאים ב 1 ס מ2 טוב) יהיה לעקוף את היווצרות של שערי מעלה מורכבים הסלולר, אבל לא יכול להיות מספיק תא מעלה שערי לניתוח העוקבים של התנועה מקוטב (ראה להלן), כי בתורו תפחית גם את הסיכויים למצוא ולדמות המתעוררים מעלה המוח.
איור 2 מייצג צילומי מסך המתאימים לפרמטרים הדמיה המשמשים לכידת סימולטני של שני fluorochromes שונים (cmac ו-GFP-CD63) באמצעות התוכנה המתאימה (כלומר, ניקון NIS_AR) בניסוי הפקיעה זמן נציג המתאים וידאו 1.
וידאו 1 (סינפסות אימונולוגיים, raw) מייצג לימפוציטים לימפוציט T ביטוי GFP-CD63 (סמן של גופים מרובים-mvb, ירוק ושלפוחיות) והיווצרות סינפסה כפולה בין תא 1 ג'ורקט ו-2 התאים ראג'י מתויג עם cmac, בכחול (אחד מהם עובר שתבלע). התנועה הסימולטני של MVB בתוך התא של ג'ורקאט לכיוון שטחים הסינפסה נרשמה (לכידת שיעור מסגרת = 1 מסגרת כל 20 שניות עבור GFP-CD63; שכפול וידאו מהירות = 2 מסגרות לכל s). שערי המוח הסינפטית הושגו והדמיה בעקבות הפרוטוקול המתואר לעיל (שלב 6.2), אשר איפשר הדמיה של סינפסות המתעוררים (וידאו 1). הלכידה הסימולטנית הן של GFP-CD63 והן ערוצי הזריחה של CMAC בוצעו באמצעות תוכנה מתאימה (כלומר, ש"ח-AR, טבלת חומרים). הסרטון מייצג את הנתונים הגולמיים מתוך ניסוי של נציג, מעידה בזמן. מערכת המיקוד האוטומטי הוגדרה עם היסט מתאים ביחס לתאי ראג'י המאוגדים לתחתית הזכוכית, כדי להבטיח מיקוד יציב לאורך הניסוי.
וידאו 2 (הסינפסות החיסונית, לאחר הפירוק) מתאים וידאו 1, אבל הפירוק של תמונות ערוץ הזריחה gfp-CD63 בוצע על ידי שימוש בתוכנה מתאימה לפירוק (כלומר, huygens), באמצעות "שדה רחב" אופציה אופטית ופרמטרים אופטיים נכונה (שלב 8). הערוץ הגולמי ממוזג לאחר מכן ל-CMAC, ערוץ raw. השיפור של יחס אות לרעש וחדות התמונה ניכר. הפירוק בוצע לאחר הרכישה, כמתואר לעיל. לפרטים ספציפיים לגבי תוכנת הפירוק נא להפנות ל-4.
וידאו 3 (סינפולוגית, לאחר תיקון ו immunofluorescence כתמים) מייצג z-מחסנית (גודל z-שלב = 0.8 μm, 5 מסגרות) של קבוע הוא המשלים לאחר שלב 6 של הפרוטוקול (אצטון קיבעון). לאחר קיבעון, immunofluorescence בוצע בעקבות פרוטוקולים סטנדרטיים25 באמצעות Phalloidin כדי להמחיש את F-actin (ירוק), ANTI-CD63 כדי להמחיש mvb (מגנטה), anti-γ-טובולין להמחיש mvb (אדום). CMAC (כחול) מתייג את התא ראג'י. לאחר מכן המשלים היה התמונה על ידי epiפלואורסצנטית ומספר ערוצים לפירוק באמצעות "שדה רחב" אופציה אופטית הפרמטרים האופטיים הנכונים (שלב 7). הערוצים לפירוק מוזגו לאחר מכן ל-CMAC, ערוץ raw, כפי שמצוין בפאנלים השונים (CMAC בתוספת מעבר מעבר-טרנס, cmac פלוס Phallodin, CMAC פלוס anti-CD63 ו-CMAC פלוס anti-γ-טובולין, בהתאמה). החץ הלבן מתייג את הסינפסה, ואילו החץ הירוק מתייג את ה-MVB ואת החץ הצהוב מתייג את MVB. הקוונפיקציה מפורטת של mvb ו mvb קיטוב הוסבר במקום אחר25.
הגישה המוצגת כאן כרוכה בהיווצרות שערי מעלה תא אל התא, ובמקביל, רכישת הזמן השגה על ידי המיקרוסקופיה פלואורסצנטית בשדה רחב (WFFM) ואחריו עיבוד תמונה (לאחר הרכישה מפרק). טקטיקה זו שיפרה את היחס אות לרעש (SNR) של התמונות, הגדילו את הרזולוציה הטמפורלית שלהם, ואיפשר את הרכישה מסונכרן של מספר fluorochromes ב המתעוררים השערים סינפטית4. בנוסף, הפרוטוקול הוא מותאם היטב עם שיטות קיבעון הסופי של תא הקצה (פאראפורמלדהיד, אצטון או מתנול), אשר יאפשרו החיסונית נוספת של כתמים וניתוחים25 (וידאו 3). פרוטוקול זה תואם גם עם מיקרוסקופ מיקוד לייזר וטכניקות אחרות של מיקרוסקופ חדיש.
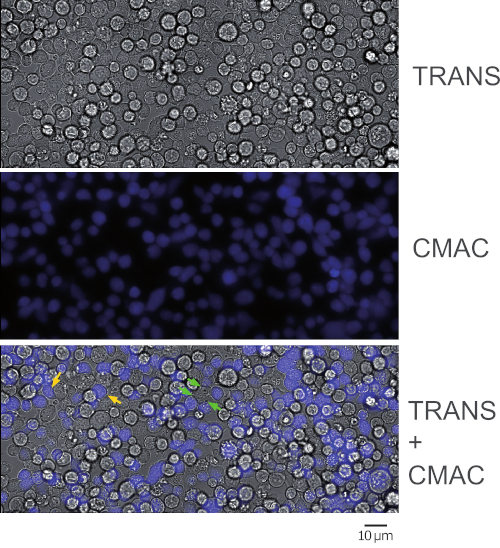
איור 1: שדה מיקרוסקופ בגודל כפול של שערים סינפטית. התמונה מייצגת את המסגרת הראשונה מתוך ניסוי של נציג, מעידה בזמן שלאחר הפרוטוקול. הלוח העליון מציג את הערוץ המעבר, ערוץ CMAC האמצעי (תאים ראג'י) והלוח התחתון שני הערוצים הממוזגים. חיצים צהובים לסמן כמה שערים סינפטית, כהפניה. החצים הירוקים מציינים שערי מעלה סינפטית מורכבים (כלומר, תא אחד של ג'ורקאט הקמת הסינפסות עם יותר מתא ראג'י אחד). שנתפסו עם מטרה 40x EWD (0.6 NA). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
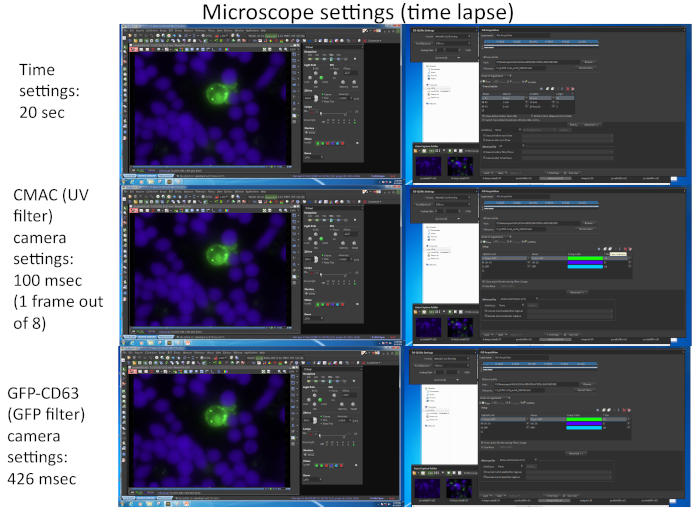
איור 2: הגדרות מיקרוסקופ זמן פקיעה. התמונה מתאימה כמה צילומי מסך המתאימים לפרמטרים הדמיה המשמשים לכידת סימולטני של שני fluorochromes שונים (CMAC ו-GFP-CD63) באמצעות התוכנה המתאימה (כלומר, ניקון NIS_AR) בניסוי הפקיעה זמן נציג המתאים וידאו 1. כל מסגרת עבור ערוץ GFP-CD63 נלכד כל 20 s. רק מסגרת אחת עבור ערוץ UV מתוך שמונה מסגרות עבור ערוץ GFP נלכד על מנת לשמור על הכדאיות התאית לאורך הניסוי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
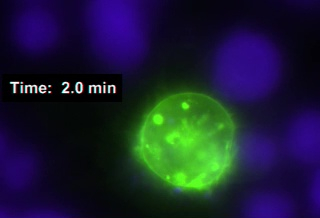
וידאו 1: סינפסות אימונולוגיים שנעשו על ידי תא של ג'ורקט ביטוי GFP-CD63, נתונים גולמיים. התאים ראג'י B מתויג עם מעקב תאים כחול (CMAC, כחול) היו פעמו עם לראות עבור 30 דקות ו הסינפסות עם תאים וכיוקאט ביטוי GFP-CD638 נוצרו. זמן הכשלים המתאימים GFP-CD63 וערוצי CMAC נתפסו (20 s לכל מסגרת; שכפול וידאו מהירות = 2 מסגרות לכל s) ודוגמה ייצוגית מוצג. שנתפסו עם מטרת התוכנית 60x (1.4 NA). אנא לחץ כאן כדי להציג וידאו זה (לחץ לחיצה ימנית כדי להוריד).
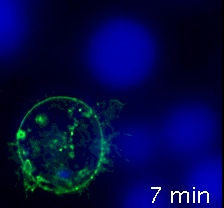
וידאו 2: סינפסות אימונולוגיים שנעשו על ידי תא של ג'ורקט ביטוי GFP-CD63, לאחר הפירוק. כמו וידאו 1, אבל תמונות היו לפרק באמצעות תוכנה לפירוק. היחס המשופר של האות לרעש והחדות המשופרת, עקב חיסול מזהם האור של הזריחה, ניכר. אנא לחץ כאן כדי להציג וידאו זה (לחץ לחיצה ימנית כדי להוריד).
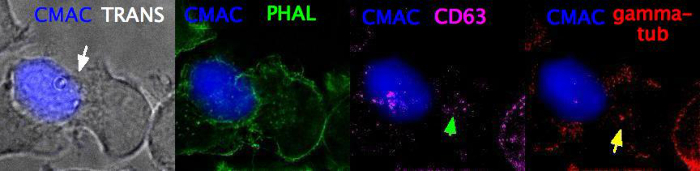
וידאו 3: סינפולוגית קבועה ומוכתמת חיסונית. התמונה מציגה את המשלים של הסינפטיות קבוע לאחר שלב 7 של הפרוטוקול ובעקבות immunofluorescence הבאים. CMAC (כחול) תוויות התאים ראג'י, מעבר (טרנס) כדי להראות את המשלים סינפטית (חץ לבן), תוויות Phalloidin (ירוק), anti-CD63 תוויות MVB (מגנטה, החץ הירוק) ו anti-γ-טובולין תוויות MVB (אדום, חץ צהוב), בהתאמה. ערוצים אלה התעברו על ידי אפיטנטית, התמזגו ומוזגו כמצוין. הווידאו כולל Z-מחסנית (גודל z-שלב = 0.8 μm, 5 מסגרות). החץ הלבן מתייג את אזור יצירת הקשר הסינפטית, ואילו החץ הירוק מתייג את MVB ואת החץ הצהוב מתייג את MVB. אנא לחץ כאן כדי להציג וידאו זה (לחץ לחיצה ימנית כדי להוריד).
Discussion
הגבלה של פרוטוקול זה היא כי לא כל הסינפסות יהיה מונחה באופן אידיאלי בניצב לציר האופטי. באמצעות טכניקה זו, אין דרך לנבא ו/או להשפיע על האוריינטציה האידיאלית הדמיה החיסון החיסונית. כדי לפתור בעיה זו, אנו לא לכלול את הניתוחים הבאים כל הסינפסות שנתפסו באופן אקראי, כי לבסוף לא למלא את הקריטריונים האידיאליים. הסינפסות האלה, בלתי מספיקים, אינן תכופות במיוחד. עם זאת, ניתן לעקוף מגבלה זו באמצעות מספר גישות נסיוניות4.
שחרור מקוטב CD63 (degranulation) ניתן לכמת על ידי טכניקות משלימות אחרות כגון משטח התא כתמים של CD63 (CD63 מחדש לפני השטח התא) בתאי החיים (לא קבוע ולא חדיר), לאחר שלב 6, והכביסה הבאים וקיבוע, כפי שהוצג בעבר8. בנוסף, CD63 שחרור על אקסוזומים8,9 ו אקפי כימות על ידי ניתוח ננו-חלקיק מעקב9,25 ניתן לבצע. גישות אלה מתאימות בהחלט עם הפרוטוקול שלנו, סיפק קיבעון מבוצעת לאחר משטח התא מאימונוoforof תאים חיים.
מצאנו את המספר האידיאלי של תאים (עבור 1 ס מ2 גם בשקופית קאמרית 8-היטב) הוא 4 x 105 תאים (2 x 105 תאים ראג'י ו-2 x 105 התאים האלה) מאז הם לדבוק ביעילות בתחתית הבאר. מאגד יעילות פלסטיק (באמצעות fibronectin), או בתחתית הזכוכית (באמצעות פולי-L-ליזין) מיקרושקופיות אינה בדרך כלל בעיה. מספרי תאים גבוהים יותר עלולים ליצור מרווחים בין התאים הדבקו, ולאחר מכן לאחר מכן, לאחר מכן, בעלי מעלה סינפטית מורכבים (איור 1); שני המצבים אינם רצויים כאשר שערי מעלה בודדים של תא לתאים צריכים להיות מותמונות ב-, למשל, MTOC או הפרשה החוצה ניסויים בקיטוב. מספר נמוך יותר של תאים עלול להקטין את הסיכוי למצוא שערי מעלה, במיוחד כאשר התאים האחרים בתאי הכניסה מאותגרים עם APC ליצור הסינפסות. שימו לב כי הבחנו כי הטמפרטורה התייצב בשלב החממה במקום על המיקרוסקופ X/Y שלב לפני תחילת הפרוטוקול (כלומר, 1-2 h מראש כדי לייצב את השלב/מיקרוסקופ ההתקנה) שומר יציב X, Y, הפרמטרים Z, אשר חיוני הדמיה נכונה. מערכת המיקוד האוטומטי תפצה בסופו של דבר וריאציות קטנות של Z.
כשטכניקות מסוימות של התמרה גנטית כגון אלקטרופורציה משמשות לבטא חלבונים מסוג פלורסנט (כלומר, GFP-CD63) במשובטים ג'ורקאט (וידאו 1), חלק ניכר של התאים עלול למות לאחר אלקטרופורציה. זו יכולה להיות בעיה, כי למרות תאים מתים לא יוצרים הסינפסות, כאשר הם מיותרים על החיים, התאים מזוהמים, הם עלולים להפריע להיווצרות שערים שנעשו על ידי חיים Th תאים. מצאנו כי חיסול זהיר של תאים מתים מתרבויות מעלה באמצעות צפיפות בינוני הדרגתי בעקבות פרוטוקולים סטנדרטיים לפני שלב היווצרות המשלים יכול באמת להגדיל את הסיכויים התמונה כראוי השערים. בנוסף, יעילות הזיהום הנמוך (< 20%) יכול להיות אזהרה חשובה מאז זה, בשילוב עם יעילות היווצרות המשלים מתון (בסביבות60%),תפחית את ההסתברות למצוא שערי מעלה שנעשו על ידי תאים מזוהמים. זו אינה בעיה כאשר תאים לא מבוקר משמשים כדי להשיג שערי מעלה בניסויים נקודת סיום הקיבעון העוקב. שמונה השקופיות בחדר המיקרוגל תואמות. לפרוטוקולי אימונולוורנציה קונבנציונליים פעולה זו מגבירה את הגמישות של הפרוטוקול הנ ל במטרות שונות. קיבעון עם אצטון יכול להיות בעיה לשקול בעת שימוש שקופיות קאמרית עם בארות התחתון פלסטיק. עם זאת, יש מסחרית זמינים 8 מיקרוסקופ למיקרוגל קאמרית המכילים שבחרת זכוכית, אשר תואמים אצטון קיבוע. להסיר מכסים פלסטיים כאשר אצטון משמש כדי לתקן את התאים המתורבת 8 שקופיות בחדר בתחתית זכוכית המיקרוגל.
מומלץ כי המיקרוסקופ מצויד בשלב XY ממונע, ממונע מנועי הצריח ומיקוד המוקד אוטומטי (g., מערכת המוקד מושלמת) או תוספי מקבילה. כאשר יש צורך ברכישה מרובת היטב25, מערכת המיקוד האוטומטית תבטיח מיקוד יציב לאורך כל הניסוי. ניסיון קודם מציין כי על ידי הקמת היסט מיקוד מתאים על התאים ראג'י, הן התנועה של תאי T (וידאו 1) ואת התנועות מיקרוסקופ שלב/שקופית קאמרית בניסויים מרובת נקודות, ניתן לפצות. זה אכן נוח עבור לכידת זמן רב היטב לכידה.
שחור ולבן, כרומטית ומקורר טעונה מצמידים המכשיר (CDD) מצלמה שימש אך גבוהה רגישות, מדעית המשלים מתכת תחמוצת מוליכים למחצה (sCMOS) מצלמה רצוי, מאז זה יהיה להקטין את החשיפה מצלמה פעמים ולשפר את הרזולוציה הטמפורלית. המצלמה קצר חשיפה פעמים השתמשנו (טופס הדירוג 100 ms ל 500 ms) בשילוב עם תריס הזריחה אוטומטי מאפשר לכידת זמן ממושך (עד 24 שעות) עם רזולוציית זמן נאותה (1 מסגרת לדקה או פחות, עבור עד 16 משרות XY) ללא הלבנת זריחה משמעותית ו/או אובדן של הכדאיות התא. השלב המונע מאפשר מרובת נקודות (XY) ומגדיל את ההזדמנות למצוא ולדמות את הסינפסות המתפתחת והמתפתחת באוריינטציה האידיאלית, אך גם מתיר רכישת תמונה בשקופיות קאמרית מרובות כאשר שיבוטים שונים של ג'ורקאט צריכים להיות מצוקים בו25. מפתח מספרי גבוה של המטרה (כלומר 60x, 1.4) הוא הכרחי על מנת להשיג את התוצאות הטובות ביותר בעת ניתוח התנועה של בגרגרים הפרשה.
ראג'י-ראה-ג'ורקאט מהווה מודל סינפולוגית מבוסס היטב, ששימש מספר רב של חוקרים מאז שתוארה במקור11. התאמתי את הפרוטוקול שלנו למודל זה כדי לדמות כראוי את השלבים המוקדמים של היווצרות. המטרה שלנו היתה לשפר את הגישות המוקדמות20 בעבר ללמוד את הקיטוב של mtoc ואת מכונות הפרשה לקראת IS. זה מדהים כי שערי הבצובות עשה עם פרוטוקול זה לייצר F-actin התארגנות מחודש בסינפסה, הגדרת SMAC קאנוני, במקביל לתנועה מקוטב MVB25. האירועים הקריטיים הללו נותחו ואומתו על ידי המיקרוסקופיה הקונפוקלית25.
הבדלים קינטי בתנועה מקוטב קיימים בין סוגים שונים של IS. לדוגמה, הובלה מקוטנת של גרגרי לטיק מ-CTLs מתקיימת בתוך שניות או דקות ספורות בלבד, בעוד שמספר ציטוקין המכיל שלפוחיות מתוך לימפוציטים של Th מגיע מדקות עד מספר שעות עד לסיום. וני הזמני הזה יש לקחת בחשבון מראש, על מנת לעצב את האסטרטגיה הטובה ביותר כדי לבחור את הגישה המתאימה ביותר ניסיוני והדמיה, מאז כמה תחבולות הדמיה (כלומר, סריקת לייזר קונפוקלית יקרוסקופית מיקרוסקופ (lscm)), הזמן יכול להיות גורם מגביל מאז הזמן ללכוד הוא הרבה יותר גבוה אין זו מגבלה כאשר מיקרוסקופ הקרינה הפלואורסצנטית (WFFM) משמש כמתואר בפרוטוקול לעיל. מאז ב-ctls, הקיטוב של mtoc לכיוון הסינפסה נמשך רק כמה דקות3,6,17, מדינה ספציפית מגוונת של מיקרוסקופ אמנות גישות שונות שתוארו כאן (אך מחסה מרחבית גבוהה יותר הרזולוציה הטמפורלית) נחוצים כדי לדמות נכונה התמונה האלה סינפסות26,27, בעיקר כאשר מספר שדות מיקרוסקופ ( אלה ברזולוציה גבוהה, גישות חדשות יכול להיות מנוצל גם עבור הדמיה של הסינפסות שנעשו על ידי לימפוציטים Th, אם כי חסכוני ו/או לוגיסטי סיבות (כלומר, ציוד הליבה הנדרש עבור חלק מטכניקות אלה הדמיה עלויות 6-7 פעמים יותר מאשר המתואר כאן) יכול בהחלט להוות מגבלה עבור המצב הזה של שיטות דימות אמנות4 העובדה כי הוא עשה על ידי לימפוציטים לאורך זמן, ואת הנסיבות כי ב לימפוציטים ה-MTOC, lymphokine המכיל הסוד שלפוחיות ו MTOC לקחת מתוך מספר דקות עד שעות הובלה לעגן את זה22, עושה את הפרוטוקול הזה אידיאלי, גישה במחיר נוח עבור הדמיה TH-APC הוא.
WFFM בשילוב עם פירוק תמונה לאחר הרכישה מהווה גישה מעניינת ולא רק סיבות כלכליות תומכות באסטרטגיה זו. הרזולוציה הירודה הפנימית בציר Z (האזהרה החשובה ביותר של הטכניקה) ניתן לשפר באמצעות התמונה שלאחר הרכישה מפרק4 (השוואת וידאו 1 עם וידאו 2). התהליך משתמש בגישה מבוססת חישוב, עיבוד תמונה שיכול לשפר את יחס הרעש ואת רזולוציית התמונה וניגודיות27 עד 2 פעמים, עד 150-100 ננומטר בציר XY ו 500 nm בציר Z4.
השימוש ברגישות גבוהה יותר, מהירות בדיקה גבוהה וטווח דינמי רחב, מצלמות חדשות של הזריחה sCMOS ישפרו את איכות התמונות תפחית את הלבנת הזריחה. הגמישות המוצעת על-ידי הפרוטוקול של התא לתאים המתואר כאן מאפשרת את השילוב של הגישה הסלולרית המתוארת עם מספר מצבים של טכניקות מיקרוסקופ אמנות, הן בתאי החיים אלא גם בתאים קבועים, והתוצאה הצפויה בהחלט ישפרו את הידע שלנו על הסינפולוגית החיסונית.
למרות שיושמו ובתוקף את הפרוטוקול באמצעות קל לטפל, קווי תא מבוססת, פוטנציאל הגישה עשויה לאפשר ויזואליזציה של אינטראקציות פיזיולוגיות יותר כאשר התאים הראשוניים T וסוגים שונים של תאים אנטיגן הצגת (כגון תאים דנדריטים של מקרופאגים) משמשים5. בהקשר זה, פרוטוקול זה הורחב גם ואומת על ידי שימוש סופר אנטיגן (סאב)-פעמו עכבר אל 4 קו התא המשמש APC, כדי לאתגר את העכבר הראשי T lymphoblasts9. אכן, לימפוציטים הראשי T, CTLs בפרט, מעובד יותר קצר-חי ודינמי הקשר הסינפטית (ראה וידאו משלים 8 בהפניה9) לאלה שנראו עם המודל ראה-ראג'י וג'ורקאט. השונות של מצבי קשר סינפטית ניתן לראות הטוב ביותר עבור אינטראקציות T-cell הראשי עם תאים דנדריטים או B בתאי דו מימדי של רקמות שווי מבחנה שניתן גם להקליט ונותחו באמצעות פרוטוקול זה. בנוסף, מלבד superantigens, הטכניקה יכולה לשמש לתמונה סוגים אחרים של הסינפסות. למשל, זה יכול לשמש tcr transgenic, אנטיגן ספציפי מודל תא T, למשל באמצעות אובלבומין ספציפי מורטין OT1/OT2 מערכת או על ידי העברה של תאים t עם קולטנים ייחודיים לאנטיגן t תאים. הדבר פותח מספר רב של אפשרויות נסיוניות לעתיד הקרוב.
Disclosures
המחברים לא מצהירים. על ניגוד אינטרסים
Acknowledgements
אנו מכירים בכל העבר והנוכחים במעבדה על תרומתם הנדיבה. עבודה זו הייתה נתמכת על ידי מענקים מMinisterio הספרדית דה אקונוניה התחרות אבא (MINECO), תוכנית הלאומי של המחקר (SAF2016-77561-R כדי מ, אשר היה בחלקו הוענק עם מימון פדר-EC). אנו מכירים בפסולטד דה מדיטינה (UAM) ובחלק האמצעי לתמיכה ולמתקנים הניתנים להפקת הווידאו. אנו מכירים בחברת NIKON-Europe לתמיכה טכנית רציפה ועיונית מעולה. גישה חופשית למאמר זה ממומנת על ידי ניקון.
Materials
| Name | Company | Catalog Number | Comments |
| Camera Nikon DS-QI1MC | Nikon | MQA11550 | Cooled Camera Head |
| CMAC | ThermoFisher Scientific | C2110 | Cell tracker blue |
| JURKAT cells | ATCC | ATCC TIB-152 | Effector T lymphocytes |
| μ-Slide 8 well ibiTreat, μ-Slide 8 well Glass-Bottom | IBIDI | Cat.No: 80826, 80827 | Cell culture and cell imaging supports |
| Microscope NIKON Eclipse Ti-E | Nikon | NIKON Eclipse Ti-E | Wide-field fluorescence, fully-motorized microscope equipped with Perfect Focus System (PFS) option |
| Microscope Stage Incubator with 3-channel manual gas mixer and gas bubbler/ humidity module | OKOLAB | H201-NIKON-TI-S-ER | Cell culture atmosphere |
| Raji Cells | ATCC | ATCC CCL-86 | APC |
| RPMI medium GIBCO | ThermoFisher Scientific | 21875034 | Culture medium |
| Streptococcus Enterotoxin E (SEE) | Toxin Technology, Inc | EP404 | Bacterial Toxin |
| Software Huygens Essential | SVI | Huygens Essential | Image Deconvolution software |
| Software ImageJ | NIH | Image J | Image software |
| Software Nikon NIS-AR | Nikon | NIS-Elements AR | Image capture and analysis software |
References
- Fooksman, D. R., et al. Functional anatomy of T cell activation and synapse formation. Annual Review of Immunology. 28, 79-105 (2010).
- de la Roche, M., Asano, Y., Griffiths, G. M. Origins of the cytolytic synapse. Nature Reviews. Immunology. 16, 421-432 (2016).
- Griffiths, G. M., Tsun, A., Stinchcombe, J. C. The immunological synapse: a focal point for endocytosis and exocytosis. The Journal of Cell Biology. 189, 399-406 (2010).
- Calvo, V., Izquierdo, M. Imaging Polarized Secretory Traffic at the Immune Synapse in Living T Lymphocytes. Frontiers in Immunology. 9, 684 (2018).
- Friedl, P., den Boer, A. T., Gunzer, M. Tuning immune responses: diversity and adaptation of the immunological synapse. Nature Reviews. Immunology. 5, 532-545 (2005).
- Xie, J., Tato, C. M., Davis, M. M. How the immune system talks to itself: the varied role of synapses. Immunological Reviews. 251, 65-79 (2013).
- Colombo, M., Raposo, G., Théry, C. Biogenesis, Secretion, and Intercellular Interactions of Exosomes and Other Extracellular Vesicles. Annual Review of Cell and Developmental Biology. 30, 255-289 (2014).
- Alonso, R., et al. Diacylglycerol kinase alpha regulates the formation and polarisation of mature multivesicular bodies involved in the secretion of Fas ligand-containing exosomes in T lymphocytes. Cell Death & Differentiation. 18, 1161-1173 (2011).
- Mazzeo, C., Calvo, V., Alonso, R., Merida, I., Izquierdo, M. Protein kinase D1/2 is involved in the maturation of multivesicular bodies and secretion of exosomes in T and B lymphocytes. Cell Death & Differentiation. 23, 99-109 (2016).
- Mittelbrunn, M., et al. Unidirectional transfer of microRNA-loaded exosomes from T cells to antigen-presenting cells. Nature Communications. 2, 282 (2011).
- Montoya, M. C., et al. Role of ICAM-3 in the initial interaction of T lymphocytes and APCs. Nature Immunology. 3, 159-168 (2002).
- Abraham, R. T., Weiss, A. Jurkat T cells and development of the T-cell receptor signalling paradigm. Nature Reviews. Immunology. 4, 301-308 (2004).
- Huse, M., Quann, E. J., Davis, M. M. Shouts, whispers and the kiss of death: directional secretion in T cells. Nature Immunology. 9, 1105-1111 (2008).
- Peters, P. J., et al. Cytotoxic T lymphocyte granules are secretory lysosomes, containing both perforin and granzymes. The Journal of Experimental Medicine. 173, 1099-1109 (1991).
- Vignaux, F., et al. TCR/CD3 coupling to Fas-based cytotoxicity. The Journal of Experimental Medicine. 181, 781-786 (1995).
- de Saint Basile, G., Menasche, G., Fischer, A. Molecular mechanisms of biogenesis and exocytosis of cytotoxic granules. Nature Reviews. Immunology. 10, 568-579 (2010).
- Huse, M. Microtubule-organizing center polarity and the immunological synapse: protein kinase C and beyond. Frontiers in Immunology. 3, 235 (2012).
- Yi, J., et al. Centrosome repositioning in T cells is biphasic and driven by microtubule end-on capture-shrinkage. The Journal of Cell Biology. 202, 779-792 (2013).
- Jang, J. H., et al. Imaging of Cell-Cell Communication in a Vertical Orientation Reveals High-Resolution Structure of Immunological Synapse and Novel PD-1 Dynamics. Journal of Immunology. 195, 1320-1330 (2015).
- Kupfer, A., Singer, S. J. Cell biology of cytotoxic and helper T cell functions: immunofluorescence microscopic studies of single cells and cell couples. Annual Review of Immunology. 7, 309-337 (1989).
- Dustin, M. L., Depoil, D. New insights into the T cell synapse from single molecule techniques. Nature Reviews. Immunology. 11, 672-684 (2011).
- Dustin, M. L. Supported bilayers at the vanguard of immune cell activation studies. Journal of Structural Biology. 168, 152-160 (2009).
- Jambrina, E., et al. Calcium influx through receptor-operated channel induces mitochondria-triggered paraptotic cell death. The Journal of Biological Chemistry. 278, 14134-14145 (2003).
- Fuss, I. J., Kanof, M. E., Smith, P. D., Zola, H. Isolation of whole mononuclear cells from peripheral blood and cord blood. Current Protocols in Immunology. , 1 (2009).
- Herranz, G., et al. Protein Kinase C delta Regulates the Depletion of Actin at the Immunological Synapse Required for Polarized Exosome Secretion by T Cells. Frontiers in Immunology. 10, 851 (2019).
- Ritter, A. T., et al. Actin depletion initiates events leading to granule secretion at the immunological synapse. Immunity. 42, 864-876 (2015).
- Combs, C. A., Shroff, H. Fluorescence Microscopy: A Concise Guide to Current Imaging Methods. Current Protocols in Neuroscience. 79, (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved