Method Article
تحديد هوية الخلية المناعية ونقاوتها باستخدام PCR الكمية اللاجينية
In This Article
Summary
هنا نصف طريقة قوية لتحديد هوية الخلايا المناعية ونقاوتها من خلال التوقيعات اللاجينية التي تم اكتشافها باستخدام PCR الكمي (qPCR). ديميثيل الحمض النووي في مكان معين بمثابة معرف فريد لنوع خلية معينة ويسمح لتحديد CD8 + ، والخلايا التنظيمية ، أو T Th17.
Abstract
يمكن أن يكون لترددات الخلايا المناعية الفرعية تأثير كبير على فعالية علاجات الخلايا التائية. الأساليب الحالية ، مثل تدفق الخلايا ، لديها متطلبات عينة محددة ، ومدخلات عينة عالية ، هي إنتاجية منخفضة ، ويصعب توحيدها ، وكلها ضارة بتوصيف منتجات العلاج بالخلايا أثناء تطورها و التصنيع.
تحدد الاختبارات الموصوفة هنا بدقة أنواع الخلايا المناعية وقياسها في خليط غير متجانس من الخلايا باستخدام الحمض النووي الجينومي المعزول (gDNA). يتم الكشف عن أنماط ميثيل الحمض النووي من خلال تحويل بيسولفيت ، وهي عملية يتم فيها تحويل السيتوسات غير الميثيلية إلى uracils. يتم الكشف عن مناطق الحمض النووي غير الميثيلية من خلال تضخيم qPCR باستخدام الكبيات التي تستهدف المناطق المحولة. يتم قياس موضع واحد فريد لكل معين ويعمل كمعرف دقيق لنوع خلية معينة. وتتسم الخلايا القوية وتحديد CD8+, الخلايا التنظيمية, وTh17 T بطريقة إنتاجية عالية. يمكن استخدام هذه الاختبارات المحسنة لاختبار الإفراج عن المنتج والعملية في العملية.
Introduction
وقد زاد استخدام الخلايا التائية في العلاج المناعي الخلوي بشكل كبير على مدى العقد الماضي، وخاصة مع ظهور مستقبلات مستضد الشيم (CAR) تكنولوجيا الخلايا التائية1. في حين أن العلاجات القائمة على الخلايا التائية قد قوبلت بنجاح سريري كبير ، إلا أنها غير متجانسة ويمكن أن تختلف خصائص الخلايا والهويات بشكل كبير بين المتبرعين2. يمكن أن يكون لعدم تجانس مجموعات الخلايا التائية آثارًا كبيرة على الفعالية العلاجية وتعقيد الاستنتاجات من التجارب السريرية. لهذا السبب، من الأهمية بمكان فهم ت التائية الخلايا أثناء تصنيع المنتج وصياغة لتحديد التركيبات المثلى من العلاجات المناعية الخلايا التائية.
بالمعنى الواسع ، يمكن تقسيم الخلايا التائية إلى مجموعتين: خلايا CD4 + المساعد T ، التي تفرز السيتوكينات المناعية ، وخلايا CD8 + T السامة للخلايا ، والتي تقدم مباشرة خلايا الليسية التي تقدم مستضد الكونسعلى مجمع التوافق الهيستواني الرئيسي (MHC) الجزيئات I. CD4 + المساعد T الخلايا يمكن أن تفرق في عدد لا يحصى من مجموعات فرعية محددة التي تنتج مجموعة فريدة من السيتوكينات. يقترح البعض أن نسبة محددة من CD4 + إلى CD8 + T الخلايا في المنتج الخلية النهائية تعظيم في فعالية vivo والمثابرة ولكن يمكن أن تعقد تصنيع الخلايا3. الخلايا التائية التنظيمية (Tregs) ، وهي مجموعة فرعية من خلايا CD4 + T ، هي مثبطة للمناعة وتقلل من تنشيط الخلايا المناعية. وقد تورطت الخلايا T التنظيمية في التوسط التسامح الورم، وإذا كان موجودا خلال تصنيع خلايا T CAR، يمكن أن تمنع الاستجابة المناعية المضادة للورم من خلايا Car T4،5،6. مجموعات فرعية أخرى CD4 + مثل T المساعد 17 (Th17) الخلايا التائية تعزيز إزالة الورم ويمكن الاستفادة منها لزيادة فعالية العلاجات الخلايا التائية. وهكذا، زيادة Th17 CD4 + الخلايا التائية هي ذات أهمية خاصة في إعدادات الورم الصلبة حيث زيادة إنتاج إنترلوكين 17 (IL-17) يعزز الاستجابة المناعية المضادة للورم5،7،8،9. وقد أدى فهم أهمية خلايا Th17 في استجابات الورم إلى مزيد من التحقيق في استراتيجيات توليد هذه الخلايا في المختبر7،9. ولذلك، فإن أساليب الكشف عن هذه المجموعات الفرعية للخلايا التائية حاسمة لتحسين علاجات الخلايا التائية ويجب أن تكون قوية وسهلة وقابلة للتطوير وقابلة للاستنساخ.
قياس التدفق الخلوي هو الطريقة الأكثر شيوعًا لتحديد هوية الخلية المناعية. ومع ذلك، يتطلب قياس الخلايا تدفق حية، والخلايا السليمة التي يجب تحليلها في نفس اليوم يتم حصادها. لتلطيخ السيتوكين داخل الخلايا (ICS), مطلوب تثبيط إفراز البروتين للاحتفاظ السيتوكينات داخل الخلايا التائية. ومع ذلك، مركبات مثبطة مختلفة لها آثار تفاضلية على إفراز السيتوكينات محددة، مما اضطر المستخدمين إلى إنشاء الكوكتيلات المتخصصة للكشف عن السيتوكين من الفائدة10،11. بالإضافة إلى ذلك ، يعتمد إخلاص قياس التدفق الخلوي على مستنسخات الأجسام المضادة التي ترتبط بشكل محدد وقوي بهدفها. استخدام الأجسام المضادة المستنسخة المختلفة يمكن أن يسبب نتائج متفاوتة ويؤدي إلى استنتاجات غير دقيقة، مما يجعل من الصعب لتوحيد طريقة12. علاوة على ذلك ، يمكن أن يختلف تحليل البيانات التي تم جمعها عبر قياس التدفق الخلوي ، وبالتالي الاستنتاجات المستخلصة من البيانات ، بشكل كبير بين المستخدمين استنادًا إلى كيفية تعيين البوابات13،14. لهذه الأسباب، والتدفق الخلوي ليست مثالية لمراقبة الجودة الدقيقة أثناء تطوير العلاج بالخلايا.
تقييم المثيل الجيني في موضع جين معين هو طريقة بديلة لتحديد هوية الخلية. وقد تم وصف الأساس المنطقي لاستخدام ميثيل الحمض النووي لتحديد أنواع معينة من الخلايا في مواد متعددة ويعتمد على أنماط مثيلة محددة موجودة في مجموعة خلايا معينة15،16،17. وفي الخلايا المستهدفة، تحتوي بعض المواقع على نيوكليوتيدات غير ميثيلية، بينما في الخلايا غير المستهدفة تكون هذه المواقع مُبتيَّدة. يمكن الكشف عن هذا النمط من خلال تحويل بيسولفيت، وهي عملية تحول حصرا النيوكليوتيدات السيتوسين غير الميثيلية (C) إلى uracil (U). يمكن تصميم الكبيات والمسابير ضد المواقع المحولة ، ثم تضخيمها واكتشافها من خلال qPCR16.
يقيس المقاسير الموصوف هنا تواتر الأنواع الفرعية للخلايا المناعية ضمن مجموعات غير متجانسة من خلال تحديد عدد loci غير الميثيلي المحدد مقارنة بجين التدبير المنزلي. يتم قياس نسخ من العناصر التنظيمية غير المثيلة لجين CD8 B في اختبار CD8، FoxP3 في Treg، وIL-17 في Th17 في هذا التنظير. تم تحديد هذه loci عن طريق عزل مجموعة الخلايا المحددة ذات الأهمية (على سبيل المثال ، خلايا CD8 + T) وأداء تسلسل bisulfite لتحديد loci التي لا ميثيلها في نوع الخلية15فقط . يتم تطوير الكبيات والمسابير ضد loci غير الميثيلية بشكل فريد ويتم تحليل العينات عبر qPCR. يتم إنشاء منحنى قياسي من أرقام النسخ المعروفة من تخفيف اتّفاقات عدد النسخ العالي بلازميد قياسي، مما يسمح بتحويل قيمة Ct إلى رقم نسخة.
لتقييم أداء العينات، يلزم أخذ عينات من التحكم، بما في ذلك gDNA المرجعية وبلازميد المعايرة. المواد الجينومية المرجعية هي عينة دم مجمعة من متبرعين متعددين بترددات معروفة للخلايا المناعية وتستخدم لفحص أداء فحص قياس الجودة (QC). عينة المعايرة هي البلازميد المركبة التي تحتوي على تسلسل الجينات CD8، FoxP3، وGAPDH في نسبة متساوي. يتم استخدامه كمقياس لكفاءة تحويل البيسولفيت ، لأن تحويلات البيسوفيت داخل مناطق الجينوم المختلفة ستختلف في الكفاءة. نسبة الهدف إلى GAPDH داخل المعايرة هي 1 ، ولكن بسبب الاختلافات في كفاءة تحويل bisulfite ، يمكن أن تختلف النسبة. يتم تطبيق عامل المعايرة هذا على مقالات CD8 و Treg. يقع FoxP3، الجين المستخدم في اختبار Treg، على كروموسوم X. لأن هذا الفحص يقيس فقط نسخ غير ميثيلية من FoxP3، ونسخة واحدة فقط من FoxP3 غير ميثيلية في Tregs، وهذا الفحص هو لاأدري الجنس ويمكن استخدامها مع كل من الذكور والإناث عينات18. لا تستخدم عينة Th17 عينة معايرة أو GAPDH كجين التدبير المنزلي. وبدلاً من ذلك، يتم تضمين مجموعة التمهيدي ة الأخرى التي تستهدف loci الميثيلية الموجودة في الخلايا غير Th17 وينعكس العدد الإجمالي للخلايا من خلال مجموع نسخ ميثيلوغير ميثيلمن IL-17. يتم إدخال البيانات التي تم الحصول عليها من qPCR في قالب تحليل محدد مسبقًا يقوم بإجراء فحوصات مراقبة الجودة على البيانات وحساب النسبة المئوية للخلية المستهدفة ضمن مجموعة البداية. وهذا يوفر تحليل البيانات الآلي وغير المتحيزة، وبالتالي إزالة ذاتية المستخدم وتحسين قدرات التوحيد القياسي.
يستخدم هذا الفحص gDNA ، والذي يمكن عزله عن طريق إجراء leukapheresis باستخدام خلايا مستزرعة أو ثابتة ، أو كريات الخلايا المجمدة. متطلبات عينة منخفضة، والمرونة في عينة المواد بدءا، ودقة عالية، وتحليل موحد معالجة القيود المرتبطة بتدفق الخلايا وهي مثالية لأغراض مراقبة الجودة أثناء تطوير عملية العلاج بالخلايا.
Protocol
تم الحصول على جميع العينات البشرية من مصدر تجاري وفقا للمبادئ التوجيهية الخاصة بها لأخلاقيات البحوث البشرية.
1- عزل الحمض النووي الجينومي
ملاحظة: يتم إجراء عزل الحمض النووي الجينومي باستخدام مجموعة متاحة تجاريًا (انظر جدول المواد)من أي خلايا دموية، مثل الخلايا أحادية النواة في الدم المحيطية (PBMCs)، أو الخلايا التائية النقية، أو أي نوع آخر من الخلايا الدموية. وفي هذه التجربة، استُخدمت خلايا أحادية النواة في الدم المحيطية وخلايا تائية من ثلاثة متبرعين بشريين مختلفين.
- ضع 1-2 × 106 خلايا هيماتوبوية في أنبوب مخروطي والطرد المركزي في 400 × ز لمدة 10 دقيقة.
- يستنشق الـ(سوبرناتانت) تماماً
- إضافة 350 ميكرولتر من العازلة الانزيم / ملزمة إلى العينة واحتضان لمدة 10 دقيقة في 55 درجة مئوية.
- أضف 50 ميكرولتر من البروتينات K (20 ملغم/مل) إلى 350 ميكرولتر من تعليق الخلايا والدوامة لمدة 30 s.
- أضف 50 ميكرولتر من الخرز شبه المغناطيسي الملزم للحمض النووي و400 ميكرولتر من الايزوبروبانول بنسبة 100% واحتضان لمدة 3 دقيقة في درجة حرارة الغرفة (RT).
- ضع الأنبوب على رف مغناطيسي لمدة دقيقتين وأزل الفوق، مع الحرص على عدم إزعاج الخرز. الحمض النووي مرتبط بالخرز المغناطيسي في هذه الخطوة.
- إضافة 950 ميكرولتر من غسل المخزن المؤقت 1. دوامة لمدة 30 s وتكرار الخطوة 1.6.
- كرر الخطوة 1.7.
- إضافة 950 ميكرولتر من غسل المخزن المؤقت 2. دوامة لمدة 30 s وتكرار الخطوة 1.6.
- إضافة 100 ميكرولتر من العازلة elution والدوامة لمدة 2 دقيقة. ضع الأنبوب على موقف المغناطيسي لمدة 1 دقيقة ونقل supernatant التي تحتوي على gDNA إلى أنبوب جديد.
- استخدام 1 ميكرولتر من الحمض النووي المعزول عن الخلايا الهيماتوبوية لقياس نقاء الحمض النووي من خلال قياس الطيف باستخدام مقياس الفلور عن طريق الحصول على OD في 260 نانومتر، 280 نانومتر، و 230 نانومتر. تأكد من أن نسبة الكثافة البصرية (نسبة OD) عند 260 و 280 نانومتر بين 1.7-2.0 ونسبة OD عند 260 و 230 نانومتر بين 1.5-2.4.
2. إعداد العينة
- سخني الخلاط الحراري إلى 56 درجة مئوية.
- تسمية أنابيب 2 مل لجميع العينات، والمعايرة، والمواد المرجعية.
- تمييع العينات والمعايرة مع المخزن المؤقت elution (متوفر مع المجموعة المستخدمة للخطوة 1) في RT.
- بالنسبة لجميع العينات التجريبية، تمييع الحمض النووي إلى حجم إجمالي قدره 142 ميكرولتر. على سبيل المثال، تمييع 4 ميكرولتر من الحمض النووي الصبغي عند 100 نانوغرام/ميكرولتر إلى 138 ميكرولتر من المخزن المؤقت للاليوطيون.
ملاحظة: يمكن استخدام 400-1200 نانوغرام من الحمض النووي للفحص. - تمييع 75 ميكرولتر من المعايرة إلى حجم إجمالي قدره 142 ميكرولتر.
- تحقق من تركيز gDNA المرجعي باستخدام مقياس الطيف الضوئي، باستخدام TE (درجة الحموضة = 8.0) كفارغ.
- تمييع 1000-1200 نانوغرام من الحمض النووي المرجعي إلى حجم إجمالي قدره 142 ميكرولتر. على سبيل المثال، تمييع 10 ميكرولتر من الحمض النووي المرجعي عند 100 نانوغرام/ميكرولتر إلى 132 ميكرولتر من المخزن المؤقت للاليوطيون.
- بالنسبة لجميع العينات التجريبية، تمييع الحمض النووي إلى حجم إجمالي قدره 142 ميكرولتر. على سبيل المثال، تمييع 4 ميكرولتر من الحمض النووي الصبغي عند 100 نانوغرام/ميكرولتر إلى 138 ميكرولتر من المخزن المؤقت للاليوطيون.
- احتضان الأنابيب عند درجة حرارة 56 درجة مئوية لمدة 5 دقيقة عند 900 دورة في الدقيقة في جهاز ثيرموميكس. تدور لفترة وجيزة أسفل الأنابيب لجمع العينات.
3- تحويل بيسولفيت
ملاحظة: تأكد من أن أوقات الحضانة أثناء تحويل bisulfite تتبع الأوقات الموصى بها. الإفراط في الحضانة أو تحت الحضانة سيؤثر على نتائج الخضوع.
- تعيين خلاط حراري إلى 80 درجة مئوية.
- أضف 270 ميكرولتر من بيسولفيت الأمونيوم و90 ميكرولتر من كحول رباعي هيدروفورفوريل (THFA) إلى جميع الأنابيب. دوامة لمزيج تماما ولفترة وجيزة تدور أسفل العينات لجمع السائل في الجزء السفلي.
- احتضان الأنابيب في خلاط حراري عند 80 درجة مئوية لمدة 45 دقيقة عند 900 دورة في الدقيقة. إذا كنت تستخدم كتلة الحرارة، دوامة الأنابيب لمدة 1-2 s كل 4.5 دقيقة أثناء الحضانة.
- تدور لفترة وجيزة أسفل العينات والسماح لتبرد لRT لمدة 3-5 دقائق قبل الاستمرار في الخطوة 4 أو 5. يجب أن يكون الحجم النهائي ~ 500 ميكرولتر.
4. CD8 وTreg المقالات
- تنقية الحمض النووي بعد تحويل بيسولفيت
ملاحظة: يتم تنفيذ هذه الخطوة باستخدام مجموعة تنقية الحمض النووي المتاحة تجاريًا (انظر جدول المواد)على الحمض النووي المحول من bisulfite. تأكد من تسخين الكواشف إلى RT قبل الاستخدام.- قبل البدء في تنقية، وخلق خليط متجانس من الحمض النووي عزل الخرز المغناطيسي عن طريق دوامة لمدة 30 s. إضافة الإيثانول وisopropanol إلى المخازن المؤقتة غسل، بعد وحدات التخزين المدرجة على الزجاجات، وتعيين كتلة الحرارة إلى 65 درجة مئوية.
- في RT، أضف 870 ميكرولتر من العازلة الانليس/الربط و105 ميكرولتر من الخرز شبه المغناطيسي الملزم للحمض النووي إلى كل أنبوب من الخطوة 3.4. دوامة لمزيج تماما ولفترة وجيزة تدور أسفل الأنابيب.
- أضف 570 ميكرولتر من 2-بروبانول ودوامة لخلط تماما.
- احتضان الأنابيب في RT لمدة 7 دقيقة عند 50 دورة في الدقيقة في خلاط حراري أو خلاط دوار قياسي.
- تدور لفترة وجيزة أسفل الأنابيب. ضع الأنابيب على الرف المغناطيسي واحتضان لمدة 5 دقيقة.
- مع العينات لا تزال على الرف المغناطيسي، وإزالة supernatant دون إزعاج الخرز.
ملاحظة: الحمض النووي مرتبط بالخرز. - إزالة الأنابيب من الرف المغناطيسي وإضافة 900 ميكرولتر من غسل المخزن المؤقت 1. دوامة الأنابيب لإعادة تعليق تماما الخرز ومن ثم تدور لفترة وجيزة أسفل الأنابيب.
- إعادة الأنابيب إلى الرف المغناطيسي واحتضان لمدة 3 دقيقة.
- مع العينات لا تزال على الرف المغناطيسي، وإزالة supernatant دون إزعاج الخرز.
- كرر يغسل (4.1.7-4.1.9)، مرة واحدة مع غسل المخزن المؤقت 1، ثم مرتين مع غسل المخزن المؤقت 2.
- بعد إزالة supernatant، تدور لفترة وجيزة أسفل الأنابيب والعودة إلى رف المغناطيسي لمدة 3 دقيقة.
- إزالة جميع الاحتياطي غسل المتبقية 2 وإزالة الأنابيب من الرف المغناطيسي.
- جفف الخرز مع فتح أغطية الأنبوب عند 65 درجة مئوية لمدة 15 دقيقة.
- إضافة 60 ميكرولتر من العازلة elution إلى كل أنبوب واحتضان في RT لمدة 7 دقيقة في 1400 دورة في الدقيقة. بدلا من ذلك، دوامة بسرعة معتدلة باستخدام محول رغوة.
- تدور لفترة وجيزة أسفل الأنابيب ومكان على الرف المغناطيسي لمدة 2 دقيقة.
- نقل 55 ميكرولتر من eluate إلى أنبوب جديد دون إزعاج الخرز. يحتوي eluate على الحمض النووي المحول من bisulfite. قياس تركيز الحمض النووي غير مطلوب.
- إعداد وتشغيل qPCR
- قم بتشغيل جهاز qPCR والكمبيوتر الذي يقوم بتشغيل برنامجه.
- على واجهة مستخدم البرنامج إنشاء تجربة جديدة وتحديد الكتلة التي يتم استخدامها لتشغيل التجربة.
- حدد المنحنى القياسي كنوع من التجربة.
- إذا كان ذلك ممكنًا، فحدد كيمياء الكشف التي تريد استخدامها. يستخدم هذا الاسبوع الكواشف TaqMan. وإلا، حدد ROX كمرجع سلبي.
- إذا كان ذلك ممكناً، حدد خصائص الأداة التي يتم تشغيلها كـ قياسي.
- حدد تصميمك التجريبي من خلال تعيين أهداف (على سبيل المثال، GAPDH أو CD8 مع FAM كمراسل)، وquencher غير الفلورية.
- تعيين أسماء نماذج للمعايير والعينات وعناصر التحكم.
- بعد ذلك، تعيين كل موقف جيد وفقا للوحة qPCR. يتطلب كل بئر هدفًا، مثل CD8 أو GAPDH، واسم عينة. يتم تشغيل كل عينة في ثلاث مرات ويجب أن تنعكس على تخطيط لوحة للصك.
- تعيين كل معيار معيار المهمة القياسية وتحديد أرقام النسخة النهائية وفقا للجدول 1.
- تعيين عينات ومعايرة ومرجع المهمة غير معروف.
- تعيين آبار لـ لا يوجد تحكم في القالب كـ NTC أو N.
- إعداد التخفيفات التسلسلية للحمض النووي لامدا (10 نانوغرام/ميكرولتر) لاستخدامها كمعيار (انظر الجدول 1).
- إعداد الكوكتيلات مزيج qPCR الرئيسية، واحدة لنوع الخلية المستهدفة وواحدة لGAPDH (انظر الجدول 2). تشغيل جميع العينات والمعايير، وسيطرة NTC في ثلاثة توائم.
ملاحظة: يتم استخدام GAPDH لتحديد العدد الإجمالي للخلايا ويتم تشغيله بالتوازي مع تضخيم الهدف. يتم قياس نسخ من العناصر التنظيمية غير المثيلة لجين CD8 B في اختبار CD8، FoxP3 في Treg، وIL-17 في Th17. - استخدام لوحة جيدة 96 لqPCR. تحميل 3 ميكرولتر من الحمض النووي القالب في الآبار أولا. بعد ذلك، تحميل 7 ميكرولتر من المزيج الرئيسي.
- ختم لوحة مع فيلم qPCR وتدور لفترة وجيزة أسفل لوحة قبل وضعه في أداة qPCR.
- تشغيل qPCR كما هو موضح في الجدول 3.
- بعد اكتمال التشغيل، قم بتصدير بيانات qPCR كملف .txt أو .xlsx.
- تحليل البيانات باستخدام قوالب التحليل لـ فحص CD8 وفحص Treg (انظر جدول المواد)لحساب متوسط Ct والانحراف المعياري Ct ورقم النسخ.
| رقم نسخة البلازميد الأولي/3 ميكرولتر | حجم | دي إن دي إن تي [1] | رقم النسخة النهائية لكل 3 ميكرولتر | تسميه |
| 31250 | 1000 ميكرولتر | - | 31250 | الأمراض المنقولة عن بعد #1 |
| 31250 | 200 ميكرولتر | 800 ميكرولتر | 6250 | الأمراض المنقولة عن بعد #2 |
| 6250 | 200 ميكرولتر | 800 ميكرولتر | 1250 | الأمراض المنقولة عن بعد # 3 |
| 1250 | 200 ميكرولتر | 800 ميكرولتر | 250 | الأمراض المنقولة عن بعد # 4 |
| 250 | 200 ميكرولتر | 800 ميكرولتر | 50 | الأمراض المنقولة عن بعد # 5 |
| 1250 | 30 ميكرولتر | 1200 ميكرولتر | 30 | STD # 6 [2] |
| [1] 10 نانوغرام/ميكرولتر لامبادا الحمض النووي في TE (10 mM Tris، 1 mM EDTA، درجة الحموضة 8.0) | ||||
| [2] استخدام الأمراض المنقولة عن بعد # 3 لإعداد الأمراض المنقولة عن بعد # 6 | ||||
الجدول 1: إعداد حالات التخفيف القياسية. تم إعداد معايير تخفيف 4-سجل تمتد 31250-30 نسخة وفقا للجدول باستخدام الحمض النووي TE /lambda كما المخفف. واستخدمت نفس التخفيفات القياسية لكل من CD8 وGAPDH. تم تخزين المعايير عند -20 درجة مئوية.
| الكواشف | المبلغ |
| الحمض النووي لامبدا (50 نانوغرام/ميكرولتر في TE، درجة الحموضة 8.0) | 1 ميكرولتر |
| طاقة | 0.5 ميكرولتر |
| المياه، خالية من Nuclease | 0.5 ميكرولتر |
| ماستر ميكس | 5 ميكرولتر |
| مجموع | 7 ميكرولتر |
الجدول 2: إعداد كوكتيل qPCR. إعداد مزيج qPCR الرئيسي في أنبوبين منفصلين، واحد لكل CD8 و GAPDH، باستثناء الحمض النووي القالب وفقا للجدول.
| خطوه | الوقت | Temp | دورات |
| ما قبل الحضانة | 35 دقيقة | 95 درجة مئوية | 1X |
| التضخيم | 15 ثانية | 95 درجة مئوية | 50X |
| دقيقة واحدة | 61 درجة مئوية | ||
| تباطوء | 5 ثوان | 42 درجة مئوية | 1X |
الجدول 3: معلمات تشغيل qPCR لـ CD8 و Treg. تم تشغيل qPCR وفقا ً للمعلمات المحددة في الجدول.
5. Th17 الحسب
- تنقية الحمض النووي بعد تحويل بيسولفيت
- تنفيذ خطوات التنقية كما هو موضح في القسم 4.1.
- لelute العينات، إضافة 25 ميكرولتر من العازلة elution إلى كل أنبوب واحتضان في RT لمدة 7 دقيقة في 1400 دورة في الدقيقة. بدلا من ذلك، دوامة بسرعة معتدلة باستخدام محول رغوة.
- تدور لفترة وجيزة أسفل الأنابيب ومكان على رف المغناطيسي لمدة 2 دقيقة.
- نقل 20 ميكرولتر من الإيلوت إلى أنبوب جديد دون إزعاج الخرز. يحتوي eluate على الحمض النووي المحول من bisulfite.
- التضخيم المسبق للحمض النووي
ملاحظة: يوصى بالتضخيم المسبق للحمض النووي لأهداف الوفرة المنخفضة للقياس الكمي الدقيق عبر qPCR19. تم تصميم اختبار الميثيل Th17 لتتطلب preamplification لهذا السبب.- نقل 2 ميكرولتر من الحمض النووي المحول من البيسلفيت إلى أنابيب قطاع PCR. إنشاء أنبوب NTC مع 2 ميكرولتر من الماء.
- إنشاء المزيج الرئيسي preamplification لجميع العينات (انظر الجدول 4).
- أضف 23 ميكرولتر من المزيج الرئيسي إلى كل أنبوب. كاب الأنابيب، دوامة، وتدور لفترة وجيزة أسفل الأنابيب.
- تشغيل بروتوكول preamplification على cycler باستخدام غطاء ساخن. (الجدول5). بعد اكتمال المدى، تدور لفترة وجيزة أسفل الأنابيب.
- نقل 2 ميكرولتر من الحمض النووي المضخم إلى أنابيب جديدة وإضافة 78 ميكرولتر من الماء، مما يضعف العينات 1:40.
- إعداد وتشغيل qPCR
- اتبع القسم 4.2 لإعداد وتشغيل qPCR.
- تحليل البيانات باستخدام قالب التحليل لـ Th17 فحص (انظر جدول المواد)لحساب المتوسط Ct والانحراف المعياري Ct ورقم النسخ.
| كاشف | المبلغ |
| المياه، خالية من Nuclease | 9.5 ميكرولتر |
| الساخنة بدء PCR ميكس الرئيسي | 12.5 ميكرولتر |
| Th17 PCR التمهيدي | 1 ميكرولتر |
| مجموع | 23 ميكرولتر |
الجدول 4: ما قبل تضخيم الحمض النووي للفحص Th17. تم إعداد المزيج الرئيسي لرد الفعل قبل التضخيم وفقًا للجدول.
| خطوه | الوقت | Temp | دورات |
| ما قبل الحضانة | 35 دقيقة | 95 درجة مئوية | 1X |
| التسخ | دقيقة واحدة | 95 درجة مئوية | 12X |
| الصلب | 45 ثانية | 55 درجة مئوية | |
| استطاله | 30 ثانية | 72 درجة مئوية | |
| الإطالة النهائية | 10 دقيقة | 72 درجة مئوية | 1X |
| عقد | الي اجل غير مسمي | 4 درجات مئوية |
الجدول 5: Preamplify Th17 الحمض النووي. تم تضخيم الحمض النووي Th17 مسبقًا لمدة 12 دورة قبل qPCR الفعلي.
النتائج
تبدأ جميع اختبارات الميثيل الثلاثة بمدخلات من الحمض النووي العالمي وتسفر عن نسبة مئوية من خلايا CD8+ T أو Treg أو Th17 داخل مجموعة الخلايا بأكملها. تم تحليل البيانات التي تم إنشاؤها من qPCR بعد تحويل bisulfite باستخدام قالب التحليل المقدم. استخدم هذا القالب المنحنيات القياسية التي تم الحصول عليها من العينات القياسية لتقدير رقم نسخة الأهداف وإجمالي عدد الخلايا في عينات الاختبار. ثم تم حساب نوع الخلية النسبة المئوية باستخدام الصيغ المتكاملة في قوالب التحليل. ويبين الشكل 1 بيانات تمثيلية من فحص CD8+، تم الحصول عليها من تحليل كل من الخلايا أحادية النواة في الدم المحيطية والخلايا التائية من ثلاثة مانحين مختلفين باستخدام كل من قياس التدفق الخلوي وعينات الميثيل الموصوفة. وكانت الاتجاهات بين الطريقتين في جميع الجهات المانحة في كلا النوعين من الخلايا متشابهة. يوضح الشكل 2 بيانات تمثيلية من مُقَسَم Treg. تم تحليل ثلاثة متبرعين منقى من Treg باستخدام كل من qPCR المستندة إلى الميثيل وقياس التدفق الخلوي وتم رسم النتائج على الرسم البياني المبين. وكانت النتائج لكلا الطريقتين متشابهة نسبيا. ومع ذلك، في جميع الحالات تدفق علم الخلايا أسفرت عن قيم أعلى. ويبين الشكل 3 مقارنة خلايا Th17 المكتشفة عن طريق قياس التدفق الخلوي والميثيل. في هذا الرسم البياني ، هناك ظروف محفزة وغير محفزة للطرق التجريبية. الخلايا تتطلب التحفيز مع PMA والأيونوميسين والعلاج مع مثبط نقل البروتين لزيادة كمية IL-17A موجودة داخل كل خلية بحيث يمكن الكشف عنها عن طريق تدفق الخلايا20. يمكن الكشف عن حالة الميثيل بغض النظر عن حالة التحفيز. وأسفر قياس التدفق الخلوي عن مستويات أقل من خلايا Th17 بالمقارنة مع الميثيل. وقد تجلت حساسية وخصوصية الطرح من خلال حد قيم الفارغة (LOB) والحد من الكشف (LOD) والحد من الكمية (LOQ) المعروضة في الجدول 6.

الشكل 1: مقارنة التدفق والميثيل للنسب المئوية CD8+ لكل من PBMCs والخلايا التائية لثلاثة مانحين مختلفين. تم تعيين PBMCs والخلايا التائية من ثلاثة متبرعين مختلفين بالنسبة للنسبة المئوية لخلايا CD8 + T في جميع السكان باستخدام إما قياس التدفق الخلوي أو الميثيل. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
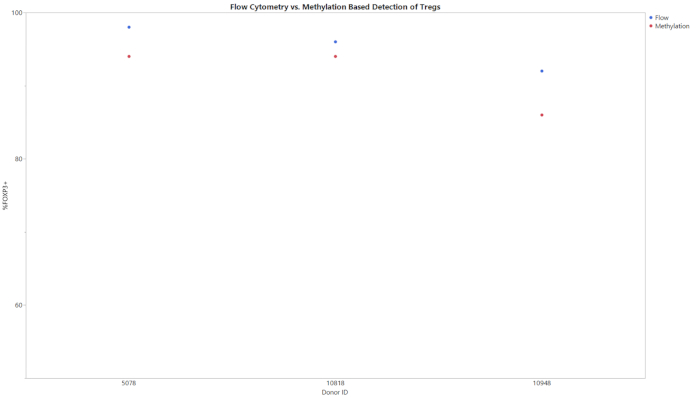
الشكل 2: مقارنة التدفق والميثيل لنسب Treg المئوية للTreg المنقى لثلاثة مانحين مختلفين. تم تعيين خلايا Treg المنقى بالنسبة المئوية لخلايا Treg في جميع السكان باستخدام إما قياس التدفق الخلوي أو الميثيل. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
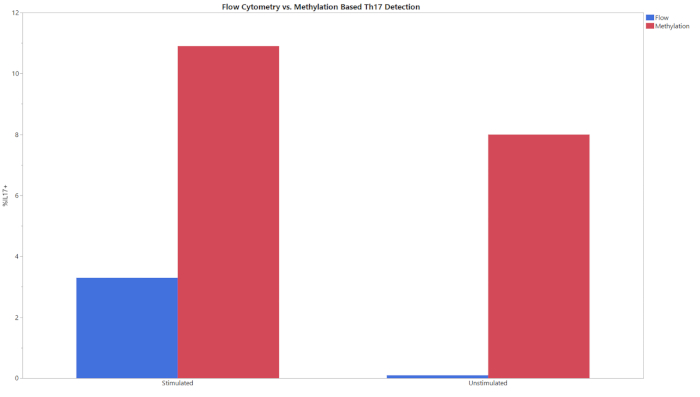
الشكل 3: مقارنة التدفق والميثيل للنسب المئوية لـ Th17 للمجموعات التجريبية المحفزة وغير المحفزة. تم تحليل الخلايا التائية المحفزة وغير المحفزة باستخدام كل من قياس التدفق الخلوي والميثيل. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
| مقايسه | Lob | اللد | LoQ |
| CD8 | 0 | 19 | 52 |
| غابد | 0 | 7 | 21 |
| FoxP3 | 0 | 3 | 12 |
| Th17 TpG | 0 | 35 | 73 |
| Th17 CpG | 0 | 38 | 73 |
الجدول 6: LoB، LoD، LoQ من أرقام النسخ للمقالات المستندة إلى الميثيل. يتم تفصيل حساسية وخصوصية المنقّاة من قبل قيم LoB و LoD و LoQ التي تم الحصول عليها بواسطة إرشادات MIQE21و22. بشكل عام، يمكن الكشف عن عدد قليل من 40 نسخة بدقة من خلال هذه المقالات.
Discussion
مع ظهور علاجات مناعية جديدة ، هناك حاجة إلى طرق موحدة للكشف عن هوية الخلايا المناعية ونقاوتها. ولا تزال أساليب التقييم لاختبار الاختبارات العملية واختبارات الإطلاق القوية والمعتمدة والقابلة للتطوير قائمة وتطرح تحدياً كبيراً لتسويق العلاجات القائمة على الخلايا. في حين أن قياس التدفق الخلوي هو حاليا الطريقة الأكثر شيوعا لفينوبتيب الخلايا المناعية، وارتفاع نوعية العينة ومتطلبات الكمية تجعل من الصعب للاستخدام المنتظم. علاوة على ذلك ، يتم تقييد تنفيذ قياس التدفق الخلوي في بيئة ممارسة التصنيع الجيدة (GMP) من خلال استراتيجيات الجاتينغ المعتمدة على المشغل ومتطلبات المعايير المرجعية لكل علامة تستخدم13،14. وعلى الرغم من أن الجاتينغ الآلي قد ثبت أنه يحسن متانة الاختبارات، فإنه ليس بعد استراتيجية راسخة لمراقبة الجودة. في حين يمكن أيضا أن تستخدم التنميط التعبير الجيني لتوصيف هوية المنتج العلاج الخلوي والنقاء، والبيانات هي شبه كمية وكثيفة العمالة. بالإضافة إلى ذلك، الحمض النووي الريبي والحمض النووي الريبي هي أقل استقرارا نسبيا من الحمض النووي ويمكن أن تسهم في عدم وجود نتائج قوية وقابلة للاستنساخ. وهكذا، فإن استخدام حالة ميثيل الحمض النووي اللاجيني لموضع معين يوفر طريقة مستقرة وسهلة الأداء وقوية وقابلة للتطوير لتحديد وتحديد نوع الخلية من الفائدة.
يعتمد الكشف عن أنماط الميثيل في الخلايا النمط الظاهري على ثلاث خطوات حاسمة: أولاً ، يتطلب إجراء فحص استخدام gDNA ، المعزول وفقًا للطرق الموصوفة. مطلوب الحمض النووي عالية الجودة وإذا لم تستخدم، قد تتأثر تحويل bisulfite23،24. إذا تم الحصول على الحمض النووي منخفض الجودة، يوصى بمزيد من التنقية لضمان موثوقية العينات. ثانيا، مطلوب نجاح تحويل بيسولفيت من السيتوزين غير ميثيلإلى uracil. الخطوة الأكثر أهمية في تحويل bisulfite هو تسخ الحمض النووي23،25. ارتفاع درجة الحرارة التهيئة باستخدام bisulfite الأمونيوم، بدلا من بيسولفيت الصوديوم، ويزيد من كفاءة التحويل والاتساق وهي العملية الموصى بها لهذه المقالات25،26. يجب على المستخدمين التأكد من أن التفاعل يحدث في 80 درجة مئوية وأن يتم خلط العينة بشكل متكرر. لهذه الأسباب ، يوصى بخلاط حراري رقمي (انظر جدول المواد). ثالثا، يجب اتباع تقنية الأنابيب السليمة أثناء إعداد qPCR. هناك حاجة إلى ثلاثة تكرار التقنية خلال رد فعل qPCR للتقيد بالحد الأدنى من المعلومات لنشر التجارب الكمية في الوقت الحقيقي PCR (MIQE) المبادئ التوجيهية27. وإدراج المزيد من اليكررات التقنية أمر مقبول ولكنه غير مطلوب. تقنية الأنابيب غير صحيح و / أو لا بما في ذلك يكرر التقنية سيؤدي إلى نتائج qPCR لا يمكن الاعتماد عليها.
إذا تم اتباع الخطوات الهامة ولم يتم الحصول على النتائج المرجوة بعد، يمكن الاستفادة من عناصر تحكم متعددة داخل الفحص لتحديد المشكلة. تحويل bisulfite السليم هو الخطوة الأكثر أهمية في هذا المنقّع. سيتم تمييز تحويل bisulfite غير السليم بواسطة عامل معايرة فاشل و/أو قيم مرجعية محسوبة بواسطة قالب التحليل. إذا تم إجراء تحويل bisulfite بشكل غير صحيح (على سبيل المثال، إذا تم تنفيذ رد الفعل في RT)، فلن يكون هناك أي تضخيم أثناء qPCR. أيضا، لن ينظر إلى أي تضخيم إذا تم إجراء خطأ أثناء إعداد رد فعل qPCR (على سبيل المثال، إذا لم تتم إضافة المزيج الرئيسي qPCR). يمكن فصل هاتين المسألتين عن طريق التحقيق في العينات القياسية. التضخيم في العينات القياسية، ولكن ليس العينات المرجعية والمعايرة والتجريبية، يشير إلى أن تحويل البيسولفيت لم يتم بشكل صحيح. لا يوجد تضخيم في أي من العينات تشير إلى أن qPCR لم يتم تنفيذها بشكل صحيح.
في حين أن هذا التحليل يتناول متطلبات العينة الصارمة وتباين التحليل المرتبط بأساليب الفينوبة الأخرى ، وتحديداً قياس التدفق الخلوي ، هناك قيود يجب ملاحظتها. يستهدف هذا الاسبلي موضع واحد يستخدم كمعرف فريد للخلية المستهدفة، والذي يحظر التحليل متعدد المضاعف الذي يتم تنفيذه بشكل شائع مع قياس التدفق الخلوي. وهذا يجعل تحديد أنواع الخلايا المعقدة مثل Th17 صعبة. ومع ذلك ، فقد ثبت أن استخدام أنماط الميثيل في مكان واحد علامة دقيقة لخلايا متعددة وقد استخدم في تجارب سريرية متعددة15،16. هذا صحيح خاصة في Tregs حيث تقييم FOXP3 التوقيعات الميثيل هو وسيلة دقيقة ولا لبس فيها للكشف عن Tregs صحيح من الخلايا عبر FOXP3 عابرة28. يتم تعويض فقدان التحليل المتعدد من خلال دقة loci التي تم استجوابها. يمكن أن تتضمن التكرارات المستقبلية للالمقايسة أصباغ qPCR متعددة وquenchers للسماح بالكشف عن loci متعددة في رد فعل واحد qPCR.
ويمكن استخدام هذا الفحص كطريقة بديلة للتدفق الخلوي في تحديد النمط الظاهري للخلية والهوية. تجدر الإشارة إلى أن هذا الخضوع لا ينتج القيم الدقيقة التي تدفق cytometry لا(الأشكال 1-3). ويرجع ذلك جزئيا إلى تباين تحليل البيانات المرتبط بقياس التدفق الخلوي. اعتمادا على استراتيجية الجاتينغ، يمكن أن تختلف النتائج من تدفق الخلايا بشكل كبير. هذا هو الحال بشكل خاص عند استخدام بروتوكولات تلطيخ معقدة للنظر في الأهداف داخل الخلايا ، مثل IL-17 ، حيث يمكن أن يصل معامل الاختلاف (CV) إلى 15٪14. بين العديد من المستخدمين ، وكان على النحو الثابت في إجراء عملية تقييم السيرة الذاتية من <15 ٪، مما يدعم متانة من قُدم وتحسين قدرات التوحيد القياسي. وينظر إلى أكبر الاختلافات بين اللاجينية وتدفق الخلايا القائم على phenotyping عندما يكون مطلوبا تحفيز الخلية(الشكل 3). تم إنجاز الكشف عن خلايا Th17 عبر قياس التدفق الخلوي باستخدام بروتوكول مشترك لتحفيز الخلايا التائية وتلطيخ الخلايا الخلوية29،30،31. يمكن أن تكون الاختلافات التي شوهدت في Th17 فينوبتيبينت بين القياس اللاجيني وقياس التدفق الخلوي بسبب حركية إنتاج IL-17. في حين أن توقيعات الميثيل ثابتة ، فإن إنتاج البروتين يستغرق وقتًا ويجب أن يكون موجودًا بكميات كافية ليتم اكتشافها بواسطة الأجسام المضادة الفلورية20،32. قد تحتاج الحضانة 6 h مع مثبط نقل البروتين وكوكتيل تحفيز الخلايا إلى توسيع هاوية لمعرفة مستوى خلايا Th17 التي تم اكتشافها عبر طرق الفينوتيكلالالجينية. هناك حاجة إلى مزيد من الدراسات لتحديد السبب الدقيق لعدم تطابق القيم وتحديد طريقة الفينوبة الأكثر دقة.
في هذا التقرير، نفصّل كيفية تحديد أنواع الخلايا المناعية وقياسها في خليط غير متجانس من الخلايا بطريقة بسيطة وقوية. تم تصميم وتحسين الاختبارات للاستخدام المحتمل في العملية واختبار الإفراج عن العلاجات القائمة على الخلايا. وتستوفي المقالات الموصوفة متطلبات استخدام المواد الخام المؤهلة تأهيلاعاليا في تطبيقات العلاج الخلوي. من خلال معالجة أوجه القصور في قياس التدفق الخلوي والأساليب الجزيئية الأخرى مثل الاستقرار ومتطلبات العينة والتحفيز المسبق وpermeabilization الخلوية للتلطيخ داخل الخلايا ، وموضوعية تحليل البيانات ، فإن الاختبارات الموصوفة في الخط مع أهداف تسويق العلاجات القائمة على الخلايا.
Disclosures
سومان ك. برادان، جيري غوزمان، كارل دارجيتز، مارك لاندون، وأوما لاكشميباثي يعملون من قبل Thermo Fisher Scientific. سفين أوليك، بيورن سمانز، وأولريش هوفمولر هم مؤسس وموظفون في شركة إيبوونتس، على التوالي. لم يتم استخدام أي مساعدة في الكتابة في إنتاج هذه المخطوطة.
Acknowledgements
تم تمويل المشروع من منحة Thermo Fisher العلمية الداخلية.
Materials
| Name | Company | Catalog Number | Comments |
| 2.0 ml Eppendorf Safe-Lock Tubes | Eppendorf | 22363344 | |
| Analysis template for CD8 assay | Click Here | ||
| Analysis template for Th17 assay | Click Here | ||
| Analysis template for Treg assay | Click Here | ||
| Attune NxT Acoustic Focusing Cytometer, blue/red/violet6/yellow | Thermo Fisher Scientific | A29004 | |
| CTS PureQuant CD8+ T-Cell Assay | Thermo Fisher Scientific | A43674 | |
| CTS PureQuant Th17 Assay | Thermo Fisher Scientific | A43676 | |
| CTS PureQuant Treg Assay | Thermo Fisher Scientific | A43675 | |
| Dynabeads SILANE Genomic DNA Kit | Thermo Fisher Scientific | 37012D | Used for genomic DNA isolation and purification after bisulfite conversion. Contains elution buffer to dilute samples. |
| DynaMag-2 Magnet | Thermo Fisher Scientific | 12321D | Used as a magnetic rack during DNA isolation and purification |
| eBioscience Essential Human T cell Phenotyping Kit | Thermo Fisher Scientific | A42923 | |
| eBioscience Essential Human Th1/Th17 Phenotyping Kit | Thermo Fisher Scientific | A42927 | |
| eBioscience Essential Human Treg Phenotyping Kit | Thermo Fisher Scientific | A42925 | |
| Eppendorf SmartBlock 2 mL | Eppendorf | 5362000035 | |
| Eppendorf ThermoMixer C | Eppendorf | 5382000023 | |
| HulaMixer Sample Mixer | Thermo Fisher Scientific | 15920D | Recommended sample mixer |
| NanoDrop | Thermo Fisher Scientific | ND 1000 | |
| Nonstick, RNase-free Microfuge Tubes, 1.5 mL | Applied Biosystems | AM12450 | |
| QuantStudio 12S Flex | Applied Biosystems | 4470661 | |
| TE, pH 8.0, RNase-free | Thermo Fisher Scientific | AM9849 | |
| Vortex Mixer | Thermo Fisher Scientific | H2KT17113 |
References
- Hartmann, J., Schüßler-Lenz, M., Bondanza, A., Buchholz, C. J. Clinical development of CAR T cells-challenges and opportunities in translating innovative treatment concepts. EMBO Molecular Medicine. 9, 1183-1197 (2017).
- Graham, C., Jozwik, A., Pepper, A., Benjamin, R. Allogeneic CAR-T Cells: More than Ease of Access? Cells. 7, E155(2018).
- Turtle, C. J., et al. CD19 CAR-T cells of defined CD4+:CD8+ composition in adult B cell ALL patients. Journal of Clinical Investigation. 126, 2123-2138 (2016).
- Akalin, I., et al. Effects of Chimeric Antigen Receptor (CAR) Expression on Regulatory T Cells. Molecular Therapy. 17, S25(2009).
- Knochelmann, H. M., et al. CAR T Cells in Solid Tumors: Blueprints for Building Effective Therapies. Frontiers in Immunology. 9, (2018).
- Chen, M. L., et al. Regulatory T cells suppress tumor-specific CD8 T cell cytotoxicity through TGF-β signals in vivo. Proceedings of the National Academy of Sciences. 102, 419-424 (2005).
- Muranski, P., et al. Tumor-specific Th17-polarized cells eradicate large established melanoma. Blood. 112, 362-373 (2008).
- Majchrzak, K., et al. Exploiting IL-17-producing CD4+ and CD8+ T cells to improve cancer immunotherapy in the clinic. Cancer Immunology, Immunotherapy. 65, 247-259 (2016).
- Guedan, S., et al. ICOS-based chimeric antigen receptors program bipolar TH17/TH1 cells. Blood. 124, 1070-1080 (2014).
- Vicetti Miguel, R. D., Maryak, S. A., Cherpes, T. L. Brefeldin A, but not monensin, enables flow cytometric detection of interleukin-4 within peripheral T cells responding to ex vivo stimulation with Chlamydia trachomatis. Journal of Immunological Methods. 384, 191-195 (2012).
- Lovelace, P., Maecker, H. T. Multiparameter Intracellular Cytokine Staining. Methods in Molecular Biology. 699, 165-178 (2011).
- Presicce, P., Moreno-Fernandez, M. E., Lages, C. S., Orsborn, K. I., Chougnet, C. A. Association of two clones allows for optimal detection of human FOXP3. Cytometry A. 77, 571-579 (2010).
- Pachón, G., Caragol, I., Petriz, J. Subjectivity and flow cytometric variability. Nature Reviews Immunology. 12, 396(2012).
- Westera, L., et al. Centrally Determined Standardization of Flow Cytometry Methods Reduces Interlaboratory Variation in a Prospective Multicenter Study. Clinical and Translational Gastroenterology. 8, e126(2017).
- Baron, U., et al. Epigenetic immune cell counting in human blood samples for immunodiagnostics. Science Translational Medicine. 10, (2018).
- Kleen, T. O., Yuan, J. Quantitative real-time PCR assisted cell counting (qPACC) for epigenetic - based immune cell quantification in blood and tissue. Journal for ImmunoTherapy of Cancer. 3, 46(2015).
- Rapko, S., et al. DNA methylation analysis as novel tool for quality control in regenerative medicine. Tissue Engineering. 13, 2271-2280 (2007).
- Wieczorek, G., et al. Quantitative DNA Methylation Analysis of FOXP3 as a New Method for Counting Regulatory T Cells in Peripheral Blood and Solid Tissue. Cancer Research. 69, 599-608 (2009).
- Andersson, D., et al. Properties of targeted preamplification in DNA and cDNA quantification. Expert Review of Molecular Diagnosis. 15, 1085-1100 (2015).
- Jung, T., Schauer, U., Heusser, C., Neumann, C., Rieger, C. Detection of intracellular cytokines by flow cytometry. Journal of Immunological Methods. 159, 197-207 (1993).
- Armbruster, D. A., Pry, T. Limit of Blank, Limit of Detection and Limit of Quantitation. Clinical Biochemistry Reviews. 29, S49-S52 (2008).
- Bustin, S. A., et al. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments. Clinical Chemistry. 55, 611-622 (2009).
- Li, Y., Tollefsbol, T. O. DNA methylation detection: Bisulfite genomic sequencing analysis. Methods in Molecular Biology. 791, 11-21 (2011).
- Warnecke, P. M., et al. Identification and resolution of artifacts in bisulfite sequencing. Methods. 27, 101-107 (2002).
- Genereux, D. P., Johnson, W. C., Burden, A. F., Stöger, R., Laird, C. D. Errors in the bisulfite conversion of DNA: modulating inappropriate- and failed-conversion frequencies. Nucleic Acids Research. 36, e150(2008).
- Darst, R. P., Pardo, C. E., Ai, L., Brown, K. D., Kladde, M. P. Bisulfite Sequencing of DNA. Current Protocols in Molecular Biology. 91, 7.9.1-7.9.7 (2010).
- Taylor, S., Wakem, M., Dijkman, G., Alsarraj, M., Nguyen, M. A practical approach to RT-qPCR-Publishing data that conform to the MIQE guidelines. Methods. 50, S1-S5 (2010).
- Baron, U., et al. DNA demethylation in the human FOXP3 locus discriminates regulatory T cells from activated FOXP3(+) conventional T cells. European Journal of Immunology. 37, 2378-2389 (2007).
- Yao, Z., et al. Human IL-17: a novel cytokine derived from T cells. Journal of Immunology. 155, 5483-5486 (1995).
- Lockhart, E., Green, A. M., Flynn, J. L. IL-17 production is dominated by gammadelta T cells rather than CD4 T cells during Mycobacterium tuberculosis infection. Journal of Immunology. 177, 4662-4669 (2006).
- Liang, S. C., et al. Interleukin (IL)-22 and IL-17 are coexpressed by Th17 cells and cooperatively enhance expression of antimicrobial peptides. Journal of Experimental Medicine. 203, 2271-2279 (2006).
- Olsen, I., Sollid, L. M. Pitfalls in determining the cytokine profile of human T cells. Journal of Immunological Methods. 390, 106-112 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved