Method Article
קביעת זהות התא החיסונית וטוהר באמצעות PCR כמותי מבוסס אפיגנטי
In This Article
Summary
כאן אנו מתארים שיטה איתנה של קביעת זהות התא החיסונית וטוהר באמצעות חתימות אפיגנטיות זוהה באמצעות PCR כמותי (qPCR). DNA demethylation על מקום מסוים משמש מזהה ייחודי עבור סוג תא מסוים ומאפשר זיהוי של CD8 +, רגולציה, או Th17 T תאים.
Abstract
תא החיסונית מסוג תדרים האוכלוסייה יכול להיות השפעה גדולה על היעילות של טיפולים תא T. שיטות נוכחיות, כמו הזרימה cy, יש דרישות דוגמה ספציפיות, הקלט לדוגמה גבוהה, הם תפוקה נמוכה, והם קשים לתקנן, כולם מזיקים לאפיון של מוצרי טיפול בתאים במהלך התפתחותם ו ייצור.
The אומר תיאר בזאת במדויק לזהות לכמת את סוגי התא החיסונית בתערובת הטרוגנית של תאים באמצעות DNA גנומית מבודדת (gDNA). דפוסי מתילציה DNA מתגלים באמצעות המרה ביסולפיט, תהליך שבו ציטוסינוסים בלתי מגנטיים מומרים uracils. אזורי ה-DNA ללא מתילנטי מזוהים באמצעות הגברה של qPCR באמצעות התמקדות באזורים שהומרו למטרה. מקום ייחודי אחד לכל שיטת המדידה נמדד ומשמש כמזהה מדויק עבור סוג תא מסוים. השיטה היא איתנה וזהה תאים CD8 +, רגולציה וTh17 T באופן תפוקה גבוהה. אלה בחני ממוטבת יכול לשמש בדיקה בתהליך ובדיקות שחרור המוצר עבור תהליך הטיפול בתאים.
Introduction
השימוש בתאי T בטיפול חיסוני הסלולר עלה באופן משמעותי במהלך העשור האחרון, במיוחד עם הופעתו של קולטן אנטיגן של צ'יאריק (רכב) T טכנולוגיית תא1. בעוד הטיפולים T מבוססי תא נפגשו עם הצלחה קלינית גדולה, הם הטרוגנית מאפייני התא זהויות יכול להשתנות באופן משמעותי בין התורמים2. טרוגניות של אוכלוסיות T יכול להיות השפעה גדולה על יעילות טיפולית ומסבך מסקנות מניסויים קליניים. מסיבה זו, הוא חיוני כדי להבין תא T טרוגניות במהלך ייצור המוצר וניסוח כדי לקבוע את הניסוחים האופטימלי של הטיפול החיסוני T תא.
במובן רחב, תאים t ניתן לחלק לשתי קבוצות: CD4 + מסייע תאים t, אשר מפרישות ציטוקינים האימונומודולטוריים, ו CD8 + ציטוטוקסיים t תאים, אשר ישירות lyse תאים המציגים את האנטיגן קנצוני על מורכבות מורכבת היסטלבית (mhc). אני מולקולות CD4 + מסייע תאים T יכול להבדיל מספר רב של קבוצות מערכות ספציפיות המייצרים קבוצה ייחודית של ציטוקינים. יש המציעים כי יחס מוגדר של CD4 + כדי CD8 + T תאים במוצר התא הסופי למקסם את היעילות vivo והתמדה אבל יכול לסבך את ייצור התאים3. התאים הרגולטורים T (Tregs), תת קבוצה של תאים CD4 + T, הם מדכאים ולצמצם את ההפעלה של תאים חיסוניים. התאים הרגולציה t היו מעורבים סובלנות הגידול תיווך, אם הנוכחי במהלך ייצור תא T מכונית, יכול לעכב את התגובה החיסונית antitumor של תאים tמכונית 4,5,6. אחרים CD4 + קבוצות מערכות כגון T עוזר 17 (Th17) תאי T לקדם את הסיווג הגידול יכול להיות ממונפת כדי להגדיל את היעילות של טיפולים תא T. כך, הגדלת Th17 CD4 + T תאים הוא עניין מיוחד הגדרות הגידול מוצק שבו הפקה מוגברת של אינטרלויקין 17 (IL-17) מקדם את תגובת החיסון נגד הגידול5,7,8,9. הבנת החשיבות של תאים Th17 בתגובות לגידול התבקשו לחקור יותר אסטרטגיות כדי ליצור תאים אלה בתוך מבחנה7,9. לכן, שיטות לזיהוי אלה ערכות המשנה של תא T הם חיוניים למיטוב טיפולים תא T צריך להיות חסון, קל, מדרגי, ו להיות הניתנים לגילוי.
השיטה השכיחה ביותר היא לקבוע את זהותו של תא החיסון. עם זאת, הזרימה cy, לנסות לחיות, תאים שלמים שיש לנתח באותו יום הם נקצרו. עבור כתמים הפרשות תאיים (ICS), הפרשת חלבון עיכוב נדרש כדי לשמור ציטוקינים בתוך התאים T. עם זאת, תרכובות מעכבי שונים יש השפעות דיפרנציאליות על הפרשה של ציטוקינים ספציפיים, לאלץ את המשתמשים ליצור קוקטיילים מיוחדים לגילוי של ציטוקינים הריבית10,11. בנוסף, הנאמנות של הזרימה cy, לנסות מסתמך על שיבוטים נוגדנים כי לאגד באופן ספציפי ומלא המטרה שלהם. השימוש שיבוטים נוגדנים שונים יכולים לגרום לתוצאות משתנות להוביל למסקנות מדויקות, מה שהופך את השיטה קשה לתקנן12. עוד, ניתוח של נתונים שנאספו באמצעות הזרימה cy, ולכן מסקנות הנובעות מהנתונים, יכולים להשתנות במידה רבה בין משתמשים המבוססים על האופן שבו גייטס מוגדר13,14. מסיבות אלה, הזרמת cy, הזרימה אינה אידיאלית לבקרת איכות מדויקת במהלך פיתוח הטיפול בתאים.
הערכה של מתיונין גנולציה במקום הגן הספציפי היא שיטה חלופית לקביעת זהות התא. הרציונל לשימוש ב-DNA מתילציה כדי לזהות סוגי תאים ספציפיים תוארה במאמרים מרובים מסתמך על דפוסי מתילציה ספציפיים נוכח באוכלוסייה תא נתון15,16,17. בתאי יעד, אתרים מסוימים מכילים נוקלאוטידים לא ממוזגים, ואילו בתאים שאינם כוונת יעד אתרים אלה מתאבקי. תבנית זו ניתן לזהות באמצעות המרה יסולפיט תהליך הממיר באופן בלעדי נוקלאוטידים ציטוסינוס (C) כדי אורציל (U). התחל והבדיקות יכולות להיות מתוכננות נגד האתרים שהומרו, ואז הוגדל וזוהו באמצעות qPCR16.
השיטת המדידה המתוארת בזאת מודדת את תדירות תת-הבית החיסונית בתוך אוכלוסיות הטרוגניות, על-ידי כימות מספר המקום המסוים שאינו מתילנטי לעומת גן שירות. העתקים של האלמנטים הרגולטורים הבלתי מגנטיים עבור הגן CD8 B נמדדים בCD8, FoxP3 ב-Treg, ו-IL-17 בשנת Th17 באותו שיטת הפעולה. לוקוסים אלה זוהו על ידי בידוד אוכלוסיית התאים הספציפיים של עניין (למשל, CD8 + T תאים) וביצוע רצף יסולפיט כדי לזהות את האתר כי הם בלתי ממתיט רק את סוג התא15. התחל והבדיקות מפותחות כנגד המטה הבלתי מתילנטי והדגימות מנתחים באמצעות qPCR. עקומה סטנדרטית של מספרי עותקים מוכרים נוצרת מדילול של מספר עותקים גבוה של התקן הסינון, ומאפשר המרה של ערך Ct למספר עותק תעתיק.
כדי להעריך את ביצועי היישום, יש צורך בדגימות שליטה, כולל gDNA הפניה ומרכז פלגיאטור. ההתייחסות חומר גנומית הוא דגימת דם במאגר מתורמים מרובים עם תדרים הידוע תאים החיסונית משמש עבור בקרת איכות (QC) בדיקת הביצועים. מדגם מכייל הוא מסונתז באמצע המכיל את CD8, FoxP3, ואת רצפי הגנים של שוויון היחס. הוא משמש כמדד של יעילות המרה יסולפיט כי המרות יסולפיט בתוך אזורים גנומית שונים ישתנו ביעילות. היחס של היעד כדי לשנות את בתוך הכייל הוא 1, אבל בשל הבדלים של יעילות המרה יסולפיט היחס יכול להשתנות. גורם כיול זה מוחל על CD8 ו Treg assays אמר. FoxP3, הגן המשמש בתוך שיטת Treg, ממוקם על כרומוזום X. מאחר שהקיום הזה מודד רק עותקים שאינם מFoxP3, ורק עותק אחד של FoxP3 הוא בלתי מתילנטי בתוך הטריגים, שיטת הסקס היא אגנוסטי וניתן להשתמש בה עם דגימות של זכרים ונשים18. הTh17 אינו מנצל את מדגם המכייל או את ה-gdh כגנים של משק בית. במקום זאת, תחל אחר להגדיר מיקוד את המקום המתיל הקיים בתאים שאינם Th17 כלולים, המספר הכולל של תאים משתקף על ידי הסכום של עותקים ממתיל ובלתי ממתיל של IL-17. הנתונים שהתקבלו מ-qPCR מוזנים לתבנית ניתוח מוגדרת מראש המבצעת בדיקות בקרת איכות על הנתונים ומחשבת את האחוז של תא היעד בתוך האוכלוסיה המתחילה. הדבר מספק ניתוח נתונים אוטומטי ולא משוחד, ובכך מסיר סובייקטיביות של משתמשים ושיפור יכולות סטנדרטיזציה.
השיטה משתמשת ב-gDNA, אשר ניתן לבודד על ידי הליך לוקיהרזיס באמצעות מתורבת או תאים קבועים, או כדורי תא קפואים. הדרישה למדגם נמוך, גמישות בחומר ההתחלתי לדוגמה, דיוק גבוהה, וניתוח מתוקננת כתובת המגבלות המשויכות לזרימה cy, והינם אידיאליים למטרות בקרת איכות במהלך התפתחות תהליך הטיפול בתאים.
Protocol
כל הדגימות האנושיות התקבלו ממקור מסחרי בעקבות ההנחיות שלהם לאתיקה של המחקר האנושי.
1. דנ א גנומית בידוד
הערה: בידוד DNA גנומית מבוצע באמצעות ערכה מסחרית זמין (ראה טבלת חומרים) מכל התאים המטבטיים, כגון תאי דם היקפיים (PBMCs), תאי T מטוהרים, או כל סוג תא המטמית אחרת. בניסוי זה, נעשה שימוש בתאי דם היקפיים (PBMCs) ובתאי T משלושה תורמים אנושיים שונים.
- מקום 1-2 x 106 תאים המטפאות בצינור חרוט וצנטריפוגה ב 400 x g עבור 10 דקות.
- . מרוב את הסופרנטאנט לחלוטין
- הוסף 350 μL של מאגר הליזה/כריכה למדגם ו-דגירה עבור 10 דקות ב 55 ° c.
- הוסף 50 μL של פרוטאינאז K (20 מ"ג/mL) כדי 350 μL של השעיית תא ומערבולת עבור 30 s.
- הוסף 50 μL של כריכת ה-DNA חרוזי פאראמגנטים ו 400 μL של 100% איזופנול ו דגירה עבור 3 דקות בטמפרטורת החדר (RT).
- מניחים את הצינור על מתלה מגנטי עבור 2 דקות ולהסיר את supernatant, מטפלת לא להפריע את החרוזים. הדנ א מאוגד לחרוזים המגנטיים בשלב זה.
- הוסף 950 μL של שטיפת מאגר 1. מערבולת עבור 30 s וחזור על שלב 1.6.
- חזור על שלב 1.7.
- הוסף 950 μL של שטיפת מאגר 2. מערבולת עבור 30 s וחזור על שלב 1.6.
- הוסף 100 μL של מאגר הימנעות ומערבולת עבור 2 דקות. מניחים את הצינור על עמדה מגנטית עבור 1 דקות ולהעביר את supernatant המכיל את gDNA לצינור חדש.
- השתמש 1 μL של gDNA מבודדים מתאי המטפאות כדי למדוד את הטוהר של gDNA על ידי ספקטרופוטומטר באמצעות fluorimeter על ידי קבלת OD ב 260 nm, 280 nm, ו 230 nm. ודא כי היחס של צפיפות אופטית (מיחס OD) ב 260 ו 280 ננומטר הוא בין 1.7-2.0 ואת יחס OD ב 260 ו 230 ננומטר בין 1.5-2.4.
2. הכנה לדוגמא
- מחממים thermomixer עד 56 ° c.
- תווית 2 מ ל צינורות עבור כל הדגימות, מכייל, וחומר התייחסות.
- לדלל את הדגימות ומכייל עם מאגר להתחמק (זמין עם הקיט המשמש שלב 1) ב RT.
- עבור כל הדגימות ניסיוני, לדלל את gDNA לנפח כולל של 142 μL. לדוגמה, לדלל 4 μL של gDNA ב 100 ng/μL לתוך 138 μL של מאגר הימנעות.
הערה: ניתן להשתמש ב-400 אלף ng של gDNA לצורך האפשרות. - לדלל 75 μL של המכייל לנפח הכולל של 142 μL.
- בדוק את ריכוז gDNA הייחוס עם ספקטרוסקופיה, באמצעות TE (pH = 8.0) כריק.
- לדלל 1000-1200 ng של התייחסות gDNA לנפח כולל של 142 μL. לדוגמה, לדלל 10 μL של התייחסות gDNA ב 100 ng/μL לתוך 132 μL של מאגר הימנעות.
- עבור כל הדגימות ניסיוני, לדלל את gDNA לנפח כולל של 142 μL. לדוגמה, לדלל 4 μL של gDNA ב 100 ng/μL לתוך 138 μL של מאגר הימנעות.
- מודטה את הצינורות ב 56 ° צ' עבור 5 דקות ב 900 rpm ב thermomixer. בקצרה לסובב את הצינורות כדי לאסוף את הדגימות.
3. המרת ביסולפיט
הערה: ודא שזמני הדגירה במהלך ההמרה הביוסולפיט מתבצע במועדים המומלצים. דגירה מחדש או מתחת לדגירה תשפיע על תוצאות הערך.
- הגדר מthermomixer ל-80 ° c.
- הוסף 270 μL של אמוניום ביסולפיט ו 90 μL של כוהל (THFA) לתוך כל הצינורות. מערבולת לערבב לחלוטין ובקצרה לסובב את הדגימות כדי לאסוף את הנוזל בתחתית.
- מודטה את הצינורות thermomixer ב 80 ° צ' עבור 45 דקות ב 900 rpm. אם באמצעות בלוק חום, מערבולת את הצינורות עבור 1-2 s כל 4.5 דקות במהלך הדגירה.
- בקצרה לסובב את הדגימות ולאפשר קריר כדי RT עבור 3-5 דקות לפני שתמשיך עם שלב 4 או 5. אמצעי האחסון הסופי צריך להיות ~ 500 μL.
4. CD8 ו treg בחני
- טיהור דנ א בעקבות המרה ביסולפיט
הערה: שלב זה מבוצע באמצעות ערכת הטיהור הזמינה מסחרית DNA (ראה טבלת חומרים) על ה-dna ביסולפיט המרה. ודא כי ריאגנטים מחוממים RT לפני השימוש.- לפני תחילת הטיהור, ליצור תערובת הומוגנית של בידוד ה-DNA מחרוזת מגנטית על ידי vortexing עבור 30 s. הוסיפו אתנול ואיזופנול למאגרי הכביסה, בעקבות הכרכים המפורטים על הבקבוקים, וקבעו בלוק חום עד 65 ° c.
- ב-RT, להוסיף 870 μL של מאגר הליזה/כריכה ו 105 μL של כריכת ה-DNA מחרוזת פאראמגנטית על כל צינור משלב 3.4. מערבולת לערבב לגמרי ובקצרה לסובב את הצינורות.
- הוסף 570 μL של 2-propanol ומערבולת לערבב לחלוטין.
- מודטה את הצינורות ב-RT עבור 7 דקות ב 50 rpm ב thermomixer או מערבל מסתובבת רגיל.
- . לקצר את הצינורות מניחים את הצינורות על המדף המגנטי ו הדגירה עבור 5 דקות.
- , כאשר הדגימות עדיין על המדף המגנטי. הסר את הסופרנטאנט מבלי להפריע לחרוזים
הערה: הדנ א מאוגד לחרוזים. - להסיר את הצינורות מהמדף המגנטי ולהוסיף 900 μL של כביסה מאגר 1. מערבולת צינורות כדי להשעות מחדש לחלוטין את החרוזים ולאחר מכן בקצרה לסובב את הצינורות.
- להחזיר את הצינורות אל המדף המגנטי ו הדגירה עבור 3 דקות.
- , כאשר הדגימות עדיין על המדף המגנטי. הסר את הסופרנטאנט מבלי להפריע לחרוזים
- חזור על השטיפה (4.1.7-4.1.9), פעם אחת עם מאגר הכביסה 1, ולאחר מכן פעמיים עם מאגר כביסה 2.
- לאחר הסרת supernatant, בקצרה לסובב את הצינורות ולחזור למדף המגנטי עבור 3 דקות.
- להסיר את כל מאגר לשטוף שיורית 2 ולהסיר את הצינורות מהמדף המגנטי.
- מייבשים את החרוזים עם מכסים הצינור ב65 ° c למשך 15 דקות.
- הוסף 60 μL של מאגר משחרל כל צינור ו-דגירה ב-RT עבור 7 דקות ב 1,400 סל ד. לחילופין, מערבולת במהירות מתונה באמצעות מתאם קצף.
- בקצרה לסובב את הצינורות ואת המקום על המדף המגנטי עבור 2 דקות.
- העבר 55 μL של הפרעות לצינור חדש מבלי להפריע את החרוזים. האלוטה מכיל את הדנ א. של הביסולפיט המומר אין צורך למדוד את ריכוז ה-DNA.
- הגדר והפעל את qPCR
- הפעל את מחשב ה-qPCR ואת המחשב שמפעיל את התוכנה שלה.
- בממשק המשתמש של התוכנה ליצור ניסוי חדש ולבחור איזה בלוק משמש להפעלת הניסוי.
- בחר עיקול רגיל כסוג הניסוי.
- אם ישים, בחר את כימיית הזיהוי שבה ברצונך להשתמש. שיטת הפעולה משתמשת בריאגנטים של Taqman. אחרת, בחר רוקס כהפניה הפסיבית.
- אם ישים, בחר את מאפייני הכלי הפעל כסטנדרט.
- הגדירו את העיצוב הניסיוני שלכם על ידי הקצאת יעדים (למשל, "CD8 DH" או "משפחה"), ומלא-פלורסנט.
- הקצה שמות לדוגמה עבור התקנים, הדוגמאות והפקדים.
- לאחר מכן, הקצה כל מיקום טוב בהתאם ללוחית ה-qPCR. כל הטוב דורש יעד, כגון CD8 או הגנד, ושם מדגם. כל מדגם מופעל בטרילקאט וחייב להיות משתקף בפריסת הלוחית של הכלי.
- הקצה כל תקן לתקן הפעילות וציין את מספרי העותקים הסופיים בהתאם לטבלה 1.
- הקצאת דגימות, מכייל והפניה למשימה לא ידועה.
- הגדר בארות ללא פקד תבנית כ- Ntc או N.
- הכן את הדילול הסידורי של ה-DNA של למדא (10 ng/μL) כדי לשמש כתקן (ראה טבלה 1).
- הכן את הקוקטיילים הראשיים של qPCR, אחד עבור סוג תא היעד ואחד עבור היחידה (ראה טבלה 2). הפעל את כל הדגימות, התקנים ובקרת NTC בטרילקאט.
הערה: במקביל משמש לכמת את המספר הכולל של התאים והוא מופעל מקביל עם הגברה היעד. העתקים של מרכיבי רגולציה בלתי מגנטיים עבור הגן CD8 B נמדדים בCD8, FoxP3 ב-Treg, ו -IL-17 בTh17. - השתמש בצלחת 96 עבור qPCR. טען 3 μL של DNA תבנית לתוך הבארות תחילה. לאחר מכן, טען 7 μL של המיקס הראשי.
- לאטום את הצלחת עם סרט qPCR ולקצר את הצלחת לפני הצבת אותו לתוך המכשיר qPCR.
- הפעל את ה-qPCR כפי שמוצג בטבלה 3.
- לאחר השלמת ההפעלה, יצא את נתוני ה-qPCR כקובץ. txt או. xlsx.
- נתח את הנתונים באמצעות תבניות הניתוח עבור הCD8 והטיפול בשיטת Treg (ראה טבלת חומרים) כדי לחשב את ממוצע ה-Ct, סטיית תקן ct ומספר עותק.
| מספר העתק ראשוני של העותק/3 μL | אמצעי אחסון | מדלל דנ א [1] | מספר עותק סופי לכל 3 μL | תווית |
| 31250 | 1000 מיקרומטר | - | 31250 | STD 1 |
| 31250 | 200 מיקרומטר | 800 מיקרומטר | 6250 | סטיית תקן 2 |
| 6250 | 200 מיקרומטר | 800 מיקרומטר | 1250 | STD 3 |
| 1250 | 200 מיקרומטר | 800 מיקרומטר | 250 | סטיית תקן 4 |
| 250 | 200 מיקרומטר | 800 מיקרומטר | 50 | סטיית תקן 5 |
| 1250 | 30 μL | 1200 מיקרומטר | 30 | STD 6 [2] |
| [1] 10 ng/μL DNA למדא ב TE (10 מ"מ טריס, 1 מ"מ EDTA, pH 8.0) | ||||
| [2] להשתמש STD 3 כדי להכין STD 6 | ||||
טבלה 1: הכנת מדלל סטנדרטי. תקני דילול 4-log המשתרעים על-פני 31250-30 עותקים הוכנו בהתאם לטבלה באמצעות ד. נ. א/למדא כדילול. אותן הדילול הרגיל שימשו הן עבור CD8 והן עבור השאר. הסטנדרטים אוחסנו ב-20 ° c.
| ריאגנטים | כמות |
| DNA למדא (50 ng/μL ב-TE, pH 8.0) | 1 ליטר |
| שיטת טקמאן | 0.5 מיקרומטר |
| מים, נוקיחכירה-חינם | 0.5 מיקרומטר |
| מיקס מאסטר | 5 מיקרומטר |
| כולל | 7 מיקרומטר |
שולחן 2: הכנת קוקטייל qPCR. הכינו את התמהיל הראשי של qPCR בשתי שפופרות נפרדות, אחת לכל CD8 ו-"המשך", למעט ה-DNA של התבנית לפי הטבלה.
| צעד | זמן | Temp | מחזורי |
| טרום דגירה | 35 דקות | 95 ° c | 1X |
| גברה | 15 שניות | 95 ° c | 50X |
| 1 דקות | 61 ° צ' | ||
| Cooldown | 5 שניות | 42 ° c | 1X |
שולחן 3: הפרמטרים של qPCR מנהלים את הCD8 והשיטת Treg. ה-qPCR הופעל בהתאם לפרמטרים שצוינו בטבלה.
Th17 שיטת 5.
- טיהור דנ א בעקבות המרה ביסולפיט
- בצע את שלבי הטיהור כמתואר בסעיף 4.1.
- כדי לעשות את הדגימות, להוסיף 25 μL של מאגר החומקת לכל צינור ו-דגירה ב RT עבור 7 דקות ב 1,400 סל ד. לחילופין, מערבולת במהירות מתונה באמצעות מתאם קצף.
- בקצרה לסובב את הצינורות ומניחים על מדף מגנטי עבור 2 דקות.
- העברה 20 μL של הפרעות לצינור חדש מבלי להפריע את החרוזים. האלוטה מכיל את הדנ א. של הביסולפיט המומר
- מקדם הגברה של דנ א
הערה: הגברה של הדנ א מומלצת למטרות שפע נמוכות לקוונפיקציה מדויקת דרך qPCR19. הTh17 של מתילציה תוכננה לדרוש הגברה מסיבה זו.- העברה 2 μL של ה-DNA ביסולפיט המרה לצינורות הסטריפ של ה-PCR. צור צינורית NTC עם 2 μL של מים.
- צור את המיקס הראשי של הגברה עבור כל הדגימות (ראה טבלה 4).
- הוסף 23 μL של המיקס הראשי לכל צינור. מכסה את הצינורות, מערבולת, ולקצר לסובב את הצינורות.
- הפעל את פרוטוקול ההגברה על הציקלוניים באמצעות מכסה מחומם. (שולחן 5). לאחר ההפעלה הושלמה, בקצרה לסובב את הצינורות.
- העברה 2 μL של ה-DNA מוגבר לצינורות חדשים ולהוסיף 78 μL של מים, מדלל את הדגימות 1:40.
- qPCR מוגדר ומופעל
- בצע את סעיף 4.2 כדי להגדיר ולהפעיל את ה-qPCR.
- ניתוח נתונים באמצעות תבנית הניתוח עבור הTh17 (ראה טבלת חומרים) כדי לחשב את ממוצע ה-Ct, סטיית התקן של ה-ct ומספר ההעתקה.
| ריאגנט | כמות |
| מים, נוקיחכירה-חינם | 9.5 מיקרומטר |
| התחלה חמה PCR מיקס מאסטר | 12.5 מיקרומטר |
| Th17-PCR פריימר | 1 ליטר |
| כולל | 23 μL |
טבלה 4: להגביר מראש את ה-DNA לTh17. המיקס הראשי של תגובת ההגברה הוכן על פי השולחן.
| צעד | זמן | Temp | מחזורי |
| טרום דגירה | 35 דקות | 95 ° c | 1X |
| דנטורציה | 1 דקות | 95 ° c | 12X |
| ריפוי | 45 שניות | 55 ° c | |
| תארכות | 30 שניות | 72 ° צ' | |
| התארכות סיום | 10 דקות | 72 ° צ' | 1X |
| החזיק | וגבל | 4 ° c |
שולחן 5: להגביר TH17 DNA. Th17 DNA היה מוגבר מראש עבור 12 מחזורים לפני qPCR בפועל.
תוצאות
כל שלושת המתילציה מאמר להתחיל עם קלט של gDNA ותוצאה של אחוז CD8 + T תאים, Treg, או Th17 תאים בתוך כל אוכלוסיית התא. הנתונים שנוצרו מ-qpcr בעקבות ההמרה של יסולפיט נותחו באמצעות תבנית הניתוח שסופקה. תבנית זו השתמשה בעקומות הסטנדרטיות שהתקבלו מהדגימות הסטנדרטיות כדי להעריך את מספר ההעתקה של היעדים וספירות התא הכולל בדגימות הבדיקה. לאחר מכן, סוג התא של אחוז החישוב החושב באמצעות הנוסחאות המשולבות בתבניות הניתוח. איור 1 מציג את נתוני הנציג מתוך הCD8 +, המתקבלים מניתוח הן תאים היקפיים (PBMCs) ותאי T משלושה תורמים שונים באמצעות שתי הזרימה של cy, והשימוש המתואר בשיטת מתילציה. המגמות בין שתי השיטות בכל התורמים בשני סוגי התאים היו דומות. איור 2 מציג נתונים מייצגים מתוך הנתון treg. שלושה תורמים Treg מטוהרים נותחו באמצעות מתילציה מבוססי qPCR וזרימה cy, התוצאות הותוות על הגרף המוצג. התוצאות של שתי השיטות היו דומות יחסית. עם זאת, בכל המקרים הזרימה cy, לנסות ערכים גבוהים יותר. איור 3 מראה את ההשוואה של Th17 תאים שזוהו באמצעות cy try זרימה ומתילציה. בגרף זה קיימים תנאים ממריצים ובלתי ממריצים לשיטות הנסיוניות. תאים דורשים גירוי עם PMA ואיקונמיצין וטיפול עם מעכב הובלה חלבון כדי להגדיל את כמות IL-17A מתנה בתוך כל תא, כך ניתן לזהות דרך הזרימה cy, לנסות20. המצב של מתילציה ניתן לזיהוי ללא קשר למצב הגירוי. הזרימה cy, try הניב רמות נמוכות יותר של תאים Th17 בהשוואה למתלציה. הרגישות והספציפיות של המנה הוכחו על-ידי הגבלת הערך הריק (בלוב), הגבלת הזיהוי (לוד), והגבלת ערכי הכמת (LOQ) המוצגים בטבלה 6.

איור 1: זרימה ומתילציה השוואה של CD8 + אחוזים עבור שני התאים PBMCs ו-T עבור שלושה תורמים שונים. PBMCs ו-T תאים של שלושה תורמים שונים התעצמו עבור אחוז CD8 + T תאים באוכלוסיה כולה באמצעות הזרמת cy try או מתילציה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
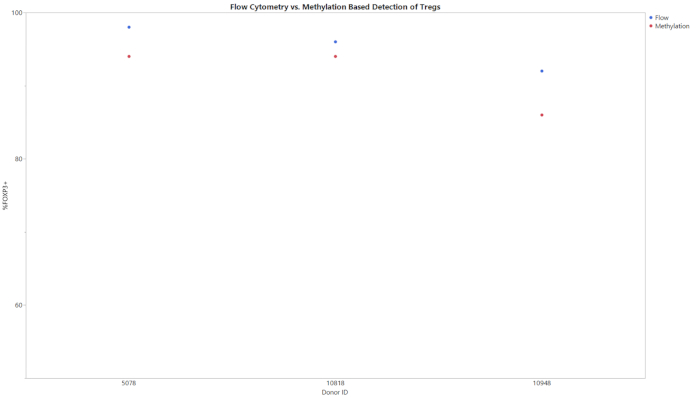
איור 2: זרימה ומתילציה השוואה בין אחוזי treg עבור Treg מטוהרים עבור שלושה תורמים שונים. תאים Treg מטוהרים התעצמו עבור אחוז התאים Treg באוכלוסייה כולה באמצעות או לזרום cy, או מתילציה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
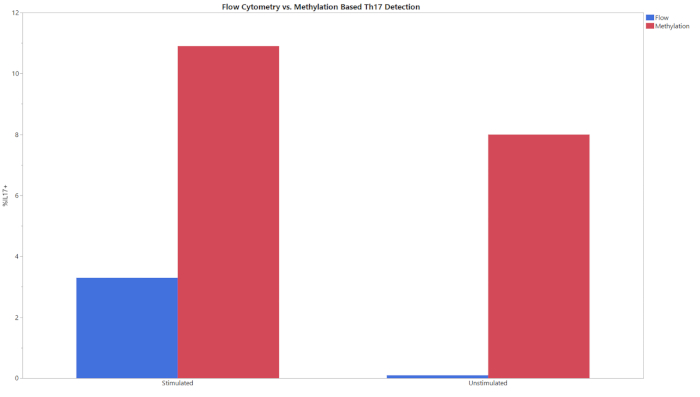
איור 3: זרימה ומתילציה השוואה בין Th17 אחוזים לקבוצות נסיוניות ממריצים ובלתי ממריצים. תאי T ממריצים ובלתי ממריצים נותחו תוך שימוש בשני הצדדים בשתי הזרימה ובמתתילציה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| Assay | LoB | לוד | לוקיו |
| CD8 | 0 | 19 | 52 |
| שגנד | 0 | 7 | 21 |
| FoxP3 | 0 | 3 | 12 |
| Th17 TpG | 0 | 35 | 73 |
| Th17 CpG | 0 | 38 | 73 |
שולחן 6: לוב, לוד, LoQ של מספרי העתקה למתילציה מבוססי מאמר. הרגישות והספציפיות של המנה מפורטת על-ידי הערכים של לוז, לוד והלל המתקבלים על ידי הנחיות מקדאי21,22. באופן כללי, מעטים כמו 40 עותקים ניתן לזהות במדויק על ידי אלה מספר.
Discussion
עם הופעתו של immunotherapeutics חדש, יש צורך בשיטות סטנדרטיות של זיהוי זהות התא החיסונית וטוהר. שיטות הערכה עבור בדיקות in-process ושחרור כי הם חזקים, מאומתים, מדרגיים להישאר להקים ולהוות אתגר מרכזי מסחור של טיפולים מבוססי תאים. בעוד הזרימה cy, try היא כיום השיטה הנפוצה ביותר עבור פנוטיפים תא החיסון, איכות המדגם גבוהה ודרישות כמות להקשות על שימוש רגיל. יתר על כן, יישום cy, הזרמת הזרימה בסביבת הייצור הטובה (GMP) מוגבלת על-ידי אסטרטגיות הקשורות למפעיל והדרישה של תקני התייחסות לכל סמן המשמש13,14. למרות שהבקרה האוטומטית הוצגה לשיפור החוסן העצמי, היא עדיין אינה אסטרטגית בקרת איכות מבוססת היטב. בעוד ביטוי גנים הפרופיל עשוי לשמש גם כדי לאפיין את הטיפול בתאים זהות המוצר וטוהר, הנתונים הם כמותיים למחצה ועבודה אינטנסיבית. בנוסף, רנ א ומיקרוארנה הם פחות יציבים מ-DNA והוא יכול לתרום לחוסר התוצאות החזקות והנוזרה. כך, ניצול הסטטוס DNA epigenetic מעמד של מקום מסוים מספק יציבה, קל לבצע, חסון, ומדרגי שיטה של זיהוי וכימות סוג תא של עניין.
הגילוי של דפוסי מתילציה לפנוטיפ מסתמך על שלושה שלבים קריטיים: ראשית, השיטה דורשת שימוש ב-gDNA, המבודד בהתאם לשיטות המתוארות. DNA באיכות גבוהה נדרש ואם לא בשימוש, ההמרה יסולפיט שפעה עלולה להיות מושפעת23,24. אם מתקבלת באיכות נמוכה DNA, טיהור נוסף מומלץ כדי להבטיח את אמינות השיטה. שנית, המרה הביסולפיט המוצלח של הציטוסינוס הבלתי ממתיט ל-אורציל נדרש. הצעד הקריטי ביותר בהמרת יסולפיט הוא דנ א הדנטורציה23,25. טמפרטורה גבוהה דנטורציה באמצעות אמוניום ביסולפיט, בניגוד נתרן bisulfite מגביר את יעילות ההמרה ועקביות הוא התהליך המומלץ עבור אלהבחני26. על המשתמשים לוודא שהתגובה מתרחשת ב-80 ° צ' ושערבוב המדגם נעשה בתדירות גבוהה. מסיבות אלה, מומלץ לthermomixer דיגיטלי (ראה טבלת חומרים). שלישית, יש לעקוב אחר טכניקת ההכנה הנכונה במהלך הכנת ה-qPCR. שלושה משכפל טכני נדרשים במהלך תגובת qPCR כדי לדבוק במידע המינימלי לפרסום של ניסויים כמותיים בזמן אמת (PCR) הנחיות (מקווה)27. הכללת משכפל טכני רב יותר מקובלת אך לא נדרשת. טכניקת ליטוף מגונה ו/או לא כולל משכפל טכני תוביל לתוצאות qPCR לא אמינות.
אם הצעדים הקריטיים ממשיכים והתוצאות הרצויות עדיין לא יתקבלו, ניתן למונף פקדים מרובים בתוך המנה כדי לאתר את הבעיה. המרה מתאימה של יסולפיט היא הצעד המכריע ביותר באותה שיטת פעולה. המרה ביוסולפיט לא תקינה תהיה מודגשת על-ידי גורם כיול כושל/או ערכי הפניה שחושבו על-ידי תבנית הניתוח. אם ההמרה יסולפיט פיט בוצעה בצורה שגויה (למשל, אם התגובה בוצעה ב RT), לא היה הגברה במהלך qpcr. כמו כן, לא יראו הגברה אם שגיאה נעשתה במהלך הכנת התגובה של qPCR (למשל, אם המיקס הראשי של qPCR לא התווסף). ניתן להפריד בין שתי סוגיות אלה על-ידי חקירת הדגימות הסטנדרטיות. הגברה בדגימות הסטנדרטיות, אך לא ההפניה, הכייל והדוגמאות הנסיוניות, מציינות כי ההמרה הביוסולפיט לא בוצעה כראוי. אין הגברה באף אחת מדגימות שמצביעות על כך ש-qPCR לא בוצע כראוי.
בעוד שיטה זו מטפלת בדרישות לדוגמה הקפדניות והשתנות הניתוח הקשורות לשיטות הקלדה אחרות, במיוחד בזרימה של cy, יש מגבלות שיש לציין. שימוש זה מייעד מקום בודד המשמש כמזהה ייחודי עבור תא היעד, האוסר על הניתוח הריבוב המתבצע בדרך כלל עם הזרימה cy, try. זה גורם לזיהוי סוגי תאים מורכבים כמו Th17 קשה. עם זאת, השימוש בדפוסי מתילציה על מקום בודד הוכח להיות סמן גמישות פנוטיפית מדויק של תאים מרובים ושימש בניסויים קליניים מרובים15,16. זה נכון במיוחד Tregs שבו הערכה FOXP3 מתילציה חתימות היא שיטה מדויקת חד משמעית לגילוי Tregs אמיתי מן באופן מFOXP3 ביטוי תאים28. אובדן הניתוח הריבוב מפוצה על ידי הדיוק שנחקר. חזרות עתידיות של היכולת יכול לכלול מספר רב של צבעים qPCR וכלי מונים כדי לאפשר זיהוי של לוקואו מרובים בתגובה אחת qPCR.
שיטה זו יכולה לשמש כשיטה חלופית לזרימה של הציטוזה בקביעת התאים והזהות. יש לציין כי שיטת הפעולה אינה מזרימה את הערכים המדויקים הזורמים על-ידי cy, (איורים 1-3). הדבר נובע בחלקו לשונות של ניתוח נתונים הקשורים באמצעות הזרימה cy, try. בהתאם לאסטרטגיית העליה, התוצאות של cy, מזרימה, יכולות להשתנות באופן משמעותי. זה במיוחד המקרה בעת שימוש בפרוטוקולים מורכבים להסתכל על מטרות תאיים, כגון IL-17, שבו מקדם הווריאציה (CV) יכול להיות גבוה כמו 15%14. בין מספר משתמשים, היכולת שהוצגה באופן עקבי הייתה בעלת קורות חיים של < 15%, תוך תמיכה בחוסן העקביות וביכולות התקינה המשופרות. ההבדלים הגדולים ביותר בין אפיגנטיות וזרימה cy, המבוסס על הפנוטיפים המבוססים על הזרם נראה כאשר גירוי התא נדרש (איור 3). הזיהוי של תאים Th17 דרך הזרימה cy try הושגה באמצעות פרוטוקול נפוץ עבור גירוי תא T ו cytometry תאיים כתמים29,30,31. ההבדלים הראו פנוטיפים Th17 בין המדידה epigenetic וזרימה cy, יכול להיות בשל הקינטיקה של IL-17 ייצור. בעוד חתימות מתיונין הן יציבות, ייצור החלבון לוקח זמן וחייב להיות נוכח בכמויות מספיקות כדי להתגלות על ידי נוגדנים פלורסנט20,32. 6 h דגירה עם מעכב הובלה חלבון וקוקטייל גירוי התא ייתכן שיהיה צורך להרחיב כדי לראות את רמת Th17 תאים שאותרו באמצעות אפיגנטי מבוססי שיטות פנוטיפים. מחקרים נוספים נחוצים כדי לקבוע את הסיבה המדויקת מדוע הערכים אינם תואמים ולקבוע את השיטה המדויקת ביותר הפנוטיפים.
בדו ח זה, אנו מפרטים כיצד לזהות ולכמת את סוגי התא החיסונית בתערובת הטרוגנית של תאים בצורה פשוטה ואיתנה. האסמאומר מתוכננים וממוטבים לשימוש פוטנציאלי בתהליך ובדיקות שחרורים של therapeutics מבוססות תא. האסמאמר המתואר לענות על הדרישה עבור חומרי גלם מוסמכים מאוד לשימוש ביישומי טיפול בתאים. על ידי התייחסות החסרונות של הזרימה cy, ושיטות מולקולריות אחרות כגון יציבות, דרישות לדוגמה, גירוי מוקדם, חדירות הסלולר עבור כתמים תאיים, וסובייקטיביות של ניתוח נתונים, התנאים המתוארים הם בשורה עם המטרות של מסחור של טיפולים מבוססי תאים.
Disclosures
סומאן ק. פראדהן, ג'רי גוזמן, קרל דרגביץ ', מארק לנדון, ואומה לאקשמיטיה מועסקים על ידי המדע התרמי פישר. סוון אולק, ביוארן סאמנס, ואולריך הופיולר הם מייסד ועובד של החברה אפיונטיס, בהתאמה. בהפקה של כתב היד לא נעשה שימוש בסיוע כתיבה.
Acknowledgements
הפרויקט מומן על ידי מענק.
Materials
| Name | Company | Catalog Number | Comments |
| 2.0 ml Eppendorf Safe-Lock Tubes | Eppendorf | 22363344 | |
| Analysis template for CD8 assay | Click Here | ||
| Analysis template for Th17 assay | Click Here | ||
| Analysis template for Treg assay | Click Here | ||
| Attune NxT Acoustic Focusing Cytometer, blue/red/violet6/yellow | Thermo Fisher Scientific | A29004 | |
| CTS PureQuant CD8+ T-Cell Assay | Thermo Fisher Scientific | A43674 | |
| CTS PureQuant Th17 Assay | Thermo Fisher Scientific | A43676 | |
| CTS PureQuant Treg Assay | Thermo Fisher Scientific | A43675 | |
| Dynabeads SILANE Genomic DNA Kit | Thermo Fisher Scientific | 37012D | Used for genomic DNA isolation and purification after bisulfite conversion. Contains elution buffer to dilute samples. |
| DynaMag-2 Magnet | Thermo Fisher Scientific | 12321D | Used as a magnetic rack during DNA isolation and purification |
| eBioscience Essential Human T cell Phenotyping Kit | Thermo Fisher Scientific | A42923 | |
| eBioscience Essential Human Th1/Th17 Phenotyping Kit | Thermo Fisher Scientific | A42927 | |
| eBioscience Essential Human Treg Phenotyping Kit | Thermo Fisher Scientific | A42925 | |
| Eppendorf SmartBlock 2 mL | Eppendorf | 5362000035 | |
| Eppendorf ThermoMixer C | Eppendorf | 5382000023 | |
| HulaMixer Sample Mixer | Thermo Fisher Scientific | 15920D | Recommended sample mixer |
| NanoDrop | Thermo Fisher Scientific | ND 1000 | |
| Nonstick, RNase-free Microfuge Tubes, 1.5 mL | Applied Biosystems | AM12450 | |
| QuantStudio 12S Flex | Applied Biosystems | 4470661 | |
| TE, pH 8.0, RNase-free | Thermo Fisher Scientific | AM9849 | |
| Vortex Mixer | Thermo Fisher Scientific | H2KT17113 |
References
- Hartmann, J., Schüßler-Lenz, M., Bondanza, A., Buchholz, C. J. Clinical development of CAR T cells-challenges and opportunities in translating innovative treatment concepts. EMBO Molecular Medicine. 9, 1183-1197 (2017).
- Graham, C., Jozwik, A., Pepper, A., Benjamin, R. Allogeneic CAR-T Cells: More than Ease of Access? Cells. 7, E155(2018).
- Turtle, C. J., et al. CD19 CAR-T cells of defined CD4+:CD8+ composition in adult B cell ALL patients. Journal of Clinical Investigation. 126, 2123-2138 (2016).
- Akalin, I., et al. Effects of Chimeric Antigen Receptor (CAR) Expression on Regulatory T Cells. Molecular Therapy. 17, S25(2009).
- Knochelmann, H. M., et al. CAR T Cells in Solid Tumors: Blueprints for Building Effective Therapies. Frontiers in Immunology. 9, (2018).
- Chen, M. L., et al. Regulatory T cells suppress tumor-specific CD8 T cell cytotoxicity through TGF-β signals in vivo. Proceedings of the National Academy of Sciences. 102, 419-424 (2005).
- Muranski, P., et al. Tumor-specific Th17-polarized cells eradicate large established melanoma. Blood. 112, 362-373 (2008).
- Majchrzak, K., et al. Exploiting IL-17-producing CD4+ and CD8+ T cells to improve cancer immunotherapy in the clinic. Cancer Immunology, Immunotherapy. 65, 247-259 (2016).
- Guedan, S., et al. ICOS-based chimeric antigen receptors program bipolar TH17/TH1 cells. Blood. 124, 1070-1080 (2014).
- Vicetti Miguel, R. D., Maryak, S. A., Cherpes, T. L. Brefeldin A, but not monensin, enables flow cytometric detection of interleukin-4 within peripheral T cells responding to ex vivo stimulation with Chlamydia trachomatis. Journal of Immunological Methods. 384, 191-195 (2012).
- Lovelace, P., Maecker, H. T. Multiparameter Intracellular Cytokine Staining. Methods in Molecular Biology. 699, 165-178 (2011).
- Presicce, P., Moreno-Fernandez, M. E., Lages, C. S., Orsborn, K. I., Chougnet, C. A. Association of two clones allows for optimal detection of human FOXP3. Cytometry A. 77, 571-579 (2010).
- Pachón, G., Caragol, I., Petriz, J. Subjectivity and flow cytometric variability. Nature Reviews Immunology. 12, 396(2012).
- Westera, L., et al. Centrally Determined Standardization of Flow Cytometry Methods Reduces Interlaboratory Variation in a Prospective Multicenter Study. Clinical and Translational Gastroenterology. 8, e126(2017).
- Baron, U., et al. Epigenetic immune cell counting in human blood samples for immunodiagnostics. Science Translational Medicine. 10, (2018).
- Kleen, T. O., Yuan, J. Quantitative real-time PCR assisted cell counting (qPACC) for epigenetic - based immune cell quantification in blood and tissue. Journal for ImmunoTherapy of Cancer. 3, 46(2015).
- Rapko, S., et al. DNA methylation analysis as novel tool for quality control in regenerative medicine. Tissue Engineering. 13, 2271-2280 (2007).
- Wieczorek, G., et al. Quantitative DNA Methylation Analysis of FOXP3 as a New Method for Counting Regulatory T Cells in Peripheral Blood and Solid Tissue. Cancer Research. 69, 599-608 (2009).
- Andersson, D., et al. Properties of targeted preamplification in DNA and cDNA quantification. Expert Review of Molecular Diagnosis. 15, 1085-1100 (2015).
- Jung, T., Schauer, U., Heusser, C., Neumann, C., Rieger, C. Detection of intracellular cytokines by flow cytometry. Journal of Immunological Methods. 159, 197-207 (1993).
- Armbruster, D. A., Pry, T. Limit of Blank, Limit of Detection and Limit of Quantitation. Clinical Biochemistry Reviews. 29, S49-S52 (2008).
- Bustin, S. A., et al. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments. Clinical Chemistry. 55, 611-622 (2009).
- Li, Y., Tollefsbol, T. O. DNA methylation detection: Bisulfite genomic sequencing analysis. Methods in Molecular Biology. 791, 11-21 (2011).
- Warnecke, P. M., et al. Identification and resolution of artifacts in bisulfite sequencing. Methods. 27, 101-107 (2002).
- Genereux, D. P., Johnson, W. C., Burden, A. F., Stöger, R., Laird, C. D. Errors in the bisulfite conversion of DNA: modulating inappropriate- and failed-conversion frequencies. Nucleic Acids Research. 36, e150(2008).
- Darst, R. P., Pardo, C. E., Ai, L., Brown, K. D., Kladde, M. P. Bisulfite Sequencing of DNA. Current Protocols in Molecular Biology. 91, 7.9.1-7.9.7 (2010).
- Taylor, S., Wakem, M., Dijkman, G., Alsarraj, M., Nguyen, M. A practical approach to RT-qPCR-Publishing data that conform to the MIQE guidelines. Methods. 50, S1-S5 (2010).
- Baron, U., et al. DNA demethylation in the human FOXP3 locus discriminates regulatory T cells from activated FOXP3(+) conventional T cells. European Journal of Immunology. 37, 2378-2389 (2007).
- Yao, Z., et al. Human IL-17: a novel cytokine derived from T cells. Journal of Immunology. 155, 5483-5486 (1995).
- Lockhart, E., Green, A. M., Flynn, J. L. IL-17 production is dominated by gammadelta T cells rather than CD4 T cells during Mycobacterium tuberculosis infection. Journal of Immunology. 177, 4662-4669 (2006).
- Liang, S. C., et al. Interleukin (IL)-22 and IL-17 are coexpressed by Th17 cells and cooperatively enhance expression of antimicrobial peptides. Journal of Experimental Medicine. 203, 2271-2279 (2006).
- Olsen, I., Sollid, L. M. Pitfalls in determining the cytokine profile of human T cells. Journal of Immunological Methods. 390, 106-112 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved