Method Article
利用基于表观遗传学的定量PCR确定免疫细胞特性和纯度
摘要
在这里,我们描述了一种通过使用定量PCR(qPCR)检测的表观遗传特征来确定免疫细胞特性和纯度的可靠方法。特定位点的脱甲基化作为特定细胞类型的唯一标识符,允许识别CD8+、调节或Th17 T细胞。
摘要
免疫细胞亚型群体频率对T细胞疗法的疗效有较大影响。目前的方法,如流式细胞测量,具有特定的样品要求,样品输入高,低通量,难以标准化,所有这些都不利于细胞治疗产品的特性,并在开发和制造。
本文描述的测定使用分离基因组DNA(gDNA)准确识别和量化细胞异构混合物中的免疫细胞类型。DNA甲基化模式通过双硫酸酯转化显露出来,在这个过程中,未甲基化的细胞氨酸被转化为尿素。使用靶向转化区域的引基剂通过qPCR扩增检测未甲基化DNA区域。每个测定一个唯一的位点被测量,并作为特定细胞类型的准确标识符。该检测功能可靠,以高通量方式识别 CD8+、监管和 Th17 T 单元。这些优化的检测可能可用于细胞治疗过程中的加工和产品释放测试。
引言
在过去十年中,T细胞在细胞免疫治疗中的应用显著增加,特别是随着嵌合抗原受体(CAR)T细胞技术1的出现。虽然T细胞为基础的疗法已经取得了巨大的临床成功,它们是异质的,细胞特征和特性在捐赠者2之间可能有很大差异。T细胞群的异质性会对疗效产生重大影响,并使临床试验的结论复杂化。因此,在产品制造和配方过程中了解T细胞异质性以确定T细胞免疫疗法的最佳配方至关重要。
从广义上讲,T细胞可以分为两组:CD4+帮助T细胞,分泌免疫调节细胞因子;CD8+细胞毒性T细胞,直接裂解细胞在主要组织相容性复合物(MHC)I分子上呈现共性抗原。CD4+ 帮助器 T 细胞可以分化成无数特定的子集,从而产生一组独特的细胞因子。一些人认为,在最终细胞产品中,CD4+与CD8+T细胞的确定比例可最大化体内的功效和持久性,但可能会使细胞制造复杂化3。调节性T细胞(Tregs)是CD4+T细胞的子集,具有免疫抑制性,并减少免疫细胞的活化。调节性T细胞被牵连于调解肿瘤耐受性,如果存在于CAR T细胞制造过程中,可以抑制CAR T细胞4、5、6的抗肿瘤免疫反应。其他CD4+子集,如T帮助器17(Th17)T细胞促进肿瘤清除,并可以利用提高T细胞疗法的疗效。因此,增加Th17 CD4+T细胞在固体肿瘤环境中特别感兴趣,其中白细胞素17(IL-17)的增产促进抗肿瘤免疫反应5,7,8,9。了解Th17细胞在肿瘤反应中的重要性促使人们进一步研究在体外7、9产生这些细胞的策略。因此,检测这些T细胞子集的方法对于优化T细胞疗法至关重要,并且应该可靠、简单、可扩展和可重复。
流式细胞测定是确定免疫细胞身份的最常见方法。然而,流式细胞学需要活的、完整的细胞,必须在收获的同一天进行分析。对于细胞内细胞因子染色(ICS),需要蛋白质分泌抑制来保持T细胞内细胞因子。然而,不同的抑制剂化合物对特定细胞因子的分泌有差异效应,迫使用户创建专用鸡尾酒来检测感兴趣的细胞因子10,11。此外,流式细胞测定的保真度依赖于抗体克隆,这些克隆与目标具体而有效结合。使用不同的抗体克隆会导致不同的结果,并导致不精确的结论,使该方法难以标准化12。此外,分析通过流式细胞测定收集的数据,从而从数据中得出的结论,根据门的设定方式,用户之间可能有很大差异。由于这些原因,流式细胞仪在细胞治疗开发过程中不是精确质量控制的理想选择。
特定基因位点的基因组甲基化评估是确定细胞特性的替代方法。使用DNA甲基化来识别特定细胞类型的理由已在多篇文章中描述,并依赖于特定细胞群15、16、17中存在的特定甲基化模式。在靶细胞中,某些位点含有非甲基化核苷酸,而在非靶细胞中,这些位点被甲基化。这种模式可以通过双硫酸酯转化来检测,这种工艺专门将非甲基化的细胞氨酸核苷酸(C)转换为尿素(U)。引信和探头可以针对转换的站点进行设计,然后通过qPCR16进行放大和检测。
本文所述的测定通过量化与内务管理基因相比的特定非甲基化位点的数量,测量异质种群中免疫细胞亚型的频率。CD8 B基因的未甲基化调节元素的副本在CD8测定中进行测量,在Treg中测量FoxP3,在Th17中测量IL-17。通过分离感兴趣的特定细胞群(例如CD8+T细胞)和进行双硫酸盐测序来识别仅在该细胞类型15中未甲基化的位点,从而识别这些位点。引源和探针针对独特的非甲基化位点进行开发,并通过qPCR分析样品。已知拷贝数的标准曲线由高拷贝数标准质粒的稀释创建,允许将 Ct 值转换为抄录副本编号。
为了评估测定性能,需要控制样本,包括参考gDNA和校准质粒。参考基因组材料是来自多个已知免疫细胞频率的献血者汇集的血液样本,用于质量控制 (QC) 检测性能检查。校准器样本是一种合成质粒,含有CD8、FoxP3和GAPDH基因序列,在等值比中。它用作双硫酸盐转化效率的度量,因为不同基因组区域内的二硫酸盐转化效率会有所不同。校准器内目标与GAPDH的比率为1,但由于双硫酸盐转化效率的差异,该比率可能有所不同。此校准系数应用于 CD8 和 Treg 测定。FoxP3,在Treg测定中使用的基因,位于X染色体上。由于这种测定只测量FoxP3的未甲基化副本,并且只有一份FoxP3在Tregs中未甲基化,这种测定是性不可知的,可用于男性和女性样本18。Th17测定不使用校准器样品或GAPDH作为内务管理基因。相反,包括另一个针对非Th17细胞中甲基化位点的引基集,并且细胞的总数由IL-17的甲基化和非甲基化拷贝的总和反映出来。从 qPCR 获得的数据被输入到预设分析模板中,该模板对数据执行质量控制检查,并计算起始总体中目标单元格的百分比。这提供了自动化和无偏见的数据分析,从而消除了用户主观性并提高了标准化功能。
这种测定使用gDNA,可以通过使用培养或固定细胞或冷冻细胞颗粒的白血病处理程序进行分离。样品要求低、样品起始材料灵活、高精度和标准化分析解决了与流式细胞测量相关的局限性,是细胞治疗过程开发过程中质量控制的理想选择。
研究方案
所有人类样本都是根据人类研究伦理准则从商业来源获得的。
1. 基因组DNA分离
注: 基因组DNA分离使用市售试剂盒(见材料表)从任何造血细胞,如外周血单核细胞(PBMC),纯化T细胞或任何其他造血细胞类型进行。在这个实验中,使用了来自三个不同人类捐赠者的外周血单核细胞(PBMC)和T细胞。
- 将1-2 x 106造血细胞放入锥形管中,以400 x g离心10分钟。
- 完全吸出上清液。
- 在样品中加入350 μL的解液/结合缓冲液,并在55°C下孵育10分钟。
- 将50μL蛋白酶K(20mg/mL)加入350μL细胞悬浮液和涡旋30s。
- 加入50μL的DNA结合顺磁珠和400μL的100%异丙醇,并在室温(RT)孵育3分钟。
- 将管子放在磁性机架上 2 分钟,取出上清液,注意不要干扰磁珠。DNA在此步骤时与磁珠结合。
- 加入950 μL的洗涤缓冲液1。涡旋 30 s 并重复步骤 1.6。
- 重复步骤 1.7。
- 加入950 μL的洗涤缓冲液2。涡旋 30 s 并重复步骤 1.6。
- 加入100 μL的洗脱缓冲液和涡流2分钟。将管子放在磁性支架上1分钟,并将含有gDNA的上清液转移到新管中。
- 使用从造血细胞中分离的1 μL gDNA,通过在260纳米、280纳米和230纳米处获得OD,使用荧光计分光度测量gDNA的纯度。确保 260 和 280 nm 的光学密度 (OD 比率) 比率介于 1.7-2.0 之间,260 和 230 nm 的 OD 比率在 1.5-2.4 之间。
2. 样品制备
- 热敏混合器预热至 56°C。
- 为所有样品、校准器和参考材料标注 2 mL 管。
- 在 RT 处使用洗脱缓冲液(可用于步骤 1 的套件)稀释样品和校准器。
- 对于所有实验样品,将gDNA稀释至总体积为142μL。例如,在100纳克/μL时将4μL的gDNA稀释成138μL的洗脱缓冲液。
注:400-1,200 ng的gDNA可用于测定。 - 将校准器的 75 μL 稀释至总体积为 142 μL。
- 使用分光光度计检查参考 gDNA 浓度,使用 TE(pH = 8.0)作为空白。
- 将参考gDNA的1,000-1,200 ng稀释至总体积为142 μL。例如,在100纳克/μL时将10μL的参考gDNA稀释至132μL的洗脱缓冲液中。
- 对于所有实验样品,将gDNA稀释至总体积为142μL。例如,在100纳克/μL时将4μL的gDNA稀释成138μL的洗脱缓冲液。
- 在 56°C 下在 900 rpm 的温混压下孵育管 5 分钟。短暂地旋转管子以收集样品。
3. 双硫酸盐转换器
注:确保双硫酸盐转化期间的孵育时间遵循建议的时间。过度孵化或孵化不足将影响检测结果。
- 将热混合器设置为 80°C。
- 在所有管中加入270μL的双硫酸铵和90μL的四氢富氟醇(THFA)。涡旋完全混合,并短暂地旋转样品,以收集底部的液体。
- 在 80°C 的温混器中孵育管 45 分钟,转速为 900 rpm。如果使用热块,在孵育过程中每 4.5 分钟涡旋管 1-2 秒。
- 在继续步骤 4 或 5 之前,请短暂旋转样品并冷却至 RT 3-5 分钟。最终体积应为 ±500 μL。
4. CD8和Treg测定
- 双硫酸盐转化后的DNA纯化
注:此步骤使用市售的DNA纯化试剂盒(见材料表)在双硫酸盐转化的DNA上执行。在使用前,确保试剂加热到RT。- 在开始纯化之前,通过涡旋30s,创建DNA分离顺磁珠的同质混合物。在洗涤缓冲液中加入乙醇和异丙醇,按照瓶上列出的体积,将热块设置为65°C。
- 在RT,从步骤3.4向每个管中加入870μL的莱沙/结合缓冲液和105μL的DNA结合顺磁珠。涡旋完全混合,并短暂地旋转管。
- 加入570 μL的2丙醇和涡旋完全混合。
- 在热混合器或标准旋转混合器中,在 50 rpm 下以 RT 孵育管 7 分钟。
- 短暂地旋转管子。将管子放在磁性机架上,孵育5分钟。
- 当样品仍然位于磁性机架上时,在不干扰磁珠的情况下取出上清液。
注:DNA与珠子结合。 - 从磁性机架上取下管子,并添加 900 μL 的洗涤缓冲液 1。涡旋管完全重新悬浮珠子,然后短暂地旋转管。
- 将管子返回到磁性机架并孵育 3 分钟。
- 当样品仍然位于磁性机架上时,在不干扰磁珠的情况下取出上清液。
- 重复洗涤(4.1.7-4.1.9),一次用洗涤缓冲液1,然后用洗涤缓冲液2两次。
- 取出上清液后,短暂地旋转管,返回磁性机架 3 分钟。
- 拆下所有残留洗涤缓冲液 2 并从磁性机架上拆下管。
- 将管盖在 65°C 打开的磁珠干燥 15 分钟。
- 在每个管中加入60 μL洗脱缓冲液,并在1,400 rpm转速下在RT下孵育7分钟。或者,使用泡沫适配器以中等速度涡旋。
- 短暂地旋转管子,放在磁性机架上 2 分钟。
- 将 55 μL 的渗脂剂转移到新管中,而不会干扰珠子。脱氧核糖核酸含有双硫酸盐转化的DNA。不需要测量DNA浓度。
- 设置并运行 qPCR
- 打开 qPCR 计算机和操作其软件的计算机。
- 在软件用户界面上创建新的实验,并选择用于运行该实验的块。
- 选择标准曲线作为实验类型。
- 如果适用,请选择要使用的检测化学。这种测定使用塔克曼试剂。否则,选择ROX作为被动参考。
- 如果适用,请选择作为标准运行的仪器的属性。
- 通过分配目标(例如,以 FAM 为报告器的 GAPDH 或 CD8)和非荧光要求来定义您的实验设计。
- 为标准、示例和控件分配示例名称。
- 接下来,根据 qPCR 板分配每个井位。每个井都需要一个目标,如 CD8 或 GAPDH,以及一个示例名称。每个样品以三元运行,必须反映在仪器的板布局上。
- 为每个标准指定任务标准,并根据表 1指定最终副本编号。
- 分配样本、校准器并引用任务未知。
- 将无模板控件的井指定为NTC或N。
- 准备羊肉DNA(10纳克/μL)的连续稀释,作为标准(见表1)。
- 准备qPCR主混合鸡尾酒,一种用于目标细胞类型,一种用于GAPDH(见表2)。以三元运行所有示例、标准和 NTC 控件。
注:GAPDH用于量化细胞总数,并与目标扩增并行运行。CD8 B基因的无甲基调控元素的副本在CD8测定中进行测量,在Treg中测量FoxP3,在Th17中测量IL-17。 - 使用 96 孔板进行 qPCR。首先将3μL的模板DNA加载到井中。接下来,加载主组合的 7 μL。
- 用 qPCR 薄膜密封板,并在将其放入 qPCR 仪器之前短暂旋转板。
- 运行 qPCR,如表 3所示。
- 运行完成后,将 qPCR 数据导出为 .txt 或 .xlsx 文件。
- 使用 CD8 测定的分析模板和 Treg 测定(参见材料表)分析数据,以计算 Ct 平均值、Ct 标准偏差和拷贝号。
| 初始质粒拷贝数/3 μL | 体积 | 稀释DNA [1] | 每 3 μL 的最终拷贝数 | 标签 |
| 31250 | 1000 μL | - | 31250 | 性病#1 |
| 31250 | 200 μL | 800 μL | 6250 | 性病*2 |
| 6250 | 200 μL | 800 μL | 1250 | 性病+3 |
| 1250 | 200 μL | 800 μL | 250 | 性病*4 |
| 250 | 200 μL | 800 μL | 50 | 性病+5 |
| 1250 | 30 μL | 1200 μL | 30 | 性病[6][2] |
| [1] TE 中的 10 纳克/μL Lambda DNA(10 mM Tris,1 mM EDTA,pH 8.0) | ||||
| [2] 使用 STD#3 准备 STD#6 | ||||
表1:标准稀释的制备。根据表格,使用TE/lambda DNA作为稀释剂,编制了跨越31250-30份的4对数稀释标准。CD8 和 GAPDH 也使用相同的标准稀释。标准储存在-20°C。
| 试剂 | 量 |
| 兰姆达DNA(TE中50纳克/μL,pH8.0) | 1 μL |
| 塔克曼测定 | 0.5 μL |
| 水,无核酸酶 | 0.5 μL |
| 主混合 | 5 μL |
| 总 | 7 μL |
表2:qPCR鸡尾酒的制备。在两个单独的管中制备qPCR主混合物,每个管分别用于CD8和GAPDH,不包括根据表格的模板DNA。
| 步 | 时间 | 临时 | 周期 |
| 孵化前 | 35分钟 | 95°C | 1X |
| 放大 | 15 秒 | 95°C | 50倍 |
| 1 分钟 | 61°C | ||
| 冷却 | 5 秒钟 | 42°C | 1X |
表 3:qPCR 运行 CD8 和 Treg 测定参数。qPCR 是根据表中指定的参数运行的。
5. Th17测定
- 双硫酸盐转化后的DNA纯化
- 执行第 4.1 节所述的纯化步骤。
- 要洗脱样品,向每根管中加入25 μL洗脱缓冲液,并在1,400rpm转速下在RT下孵育7分钟。或者,使用泡沫适配器以中等速度涡旋。
- 短暂地旋转管子,放在磁性机架上 2 分钟。
- 将 20 μL 的渗脂剂转移到新管中,而不会干扰珠子。脱氧核糖核酸含有双硫酸盐转化的DNA。
- 脱氧核糖核酸预扩增
注:DNA预扩增建议用于低丰度靶点,以便通过qPCR19进行精确定量。因此,Th17甲基化测定设计需要预放大。- 将2μL的双硫酸盐转化DNA转移到PCR带管中。使用 2 μL 的水创建 NTC 管。
- 为所有样本创建预放大主组合(参见表4)。
- 将 23 μL 的主混合物添加到每个管中。盖住管子,旋涡,然后短暂地旋转管子。
- 使用加热盖在热循环器上运行预放大协议。(表5) .运行完成后,短暂地旋转管子。
- 将2μL的扩增DNA转移到新管中,加入78μL的水,稀释样品1:40。
- qPCR 设置并运行
- 按照第 4.2 节设置并运行 qPCR。
- 使用 Th17 测定的分析模板(参见材料表)分析数据,以计算 Ct 平均值、Ct 标准偏差和拷贝号。
| 试剂 | 量 |
| 水,无核酸酶 | 9.5 μL |
| 热启动 PCR 主混合 | 12.5 μL |
| Th17 PCR 底漆 | 1 μL |
| 总 | 23 μL |
表4:预扩增Th17测定的DNA。根据表制备了扩增前反应主组合。
| 步 | 时间 | 临时 | 周期 |
| 孵化前 | 35分钟 | 95°C | 1X |
| 变性 | 1 分钟 | 95°C | 12倍 |
| 退火 | 45 秒 | 55°C | |
| 伸长 | 30 秒 | 72°C | |
| 最终伸长 | 10分钟 | 72°C | 1X |
| 保持 | 不定 | 4°C |
表5:预扩增Th17 DNA。Th17 DNA在实际qPCR之前预扩12个周期。
结果
所有三种甲基化测定从gDNA的输入开始,导致整个细胞群中CD8+T细胞、Treg或Th17细胞的百分比。使用所提供的分析模板分析了在双硫酸盐转化后从qPCR生成的数据。此模板使用从标准样本获取的标准曲线来估计测试样本中目标的副本数和总单元计数。然后,使用分析模板中集成的公式计算单元格类型百分比。图1显示了CD8+测定的代表性数据,这些数据来自使用流式细胞测定和所述甲基化测定,从三个不同献血者中分析外周血单核细胞(PBMC)和T细胞。两种细胞类型中所有捐赠者的两种方法之间的趋势相似。图 2显示了来自 Treg 测定的代表性数据。使用甲基化qPCR和流式细胞测定法对三个纯化Treg供体进行了分析,并在图上绘制了结果。两种方法的结果相对相似。然而,在所有情况式细胞学都产生了更高的值。图3显示了通过流式细胞测定和甲基化检测的Th17细胞的比较。在此图中,实验方法有刺激和无刺激的条件。细胞需要用PMA和碘霉素刺激,用蛋白质运输抑制剂进行治疗,以增加每个细胞中存在的IL-17A的量,以便通过流式细胞测定20检测。无论刺激状态如何,都可以检测到甲基化状态。与甲基化相比,流式细胞测定产生较低的Th17细胞水平。表6所示的空(LOB)、检测极限(LOD)和定量(LOQ)值限制证明了测定的灵敏度和特异性。

图1:三个不同供体多氯联苯和T细胞CD8+百分比的流量和甲基化比较。使用流动细胞测定法或甲基化法对来自三个不同捐赠者的PBMC和T细胞进行CD8+T细胞在整个人群中的百分比。请点击此处查看此图的较大版本。
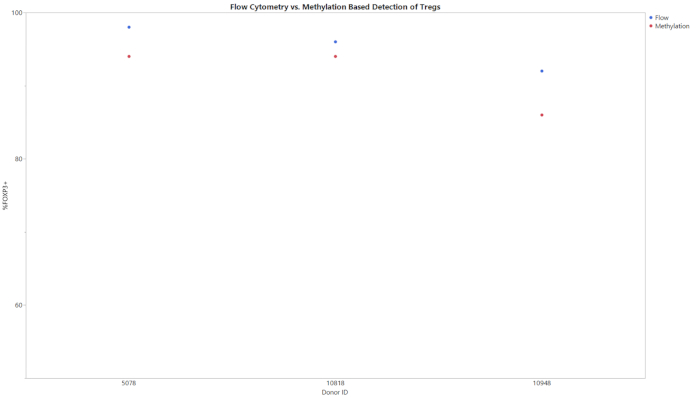
图2:三个不同捐赠者的纯化Treg的流量和甲基化比较。使用流式细胞测定或甲基化对整个种群中Treg细胞的百分比进行纯化Treg细胞的测定。请点击此处查看此图的较大版本。
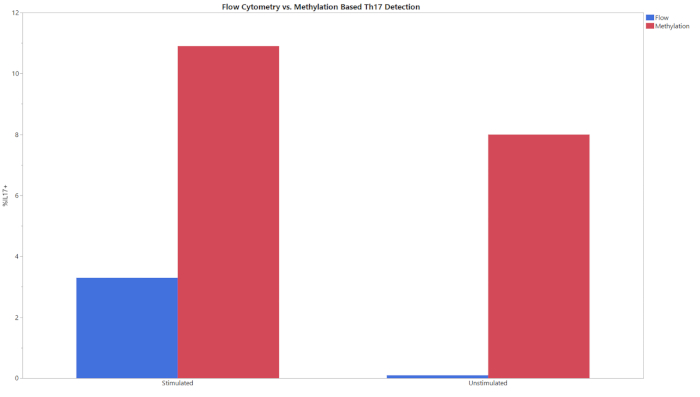
图3:刺激和非刺激实验组的Th17百分比的流量和甲基化比较。使用流式细胞测定和甲基化分析刺激和未刺激的T细胞。请点击此处查看此图的较大版本。
| 测定 | Lob | Lod | 洛Q |
| CD8 | 0 | 19 | 52 |
| 加普德 | 0 | 7 | 21 |
| 福克斯P3 | 0 | 3 | 12 |
| Th17 TpG | 0 | 35 | 73 |
| Th17 CpG | 0 | 38 | 73 |
表6:基于甲基化测定的拷贝号的LoB、LoD、LoQ。MIQE准则21、22获得的LoB、LoD和LoQ值详细说明了测定的灵敏度和特异性。一般来说,这些测定可以准确地检测出多达40个拷贝。
讨论
随着新的免疫疗法的出现,需要标准化的方法来检测免疫细胞特性和纯度。对于可靠、验证和可扩展的在建和释放测试的评估方法仍有待建立,对基于细胞的疗法的商业化构成重大挑战。虽然流式细胞测定是目前免疫细胞体位最常见的方法,但高样品质量和数量要求使得常规使用变得困难。此外,在良好的制造实践 (GMP) 环境中实施流式细胞测量受到操作员依赖的浇注策略和每个标记使用13、14的参考标准要求的限制。尽管自动浇注已被证明能够提高测定鲁棒性,但它还不是一个成熟的质量控制策略。虽然基因表达分析也可用于描述细胞治疗产品的身份和纯度,但数据是半定量和劳动密集型的。此外,RNA和微RNA比DNA的稳定性相对较低,并且会导致缺乏健壮和可重复的结果。因此,利用特定位点的表观遗传DNA甲基化状态,提供了一种稳定、易于执行、强大且可扩展的识别和量化感兴趣的细胞类型的方法。
对表型细胞的甲基化模式的检测取决于三个关键步骤:首先,检测需要使用gDNA,根据所述方法分离。需要高质量的DNA,如果不使用,双硫酸盐的转化可能会受到影响23,24。如果获得低质量的DNA,建议进一步纯化,以确保检测的可靠性。其次,非甲基化细胞氨酸将双硫酸盐成功转化为尿素。双硫酸盐转化最关键的一步是脱氧核糖核酸(DNA)变性23,25。使用双硫酸铵(与双硫酸钠相比)的高温变性可提高转化效率和一致性,是这些测定剂25、26的推荐工艺。用户必须确保反应发生在80°C,并且样品混合经常进行。出于这些原因,建议使用数字热混合器(参见材料表)。第三,在qPCR制备过程中,必须遵循适当的移液技术。在qPCR反应过程中,需要三个技术复制,以遵守发布定量实时PCR实验(MIQE)指南27的最小信息。列入更多的技术复制是可以接受的,但不是必须的。移液技术和/或不包括技术复制将导致 qPCR 结果不可靠。
如果遵循关键步骤,但仍未获得预期结果,则可利用测定中的多个控制来查明问题。适当的双硫酸盐转化是该测定中最关键的一步。不正确的双硫酸盐转换将由失败的校准因子和/或分析模板计算的参考值突出显示。如果双硫酸盐转换执行不正确(例如,如果反应在RT上执行),在qPCR期间不会放大。此外,如果在qPCR反应制备过程中出现错误(例如,如果未添加qPCR主混合物),则不出现扩增。通过调查标准样本,可以分离这两个问题。在标准样品中放大,但不包括参考样品、校准器和实验样品,将表明双硫酸盐的转化没有正确执行。任何样本中的无扩增都表明 qPCR 未正确执行。
虽然此测定解决了与其他标注方法(特别是流式细胞学)相关的严格的样品要求和分析变异性,但必须注意一些限制。此测定针对用作目标细胞的唯一标识符的单个位点,该基点禁止通常使用流式细胞测量执行的多路复用分析。这使得识别像Th17这样的复杂细胞类型变得困难。然而,在单个位点使用甲基化模式已被证明是多个细胞的准确型型标记,并已用于多个临床试验15,16。这一点在Tregs中尤为明显,在Tregs中,评估FOXP3甲基化特征是一种准确而明确的方法,用于从瞬时FOXP3表达细胞28中检测真正的Tregs。多路复用分析的损失由被询问的位点的准确性补偿。未来的检测迭代可以包括多个qPCR染料和成套剂,以便在一个qPCR反应中检测多个位点。
在确定细胞表型和身份时,此测定可用作流式细胞测定的替代方法。需要注意的是,这种测定不会产生流式细胞测定的精确值(图1-3)。这部分是由于与流式细胞学相关的数据分析的可变性。根据浇注策略,流式细胞测量的结果可能有很大差异。当使用复杂的染色协议来观察细胞内目标时尤其如此,例如IL-17,其中变异系数(CV)可以高达15%14。在多个用户之间,一致展示的测定的CV为<15%,支持测定的鲁棒性和改进的标准化能力。在需要细胞刺激时,可以看到表观遗传和流细胞学之间的最大差异(图3)。通过流细胞测定对Th17细胞的检测,使用T细胞刺激和细胞内细胞因子染色29、30、31的常见方案完成。在Th17表征中看到的差异,表观遗传测量和流细胞学可能是由于IL-17生产的动力学。虽然甲基化特征是稳定的,蛋白质的产生需要时间,并且必须有足够的数量被荧光抗体20,32检测出来。6 h培养与蛋白质运输抑制剂和细胞刺激鸡尾酒可能需要扩展,以看到通过表观遗传表型方法检测的Th17细胞的水平。需要更多的研究来确定值不匹配的确切原因,并确定最准确的表示法。
在本报告中,我们将详细介绍如何以简单和稳健的方式识别和量化细胞异质混合物中的免疫细胞类型。该检测系统经过设计和优化,可用于基于细胞的治疗药物的在加工和释放测试中的潜在用途。所述测定符合在细胞治疗应用中使用高素质原料的要求。通过解决流式细胞测定和其他分子方法的缺点,如稳定性、样品要求、先前刺激、细胞内染色的细胞渗透和数据分析的主观性,所述测定方法符合以细胞为基础的疗法商业化的目标。
披露声明
苏曼·普拉丹、杰里·古兹曼、卡尔·达尔吉茨、马克·兰登和乌玛·拉克什米帕蒂受雇于赛默·费舍尔科学公司。斯文·奥莱克、比约恩·萨曼斯和乌尔里希·霍夫穆勒分别是Epiontis公司的创始人和雇员。在制作这份手稿时没有使用任何书面协助。
致谢
该项目由赛默费舍尔科学内部赠款资助。
材料
| Name | Company | Catalog Number | Comments |
| 2.0 ml Eppendorf Safe-Lock Tubes | Eppendorf | 22363344 | |
| Analysis template for CD8 assay | Click Here | ||
| Analysis template for Th17 assay | Click Here | ||
| Analysis template for Treg assay | Click Here | ||
| Attune NxT Acoustic Focusing Cytometer, blue/red/violet6/yellow | Thermo Fisher Scientific | A29004 | |
| CTS PureQuant CD8+ T-Cell Assay | Thermo Fisher Scientific | A43674 | |
| CTS PureQuant Th17 Assay | Thermo Fisher Scientific | A43676 | |
| CTS PureQuant Treg Assay | Thermo Fisher Scientific | A43675 | |
| Dynabeads SILANE Genomic DNA Kit | Thermo Fisher Scientific | 37012D | Used for genomic DNA isolation and purification after bisulfite conversion. Contains elution buffer to dilute samples. |
| DynaMag-2 Magnet | Thermo Fisher Scientific | 12321D | Used as a magnetic rack during DNA isolation and purification |
| eBioscience Essential Human T cell Phenotyping Kit | Thermo Fisher Scientific | A42923 | |
| eBioscience Essential Human Th1/Th17 Phenotyping Kit | Thermo Fisher Scientific | A42927 | |
| eBioscience Essential Human Treg Phenotyping Kit | Thermo Fisher Scientific | A42925 | |
| Eppendorf SmartBlock 2 mL | Eppendorf | 5362000035 | |
| Eppendorf ThermoMixer C | Eppendorf | 5382000023 | |
| HulaMixer Sample Mixer | Thermo Fisher Scientific | 15920D | Recommended sample mixer |
| NanoDrop | Thermo Fisher Scientific | ND 1000 | |
| Nonstick, RNase-free Microfuge Tubes, 1.5 mL | Applied Biosystems | AM12450 | |
| QuantStudio 12S Flex | Applied Biosystems | 4470661 | |
| TE, pH 8.0, RNase-free | Thermo Fisher Scientific | AM9849 | |
| Vortex Mixer | Thermo Fisher Scientific | H2KT17113 |
参考文献
- Hartmann, J., Schüßler-Lenz, M., Bondanza, A., Buchholz, C. J. Clinical development of CAR T cells-challenges and opportunities in translating innovative treatment concepts. EMBO Molecular Medicine. 9, 1183-1197 (2017).
- Graham, C., Jozwik, A., Pepper, A., Benjamin, R. Allogeneic CAR-T Cells: More than Ease of Access? Cells. 7, E155(2018).
- Turtle, C. J., et al. CD19 CAR-T cells of defined CD4+:CD8+ composition in adult B cell ALL patients. Journal of Clinical Investigation. 126, 2123-2138 (2016).
- Akalin, I., et al. Effects of Chimeric Antigen Receptor (CAR) Expression on Regulatory T Cells. Molecular Therapy. 17, S25(2009).
- Knochelmann, H. M., et al. CAR T Cells in Solid Tumors: Blueprints for Building Effective Therapies. Frontiers in Immunology. 9, (2018).
- Chen, M. L., et al. Regulatory T cells suppress tumor-specific CD8 T cell cytotoxicity through TGF-β signals in vivo. Proceedings of the National Academy of Sciences. 102, 419-424 (2005).
- Muranski, P., et al. Tumor-specific Th17-polarized cells eradicate large established melanoma. Blood. 112, 362-373 (2008).
- Majchrzak, K., et al. Exploiting IL-17-producing CD4+ and CD8+ T cells to improve cancer immunotherapy in the clinic. Cancer Immunology, Immunotherapy. 65, 247-259 (2016).
- Guedan, S., et al. ICOS-based chimeric antigen receptors program bipolar TH17/TH1 cells. Blood. 124, 1070-1080 (2014).
- Vicetti Miguel, R. D., Maryak, S. A., Cherpes, T. L. Brefeldin A, but not monensin, enables flow cytometric detection of interleukin-4 within peripheral T cells responding to ex vivo stimulation with Chlamydia trachomatis. Journal of Immunological Methods. 384, 191-195 (2012).
- Lovelace, P., Maecker, H. T. Multiparameter Intracellular Cytokine Staining. Methods in Molecular Biology. 699, 165-178 (2011).
- Presicce, P., Moreno-Fernandez, M. E., Lages, C. S., Orsborn, K. I., Chougnet, C. A. Association of two clones allows for optimal detection of human FOXP3. Cytometry A. 77, 571-579 (2010).
- Pachón, G., Caragol, I., Petriz, J. Subjectivity and flow cytometric variability. Nature Reviews Immunology. 12, 396(2012).
- Westera, L., et al. Centrally Determined Standardization of Flow Cytometry Methods Reduces Interlaboratory Variation in a Prospective Multicenter Study. Clinical and Translational Gastroenterology. 8, e126(2017).
- Baron, U., et al. Epigenetic immune cell counting in human blood samples for immunodiagnostics. Science Translational Medicine. 10, (2018).
- Kleen, T. O., Yuan, J. Quantitative real-time PCR assisted cell counting (qPACC) for epigenetic - based immune cell quantification in blood and tissue. Journal for ImmunoTherapy of Cancer. 3, 46(2015).
- Rapko, S., et al. DNA methylation analysis as novel tool for quality control in regenerative medicine. Tissue Engineering. 13, 2271-2280 (2007).
- Wieczorek, G., et al. Quantitative DNA Methylation Analysis of FOXP3 as a New Method for Counting Regulatory T Cells in Peripheral Blood and Solid Tissue. Cancer Research. 69, 599-608 (2009).
- Andersson, D., et al. Properties of targeted preamplification in DNA and cDNA quantification. Expert Review of Molecular Diagnosis. 15, 1085-1100 (2015).
- Jung, T., Schauer, U., Heusser, C., Neumann, C., Rieger, C. Detection of intracellular cytokines by flow cytometry. Journal of Immunological Methods. 159, 197-207 (1993).
- Armbruster, D. A., Pry, T. Limit of Blank, Limit of Detection and Limit of Quantitation. Clinical Biochemistry Reviews. 29, S49-S52 (2008).
- Bustin, S. A., et al. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments. Clinical Chemistry. 55, 611-622 (2009).
- Li, Y., Tollefsbol, T. O. DNA methylation detection: Bisulfite genomic sequencing analysis. Methods in Molecular Biology. 791, 11-21 (2011).
- Warnecke, P. M., et al. Identification and resolution of artifacts in bisulfite sequencing. Methods. 27, 101-107 (2002).
- Genereux, D. P., Johnson, W. C., Burden, A. F., Stöger, R., Laird, C. D. Errors in the bisulfite conversion of DNA: modulating inappropriate- and failed-conversion frequencies. Nucleic Acids Research. 36, e150(2008).
- Darst, R. P., Pardo, C. E., Ai, L., Brown, K. D., Kladde, M. P. Bisulfite Sequencing of DNA. Current Protocols in Molecular Biology. 91, 7.9.1-7.9.7 (2010).
- Taylor, S., Wakem, M., Dijkman, G., Alsarraj, M., Nguyen, M. A practical approach to RT-qPCR-Publishing data that conform to the MIQE guidelines. Methods. 50, S1-S5 (2010).
- Baron, U., et al. DNA demethylation in the human FOXP3 locus discriminates regulatory T cells from activated FOXP3(+) conventional T cells. European Journal of Immunology. 37, 2378-2389 (2007).
- Yao, Z., et al. Human IL-17: a novel cytokine derived from T cells. Journal of Immunology. 155, 5483-5486 (1995).
- Lockhart, E., Green, A. M., Flynn, J. L. IL-17 production is dominated by gammadelta T cells rather than CD4 T cells during Mycobacterium tuberculosis infection. Journal of Immunology. 177, 4662-4669 (2006).
- Liang, S. C., et al. Interleukin (IL)-22 and IL-17 are coexpressed by Th17 cells and cooperatively enhance expression of antimicrobial peptides. Journal of Experimental Medicine. 203, 2271-2279 (2006).
- Olsen, I., Sollid, L. M. Pitfalls in determining the cytokine profile of human T cells. Journal of Immunological Methods. 390, 106-112 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。