Method Article
الثقافة والتلاعب وزرع تقويم العظام من ورم المثانة الماوس Organoids
* These authors contributed equally
In This Article
Summary
يوفر هذا البروتوكول خطوات تجريبية مفصلة لإنشاء ثقافة ثلاثية الأبعاد في المختبر من organoids ورم المثانة المستمدة من سرطان المثانة الميورين الناجم عن مادة مسرطنة. يتم وصف أساليب الاستزراع بما في ذلك المرور والهندسة الوراثية وزرع العظام من organoids الورم.
Abstract
وقد تم تشجيع تطوير نماذج متقدمة للورم منذ فترة طويلة لأن نماذج السرطان الحالية أظهرت قيودًا مثل عدم وجود بنية ورم ثلاثي الأبعاد (3D) وانخفاض الصلة بسرطان الإنسان. وقد طور الباحثون مؤخرا نموذج سرطان 3D في المختبر المشار إليها باسم organoids الورم التي يمكن أن تحاكي خصائص الورم الأصلي في طبق الثقافة. هنا ، يتم وصف الإجراءات التجريبية بالتفصيل لإنشاء organoids ورم المثانة من ورم المثانة الميورين الناجم عن مادة مسرطنة ، بما في ذلك الثقافة والمرور والحفاظ على الأعضاء التناسلية للورم ثلاثي الأبعاد الناتجة في المختبر. بالإضافة إلى ذلك ، يتم وصف بروتوكولات للتلاعب بخطوط ورم المثانة الاعضاء المنشأة للهندسة الوراثية باستخدام نقل بوساطة اللاتين ، بما في ذلك الظروف المثلى لإدخال عناصر وراثية جديدة إلى الورم بكفاءة الاعضاء. وأخيرا ، يتم وضع إجراء زرع تقويم العظام من organoids ورم المثانة في جدار المثانة مورين لمزيد من التحليل. يمكن أن تسهل الأساليب الموصوفة في هذه المقالة إنشاء نموذج في المختبر لسرطان المثانة لتطوير خيارات علاجية أفضل.
Introduction
سرطان المثانة هو سرطان المسالك البولية الأكثر انتشارا، مع ما يقرب من 165،000 مريض الذين يلاون سنويا1. من بين أنواع مختلفة من سرطان المثانة، والعضلات الغازية سرطان المسالك البولية معارض النمط الظاهري العدوانية، ومعدل البقاء على قيد الحياة 5 سنوات أقل من 50٪2. لم يتم توسيع الخيارات العلاجية الجديدة للأورام البولية الغازية على مدى العقود القليلة الماضية1.
وقد استخدمت خطوط الخلايا السرطانية على نطاق واسع لفحص المخدرات3. على الرغم من أن النتائج المواتية قد لوحظت في العديد من المرشحين المخدرات في خطوط الخلايا السرطانية, يتم الإبلاغ عن نتائج سيئة في التجارب السريرية4. بعد زيادة التكيف مع بيئات الثقافة ثنائية الأبعاد في المختبر ، أصبح من الصعب بشكل متزايد تلخيص الأورام الأصلية في خطوط الخلايا. يمكن استخدام نماذج سرطان الحيوان أو xenografts الورم المشتقة من المريض لمعالجة القيود التي لوحظت في خطوط خلايا سرطان المثانة. ومع ذلك، فإن نماذج سرطان الحيوانات هي الوقت والموارد الكثيفة. ولذلك ، تم تحسين نماذج المرض على الطلب لسنوات ، ونظام نموذج جديد ، organoids ، وقد وضعت للتغلب على أوجه القصور في النماذج القائمة5.
وorganoid هو بناء ثلاثي الأبعاد متعدد الخلايا التي يمكن أن تُلخص في المختبر الخصائص الفسيولوجية للعضو في الجسم الحي. يمكن اشتقاق الأورام الطبيعية والورم من الخلايا الجذعية متعددة القدرات أو البالغة ، والخلايا السرطانية الأولية ، على التوالي5،6. على مدى السنوات القليلة الماضية ، تم إنشاء organoids الورم من عدد كبير من أنسجة الورم المتنوعة7، بما في ذلك القولون8،9، المثانة10، البنكرياس11،12، البروستاتا13، الكبد14، والثدي15 أنسجة الورم. هذه الأورام الاعضاء تحاكي أورامها الأصلية فينونموذجيا ووراثيا. نظرًا لتشابهها مع أنسجة أورام الجسم الحي وتطبيقاتها العملية العديدة ، اعتمدها الباحثون كنماذج جديدة للمرض في دراسة الإمراض السرطاني.
هنا ، يتم وضع إجراءات إنشاء organoids الورم من ورم المورين الغازية التي يسببها مادة المورين16. يستخدم N-butyl-N-(4-هيدروكسي بوتيل) النيتروزامين (BBN) كمسرطن للحث على سرطان المسالك البولية الغازية في الفئران17 ويتم تأسيس organoids الورم، التي تظهر الخصائص المرضية لأورام المثانة الغازية العضلات الماوس، من سرطان المثانة الميورين الناجم عن BBN16. ويتضح طريقة للتلاعب وراثيا organoids الورم باستخدام نقل بوساطة فيروس لتطوير نظام نموذجي لدراسة الأساس الجزيئي لتطور سرطان المثانة. بالإضافة إلى ذلك ، يتم وصف طريقة لزرع الأعضاء التقويمية في المثانة للتحقيق في دور بيئة المثانة الأصلية في سرطان المثانة.
Protocol
تمت الموافقة على جميع الإجراءات وتنفيذها بموجب المبادئ التوجيهية للجنة المؤسسية لرعاية الحيوانات واستخدامها في POSTECH (رقم IACUC: POSTECH-2019-0055).
1. في الثقافة الفيترو من ورم المثانة Organoids
- إنشاء organoids ورم المثانة من ورم المثانة المورين (الشكل 1أ).
ملاحظة: يتم تحديد إجراء توليد أورام المثانة الماوس التي يسببها BBN في شين وآخرون.17.- توفير 0.1٪ BBN التي تحتوي على المياه في زجاجة داكنة لبور الإعلانية libitum لمدة 6 أشهر. تغيير المياه التي تحتوي على BBN 2x في الأسبوع.
ملاحظة: تم استخدام فأر ذكر C57BL/6 بوزن جسم يبلغ حوالي 25 جم في عمر 8-10 أسابيع. يمكن إعطاء الماء المحتوي على BBN إلى ما يصل إلى خمسة فئران في قفص واحد. - بعد 6 أشهر، القتل الرحيم الماوس باستخدام استنشاق ثاني أكسيد الكربون وعزل ورم المثانة بأكمله. نقله إلى طبق بيتري 90 ملم.
- قم بإزالة الأجزاء غير السرطانية والمناطق النخرية باستخدام المقص الجراحي المعقم واغسل شظايا ورم المثانة 2-3 مرات بمحلول السلوي البارد 1x Dulbecco المُخلٍ بالفوسفات (DPBS). جمع شظايا ونقلها إلى طبق جديد بيتري 90 ملم.
- أضف 1 مل من المتوسط الأساسي الأدنى المعدل من Dulbecco (DMEM) مع حمض 10 mM 4-(2-hydroxyethyl)-1-piperazineethanesulfonic (HEPES).
- فرم أنسجة الورم إلى قطع صغيرة قدر الإمكان (0.5-1 مم3)باستخدام شفرة حلاقة معقمة.
- أضف 9 مل من DMEM مع 10 mM HEPES، 250 ميكروغرام/مل الكولاجين من النوع الأول، 250 ميكروغرام/مل كولاكولاز من النوع الثاني، و250 U/mL الليليسين الحراري. احتضان أنسجة الورم المفروم لمدة 1.5-2 ساعة على شاكر المداري في حاضنة (37 درجة مئوية، 5٪ CO2)لفصل شظايا في تعليق الخلية. نقل تعليق الخلية إلى أنبوب 50 مل.
ملاحظة: إذا كان حجم الورم حصاده من الماوس أكبر من 1 سم3، وعلاج ذلك مع 2x كمية الليليسين بالحرارة أو زيادة وقت الحضانة. - الطرد المركزي الأنبوب في 400 × ز لمدة 5 دقيقة في 4 درجة مئوية واستنشاق supernatant.
- إعادة تعليق بيليه باستخدام 5 مل من الأمونيوم كلوريد البوتاسيوم (ACK) العازلة اللايليس لليسأي خلايا الدم الحمراء. احتضان الأنبوب لمدة 3-5 دقيقة في درجة حرارة الغرفة (RT) حتى الانضاج الكامل لخلايا الدم الحمراء.
ملاحظة: إذا لم يتم ملاحظة خلايا الدم الحمراء، قم بحذف عملية الانحِل. - إضافة 20 مل من DMEM في الأنبوب. الطرد المركزي الأنبوب في 400 × ز لمدة 5 دقيقة في 4 درجة مئوية واستنشاق supernatant.
- إعادة تعليق بيليه مع 1 مل من 0.25٪ التربسين-EDTA و 10 μM Y-27632 ديهيدروكلوريد (Y-27632) لفصل بيليه في خلايا واحدة. احتضان الأنبوب لمدة 5 دقيقة في حمام مائي 37 درجة مئوية.
ملاحظة: مراقبة الورم تحت المجهر لتأكيد الانفصام الكامل في خلايا واحدة. إذا استمرت قطع من الخلايا، ماصة التعليق كذلك. - تحييد التربسين باستخدام 10 مل من DMEM مع 10٪ مصل الأبقار الجنين (FBS). قم بتصفية تعليق الخلية من خلال مصفاة خلية 100 ميكرومتر على أنبوب جديد بقيمة 50 مل لإزالة الحطام غير المهضوم.
- الطرد المركزي الأنبوب في 400 × ز لمدة 5 دقيقة في 4 درجة مئوية واستنشاق supernatant.
- معطف بئر في 24 لوحة جيدة باستخدام 150 ميكرولتر من الجليد البارد عامل النمو انخفاض مصفوفة غشاء الطابق السفلي(جدول المواد)ووضع لوحة بئر 24 في حاضنة (37 درجة مئوية، 5٪ CO2)لمدة 30 دقيقة لترسيخ مصفوفة غشاء الطابق السفلي.
ملاحظة: إذابة والحفاظ على مصفوفة غشاء الطابق السفلي عند 4 درجة مئوية لمنع التصلب قبل الاستخدام. - إعادة تعليق بيليه باستخدام 1 مل من DMEM وعد الخلايا باستخدام مقياس الهيوكتومتر. نقل 3-4 × 104 خلايا الورم إلى 1.5 مل microtube على الجليد.
- الطرد المركزي الأنابيب الدقيقة في 400 × ز لمدة 3 دقيقة في 4 درجة مئوية وتجاهل بعناية supernatant.
- إعادة تعليق الخلايا مع 500 ميكرولتر من متوسطة العضو ية القابلة للتدفئة الأولية(الجدول 1)و 10 ميكرومتر Y-27632 ونقلها إلى البئر المغلفة. ضع لوحة البئر 24 في حاضنة (37 درجة مئوية، 5٪ من ثاني أكسيد الكربون2).
- يمكن تخزين خلايا ورم المثانة الإضافية مع 1 مل من DMEM تحتوي على 10٪ FBS، 1٪ البنسلين / ستريبتومسين، و 10٪ ثنائي ميثيل سلفأكسيد (DMSO) في 1.5 مل من التبريد. ضعها في حاوية تجميد باردة ونقل الحاوية إلى ثلاجة -80 درجة مئوية. بعد التخزين في الثلاجة بين عشية وضحاها، نقل cryovials إلى النيتروجين السائل للتخزين على المدى الطويل.
- تغيير المتوسط كل يومين باستخدام 500 ميكرولتر من متوسطة العضو ية المرتاة(الشكل 1B).
- توفير 0.1٪ BBN التي تحتوي على المياه في زجاجة داكنة لبور الإعلانية libitum لمدة 6 أشهر. تغيير المياه التي تحتوي على BBN 2x في الأسبوع.
- الأورمنات الأوروية لأورام المثانة.
ملاحظة: يوصى بمرور organoids ورم المثانة عندما تصل إلى 100-150 ميكرومتر في القطر.- أضف 500 ميكرولتر من الكولاجين/الديسباز إلى الوسط العضوي في صفيحة 24 مع الأورام الاعضاء. ماسيت صعودا وهبوطا في مصفوفة غشاء الطابق السفلي والمتوسطة. احتضان لمدة 20 دقيقة في 37 درجة مئوية وحصاد الخلايا في أنبوب 15 مل.
ملاحظة: فحص organoids معزولة من مصفوفة غشاء الطابق السفلي تحت المجهر. إذا لم يتم فصل organoids من مصفوفة غشاء الطابق السفلي، وزيادة وقت الحضانة أو ماصة أكثر من مرة. - إضافة 5 مل من DMEM الداوة، والطرد المركزي الأنبوب في 400 × ز لمدة 3 دقيقة في 4 درجة مئوية، واستنشاق supernatant.
- إعادة تعليق بيليه باستخدام 1 مل من مُدفئة 0.25% التربسين-EDTA و 10 ميكرومتر Y-27632. احتضان لمدة 5 دقيقة في حمام مائي 37 درجة مئوية. بقوة ماصة الخلايا صعودا وهبوطا وتحييد التربسين باستخدام 5 مل من DMEM مع FBS 10٪.
- الطرد المركزي الأنبوب في 400 × ز لمدة 3 دقيقة في 4 درجة مئوية واستنشاق supernatant.
- إعادة تعليق بيليه باستخدام 1 مل من وسط العضو ية الدفء وحساب عدد الخلايا السرطانية واحدة.
- كرر الخطوات 1.1.14−1.1.18.
- أضف 500 ميكرولتر من الكولاجين/الديسباز إلى الوسط العضوي في صفيحة 24 مع الأورام الاعضاء. ماسيت صعودا وهبوطا في مصفوفة غشاء الطابق السفلي والمتوسطة. احتضان لمدة 20 دقيقة في 37 درجة مئوية وحصاد الخلايا في أنبوب 15 مل.
2. التلاعب الجيني للOrganoids ورم المثانة باستخدام النتفير بوساطة اللينتي(الشكل 2A)
- إنتاج الجسيمات اللافيروسية التي تعبر عن GFP.
- في اليوم 0، لوحة HEK 293T الخلايا بكثافة 5-6 × 106 خلايا لكل 10 سم لوحة ثقافة الخلية في وسط ثقافة خط الخلية (أي DMEM مع FBS 10٪ و 1٪ البنسلين / ستريبتومسين).
- في اليوم 1، قم بإعداد محلول تحويل الحمض النووي بما في ذلك البلازميد المنقول الذي يحتوي على GFP (8 ميكروغرام) والبلازميد التعبئة والتغليف اللافيفيروسات (10 ميكروغرام من pCMVR 8.74 و 3 ميكروغرام من pMD2.G) ، و 1 مل من وسط المصل المخفض(جدول المواد).
- إضافة 3 ميكرولتر من كاشف الترانفيس(جدول المواد)لكل 1 ميكروغرام من إجمالي البلازميد وفقا لتعليمات الشركة المصنعة وتخلط بلطف عن طريق الأنابيب. احتضان لمدة 20 دقيقة في RT وإضافة 9 مل من DMEM مع FBS 10٪.
- اسشق الوسط الثقافي في لوحة ثقافة الخلية مع خلايا HEK 293T. نقل بعناية 10 مل من محلول نقل الحمض النووي على خلايا HEK 293T واحتضان في حاضنة ثقافة الخلية في 37 درجة مئوية.
- في اليوم 3، ومراقبة الخلايا تحت المجهر الفلوري (الإثارة في 488 نانومتر والانبعاثات في 512 نانومتر) لتحديد كفاءة الترانزfecشن. ما يقرب من 90٪ -100٪ من الخلايا في مجموع سكان الخلايا يجب أن تعبر عن GFP.
- جمع supernatant (التي تحتوي على الفيروس) وfiltrate supernatant مع 0.45 ميكرومتر البوليإيثرسولفون (PES) مرشح.
ملاحظة: استخدم عامل تصفية منخفض ربط البروتين مثل عامل تصفية PES. - لتركيز الفيروس، الطرد المركزي الفيروس supernatant في 98،768 x ز في جهاز طرد مركزي لمدة 2 ساعة في 4 درجة مئوية في الدوار دلو يتأرجح(جدول المواد)وتجاهل بعناية supernatant.
- إعادة تعليق بيليه في 2.5 مل من وسط العضو البارد.
- للتخزين على المدى الطويل، aliquot 250 ميكرولتر من متوسطة اللافيروسية إلى قوارير المبردة وتجميدها باستخدام النيتروجين السائل. تخزين المخزونات الفيروسية المجمدة في الثلاجة -80 درجة مئوية.
- إجراء نقل بوساطة اللاتيفية لأورام المثانة.
- في اليوم 2, تقسيم organoids الورم كما هو موضح أعلاه (الخطوة 1.2) 12 ح قبل نقل بوساطة فيروس lenti.
- في اليوم الثالث، قم بسرعة بإذابة أعليكوت (الخطوة 2.1.9) التي تحتوي على فيروس في حمام مائي 37 درجة مئوية وإضافة 250 ميكرولتر من الوسط العضوي مع 10 ميكرومتر Y-27632 و 8 ميكروغرام/مل سداسي الديميترين.
- استبدال الوسط العضوي في صفيحة بئر 24 مع organoids الورم من قبل 500 ميكرولتر من المتوسطة المحتوية على الفيروس واحتضان لمدة 12-16 ساعة في حاضنة (37 درجة مئوية، 5٪ CO2).
- في اليوم 4، تغيير المتوسطة مع 500 ميكرولتر من الوسائط الاعضاء الطازجة.
ملاحظة: بعد 12-16 ساعة من الحضانة ، يجب تغيير الوسط ، لأن الوسيط الذي يحتوي على فيروس اللاتي وبروميد سداسي الديميترين سام للخلايا. - في اليوم 6 ، راقب إشارة GFP من organoids الورم بعد 3 أيام من نقلها تحت مجهر مضان(الشكل 2B).
- في اليوم 10، مرور وتخزين organoids 7 أيام بعد نقل كما هو موضح في الخطوة 1.2، للحفاظ على خطوط الورم الاعضاء المعدلة وراثيا.
3. زرع تقويم العظام من المثانة Organoid(الشكل 3A)
- إعداد الأعضاء ورم المثانة لزرع تقويم العظام.
- قبل زرع, ثقافة organoids ورم المثانة لمدة 5-7 أيام, كما هو موضح أعلاه (الخطوة 1.2).
- أضف 500 ميكرولتر من الكولاجين/الديسباز إلى وسط عضوي في 24 طبق جيد مع الأورام الاعضاء. ماسيت صعودا وهبوطا في مصفوفة غشاء الطابق السفلي والمتوسطة. احتضان لمدة 20 دقيقة في 37 درجة مئوية وجمع الخلايا في أنبوب 15 مل.
- إضافة 5 مل من DMEM الداوة، والطرد المركزي الأنبوب في 400 × ز لمدة 3 دقيقة في 4 درجة مئوية، واستنشاق supernatant.
- إعادة تعليق بيليه مع 1 مل من DMEM ونقل الحل إلى طبق بيتري 90 ملم.
- تحت المجهر، التقط 10-100 عضوية الورم باستخدام ميكروبيبت P200 وجمعها في أنبوب صغير على الجليد.
- الطرد المركزي الأنبوب في 400 × ز لمدة 3 دقيقة في 4 درجة مئوية وتجاهل بعناية supernatant.
- الحفاظ على بيليه الخلية على الجليد حتى الفئران جاهزة للجراحة.
- زرع جدار المثانة تحت المخاطية
ملاحظة: يتم تعديل هذا الإجراء من البروتوكول الذي نشره Fu et al18.- إعداد 8 إلى 10 أسبوع من العمر الذكور الماوس عارية (CAnN.Cg-Foxn1nu/Crl) على الأقل 1 قبل أسبوع من التجربة للسماح لها بالتكيف مع بيئة جديدة. حقن enrofloxacin (5 ملغ / كغ) تحت الجلد 24 ساعة قبل الجراحة.
- تنظيف سطح مقاعد البدلاء عن طريق الصابون والماء. الأوتوكلاف الأدوات الجراحية قبل العملية الجراحية وإجراء عملية جراحية باستخدام أدوات معقمة.
- الحفاظ على حقنة الأنسولين 29 G، نصائح ماصة، ومصفوفة غشاء الطابق السفلي على الجليد. إدارة كيتوبروفين (5 ملغ / كجم) تحت الجلد قبل إعطاء التخدير.
- تطفل الفأر مع 4٪ isoflurane في غرفة التعريفي. مرة واحدة التخدير العام يتحقق، ووضع الماوس في موقف supine والحفاظ على التخدير عن طريق استنشاق قناع من 2٪ isoflurane متبخرة.
ملاحظة: إذا كان وقت التطفل أكثر من 30 دقيقة، ضع مرهم العين على كلتا العينين باستخدام مسحة قطنية لتجنب تجفيف القرنية. - تطبيق اليود povidone مع الشاش المعقم ومسحعليه مع الإيثانول 70٪. كرر 3x مع شاش جديد أو مسحة القطن في كل مرة.
- قم بتغطية السُبُق والحقل الجراحي باستخدام الستائر الجراحية المعقمة التي يمكن التخلص منها.
- باستخدام المجهر تشريح للتكبير، وجعل شق عرضية صغيرة (أصغر من 1.5 سم) في الجلد والجدار العضلي من أسفل البطن منتصف الخط مع مقص الجراحية العقيمة. كشف المثانة من تجويف البطن ودعمها مع مسحات القطن المنقوعة بالمالحة.
ملاحظة: إذا كانت المثانة مليئة بالبول، اضغط بلطف على المثانة لفك ضغطها قليلاً. - إعادة تعليق الكريات العضوية (الخطوة 3.1.7) في 80 ميكرولتر من المتوسطة العضوية التي تحتوي على 50٪ مصفوفة غشاء الطابق السفلي عالية التركيز(جدول المواد).
- حقن تعليق العضو في الجانب الأمامي من قبة المثانة باستخدام حقنة الأنسولين 29 G تحت المجهر تشريح.
- أغلق الطبقة الداخلية من جدار البطن بخياطة قابلة للامتصاص مضادة للبكتيريا ثم أغلق الطبقة الخارجية بخياطة النايلون 4-0. تطهير الموقع الجراحي مع اليود povidone و الإيثانول 70٪.
- السماح للفأرة لاسترداد تحت الأشعة تحت الحمراء الراديافي10-15 دقيقة. مراقبة الماوس حتى يستعيد وعيه والحركة.
- يوم واحد بعد الجراحة، والتحقق من الحالة العامة للفأر وتسرب anastomotic. إدارة كيتوبروفين (5 ملغ /كغ) مرة واحدة يوميا لمدة 3 أيام بعد العملية الجراحية وعلاج enrofloxacin (5 ملغ / كغ) مرة واحدة يوميا لمدة 10 أيام بعد العملية الجراحية.
- عندما يشفى موقع الشق (10-14 يومًا بعد الجراحة) ، قم بإزالة الغرز. مراقبة نمو ورم المثانة الماوس لمدة 2-3 أسابيع بعد حقن العضو الورم.
- إذا لوحظ نمو ورم المثانة، قتل الإنسان باستخدام استنشاق ثاني أكسيد الكربون، وحصاد ورم المثانة بأكمله. غسله باستخدام DPBS الباردة(الشكل 3B)16.
- لتحليل الأنسجة ورم المثانة، وصمة عار في الجزء جزءا لا يتجزأ من البارافين من الأنسجة باستخدام الدماتوكسيلين وإيوسين (H و E) تلطيخ(الشكل 3B)16.
النتائج
في الثقافة المختبرية للورم المثانة الماوس organoids
عدد الخلايا السرطانية المنفصلة عن الورم الناجم عن 1سم ~ 3 BBN هو على الأقل 4 × 105 خلايا. عندما يتم بذر الخلايا في البداية في مصفوفة غشاء الطابق السفلي ، يمكن ملاحظة الخلايا غير السرطانية والحطام. تم تخفيف الحطام تدريجيا من خلال مواصلة الثقافة الفرعية. يعرض الشكل 1B صورًا للأعضاء المستزرعة في نقاط زمنية مختلفة. إذا كانت الخلايا السرطانية لا تشكل organoids الورم، والخلايا يحتمل أن تكون ميتة خلال خطوة التفكك. في مثل هذه الحالة ، يجب تعديل إجراءات الانفصام بما في ذلك وقت الحضانة مع الإنزيم لزيادة قدرة الخلية على البقاء.
التعبير عن GFP في organoids ورم المثانة باستخدام التلاعب الجيني بوساطة فيروس lenti
أظهرت organoids ورم المثانة إشارات GFP قوية مع عدوى لينتيفية ناجحة(الشكل 2B). بعد التركيز، كان ما مجموعه 250 ميكرولتر من الوسائط المحتوية على الفيروسات كافية لإصابة 3 × 104 خلايا ورم واحدة على مصفوفة غشاء الطابق السفلي، مع الحفاظ على كفاءة العدوى بنسبة 90٪ إلى 100٪. يمكن الكشف عن إشارات GFP من organoids ورم المثانة بعد 3 أيام من انتقال اللافيروسية. إذا كانت إشارات الفلورسينس منخفضة ، فإن كفاءة العدوى الفيروسية منخفضة. يمكن أن يكون هذا بسبب العديد من العوامل، مثل انخفاض تتر الفيروسية، والإجراءات تحتاج إلى تعديل وفقا لذلك.
زرع تقويم العظام من الأعضاء ورم المثانة
يتم تقديم ورم المثانة allograft التي تم الحصول عليها من الأعضاء ورم المثانة الناجمة عن BBN في الشكل 3B16. تم حصاد allografts ورم المثانة 3 أسابيع بعد زرع تقويم العظام. تم تحليل الأنسجة من ورم المثانة المزروعة باستخدام H و E تلطيخ. يمكن أن تنمو عمليات زرع العظام من الأعضاء السرطانية كأورام المثانة لمدة 2-3 أسابيع.

الشكل 1: في ثقافة المختبر من الأعضاء ورم المثانة الماوس. (أ)رسم تخطيطي لإنشاء أورام المثانة الماوس organoids. (ب)صور تمثيلية لثقافة أورام المثانة organoids في نقاط زمنية مختلفة. تم تأسيس organoids ورم المثانة الماوس والمستزرعة على مدى 9 أيام. مقياس شريط = 100 ميكرومتر. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
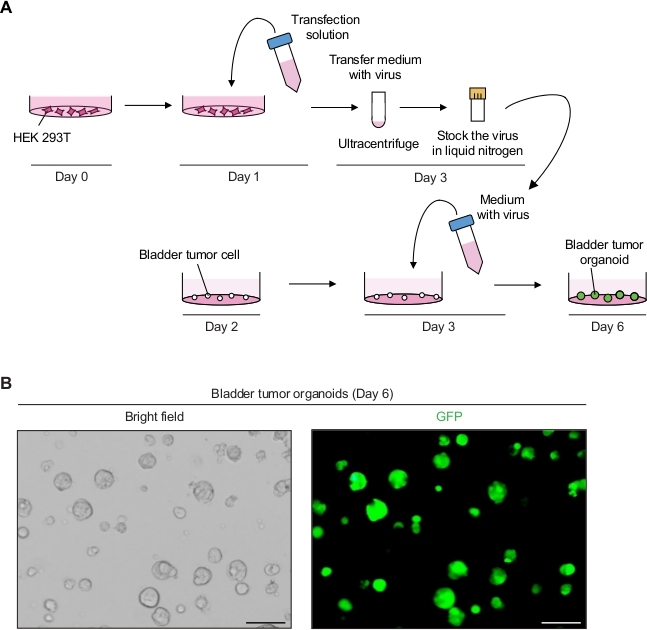
الشكل 2: التعبير عن GFP في organoids ورم المثانة باستخدام التلاعب الجيني بوساطة فيروس. (أ)رسم تخطيطي للترانسفير اللافيروسي وانتقال organoids ورم المثانة. (ب)صور تمثيلية لأورام المثانة التي تعبر عن GFP. أشرطة المقياس = 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: زرع تقويم العظام من organoids ورم المثانة. (أ)رسم تخطيطي لزرع تقويم العظام من organoids ورم المثانة إلى فأر ة عارية. (ب)صور تمثيلية للمثانات وأقسام ملونة H و E من الفئران المزروعة بتقويم المثانة مع organoids ورم المثانة. يتم عرض طرق العرض المكبرة للمناطق المعبّرة في اللوحات الوسطى في اللوحات اليسرى. مقياس شريط = 500 ميكرون. وقد استُنسخ هذا الرقم من الشكل 1 -الشكل الملحق 1، كيم وآخرون16،المنشور تحت الإسناد المتعلق بالمشاع الإبداعي 4.0 الترخيص العام الدولي (CC BY 4.0؛ https://creativecommons.org/licenses/by/4.0/). يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
| ورم المثانة الماوس الاعضاء المتوسطة | |
| متقدمة DMEM/F-12 (المتوسطة الأساسية) | 10 مم HEPES (درجة الحموضة 7.4) |
| 10 م م نيكوتيناميد | 0.5x مصل خالية من الملحق |
| 2 mM L-alanyl-L-الجلوتامين ديبتيد | 1% البنسلين/ستريبتومسين |
| 1 mM N-أسيتيل-L-السيستين | 50 نانوغرام/مل Murine عامل نمو البشرة |
| 1 ميكرومتر A 83-01 | |
الجدول 1: تكوين ورم المثانة الجهازية المتوسطة.
Discussion
يصف هذا البروتوكول الإجراءات التجريبية لثقافة والحفاظ على organoids ورم المثانة المستمدة من أورام المثانة الميورين الناجمة عن المواد المسرطنة.
في هذا البروتوكول، هناك العديد من الخطوات التجريبية التي قد تحتاج الإجراءات بعض استكشاف الأخطاء وإصلاحها. أولاً، عدد الخلايا السرطانية التي يتم بذرها في البداية هو عامل حاسم لأن انخفاض أعداد الخلايا السرطانية في الثقافة (<2 × 104 خلايا) يؤدي في الغالب إلى موت الخلايا بسبب عدم وجود تفاعلات بين الخلايا السرطانية. وعلى النقيض من ذلك، فإن البدء بخلايا كثيرة جداً (أكثر من 5 × 104 خلايا) عند البذر يؤدي إلى اكتظاظ الأعضاء، مما يؤدي إلى صعوبة عند التعامل مع الثقافات ذات النمو الضعيف لكل عضو. ويقترح بقوة أن لوحات متعددة مع أعداد مختلفة من الخلايا التي أنشئت في البداية لتحسين الظروف التجريبية. تحديد العدد الصحيح من الخلايا السرطانية الأولية أمر بالغ الأهمية لتحقيق أعلى قدرة على البقاء الخلية وإنشاء organoids ورم المثانة ناجحة. أيضا ، في الثقافة على المدى الطويل من أكثر من 2 أسابيع دون مرور ، تتوقف معظم organoids الورم النمو ، وربما بسبب عدم كفاية إمدادات المواد الغذائية في مركز organoids واستنفاد عامل النمو في مصفوفة غشاء الطابق السفلي. لذلك ، فإن الاستزراع الفرعي للأعضاء في الوقت المناسب هو خطوة حاسمة للحفاظ على ثقافة الورم العضوي.
ثانياً، يعد إنتاج جزيئات اللافيتالفيروسية عالية التتر أمراً حاسماً للتلاعب الجيني الفعال بالأعضاء السرطانية. لاستكشاف القضايا المتعلقة بالفيروسات ، يقترح بقوة أن يتم تحديد تتر الفيروس قبل انتقال الفيروس في كل مرة لأن البنى اللافيروسية تميل إلى إنتاج جزيئات فيروسية بكفاءة متفاوتة. إذا كانت organoids الورم تظهر انخفاض القدرة على البقاء بعد العدوى الفيروسية، فمن المرجح أن التيتر الفيروسية يحتمل أن تكون عالية جدا. ويقترح بقوة لاستخدام كمية أقل من الفيروس في هذه الحالة. ثالثا، أثناء زرع تقويم العظام من الأعضاء ورم المثانة الناجم ة عن BBN، فمن الأهمية بمكان للحفاظ على سلامة جدار المثانة. في حالة وصول الحقن إلى تجويف المثانة عن طريق اختراق طبقة جدار المثانة ، يجب إنهاء التجربة والتخلص منها. إذا كان ذلك ممكنا، يوصى بمراقبة نمو ورم المثانة باستخدام نظام التصوير بالموجات فوق الصوتية.
أحد القيود على التقنيات الحالية هو عدم وجود بيئة دقيقة الورم أو ستروما في هذه organoids. للتغلب على هذه المسألة، يقترح بقوة أن زرع تقويم العظام من organoids الورم استخدام نظام في الجسم الحي لتقليد البيئة الدقيقة الورم الأصلي. في المستقبل، سيكون من الضروري تطوير 3D في النظم الاعضاء المختبرية التي تتكون من organoids الورم مع مكونات أخرى من ستروما الورم.
واحدة من الآثار الرئيسية لتقنيتنا هو أنه في زرع العظام من organoids الورم، فقط 10 organoids ورم المثانة يمكن أن تحفز نمو الورم في المثانة. بالمقارنة مع تجارب زرع الورم التقليدية التي تتطلب 5 × 105- 1 × 106 خلايا ورم المثانة المفردة ، فإن أساليبنا أكثر كفاءة وقوة. وثمة فرق هام آخر هو أن organoids يمكن التلاعب بها بشكل متنوع باستخدام ناقلات لينتيفية مختلفة، مثل بنيات لينتيفية تحتوي على الحمض النووي الريبي قصيرة الشعر، ونظام CRISPR-Cas9، أو الجينات ذات الأهمية. وستكون هذه أدوات قوية لإضافتها إلى التكنولوجيا الاعضاء الحالية. وعموما، يمكن للنهج التجريبية المعروضة هنا تسهيل إنشاء نماذج الورم في المختبر التي يمكن أن تحسن فهمنا لمسببات سرطان المثانة بدلا من استخدام خطوط خلايا سرطان المثانة 2D.
وكانت هذه الطريقة قادرة على إنشاء organoids ورم المثانة المستمدة من ورم المثانة الناجم عن مادة مسرطنة. تقدم المقالة وصفاً للإجراءات التجريبية بوساطة فيروس اللينتي والتي يتم من خلالها إدخال التعديلات الجينية والحفاظ عليها بشكل ثابت في organoids ورم المثانة. بالإضافة إلى ذلك ، يتم تضمين إجراء لزرع تقويم العظام من organoids الورم. في تركيبة مع الحالية في نماذج سرطان الجسم الحي، وهذه التقنية تكون أداة مفيدة لدراسة الأساس الجزيئي لورم المثانة.
Disclosures
ولا يعلن صاحبا البلاغ عن أي مصالح مالية متنافسة.
Acknowledgements
تم دعم هذا البحث من خلال منح من المؤسسة الوطنية للبحوث في كوريا إلى K.S: NRF-2017R1A2B4006043، NRF-2017M3C7A1047875, NRF-2017R1A5A1015366, الاقتصاد الإبداعي الرائدة برنامج تطوير التكنولوجيا (SF317001A), بوسكو (2018Y060) و زمالة أبحاث BK21 Plus.
Materials
| Name | Company | Catalog Number | Comments |
| 0.45 µm syringe filter (PES membrane) | Millipore | SLHP033RS | |
| 10 cm culture plate | Eppendorf | 0030-702-115 | |
| 90 mm Petri dish | SPL | 10090 | |
| 100 µm cell strainer | Corning | 352360 | |
| 15 mL conical tube | SPL | 50015 | |
| 24-well plate | Corning | 3526 | |
| 29 G 1/2 insulin syringe | SHINA | B299473538 | |
| 3 mL syringe | Norm-ject | N7.A03 | |
| 50 mL conical tube | SPL | 50050 | |
| A8301 | Tocris | 2939 | stock concentration: 25 mM |
| Absolute ethanol | Daejung | 4023-2304 | |
| Absorbable suture | Henry Schein | 039010 | |
| Advanced DMEM/F-12 | Thermo | 12634028 | |
| Ammonium-chloride-potassium (ACK) lysing buffer | Thermo | A1049201 | |
| B-27 | Gibco | 17504-044 | stock concentration: 50X |
| BBN(N-butyl-N-(4-hydroxybutyl) nitrosamine) | Tokyo Chemical Industry | B0938 | |
| Blue nylon 5/0-13mm | AILEE | NB521 | |
| C57BL Mouse | The Jackson Laboratory | 000664 | |
| CAnN.Cg-Foxn1nu/Crl (nude mouse) | Charles River | 194 | |
| Collagenase type I | Thermo | 17100017 | stock concentration: 20 mg/mL |
| Collagenase type II | Thermo | 17100015 | stock concentration: 20 mg/mL |
| Collagenase/dispase | Sigma | 10269638001 | stock concentration: 1 mg/mL |
| Cyrovial | Corning | 430488 | |
| DMEM(Dulbecco's modified minimum essential media) | Gibco | 11965-118 | |
| DMSO(Dimethyl sulfoxide) | Sigma | D8418 | |
| DPBS(Dulbecco's phosphate-buffered saline) | Welgene | LB 001-02 | |
| Enrofloxacin (Baytril) | Bayer Healthcare | DIN: 02169428 | |
| FBS(Fetal bovine serum) | Millipore | ES009B-KC | |
| Glutamax | Gibco | 35050061 | 100X |
| HEK 293T | ATCC | CRL-11268 | |
| HEPES(4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid) | Welgene | BB001-01 | |
| Isoflurane | Hana Pharm Co., Ltd. | ||
| Ketoprofen (Anafen) | Merial | DIN: 02150999 | |
| Matrigel growth factor reduced (GFR) Growth Factor Reduced (GFR) | Corning | 354230 | use for organoid culture in plate |
| Matrigel high concentration (HC) | Corning | 354248 | use for organoid transplantation |
| 1.5 mL microtube | Axygen | MCT-150-C | |
| LT1 transfection reagent | Mirus Bio | MIR 2300 | |
| murine EGF(epidermal growth factor) | Peprotech | 315-09 | stock concentration: 100 µg/mL |
| N-acetyl-L-cysteine | Sigma | A9165 | stock concentration: 200 mM |
| Nicotinamide | Sigma | N0636 | stock concentration: 1M |
| Opti-MEM | Gibco | 31985070 | |
| pCMV.R 8.74 | Addgene | 22036 | Packaging plasmid |
| Penicillin/streptomycin | Gibco | 15140122 | 100X |
| pMD2.G | Addgene | 12259 | Envelope plasmid |
| Polybrene(hexadim ethrine bromide) | Sigma | H9286 | stock concentration: 2 µg/mL |
| pSiCoR | Addgene | 11579 | Lentiviral plasmid |
| Razor blade | |||
| Saline buffer | JW Pharmaceutical | ||
| SW41Ti swinging bucket rotor | Beckman Coulter | ||
| Thermolysin, Bacillus thermoproteolyticus | Millipore | 58656-2500KUCN | stock concentration: 250 KU/mL |
| Trypsin-EDTA (0.25%) | Gibco | 25200072 | |
| Ultracentrifugation tube | Beckman Coulter | 331372 | |
| Y-27632 dihydrochloride | Abmole | M1817 | stock concentration: 10 mM |
References
- Sanli, O., et al. Bladder cancer. Nature Reviews Disease Primers. 3, 17022 (2017).
- Stenzl, A., et al. Treatment of muscle-invasive and metastatic bladder cancer: update of the EAU guidelines. European Urology. 59 (6), 1009-1018 (2011).
- Barretina, J., et al. The Cancer Cell Line Encyclopedia enables predictive modelling of anticancer drug sensitivity. Nature. 483 (7391), 603 (2012).
- Caponigro, G., Sellers, W. R. Advances in the preclinical testing of cancer therapeutic hypotheses. Nature Reviews Drug Discovery. 10 (3), 179 (2011).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407 (2018).
- Fatehullah, A., Tan, S. H., Barker, N. Organoids as an in vitro model of human development and disease. Nature Cell Biology. 18 (3), 246 (2016).
- Pauli, C., et al. Personalized in vitro and in vivo cancer models to guide precision medicine. Cancer discovery. 7 (5), 462-477 (2017).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- van de Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Lee, S. H., et al. Tumor evolution and drug response in patient-derived organoid models of bladder cancer. Cell. 173 (2), 515-517 (2018).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Huang, L., et al. Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell-and patient-derived tumor organoids. Nature Medicine. 21 (11), 1364 (2015).
- Gao, D., et al. Organoid cultures derived from patients with advanced prostate cancer. Cell. 159 (1), 176-187 (2014).
- Broutier, L., et al. Human primary liver cancer–derived organoid cultures for disease modeling and drug screening. Nature Medicine. 23 (12), 1424 (2017).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Kim, S., et al. Epigenetic regulation of mammalian Hedgehog signaling to the stroma determines the molecular subtype of bladder cancer. eLife. 8, 43024 (2019).
- Shin, K., et al. Cellular origin of bladder neoplasia and tissue dynamics of its progression to invasive carcinoma. Nature Cell Biology. 16 (5), 469 (2014).
- Fu, C. L., Apelo, C. A., Torres, B., Thai, K. H., Hsieh, M. H. Mouse bladder wall injection. JoVE (Journal of Visualized Experiments). (53), e2523 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved