Method Article
マウス膀胱腫瘍オルガノイドの培養、操作、および正体移植
要約
このプロトコルは、発癌性癌誘発性マウス膀胱癌に由来する膀胱腫瘍オルガノイドの三次元体内培養を確立するための詳細な実験ステップを提供する。腫瘍オルガノイドの受動法、遺伝子工学、および正体移植を含む培養方法が記載されている。
要約
現在のがんモデルは、3次元(3D)腫瘍アーキテクチャの欠如やヒト癌との関連性の低さなどの限界を示しているため、高度な腫瘍モデルの開発は長い間奨励されてきました。研究者たちは最近、培養皿の在来腫瘍の特徴を模倣できる腫瘍オルガノイドと呼ばれる3D体外癌モデルを開発した。ここで、実験手順は、発癌性物質誘発性マウス膀胱腫瘍からの膀胱腫瘍オルガノイドの確立に関して詳述されているが、結果として生じる3D腫瘍オルガノイドの培養、通過、および維持を含むインビトロで。さらに、レンチウイルス媒介性形容積を用いた遺伝子工学のための確立された膀胱腫瘍オルガノイドラインを操作するためのプロトコルが記載されており、腫瘍への新しい遺伝子要素の効率的な導入のための最適化された条件が含まれるオルガノイド。最後に、更なる分析のために膀胱の壁に膀胱腫瘍オルガノイドの正所移植のための手順がレイアウトされている。この記事で説明する方法は、より良い治療オプションの開発のための膀胱癌のためのインビトロモデルの確立を促進することができる。
概要
膀胱癌は最も一般的な尿路癌であり、年間約165,000人の患者が死亡している。種々の膀胱癌の中で、筋浸潤性尿路上皮癌は積極的な表現型を示し、その5年生存率は50%2より低い。侵襲性尿路上皮腫瘍の新しい治療オプションは、過去数十年にわたって拡大されていません1.
癌細胞株は、薬物スクリーニング3に広く使用されている。好ましい結果は癌細胞株の多数の薬剤候補で観察されているが、臨床試験4で悪い結果が報告される。in vitro2次元(2D)培養環境への適応が増加した後、細胞株における天然腫瘍の再現がますます困難になっている。動物癌モデルまたは患者由来腫瘍異種移植片は、膀胱癌細胞株で観察される限界に対処するために使用することができる。しかし、動物癌モデルは時間と資源集約的です。したがって、改良された疾患モデルは長年にわたって需要に応じて行われ、新しいモデルシステム、オルガノイドは、既存モデル5の欠点を克服するために開発されている。
オルガノイドは、インビボ器官の生理学的特性をin vitroで再現できる多細胞3Dコンストラクトです。正常および腫瘍オルガノイドは、多能性幹細胞または成体幹細胞、および原発性腫瘍細胞、それぞれ5、6のいずれかに由来することができる。過去数年間にわたり、腫瘍オルガノイドは、大腸8、9、膀胱10、膵臓11、12、前立腺13、肝臓14、および乳房15腫瘍組織を含む多数の多様な腫瘍組織7から確立されてきた。このような腫瘍オルガノイドは、元の腫瘍を典型的かつ遺伝的に模倣する。インビボ腫瘍組織との類似性と数多くの実用的な応用により、研究者は癌病因の研究において新しい疾患モデルとしてそれらを採用している。
ここでは、発癌性泌尿器科腫瘍16から腫瘍オルガノイドを確立するための手順がレイアウトされている。N-ブチル-N-(4-ヒドロキシブチル)ニトロソミン(BBN)は、マウス17に侵襲性尿路上皮癌を誘導する発癌物質として使用され、マウスの筋肉浸潤性膀胱腫瘍の病理学的特徴を示す腫瘍オルガノイドは、BBN誘発性のマウス膀胱癌16から確立される。腫瘍オルガノイドを遺伝的に操作する方法は、レンチウイルス媒介性形容変を用いて、膀胱癌の発症の分子基盤を研究するためのモデルシステムを開発する方法を示している。また、オルガノイドを結体的に膀胱に移植して膀胱癌における在来膀胱環境の役割を調べる方法が記載されている。
プロトコル
すべての手続きは、POSTECHの機関動物管理および使用委員会のガイドラインの下で承認され、実施されました(IACUC番号:POSTECH-2019-0055)。
1. 膀胱腫瘍オルガノイドのインビトロ培養
- マウス膀胱腫瘍から膀胱腫瘍オルガノイドを確立する (図1A).
注:BBN誘発マウス膀胱腫瘍を発生させる手順は、Shinらalに概説されている。17.- 暗いボトルに0.1%BBN含有水をマウスのアドリビタムに6ヶ月間提供する。BBN含有水を週2倍に変更します。
注:体重が約25gのC57BL/6雄マウスを8~10週齢で使用しました。BBN含有水は、単一のケージ内に最大5匹のマウスを投与することができる。 - 6ヶ月後、二酸化炭素吸入を用いてマウスを安楽死させ、膀胱腫瘍全体を単離した。90mmのペトリ皿に移します。
- 無菌手術用はさみを使用して非癌部分および壊死領域を除去し、冷たい1x Dulbeccoのリン酸緩衝生理食塩水(DPBS)で膀胱腫瘍断片を2〜3回洗浄する。断片を収集し、新しい90ミリメートルペトリ皿にそれらを転送します。
- 10 mM 4-(2-ヒドロキセチル)-1-ピペラジンエタンスルホン酸(HEPES)で、ダルベッコの修正最小必須培地(DMEM)の1 mLを加えます。
- 殺菌されたカミソリの刃を使用して、腫瘍組織をできるだけ小さく(0.5〜1 mm3)小さく刻みます。
- 10 mM HEPES、250 μg/mL コラゲアーゼタイプI、250 μg/mLコラゲアーゼタイプII、および250 U/mL熱分解器を使用して、DMEMの9 mLを添加します。インキュベーターの軌道シェーカー(37°C、5%CO2)で1.5~2時間の腫瘍組織をインキュベートし、断片を細胞懸濁液に解き出します。細胞懸濁液を50mLチューブに移します。
注:マウスから採取した腫瘍のサイズが1cm3より大きい場合は、熱量の2倍で治療するか、潜伏時間を増やしてください。 - チューブを4°Cで5分間400xgで遠心分離し、上清を吸引します。
- 5 mLのアンモニウム塩化カリウム(ACK)を用いてペレットを再懸濁し、赤血球をリセリングする。赤血球の完全なリシスまで、室温(RT)で3〜5分間チューブをインキュベートします。
注:赤血球が観察されない場合は、ライジングプロセスを省略してください。 - チューブに20 mLのDMEMを加えます。チューブを4°Cで5分間400xgで遠心分離し、上清を吸引します。
- 1 mL 0.25% トリプシン EDTA および 10 μM Y-27632 ジヒドロクロリド (Y-27632) でペレットを再懸濁し、ペレットを単一細胞に解化します。37 °Cの水浴でチューブを5分間インキュベートします。
注:顕微鏡下で腫瘍を観察し、単一細胞への完全な解離を確認してください。細胞の塊が持続する場合は、さらに懸濁液をピペットします。 - 10%のウシ胎児血清(FBS)で10 mLのDMEMを用いてトリプシンを中和する。新しい50 mLチューブで100μmの細胞ストレーナーを通して細胞懸濁液をろ過し、未消化の破片を除去します。
- チューブを4°Cで5分間400xgで遠心分離し、上清を吸引します。
- 150 μLの氷冷成長因子を用いて24ウェルプレートにウェルをコーティングし、基細胞膜マトリックス(材料表)をインキュベーター(37°C、5%CO2)に24ウェルプレートを30分間インキュベーター(37°C、5%CO2)で配置し、基材マトリックスを固めます。
注:使用前に凝固を防ぐために、基調膜マトリックスを4°Cで解凍して維持してください。 - 1 mLのDMEMを用いてペレットを再懸濁し、ヘモサイトメーターを用いて細胞をカウントする。3~4 x 104個の腫瘍細胞を氷上の1.5mLマイクロチューブに移します。
- マイクロチューブを4°Cで3分間400×gで遠心分離し、慎重に上清を捨てます。
- 500 μLの前温型オルガノイド培地(表1)および10μM Y-27632で細胞を再懸濁し、コーティングしたウェルに移します。24ウェルプレートをインキュベーター(37°C、5%CO2)に入れる。
- 余分な膀胱腫瘍細胞は、10%FBS、1%ペニシリン/ストレプトマイシン、および10%ジメチルスルホキシド(DMSO)を1.5 mL凍結で含むDMEMの1 mLをストックすることができます。凍結凍結容器に入れ、容器を-80°Cの冷凍庫に移します。冷凍庫に一晩保管した後、凍結液を液体窒素に移し、長期保存する。
- 500 μLのプレウォートオルガノイド培地を使用して、2日ごとに培地を交換します(図1B)。
- 暗いボトルに0.1%BBN含有水をマウスのアドリビタムに6ヶ月間提供する。BBN含有水を週2倍に変更します。
- サブカルチャー膀胱腫瘍オルガノイド。
注:膀胱腫瘍オルガノイドが直径100〜150μmに達したときの通過が推奨されます。- 腫瘍オルガノイドを備えた24ウェルプレートのオルガノイド培地に500μLのコラゲアーゼ/ジスパーゼを加える。基下膜マトリックスおよび媒体の上と下にピペット。37°Cで20分間インキュベートし、細胞を15mLチューブに収穫した。
注:基細胞膜マトリックスから分離されたオルガノイドを顕微鏡で調べます。オルガノイドが基細胞膜マトリックスから切り離されない場合、インキュベーション時間またはピペットを複数回増加させる。 - 5 mLのプレウォーマードDMEMを加え、チューブを4°Cで3分間400 x gで遠心分離し、上清を吸引します。
- プレウォート0.25%トリプシン-EDTAおよび10 μM Y-27632の1 mLを使用してペレットを再懸濁します。37 °Cの水浴で5分間インキュベートします。細胞を上下に激しくピペットし、10%FBSで5 mLのDMEMを使用してトリプシンを中和します。
- 4°Cで3分間400xgでチューブを遠心分離し、上清を吸引します。
- プレウォートされたオルガノイド培地の1 mLを用いてペレットを再懸濁し、単一腫瘍細胞の数をカウントする。
- 手順 1.1.14-1.18 を繰り返します。
- 腫瘍オルガノイドを備えた24ウェルプレートのオルガノイド培地に500μLのコラゲアーゼ/ジスパーゼを加える。基下膜マトリックスおよび媒体の上と下にピペット。37°Cで20分間インキュベートし、細胞を15mLチューブに収穫した。
2. レンチウイルス媒介性トランスダクションを用いた膀胱腫瘍オルガノイドの遺伝子操作 (図 2A)
- GFP発現レンチウイルス粒子を生成する。
- 0日目、細胞系培養培地(すなわち、10%FBSおよび1%ペニシリン/ストレプトマイシンを有するDMEM)における10cm細胞培養プレートあたり5〜6 x106細胞の密度でプレートHEK 293T細胞。
- 1日目に、GFP(8μg)を含むトランスファープラスミドを含むDNAトランスフェクション液を調製し、レンチウイルス包装プラスミド(pCMVR8.74および3μgのpMD2.Gの10μg)、および1mLの還元血清培地(材料表)を調製した。
- 製造業者の指示に従って総プラスミドの1μgあたりトランスフェクション試薬(材料表)の3 μLを加え、ピペットで穏やかに混ぜます。RTで20分間インキュベートし、10%FBSで9 mLのDMEMを加えます。
- HEK 293T細胞を用いて培養液を細胞培養板に吸引する。10 mLのDNAトランスフェクション溶液をHEK 293T細胞に慎重に移し、37°Cで培養培養器内にインキュベートする。
- 3日目に、蛍光顕微鏡下で細胞を観察し(488nmで励起し、512nmで発光)、トランスフェクション効率を決定した。細胞集団全体の細胞の約90%~100%がGFPを発現する必要があります。
- 上清(ウイルスを含む)を集め、0.45 μmのポリエーテルスルホン(PES)フィルターで上清を濾過します。
注:PESフィルターなどの低タンパク質結合フィルタを使用してください。 - ウイルスを濃縮するには、振動バケットローター(材料表)で4°Cで2時間超遠心分離機で98,768 x gでウイルス上清を遠心分離し、慎重に上清を捨てます。
- 2.5 mLの冷たいオルガノイド培地でペレットを再懸濁する。
- 長期保存のために、250μLのレンチウイルス培地を極低温バイアルにアリコートし、液体窒素を用いてスナップ凍結する。冷凍ウイルスストックを-80°Cの冷凍庫に保管します。
- 膀胱腫瘍オルガノイドのレンチウイルス媒介性伝達を行う。
- 2日目に、上記のように腫瘍オルガノイドを分割する(ステップ1.2)レンチウイルス媒介性形容への12時間。
- 3日目、37°Cの水浴にウイルスを含むアリコート(ステップ2.1.9)を素早く解凍し、10 μM Y-27632と8 μg/mLヘキサジメトリンブロマイドを含む250μLのオルガノイド培地を加えます。
- 24ウェルプレートのオルガノイド培地をウイルス含有培地の500μLずつ腫瘍オルガノイドで交換し、インキュベーターで12〜16時間インキュベートします(37°C、5%CO2)。
- 4日目に、500μLの新鮮なオルガノイド培地で培地を交換します。
注:12〜16時間のインキュベーション後、レンチウイルスとヘキサジメトリンブロマイドを含む培地は細胞毒性であるため、培地を交換する必要があります。 - 6日目に、蛍光顕微鏡下での転写3日後の腫瘍オルガノイドからのGFPシグナルをモニタリングする(図2B)。
- 10日目、ステップ1.2で説明した通り、転写7日後にオルガノイドを入れ、遺伝子組換え腫瘍オルガノイドラインを維持する。
3. 膀胱オルガノイドの正体移植 (図3A)
- 正所移植のために膀胱腫瘍オルガノイドを準備する。
- 移植前に、膀胱腫瘍オルガノイドを5~7日間培養し、上記のように(ステップ1.2)。
- 腫瘍オルガノイドを含む24ウェルプレートのオルガノイド培地にコラゲアーゼ/ジスパーゼを500μL加える。基細胞膜マトリックスおよび媒体の上と下にピペット。37°Cで20分間インキュベートし、細胞を15mLチューブに集めます。
- 5 mLのプレウォーマードDMEMを加え、チューブを4°Cで3分間400 x gで遠心分離し、上清を吸引します。
- 1 mLのDMEMでペレットを再懸濁し、溶液を90mmのペトリ皿に移します。
- 顕微鏡の下で、p200マイクロピペットを使用して10~100個の腫瘍オルガノイドを拾い上げ、氷上のマイクロチューブに集めます。
- チューブを4°Cで3分間400xgで遠心分離し、慎重に上清を捨てます。
- マウスが手術の準備ができるまで、細胞ペレットを氷上に保持します。
- 粘膜下膀胱壁移植
注 : この手順は、Fu ら18によって公開されたプロトコルから変更されます。- 実験の少なくとも1週間前に生後8~10週の男性ヌードマウス(CAnN.Cg-Foxn1nu/Crl)を準備し、新しい環境に順応できるようにします。手術前に皮下24時間にエンロフロキサシン(5mg/kg)を注入する。
- 石鹸と水でベンチの表面をきれいにします。手術手順の前に手術器具をオートクレーブし、無菌器具を使用して手術を行います。
- 29Gインスリンシリンジ、ピペットチップ、基細胞膜マトリックスを氷上に置きます。麻酔の投与前にケトプロフェン(5mg/kg)を皮下に投与する。
- 誘導チャンバー内の4%イソファフルランでマウスを麻酔する。全身麻酔が達成されたら、マウスを仰向けの位置に置き、2%の気化イセフルランのマスク吸入によって麻酔を維持する。
注:麻酔時間が30分を超える場合は、角膜乾燥を避けるために綿棒を使用して両目に目軟膏を塗布してください。 - 滅菌ガーゼでポビドネヨウ素を塗布し、70%エタノールで拭き取ります。毎回新しいガーゼまたは綿棒で3倍を繰り返します。
- 使い捨て、無菌外科用ドレープを使用して、ANUSと手術フィールドをカバーします。
- 拡大のために解剖顕微鏡を使用して、無菌手術用はさみで下中線下腹部の皮膚および筋肉壁に小さな横切開部(1.5cm未満)を作る。腹腔から膀胱を露出させ、生理痛に浸した綿棒で支えます。
注:膀胱が尿でいっぱいなら、軽く膀胱を押して少し解凍してください。 - 50%高濃度基底膜マトリックス(表表)を含むオルガノイド培地の80μLでオルガノイドペレット(ステップ3.1.7)を再懸濁する。
- 解剖顕微鏡下で29Gインスリン注射器を用いて膀胱ドームの前部側面にオルガノイド懸濁液を注入する。
- 抗菌吸収性縫合糸で腹壁の内層を閉じ、4-0ナイロン縫合で外層を閉じます。ポビドネヨウ素と70%エタノールで手術部位を消毒する。
- マウスが赤外線照射器の下で10〜15分回復することを許可します。
- 手術後のある日、マウスの全身状態と解剖漏れを確認します。ケトプロフェン(5 mg/kg)を手術後3日間毎日1回投与し、手術後10日間、1日1回エンロフロキサシン(5mg/kg)を治療する。
- 切開部位が治癒した場合(手術後10〜14日)、縫合糸を取り除く。腫瘍オルガノイド注射後2~3週間、マウス膀胱腫瘍の成長をモニターする。
- 膀胱腫瘍の増殖が観察される場合、二酸化炭素吸入を用いてマウスを安楽死させ、膀胱腫瘍全体を収穫する。冷たい DPBS (図 3B)16を使用して洗浄します。
- 膀胱腫瘍組織学を解析するために、ヘマトキシリンおよびエオシン(HおよびE)染色を用いて組織のパラフィン包埋部を染色する(図3B)16)。
結果
マウス膀胱腫瘍オルガノイドの体外培養
〜1cm3 BBN誘導腫瘍から解離した腫瘍細胞の数は、少なくとも4x105細胞である。細胞が最初に基細胞膜マトリックスに播種されると、非癌細胞および破片が観察され得る。残骸は、サブカルチャーを継続することによって徐々に希釈された。図1Bは、異なる時点における培養オルガノイドの画像を示す。腫瘍細胞が腫瘍オルガノイドを形成しない場合、解離段階で細胞が死んでしまう可能性がある。このような場合、酵素とのインキュベーション時間を含む解離手順は、細胞生存率を高めるために調整する必要がある。
レンチウイルス媒介遺伝子操作を用いた膀胱腫瘍オルガノイドにおけるGFPの発現
膀胱腫瘍オルガノイドは、レンチウイルス感染に成功した強力なGFPシグナルを示した(図2B)。濃度の後、合計250 μLのウイルス含有培地は、基細胞膜マトリックス上の3 x 104つの腫瘍細胞に感染するのに十分であり、90%〜100%の感染効率を維持した。GFPシグナルは、レンチウイルス形容導入の3日後に膀胱腫瘍オルガノイドから検出できた。蛍光シグナルが低い場合、ウイルス感染の効率は潜在的に低い。これは、低ウイルス価など、多くの要因が原因であり、それに応じて手順を調整する必要があります。
膀胱腫瘍オルガノイドの正体移植
BBN誘発膀胱腫瘍オルガノイドから得られた膀胱腫瘍同種移植片を図3B16に提示する。膀胱腫瘍同種移植片は、正所移植の3週間後に収穫した。移植した膀胱腫瘍の組織学を、H染色およびE染色を用いて分析した。腫瘍オルガノイドの正体移植は、膀胱腫瘍として2~3週間成長する可能性がある。

図1:マウス膀胱腫瘍オルガノイドのインビトロ培養。(A) マウス膀胱腫瘍オルガノイドの確立のための模式図。(B) 異なる時点における膀胱腫瘍オルガノイドの培養のための代表的な画像。マウス膀胱腫瘍オルガノイドを樹立し、9日間にわたって培養した。スケールバー = 100 μm.この図の大きいバージョンを表示するにはここをクリックしてください。
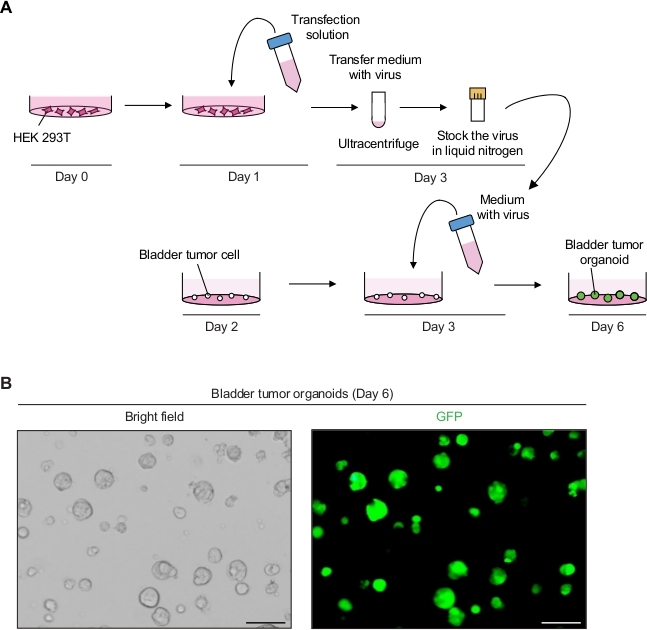
図2:レンチウイルス媒介遺伝子操作を用いた膀胱腫瘍オルガノイドにおけるGFPの発現(A)膀胱腫瘍オルガノイドのレンチウイルストランスフェクションおよびトランスダクションの概略図。(B) GFPを発現する膀胱腫瘍オルガノイドの代表的な画像。スケールバー = 100 μm.この図の大きいバージョンを表示するにはここをクリックしてください。

図3:膀胱腫瘍オルガノイドの正体移植(A) ヌードマウスに対する膀胱腫瘍オルガノイドの正体移植の概略図(B) 膀胱腫瘍オルガノイドを移植したマウスからの膀胱およびHおよびE染色片の代表的な画像。中央のパネルのボックス化された領域の拡大表示が左側のパネルに表示されます。スケールバー = 500 μmこの図は、図1-図サプリメント1、キムら16、クリエイティブ・コモンズ・アトリビューション4.0国際公共ライセンス(CC BY 4.0;https://creativecommons.org/licenses/by/4.0/)の下で公開された図から再現されました。この図の大きなバージョンを表示するには、ここをクリックしてください。
| マウス膀胱腫瘍オルガノイド培地 | |
| アドバンスドDMEM/F-12(ベーシックメディア) | 10 mM HEPES(pH 7.4) |
| 10 mM ニコチンアミド | 0.5x 無血清サプリメント |
| 2 mM L-アラニル-L-グルタミンジペプチド | 1% ペニシリン/ストレプトマイシン |
| 1 mM N-アセチル-L-システイン | 50 ng/mL マウス表皮成長因子 |
| 1 μM A 83-01 | |
表1:膀胱腫瘍オルガノイド培地の組成。
ディスカッション
このプロトコルは、発癌性腫瘍誘発性マウス膀胱腫瘍に由来する膀胱腫瘍オルガノイドを培養および維持するための実験的手順を記述する。
このプロトコルでは、いくつかの手順でトラブルシューティングが必要ないくつかの実験的な手順があります。まず、最初に播種される腫瘍細胞の数は、培養中の腫瘍細胞の数が少ないため(<2 x 104細胞)、腫瘍細胞間の相互作用の欠如のために細胞死を引き起こします。対照的に、播種時にあまりにも多くの細胞(>5 x 104細胞)から始まり、過剰なオルガノイドを引き起こし、各オルガノイドの生育不良の培養を扱う際に困難が生じる。実験条件を最適化するために、細胞数が異なる複数のプレートを最初に確立することが強く示唆されている。初期腫瘍細胞の適切な数を特定することは、最高の細胞生存率を達成し、成功した膀胱腫瘍オルガノイドを確立するために重要です。また、2週間以上の長期培養では、ほとんどの腫瘍オルガノイドは成長を止め、オルガノイドの中心にある栄養素の供給が不十分であり、基細胞膜マトリックスにおける成長因子の枯渇に起因する可能性がある。したがって、オルガノイドを適時に覆い、腫瘍オルガノイド培養を維持する重要なステップとなる。
第二に、高刺激レンチウイルス粒子の産生は、腫瘍オルガノイドの効率的な遺伝子操作に不可欠である。ウイルスの反復子関連の問題をトラブルシューティングするために、レンチウイルス構築物は様々な効率でウイルス粒子を産生する傾向があるため、ウイルスの誘導前にウイルスの反復物を毎回決定することが強く示唆されている。腫瘍オルガノイドがウイルス感染後に生存率が低い場合、ウイルス力価が高すぎる可能性がある。この場合、ウイルスの量を減らすと強く推奨されます。第3に、BBN誘発膀胱腫瘍オルガノイドの正体移植の際に、膀胱壁の完全性を維持することが重要である。注射が膀胱壁層を貫通して膀胱の内腔に達した場合、実験は終了し、廃棄されるべきである。可能であれば、超音波画像システムを用いた膀胱腫瘍増殖のモニタリングが推奨される。
現在の技術の1つの制限は、これらのオルガノイドにおける腫瘍微小環境または間質の欠如である。この問題を克服するために、腫瘍オルガノイドの正体移植は、インビボシステムを用い、ネイティブの腫瘍微小環境を模倣することが強く示唆されている。今後は、腫瘍間質の他の成分を有する腫瘍オルガノイドから構成される3D in vitroオルガノイド系を開発する必要があります。
我々の技術の主な意味の1つは、腫瘍オルガノイドの正体移植において、膀胱内の腫瘍増殖を誘導できるのは10個の膀胱腫瘍オルガノイドだけである。5 x 105–1 x 106単一膀胱腫瘍細胞を必要とする従来の腫瘍移植実験と比較して、我々の方法ははるかに効率的で堅牢です。もう一つの大きな違いは、オルガノイドは、短いヘアピンRNA、CRISPR-Cas9系、または関心のある遺伝子を含むレンチウイルス構造など、様々なレンチウイルスベクターを使用して多様に操作できることです。これらは、現在のオルガノイド技術に追加する強力なツールになります。全体として、ここで提示された実験的アプローチは、2D膀胱癌細胞株を使用するのではなく、膀胱癌の病因に関する理解を向上させることができるインビトロ腫瘍モデルの確立を促進することができる。
この方法は、発癌性物質誘発性マウス膀胱腫瘍に由来する膀胱腫瘍オルガノイドを確立することができた。この記事では、遺伝子組み換えが導入され、膀胱腫瘍オルガノイドで安定に維持されるレンチウイルス媒介実験手順の説明を提供する。また、腫瘍オルガノイドの正体移植の手順も含まれる。現在の生体内癌モデルと組み合わせて、この技術は膀胱腫瘍形成の分子基盤を研究するのに有用なツールとなるであろう。
開示事項
著者らは、競合する財政的利益を宣言していない。
謝辞
この研究は、韓国国立研究財団からK.S.への助成金によって支えられました:NRF-2017R1A2B4006043、NRF-2017M3C7A1047875、NRF-2017R1A5A101010101066、クリエイティブエコノミーリーディング技術開発プログラム(SF31701A)、および2018年BK21プラスリサーチフェローシップ。
資料
| Name | Company | Catalog Number | Comments |
| 0.45 µm syringe filter (PES membrane) | Millipore | SLHP033RS | |
| 10 cm culture plate | Eppendorf | 0030-702-115 | |
| 90 mm Petri dish | SPL | 10090 | |
| 100 µm cell strainer | Corning | 352360 | |
| 15 mL conical tube | SPL | 50015 | |
| 24-well plate | Corning | 3526 | |
| 29 G 1/2 insulin syringe | SHINA | B299473538 | |
| 3 mL syringe | Norm-ject | N7.A03 | |
| 50 mL conical tube | SPL | 50050 | |
| A8301 | Tocris | 2939 | stock concentration: 25 mM |
| Absolute ethanol | Daejung | 4023-2304 | |
| Absorbable suture | Henry Schein | 039010 | |
| Advanced DMEM/F-12 | Thermo | 12634028 | |
| Ammonium-chloride-potassium (ACK) lysing buffer | Thermo | A1049201 | |
| B-27 | Gibco | 17504-044 | stock concentration: 50X |
| BBN(N-butyl-N-(4-hydroxybutyl) nitrosamine) | Tokyo Chemical Industry | B0938 | |
| Blue nylon 5/0-13mm | AILEE | NB521 | |
| C57BL Mouse | The Jackson Laboratory | 000664 | |
| CAnN.Cg-Foxn1nu/Crl (nude mouse) | Charles River | 194 | |
| Collagenase type I | Thermo | 17100017 | stock concentration: 20 mg/mL |
| Collagenase type II | Thermo | 17100015 | stock concentration: 20 mg/mL |
| Collagenase/dispase | Sigma | 10269638001 | stock concentration: 1 mg/mL |
| Cyrovial | Corning | 430488 | |
| DMEM(Dulbecco's modified minimum essential media) | Gibco | 11965-118 | |
| DMSO(Dimethyl sulfoxide) | Sigma | D8418 | |
| DPBS(Dulbecco's phosphate-buffered saline) | Welgene | LB 001-02 | |
| Enrofloxacin (Baytril) | Bayer Healthcare | DIN: 02169428 | |
| FBS(Fetal bovine serum) | Millipore | ES009B-KC | |
| Glutamax | Gibco | 35050061 | 100X |
| HEK 293T | ATCC | CRL-11268 | |
| HEPES(4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid) | Welgene | BB001-01 | |
| Isoflurane | Hana Pharm Co., Ltd. | ||
| Ketoprofen (Anafen) | Merial | DIN: 02150999 | |
| Matrigel growth factor reduced (GFR) Growth Factor Reduced (GFR) | Corning | 354230 | use for organoid culture in plate |
| Matrigel high concentration (HC) | Corning | 354248 | use for organoid transplantation |
| 1.5 mL microtube | Axygen | MCT-150-C | |
| LT1 transfection reagent | Mirus Bio | MIR 2300 | |
| murine EGF(epidermal growth factor) | Peprotech | 315-09 | stock concentration: 100 µg/mL |
| N-acetyl-L-cysteine | Sigma | A9165 | stock concentration: 200 mM |
| Nicotinamide | Sigma | N0636 | stock concentration: 1M |
| Opti-MEM | Gibco | 31985070 | |
| pCMV.R 8.74 | Addgene | 22036 | Packaging plasmid |
| Penicillin/streptomycin | Gibco | 15140122 | 100X |
| pMD2.G | Addgene | 12259 | Envelope plasmid |
| Polybrene(hexadim ethrine bromide) | Sigma | H9286 | stock concentration: 2 µg/mL |
| pSiCoR | Addgene | 11579 | Lentiviral plasmid |
| Razor blade | |||
| Saline buffer | JW Pharmaceutical | ||
| SW41Ti swinging bucket rotor | Beckman Coulter | ||
| Thermolysin, Bacillus thermoproteolyticus | Millipore | 58656-2500KUCN | stock concentration: 250 KU/mL |
| Trypsin-EDTA (0.25%) | Gibco | 25200072 | |
| Ultracentrifugation tube | Beckman Coulter | 331372 | |
| Y-27632 dihydrochloride | Abmole | M1817 | stock concentration: 10 mM |
参考文献
- Sanli, O., et al. Bladder cancer. Nature Reviews Disease Primers. 3, 17022 (2017).
- Stenzl, A., et al. Treatment of muscle-invasive and metastatic bladder cancer: update of the EAU guidelines. European Urology. 59 (6), 1009-1018 (2011).
- Barretina, J., et al. The Cancer Cell Line Encyclopedia enables predictive modelling of anticancer drug sensitivity. Nature. 483 (7391), 603 (2012).
- Caponigro, G., Sellers, W. R. Advances in the preclinical testing of cancer therapeutic hypotheses. Nature Reviews Drug Discovery. 10 (3), 179 (2011).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407 (2018).
- Fatehullah, A., Tan, S. H., Barker, N. Organoids as an in vitro model of human development and disease. Nature Cell Biology. 18 (3), 246 (2016).
- Pauli, C., et al. Personalized in vitro and in vivo cancer models to guide precision medicine. Cancer discovery. 7 (5), 462-477 (2017).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- van de Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Lee, S. H., et al. Tumor evolution and drug response in patient-derived organoid models of bladder cancer. Cell. 173 (2), 515-517 (2018).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Huang, L., et al. Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell-and patient-derived tumor organoids. Nature Medicine. 21 (11), 1364 (2015).
- Gao, D., et al. Organoid cultures derived from patients with advanced prostate cancer. Cell. 159 (1), 176-187 (2014).
- Broutier, L., et al. Human primary liver cancer–derived organoid cultures for disease modeling and drug screening. Nature Medicine. 23 (12), 1424 (2017).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Kim, S., et al. Epigenetic regulation of mammalian Hedgehog signaling to the stroma determines the molecular subtype of bladder cancer. eLife. 8, 43024 (2019).
- Shin, K., et al. Cellular origin of bladder neoplasia and tissue dynamics of its progression to invasive carcinoma. Nature Cell Biology. 16 (5), 469 (2014).
- Fu, C. L., Apelo, C. A., Torres, B., Thai, K. H., Hsieh, M. H. Mouse bladder wall injection. JoVE (Journal of Visualized Experiments). (53), e2523 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved