Method Article
Cultura, Manipulação e Transplante Ortotópico de Organoides tumorais da bexiga de camundongo
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo fornece medidas experimentais detalhadas para estabelecer uma cultura in vitro tridimensional de organoides tumorais da bexiga derivados do câncer de bexiga induzido pelo cancerígeno. Métodos culturais, incluindo passaging, engenharia genética e transplante ortotópico de organoides tumorais são descritos.
Resumo
O desenvolvimento de modelos tumorais avançados tem sido há muito incentivado porque os modelos atuais de câncer têm mostrado limitações como a falta de arquitetura tumoral tridimensional (3D) e baixa relevância para o câncer humano. Pesquisadores desenvolveram recentemente um modelo de câncer in vitro 3D referido como organoides tumorais que podem imitar as características de um tumor nativo em um prato cultural. Aqui, os procedimentos experimentais são descritos em detalhes para o estabelecimento de organoides tumorais da bexiga a partir de um tumor de bexiga de murina induzido pelo cancerígeno, incluindo cultura, passagem e manutenção dos organoides tumorais 3D resultantes in vitro. Além disso, são descritos protocolos para manipular as linhas organoides estabelecidas do tumor da bexiga para engenharia genética usando transdução mediada por lentivírus, incluindo condições otimizadas para a introdução eficiente de novos elementos genéticos no tumor organoides. Finalmente, o procedimento para transplante ortotópico de organoides tumorais da bexiga na parede da bexiga murina para análise posterior é definido. Os métodos descritos neste artigo podem facilitar o estabelecimento de um modelo in vitro para câncer de bexiga para o desenvolvimento de melhores opções terapêuticas.
Introdução
O câncer de bexiga é o câncer de trato urinário mais prevalente, com aproximadamente 165.000 pacientes morrendo anualmente1. Entre os vários tipos de câncer de bexiga, o carcinoma urotelolial invasivo por músculos apresenta um fenótipo agressivo, e sua taxa de sobrevivência de 5 anos é inferior a 50%2. Novas opções terapêuticas para tumores uroteliais invasivos não foram expandidas nas últimas décadas1.
As linhas de células cancerígenas têm sido amplamente usadas para o rastreamento de medicamentos3. Embora os resultados favoráveis tenham sido observados em numerosos candidatos a medicamentos em linhas de células cancerosas, resultados ruins são relatados em ensaios clínicos4. Após o aumento da adaptação a ambientes culturais bidimensionais in vitro (2D), tornou-se cada vez mais difícil recapitular tumores nativos em linhas celulares. Modelos de câncer animal ou xenoenxertos tumorais derivados do paciente podem ser usados para lidar com as limitações observadas nas linhas celulares cancerosos da bexiga. No entanto, os modelos de câncer animal são intensivos em tempo e recursos. Portanto, os modelos de doenças melhorados estão demanda há anos e um novo sistema modelo, organoides, foi desenvolvido para superar as deficiências dos modelos5existentes.
Um organoide é uma construção 3D multicelular que pode recapitular in vitro as características fisiológicas de seu órgão in vivo correspondente. Os organoides normais e tumorais podem ser derivados de células-tronco pluripotentes ou adultas, e células tumorais primárias, respectivamente5,6. Nos últimos anos, os organoides tumorais foram estabelecidos a partir de um grande número de diversos tecidos tumorais7, incluindo cólon8,9, bexiga10,pâncreas11,12, próstata13, fígado14, e tecido tumoral de15 mamas. Tais organoides tumorais imitam seus tumores originais fenotipicamente e geneticamente. Devido à sua semelhança com os tecidos tumorais vivos e suas inúmeras aplicações práticas, os pesquisadores os adotaram como novos modelos de doençano estudo da patogense do câncer.
Aqui, estão estabelecidos os procedimentos para o estabelecimento de organoides tumorais a partir de um tumor urotellial invasivo induzido por cancerígeno16. A nitrosamina n-butil-N-(4-hidroxibutyl) é usada como cancerígeno para induzir o carcinoma urotelial invasivo em camundongos17 e os organoides tumorais, que apresentam as características patológicas dos tumores de bexiga invasivos por ratos, são estabelecidos a partir do câncer de bexiga murina induzido pelo BBN16. O método para manipular geneticamente os organoides tumorais é ilustrado usando transdução mediada por lentivírus para desenvolver um sistema modelo para estudar a base molecular do desenvolvimento do câncer de bexiga. Além disso, é descrito um método de transplante de organoides ortotópico em uma bexiga para investigar o papel do ambiente nativo da bexiga no câncer de bexiga.
Protocolo
Todos os procedimentos foram aprovados e conduzidos as diretrizes do Comitê Institucional de Cuidados e Uso de Animais do POSTECH (número do IACUC: POSTECH-2019-0055).
1. Cultura In Vitro de Organoides tumorais da bexiga
- Estabelecer organoides tumorais da bexiga a partir do tumor da bexiga murina (Figura 1Um).
NOTA: O procedimento para gerar tumores de bexiga de camundongo induzidos por BBN é delineado em Shin et al.17.- Forneça 0,1% de água contendo BBN em uma garrafa escura para o ad libitum do mouse por 6 meses. Troque a água contendo BBN 2x por semana.
NOTA: Foi utilizado um rato macho C57BL/6 com peso corporal de aproximadamente 25 g aos 8 e 10 semanas de idade. A água contendo BBN pode ser administrada até cinco ratos em uma única gaiola. - Após 6 meses, eutanize o camundongo usando inalação de dióxido de carbono e isole todo o tumor da bexiga. Transfira para uma placa de Petri de 90 mm.
- Remova partes não cancerígenas e regiões necróticas usando tesouras cirúrgicas estéreis e lave os fragmentos do tumor da bexiga 2-3 vezes com o sorolo tampão de fosfato (DPBS) de 1x Dulbecco frio. Pegue os fragmentos e transfira-os para uma nova placa de Petri de 90 mm.
- Adicione 1 mL do meio mínimo essencial modificado de Dulbecco (DMEM) com 10 mM 4-(2-hidroxyethyl)-1-piperazineethanesulfonic (HEPES).
- Pique o tecido tumoral em pedaços o menor possível (0,5-1 mm3) usando uma lâmina de barbear esterilizada.
- Adicione 9 mL de DMEM com HEPES de 10 mM, 250 μg/mL coloagenase tipo I, 250 μg/mL coloagenase tipo II, e 250 Termollysin U/mL. Incubar o tecido tumoral picado por 1,5-2 h em um agitador orbital em uma incubadora (37 °C, 5% CO2) para dissociar os fragmentos na suspensão celular. Transfira a suspensão da célula para um tubo de 50 mL.
NOTA: Se o tamanho do tumor colhido do camundongo for superior a 1 cm3,trate-o com 2x a quantidade de termolysina ou aumente o tempo de incubação. - Centrífuga o tubo a 400 x g por 5 min a 4 °C e aspirar o supernatante.
- Resuspender a pelota usando 5 mL de tampão de lysing de amônio-cloreto-potássio (ACK) para lyse quaisquer glóbulos vermelhos. Incubar o tubo por 3-5 min à temperatura ambiente (RT) até a lise completa dos glóbulos vermelhos.
NOTA: Se os glóbulos vermelhos não forem observados, omita o processo de lising. - Adicione 20 mL de DMEM no tubo. Centrífuga o tubo a 400 x g por 5 min a 4 °C e aspirar o supernatante.
- Suspenda novamente a pelota com 1 mL de 0,25% Trypsin-EDTA e 10 μM Y-27632 dicloridor (Y-27632) para dissociar a pelota em células únicas. Incubar o tubo por 5 min em um banho de água de 37 °C.
NOTA: Observe o tumor um microscópio para confirmar a dissociação completa em células únicas. Se pedaços de células persistirem, pipeta a suspensão ainda mais. - Neutralizar a trippsina utilizando 10 mL de DMEM com soro bovino 10% fetal (FBS). Filtrar a suspensão da célula através de um filtro de célula de 100 μm em um novo tubo de 50 mL para remover os detritos não digeridos.
- Centrífuga o tubo a 400 x g por 5 min a 4 °C e aspirar o supernatante.
- Cubra um poço em uma placa de 24 poços usando 150 μL de fator de crescimento frio reduzido matriz de membrana do porão (Tabela de Materiais) e coloque a placa de poço 24 em uma incubadora (37 °C, 5% CO2) por 30 min para solidificar a matriz de membrana do porão.
NOTA: Descongele e mantenha a matriz de membrana do porão a 4 °C para evitar solidificação antes do uso. - Resuspender a pelota usando 1 mL de DMEM e conte as células usando um hemocímetro. Transfira 3-4 x 104 células tumorais em um microtubo de 1,5 mL no gelo.
- Centrífuga o microtubo a 400 x g por 3 min a 4 °C e descarte cuidadosamente o supernatante.
- Resuspender as células com 500 μL de meio organoide pré-aquecido(Tabela 1) e 10 μM Y-27632 e transferi-las para o poço revestido. Coloque a placa de 24 poços em uma incubadora (37 °C, 5% CO2).
- As células tumorais extras da bexiga podem ser estocados com 1 mL de DMEM contendo 10% de FBS, 1% penicilina/estreptomiacina e 10% sulfoxida de dimetila (DMSO) em crioviais de 1,5 mL. Coloque-os em um recipiente de congelamento criovial e transfira o recipiente para um freezer de -80 °C. Depois de armazenar no congelador durante a noite, transfira os crioviais para nitrogênio líquido para armazenamento a longo prazo.
- Altere o meio a cada 2 dias usando 500 μL de meio organoide pré-aquecido(Figura 1B).
- Forneça 0,1% de água contendo BBN em uma garrafa escura para o ad libitum do mouse por 6 meses. Troque a água contendo BBN 2x por semana.
- Organoides tumorais de bexiga subcultura.
NOTA: Recomenda-se a passagem de organoides tumorais da bexiga quando atingirem 100-150 μm de diâmetro.- Adicione 500 μL de colagenase/dispase ao meio organoide na placa de 24 poços com organoides tumorais. Pipette para cima e para baixo a matriz de membrana do porão e o meio. Incubar por 20 min a 37 °C e colher as células em um tubo de 15 mL.
NOTA: Examine os organoides isolados da matriz de membrana do porão um microscópio. Se os organoides não forem separados da matriz da membrana do porão, aumente o tempo de incubação ou pipeta mais vezes. - Adicione 5 mL de DMEM pré-aquecido, centrífuga o tubo a 400 x g por 3 min a 4 °C, e aspirar o supernatante.
- Resuspender a pelota usando 1 mL de pré-aquecido 0,25% trypsin-EDTA e 10 μM Y-27632. Incubar por 5 min em um banho de água de 37 °C. Vigorosamente pipette as células para cima e para baixo e neutralizar a trippsina usando 5 mL de DMEM com 10% FBS.
- Centrífuga o tubo a 400 x g por 3 min a 4 °C e aspirar o supernatante.
- Resuspender a pelota usando 1 mL de meio organoide pré-aquecido e conte o número de células tumorais únicas.
- Repita as etapas 1.1.14-1.1.18.
- Adicione 500 μL de colagenase/dispase ao meio organoide na placa de 24 poços com organoides tumorais. Pipette para cima e para baixo a matriz de membrana do porão e o meio. Incubar por 20 min a 37 °C e colher as células em um tubo de 15 mL.
2. Manipulação Genética de Organoides tumorais da bexiga usando transdução mediada por lentivírus(Figura 2A)
- Produzir as partículas lentivirais expressas pelo GFP.
- No dia 0, placa HEK 293T células em uma densidade de 5-6 x 106 células por placa de cultura celular de 10 cm em meio de cultura de linha celular (ou seja, DMEM com 10% FBS e 1% de penicilina/estreptomicina).
- No primeiro dia, prepare a solução de transfecção de DNA, incluindo plasmídeo de transferência contendo GFP (8 μg), plasmídeo de embalagem lentiviral (10 μg de pCMVR 8,74 e 3 μg de pMD2.G) e 1 mL de meio soro reduzido (Tabela de Materiais).
- Adicione 3 μL de reagente de transfecção(Tabela de Materiais) por 1 μg de plasmídeo total de acordo com as instruções do fabricante e misture suavemente tubulando. Incubar por 20 min na RT e adicionar 9 mL de DMEM com 10% de FBS.
- Aspirar o meio cultural na placa de cultura celular com células HEK 293T. Transfira cuidadosamente 10 mL da solução de transfecção de DNA para as células HEK 293T e incuba restou em uma incubadora de cultura celular a 37 °C.
- No dia 3, observe as células um microscópio de fluorescência (excitação a 488 nm e emissão a 512 nm) para determinar a eficiência da transfecção. Quase 90% a 100% das células de toda a população celular devem expressar GFP.
- Colete o supernatante (contendo o vírus) e filtra o supernatant com um filtro de polietersulfone de 0,45 μm (PES).
NOTA: Use um filtro de baixa ligação proteica, como um filtro PES. - Para concentrar o vírus, centrífuga o vírus supernatant em 98.768 x g em um ultracentrífuga por 2 h a 4 °C em um rotor de balde balançando (Tabela de Materiais) e descarte cuidadosamente o supernatante.
- Resuspender a pelota em 2,5 mL de meio organoide frio.
- Para armazenamento a longo prazo, alíquota de 250 μL de meio lentiviral em frascos criogênicos e congelá-los usando nitrogênio líquido. Guarde os estoques virais congelados em um freezer de -80 °C.
- Realizar transdução mediada por lentivírus dos organoides tumorais da bexiga.
- No dia 2, divida os organoides tumorais descritos acima (passo 1.2) 12 h antes da transdução mediada por lentivírus.
- No dia 3, descongele rapidamente uma alíquota (passo 2.1.9) contendo vírus em um banho de água de 37 °C e adicione os 250 μL de meio organoide com 10 μM Y-27632 e 8 μg/mL hexadimethrine brometo.
- Substitua o meio organoide na placa de 24 poços por organoides tumorais por 500 μL de meio contendo vírus e incubação por 12-16 h em uma incubadora (37 °C, 5% CO2).
- No dia 4, mude o meio com 500 μL de meio organoide fresco.
NOTA: Após 12-16 h de incubação, o meio deve ser alterado, pois o meio contendo lentivírus e brometo de hexadimetrina é citotóxico. - No dia 6, monitore o sinal GFP dos organoides tumorais 3 dias após a transdução um microscópio de fluorescência (Figura 2B).
- No dia 10, passagem e estocagem os organoides 7 dias após a transdução conforme descrito na etapa 1.2, para manter as linhas organoides tumorais geneticamente modificadas.
3. Transplante ortotópico de Organoide bexiga (Figura 3A)
- Prepare os organoides tumorais da bexiga para transplante ortotópico.
- Antes do transplante, a cultura do tumor da bexiga organoides por 5 a 7 dias, conforme descrito acima (passo 1.2).
- Adicione 500 μL de colagenase/dispase ao meio organoide em uma placa de 24 poços com organoides tumorais. Pipette para cima e para baixo a matriz de membrana do porão e meio. Incubar por 20 min a 37 °C e coletar as células em um tubo de 15 mL.
- Adicione 5 mL de DMEM pré-aquecido, centrífuga o tubo a 400 x g por 3 min a 4 °C, e aspirar o supernatante.
- Resuspender a pelota com 1 mL de DMEM e transfira a solução para uma placa de Petri de 90 mm.
- um microscópio, pegue os organoides tumorais de 10 a 100 usando uma micropipeta p200 e recolhe-os em um microtubo no gelo.
- Centrífuga o tubo a 400 x g por 3 min a 4 °C e descarte cuidadosamente o supernatante.
- Mantenha a pelota celular no gelo até que os ratos estejam prontos para cirurgia.
- Transplante de parede submucosal da bexiga
NOTA: Este procedimento é modificado a partir do protocolo publicado por Fu et al18.- Prepare um rato nu masculino de 8 a 10 semanas (CAnN.Cg-Foxn1nu/Crl) pelo menos 1 semana antes do experimento para permitir que ele se aclimate a um novo ambiente. Injete enrofloxacina (5 mg/kg) subcutâneamente 24h antes da cirurgia.
- Limpe a superfície do banco por água e sabão. Autoclave os instrumentos cirúrgicos antes do procedimento cirúrgico e realizar cirurgia utilizando instrumentos estéreis.
- Mantenha a seringa de insulina de 29 G, dicas de pipeta e matriz de membrana do porão no gelo. Administrar cetoprofeno (5 mg/kg) subcutâneamente antes da administração da anestesia.
- Anestesiar o rato com 4% de isoflurano em uma câmara de indução. Uma vez que a anestesia geral alcançada, coloque o rato em uma posição supina e mantenha anestesia por inalação de 2% de isoflurano vaporizado.
NOTA: Se o tempo de anestesia for superior a 30 min, aplique pomada ocular em ambos os olhos usando um cotonete de algodão para evitar a secagem da córnea. - Aplique povido-iodo com uma gaze estéril e limpe-o com 70% de etanol. Repita 3x com uma nova gaze ou um cotonete de algodão cada vez.
- Cubra o ânus e o campo cirúrgico usando cortinas cirúrgicas descartáveis e estéreis.
- Usando um microscópio dissecando para ampliação, faça uma pequena incisão transversa (menor que 1,5 cm) na pele e parede muscular do abdômen médio inferior com tesoura cirúrgica estéril. Exponha a bexiga da cavidade abdominal e apoie-a com cotonetes de algodão encharcado salinos.
NOTA: Se a bexiga estiver cheia de urina, pressione suavemente a bexiga para descomprimi-la ligeiramente. - Resuspender as pelotas organoides (passo 3.1.7) em 80 μL de meio organoide contendo 50% de matriz de membrana do porão de alta concentração(Tabela de Materiais).
- Injete a suspensão organoide no aspecto anterior da cúpula da bexiga usando a seringa de insulina de 29 G um microscópio dissecando.
- Feche a camada interna da parede abdominal com sutura absorvível antibacteriana e, em seguida, feche a camada externa com sutura de nylon 4-0. Desinfete o local cirúrgico com povido-iodo e 70% de etanol.
- Deixe o rato se recuperar um irradiador infravermelho de 10 a 15 min. Monitore o rato até que recupere a consciência e a motilidade.
- Um dia após a cirurgia, verifique a condição geral do rato e vazamento anastomótico. Administrar cetoprofeno (5 mg/kg) uma vez por dia por 3 dias após o funcionamento e tratar enrofloxacina (5 mg/kg) uma vez por dia durante 10 dias pós-operatório.
- Quando o local de incisão tiver curado (10-14 dias após a cirurgia), remova as suturas. Monitore o crescimento do tumor da bexiga do camundongo por 2 a 3 semanas após a injeção de organoide tumoral.
- Se o crescimento do tumor da bexiga for observado, eutanásia o camundongo usando inalação de dióxido de carbono, e colher todo o tumor da bexiga. Lave-o usando DPBS frios(Figura 3B)16.
- Para analisar a histologia tumoral da bexiga, manusee a seção incorporada à parafina do tecido utilizando hematoxilina e eosina(Figura 3B)16.
Resultados
Cultura in vitro de organoides tumorais de bexiga de camundongo
O número de células tumorais dissociadas de um tumor induzido por ~1 cm3 BBN é de pelo menos 4 x 105 células. Quando as células são inicialmente semeadas na matriz de membrana do porão, células não cancerígenas e detritos podem ser observados. Os destroços foram gradualmente diluídos pela continuidade da subcultura. A Figura 1B mostra imagens dos organoides cultivados em diferentes pontos de ponto. Se as células tumorais não formam organoides tumorais, as células estão potencialmente mortas durante a etapa de dissociação. Nesse caso, os procedimentos de dissociação, incluindo o tempo de incubação com a enzima, precisam ser ajustados para aumentar a viabilidade celular.
Expressão de GFP em organoides tumorais da bexiga usando manipulação genética mediada por lentivírus
Organoides tumorais da bexiga apresentaram fortes sinais de GFP com infecção lentiviral bem sucedida (Figura 2B). Após a concentração, um total de 250 μL de mídia contendo vírus foi suficiente para infectar 3 x 104 células tumorais únicas na matriz de membrana do porão, mantendo 90% a 100% de eficiência de infecção. Sinais de GFP podem ser detectados a partir dos organoides tumorais da bexiga 3 dias após a transdução lentiviral. Se os sinais de fluorescência são baixos, a eficiência da infecção viral é potencialmente baixa. Isso pode ser devido a inúmeros fatores, como o baixo titer viral, e os procedimentos precisam ser ajustados em conformidade.
Transplante ortotópico de organoides tumorais da bexiga
Um aloenxerto de tumor de bexiga obtido de organoides tumorais de bexiga induzidos pelo BBN é apresentado na Figura 3B16. Os aloenxertos de tumor de bexiga foram colhidos 3 semanas após o transplante ortotópico. A histologia do tumor de bexiga transplantado foi analisada utilizando a coloração H e E. Transplantes ortotópicos de organoides tumorais podem crescer como tumores de bexiga por 2 a 3 semanas.

Figura 1: Cultura in vitro de organoides tumorais da bexiga de camundongo. (A)Diagrama esquemática para o estabelecimento de organoides tumorais de bexiga de camundongo. (B) Imagens representativas para a cultura dos organoides tumorais da bexiga em diferentes pontos de tempo. Organoides tumorais de bexiga de camundongo foram estabelecidos e cultivados ao longo de 9 dias. Barra de escala = 100 μm. Clique aqui para ver uma versão maior deste valor.
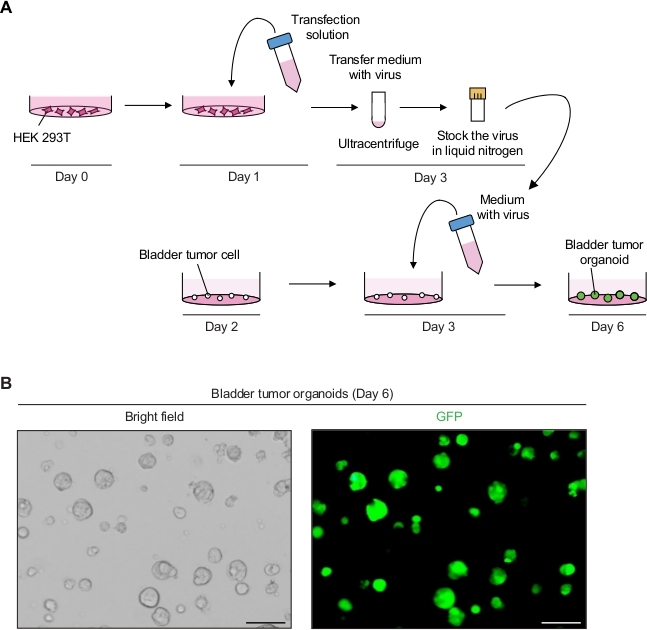
Figura 2: Expressão do GFP nos organoides tumorais da bexiga usando manipulação genética mediada por lentivírus. (A)Diagrama esquemática de transfecção lentiviral e transdução de organoides tumorais da bexiga. (B) Imagens representativas de organoides tumorais da bexiga expressando GFP. Barras de escala = 100 μm. Clique aqui para ver uma versão maior deste valor.

Figura 3: Transplante ortotópico de organoides tumorais da bexiga. (A)Diagrama esquemática de transplante ortotópico de organoides tumorais da bexiga para um rato nu. (B) Imagens representativas de bexigas e seções manchadas de H e E de camundongos ortotópicos transplantados com organoides tumorais da bexiga. Vistas ampliadas das regiões encaixotadas nos painéis médios são mostradas nos painéis esquerdos. Barra de escala = 500 μm. Esse número foi reproduzido a partir da Figura 1-Figure Supplement 1, Kim et al.16,publicada a Creative Commons Atribuição 4.0 International Public License (CC BY 4.0; https://creativecommons.org/licenses/by/4.0/). Clique aqui para ver uma versão maior deste valor.
| Organoides tumorais da bexiga de camundongo | |
| DMEM/F-12 avançado (meio básico) | HEPES de 10 mM (pH 7.4) |
| Nicotinamida de 10 mM | Suplemento sem soro 0,5x |
| 2 mM L-alanyl-L-glutamina dipeptídeo | 1% Penicilina/Estreptomicina |
| 1 mM N-acetyl-L-cysteine | Fator de crescimento epidérmico de 50 ng/mL Murine |
| 1 μM A 83-01 | |
Tabela 1: Composição do tumor de bexiga organoide médio.
Discussão
Este protocolo descreve os procedimentos experimentais para a cultura e mantém organoides tumorais da bexiga derivados de tumores de bexiga murina induzidos pelo cancerígeno.
Neste protocolo, existem várias etapas experimentais em que os procedimentos podem precisar de alguma solução de problemas. Em primeiro lugar, o número de células tumorais que são inicialmente semeadas é um fator crítico porque o baixo número de células tumorais na cultura (<2 x 104 células) leva principalmente à morte celular devido à falta de interações entre as células tumorais. Em contraste, começar com muitas células (>5 x 104 células) na semeade leva a organoides superlotados, resultando em dificuldade ao lidar com culturas com mau crescimento de cada organoide. Sugere-se fortemente que várias placas com diferentes números de células sejam estabelecidas no início para otimizar as condições experimentais. Identificar o número certo de células tumorais iniciais é crucial para alcançar a maior viabilidade celular e estabelecer organoides tumorais bem sucedidos da bexiga. Além disso, na cultura de longo prazo de mais de 2 semanas sem passar, a maioria dos organoides tumorais param de crescer, potencialmente devido ao fornecimento inadequado de nutrientes no centro dos organoides e ao esgotamento do fator de crescimento na matriz de membrana do porão. Portanto, subculir organoides em tempo hábil é um passo fundamental para manter a cultura organoide tumoral.
Em segundo lugar, a produção de partículas lentivirais de alta titer é fundamental para a manipulação genética eficiente dos organoides tumorais. Para solucionar problemas relacionados ao vírus, é fortemente sugerido que os titers vírus sejam determinados antes da transdução viral todas as vezes porque construções lentivirais tendem a produzir partículas virais com eficiência variável. Se os organoides tumorais apresentarem baixa viabilidade após infecção viral, é provável que os titers virais sejam potencialmente muito altos. Sugere-se fortemente o uso de menor quantidade de vírus neste caso. Terceiro, durante o transplante ortotópico de organoides tumorais de bexiga induzidos por BBN, é fundamental manter a integridade da parede da bexiga. Caso a injeção atinja o lúmen da bexiga penetrando na camada da parede da bexiga, o experimento deve ser encerrado e descartado. Se possível, recomenda-se o monitoramento do crescimento do tumor da bexiga usando um sistema de ultrassom.
Uma limitação das técnicas atuais é a ausência do microambiente tumoral ou estromático nesses organoides. Para superar essa questão, sugere-se fortemente que o transplante ortotópico de organoides tumorais use um sistema in vivo para imitar o microambiente tumoral nativo. No futuro, será necessário desenvolver sistemas organoides 3D in vitro que são compostos de organoides tumorais com outros componentes do estroma tumoral.
Uma das principais implicações de nossa técnica é que, no transplante ortotópico de organoides tumorais, apenas 10 organoides tumorais da bexiga podem induzir o crescimento tumoral na bexiga. Em comparação com os experimentos convencionais de transplante de tumores que requerem 5 x 105-1 x 106 células tumorais de bexiga únicas, nossos métodos são muito mais eficientes e robustos. Outra diferença significativa é que os organoides podem ser manipulados diversamente usando vários vetores lentivirais, como construções lentivirais contendo RNA de cabelo curto, o sistema CRISPR-Cas9 ou genes de interesse. Estas seriam ferramentas poderosas para adicionar à tecnologia organoide atual. No geral, as abordagens experimentais aqui apresentadas podem facilitar o estabelecimento de modelos tumorais in vitro que podem melhorar nossa compreensão da patogênese do câncer de bexiga em vez de usar linhas celulares de câncer de bexiga 2D.
Este método foi capaz de estabelecer organoides tumorais da bexiga derivados de um tumor de bexiga murina induzida pelo cancerígeno. O artigo fornece uma descrição dos procedimentos experimentais mediados por lentivírus através dos quais as modificações genéticas são introduzidas e mantidas em organoides tumorais da bexiga. Além disso, está incluído um procedimento para transplante ortotópico de organoides tumorais. Em combinação com a corrente nos modelos de câncer vivo, esta técnica será uma ferramenta útil para estudar a base molecular da tumorigênese da bexiga.
Divulgações
Os autores não declaram interesses financeiros concorrentes.
Agradecimentos
Esta pesquisa foi apoiada por subsídios da Fundação Nacional de Pesquisa da Coreia para K.S: NRF-2017R1A2B4006043, NRF-2017M3C7A1047875, NRF-2017R1A5A1015366, Creative Economy Leading Technology Development Program (SF317001A), POSCO (2018Y060) e a BK21 Plus Research Fellowship.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.45 µm syringe filter (PES membrane) | Millipore | SLHP033RS | |
| 10 cm culture plate | Eppendorf | 0030-702-115 | |
| 90 mm Petri dish | SPL | 10090 | |
| 100 µm cell strainer | Corning | 352360 | |
| 15 mL conical tube | SPL | 50015 | |
| 24-well plate | Corning | 3526 | |
| 29 G 1/2 insulin syringe | SHINA | B299473538 | |
| 3 mL syringe | Norm-ject | N7.A03 | |
| 50 mL conical tube | SPL | 50050 | |
| A8301 | Tocris | 2939 | stock concentration: 25 mM |
| Absolute ethanol | Daejung | 4023-2304 | |
| Absorbable suture | Henry Schein | 039010 | |
| Advanced DMEM/F-12 | Thermo | 12634028 | |
| Ammonium-chloride-potassium (ACK) lysing buffer | Thermo | A1049201 | |
| B-27 | Gibco | 17504-044 | stock concentration: 50X |
| BBN(N-butyl-N-(4-hydroxybutyl) nitrosamine) | Tokyo Chemical Industry | B0938 | |
| Blue nylon 5/0-13mm | AILEE | NB521 | |
| C57BL Mouse | The Jackson Laboratory | 000664 | |
| CAnN.Cg-Foxn1nu/Crl (nude mouse) | Charles River | 194 | |
| Collagenase type I | Thermo | 17100017 | stock concentration: 20 mg/mL |
| Collagenase type II | Thermo | 17100015 | stock concentration: 20 mg/mL |
| Collagenase/dispase | Sigma | 10269638001 | stock concentration: 1 mg/mL |
| Cyrovial | Corning | 430488 | |
| DMEM(Dulbecco's modified minimum essential media) | Gibco | 11965-118 | |
| DMSO(Dimethyl sulfoxide) | Sigma | D8418 | |
| DPBS(Dulbecco's phosphate-buffered saline) | Welgene | LB 001-02 | |
| Enrofloxacin (Baytril) | Bayer Healthcare | DIN: 02169428 | |
| FBS(Fetal bovine serum) | Millipore | ES009B-KC | |
| Glutamax | Gibco | 35050061 | 100X |
| HEK 293T | ATCC | CRL-11268 | |
| HEPES(4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid) | Welgene | BB001-01 | |
| Isoflurane | Hana Pharm Co., Ltd. | ||
| Ketoprofen (Anafen) | Merial | DIN: 02150999 | |
| Matrigel growth factor reduced (GFR) Growth Factor Reduced (GFR) | Corning | 354230 | use for organoid culture in plate |
| Matrigel high concentration (HC) | Corning | 354248 | use for organoid transplantation |
| 1.5 mL microtube | Axygen | MCT-150-C | |
| LT1 transfection reagent | Mirus Bio | MIR 2300 | |
| murine EGF(epidermal growth factor) | Peprotech | 315-09 | stock concentration: 100 µg/mL |
| N-acetyl-L-cysteine | Sigma | A9165 | stock concentration: 200 mM |
| Nicotinamide | Sigma | N0636 | stock concentration: 1M |
| Opti-MEM | Gibco | 31985070 | |
| pCMV.R 8.74 | Addgene | 22036 | Packaging plasmid |
| Penicillin/streptomycin | Gibco | 15140122 | 100X |
| pMD2.G | Addgene | 12259 | Envelope plasmid |
| Polybrene(hexadim ethrine bromide) | Sigma | H9286 | stock concentration: 2 µg/mL |
| pSiCoR | Addgene | 11579 | Lentiviral plasmid |
| Razor blade | |||
| Saline buffer | JW Pharmaceutical | ||
| SW41Ti swinging bucket rotor | Beckman Coulter | ||
| Thermolysin, Bacillus thermoproteolyticus | Millipore | 58656-2500KUCN | stock concentration: 250 KU/mL |
| Trypsin-EDTA (0.25%) | Gibco | 25200072 | |
| Ultracentrifugation tube | Beckman Coulter | 331372 | |
| Y-27632 dihydrochloride | Abmole | M1817 | stock concentration: 10 mM |
Referências
- Sanli, O., et al. Bladder cancer. Nature Reviews Disease Primers. 3, 17022 (2017).
- Stenzl, A., et al. Treatment of muscle-invasive and metastatic bladder cancer: update of the EAU guidelines. European Urology. 59 (6), 1009-1018 (2011).
- Barretina, J., et al. The Cancer Cell Line Encyclopedia enables predictive modelling of anticancer drug sensitivity. Nature. 483 (7391), 603 (2012).
- Caponigro, G., Sellers, W. R. Advances in the preclinical testing of cancer therapeutic hypotheses. Nature Reviews Drug Discovery. 10 (3), 179 (2011).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407 (2018).
- Fatehullah, A., Tan, S. H., Barker, N. Organoids as an in vitro model of human development and disease. Nature Cell Biology. 18 (3), 246 (2016).
- Pauli, C., et al. Personalized in vitro and in vivo cancer models to guide precision medicine. Cancer discovery. 7 (5), 462-477 (2017).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- van de Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Lee, S. H., et al. Tumor evolution and drug response in patient-derived organoid models of bladder cancer. Cell. 173 (2), 515-517 (2018).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Huang, L., et al. Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell-and patient-derived tumor organoids. Nature Medicine. 21 (11), 1364 (2015).
- Gao, D., et al. Organoid cultures derived from patients with advanced prostate cancer. Cell. 159 (1), 176-187 (2014).
- Broutier, L., et al. Human primary liver cancer–derived organoid cultures for disease modeling and drug screening. Nature Medicine. 23 (12), 1424 (2017).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Kim, S., et al. Epigenetic regulation of mammalian Hedgehog signaling to the stroma determines the molecular subtype of bladder cancer. eLife. 8, 43024 (2019).
- Shin, K., et al. Cellular origin of bladder neoplasia and tissue dynamics of its progression to invasive carcinoma. Nature Cell Biology. 16 (5), 469 (2014).
- Fu, C. L., Apelo, C. A., Torres, B., Thai, K. H., Hsieh, M. H. Mouse bladder wall injection. JoVE (Journal of Visualized Experiments). (53), e2523 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados