Method Article
Fare Mesane Tümörü Organoidlerinin Kültürü, Manipülasyonu ve Ortotopik Transplantasyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, kanserojen kaynaklı murin mesane kanserinden elde edilen mesane tümörü organoidlerinin üç boyutlu in vitro kültürünü oluşturmak için ayrıntılı deneysel adımlar sağlar. Paslanma, genetik mühendislik ve tümör organoidlerinin ortotopik transplantasyonlarını içeren kültür yöntemleri tanımlanmıştır.
Özet
Mevcut kanser modelleri üç boyutlu (3D) tümör mimarisi nin eksikliği ve insan kanseri ile düşük alaka gibi sınırlamalar göstermiştir çünkü gelişmiş tümör modellerinin gelişimi uzun teşvik edilmiştir. Araştırmacılar son zamanlarda bir kültür çanak yerli bir tümörün özelliklerini taklit edebilir tümör organoidler olarak adlandırılan bir 3D in vitro kanser modeli geliştirdik. Burada, kanserojen kaynaklı bir murin mesane tümöründen mesane tümörü organoidlerinin kurulması için yapılan deneysel işlemler, kültür, geçiş ve in vitro olarak ortaya çıkan 3Boyutlu tümör organoidlerinin bakımı da dahil olmak üzere ayrıntılı olarak açıklanmıştır. Buna ek olarak, lentivirus aracılı transdüksiyon kullanarak genetik mühendisliği için kurulan mesane tümörü organoid hatları işlemek için protokoller açıklanmıştır, tümör içine yeni genetik unsurların verimli giriş için optimize koşulları da dahil olmak üzere organoidler. Son olarak, daha fazla analiz için mesane mesane duvarına mesane tümör organoidlerinin ortotopik nakli için prosedür ortaya konur. Bu makalede açıklanan yöntemler daha iyi tedavi seçenekleri nin geliştirilmesi için mesane kanseri için bir in vitro model kurulmasını kolaylaştırabilir.
Giriş
Mesane kanseri en yaygın idrar yolu kanseri, yaklaşık 165.000 hasta yılda ölüyor1. Mesane kanseri çeşitli türleri arasında, kas-invaziv ürotelyal karsinom agresif bir fenotip sergiler, ve 5 yıllık sağkalım oranı daha düşüktür 50%2. İnvaziv ürotelyal tümörler için yeni tedavi seçenekleri son birkaç on yıl içinde genişletilmedi1.
Kanser hücre hatları yaygın ilaç taraması için kullanılmıştır3. Kanser hücresi hatlarında çok sayıda ilaç adaylarında olumlu sonuçlar gözlenmiş olmasına rağmen, klinik çalışmalarda kötü sonuçlar bildirilmiştir4. In vitro iki boyutlu (2D) kültür ortamlarına adaptasyonun artmasının ardından, hücre hatlarındaki yerli tümörleri yeniden kapamak giderek zorlaşmak güçleşmiştir. Hayvan kanseri modelleri veya hasta kaynaklı tümör ksenogreftleri mesane kanseri hücre hatlarında gözlenen sınırlamaları gidermek için kullanılabilir. Ancak, hayvan kanseri modelleri zaman ve kaynak yoğun. Bu nedenle, geliştirilmiş hastalık modelleri yıllardır talep üzerine olmuştur ve yeni bir model sistemi, organoidler, mevcut modellerin eksiklikleri aşmak için geliştirilmiştir5.
Organoid, in vitro in vivo organının fizyolojik özelliklerini özetleyen çok hücreli bir 3D yapıdır. Normal ve tümör organoidleri pluripotent veya erişkin kök hücrelerden ve primer tümör hücrelerinden elde edilebilir, sırasıyla5,6. Son birkaç yıl içinde, tümör organoidler çeşitli tümör dokularının çok sayıda kurulmuştur7, kolondahil8 ,9, mesane10, pankreas11,12, prostat13, karaciğer14, ve meme15 tümör dokuları. Bu tür tümör organoidleri orijinal tümörlerini fenotipik ve genetik olarak taklit ederler. In vivo tümör dokularına olan benzerlikleri ve sayısız pratik uygulamaları nedeniyle, araştırmacılar kanser patogenezinin incelenmesinde yeni hastalık modelleri olarak benimsemişlerdir.
Burada kanserojen kaynaklı murine invaziv ürotelyal tümör den tümör organoidlerinin kurulması için prosedürler ortaya konur16. N-butyl-N-(4-hidroksibütil) nitrozamin (BBN) farelerde invaziv ürotelyal karsinom neden bir kanserojen olarak kullanılır17 ve tümör organoidler, hangi fare kas-invaziv mesane tümörlerinin patolojik özelliklerini sergileyen, BBN kaynaklı idrar kesesi kanseri16. Genetik tümör organoidleri işlemek için yöntem mesane kanseri gelişiminin moleküler temelini incelemek için bir model sistemi geliştirmek için lentivirus aracılı transdüksiyon kullanılarak gösterilmiştir. Buna ek olarak, mesane kanserinde doğal mesane ortamının rolünü araştırmak için bir mesane içine ortotopik organoidler nakli için bir yöntem açıklanmıştır.
Protokol
Tüm prosedürler POSTECH Kurumsal Hayvan Bakım ve Kullanım Komitesi yönergeleri (IACUC numarası: POSTECH-2019-0055) tarafından onaylandı ve yürütüldü.
1. Mesane Tümörü Organoidlerinin Tüp Kültürü
- Murin mesane tümöründen mesane tümörü organoidleri kurmak (Şekil 1A).
NOT: BBN'ye bağlı fare mesane tümörleri oluşturma prosedürü Shin ve ark.'da özetlenmiştir.17.- 6 ay boyunca fare reklam libitum için karanlık bir şişede% 0.1 BBN içeren su sağlayın. BBN içeren suyu haftada 2 x değiştirin.
NOT: 8-10 haftalıkken vücut ağırlığı yaklaşık 25 g olan bir C57BL/6 erkek fare kullanıldı. BBN içeren su, tek bir kafeste en fazla beş fareye verilebilir. - 6 ay sonra, karbondioksit teneffüs kullanarak fare ötenazi ve tüm mesane tümörü izole. 90 mm Petri kabına aktarın.
- Steril cerrahi makas kullanarak kanser olmayan parçaları ve nekrotik bölgeleri çıkarın ve mesane tümörü parçalarını soğuk 1x Dulbecco'nun fosfat tamponlu salini (DPBS) ile 2-3 kez yıkayın. Parçaları toplayın ve yeni bir 90 mm Petri kabına aktarın.
- 10 mM 4-(2-hidroksietil)-1-piperazineeeesulfonic asit (HEPES) ile Dulbecco'nun modifiye edilmiş minimum esansiyel ortamının (DMEM) 1 mL'sini ekleyin.
- Sterilize jilet kullanarak tümör dokusunu mümkün olduğunca küçük parçalara (0.5-1 mm3)dolaştırın.
- 10 mM HEPES, 250 μg/mL kollajenaz tip I, 250 μg/mL kollajenaz tip II ve 250 U/mL termolizin ile 9 mL DMEM ekleyin. Bir kuvözdeki orbital shaker üzerinde kıymalı tümör dokusunu 1,5-2 saat kuluçkaya yatırın (37 °C, %5 CO2) parçaları hücre süspansiyonuna ayrıştırın. Hücre süspansiyonuna 50 mL'lik bir tüp aktarın.
NOT: Fareden alınan tümörün boyutu 1 cm3'tenbüyükse, termolizin miktarı 2 kat daha fazla ysa veya kuluçka süresini artırın. - Tüpü 4 °C'de 5 dk 400 x g'de santrifüj edin ve süpernatantı aspire edin.
- 5 mL amonyum-klorür-potasyum (ACK) kullanarak kırmızı kan hücrelerini tedavi etmek için peleti yeniden askıya alın. Tüpü 3-5 dakika oda sıcaklığında (RT) kırmızı kan hücrelerinin tam olarak dolana kadar kuluçkaya yatırın.
NOT: Kırmızı kan hücreleri gözlenmezise, lysing işlemini atlamayın. - Tüpe 20 mL DMEM ekleyin. Tüpü 4 °C'de 5 dk 400 x g'de santrifüj edin ve süpernatantı aspire edin.
- Peleti tek hücrelere ayırmak için 1 mL%0,25 Tripsin-EDTA ve 10 μM Y-27632 dihidroklorür (Y-27632) ile tekrar askıya alın. Tüpü 37 °C'lik su banyosunda 5 dakika kuluçkaya yatırın.
NOT: Tek hücrelere tam dissosyasyon onaylamak için bir mikroskop altında tümör gözlemleyin. Hücre parçaları devam ederse, pipet süspansiyon daha fazla. - % 10 fetal sığır serumu (FBS) ile 10 mL DMEM kullanarak tripsinnötral. Sindirilmemiş enkazı temizlemek için hücre süspansiyonuna 50 mL'lik yeni bir tüpüzerindeki 100 m hücreli süzgeçten süzün.
- Tüpü 4 °C'de 5 dk 400 x g'de santrifüj edin ve süpernatantı aspire edin.
- 150 μL buz gibi büyüme faktörü kullanarak 24 kuyuplakasını katlayınve 24 kuyu plakasını 30 dakika boyunca bir kuvöze (37 °C, %5 CO2)yerleştirin.
NOT: Kullanmadan önce katılaşmayı önlemek için temel membran matrisini 4 °C'de eritin ve bakımını edin. - 1 mL DMEM kullanarak peleti yeniden askıya alın ve hemositometre kullanarak hücreleri sayın. 3-4 x 104 tümör hücrelerini buz üzerinde 1,5 mL'lik bir mikrotüpe aktarın.
- Mikrotüpü 4 °C'de 3 dk 400 x g'da santrifüj edin ve süpernatantı dikkatlice atın.
- 500 μL önceden ısınmış organoid ortam(Tablo 1) ve 10 μM Y-27632 ile hücreleri yeniden askıya alın ve kaplanmış kuyuya aktarın. 24 kuyu plakasını bir kuvöze yerleştirin (37 °C, %5 CO2).
- Ekstra mesane tümör hücreleri 1,5 mL cryovials% 10 FBS,% 1 penisilin / streptomisin içeren DMEM 1 mL ile stoklanabilir ve% 10 dimetil sülfoksit (DMSO) ile. Bir cryovial dondurma kabına yerleştirin ve -80 °C dondurucuya konteyner aktarın. Bir gece dondurucuda sakladıktan sonra, cryovials uzun süreli depolama için sıvı nitrojen içine aktarın.
- Önceden ısıtılmış organoid ortamın 500 μL'sini kullanarak her 2 günde bir ortamı değiştirin (Şekil 1B).
- 6 ay boyunca fare reklam libitum için karanlık bir şişede% 0.1 BBN içeren su sağlayın. BBN içeren suyu haftada 2 x değiştirin.
- Alt kültür mesane tümörü organoidleri.
NOT: Mesane tümörü organoidlerinin çapı 100-150 μm'ye ulaştıklarında geçirilmesi önerilir.- Tümör organoidleri ile 24 kuyu plaka organoid orta kollajenaz / dispase 500 μL ekleyin. Pipet yukarı ve aşağı bodrum membran matris ve orta. 37 °C'de 20 dakika kuluçkaya yatın ve hücreleri 15 mL'lik bir tüpe toplayın.
NOT: Bir mikroskop altında bodrum membran matris izole organoidler inceleyin. Organoidler bazal membran matrisinden ayrılmazlarsa, kuluçka süresini veya pipeti daha fazla artırın. - Önceden ısıtılmış DMEM 5 mL ekleyin, 400 x g'de tüpü 4 °C'de 3 dk santrifüj edin ve süpernatantı aspire edin.
- Önceden ısıtılmış 1 mL tripsin-EDTA ve 10 μM Y-27632 kullanarak peleti yeniden askıya alın. 37 °C'lik su banyosunda 5 dk kuluçka. Hücreleri yukarı ve aşağı kuvvetle pipetlendirin ve %10 FBS ile 5 mL DMEM kullanarak tripsini nötralize edin.
- Tüpü 4 °C'de 3 dk 400 x g'da santrifüj edin ve süpernatantı aspire edin.
- Önceden ısıtılmış organoid ortamın 1 mL'sini kullanarak peleti yeniden askıya alın ve tek tümör hücresi sayısını sayın.
- Adımları 1.1.14−1.1.18'i yineleyin.
- Tümör organoidleri ile 24 kuyu plaka organoid orta kollajenaz / dispase 500 μL ekleyin. Pipet yukarı ve aşağı bodrum membran matris ve orta. 37 °C'de 20 dakika kuluçkaya yatın ve hücreleri 15 mL'lik bir tüpe toplayın.
2. Lentivirus aracılı Transdüksiyon Kullanarak Mesane Tümörü Organoidlerinin Genetik Manipülasyonu (Şekil 2A)
- GFP ifade lentiviral parçacıklar üretin.
- 0. günde, hücre hattı kültür ortamında 10 cm hücre kültür plakası başına5-6 x 10 6 hücre yoğunluğunda hek 293T hücreleri (yani% 10 FBS ve% 1 penisilin/ streptomisin ile DMEM).
- 1. günde, GFP içeren transfer plazmidi (8 g), lentiviral ambalaj plazmidi (10 μg pCMVR 8.74 ve pMD2.G 3 μg) ve 1 mL azaltılmış serum ortamı(Malzeme Tablosu)dahil olmak üzere DNA transfeksiyon çözeltisini hazırlayın.
- Üreticinin talimatlarına göre toplam plazmidin 1 μg'inde 3 μL transfeksiyon reaktifi(Malzeme Tablosu)ekleyin ve pipetleme ile hafifçe karıştırın. RT'de 20 dakika kuluçkaya yatve 9 mL DMEM ilave edin ve %10 FBS ile.
- HEK 293T hücreleri ile hücre kültürü plakasındaki kültür ortamını aspire edin. DNA transfeksiyon çözeltisinin 10 mL'sini HEK 293T hücrelerine dikkatlice aktarın ve 37 °C'de bir hücre kültürü kuluçka makinesine inkübedin.
- 3. günde, transfeksiyon verimliliğini belirlemek için floresan mikroskobu (488 nm'de uyarma ve 512 nm'de emisyon) altındaki hücreleri gözlemleyin. Tüm hücre popülasyonundaki hücrelerin neredeyse %90-%100'ü GFP'yi ifade etmelidir.
- Supernatant toplamak (virüs içeren) ve 0.45 μm polyethersulfone (PES) filtre ile supernatant filtrrate.
NOT: PES filtresi gibi düşük protein bağlayıcı bir filtre kullanın. - Virüsü yoğunlaştırdık, 98.768 x g'de virüs supernatantını ultrasantrifüjde 4 °C'de 2 saat salıncak kova rotorunda(Malzeme Tablosu)santrifüj edin ve supernatant'ı dikkatlice atın.
- 2,5 mL soğuk organoid ortamda peletrere resuspend.
- Uzun süreli depolama için, 250 μL'lik lentiviral ortam kriyojenik şişelere dönüştürülür ve sıvı nitrojen kullanarak onları tutturun. Dondurulmuş viral stokları -80 °C'lik bir dondurucuda saklayın.
- Mesane tümörü organoidlerinin lentivirus aracılı transdüksiyonunu gerçekleştirin.
- Gün 2, yukarıda açıklandığı gibi tümör organoidler bölünmüş (adım 1.2) 12 h lentivirus aracılı transdüksiyon önce.
- 3. günde, 37 °C'lik su banyosunda virüs içeren bir aliquot'u (adım 2.9) hızlı bir şekilde eritin ve 10 μM Y-27632 ve 8 μg/mL hekaksimebromür içeren 250 μL organoid ortamı ekleyin.
- 24 kuyu plakasındaki organoid ortamı tümör organoidleri ile değiştirin ve bir kuluçka makinesinde 12-16 saat (37 °C, %5 CO2)için 500°L virüs içeren orta ve inkübatör ekleyin.
- 4. günde, 500 μL taze organoid ortam ile orta değiştirin.
NOT: 12-16 saat inkübasyondan sonra, merceksivirüs ve heksadimethrine bromür içeren ortam sitotoksik olduğu için ortam değiştirilmelidir. - 6. günde, transdüksiyondan 3 gün sonra tümör organoidlerinden gelen GFP sinyalini floresan mikroskobu altında izleyin(Şekil 2B).
- 10. günde, genetiği değiştirilmiş tümör organoid hatlarını korumak için, 1.2.
3. Mesane Organoidinin Ortotopik Transplantasyonu (Şekil 3A)
- Mesane tümörü organoidlerini ortotopik transplantasyona hazırlayın.
- Transplantasyon dan önce mesane tümörü organoidlerini 5-7 gün boyunca kültüre ait olarak, yukarıda açıklandığı gibi (adım 1.2).
- Tümör organoidleri ile 24 iyi plaka organoid orta kollajenaz / dispase 500 μL ekleyin. Pipet yukarı ve aşağı bodrum membran matris ve orta. 37 °C'de 20 dakika kuluçkaya yatırın ve hücreleri 15 mL'lik bir tüpe toplayın.
- Önceden ısıtılmış DMEM 5 mL ekleyin, 400 x g'de tüpü 4 °C'de 3 dk santrifüj edin ve süpernatantı aspire edin.
- 1 mL DMEM ile peleti yeniden askıya alın ve çözeltiyi 90 mm Petri kabına aktarın.
- Mikroskop altında, bir p200 mikropipet kullanarak 10-100 tümör organoidleri almak ve buz üzerinde bir mikrotüp içine toplamak.
- Tüpü 4 °C'de 3 dk 400 x g'da santrifüj edin ve süpernatantı dikkatlice atın.
- Fareler ameliyata hazır olana kadar hücre peletini buzüzerinde saklayın.
- Submukozal mesane duvarı nakli
NOT: Bu yordam Fu ve ark18tarafından yayınlanan protokolden değiştirilmiştir.- Yeni bir ortama alışmak için denemeden en az 1 hafta önce 8 ila 10 haftalık erkek çıplak fare (CAnN.Cg-Foxn1nu/Crl) hazırlayın. Enrofloksasin (5 mg/kg) deri altı 24 saat ameliyattan önce enjekte edin.
- Tezgah yüzeyini sabun ve suyla temizleyin. Cerrahi işlem öncesinde cerrahi aletleri otoklavve ve steril aletler kullanarak cerrahi gerçekleştirin.
- 29 G insülin şırıngasını, pipet uçlarını ve bazzar matriksini buzüzerinde saklayın. Anestezi uygulanmadan önce ketoprofen (5 mg/kg) subkutan olarak uygulayın.
- Bir indüksiyon odasında% 4 izofluran ile fare anestezi. Genel anestezi sağlandıktan sonra fareyi bir supine pozisyonda yerleştirin ve %2 buharlaşmış izofluran maske teneffüs ederek anesteziyi koruyun.
NOT: Anestezi süresi 30 dk'nın üzerindeyse, korneanın kurumasını önlemek için pamuklu bir bez kullanarak her iki göze de göz merhemi uygulayın. - Steril bir gazlı bez ile povidon-iyot uygulayın ve% 70 etanol ile aşağı silin. Her seferinde yeni bir gazlı bez veya pamuklu bez ile 3x tekrarlayın.
- Tek kullanımlık, steril cerrahi perdeler kullanarak anüs ve cerrahi alanı kaplayın.
- Büyütme için bir diseksiyon mikroskobu kullanarak, steril cerrahi makas ile deri ve alt orta hat karın kas duvarında küçük bir enine kesi (1,5 cm'den küçük) olun. Karın boşluğundan mesane maruz ve tuzlu batırılmış pamuk lu bezler ile destek.
NOT: Mesane idrarla doluysa, hafifçe basıncı azaltmak için mesaneye hafifçe basın. - Organoid peletlerin (adım 3.1.7) %50 yüksek konsantrasyonlu bazal membran matrisi içeren 80 μL organoid ortamda(Malzeme Tablosu)resuspend.
- Organoid süspansiyonu, 29 G insülin şırıngasını bir kesişme mikroskobu altında kullanarak mesane kubbesinin ön yönüne enjekte edin.
- Antibakteriyel emilebilir sütür ile karın duvarının iç tabakasını kapatın ve sonra 4-0 naylon sütür ile dış tabakakapatın. Cerrahi bölgeyi povison-iyot ve %70 etanol ile dezenfekte edin.
- Farenin kızılötesi ışınlayıcı 10-15 dk. Bilinci ve hareketliliği yeniden kazanana kadar fareyi izleyin.
- Ameliyattan bir gün sonra farenin genel durumunu ve anastomoz sızıntısını kontrol edin. Ketoprofen (5 mg/kg) ameliyat sonrası 3 gün boyunca günde bir kez uygulayın ve ameliyat sonrası 10 gün boyunca günde bir kez enrofloksasin (5 mg/kg) tedavi edin.
- Kesi bölgesi iyileştiğinde (ameliyattan 10-14 gün sonra), dikişleri çıkarın. Tümör organoid enjeksiyonundan sonra 2-3 hafta boyunca fare mesane tümörü büyümesini izleyin.
- Mesane tümörü büyüme gözlenirse, karbondioksit inhalasyon kullanarak fare ötenazi, ve tüm mesane tümörü hasat. Soğuk DPBS(Şekil 3B)16kullanarak yıkayın.
- Mesane tümörü histolojisini analiz etmek için hematoknin ve eozin (H ve E) boyama(Şekil 3B)16kullanarak dokunun parafin gömülü kısmını lekelemek.
Sonuçlar
Fare mesane tümör organoidlerinin in vitro kültürü
~1 cm3 BBN kaynaklı tümörden ayrıştırılabilen tümör hücrelerinin sayısı en az 4 x 105 hücredir. Hücreler başlangıçta bazal membran matris tohumlu olduğunda, kanser olmayan hücreler ve enkaz görülebilir. Enkaz yavaş yavaş alt kültür devam ederek seyreltildi. Şekil 1B, farklı zaman noktalarında kültürlü organoidlerin görüntülerini gösterir. Tümör hücreleri tümör organoidleri oluşturmazsanız, hücreler dissosyasyon adımı sırasında potansiyel olarak ölüdür. Böyle bir durumda, enzim ile kuluçka süresi de dahil olmak üzere dissosiation prosedürleri hücre canlılığını artırmak için ayarlanması gerekir.
Lentivirus aracılı genetik manipülasyon kullanarak mesane tümörü organoidlerinde GFP ekspresyonu
Mesane tümörü organoidleri başarılı lentiviral enfeksiyon ile güçlü GFP sinyalleri sergilediler(Şekil 2B). Konsantrasyondan sonra, toplam 250 μL virüs içeren ortam, bazal membran matrisinde 3 x 104 tek tümör hücrelerini enfekte etmeye yetti ve %90-100 enfeksiyon verimini korudu. Lentiviral transdüksiyondan 3 gün sonra mesane tümörü organoidlerinden GFP sinyalleri saptanabilir. Floresan sinyalleri düşükse, viral enfeksiyonun verimi potansiyel olarak düşüktür. Bu düşük viral titre gibi çok sayıda faktörnedeniyle olabilir, ve prosedürler buna göre ayarlanması gerekir.
Mesane tümörü organoidlerinin ortotopik transplantasyonu
BBN'ye bağlı mesane tümörü organoidlerinden elde edilen mesane tümörü allogrefti Şekil 3B16'dasunulmuştur. Mesane tümörü allogreftleri ortotopik transplantasyondan 3 hafta sonra alındı. Nakledilen mesane tümörü histolojisi H ve E boyama kullanılarak incelendi. Tümör organoidlerinin ortotopik nakli mesane tümörü olarak 2-3 hafta süreyle büyüyebilir.

Şekil 1: Fare mesane tümör organoidlerinin in vitro kültürü. (A) Fare mesane tümör organoidlerinin kurulması için şematik diyagram. (B) Farklı zaman noktalarında mesane tümörü organoidlerinin kültürü için temsili görüntüler. Fare mesane tümörü organoidleri kuruldu ve 9 gün boyunca kültürlendi. Ölçek çubuğu = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
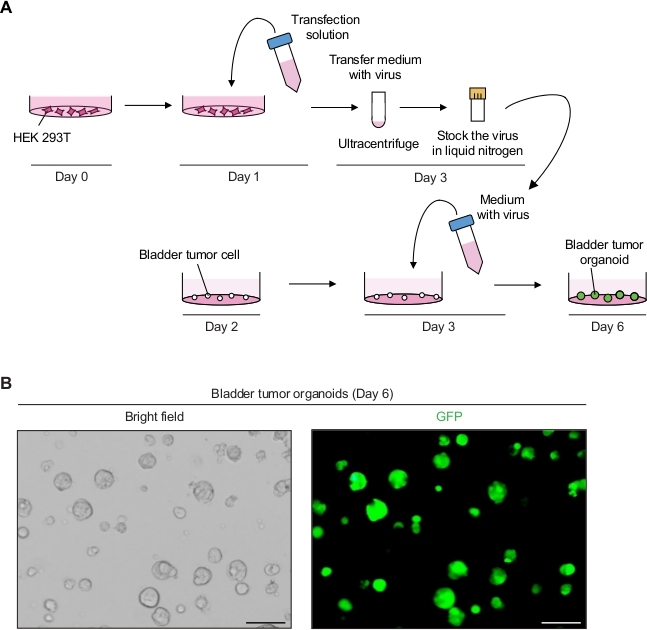
Şekil 2: Lentivirus aracılı genetik manipülasyon kullanarak mesane tümörü organoidlerinde GFP ekspresyonu. (A) Mesane tümörü organoidlerinin lentiviral transfeksiyonve transdüksiyon şematik diyagramı. (B) GFP ifade mesane tümörü organoidlerinin temsili görüntüleri. Ölçek çubukları = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Mesane tümörü organoidlerinin ortotopik transplantasyonu. (A) Çıplak fare mesane tümörü organoidlerinin ortotopik transplantasyonuşematik diyagramı. (B) Mesane tümörü organoidleri ile nakledilen farelerden mesane ve H ve E lekeli kesitlerinin temsili görüntüleri. Orta panellerde kutulu bölgelerin büyütülmüş görünümleri sol panellerde gösterilir. Ölçek çubuğu = 500 μm. Bu rakam Şekil 1-Şekil Ek 1, Kim ve ark.16, Creative Commons Attribution 4.0 Uluslararası Kamu Lisansı (CC BY 4.0; https://creativecommons.org/licenses/by/4.0/) altında yayınlanan çoğaltıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Fare mesane tümör organoidler orta | |
| Gelişmiş DMEM/F-12 (Temel orta) | 10 mM HEPES(pH 7.4) |
| 10 mM Nikotinamid | 0.5x Serumsuz ek |
| 2 mM L-alanyl-L-glutamin dipeptid | %1 Penisilin/Streptomisin |
| 1 mM N-asetil-L-sistein | 50 ng/mL Murine epidermal büyüme faktörü |
| 1 μM A 83-01 | |
Tablo 1: Mesane tümörü organoid ortamının bileşimi.
Tartışmalar
Bu protokol, kanserojen kaynaklı murine mesane tümörlerinden elde edilen mesane tümörü organoidlerinin kültür ve bakımı için deneysel prosedürleri açıklamaktadır.
Bu protokolde, yordamların bazı sorun giderme gerekebileceği birkaç deneysel adım vardır. İlk olarak, başlangıçta tohumlanan tümör hücrelerinin sayısı kritik bir faktördür, çünkü kültürdeki tümör hücrelerinin sayısının azlığı (<2 x 104 hücre) çoğunlukla tümör hücreleri arasındaki etkileşimeksikliği nedeniyle hücre ölümüne yol açmaktadır. Buna karşılık, çok fazla hücre ile başlayan (>5 x 104 hücreleri) tohumlama aşırı kalabalık organoidler yol açar, her organoid kötü büyüme ile kültürleri işleme zorluk la sonuçlanır. Deneysel koşulları optimize etmek için başlangıçta farklı sayıda hücreye sahip birden fazla plakanın kurulması kuvvetle önerilmektedir. İlk tümör hücrelerinin doğru sayıda belirlenmesi ve en yüksek hücre canlılığı elde etmek ve başarılı mesane tümör organoidler kurmak için çok önemlidir. Ayrıca, passaging olmadan 2 hafta boyunca uzun vadeli kültürde, çoğu tümör organoidler büyümeyi durdurmak, potansiyel organoidlerin merkezinde besin yetersiz kaynağı ve bazal membran matris büyüme faktörü nün tükenmesi nedeniyle. Bu nedenle, zamanında organoidler subculturing tümör organoid kültürünü korumak için kritik bir adımdır.
İkinci olarak, yüksek titrekli lentiviral partiküllerin üretimi tümör organoidlerinin etkili genetik manipülasyonu için önemlidir. Virüs titretine bağlı sorunları gidermek için, lentiviral yapılar değişen verimlilikte viral parçacıklar üretme eğiliminde olduğu için virüs titrelerinin her seferinde viral transdüksiyondan önce belirlenmesi kuvvetle önerilmektedir. Tümör organoidleri viral enfeksiyon sonrasında düşük canlılık sergilerse, viral titrelerin potansiyel olarak çok yüksek olması muhtemeldir. Bu durumda daha düşük miktarda virüs kullanılması kuvvetle önerilmektedir. Üçüncü olarak, BBN'ye bağlı mesane tümörü organoidlerinin ortotopik nakli sırasında mesane duvarının bütünlüğünün korunması çok önemlidir. Enjeksiyonun mesane duvarı tabakasına girerek mesanenin lümenine ulaşması durumunda deney sonlandırılmalı ve atılmalıdır. Mümkünse ultrason görüntüleme sistemi ile mesane tümörü büyümesinin izlenmesi önerilir.
Mevcut tekniklerin bir sınırlama bu organoidlerde tümör mikroçevre veya stroma yokluğudur. Bu sorunun üstesinden gelmek için, tümör organoidlerinin ortotopik transplantasyonunun yerli tümör mikroçevresini taklit etmek için in vivo sistemi kullanması kuvvetle önerilmektedir. Gelecekte tümör stromasının diğer bileşenleri ile tümör organoidlerinden oluşan 3 Boyutlu in vitro organoid sistemlerin geliştirilmesi gerekecektir.
Tekniğimizin en önemli etkilerinden biri, tümör organoidlerinin ortotopik transplantasyonunda, sadece 10 mesane tümörü organoidinin mesanede tümör büyümesine neden olmasıdır. 5 x 105-1 x 106 tek mesane tümör hücresi gerektiren konvansiyonel tümör transplantasyonu deneylerine kıyasla yöntemlerimiz çok daha verimli ve sağlamdır. Bir diğer önemli fark ise, organoidlerin kısa saç tokası RNA, CRISPR-Cas9 sistemi veya ilgi genleri içeren lentiviral yapılar gibi çeşitli lentiviral vektörler kullanılarak çeşitli şekillerde manipüle edilebiliyor olmasıdır. Bu mevcut organoid teknoloji eklemek için güçlü araçlar olacaktır. Genel olarak, burada sunulan deneysel yaklaşımlar 2D mesane kanseri hücre hatları kullanarak yerine mesane kanseri patogenezanlayışımızı artırabilir in vitro tümör modellerinin kurulmasını kolaylaştırabilir.
Bu yöntem, kanserojen kaynaklı murin mesane tümöründen elde edilen mesane tümörü organoidlerini saptayabildi. Makale, genetik modifikasyonların uygulandığı ve mesane tümörü organoidlerinde stably olarak sürdürülen lentivirus aracılı deneysel prosedürlerin bir açıklamasını sunmaktadır. Buna ek olarak, tümör organoidlerinin ortotopik transplantasyonu için bir prosedür dahildir. Mevcut in vivo kanser modelleri ile birlikte, bu teknik mesane tümörigenezmoleküler temeli çalışma için yararlı bir araç olacaktır.
Açıklamalar
Yazarlar hiçbir rakip mali çıkarları beyan.
Teşekkürler
Bu araştırma, Kore Ulusal Araştırma Vakfı'nın K.S.'ye verdiği hibelerle desteklenmiştir: NRF-2017R1A2B4006043, NRF-2017M3C7A1047875, NRF-2017R1A5A1015366, Yaratıcı Ekonomi Lider Teknoloji Geliştirme Programı (SF317001A), POSCO (2018Y060) ve BK21 Plus Araştırma Bursu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.45 µm syringe filter (PES membrane) | Millipore | SLHP033RS | |
| 10 cm culture plate | Eppendorf | 0030-702-115 | |
| 90 mm Petri dish | SPL | 10090 | |
| 100 µm cell strainer | Corning | 352360 | |
| 15 mL conical tube | SPL | 50015 | |
| 24-well plate | Corning | 3526 | |
| 29 G 1/2 insulin syringe | SHINA | B299473538 | |
| 3 mL syringe | Norm-ject | N7.A03 | |
| 50 mL conical tube | SPL | 50050 | |
| A8301 | Tocris | 2939 | stock concentration: 25 mM |
| Absolute ethanol | Daejung | 4023-2304 | |
| Absorbable suture | Henry Schein | 039010 | |
| Advanced DMEM/F-12 | Thermo | 12634028 | |
| Ammonium-chloride-potassium (ACK) lysing buffer | Thermo | A1049201 | |
| B-27 | Gibco | 17504-044 | stock concentration: 50X |
| BBN(N-butyl-N-(4-hydroxybutyl) nitrosamine) | Tokyo Chemical Industry | B0938 | |
| Blue nylon 5/0-13mm | AILEE | NB521 | |
| C57BL Mouse | The Jackson Laboratory | 000664 | |
| CAnN.Cg-Foxn1nu/Crl (nude mouse) | Charles River | 194 | |
| Collagenase type I | Thermo | 17100017 | stock concentration: 20 mg/mL |
| Collagenase type II | Thermo | 17100015 | stock concentration: 20 mg/mL |
| Collagenase/dispase | Sigma | 10269638001 | stock concentration: 1 mg/mL |
| Cyrovial | Corning | 430488 | |
| DMEM(Dulbecco's modified minimum essential media) | Gibco | 11965-118 | |
| DMSO(Dimethyl sulfoxide) | Sigma | D8418 | |
| DPBS(Dulbecco's phosphate-buffered saline) | Welgene | LB 001-02 | |
| Enrofloxacin (Baytril) | Bayer Healthcare | DIN: 02169428 | |
| FBS(Fetal bovine serum) | Millipore | ES009B-KC | |
| Glutamax | Gibco | 35050061 | 100X |
| HEK 293T | ATCC | CRL-11268 | |
| HEPES(4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid) | Welgene | BB001-01 | |
| Isoflurane | Hana Pharm Co., Ltd. | ||
| Ketoprofen (Anafen) | Merial | DIN: 02150999 | |
| Matrigel growth factor reduced (GFR) Growth Factor Reduced (GFR) | Corning | 354230 | use for organoid culture in plate |
| Matrigel high concentration (HC) | Corning | 354248 | use for organoid transplantation |
| 1.5 mL microtube | Axygen | MCT-150-C | |
| LT1 transfection reagent | Mirus Bio | MIR 2300 | |
| murine EGF(epidermal growth factor) | Peprotech | 315-09 | stock concentration: 100 µg/mL |
| N-acetyl-L-cysteine | Sigma | A9165 | stock concentration: 200 mM |
| Nicotinamide | Sigma | N0636 | stock concentration: 1M |
| Opti-MEM | Gibco | 31985070 | |
| pCMV.R 8.74 | Addgene | 22036 | Packaging plasmid |
| Penicillin/streptomycin | Gibco | 15140122 | 100X |
| pMD2.G | Addgene | 12259 | Envelope plasmid |
| Polybrene(hexadim ethrine bromide) | Sigma | H9286 | stock concentration: 2 µg/mL |
| pSiCoR | Addgene | 11579 | Lentiviral plasmid |
| Razor blade | |||
| Saline buffer | JW Pharmaceutical | ||
| SW41Ti swinging bucket rotor | Beckman Coulter | ||
| Thermolysin, Bacillus thermoproteolyticus | Millipore | 58656-2500KUCN | stock concentration: 250 KU/mL |
| Trypsin-EDTA (0.25%) | Gibco | 25200072 | |
| Ultracentrifugation tube | Beckman Coulter | 331372 | |
| Y-27632 dihydrochloride | Abmole | M1817 | stock concentration: 10 mM |
Referanslar
- Sanli, O., et al. Bladder cancer. Nature Reviews Disease Primers. 3, 17022 (2017).
- Stenzl, A., et al. Treatment of muscle-invasive and metastatic bladder cancer: update of the EAU guidelines. European Urology. 59 (6), 1009-1018 (2011).
- Barretina, J., et al. The Cancer Cell Line Encyclopedia enables predictive modelling of anticancer drug sensitivity. Nature. 483 (7391), 603 (2012).
- Caponigro, G., Sellers, W. R. Advances in the preclinical testing of cancer therapeutic hypotheses. Nature Reviews Drug Discovery. 10 (3), 179 (2011).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407 (2018).
- Fatehullah, A., Tan, S. H., Barker, N. Organoids as an in vitro model of human development and disease. Nature Cell Biology. 18 (3), 246 (2016).
- Pauli, C., et al. Personalized in vitro and in vivo cancer models to guide precision medicine. Cancer discovery. 7 (5), 462-477 (2017).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- van de Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Lee, S. H., et al. Tumor evolution and drug response in patient-derived organoid models of bladder cancer. Cell. 173 (2), 515-517 (2018).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Huang, L., et al. Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell-and patient-derived tumor organoids. Nature Medicine. 21 (11), 1364 (2015).
- Gao, D., et al. Organoid cultures derived from patients with advanced prostate cancer. Cell. 159 (1), 176-187 (2014).
- Broutier, L., et al. Human primary liver cancer–derived organoid cultures for disease modeling and drug screening. Nature Medicine. 23 (12), 1424 (2017).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Kim, S., et al. Epigenetic regulation of mammalian Hedgehog signaling to the stroma determines the molecular subtype of bladder cancer. eLife. 8, 43024 (2019).
- Shin, K., et al. Cellular origin of bladder neoplasia and tissue dynamics of its progression to invasive carcinoma. Nature Cell Biology. 16 (5), 469 (2014).
- Fu, C. L., Apelo, C. A., Torres, B., Thai, K. H., Hsieh, M. H. Mouse bladder wall injection. JoVE (Journal of Visualized Experiments). (53), e2523 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır