A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
LINE-1 تحليل الميثيل في الخلايا الجذعية Mesenchymal تعامل مع الحويصلات خارج الخلية المستمدة من العظام
In This Article
Summary
وصف هنا هو استخدام طريقة تضخيم مسبار خاص بالميثيل لتحليل مستويات الميثيل من عناصر LINE-1 في الخلايا الجذعية المتوسطة المعالجة بالحويصلات خارج الخلية المشتقة من عظم العظم. كما يتم إظهار التّيسق، وهو إجراء شائع لفصل الحويصلات خارج الخلية عن مصل الأبقار الجنينية.
Abstract
تضخيم مسبار خاص بالميثيل (MSPA) هو تقنية بسيطة وقوية يمكن استخدامها للكشف عن الاختلافات النسبية في مستويات الميثيل لعينات الحمض النووي. فمن الحيلة، ويتطلب كميات صغيرة من الحمض النووي، ويأخذ حوالي 4-5 ساعة من العمل العملي على. في التقنية المعروضة ، يتم تشويه عينات الحمض النووي أولاً ثم يتم هجينها إلى تحقيقات تستهدف الحمض النووي في مواقع الميثيل أو المواقع المرجعية كتحكم. يتم فصل الحمض النووي المهجن إلى ردود فعل متوازية ، واحدة تخضع لربط فقط والأخرى تخضع للربط تليها هضم HhaI-بوساطة في تسلسل GCGC غير الميثيلي. يتم تضخيم شظايا الحمض النووي الناتجة عن ذلك بواسطة PCR وفصلها بواسطة الكهربية الشعرية. لا يتم هضم مواقع GCGC الميثيلية بواسطة HhaI وتنتج إشارات الذروة ، في حين يتم هضم مواقع GCGC غير المثيلة ولا يتم إنشاء إشارات الذروة. مقارنة قمم التحكم تطبيع الإصدارات المهضومة وغير المهضومة من كل عينة يوفر نسبة جرعة الميثيل من عينة الحمض النووي. هنا ، يستخدم MSPA للكشف عن آثار الحويصلات خارج الخلية المستمدة من العظام (EVs) على حالة الميثيل للعنصر النووي - 1 (LINE-1) في الخلايا الجذعية المتوسطة. LINE-1s هي عناصر الحمض النووي المتكررة التي عادة ما تخضع لنقص الميثيل في السرطان، وبهذه الصفة، يمكن أن تكون بمثابة علامة بيولوجية. كما يستخدم التضاريس كأسلوب فعال من حيث التكلفة لفصل الحويصلات خارج الخلية عن السوائل البيولوجية (أي عند إعداد مصل الأبقار الجنيني المستنفد EV-DEPLETD [FBS] وعزل المركبات الكهربائية من هشاشة العظام وسائل الإعلام المكيفة [centrifugation التفاضلية]). ولتحليل المثيلة، تم تصميم مسابير LINE-1 المخصصة لاستهداف ثلاثة مواقع للمثيلة في تسلسل مروج LINE-1 وسبعة مواقع تحكم. يوضح هذا البروتوكول استخدام MSPA لتحليل مثيلة LINE-1 ويصف إعداد FBS المستنفدة EV عن طريق التضاريس.
Introduction
ميثيل الحمض النووي هو تعديل لاجيني كبير يحدث في الخلايا البشرية. تشير ميثيلات الحمض النووي إلى ارتباط مجموعات الميثيل بمخلفات السيتوزين في dinucleotides CpG. وعادة ما توجد هذه dinucleotides في مجموعات (جزر CpG) في منطقة 5 'من الجينات1. في الخلايا الطبيعية ، توجد معظم هذه الدينوكليوتيدات في حالة غير ميثيلية ، مما يسمح بتدوين الحمض النووي. وبالمناسبة، ترتبط العديد من أنواع السرطان مع جزر CpG hypermethylated وإسكات النسخ2، وخاصة في الجينات مثبطة الورم، والتي بدورها تسهم في السمات المختلفة للسرطان3.
ومن ناحية أخرى، فإن العناصر النووية التي تتخللها طويلاً - 1 (LINE-1s أو L1s) هي عناصر متكررة وقابلة للتبديل في الحمض النووي تتسم عادة بمستويات عالية من الميثيل في جزر CpG. ميثيل LINE-1 يمنع نقل ويساعد على الحفاظ على سلامة الجينوم. في عدة أنواع من السرطان ، هو hypomethylated LINE-1 ، مما يؤدي إلى التنشيط وعدم الاستقرار الكروموسومي بوساطة الرجعيةاللاحقة 4. LINE-1 يمثل ما يقرب من 17٪ من الجينوم البشري5، وحالة الميثيل قد تكون بمثابة مؤشر على مستويات مثيلة الجينوم العالمية6. ويعتبر نقص الميثيل العالمي LINE-1 أن تسبق انتقال الخلايا إلى النمط الظاهري الورم7; ولذلك، فإنه يحمل الوعد كعلامة محتملة لظهور السرطان في وقت مبكر.
حاليا، هناك عدة طرق لتحليل الميثيل، بما في ذلك التسلسل الحراري، PCR الميثيل محددة، microarrays، والهطول المناعي الكروماتين1. كما أتاح استخدام الجيل التالي من التسلسل إدراج نُهج على نطاق الجينوم للكشف عن ميثيل الحمض النووي. ويعتمد العديد من هذه الطرق على الحمض النووي المعالج ببسلفيت، حيث يتم تحويل السيتوسينات غير الميثيلية إلى الأوراسيل وتبقى السيتوسينات الميثيلية دون تغيير. ومع ذلك ، فإن العمل مع الحمض النووي المعالج ببيسلفيت له العديد من المزالق ، مثل التحويلات غير الكاملة للسيتوسائبين غير الميثيلية إلى uracil ، والتضخيم المتحيز للتسلسل ، وأخطاء التسلسل8.
في تضخيم المسبار الخاص بالميثيل (MSPA) ، تستهدف المسابير المكونة من اثنين من oligonucleotides تسلسل الحمض النووي الذي يحتوي على موقع تقييد (GCGC) لإنزيم تقييد HhaI9الحساس للمثيلة . بعد أن يتم تهجين المجسات إلى الحمض النووي، تنقسم كل عينة إلى مجموعتين. تخضع المسابير في المجموعة الأولى للربط ، في حين تخضع المسابير في المجموعة الثانية للربط تليها هضم HhaI-بوساطة في مواقع CGCG غير ميثيلية. ثم يتم تضخيم كل من مجموعات العينات عن طريق PCR، ويتم فصل المنتجات عن طريق الكهربية الشعرية. يتم هضم المسابير في المواقع غير المثيلة بواسطة HhaI ولا يتم تضخيمها أثناء PCR ، مما يؤدي إلى عدم وجود إشارات الذروة. وعلى النقيض من ذلك، فإن المسابير في المواقع المثيلة محمية من الهضم وبالتالي يتم تضخيمها أثناء PCR، مما يولد فيما بعد إشارات الذروة10.
MSPA لديها العديد من المزايا على الأساليب البديلة. أولاً، يتطلب كمية منخفضة من الحمض النووي (50-100 نانوغرام) وهو مناسب تمامًا لتحليل الحمض النووي من عينات البارافين المضمنة المثبتة على الفورين10. فإنه لا يتطلب الحمض النووي البسولفيت المعالجة; في الواقع، هو غير مناسب للحمض النووي الذي يتم تعديله بهذه الطريقة. ويمكن تحليل العديد من العينات في نفس الوقت، ويمكن تصميم مسابير MSPA بحيث تستهدف جينات أو تسلسلات متعددة في وقت واحد. بالإضافة إلى ذلك ، فإن المسابر محددة وحساسة للحمض النووي الميثيلي حيث يتوافق موقع تقييد HhaI مع تسلسل نموذجي لجزر CpG10.
بحثت هذه الدراسة آثار الفسيخ اتوستيساركوما (OS) المشتقة خارج الخلية (EVs) على مثيلة LINE-1 في الخلايا الجذعية المتوسطة المشتقة من الأنسجة الدهنية (AT-MSCs؛ الشكل 1). المركبات الكهربائية هي نانوية الحجم، حويصلات مرتبطة بالأغشية تفرزها معظم أنواع الخلايا. أنها تحمل البروتينات والدهون والحمض النووي الريبي وميكرورنا، وجزيئات إضافية من الخلايا الأم11،12. المركبات التوسط الاتصالات بين الخلايا وتلعب أدوارا هامة في العديد من الظروف الفيزيولوجية المرضية13،14. أظهرت دراسة حديثة أن المركبات الكهربائية المشتقة من السرطان قد تنقل LINE-1 النشط إلى الخلايا المتلقية15. وقد أفيد في وقت سابق أن المركبات الكهربائية من خط الخلية HOS-143B يمكن أن تغير حالة الميثيل من LINE-1 في MSCs، بالإضافة إلى الآثار الوراثية الأخرى16.
عند نمو الخلايا لعزل EV ، من المهم استخدام مصل الأبقار الجنينالمستنفد EV [FBS] في وسط النمو ، لأن المركبات الكهربائية المشتقة من FBS قد تتداخل مع المركبات الكهربائية من مصادر أخرى وتعوق النتائج17،18. Ultracentrifugation هي واحدة من الطرق الأكثر شيوعا لاستنفاد السيارات الكهربائية من FBS. وهو إجراء بسيط نسبيا وفعالة من حيث التكلفة بالمقارنة مع بدائل مثل الترشيح الفائق والتجارية EV-المستنفدة FBS19. هنا ، يوضح البروتوكول أيضًا كيفية إعداد FBS المستنفد ة EV عن طريق التضاريس.
تقدم هذه المقالة بروتوكولًا مفصلًا للتقنيات المذكورة أعلاه ، من عزل المركبات الكهربائية من خط خلية نظام التشغيل إلى تحليل الميثيل من LINE-1 في OS-EV MSCs المعالجة(الشكل 1).
Protocol
وافقت لجنة الأخلاقيات في هلسنكي ومنطقة مستشفى أوسيما (الموافقة الأخلاقية رقم 217/13/03/02/2015).
1. إعداد FBS المنضب EV عن طريق التضاريس
- تأخذ FBS في (فائقة) أنابيب الطرد المركزي ووضعها في دلاء الطرد المركزي فائقة. لضمان أن ultracentrifugation يعمل بسلاسة وأمان، وتحقيق التوازن بين الدلاء داخل 10 ملغ من بعضها البعض.
- تحميل الدلاء على الدوار يتأرجح (نوع SW28، k-عامل 246). ضع الدوار في جهاز الطرد المركزي الفائق واركض على 100,000 × ز لمدة 19 ساعة عند درجة حرارة 4 درجات مئوية.
- اجمع بعناية الطبقة العليا ذات الألوان الفاتحة من الـ supernatant (حوالي تسعة أعشار) ونقلها إلى أنبوب 50 مل. لا تزعج أو ماصة بيليه البني الداكن، كما أنه يحتوي على المركبات الكهربائية من FBS.
- تمرير supernatant من خلال مرشح 0.22 ميكرومتر في أنبوب جديد 50 مل.
- إضافة تصفية تعقيمها، EV-المستنفدة FBS إلى وسائط ثقافة الخلية عند الخلايا المتنامية لعزل EV.
2. عزل المركبات الكهربائية المشتقة من هشاشة العظام
- خلايا نظام التشغيل لوحة (خط الخلية HOS-143B) في قارورة T-175 مع RPMI 1640 المتوسطة, تستكمل مع FBS العادي 10% والمضادات الحيوية 1% (100 U/mL البنسلين, 0.1 ملغ/مل ستريبتومسين). ضع القارورة في حاضنة عند 37 درجة مئوية و5% ثاني أكسيد الكربون2.
- عندما تكون القارورة 70٪ -80٪ متشنجة، اغسل الخلايا بالمالحة العازلة بالفوسفات (PBS) ثم قم بزراعتها في الوسائط التي تحتوي على 10٪ من FBS المستنفدة EV (يشار إليها فيما بعد باسم الوسائط المستنفدة EV).
ملاحظة: 1 × 106 خلايا HOS-143B مطلية في قارورة T175 تصل إلى 70٪ التقاء بعد حوالي 60 ساعة. - خلال 48 ساعة القادمة, جمع وسائل الإعلام مشروطة من خلايا هشاشة العظام بعد كل 24 ساعة وإضافة وسائل الإعلام المنضب EV جديدة.
- الطرد المركزي وسائل الإعلام مكيفة في 2500 × ز لمدة 20 دقيقة في 4 درجة مئوية لإزالة الخلايا وحطام الخلايا. نقل supernatant إلى أنبوب جديد، وترك حوالي 2 مل من وسائل الإعلام في الجزء السفلي.
ملاحظة: إذا لم يتم المتابعة مباشرة مع عزل EV في هذه المرحلة، يمكن تخزين supernatant في -80 oC. - صب supernatant في أنابيب الطرد المركزي فائقة التوازن بينهما كما في وقت سابق. الطرد المركزي الأنابيب في 100،000 × ز ل2 ساعة في 4 درجة مئوية.
- تجاهل بعناية supernatant، وترك حوالي 1 مل في الجزء السفلي. إضافة حوالي 20 مل من PBS (0.1 ميكرومتر تصفيتها) إلى أنبوب وماصة بلطف لغسل وإعادة تعليق بيليه EV.
- توازن بين الأنابيب وأداء جولة أخرى من الإعدادات فائقة الإنضاق مع نفس الإعدادات.
- قم بإزالة supernatant بعناية وإعادة تعليق بيليه EV في 200 ميكرولتر من PBS بواسطة الأنابيب لطيف. تخزين المركبات الكهربائية في أنابيب ملزمة منخفضة.
ملاحظة: يمكن استخدام المركبات الكهربائية على الفور أو تخزينها في -80 درجة مئوية حتى تكون هناك حاجة إليها.
3. توصيف OS-EVs
ملاحظة: يمكن أن تتميز المركبات الكهربائية المنقية بالنشاف الغربي (WB) وتحليل تتبع الجسيمات النانوية (NTA) والمجهر الإلكتروني للإرسال (TEM)16.
- أداء البنك الدولي وفقا للبروتوكول القياسي16 مع علامات EV CD63، TSG101، وHsp70، ومع calnexin كتحكم سلبي للإشارة إلى نقاء عينة EV20.
- بالنسبة لـ NTA ، تمييع عينة EV لأول مرة في 0.1 ميكرومتر تمت تصفيتها من PBS Dulbecco للحصول على (مثالي) 30-100 جسيم لكل إطار.
- خذ حوالي 500 ميكرولتر من العينة في حقنة 1 مل وحمّلها في منفذ الدخول لأداة NTA. تأكد من وجود ما يكفي من الجسيمات لكل إطار، لإجراء قياسات دقيقة.
- افتح برنامج NTA وسجل خمسة مقاطع فيديو مدتها 60 عامًا، باستخدام مستوى الكاميرا 13 في درجة الحرارة المحيطة. أثناء التحليل، استخدام عتبة الكشف = 5 وكسب = 10.
- تحليل عينات EV بواسطة TEM كما هو موضح سابقا21.
4- ثقافة AT-MSC
ملاحظة: تم توفير الأنسجة الدهنية البشرية لعزل الخلايا الجذعية المتوسطة كما شفط الدهون كما يستنشق (قسم الجراحة التجميلية، ليزر Tilkka المحدودة، فنلندا). تم أخذ الموافقة المكتوبة المستنيرة من المتبرعين lipoaspirate، الذين كانوا يخضعون لإجراءات شفط الدهون الاختيارية.
- عزل AT-MSCs من شفط الدهون المناضوئية باستخدام أساليب العزل الميكانيكية والأنزيمية القياسية22.
ملاحظة: يمكن أيضًا استخدام MSCs من مصادر أخرى (بما في ذلك خطوط الخلايا التجارية). - الخلايا الثقافة في وسائل الإعلام DMEM/F-12 تستكمل مع FBS 10٪ والمضادات الحيوية 1٪.
5. علاج MSCs مع OS-EVs
- لوحة 15،000 AT-MSCs لكل بئر في لوحة 24 جيدا.
- بعد 24 ساعة، قم بإزالة الوسائط القديمة، واغسل الخلايا مع برنامج تلفزيوني، وغيّر إلى وسائط مستنفدة من EV.
- علاج الخلايا مع OS-EVs (بتركيز جسيمات 1 × 106 مركبات مقابل لكل خلية) في اليوم 1 (24 ساعة بعد التصاق الخلية)، واليوم 3 (48 ساعة بعد اليوم 1)، واليوم 5 (96 ساعة بعد اليوم 1).
- وقف العلاج OS-EV لنقاط زمنية (TP) 0 عينات في اليوم 1، TP 3 عينات في اليوم 3 وTP 7 عينات في اليوم 7 (48 ساعة بعد اليوم 5).
ملاحظة: يمكن أيضًا اتباع جداول نقاط زمنية أخرى حسب الخطط التجريبية.
- وقف العلاج OS-EV لنقاط زمنية (TP) 0 عينات في اليوم 1، TP 3 عينات في اليوم 3 وTP 7 عينات في اليوم 7 (48 ساعة بعد اليوم 5).
- استخراج الحمض النووي من MSCs باستخدام طريقة مناسبة. تضمين عينات التحكم الإيجابية والسلبية لتحليل البيانات.
6. LINE-1 مبهي ة القياس
- تصميم التمهيديات التحقيق LINE-1 مخصصة، كما فعلت سابقا من قبل بافيتشيتشوآخرون. بالنسبة لمسات الميثيل، حدد ثلاثة تسلسلات تحتوي على موقع تقييد HhaI داخل منطقة المروج من LINE-1. بالنسبة لمسبر التحكم، حدد سبعة تسلسلات تفتقر إلى موقع تقييد HhaI من بقية تسلسل LINE-1.
ملاحظة: يتوفر تسلسل LINE-1 في قاعدة بيانات GenBank24 (L1.2، لا الانضمام. AH005269.2). استخدم تعليمات الشركة المصنعة MSPA لتصميم المجسات25. - تمييع 70 نانوغرام من عينة الحمض النووي في العازلة TE إلى حجم 5 ميكرولتر.
- تنفيذ خطوات الدراجات الحرارية وPCR اللاحقة على النحو المذكور في الجدول 1. سخني العينات لمدة 10 دقيقة عند درجة حرارة 98 درجة مئوية، ثم ابردي إلى 25 درجة مئوية.
- إضافة 3 ميكرولتر من مزيج التهجين التحقيق إلى كل عينة وتشغيل cycler للسماح للتحقيقات لتهجين إلى الحمض النووي.
- في درجة حرارة الغرفة (RT)، أضف 13 ميكرولتر من مزيج ما بعد التهجين إلى كل عينة. نقل 10 ميكرولتر إلى أنبوب ثان.
- ضع كلتا المجموعتين من الأنابيب في cycler واحتضان في 48 درجة مئوية لمدة 1 دقيقة على الأقل.
- في حين أن العينات هي في 48 درجة مئوية، إضافة 10 ميكرولتر من مزيج الربط إلى المجموعة الأولى من الأنابيب (سلسلة غير مهضومة) و 10 ميكرولتر من مزيج الربط والهضم إلى المجموعة الثانية من الأنابيب (سلسلة مهضومة). تشغيل برنامج cycler المقبل.
- قم بتدوير الأنابيب وقم بتعيين cycler في وقت واحد إلى 72 درجة مئوية.
- إضافة 5 ميكرولتر من مزيج البوليميراز إلى كل أنبوب ووضع الأنابيب في cycler. تشغيل برنامج PCR.
- أثناء تشغيل برنامج PCR، قم بإعداد محلول من 1 مل formamide يحتوي على 2.5 ميكرولتر من معيار الحجم. ماصة 10 ميكرولتر من هذا الحل إلى كل بئر من لوحة بئر 96 البصرية (مع الباركود).
- بعد PCR، تمييع العينات غير المهضومة والمهضومة إلى 1:100 و 1:200 على التوالي في الماء فائق النقاء. أضف 2 ميكرولتر من منتج PCR المخفف إلى لوحة 96 جيدا. طرد مركزي لوحة في 200 × ز لمدة 15-20 s لإزالة فقاعات الهواء.
- إجراء تحليل جزء من العينات عن طريق الكهربية الشعرية.
ملاحظة: يجب تخزين اللوحة عند 4 درجات مئوية في الظلام حتى التحليل.
7 - تحليل البيانات المجزأة
- افتح نتائج الكهربية الشعرية في برنامج تحليل تخطيط كهربي.
- تحت عمود الفريق، لواحدة من العينات، اختر MLPA من القائمة. انقر على رأس اللوحة واضغط على Ctrl + D لتطبيق MLPA على جميع العينات.
- بنفس الطريقة، قم بتعيين أسلوب التحليل إلى الافتراضي Microsatellite لكافة العينات.
- حدد جميع العينات وانقر على زر التشغيل الأخضر لتحليل العينات وفقا للإعدادات المختارة.
- حدد جميع العينات وانقر على زر الرسم البياني لتصور قمم التحقيق.
- تكبير منطقة الذروة للحصول على دقة أعلى من قمم التحقيق الفردية. تأكد من أن جميع القمم 10 المقابلة للتحقيقات من LINE-1 التحقيق مزيج هي المسمى. تجاهل قمم إضافية (<95 نقطة أساس و > 160 نقطة أساس).
- في علامة التبويب "الأنماط الجينية"، قم بتصدير النتائج بتنسيق القيم المنفصلة بفاصلة (CSV).
- افتح ملف CSV في برنامج تحليل البيانات وفرز البيانات إلى أعمدة.
- قم بتسمية قمم موقع الميثيل الثلاثة استنادًا إلى أحجامها التقريبية (L1-1m عند 153 bp ، L1-2m عند 119 bp ، L1-3m عند 133 bp). وتتوافق القمم السبع المتبقية مع مسابجة التحكم.
ملاحظة: هنا، يتم استخدام قيم قمم التحقيق L1-2m، والتي لها حجم 117 نقطة أساس، منذ تم استخدام تلك المنطقة في معظم المقالات المثيلة LINE-123. - لكل عينة (غير مهضومة ومهضومة)، احسب مساحة ذروة المجموع لجميع قمم التحكم السبع. قسمة منطقة الذروة لكل مسبار LINE-1 على هذا المجموع.
- لكل عينة من الحمض النووي، قم بتقسيم قيمة العينة المهضومة على عينة العينة غير المهضومة للحصول على نسبة جرعة الميثيل (DM)باستخدام المعادلة التالية:
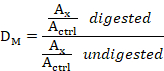
حيث: DM هو نسبة جرعة الميثيل، Ax هي المنطقة تحت الذروة x (على سبيل المثال، L1-2m الذروة)،وA ctrl هو مجموع منطقة الذروة لجميع تحقيقات التحكم السبعة.
- قم بتسمية قمم موقع الميثيل الثلاثة استنادًا إلى أحجامها التقريبية (L1-1m عند 153 bp ، L1-2m عند 119 bp ، L1-3m عند 133 bp). وتتوافق القمم السبع المتبقية مع مسابجة التحكم.
النتائج
وكان الهدف الرئيسي من هذه الدراسة هو تقييم الآثار اللاجينية لنظام التشغيل -EVs على MSCs. تم عزل OS-EVs من خلايا HOS-143B باستخدام طريقة الطرد المركزي التفاضلية القياسية. التعبير عن علامات EV النموذجية CD63، Hsp70، وTSG101 من قبل النشاف الغربي أكد وجود OS-EVs. (الشكل2أ). وأشار عدم وجود إش?...
Discussion
توضح هذه الدراسة كيف يمكن استخدام اجتماع الأطراف للكشف عن حالة الميثيل لعنصر وراثي معين وقياسها كمياً. كان LINE-1 هو التركيز هنا، ولكن يمكن تصميم المسابير لاستهداف مجموعة من الجينات والتسلسلات. وعلاوة على ذلك، هناك قائمة متزايدة من يمزج التحقيق المتاحة لمختلف التطبيقات. MSPA هو تقنية بسيطة وق...
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
تم تمويل هذا العمل من خلال تمويل مشروع جامعة هلسنكي (WBS490302، WBS73714112) تمويل مستشفى جامعة هلسنكي الحكومي للبحوث الصحية على المستوى الجامعي (Y1014SUL05، TYH2016130)، المؤسسة الطبية الفنلندية النرويجية، وسلمى و صندوق ماجا - ليزا سيلاندر (مؤسسة مينيرفا). نشكر والتر بافيتشيتش على توفير بروتوكول MSPA المعدل وعلى الدعم الفني ذي الصلة. نحن ممتنون لتيمو ماسالين (جامعة هلسنكي) لمساعدتنا في إنتاج الفيديو.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | Terumo | SS+01T1 | for NTA |
| 24-well plate | Corning | 3524 | MSC cell culture |
| 3730xl DNA Analyzer | Applied Biosystems, ThermoFisher Scientific | 3730XL | |
| 50 mL centrifuge tube | Corning | 430829 | |
| Beckman Optima LE-80K Ultracentrifuge | Beckman | ||
| BlueStar Prestained Protein Marker | Nippon Genetics | MWP03 | WB: protein marker |
| Calnexin (clone C5C9) | Cell Signaling Technology | 2679 | WB, dilution 1:800 |
| CD63 (clone H5C6) | BD Biosciences | 556019 | WB, dilution 1:1000 |
| Centrifuge 5702 R | Eppendorf | 5703000010 | For conditioned media and cells |
| Centrifuge 5810 | Eppendorf | 5810000010 | For spinning down 96-well plate |
| Centrifuge tube (polyallomer, 14x95 mm) | Beckman | 331374 | Ultracentrifugation |
| DMEM/F-12 + GlutaMAX medium | Gibco, Life Technologies | 31331-028 | For AT-MSC culture |
| Fetal bovine serum | Gibco, Life Technologies | 10270-106 | |
| GeneScan 500 LIZ size standard | Applied Biosystems, Life Technologies | 4322682 | for capillary electrophoresis |
| GenomePlex Complete Whole Genome Amplification (WGA) Kit | Sigma | WGA2-10RXN | for MSPA negative control |
| Hi-Di formamide | Applied Biosystems, Life Technologies | 4311320 | for capillary electrophoresis |
| HOS-143B cell line | ATCC | CRL-8303 | |
| Hsp70 (clone 5G10) | BD Biosciences | 554243 | WB, dilution 1:1000 |
| IRDye 800CW Goat anti-mouse | Li-Cor | 926-32210 | WB: secondary |
| IRDye 800CW Goat anti-rabbit | Li-Cor | 926-32211 | WB: secondary |
| LINE-1 probe-mix primers | IDT | Sequences in Table 1 | |
| MicroAmp Optical 96-well reaction plate with barcode | Applied Biosystems, Life Technologies | 4306737 | also requires sealing film |
| Micro BCA Protein Assay kit | ThermoFisher Scientific | 23235 | measure protein concentration |
| MiniProtean TGX 10% gels | Bio-Rad | 456-1034 | WB: gel electrophoresis |
| NanoSight LM14C | Malvern Instruments | for NTA | |
| Nitrocellulose membrane 0.2 µm | Bio-Rad | 1620112 | WB: protein transfer |
| NucleoSpin Tissue XS | Macherey-Nagel | 740901.50 | for DNA extraction |
| Odyssey Blocking Buffer | Li-Cor | 927-40000 | WB: blocking, antibodies |
| PBS, 1X | Corning | 21-040-CVR | |
| Penicillin-streptomycin | Gibco, Life Technologies | DE17-602E | Antibiotics for culture media |
| Protein LoBind tube, 0.5 mL | Eppendorf | 22431064 | For storing Evs |
| REVERT Total Protein Stain and Wash Solution Kit | Li-Cor | 926-11015 | WB: total protein staining |
| RKO cell line | ATCC | CRL-2577 | for MSPA positive control |
| RPMI medium 1640 + GlutaMAX | Gibco, Life Technologies | 61870-010 | For HOS-143B cell culture |
| SALSA MLPA HhaI enzyme | MRC-Holland | SMR50 | |
| SALSA MLPA reagent kit | MRC-Holland | EK1-FAM | |
| SALSA MLPA P300 probe-mix | MRC-Holland | P300-100R | |
| Swinging rotor SW-28 | Beckman Coulter | 342207 | Ultracentrifugation |
| Syringe filter, 0.22 µm | Jet Biofil | FPE-204-030 | sterile filtering FBS |
| Tecnai 12 | FEI Company | equipped with Gatan Orius SC 1000B CCD-camera (Gatan Inc., USA); for TEM | |
| TBS, 1X tablets | Medicago | 09-7500-100 | WB: buffer |
| Trans-Blot Turbo | Bio-Rad | WB: transfer | |
| Thermal cycler | ThermoFisher Scientific | TCA0096 | |
| TrypLE Express | Gibco | 12604-021 | for trypsinization of cells |
| TSG101 (clone 4A10) | Sigma | SAB2702167 | WB, dilution 1:500 |
References
- Esteller, M. Cancer epigenomics: DNA methylomes and histone-modification maps. Nature Reviews Genetics. 8, 286-298 (2007).
- Herman, J. G., Baylin, S. B. Gene silencing in cancer in association with promoter hypermethylation. New England Journal of Medicine. 349, 2042-2054 (2003).
- Hanahan, D., Weinberg, R. A. Hallmarks of Cancer: The Next Generation. Cell. 144 (5), 646-674 (2011).
- Howard, G., Eiges, R., Gaudet, F., Jaenisch, R., Eden, A. Activation and transposition of endogenous retroviral elements in hypomethylation induced tumors in mice. Oncogene. 27, 404-408 (2008).
- Lander, E. S., et al. Initial sequencing and analysis of the human genome. Nature. 409, 860-921 (2001).
- Rodriguez, J., et al. Chromosomal instability correlates with genome-wide DNA demethylation in human primary colorectal cancers. Cancer Research. 66, 8462 (2006).
- Feinberg, A. P., Ohlsson, R., Henikoff, S. The epigenetic progenitor origin of human cancer. Nature Reviews Genetics. 7, 21-33 (2006).
- Bock, C., et al. BiQ Analyzer: visualization and quality control for DNA methylation data from bisulfite sequencing. Bioinformatics. 21 (11), 4067-4068 (2005).
- Schouten, J. P., et al. Relative quantification of 40 nucleic acid sequences by multiplex ligation-dependent probe amplification. Nucleic Acids Research. 30, 57 (2013).
- Nygren, A. O. H., et al. Methylation-Specific MLPA (MS-MLPA): simultaneous detection of CpG methylation and copy number changes of up to 40 sequences. Nucleic Acids Research. 33 (14), 128 (2005).
- El Andaloussi, S., Mager, I., Breakefield, X. O., Wood, M. J. Extracellular vesicles: biology and emerging therapeutic opportunities. Nature Reviews Drug Discovery. 12, 347-357 (2013).
- Vallabhaneni, K. C., et al. Extracellular vesicles from bone marrow mesenchymal stem/stromal cells transport tumor regulatory microRNA, proteins, and metabolites. Oncotarget. 6 (7), 4953-4967 (2015).
- Ratajczak, J., Wysoczynski, M., Hayek, F., Janowska-Wieczorek, A., Ratajczak, M. Z. Membrane- derived microvesicles: important and underappreciated mediators of cell-to-cell communication. Leukemia. 20, 1487-1495 (2006).
- Lee, T. H., et al. Microvesicles as mediators of intercellular communication in cancer- the emerging science of cellular "debris". Seminars in Immunopathology. 33, 455-467 (2011).
- Kawamura, Y., Calle, A. S., Yamamoto, Y., Sato, T., Ochiya, T. Extracellular vesicles mediate the horizontal transfer of an active LINE-1 retrotransposon. Journal of Extracellular Vesicles. 8, 1643214 (2019).
- Mannerström, B., et al. Epigenetic alterations in mesenchymal stem cells by osteosarcoma-derived extracellular vesicles. Epigenetics. 14 (4), 352-364 (2019).
- Shelke, G. V., Lässer, C., Gho, Y. S., Lötvall, J. Importance of exosome depletion protocols to eliminate functional and RNA-containing extracellular vesicles from fetal bovine serum. Journal of Extracellular Vesicles. 3, 24783 (2014).
- Wei, Z., Batagov, A. O., Carter, D. R., Krichevsky, A. M. Fetal bovine serum RNA interferes with the cell culture derived extracellular RNA. Scientific Reports. 6, 31175 (2016).
- Kornilov, R., et al. Efficient ultrafiltration-based protocol to deplete extracellular vesicles from fetal bovine serum. Journal of Extracellular Vesicles. 7, 1422674 (2018).
- Théry, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Current Protocols in Cell Biology. 30 (1), 1-29 (2006).
- Puhka, M., et al. Metabolomic profiling of extracellular vesicles and alternative normalization methods reveal enriched metabolites and strategies to study prostate cancer-related changes. Theranostics. 7 (16), 3824 (2017).
- Peltoniemi, H. H., et al. Stem cell enrichment does not warrant a higher graft survival in lipofilling of the breast: A prospective comparative study. Journal of Plastic, Reconstructive & Aesthetic Surgery. 66 (11), 1494-1503 (2013).
- Pavicic, W., Joensuu, E. I., Nieminen, T., Peltomäki, P. LINE-1 hypomethylation in familial and sporadic cancer. Journal of Molecular Medicine. 90, 827-835 (2012).
- . L1.2 sequence on GenBank (accession number: AH005269.2) Available from: https://www.ncbi.nlm.nih.gov/nuccore/AH005269 (2000)
- Designing synthetic MLPA probes (v04). MRC-Holland Available from: https://support.mlpa.com/downloads/files/designing-synthetic-mlpa-probes (2018)
- . Takara Bio Inc Available from: https://www.takarabio.com/us/products/cell_biology_and_epigenetics/epigenetics/dna_preparation/msre_overview (2018)
- Pisanic, R., et al. Long interspersed nuclear element 1 retrotransposons become deregulated during the development of ovarian cancer precursor lesions. The American Journal of Pathology. 189 (3), 513-520 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved