需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用骨肉瘤衍生细胞外囊泡处理的美相干细胞中的LINE-1甲基化分析
摘要
这里描述的是使用甲基化特异性探针扩增方法分析使用骨肉瘤衍生的细胞外囊泡治疗的中位体干细胞中LINE-1元素的甲基化水平。也演示了超中心化,一种从胎儿牛血清中分离细胞外囊泡的常用程序。
摘要
甲基化特异性探针扩增(MSPA)是一种简单而可靠的技术,可用于检测DNA样本甲基化水平的相对差异。它是足智多谋的,需要少量的DNA,需要大约4~5小时的动手工作。在所提出的技术中,DNA样本首先变性,然后杂交为以甲基化或参考位点的DNA为目标作为对照的探针。杂交DNA被分离成平行反应,一个只进行结扎,另一个进行结扎,随后在未甲基化GCGC序列下HhaI介导消化。由此产生的DNA片段被PCR扩增,并通过毛细血管电泳分离。HhaI 不消化甲基化 GCGC 位点并产生峰值信号,而未甲基化 GCGC 位点被消化,不生成峰值信号。比较每个样本的消化和未消化版本的控制-归一化峰可提供DNA样本的甲基化剂量比。在这里,MSPA用于检测骨肉瘤衍生的细胞外囊泡(EV)对间质干细胞中长穿插核元素1(LINE-1)甲基化状态的影响。LINE-1是重复性DNA元素,通常在癌症中进行低甲基化,以这种能力,可以作为生物标志物。超离心也被用作从生物液体中分离细胞外囊泡的具有成本效益的方法(即,在制备EV耗尽的胎儿牛血清[FBS]和从骨肉瘤调节介质中分离EV[差分离离]时)。对于甲基化分析,定制LINE-1探针设计用于针对LINE-1启动器序列中的三个甲基化位点和七个控制位点。该协议演示了使用MSPA进行LINE-1甲基化分析,并描述了通过超离心制备EV-耗尽FBS。
引言
DNA甲基化是发生在人类细胞中的一种主要的表观遗传修饰。脱氧核糖核酸甲基化是指甲基组与CpG二核苷酸中细胞氨酸残留物的联系。这种核苷酸通常存在于基因1的5'区域的簇(CpG岛)中。在正常细胞中,大多数的二核苷酸处于非甲基化状态,这允许DNA转录。顺便说一句,许多癌症都与高甲基化CpG岛和转录组沉默2有关,特别是在肿瘤抑制基因中,这反过来又促成了癌症3的各种特征。
另一方面,长穿插的核元素1(LINE-1s或L1s)是重复的、可转位DNA元素,在CpG岛屿通常具有高水平的甲基化。LINE-1的甲基化可防止易位,有助于维持基因组的完整性。在几种类型的癌症中,LINE-1被甲基化,导致活化和随后逆转介导染色体不稳定4。LINE-1占人类基因组5的近17%,其甲基化状态可作为全球基因组甲基化水平6的指标。全球LINE-1低甲基化被认为是在细胞过渡到肿瘤表型7之前;因此,它有望成为早期癌症发病的潜在标志物。
目前,甲基化分析有几种方法,包括热测序、甲基化特异性PCR、微阵列和染色质免疫沉淀1。下一代测序的使用也使得有可能纳入全基因组的DNA甲基化检测方法。这些方法中有许多依赖于双硫酸盐处理的DNA,其中未甲基化的细胞氨酸转化为尿素,甲基化的细胞氨酸保持不变。然而,使用双硫酸盐处理的DNA有几个陷阱,如未甲基化的细胞氨酸不完全转化为尿素,有偏颇的序列扩增,和测序错误8。
在甲基化特异性探针扩增(MSPA)中,由两个寡核苷酸靶向DNA序列的探针靶向DNA序列,该DNA序列含有甲基化敏感限制性酶HhaI9的限制性位点(GCGC)。探针杂交为DNA后,每个样本被分成两组。第一组中的探针进行结扎,而第二组中的探针进行结扎,随后在未甲基化CGCG位点进行HhaI介导消化。两组样品然后由PCR放大,产品通过毛细血管电泳分离。未甲基化位点的探针由HhaI消化,在PCR期间不放大,因此没有峰值信号。相比之下,甲基化位点的探针受到保护,防止消化,因此在PCR期间被放大,随后产生峰值信号10。
与替代方法不同,MSPA 具有几个优点。首先,它需要少量的DNA(50-100 ng),非常适合分析从正式固定石蜡嵌入样品10的DNA。它不需要双硫酸盐处理的DNA;事实上,它不适合以这种方式修饰的DNA。可以同时分析许多样品,并设计MSPA探针,以便它们同时针对多个基因或序列。此外,探针是特定和敏感的甲基化DNA,因为HhaI限制位点对应于一个典型的CpG岛屿10序列。
本研究调查了骨肉瘤(OS)衍生的细胞外囊泡(EV)对脂肪组织衍生的中质性干细胞(AT-MSCs;图 1.EV 是纳米级、膜结合的囊泡,由大多数细胞类型分泌。它们携带蛋白质、脂质、mRNA、微RNA和来自母细胞11、12的其他分子。EV调解细胞间通信,并在几种病理生理条件下发挥重要作用13,14。最近的一项研究显示,癌症衍生的EV可能将活性LINE-1转移到受体细胞15。此前有报道称,除了其他遗传效应16外,来自HOS-143B细胞系的EV可以改变MSCs中LINE-1的甲基化状态。
当为EV分离而生长细胞时,在生长培养基中使用EV耗尽的胎儿牛血清[FBS]很重要,因为FBS衍生的EV可能会干扰来自其他来源的EV,并妨碍结果17,18。超中心化是消耗 FBS EV 的最常见方法之一。与超滤和商业EV耗尽FBS19等替代品相比,这是一个相对简单和具有成本效益的程序。在这里,该协议还演示了如何通过超离心来制备EV耗尽的FBS。
本文为上述技术提供了详细的协议,从从OS细胞系分离EV到在OSEV处理MSC中的LINE-1甲基化分析(图1)。
研究方案
这项研究得到了赫尔辛基和乌西马医院区道德委员会的批准(道德批准D.217/13/03/02/2015)。
1. 通过超离心制备EV耗尽FBS
- 将 FBS 放入(超)离心管中,并将其放入超离心桶中。为确保超离心平稳、安全地运行,将水桶彼此平衡在 10 mg 以内。
- 在摆动转子上装载铲斗(SW28 型,k 因子 246)。将转子置于超离心机中,在 4°C 下以 100,000 x g运行 19 小时。
- 小心地收集上清液的浅色上层(约十分之九),并转移到 50 mL 管中。请勿干扰或移液深棕色颗粒,因为它包含来自 FBS 的 EV。
- 通过 0.22 μm 过滤器将上清液传递到新的 50 mL 管中。
- 在培养用于 EV 隔离的细胞时,将过滤灭菌、EV 耗尽的 FBS 添加到细胞培养基。
2. 骨肉瘤衍生EV的隔离
- 带 RPMI 1640 介质的 T-175 烧瓶中的板 OS 细胞(HOS-143B 细胞系),辅以 10% 正常 FBS 和 1% 抗生素(100 U/mL 青霉素,0.1 mg/mL 链霉素)。将烧瓶置于37°C和5%CO2的培养箱中。
- 当烧瓶为70%~80%的汇入时,用磷酸盐缓冲盐水(PBS)清洗细胞,然后在含有10%EV耗尽FBS(以下简称EV耗尽介质)的介质中生长。
注:T175烧瓶中镀有1 x 106 HOS-143B的电池在大约60小时后达到70%的汇合率。 - 在接下来的48小时中,每24小时后从骨肉瘤细胞收集条件介质,并添加新鲜的EV耗尽介质。
- 在 2500 x g下在 4°C 下将调节介质离心 20 分钟,以清除细胞和细胞碎片。将上清液转移到新管中,在底部留下约 2 mL 的介质。
注:如果在此阶段不直接进行 EV 隔离,则上清液可存储在 -80 oC。 - 将上清液倒入超离心管中,并像更早一样平衡它们。在 4°C 下在 100,000 x g下将管离心 2 小时。
- 小心地丢弃上清液,在底部留下大约 1 mL。将约 20 mL 的 PBS(0.1 μm 过滤)加入管中,轻轻清洗和重新悬浮 EV 颗粒。
- 平衡管,并在相同的设置下执行另一轮超离心。
- 通过温和的移液小心地去除上清液,并在 200 μL 的 PBS 中重新悬浮 EV 颗粒。将 EV 存放在低装订管中。
注:电动汽车可以直接使用,也可以储存在-80°C中,直到需要。
3. 操作系统-电动汽车的特征
注:纯化EV的特征可以是西方印迹(WB)、纳米粒子跟踪分析(NTA)和透射电子显微镜(TEM)16。
- 按照标准协议16执行WB,使用EV标记CD63、TSG101和Hsp70,用钙化辛作为负对照,以指示EV样品20的纯度。
- 对于NTA,首先以0.1μm过滤的Dulbeco的PBS稀释EV样品,以获得(理想情况下)每帧30~100个颗粒。
- 将约 500 μL 的样品放入 1 mL 注射器中,并将其加载到 NTA 仪器的进气口中。检查每帧是否有足够的颗粒,以便进行精确测量。
- 打开 NTA 软件,在环境温度下使用摄像机级别 13 录制 5 个持续时间为 60 度的视频。在分析过程中,使用检测阈值 = 5 和增益 = 10。
- 按前21名的 TEM 分析 EV 样本。
4. AT-MSC文化
注:用于间质干细胞分离的人体脂肪组织作为抽脂吸气提供(芬兰激光蒂尔卡有限公司整形外科)。书面知情同意来自脂吸药捐赠者,他们正在接受选择性抽脂手术。
- 使用标准机械和酶分离方法将AT-MSC从抽脂吸吸中分离22。
注:也可使用来自其他来源(包括商用细胞系)的MSC。 - DMEM/F-12培养细胞辅以10%FBS和1%抗生素。
5. 使用 OS-EV 处理 MSC
- 24 孔板中每孔板 15,000 个 AT-MSC 板。
- 24 小时后,取出旧介质,使用 PBS 清洗细胞,并更改为 EV 耗尽介质。
- 在第1天(细胞粘附后24小时)、第3天(第1天后48小时)和第5天(第1天后96小时)使用OS-EV(每细胞的粒子浓度为1 x106 EV)治疗细胞。
- 在第 1 天停止时间点 (TP) 0 样本的 OS-EV 处理,在第 3 天停止 TP 3 样本,在第 7 天(第 5 天之后 48 小时)停止 TP 7 样本。
注:也可以遵循实验计划的其他时间表。
- 在第 1 天停止时间点 (TP) 0 样本的 OS-EV 处理,在第 3 天停止 TP 3 样本,在第 7 天(第 5 天之后 48 小时)停止 TP 7 样本。
- 使用适当的方法从 MSC 中提取 DNA。包括用于数据分析的正负控制样本。
6. LINE-1甲基化测定
- 设计定制的LINE-1探针引体,如之前由Pavicic等人23。对于甲基化探针,选择三个序列,在LINE-1的启动器区域内包含HhaI限制位点。对于控制探测器,从 LINE-1 序列的其余部分选择缺少HhaI 限制站点的七个序列。
注: LINE-1 序列可在 GenBank 数据库24(L1.2,加入编号)上找到。AH005269.2. 使用 MSPA 制造商的说明设计探头25。 - 在TE缓冲液中稀释70纳克的DNA样本至5μL体积。
- 执行表 1中提到的后续热循环和 PCR 步骤。在98°C下加热样品10分钟,然后冷却至25°C。
- 在每个样品中加入3μL探针杂交混合物,并运行热循环器,使探针与DNA杂交。
- 在室温 (RT) 下,在每个样品中加入 13 μL 的杂交后混合物。将 10 μL 转移到第二管。
- 将两组管子放入热循环器中,并在 48°C 孵育至少 1 分钟。
- 当样品在48°C时,将10μL的结扎混合物添加到第一组管(未消化系列)和10μL的结扎消化混合物到第二组管(消化系列)。运行下一个热循环器程序。
- 旋转管,同时将热循环器设置为 72°C。
- 在每个管中加入5μL的聚合酶混合物,并将管放入热循环器中。运行 PCR 程序。
- 在 PCR 程序运行时,准备含有 2.5 μL 尺寸标准的 1 mL 形式酰胺溶液。这种溶液的移液器10μL,用于光学96孔板(带条形码)的每个孔。
- PCR后,在超纯水中将未消化和消化的样品分别稀释至1:100和1:200。将 2 μL 的稀释 PCR 产物添加到 96 孔板中。将板在 200 x g下离心 15-20 s,以去除气泡。
- 通过毛细血管电泳对样品进行片段分析。
注:板应在黑暗中储存在4°C下,直到分析。
7. 片段数据分析
- 打开毛细管电泳会导致电图分析软件。
- 在"面板"列下,对于其中一个示例,从菜单中选择MLPA。单击"面板"标题,然后按Ctrl_D将MLPA应用于所有示例。
- 同样,将"分析"方法设置为所有样本的Micro 卫星默认值。
- 选择所有样本,然后单击"绿色播放"按钮,根据所选设置分析样本。
- 选择所有样本,然后单击"图形"按钮以可视化探头峰值。
- 放大峰值区域,使单个探头峰值的分辨率更高。确保标有与 LINE-1 探头混合中的探头对应的所有 10 个峰值。丢弃额外的峰值(<95 bp 和 >160 bp)。
- 在基因类型选项卡中,以逗号分隔值 (CSV) 格式导出结果。
- 在数据分析软件中打开 CSV 文件,并将数据分类为列。
- 根据三个甲基化位点的峰值根据其近似尺寸标记(L1-1m 在 153 bp,L1-2m 在 119 bp,L1-3m 在 133 bp)。其余七个峰值对应于控制探测器。
注:这里使用L1-2m探针峰的值,其大小为117 bp,因为该区域已用于大多数LINE-1甲基化测定23。 - 对于每个样本(未消化和消化),计算所有七个控制峰值的总和峰值面积。将每个 LINE-1 探头的峰值区域除以此总和。
- 对于每个 DNA 样本,使用以下等式将消化样本的值除以未消化样本的值,以获得甲基化剂量比 (DM):
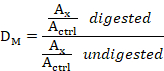
其中:DM是甲基化剂量比,Ax是峰值x下的区域(例如 L1-2m 峰值),Actrl是所有七个控制探针的总和峰值区域。
- 根据三个甲基化位点的峰值根据其近似尺寸标记(L1-1m 在 153 bp,L1-2m 在 119 bp,L1-3m 在 133 bp)。其余七个峰值对应于控制探测器。
结果
本研究的主要目的是评估OS-EV对MSCs的表观遗传效应。使用标准差分离离法从HOS-143B细胞中分离出OS-EV。典型的EV标记CD63,Hsp70和TSG101的西方印迹的表达证实了OS-EV的存在。(图2A)没有钙毒素信号表明OS-EV隔离物的纯度。使用 TEM 观察到了纯度的其他指示,存在各种尺寸的完整囊泡(图 2B)。OS-EV粒子平均浓度为7.63x1011/mL(...
讨论
这项研究说明了如何使用MSPA检测和量化特定遗传元素的甲基化状态。LINE-1是这里的焦点,但探测器可以设计为针对一系列基因和序列。此外,可用于不同应用的探头混合物越来越多。MSPA是一种简单而可靠的DNA甲基化分析技术,不需要双硫酸盐转化10。从样品制备到数据分析的完整过程大约需要 2 天,但仅涉及 4~5 小时的实际动手工作。它适用于少量的DNA(低至70 ng),如此处所?...
披露声明
作者没有什么可透露的。
致谢
这项工作由赫尔辛基大学项目资助(WBS490302,WBS73714112)赫尔辛基大学医院国家资助大学一级健康研究(Y1014SUL05,TYH2016130),芬兰-挪威医学基金会和塞尔玛和马亚-丽莎·塞兰德基金(米内尔瓦基金会)。我们感谢瓦尔特·帕维奇提供经过修改的 MSPA 协议和相关技术支持。我们感谢特穆·马萨林(赫尔辛基大学)帮助我们制作视频。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | Terumo | SS+01T1 | for NTA |
| 24-well plate | Corning | 3524 | MSC cell culture |
| 3730xl DNA Analyzer | Applied Biosystems, ThermoFisher Scientific | 3730XL | |
| 50 mL centrifuge tube | Corning | 430829 | |
| Beckman Optima LE-80K Ultracentrifuge | Beckman | ||
| BlueStar Prestained Protein Marker | Nippon Genetics | MWP03 | WB: protein marker |
| Calnexin (clone C5C9) | Cell Signaling Technology | 2679 | WB, dilution 1:800 |
| CD63 (clone H5C6) | BD Biosciences | 556019 | WB, dilution 1:1000 |
| Centrifuge 5702 R | Eppendorf | 5703000010 | For conditioned media and cells |
| Centrifuge 5810 | Eppendorf | 5810000010 | For spinning down 96-well plate |
| Centrifuge tube (polyallomer, 14x95 mm) | Beckman | 331374 | Ultracentrifugation |
| DMEM/F-12 + GlutaMAX medium | Gibco, Life Technologies | 31331-028 | For AT-MSC culture |
| Fetal bovine serum | Gibco, Life Technologies | 10270-106 | |
| GeneScan 500 LIZ size standard | Applied Biosystems, Life Technologies | 4322682 | for capillary electrophoresis |
| GenomePlex Complete Whole Genome Amplification (WGA) Kit | Sigma | WGA2-10RXN | for MSPA negative control |
| Hi-Di formamide | Applied Biosystems, Life Technologies | 4311320 | for capillary electrophoresis |
| HOS-143B cell line | ATCC | CRL-8303 | |
| Hsp70 (clone 5G10) | BD Biosciences | 554243 | WB, dilution 1:1000 |
| IRDye 800CW Goat anti-mouse | Li-Cor | 926-32210 | WB: secondary |
| IRDye 800CW Goat anti-rabbit | Li-Cor | 926-32211 | WB: secondary |
| LINE-1 probe-mix primers | IDT | Sequences in Table 1 | |
| MicroAmp Optical 96-well reaction plate with barcode | Applied Biosystems, Life Technologies | 4306737 | also requires sealing film |
| Micro BCA Protein Assay kit | ThermoFisher Scientific | 23235 | measure protein concentration |
| MiniProtean TGX 10% gels | Bio-Rad | 456-1034 | WB: gel electrophoresis |
| NanoSight LM14C | Malvern Instruments | for NTA | |
| Nitrocellulose membrane 0.2 µm | Bio-Rad | 1620112 | WB: protein transfer |
| NucleoSpin Tissue XS | Macherey-Nagel | 740901.50 | for DNA extraction |
| Odyssey Blocking Buffer | Li-Cor | 927-40000 | WB: blocking, antibodies |
| PBS, 1X | Corning | 21-040-CVR | |
| Penicillin-streptomycin | Gibco, Life Technologies | DE17-602E | Antibiotics for culture media |
| Protein LoBind tube, 0.5 mL | Eppendorf | 22431064 | For storing Evs |
| REVERT Total Protein Stain and Wash Solution Kit | Li-Cor | 926-11015 | WB: total protein staining |
| RKO cell line | ATCC | CRL-2577 | for MSPA positive control |
| RPMI medium 1640 + GlutaMAX | Gibco, Life Technologies | 61870-010 | For HOS-143B cell culture |
| SALSA MLPA HhaI enzyme | MRC-Holland | SMR50 | |
| SALSA MLPA reagent kit | MRC-Holland | EK1-FAM | |
| SALSA MLPA P300 probe-mix | MRC-Holland | P300-100R | |
| Swinging rotor SW-28 | Beckman Coulter | 342207 | Ultracentrifugation |
| Syringe filter, 0.22 µm | Jet Biofil | FPE-204-030 | sterile filtering FBS |
| Tecnai 12 | FEI Company | equipped with Gatan Orius SC 1000B CCD-camera (Gatan Inc., USA); for TEM | |
| TBS, 1X tablets | Medicago | 09-7500-100 | WB: buffer |
| Trans-Blot Turbo | Bio-Rad | WB: transfer | |
| Thermal cycler | ThermoFisher Scientific | TCA0096 | |
| TrypLE Express | Gibco | 12604-021 | for trypsinization of cells |
| TSG101 (clone 4A10) | Sigma | SAB2702167 | WB, dilution 1:500 |
参考文献
- Esteller, M. Cancer epigenomics: DNA methylomes and histone-modification maps. Nature Reviews Genetics. 8, 286-298 (2007).
- Herman, J. G., Baylin, S. B. Gene silencing in cancer in association with promoter hypermethylation. New England Journal of Medicine. 349, 2042-2054 (2003).
- Hanahan, D., Weinberg, R. A. Hallmarks of Cancer: The Next Generation. Cell. 144 (5), 646-674 (2011).
- Howard, G., Eiges, R., Gaudet, F., Jaenisch, R., Eden, A. Activation and transposition of endogenous retroviral elements in hypomethylation induced tumors in mice. Oncogene. 27, 404-408 (2008).
- Lander, E. S., et al. Initial sequencing and analysis of the human genome. Nature. 409, 860-921 (2001).
- Rodriguez, J., et al. Chromosomal instability correlates with genome-wide DNA demethylation in human primary colorectal cancers. Cancer Research. 66, 8462 (2006).
- Feinberg, A. P., Ohlsson, R., Henikoff, S. The epigenetic progenitor origin of human cancer. Nature Reviews Genetics. 7, 21-33 (2006).
- Bock, C., et al. BiQ Analyzer: visualization and quality control for DNA methylation data from bisulfite sequencing. Bioinformatics. 21 (11), 4067-4068 (2005).
- Schouten, J. P., et al. Relative quantification of 40 nucleic acid sequences by multiplex ligation-dependent probe amplification. Nucleic Acids Research. 30, 57 (2013).
- Nygren, A. O. H., et al. Methylation-Specific MLPA (MS-MLPA): simultaneous detection of CpG methylation and copy number changes of up to 40 sequences. Nucleic Acids Research. 33 (14), 128 (2005).
- El Andaloussi, S., Mager, I., Breakefield, X. O., Wood, M. J. Extracellular vesicles: biology and emerging therapeutic opportunities. Nature Reviews Drug Discovery. 12, 347-357 (2013).
- Vallabhaneni, K. C., et al. Extracellular vesicles from bone marrow mesenchymal stem/stromal cells transport tumor regulatory microRNA, proteins, and metabolites. Oncotarget. 6 (7), 4953-4967 (2015).
- Ratajczak, J., Wysoczynski, M., Hayek, F., Janowska-Wieczorek, A., Ratajczak, M. Z. Membrane- derived microvesicles: important and underappreciated mediators of cell-to-cell communication. Leukemia. 20, 1487-1495 (2006).
- Lee, T. H., et al. Microvesicles as mediators of intercellular communication in cancer- the emerging science of cellular "debris". Seminars in Immunopathology. 33, 455-467 (2011).
- Kawamura, Y., Calle, A. S., Yamamoto, Y., Sato, T., Ochiya, T. Extracellular vesicles mediate the horizontal transfer of an active LINE-1 retrotransposon. Journal of Extracellular Vesicles. 8, 1643214 (2019).
- Mannerström, B., et al. Epigenetic alterations in mesenchymal stem cells by osteosarcoma-derived extracellular vesicles. Epigenetics. 14 (4), 352-364 (2019).
- Shelke, G. V., Lässer, C., Gho, Y. S., Lötvall, J. Importance of exosome depletion protocols to eliminate functional and RNA-containing extracellular vesicles from fetal bovine serum. Journal of Extracellular Vesicles. 3, 24783 (2014).
- Wei, Z., Batagov, A. O., Carter, D. R., Krichevsky, A. M. Fetal bovine serum RNA interferes with the cell culture derived extracellular RNA. Scientific Reports. 6, 31175 (2016).
- Kornilov, R., et al. Efficient ultrafiltration-based protocol to deplete extracellular vesicles from fetal bovine serum. Journal of Extracellular Vesicles. 7, 1422674 (2018).
- Théry, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Current Protocols in Cell Biology. 30 (1), 1-29 (2006).
- Puhka, M., et al. Metabolomic profiling of extracellular vesicles and alternative normalization methods reveal enriched metabolites and strategies to study prostate cancer-related changes. Theranostics. 7 (16), 3824 (2017).
- Peltoniemi, H. H., et al. Stem cell enrichment does not warrant a higher graft survival in lipofilling of the breast: A prospective comparative study. Journal of Plastic, Reconstructive & Aesthetic Surgery. 66 (11), 1494-1503 (2013).
- Pavicic, W., Joensuu, E. I., Nieminen, T., Peltomäki, P. LINE-1 hypomethylation in familial and sporadic cancer. Journal of Molecular Medicine. 90, 827-835 (2012).
- . L1.2 sequence on GenBank (accession number: AH005269.2) Available from: https://www.ncbi.nlm.nih.gov/nuccore/AH005269 (2000)
- Designing synthetic MLPA probes (v04). MRC-Holland Available from: https://support.mlpa.com/downloads/files/designing-synthetic-mlpa-probes (2018)
- . Takara Bio Inc Available from: https://www.takarabio.com/us/products/cell_biology_and_epigenetics/epigenetics/dna_preparation/msre_overview (2018)
- Pisanic, R., et al. Long interspersed nuclear element 1 retrotransposons become deregulated during the development of ovarian cancer precursor lesions. The American Journal of Pathology. 189 (3), 513-520 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。