Method Article
إعداد الكريات الخلايا أحادية النووية الدم المحيطي والبلازما من سحب الدم واحد في مواقع التجارب السريرية لتحليل العلامات الحيوية
In This Article
Summary
يفصل هذا البروتوكول التحضير القابل للتنفيذ سريريا ل PBMC والعينات الحيوية للبلازما عالية الجودة في موقع التجارب السريرية التي يمكن استخدامها لتحليل العلامات الحيوية المترجمة.
Abstract
تحليل المؤشرات الحيوية في الدم المحيطي أصبحت ذات أهمية متزايدة في التجارب السريرية لإنشاء دليل على آلية لتقييم آثار العلاج، والمساعدة في توجيه الجرعة ووضع الجدول الزمني للعلاجات. من سحب الدم واحد، يمكن عزل خلايا الدم المحيطية أحادية النووية ومعالجتها لتحليل وقياس علامات البروتين، ويمكن استخدام عينات البلازما لتحليل الحمض النووي الورم المتداولة، السيتوكينات، ونواتج الأيض البلازما. توفر العينات الطولية من العلاج معلومات عن تطور علامة بروتين معينة ، وحالة الطفرة والمناظر الطبيعية المناعية للمريض. ولا يمكن تحقيق ذلك إلا إذا تم تجهيز الدم المحيطي بشكل فعال في المواقع السريرية وتم الحفاظ على العينات بشكل صحيح من السرير إلى المقعد. هنا، نقدم بروتوكولا محسنا للأغراض العامة يمكن تنفيذه في المواقع السريرية للحصول على حبيبات PBMC وعينات البلازما في التجارب السريرية متعددة المراكز، والتي ستمكن المهنيين السريريين في مختبرات المستشفيات من تقديم عينات عالية الجودة بنجاح، بغض النظر عن مستوى خبرتهم التقنية. كما يتم تقديم اختلافات بروتوكول بديلة محسنة لطرق تحليلية أكثر تحديدا في المرحلة النهائية. نحن نطبق هذا البروتوكول لدراسة المؤشرات الحيوية البروتين ضد الاستجابة لأضرار الحمض النووي (DDR) على الدم المشع بالأشعة السينية لإثبات مدى ملاءمة النهج في إعدادات الأورام حيث تم ممارسة أدوية DDR و / أو العلاج الإشعاعي وكذلك في المراحل قبل السريرية حيث يلزم اختبار الفرضية الميكانيكية.
Introduction
يهدف تطوير الأدوية إلى تقديم علاجات جديدة تلبي الاحتياجات الطبية غير الملباة والطب الشخصي الأكثر استهدافا. آليات المخدرات متعددة قيد التحقيق النشط بما في ذلك تثبيط الأنزيمية مثل كيناز1، بروتياز2، أو بولي (ADP - الريبوز) بوليمرات (PARP)مثبطات 3، البروتين المتدهورات4، الأجسام المضادة العلاجية5، والأدوية المضادة المترافقة (ADCs)6، من بين أمور أخرى كثيرة. ومن الأمثلة على الجهود المبذولة للحصول على علاجات أفضل في علم الأورام هو استخدام مثبطات كيناز بهدف وقف الشلالات الإشارات التي تحافظ على الخلايا السرطانية تتكاثر1،7. قياس مستويات الفوسفور الركيزة محددة لتلك kinases هو أفضل العلامات الحيوية الدوائية لتحديد آلية عمل هذه مثبطات8. أدوية أخرى قد تعدل التعبير عن بروتين معين، وفي هذه الحالة أن تكون قادرة على تحديد التغيرات في تركيز البروتين المستهدف طوليا طوال مسار العلاج أمر بالغ الأهمية. لذلك ، بغض النظر عن خصائص الدواء أو علم الأمراض ، فإن تقييم المؤشرات الحيوية لإنشاء علاقة الدوائية (PK) / الديناميكا الدوائية (PD) بين التعرض للأدوية وتعديل الهدف هو أفضل ممارسة في التطوير السريري المبكر ويمكن من تحديد جرعة نشطة صيدليا آمنة ومتسامحة / الجدول9.
بينما في التطور السريري للأورام ، قد يكون تحليل العلامات الحيوية في الخزعات أفضل إعداد لإنشاء دليل على آلية الدواء ، فإن عدد الخزعات المتاحة في التجربة عادة ما يكون محدودا جدا10،11. بدلا من ذلك، عينات الدم الطرفية هي قيمة للغاية للتجارب السريرية لأنها تنطوي على إجراء طفيفة التوغل، وسريعة وسهلة للحصول على تسهيل التحليل الطولي، وأقل تكلفة من الخزعات وتوفير معلومات واسعة لرصد في الوقت الحقيقي لنتيجة العلاج. فائدة إضافية لتقييم المؤشرات الحيوية PD في الدم المحيطي هو القدرة على استخدام biosample لتحديد أيضا PK السماح بدقة في تحديد العلاقات الكمية PK / PD والنمذجة PK / PD اللاحقة12،13. يمكن عزل خلايا الدم المحيطية أحادية النوى (PBMCs) من الدم كله لدراسة علامات البروتين ، والتي تواجه إما تغييرات في مستوى التعبير أو في تعديلاتها بعد الترجمة. بالإضافة إلى ذلك ، يمكن استخدام PBMCs لأغراض السمية المناعية14،15، اختبارات وظائف المناعة مثل تقييم السمية الخلوية المعتمدة على الأجسام المضادة (ADCC)16 والتحليل اللاجيني من خلال عزل الحمض النووي الريبي. وبالمثل ، يمكن استخدام البلازما من الدم كله لتحديد السيتوكينات لتوصيف الاستجابة المناعية للمريض ، وإجراء دراسات التمثيل الغذائي ، وكذلك لعزل وتسلسل الحمض النووي للورم المتداول (ctDNA) لرصد التطور اللاستنساخي للمرض قيد الاختيار من العامل العلاجي ، مما يوفر في كثير من الأحيان أساسا ميكانيكيا لمقاومة العلاج17و18و19 مما يتيح تطوير الأجيال اللاحقة من العلاجات20. وأخيرا، عزل الخلايا السرطانية المتداولة (CTCs) من الدم المحيطي يسمح لتقييم تطور المرض عن طريق التعداد الطولي، تسلسل الحمض النووي / الحمض النووي الريبي وتحليل البروتين والعلامات الحيوية21. على الرغم من أن هذه العزلة متوافقة مع البروتوكول الموصوف هنا22، فإن انخفاض وفرة CTCs في العديد من أنواع السرطان والمراحل المبكرة من المرض يجعل استخدام أنابيب متخصصة أكثر ملاءمة لتقليل تدهور CTC23.
في السنوات الأخيرة، وقد أدى استخدام الخزعات السائلة تحسين المعلومات التي تم الحصول عليها في التجارب السريرية ومجموعات PBMC وقد أدرجت في العديد من الدراسات لرصد المشاركة المستهدفة وإثبات آلية إما مباشرة في الخلايا السرطانية لبعض أنواع الأورام الخبيثة الدموية، أو على PBMCs أنفسهم كبدائل PD من الخلايا السرطانية24،25،26. إن إعداد عينات عالية الجودة يؤثر بشكل إيجابي على تحديد العلاج الأكثر أمانا وفعالية لأمراض معينة ، ولكن في تجربتنا ، تعرضت جودة استعدادات PBMC التي تم الحصول عليها من مواقع سريرية مختلفة لتباين واسع في الجودة مما أدى إلى عينات غير مناسبة لغرض تحليل المصب. وقد أثر ذلك على كمية بيانات شرطة الولايات المتحدة التي يمكن جمعها من تلك الدراسات.
هنا نحن نصف بالتفصيل بروتوكول سهلة لمتابعة التي تبين كيفية عزل بكفاءة كل من PBMCs وعينات البلازما من سحب الدم واحد في بيئة سريرية. ويستند البروتوكول إلى التعليمات التي قدمتها الشركة المصنعة لأنابيب إعداد الخلايا النووية الأحادية، والتي تتضمن تعديلات حيث سلطت تجربة العالم الحقيقي الضوء على الصعوبات في تنفيذ البروتوكول كما ذكرت المواقع السريرية، مثل قضايا الطرد المركزي، وتأخيرات المعالجة ونقل العينات إلى المبردات. هناك طرق بديلة متاحة تجاريا لاستخدام أنابيب إعداد الخلايا أحادية النووية على أساس فصل تدرج الكثافة باستخدام حلول البوليساكريد مع أو بدون حاجز يفصل المحلول عن الدم27. إذا كان الموقع السريري ذي الصلة بالفعل من ذوي الخبرة الجيدة في هذه المنهجيات البديلة ، يمكن استبدال هذا البروتوكول بشكل مقبول بهذه. في مثل هذه الحالات، يمكن النظر في عاملين: تتطلب بعض الطرق البديلة نقل الدم الكامل من أنبوب تجميع إلى أنبوب إعداد منفصل حيث قد يمثل نقل إضافي للمواد البيولوجية الأولية البشرية خطرا متزايدا قليلا على السلامة، ويعتمد نجاح الطرق التي لا تحتوي على حواجز تفصل الدم عن محلول البوليساكريد على خطوات حاسمة مثل طبقات عينة الدم على متوسط تدرج الكثافة الذي يتطلب تطوير مستوى مكرر من الخبرة التقنية التي لا توجد دائما في بيئة مختبر المستشفى. على الرغم من النقاط المذكورة أعلاه ، فإن الجدوى العامة واستعادة الخلايا قابلة للمقارنة بين هذه التقنيات15،28. ولذلك، فإن اختيار المنهجية يعتمد إلى حد ما على الخبرة التقنية السابقة، ولكن في أيدينا، يمكن استخدام أنابيب إعداد الخلايا أحادية النووية بنجاح في سياق سريري واسع وهي توصيتنا، بخلاف ذلك.
في حين أن إحدى نقاط النهاية لهذا البروتوكول هي إنتاج حبيبات PBMC لمزيد من المعالجة في الليسات ، يمكن تنفيذ التطبيقات النهائية الأخرى لجمع PBMC ، مثل عزل الأحماض النووية ، أو إنتاج لطاخات PBMC أو كتل PBMC المناسبة لأساليب الكيمياء المناعية (IHC). الأهم من ذلك، لأن كل biosample مأخوذة من المرضى يمثل إجراء الغازية على مستوى ما على الأقل، وهذا البروتوكول يزيد من المواد المفيدة من كل عينة عن طريق عزل البلازما أيضا والتي يمكن استخدامها لتحليل السيتوكين، والدراسات الأيضية أو تسلسل ctDNA.
تحليل المؤشرات الحيوية الطرفية في تجارب الأورام هو واحد من العديد من تطبيقات lysates PBMC. ومن الأمثلة على ذلك تقييم الاستجابة للضرر الحمض النووي (DDR) في علاجات مثل العلاج الكيميائي, العلاج الإشعاعي أو استخدام مثبطات الإنزيمات المشاركة في DDR مثل فوسفاتيدلينوستول-3 كيناز ذات الصلة كيناز (PIKKs)7 وPARPs3,13. والهدف من هذه العلاجات هو زيادة تلف الحمض النووي في الخلايا المنتشرة، مما يولد سمية عالية في الخلايا ذات آليات DDR الضعيفة ونقاط التفتيش لدورة الخلايا، مثل الخلايا السرطانية. هنا نقدم مثالا مع دراسة المؤشرات الحيوية DDR في الدم المحيطي تخضع للأشعة السينية.
Protocol
موافقة المريض المستنيرة والامتثال الكامل لمتطلبات الأخلاق الوطنية ذات الصلة في كل ولاية قضائية، مثل قانون الأنسجة البشرية (HTA - المملكة المتحدة، 2004) وقانون قابلية التأمين الصحي والمساءلة (HIPAA - الولايات المتحدة، 1996) إلزامية. يجب التأكد من أن يكون موثقا تماما الموافقة على الأخلاقيات قبل البدء في أي عمل على المواد المستمدة من الإنسان. تم توفير الدم المستخدم في تحسين هذا البروتوكول بموافقة مناسبة من فريق المتطوعين المتقدم للطب (VAMP) (مرجع الأخلاقيات 16/EE/0459 ، دراسة CRF494 ، الدراسة الفرعية 001) التي يديرها مرفق البحوث السريرية NIHR كامبريدج ، كامبريدج ، المملكة المتحدة ، بموجب اتفاقية توريد العينات البيولوجية البشرية مع المعهد الوطني للبحوث الصحية (NIHR) كامبريدج مركز البحوث الطبية الحيوية. تم ترخيص بنك AstraZeneca Biobank في المملكة المتحدة من قبل هيئة الأنسجة البشرية (الترخيص رقم 12109) ولديه موافقة اللجنة الوطنية لأخلاقيات أخلاقيات البحث (NREC) كمصرف أنسجة بحثية (REC No 17/NW/0207).
1. توجيهات إعداد عامة
ملاحظة: يجب أن تعمل جميع الأعمال التي تحتوي على مواد بشرية غير مثبتة مثل الدم والبلازما و PBMCs في هذا البروتوكول على افتراض أن هذه المواد قد تحمل عوامل معدية محتملة، وبالتالي يجب إجراؤها في إطار احتياطات السلامة البيولوجية المناسبة. بالنسبة للمرضى الذين تم اختبارهم على أنها سلبية لمسببات الأمراض المعروفة ، لا تفترض أن العينات غير معدية ، وبالتالي يجب تطبيق احتياطات السلامة المناسبة. وينبغي معالجة النفايات الناتجة عن هذه المواد بنفس احتياطات السلامة الأحيائية والتخلص منها وفقا للقواعد المحلية.
- اختر بين نوعين من أنابيب إعداد الخلايا أحادية النووية التي تستخدم إما سيترات الصوديوم أو الهيبارين الصوديوم كمضاد للتخثر. بالنسبة للعديد من التطبيقات المصب هذه مضادات التخثر اثنين يمكن استخدامها بالتبادل ولكن ينبغي اختبار كل من مضادات التخثر قبل اختيار واحد للتجربة.
- تسمية واحدة 8 مل أنبوب إعداد الخلايا النووية الأحادية لاستخدامها لجمع الدم مع هوية المريض مشفرة.
- تخزين 1x PBS في درجة حرارة الغرفة (18-25 درجة مئوية). استخدام 30 مل لكل إعداد.
- تأكد من تسمية أنابيب عينات البلازما المنفصلة والتبريد لعينة PBMC بدقة مع معرفات فريدة ، كما هو محدد في القسم المناسب من دليل المختبر.
- إذا PBMCs سوف تستخدم لرصد البروتينات الفوسفورية, إعداد برنامج تلفزيوني تستكمل مع مثبطات فوسفاتاز: مزيج 5 مل من برنامج تلفزيوني مع 50 ميكروغرام من كوكتيل مثبط فوسفاتاز 2 + 50 ميكرولتر من كوكتيل مثبط فوسفاتاز 3. إعداد الطازجة والحفاظ على الجليد حتى الاستخدام.
- إذا PBMCs ستكون cryopreserved، وإعداد 1 مل تجميد خليط لكل عينة عن طريق خلط 90٪ FBS + 10٪ DMSO.
2. جمع PBMC (الشكل 1A)
- ارسم دم 8 مل في أنبوب إعداد الخلايا أحادية النووية باستخدام التقنية القياسية التي وصفها المصنع. عكس أنبوب بلطف 8 إلى 10 مرات لخلط المضافة المضادة للتخثر مع الدم. لا تهتز لتجنب انحلال الهيمولي. سجل الوقت الذي تم سحب الدم فيه.
- بعد التجميع، قم بتخزين الأنبوب منتصبا في درجة حرارة الغرفة حتى الطرد المركزي. معالجة العينات في أقرب وقت ممكن، من الناحية المثالية في غضون ساعة واحدة من جمع الدم هذا ولكن ليس في وقت لاحق من جمع 4 ساعة آخر. تسجيل التوقيت عند بدء معالجة الدم.
- مباشرة قبل الطرد المركزي ريميكس عينة الدم عن طريق عكس بلطف أنبوب 8 إلى 10 مرات أكثر.
- الطرد المركزي أنبوب عينة أنبوب / أنابيب الدم في الدوار الأفقي (سوينغ التدريجي رئيس) في 1,500 – 1,800 س ز لمدة 30 دقيقة في درجة حرارة الغرفة (18-25 درجة مئوية). تأكد من أن جميع الأنابيب متوازنة بشكل صحيح.
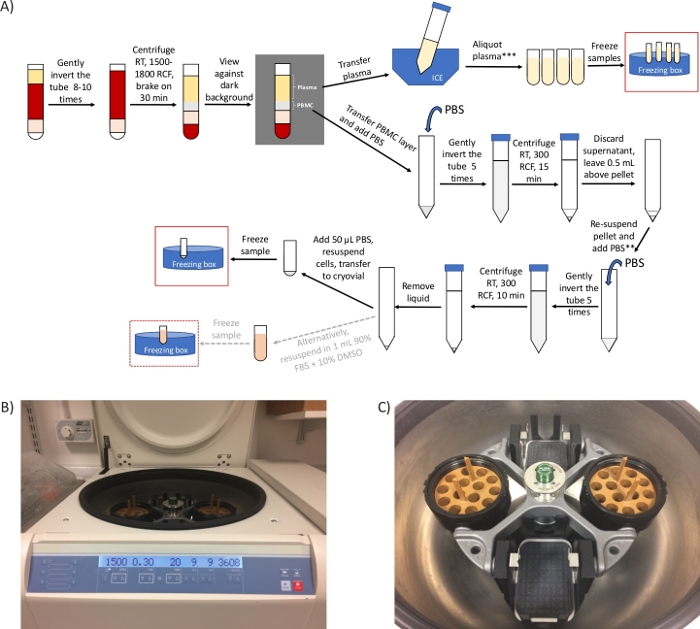
الشكل 1: نظرة عامة على البروتوكول والصور التمثيلية لأجهزة الطرد المركزي. (أ)نظرة عامة تخطيطية للبروتوكول لإعداد PBMCs والبلازما. * إذا كانت هناك قيود زمنية، يمكن تقصير الخطوة 2.4 إلى 20 دقيقة ويمكن إزالة الخطوات من 3.3 إلى 3.6. ** خذ a aliquot لحساب الخلايا، إذا لزم الأمر. 2 خطوات الطرد المركزي إضافية المطلوبة لتحليل ctDNA / الأيض (ب) صورة من رئيس سوينغ التدريجي جهاز الطرد المركزي الدوار تعيين للخطوة 2.4. (ج) صورة الدوار، والتي تشمل دلوين تحتوي على محولات لتدور أنابيب إعداد الخلايا أحادية النووية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
ملاحظة: x g (يشار إليها أيضا باسم RCF ووحدات الطرد المركزي النسبية) وRPM (الثورات في الدقيقة) وحدات مختلفة. تأكد من ضبط جهاز الطرد المركزي ل x g (RCF). استخدم الآلة الحاسبة عبر الإنترنت (راجع جدول المواد)للتحويل. إذا كان الدوار ذو الزاوية الثابتة متاحا فقط، فاؤدي هذه الخطوة لمدة 10 دقائق عند 1500 - 1800 × ز.
- بعد الطرد المركزي، تحقق من وجود طبقة حمراء داكنة تحت الحاجز (تحتوي على خلايا الدم الحمراء في الغالب)، وطبقتين فوق الحاجز. الطبقة العليا هي البلازما (القش الملونة) وطبقة بيضاء تحت هو معطف برتقالي يحتوي على PBMCs. يمكن تمييز هذه الطبقات بسهولة عند عرض الأنبوب على خلفية داكنة / سوداء.
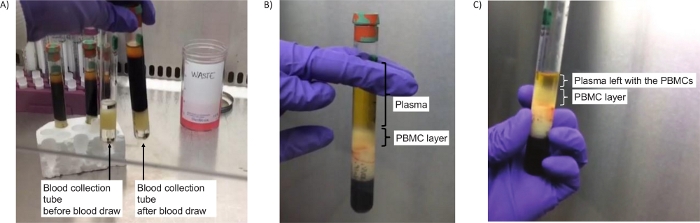
الشكل 2: أنابيب لعزل PBMCs. (أ) صورة الأنابيب قبل الطرد المركزي (الخطوة 2.4)، إما فارغة (يسار) أو تحتوي على الدم (يمين). (ب) فصل طبقة PBMC بنجاح بعد الطرد المركزي (الخطوة 2.5). (ج) صورة طبقة PBMC بعد الطرد المركزي وتبقى بعض البلازما لضمان جمع جميع مركبات PBMCs (الخطوة 2.7). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
ملاحظة: إذا كانت هذه الطبقات غير مرئية، فهذا يشير على الأرجح إلى وجود خطأ في إعداد وحدات الطرد المركزي. تأكد من استخدام محول الطرد المركزي الصحيح وتعيين "x g" الصحيح. كرر الخطوة 2.4.
- بعد الطرد المركزي مباشرة، استخدم ماصة مصلية لنقل ما يقرب من نصف البلازما إلى أنبوب طرد مركزي مخروطي الحجم بحجم 15 مل مع غطاء، مع الحرص على عدم إزعاج طبقة PBMC (حوالي 4-5 مل). تخزين مؤقتا هذا الأنبوب مع البلازما على الجليد الرطب لاستخدامها في وقت لاحق في الخطوة 4. يترك جانبا في الوقت الراهن.
- جمع طبقة PBMC كامل مع ماصة باستور عن طريق وضع ماصة داخل طبقة من الخلايا ونقلها إلى مختلفة 15 مل حجم أنبوب الطرد المركزي المخروطي مع غطاء. ومن المقبول أن تأخذ أيضا كمية صغيرة من البلازما، إذا لزم الأمر، للحصول على كل طبقة PBMC تماما. عادة ما تكون وحدة التخزين 1-2 مل. تابع فورا الخطوة 3 أدناه.
3. PBMC غسل الخطوات
ملاحظة: الغرض من خطوات الغسيل هو تخفيف وإزالة الصفائح الدموية المتبقية والبلازما من بيليه PBMC. يجب تنفيذ جميع خطوات الطرد المركزي في درجة حرارة الغرفة (18-25 درجة مئوية).
- أضف درجة حرارة الغرفة PBS إلى أنبوب PBMC لجعل مستوى الصوت إلى 15 مل. كاب الأنبوب. اخلط الخلايا عن طريق قلب الأنبوب برفق 5 مرات.
- جهاز طرد مركزي لمدة 15 دقيقة عند 300 × ز. لاحظ أن هذا هو ألطف بكثير الطرد المركزي من الطرد المركزي الأولي.
- تصور بيليه عن طريق عرض الأنبوب على خلفية مظلمة / سوداء. إزالة supernatant عن طريق فراغ الطموح أو مع ماصة (الشكل 3A). تجاهل supernatant ترك حجم ما يقرب من 500 ميكرولتر فوق بيليه PBMC الملونة بيضاء.
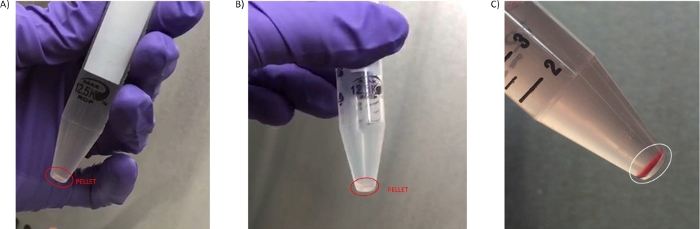
الشكل 3: الكريات PBMC. (أ) بيليه التي تم الحصول عليها في أول غسل الخطوة 3.3. (ب) بيليه معزولة في غسل الثاني (الخطوة 3.7). (ج) بيليه مع مستوى عال من انحلال الدم التي تم الحصول عليها من الدم معالجتها في وقت لاحق من 4 ح من سحب الدم معزولة في غسل الثاني (الخطوة 3.6). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- Resuspend بيليه الخلية عن طريق الأنابيب بلطف صعودا وهبوطا في supernatant المتبقية.
- إضافة برنامج تلفزيوني 1x إضافية لجعل وحدة التخزين إلى 10 مل. كاب الأنبوب. خلط الخلايا عن طريق عكس أنبوب بلطف 5x. إذا كان عد الخلايا مطلوبا في بروتوكول الدراسة انتقل إلى الخطوة 3.5.1، إذا لم يكن مطلوبا الانتقال مباشرة إلى الخطوة 3.6.
- تأخذ 40 ميكرولتر aliquot من الخلايا إعادة تعليق وتخلط مع 40 ميكرولتر من الأزرق تريبان. عد الخلايا القابلة للحياة باستخدام مقياس الدم أو عداد الخلايا التلقائي.
- الطرد المركزي تعليق من الخطوة 3.5 لمدة 10 دقيقة في 300 × ز. إزالة أكبر قدر ممكن من الطبيعة دون إزعاج بيليه الخلية.
- إزالة بعناية والتخلص من أي supernatant المتبقية فوق بيليه الخلية عن طريق الأنابيب باستخدام ماصة باستور تلميح غرامة أو micropipette دون إزعاج بيليه الخلية. ترك القليل من السائل أو لا فوق بيليه بعد الانتهاء من هذه الخطوة. إذا كانت نقطة النهاية لهذا البروتوكول هو انتقال بيليه PBMC إلى الخطوة 3.8; إذا كانت نقطة النهاية CRYOpreserved PBMCs الانتقال إلى الخطوة 3.10.
- إضافة 50 ميكرولتر من برنامج تلفزيوني جديد (أو برنامج تلفزيوني تكملة أعدت في الخطوة 1.5 إذا كان ذلك ينطبق على نقطة النهاية الخاصة بك) إلى بيليه وماصة صعودا وهبوطا بلطف باستخدام micropipette لإعادة إنفاق جميع الخلايا بشكل متجانس. نقل تعليق الخلية بأكمله إلى 1.5 مل المسمى cryovial وعلى الفور مكان على الجليد الرطب حتى تجميد العينات.
- تجميد العينات المسماة عن طريق وضعها في النيتروجين السائل أو مباشرة في الجليد الجاف. كما يمكن تجميد الخلايا عند -80 درجة مئوية باستخدام صناديق تجميد الخلايا. في هذه الحالة، prechill صناديق تماما في -80 درجة مئوية قبل إضافة أنابيب الخلية. سجل الوقت الذي تم فيه تجميد حبيبات الخلايا. مرة واحدة تجميد الخلايا، وتخزينها في -80 درجة مئوية، السفينة المجمدة على الجليد الجاف.
- اختياريا، للحفاظ على التبريد PBMCs إعادة تعليق بيليه في 1 مل من خليط التجميد (الخطوة 1.6) ونقلها إلى cryovial المسمى. استمر كما هو موضح في الخطوة 3.9، ولكن في هذه الحالة، من المقبول فقط استخدام مربعات تجميد الخلايا لتجميد العينات. نقل إلى النيتروجين السائل للشحن والتخزين بعد أن يكون في مربع تجميد لمدة لا تقل عن 24 ساعة.
4. خطوات إعداد البلازما (الشكل 1A)
- بعد -80 درجة مئوية تخزين الكريات PBMC، والآن إعداد aliquot البلازما التي تم تخزينها مؤقتا على الجليد الرطب في الخطوة 2.6. قم بتنفيذ خطوات الطرد المركزي التالية لتوضيح البلازما إذا كان الغرض من العينة هو تحليل ctDNA ، وإلا انتقل مباشرة إلى الخطوة 4.2.
- طارد مركزي البلازما لمدة 10 دقيقة في 1600 - 2000 × ز في 4 - 8 درجة مئوية في الدوار زاوية ثابتة (أو 15 دقيقة في الدوار سوينغ التدريجي).
- ماصة بعناية قبالة البلازما supernatant، مع الحرص على عدم إزعاج أي بيليه ونقل إلى أنبوب 15 مل جديدة. تجاهل الأنبوب الذي يحتوي على المواد الكريات.
- طارد مركزي البلازما لمدة 10 دقيقة في 1600 - 2000 × ز في 4 - 8 درجة مئوية في الدوار زاوية ثابتة (أو 15 دقيقة في الدوار سوينغ التدريجي).
- نقل بعناية البلازما supernatant إلى أنبوب جديد 15 مل، التأكد من عدم إزعاج أي مادة بيليه. تجاهل الأنبوب الذي يحتوي على المواد الكريات.
ملاحظة: إذا لم يتوفر جهاز طرد مركزي مبرد، احتفظ بالخلايا على الجليد لمدة 5 دقائق بين كل دورة، أو عينات الطرد المركزي في غرفة باردة.
- نقل البلازما في 1 مل aliquots إلى 5 الطازجة 2 مل الأنابيب الدقيقة. استخدام أقل من 5 قوارير إذا لم يكن هناك ما يكفي من البلازما لملء 5 قوارير مع 1 مل aliquots ومن المتوقع أن القارورة الأخيرة سوف تحتوي على أقل من 1 مل البلازما. إذا كان هناك أكثر من 5 مل البلازما، تجاهل ما تبقى. سجل الحجم الإجمالي للبلازما في كل أنبوب.
- تجميد على الفور aliquots البلازما تستقيم، عن طريق تخزينها في -80 درجة مئوية.
5. عينة الشحن
- شحن كل من الكريات PBMC وعينات البلازما على الجليد الجاف.
- تأكد من عدم إذابة العينة قبل الشحن وأثناءه. احزم ما يكفي من الثلج الجاف مع العينات لضمان بقائها مجمدة طوال عملية الشحن ، مع الأخذ في الاعتبار التأخيرات المحتملة التي قد تحدث أثناء العبور.
6. تشعيع الدم كله وتحليل بقعة الغربية من المؤشرات الحيوية DDR (الشكل 4A)
ملاحظة: هذا هو علاج الجسم الحي السابق التي لن تكون مطلوبة في معظم الحالات في العيادة، ولكن هذه التجارب هي استراتيجية استكشافية قيمة للعثور على المؤشرات الحيوية السريرية المناسبة. يجب معالجة عينات الدم في أقرب وقت ممكن عند جمعها لضمان أفضل النتائج.
- قم بإحماء خزانة الأشعة السينية تسمية ثلاثة أنابيب 15 مل كما 0, 0.2 و 7 Gy, على التوالي.
- خذ ثلاثة أنابيب إعداد الخلايا أحادية النووية التي تحتوي على دم مسحوب حديثا من فرد واحد وبعد عكس الأنابيب بلطف 8 إلى 10 مرات نقل الدم إلى أنابيب 15 مل الثلاثة.
- ضع أنبوب 0.2 Gy في خزانة الأشعة السينية ، أغلق الباب وطبق جرعة 0.2 Gy على الأنبوب عن طريق تحديد رقم الرف والجرعة. تطبيق 7 جرعة الإشعاع غي إلى أنبوب 7 Gy عن طريق ضبط الجرعة المختارة في مجلس الوزراء.
- احتضان الأنابيب الثلاثة عند 37 درجة مئوية لمدة ساعة واحدة.
- نقل الدم مرة أخرى إلى أنابيب إعداد الخلايا أحادية النووية وتنفيذ بروتوكول إعداد PBMC كما هو الحال بالنسبة لإعداد السريرية من الخطوة 2.4 إلى الخطوة 3.8.
- إضافة حجم العازلة تحلل تستكمل مع مثبطات البروتيز والفوسفاتاز يساوي حجم بيليه الخلية (في هذه الحالة 70 ميكرولتر من العازلة RIPA) إلى كل من الكريات الخلية، ماصة صعودا وهبوطا واحتضان على الجليد لمدة 10 دقيقة. Sonicate العينات إذا sonicator هو متاح (3 دورات ، 30 ق على / 30 ق قبالة ، 4 درجة مئوية) ، بدلا من حقنة العينات لكسر الأحماض النووية للقضاء على اللزوجة في العينة.
- الطرد المركزي عينات لمدة 10 دقيقة في ≥ 15000 × ز، في 4 درجة مئوية. نقل كل supernatant إلى أنبوب 1.5 مل جديدة، وتقييم نوعيا مستوى انحلال البول (الفحص البصري) وقياس تركيز البروتين بأي طريقة مفضلة.
- مزيج 40 ميكروغرام من مجموع lysate مع عينة تحميل المخزن المؤقت الذي يحتوي على SDS و عينة عامل الحد. يغلي عينات لمدة 5 دقائق في كتلة الحرارة.
- تحميل 20 ميكروغرام من كل عينة لكل حارة في تكرار في هلام البروتين بيس-تريس 4-12٪ وتشغيل SDS-PAGE.
- بعد الانفصال، نقل البروتينات إلى غشاء النيتروسليلوز باستخدام نظام متاح تجاريا (20 V، 10 دقيقة) وكتلة مع 5 ٪ الحليب في TBST.
- قطع الغشاء في الأحجام الجزيئية ذات الصلة واحتضان مع الأجسام المضادة الأولية بين عشية وضحاها في 4 درجة مئوية (انظر جدول المواد للأجسام المضادة والتخفيف).
- إزالة الأجسام المضادة الأولية وغسل الأغشية 3 مرات مع TBST لمدة 5 دقائق في درجة حرارة الغرفة. احتضان مع الأجسام المضادة الثانوية HRP المقترنة لمدة 45 دقيقة في درجة حرارة الغرفة.
- غسل 3 مرات مع TBST لمدة 5 دقائق.
- تطبيق كاشف ECL وتحليل الصور التي تم الحصول عليها بالنسبة لإشارة HRP.
النتائج
لتحسين جودة استعدادات PBMC في تجاربنا السريرية ، قمنا بإنشاء بروتوكول مع خطوات موجزة وواضحة يمكن اتباعها من قبل المتخصصين في مختبرات المستشفى ، بغض النظر عن خلفيتهم البيولوجيا الجزيئية ومهاراتهم المختبرية. لقد قمنا بتكييف بروتوكول الشركة المصنعة الذي يتضمن تعديلات على تلك الخطوات التي تم فيها تحديد قضايا التنفيذ أو الإبلاغ عنها من المواقع السريرية المشاركة في التجارب السريرية متعددة المراكز المختلفة. ومع ذلك، يمكن تحسين البروتوكول بشكل أكبر لتلبية متطلبات محددة، مثل ضيق الوقت في الموقع السريري أو نوع التحليلات النهائية (انظر الملف التكميلي). ونثبت أنه يمكن تحليل جمهورية ألمانيا الديمقراطية في مركبات ثنائي الفينيل متعددة البروم من خلال النظر في علامات بيولوجية محددة على تلف الحمض النووي الناجم عن الإشعاع.
وتتعلق الاستفسارات الأكثر شيوعا التي تلقيناها من المواقع السريرية بخطوات الطرد المركزي، التي تؤثر بشكل مباشر على القدرة على عزل مركبات PBMCs بنجاح والحصول على بيليه PBMC النهائي. استخدام النوع المناسب من الطارد المركزي الدوار الرأس سوينغ التدريجي (الشكل 1B، C) هو المفتاح لنجاح البروتوكول. ومع ذلك ، عندما يتوفر جهاز طرد مركزي دوار ثابت الزاوية فقط في الموقع السريري ، نقترح تنفيذ الخطوة 2.4 في دوار ثابت الزاوية في نفس RCF كما هو الحال بالنسبة الدوار الرأس المتأرجح ولكن لمدة 10 دقائق فقط. وهذا يضمن فصل طبقة PBMC من البلازما ، (انظر الشكل 2B ، C). في حين طبقات الدم على متوسط فصل التدرج كثافة يتطلب الطرد المركزي الفرامل قبالة, الدم في أنابيب إعداد الخلايا أحادية النووية يمكن الطرد المركزي مع الفرامل على بسبب وجود حاجز هلام في الأنبوب الذي يضمن الحفاظ على طبقة PBMC فصلها عن مكونات الدم أكثر كثافة27,28.
تم الحصول على ما لا يقل عن 4 مل من البلازما عالية الجودة وغير المخففة من الطرد المركزي للدم في شكل أنبوب 8 مل ، والتي يمكن توضيحها لاستخدامها في التحليلات المتخصصة مثل تسلسل ctDNA أو دراسات الأيض29،30 (الخطوات الاختيارية 4.1.1-4.1.4). وكانت كمية PBMCs معزولة، وحجم الكريات وانحلال الدم أو تلوث خلايا الدم الحمراء مخاوف أخرى قادمة من المواقع السريرية وتجربة تحليل العينات. كان عدد الخلايا التي تم الحصول عليها من دم 8 مل متغيرا اعتمادا على المريض ووضع المرض ، ولكن بشكل عام ، تكون الكريات التي تم الحصول عليها صغيرة الحجم ، ولون شفاف / أبيض(الشكل 3A ، B). بسبب هذه الخصائص، من المهم تصور بيليه على خلفية مظلمة لتجنب طموحه العرضي خلال خطوات الغسيل (2.5 و 3.3). في بعض الأحيان الكريات يمكن أن يكون لها بعض التلوين الأحمر بسبب تلوث خلايا الدم الحمراء (الشكل 3C)، وهذا له تأثير سلبي على نوعية التحضير. لتجنب فقدان الكريات الصغيرة مثل تلك الموضحة في الشكل 3، يتم تسهيل نقل بيليه PBMC إلى cryovial عن طريق الخطوة 3.7 حيث يتم إعادة إنفاق بيليه PBMC في 50 ميكرولتر من PBS.
العائد النموذجي عند استخدام هذه الأنابيب والدم من الأفراد الأصحاء يتراوح بين 7 إلى 21 × 106 خلايا ل8 مل، وانتعاش الخلية بين 70 و 80٪ كما هو تجربتنا وكما ثبت سابقا27،28. هذا يعتمد على كل من عدد الخلايا الفردية والمشغل وهو مشابه لأرقام الخلايا وقيم استعادة الخلية التي تم الحصول عليها بطرق أخرى باستخدام تدرج الكثافة (بما في ذلك الأنظمة التي تستخدم أنابيب مع حاجز فصل)15،27،28. مثال توضيحي على الاختلاف في عدد PBMCs المعزولة مع هذه الطريقة اعتمادا على إعداد المرض هو تحليل علامات PBMC في مرضى سرطان الدم الليمفاوي المزمن (CLL). عدد الخلايا المستردة من أنبوب إعداد الخلايا أحادية النووية 8 مل عند تطبيق هذا البروتوكول تراوحت بين 1.62 × 104 إلى 1.99 × 109 في 45 عينات تم الحصول عليها من 7 مرضى في الدراسة NCT0332827331 (الجدول 1). المعلمة ذات الصلة هي تركيز البروتين من lysates PBMC التي تم الحصول عليها من خلال هذه الطريقة، وهذا يعتمد على عدد من الخلايا المعزولة وكفاءة استخراج البروتين. تم إنشاء الكريات الخلية lysed في القسم 6 مع العازلة RIPA والصوتية (الخطوة 6.6). عادة ما ينتج عن إعادة إنفاق الكريات الخلوية في نفس حجم حاجز التحلل مجموعة من التركيزات من 3 إلى 10 ملغم / مل ، وفي هذا المثال بالذات كانت تركيزات التحلل 6.8 و 8.3 و 8.6 ملغم / مل ل 0 و 0.2 و 7 Gy على التوالي. ومع ذلك ، يتعرض هذا لتباين كبير عند تلقي عينات من المواقع السريرية التي لم يتم إعدادها على النحو الأمثل ، ومرض المريض ، ووجود الهيموغلوبين من تلوث خلايا الدم الحمراء. على سبيل المثال، يجب إعادة إنفاق الكريات الصغيرة جدا في حجم من عازل التحلل أكبر من حجم بيليه الخلية للسماح لكل من قياس تركيز البروتين وتحليل العلامات الحيوية في المصب، مما يؤدي إلى عينات أكثر مخففة. في مثل هذه الحالة، إذا كان تركيز عينة أقل من 1 ملغم / مل هذا يمكن أن تشكل تحديا لإجراء المقايسات مثل لطخة الغربية بسبب هذا عامل تخفيف عالية. في المقابل، في عينات CLL المذكورة سابقا، حجم العازلة تحلل إضافة إلى resuspend الكريات الخلية تختلف من 50 إلى 500 ميكرولتر، وتركيز البروتين امتدت من 1.62 إلى 19.77 ملغم / مل (الجدول 1).
عندما عينات الحاضر تلوث خلايا الدم الحمراء أو انحلال الدم (الشكل 3C), تركيز البروتين من lysate PBMC يصبح مبالغا فيه بسبب إدراج الهيموغلوبين من كريات الدم الحمراء. وهذا هو السبب في أنه ينبغي للمرء أن يقوم بفحص مرئي وشرح توضيحي لهذه العينات، على النحو المبين في الخطوة 6-7 من البروتوكول. تحميل العينة الزائدة يمكن أن تعوض عن وجود الهيموغلوبين عند إجراء تحليل العلامات الحيوية بقدر ما يتم تضمين عنصر تحكم التحميل في المقايسة. ويمكن تنفيذ طرق أخرى أكثر كمية لقياس انحلال الهيموليز، مثل قياس الامتصاص عند 414 نانومتر32.
تم تحليل DDR في PBMCs التي تم الحصول عليها بعد هذا البروتوكول السريري. لتوضيح الوضع الذي يحاكي الحمض النووي العلاجات السريرية الضارة مثل العلاج الإشعاعي أو العلاج الكيميائي، كان الدم كله من المتطوعين الأصحاء السابقين في الجسم الحي تعرض للأشعة السينية(الشكل 4A). الإشعاع المؤين (IR) مثل الأشعة السينية يؤدي إلى أنواع مختلفة من تلف الحمض النووي، بما في ذلك فواصل الحمض النووي مزدوجة حبلا (DSBs). استشعار تلف الحمض النووي من هذه الآفات ينشط PIKKs مثل ترنح-telangiectasia تحور (أجهزة الصراف الآلي), أجهزة الصراف الآلي وRad3 ذات الصلة (ATR) وكيناز البروتين تعتمد على الحمض النووي (DNA-PK), التي تشارك آليات إصلاح الحمض النووي مثل إعادة التركيب متجانسة (HR) أو غير متجانسة نهاية الانضمام (NHEJ). يحدث تنشيط أجهزة الصراف الآلي من خلال وجود DSBs عن طريق توظيفها في مواقع الضرر من قبل مجمع MRN (MRE11-RAD50-NBS1) ، مما تسبب في ترسب تلقائي في أجهزة الصراف الآلي في العديد من المخلفات بما في ذلك Ser1981. بدوره، المنشط أجهزة الصراف الآلي الفوسفوريات مكونات مجمع MRN وغيرها من البروتينات مثل البديل الهستون H2AX على Ser139 (حيث يعرف أيضا pSer139-H2AX باسم γH2AX) لتعزيز تغيير هيكلي في الكروماتين تمتد من DSB الذي يسهل تجنيد عوامل DDR الأخرى33. وتستجيب مركبات PBMCs للإشعاع المؤين على الرغم من انخفاض معدل انتشارها، وقد سمحت أساليب قياس الطيف الكتلي بتقدير كمية التنظيم الأعلى لسير635 الفوسفوري على RAD50 بواسطة أجهزة الصراف الآلي. يتم تقليل هذا الفوسفور في وجود مثبطات أجهزة الصراف الآلي وRAD50 pS635 وقد تم التحقق من صحتها كذلك باعتبارها علامة بيولوجية دوائية لعلاجات مثبطات أجهزة الصراف الآلي السريرية في الأورام عن طريق الكيمياء المناعية8. ولتقييم استجابة مركبات PBMCs للإشعاع، أخضع الدم من المتطوعين الأصحاء لجرعات مختلفة من الأشعة تحت الحمراء وتم جمع عينات بعد حضانة 1 ساعة عند 37 درجة مئوية(الشكل 4A). لهذا الغرض، تم نقل الدم إلى أنابيب بلاستيكية لتجنب خفض غلة العزلة PBMC بسبب ارتفاع درجة الحرارة (الخطوة 6.2). قمنا بتحليل كيفية تنشيط أجهزة الصراف الآلي ليس فقط من خلال النظر في RAD50 pS635 المبلغ عنها سابقا ولكن أيضا أجهزة الصراف الآلي pS1981 و γH2AX. وفي الحالات الثلاث التي تم فحصها لوحظت زيادة في هذه التعديلات اللاحقة للترجمة بجرعات أعلى من الأشعة تحت الحمراء(الشكل 4ب). ومن المثير للاهتمام أن فوسفور أجهزة الصراف الآلي وRAD50 كان كبيرا عند الجرعة المنخفضة من 0.2 Gy ، مما يشير إلى أن هذه التعديلات اللاحقة للترجمة قد يتم استجوابها عمليا كمؤشرات بيولوجية PD للعلاجات التي تنطوي على توليد DSBs الحمض النووي مع نطاق ديناميكي جيد ، ليس فقط في عينات الورم ولكن في الدم المحيطي. وهذا يسمح برصد استجابة PD للعلاج عن طريق الحصول على عينات طولية خلال فترة العلاج. توقيت سحب الدم إلى معالجة العينات أمر بالغ الأهمية لضمان هذه الشلالات الإشارات لا تزال نشطة كما التأخير في المعالجة سوف تؤثر على الحركية من هذه الشلالات ويمكن للمرء أن يغيب عن أحداث الفوسفور المستخدمة كما phosphomarkers.
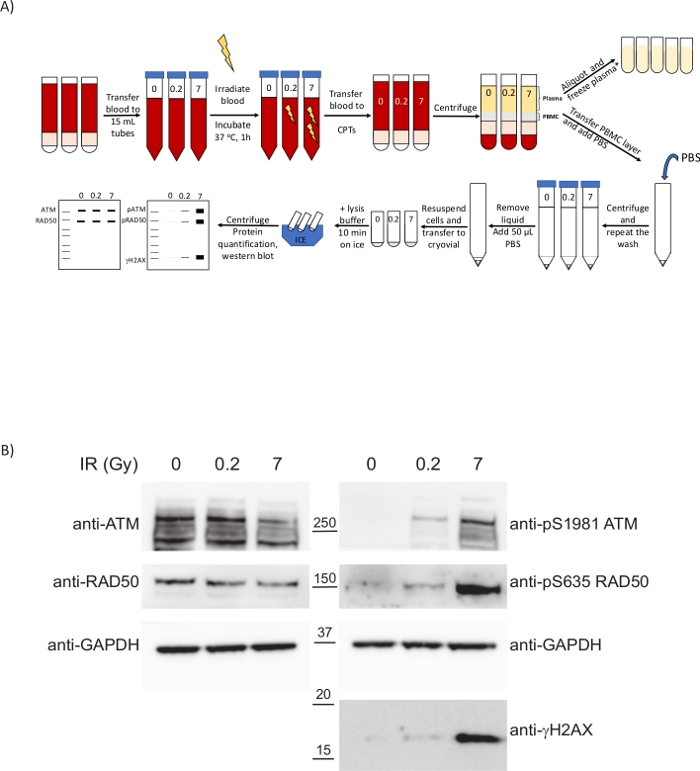
الشكل 4: تعرض مركبات PBMCs المعزولة عن الدم المشعع في الجسم الحي السابق بعد البروتوكول السريري الحالي علامات بيولوجية للإبلاغ عن مدى تلف الحمض النووي الناجم عن العلاج. (أ)نظرة عامة تخطيطية للبروتوكول الخاص بإعداد مركبات ثنائي الفينيل متعدد الكلور وتحليل جمهورية ألمانيا الديمقراطية عند تشعيع الدم كله. *2 خطوات طرد مركزي إضافية مطلوبة لتحليل /metabolomics CTDNA. (ب) لطخة الغربية التي تظهر upregulation تعتمد على الجرعة من المؤشرات الحيوية فوسفو DDR في PBMCs. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
| عينة | عدد مركبات PBMCs/ 8 مل من الدم | وحدة تخزين المخزن المؤقت RIPA المكملة (μL) | التركيز النهائي (ملغم/مل) |
| A.1 | 39100000 | 70 | 12.16 |
| A.2 | 97400000 | 100 | 4.54 |
| A.3 | 233000000 | 150 | 7.63 |
| A.4 | 316000000 | 150 | 16.87 |
| A.5 | 387000000 | 150 | 12.60 |
| A.6 | 459000000 | 150 | 12.71 |
| A.7 | 414000000 | 200 | 15.67 |
| A.8 | 253000000 | 150 | 14.56 |
| A.9 | 509000000 | 300 | 10.67 |
| باء -1 | 15200000 | 70 | 2.96 |
| باء -2 | 10500000 | 50 | 4.59 |
| باء-3 | 13200000 | 50 | 3.99 |
| باء -4 | 34800000 | 100 | 10.41 |
| باء -5 | 1620000 | 70 | 7.11 |
| باء -6 | 70200000 | 100 | 9.26 |
| باء -7 | 65400000 | 100 | 12.10 |
| باء -8 | 91100000 | 150 | 11.82 |
| جيم -1 | 6330000 | 70 | 4.04 |
| جيم -2 | 4400000 | 150 | 19.77 |
| جيم -3 | 68000000 | 100 | 8.96 |
| جيم -4 | 35100000 | 50 | 9.30 |
| جيم -5 | 35400000 | 70 | 10.55 |
| جيم -6 | 99200000 | 100 | 16.19 |
| دال-1 | 402000000 | 70 | 7.23 |
| دال-2 | 826000000 | 300 | 16.95 |
| دال-3 | 1990000000 | 300 | 14.87 |
| دال- 4 | 1000000000 | 300 | 18.34 |
| دال-5 | 1160000000 | 400 | 16.13 |
| دال-6 | 806000000 | 400 | 19.40 |
| E.1 | 302000000 | 300 | 13.86 |
| هاء-2 | 990000000 | 500 | 19.04 |
| E.3 | 1200000000 | 400 | 17.13 |
| واو-1 | 4010000 | 50 | 1.62 |
| واو-2 | 5170000 | 50 | 2.84 |
| واو-3 | 2810000 | 50 | 3.69 |
| واو-4 | 3700000 | 75 | 3.62 |
| واو-5 | 3460000 | 70 | 4.03 |
| واو-6 | 7060000 | 50 | 3.32 |
| G.1 | 60700000 | 70 | 6.57 |
| G.2 | 82100000 | 150 | 7.78 |
| ج.3 | 30500000 | 70 | 8.28 |
| ج.4 | 134000000 | 100 | 15.14 |
| G.5 | 91900000 | 100 | 8.61 |
| ج.6 | 372000000 | 150 | 15.88 |
| ج.7 | 574000000 | 200 | 15.01 |
| عينات PBMC الطولية المقابلة ل7 مرضى | |||
الجدول 1: عدد الخلايا وتركيز البروتين من الكريات PBMC من مرضى سرطان الدم الليمفاوي المزمن (CLL). البيانات المعروضة في هذا الجدول تتوافق مع 45 عينات PBMC من 7 المرضى CLL المشاركة في دراسة NCT03328273 التي تم جمعها في أنابيب إعداد الخلايا النووية الأحادية. هذه هي البيانات الأصلية التي تم إنشاؤها باستخدام عينات من الدراسة المذكورة31.
ملف تكميلي: خيارات البروتوكول البديل. الرجاء الضغط هنا لتحميل هذا الملف.
Discussion
إن الاستعدادات عالية الجودة ل PBMCs والبلازما التي يمكن إعدادها بقوة واستنساخ في مواقع التجارب السريرية لا تقدر بثمن لإعلام نقاط النهاية التوقعية المحيطية والديناميكية الدوائية للعلامات الحيوية. هنا قدمنا بروتوكولا قصيرا وواضحا يعالج الخطوات الإشكالية عادة التي كانت حتى الآن عرضة اخطاء التنفيذ في بيئة التجارب السريرية. ومع ذلك، يمكن تحسين البروتوكول بشكل أكبر لتلبية متطلبات محددة، مثل القيود الزمنية في الموقع السريري أو نوع التحليلات النهائية (انظر الملف التكميلي).
ولهذا الغرض، أظهرنا كيفية عزل كل من مركبات PBMCs والبلازما عن الدم الكامل باستخدام أنابيب إعداد الخلايا أحادية النووية لإنتاج حبيبات PBMC المجمدة والبلازما المجمدة المناسبة لمجموعة متنوعة من التحليلات المصب. وقد استرعينا الانتباه إلى الخطوات البروتوكولية الحاسمة بشكل خاص التي تنطوي على الطرد المركزي وتحديد طبقة PBMC في الخطوة 2.5، والكريات PBMC في الخطوتين 3.3 و 3.6. تاريخيا، حيث المواقع السريرية قد ذهب في كثير من الأحيان الخطأ هو في وضع الطرد المركزي إلى الوحدات الصحيحة (الخلط بين RCF أو x قيمة ز مع قيمة RPM)، وتأخير معالجة عينات الدم ودرجة الحرارة ووجود كميات كبيرة من برنامج تلفزيوني فوق بيليه الخلية المجمدة. في معظم الدوارات الطرد المركزي إدخال خطأ قيمة x ز كإعداد دورة في الدقيقة سيؤدي إلى انخفاض كبير في الطرد المركزي مع طبقة PBMC الناتجة سيئة التحديد أو غائبة، والتخلص من PBMC غير مقصودة المحتملة أثناء خطوات الغسيل بسبب الكريات الخلية غير فعالة. ومع ذلك ، هناك احتمال أن طبقة PBMC غير مرئية على الرغم من استخدام إعدادات الطرد المركزي الصحيحة ومحول الدوار إذا كان المريض قد أصيب بلوكوبيا. يمكن أن تؤثر هذه الحالة على المرضى المسجلين في تجارب الأورام بسبب العلاج الكيميائي أو العلاج الإشعاعي ويجب النظر فيها. نقطة حرجة أخرى تم توضيحها في البروتوكول هي أنه يجب معالجة العينات في غضون 1-2 ساعة من سحب الدم لتقليل إمكانية أن يحدث انحلال الدم تأثيرا سلبيا على البروتوكول. وعلاوة على ذلك، تهدف إلى معالجة العينات خلال الساعة الأولى من سحب الدم يقلل من تقلب الجسم الحي السابق، والتي يمكن أن يكون لها تأثير كبير في قراءات الدوائية وعلى المؤشرات الحيوية المتضررة من الحفاظ على الدم أو مسارات الإشارات النشطة، مثل الحالة المبينة في الشكل 4. التأخير في معالجة العينات يمكن أن يكون لها أيضا تأثير ضار في صلاحية الخلية إذا كانت الخلايا ستكون cryopreserved34. وثمة عامل آخر يمكن أن يؤثر على كل من الغلة وتلوث خلايا الدم الحمراء هو درجة حرارة التخزين والطرد المركزي، والتي ينبغي الاحتفاظ بها في درجة حرارة الغرفة (18-25 درجة مئوية). انخفاض درجات الحرارة زيادة كثافة متوسطة الانحدار الكثافة، مما يؤدي إلى درجة أعلى من خلايا الدم الحمراء وتلوث الحبيبيات وهذه الخلايا لا تتجمع كذلك. من ناحية أخرى، يؤدي ارتفاع درجات الحرارة إلى PBMCs المحاصرين بين الكريات الحمراء المجمعة، وبالتالي تقليل العائد من إعداد15،27،28. وأخيرا، من المهم أن لا يوجد أكثر من 50-100 ميكرولتر من السائل مع بيليه الخلية في cryovial، لأن هذا يؤثر سلبا على تركيز أي lysates البروتين التي تم الحصول عليها في معالجة المصب من هذه الاستعدادات PBMC. فائض من السائل سوف تفرط عينات, مما يؤدي إلى lysates مع تركيز البروتين منخفضة جدا غير مناسبة لتحليل العلامات الحيوية. وبالإضافة إلى ذلك، سيعيق الحفاظ على أي تعديلات بعد الترجمة، كما ستنخفض كفاءة التحلل إلى حد كبير.
تم اختيار أنابيب إعداد الخلايا أحادية النووية لأنها توفر الطريقة الأكثر مباشرة لعزل كل من PBMCs والبلازما في سحب دم واحد للتجارب السريرية مع، في تجربتنا، استنساخ ممتازة. معالجة الدم لا تتطلب مشغلين مدربين تدريبا عاليا، واستخدام أنبوب واحد يزيل الحاجة إلى تمييع الدم ونقله إلى أنبوب مختلف، وخفض خطر الإصابة؛ تقصير البروتوكول بسبب تنفيذ خطوات الطرد المركزي مع الفرامل على؛ وجميع الكواشف موجودة في الأنبوب، مما يقلل من التغير. في تجربتنا، وهذه الفوائد تفوق ارتفاع تكلفة هذه الأنابيب بالمقارنة مع غيرها من الأساليب الكلاسيكية التي تتألف فقط من استخدام متوسط الفصل الانحدار الكثافة27،28 (£ 410 لكل 60 وحدة في حين أن المتوسطة lymphoprep ل66 50 مل الاستعدادات هو £ 215). وهي متوفرة في نوعين من مضادات التخثر، الهيبارين والسيترات، وكلاهما قابل للمقارنة في الحفاظ على وظائف PBMCs معزولة35،وبالتالي، فإن اختيار واحد مضاد للتخثر على الآخر سوف يستند إلى التأثير المحتمل للهبارين أو سيترات في دراسات العلامات الحيوية المصب. في حين أنه قد ثبت أن أنابيب EDTA توفير أعلى إنتاجية العزل PBMC مقارنة مع الهيبارين أو سيترات13، والاستفادة من سهولة استخدام واحد أنبوب فقط التلاعب يوازن هذا الاعتبار. إذا السيتوكينات سوف يتم تحليل المضادة للتخثر يمكن أن يكون لها تأثير على المستويات التي تم الكشف عنها في البلازما, وبالتالي ينبغي اختبار كل من مضادات التخثر قبل اختيار واحد للتجربة السريرية36. إذا البلازما سوف تستخدم لدراسات الأيض, استخدام الهيبارين كما مضادات التخثر سيكون المفضل37. ولذلك، فإن النقطة الوحيدة المتبقية للمستخدم النهائي أو عالم ترجمة التجارب السريرية هي ما إذا كان سيترات أو الهيبارين سيكون أكثر ملاءمة لأغراضهم بمجرد تقييم التكاليف.
في حين أن فوائد استخدام أنابيب إعداد الخلايا عديدة مقارنة بالقيود التي تشكلها (ارتفاع تكلفة وتوافر مجموعة محدودة من مضادات التخثر) ، فإن القيد الرئيسي لاستخدام PBMCs أو البلازما للحصول على المؤشرات الحيوية PD في التجارب السريرية ، وخاصة في علم الأورام ، يمكن أن لا يكون له علاقة بطريقة العزل. باستثناء سرطانات الدم، حيث يتم أخذ عينات مباشرة من الورم من الدم المحيطي، لمؤشرات السرطان الأخرى البلازما و PBMCs هي الأنسجة البديلة التي لا تحاكي بالضرورة الورم الأساسي. قد لا تشارك الأنسجة الطرفية الجينوم والظهارة مع الورم الأساسي ، لذلك ، يقتصر التحليل المحيطي للمؤشرات الحيوية التي تعتمد على طفرة ورم محددة بشكل رئيسي على تحليل ctDNA (من البلازما) أو CTCs (عن طريق الفرز اللاحق لطبقة PBMC). بالإضافة إلى ذلك، قد لا تكون السلاسل المتتالية التي تقود أو تساهم في انتشار الورم نشطة في الدم المحيطي. ويمكن التغلب على هذا التحدي من خلال تطبيق نهج اكتشاف العلامات الحيوية التي تستهدف الدم8 لتحديد المؤشرات الحيوية البديلة أو اقتران علاجات الجسم الحي السابق لعزل البلازما38 والاستعدادات PBMC26.
في البروتوكول الحالي يمكن معالجة الكريات PBMC المجمدة بسهولة قبالة الموقع السريري لإعطاء lysates البروتين التي يمكن تقييمها عن طريق النشاف الغربية أو تقنيات ELISA. كما عرضت أساليب بديلة لاستخدام PBMCs لتمكين أساليب IHC(ملف تكميلي). بالإضافة إلى ذلك ، قمنا أيضا بتفصيل إمكانية حفظ التبريد PBMCs (انظر الملف التكميلي)لمراقبة الخلايا المناعية ، وهو تطبيق ذي صلة في علم الأورام ، مع مثبطات نقاط التفتيش المناعية ومركبات ADCs التي تم اختبارها بشكل متزايد في التجارب السريرية. تقييم وظائف المناعة مثل ADCC16 والمناعة هي تطبيقات متوافقة مع PBMCs المبردة معزولة عن أنابيب إعداد الخلايا أحادية النواة15. هناك تحذير بشأن cryopreservation ، كما يمكن أن تعزز أسفل التنظيم من بعض العلامات السطحية والداخلية ، وربما يضعف وظائف الخلايا معينة ، ولكن PBMC cryopreservation هو السبيل الوحيد الممكن لتنفيذ هذه المقايسات بسبب ضيق الوقت عند التعامل مع عينات من مواقع سريرية متعددة لمعالجة في مختبرات خارجية14،15، وهذه الآثار الضارة يمكن التغلب عليها إلى حد كبير من خلال طرق ذوبان جيدة وفترات الراحة39.
وفي الختام، سيسمح البروتوكول المقدم هنا بالتحضير الموثوق به ل PBMCs وعينات البلازما في أي مؤسسة سريرية مزودة بمعدات ومواد مشتركة بحيث يمكن تمكين نقاط النهاية التحويلية من الدم المحيطي بقوة في التجارب السريرية العالمية.
وأخيرا، فإننا نظهر كيف يمكن لتحليل lysates PBMC أن يرشد آليا الاستجابة للعوامل الضارة بالحمض النووي من خلال إظهار تعديل ما بعد الترجمة المعتمد على الجرعة لعوامل DDR الرئيسية ، والتي يمكن استخدامها للمساعدة في تشكيل التطور السريري. ومن شأن تنفيذ أساليب أكثر كمية من النشاف الغربي (مثل قياس الطيف الكتلي40)ويتطلب مواد مدخلات أقل (مثل النشاف الغربي الشعري و ELISA) أن يساعد على تحريك هذه النتائج قبل السريرية نحو تقييم أكثر قوة ومنهجية لعينات المرضى PBMC.
Disclosures
جميع المؤلفين هم أو كانوا موظفين وأصحاب حصة في AstraZeneca. VM هو موظف في أسيرتا فارما، وتمتلك أسهم في استرازينيكا وجيلياد للعلوم.
Acknowledgements
نود أن نشكر جميع أعضاء الطب التحويلي في AstraZeneca أبحاث الأورام والتنمية المبكرة لردود فعلهم على البروتوكول ، وخاصة هيدلي كار ، تامي يه وناثان ستانديفر للحصول على المشورة بشأن إعداد البلازما لتحليل CTDNA ، على عزل PBMC ، و PBMC التبريد و cryopenotyping ، على التوالي.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL cryovial | Nalgene, ThermoFisher | 5000-1020 | To store PBMC pellets and re-suspended PBMCs |
| 1.5 mL microcentrifuge tubes | VWR | 525-0990 | This is an example, use your preferred provider |
| 15 mL conical sterile propylene centrifuge tube | Nunc, ThermoFisher | 339651 | Other brands can be used |
| 2 mL screw cap tube sterile, with attached cap | ThermoFisher | 3463 | For plasma aliquoting |
| 20X TBS Buffer | ThermoFisher Scientific | 28358 | Final is 25 mM Tris, 0,15 M NaCl; pH 7,5. This is an example, you can prepare your own stock or use a different provider |
| 20X TBS Tween 20 Buffer | ThermoFisher Scientific | 28360 | Or supplement TBS with 0.05% to prepare TBST buffer |
| Automated cell counter or haemocytometer | ThermoScientific | AMQAX1000 | We use Countess device and slides but could be other methods. |
| Adjustable micropipette allowing 50 µL measurements | To handle small volumes (i.e. western blot, transfer PBMC pellets to 1.5 mL tubes) | ||
| BD Vacutainer CPT mononuclear cell preparation tube (Na-citrate or Na-heparin) 8 mL | BD | 362761, 362753 | There are 4 mL tubes but if possible 8 mL tubes are recommended to obtain more PBMCs from a single blood draw |
| Cell-freezing box | ThermoFisher Scientific | 5100-0001 | This is an example, use your preferred provider. |
| Centrifugation unit converter | LabTools | http://www.labtools.us/centrifugation-speed-rpm-to-g-conversion/ | |
| DMSO | Sigma-Aldrich, MERK | D2438 | Use your preferred provider. Ued for PBMC cryopreservation |
| ECL horseradish peroxidase substrate | ThermoFisher | 34075 | Use your preferred reagent according to the sensitivity required to detect your biomarker by western blot. Other systems can be used such as IRDye secondary antibodies with imaging systems. |
| Faxitron MultiFocus X-ray cabinet | Faxitron Bioptics | To irradiate blood. Other models/makers are available | |
| Fetal Bovine Serum (FBS), heat inactivated | ThermoScientific | 102706 | Use your preferred provider. Ued for PBMC cryopreservation |
| Fine tip, sterile 1.5 mL Pasteur pipettes | VWR | 414004-018 | Optional |
| Fixed-angle rotor centrifuge | Optional for preparation of plasma for ctDNA/metabolomics | ||
| Gel doc imaging system | SYNGENE | For imaging HRP developed membranes | |
| Heat block | To denature lysates prior to run them in western blot, any maker equipped with suitable tube adaptors | ||
| Horizontal rotor (swing-out head) centrifuge | Thermoscientific | Heraeus Megafuge 40R | This is an example |
| Liquid nitrogen/dry ice | To flash-freeze samples | ||
| Marvel dried skimmed milk | Premier Foods | This is an example, use your preferred provider | |
| Micropipette tips for range 1-200 µL | To handle small volumes (i.e. western blot, transfer PBMC pellets to 1.5 mL tubes) | ||
| NuPAGE 4-12% Bis-Tris protein gel, 1 mm, 10 wells | ThermoFisher Scientific | NP0321BOX | This is an example, cast your own or use your preferred provider |
| NuPAGE LDS Sample Buffer (4X) | ThermoFisher Scientific | NP0007 | For imaging HRP developed membranes |
| NuPAGE Sample Reducing Agent (10X) | ThermoFisher Scientific | NP0009 | This is an example. |
| PBS, no calcium, no magnesium | Gibco, ThermoFisher | 14190-144 | This is usually provided in the clinical kit. |
| Phosphatase inhibitor cocktail 2 | Sigma-Aldrich, MERK | P5726-1ML | Optional for step 3.7 |
| Phosphatase inhibitor cocktail 3 | Sigma-Aldrich, MERK | P0044-1ML | Optional for step 3.7 |
| Rabbit anti GAPDH | Cell Signaling Technology | CST 2128 | 1:1000 dilution in 5% milk TBST |
| Rabbit anti γH2AX | Cell Signaling Technology | CST 2577, lot 11 | 1:2000 dilution in 5 % milk TBST |
| Rabbit anti pS1981 ATM | Abcam | ab81292 | 1:2000 dilution in 5 % milk TBST |
| Rabbit anti pS635 RAD50 | Cell Signaling Technology | CST 14223 | 1:1000 dilution in 5 % milk TBST |
| Rabbit anti total ATM | Abcam | ab32420 | 1:1000 dilution in 5 % milk TBST |
| Rabbit anti total RAD50 | Cell Signaling Technology | CST 3427, lot 2 | 1:1000 dilution in 5 % milk TBST |
| RIPA buffer | Sigma-Aldrich, MERK | R0278-50ML | For cell lysis. This is an example, use your preferred provider |
| Sonicator | Diagenode | B01060010 | Used for 3 cycles at 30 s on/ 30 s off, 4 oC. If using a different instrument, adjust number of cycles and intensity according to your sonicator. |
| Sterile 1.7 mL Pasteur pipettes | VWR | 414004-030 | This is an example, use your preferred provider |
| Sterile serological pipettes (5 and 10 mL volume) | Costar | 4101, 4051 | This is an example, use your preferred provider |
| Trypan blue | ThermoScientific | T10282 | This is for the automated cell counter listed above. |
| Wet ice | To keep plasma samples and lysates cold |
References
- Hoelder, S., Clarke, P. A., Workman, P. Discovery of small molecule cancer drugs: successes, challenges. and opportunities. Molecular Oncology. 6, 155-176 (2012).
- Harrigan, J. A., Jacq, X., Martin, N. M., Jackson, S. P. Deubiquitylating enzymes and drug discovery: emerging opportunities. Nature Reviews Drug Discovery. 17, 57-77 (2018).
- Brown, J. S., O'Carrigan, B., Jackson, S. P., Yap, T. A. Targeting DNA repair in cancer: beyond PARP inhibitors. Cancer Discovery. 1, 20-37 (2017).
- Pettersson, M., Crews, C. M. PROteolysis TArgeting Chimeras (PROTACs)-Past, present and future. Drug Discovery Today: Technologies. 31, 15-27 (2019).
- Scott, A. M., Wolchok, J. D., Old, L. J. Antibody therapy of cancer. Nature Reviews Cancer. 12, 278-287 (2012).
- Thomas, A., Teicher, B. A., Hassan, R. Antibody-drug conjugates for cancer therapy. The Lancet Oncology. 17 (6), 254 (2016).
- Ferguson, F. M., Gray, N. S. Kinase inhibitors: the road ahead. Nature Reviews Drug Discovery. 17 (5), 353-377 (2018).
- Jones, G. N., et al. pRAD50: a novel and clinically applicable pharmacodynamic biomarker of both ATM and ATR inhibition identified using mass spectrometry and immunohistochemistry. British Journal of Cancer. 119 (10), 1233-1243 (2018).
- Cook, D., et al. Lessons learned from the fate of AstraZeneca's drug pipeline: a five-dimensional framework. Nature Reviews Drug Discovery. 13, 419-431 (2014).
- Overman, M. J., et al. Use of research biopsies in clinical trials: are risks and benefits adequately discussed. Journal of Clinical Oncology. 31 (1), 17-22 (2012).
- Olson, E. M., Lin, N. U., Krop, I. E., Winer, E. P. The ethical use of mandatory research biopsies. Nature reviews Clinical Oncology. 8, 620-625 (2011).
- O'Donnell, A., et al. Phase I pharmacokinetic and pharmacodynamic study of the oral mammalian target of rapamycin inhibitor Everolimus in patients with advanced solid tumors. Journal of Clinical Oncology. 26 (10), 1588-1595 (2008).
- Fong, P. C., et al. Inhibition of Poly(ADP-Ribose) polymerase in tumors from BRCA mutation carriers. The New England Journal of Medicine. 361 (2), 123-134 (2009).
- Verschoor, C. P., Kohli, V., Balion, C. A comprehensive assessment of immunophenotyping performed in cryopreserved peripheral whole blood. Cytometry B Clinical Cytometry. 94 (5), 662-670 (2018).
- Ruitenberg, J. J., et al. VACUTAINER®CPT™ and Ficoll density gradient separation perform equivalently in maintaining the quality and function of PBMC from HIV seropositive blood samples. BMC Immunology. 7 (11), (2006).
- Yamashita, M., et al. A novel method for evaluating antibody-dependent cell-mediated cytotoxicity by flowcytometry using cryopreserved human peripheral blood mononuclear cells. Scientific Reports. 6 (19772), 1-10 (2016).
- Schiavon, G., et al. Analysis of ESR1 mutation in circulating tumor DNA demonstrates evolution during therapy for metastatic breast cancer. Science Translational Medicine. 7 (313), 182 (2015).
- Lee, J., et al. Tumor genomic profiling guides metastatic gastric cancer patients to targeted treatment: the VIKTORY umbrella trial. Cancer Discovery. , (2019).
- Abbosh, C., et al. Phylogenetic ctDNA analysis depicts early-stage lung cancer evolution. Nature. 545, 545 (2017).
- Thress, K. S., et al. Acquired EGFR C797S mutation mediates resistance to AZD9291 in non-small cell lung cancer harboring EGFR T790M. Nature Medicine. 21 (6), 560-562 (2015).
- Rossi, G., Ignatiadis, M. Promises and pitfalls of using liquid biopsy for precision medicine. Cancer Research. 79 (11), 2798-2804 (2019).
- Balasubramanian, P., et al. Isolation and characterisation of circulating tumor cells (CTCs) from peripheral blood specimens of patients with advanced solid tumor malignancies (using ApoStream® instrumentation) [abstract 3062]. Proceedings of the Annual meeting of the American Association for Cancer Research. , (2014).
- Qin, J., Alt, J. R., Hunsley, B. A., Williams, T. L., Fernando, M. R. Stabilization of circulating tumor cells in blood using a collection device with a preservative reagent. Cancer Cell International. 14 (13), 1-6 (2014).
- Biomarkers definitions working group. Biomarkers and surrogate endpoints: preferred definitions and conceptual framework. Clinical Pharmacology & Therapeutics. 69 (3), 89-95 (2001).
- Crowley, E., Di Nicolantonio, F., Loupakis, F., Bardelli, A. Liquid biopsy: monitoring cancer-genetics in the blood. Nature Reviews Clinical Oncology. 10, 472-484 (2013).
- Bundred, N., et al. Evaluation of the pharmacodynamics of the PARP inhibitor olaparib: a phase I multicentre trial in patients scheduled for elective breast cancer surgery. Investigational New Drugs. 31, 949-958 (2013).
- Rosado, M., et al. Advances in biomarker detection: Alternative approaches for blood-based biomarker detection. Advances in Clinical Chemistry. 92, 141-199 (2019).
- Grievink, H. W., et al. Comparison of three isolation techniques for human peripheral blood mononuclear cells: cell recovery and viability, population composition and cell functionality. Biopreservation and Biobanking. 14 (5), 410-415 (2016).
- Khadka, M., et al. The effect of anticoagulants, temperature, and time on the human plasma metabolome and lipidome from healthy donors as determined by liquid chromatography-mass spectrometry. Biomolecules. 9 (5), 1-15 (2019).
- Hellmann, M. D., et al. Circulating tumor DNA analysis to assess risk of progression after long-term response to PD-(L)1 blockade in NSCLC. Clinical Cancer Research. 26 (12), 2849-2858 (2020).
- ClinicalTrials.gov [Internet}. Identifier NCT03328273, A study of AZD6738 and Acalabrutinib in subjects with relapsed or refractory chronic lymphocytic leukemia (CLL). National Library of Medicine (US) Available from: https://clinicaltrials.gov/ct2/show/NCT03328273 (2017)
- Kirschner, M. B., et al. The impact of hemolysis on cell-free microRNA biomarkers. Frontiers in Genetics. 4 (94), 1-13 (2013).
- Blackford, A. N., Jackson, S. P. ATM, ATR, and DNA-PK: The Trinity at the Heart of the DNA Damage Response. Molecular Cell. 66, 801-817 (2017).
- Riedhammer, C., Halbritter, D., Weissert, R. Peripheral Blood Mononuclear Cells: Isolation, Freezing, Thawing, and Culture. Methods in Molecular Biology. 1304, 53-61 (2016).
- Basavaraj, M. G., Østerud, B., Hansen, J. B. Influence of different anticoagulants on monocyte procoagulant functions and monocyte-platelet aggregates formation. Journal of Thrombosis and Haemostasis. 9 (8), 1673-1676 (2011).
- Biancotto, A., Feng, X., Langweiler, M., Young, N. S., McCoy, J. P. Effect of anticoagulants on multiplexed measurements of cytokine/chemokines in healthy subjects. Cytokine. 60, 438-446 (2012).
- Wawrzyniak, R., et al. New plasma preparation approach to enrich metabolome coverage in untargeted metabolomics: plasma protein bound hydrophobic metabolite release with proteinase K. Scientific Reports. 8, 1-10 (2018).
- Duffy, D., et al. Standardized whole blood stimulation improves immunomonitoring of induced immune responses in multi-center study. Clinical Immunology. 183, 325-335 (2017).
- Wang, L., et al. Standardization of cryopreserved peripheral blood mononuclear cells through a resting process for clinical immunomonitoring- development of an algorithm. Cytometry A Clinical Cytometry. 89, 246-258 (2016).
- Whiteaker, J. R., et al. Targeted mass spectrometry enables robust quantification of FANCD2 mono-ubiquitination in response to DNA damage. DNA Repair. 65, 47-53 (2018).
- Lam, N. Y., Rainer, T. H., Chiu, R. W., Lo, Y. M. EDTA is a better anticoagulant than heparin or citrate for delayed blood processing for plasma DNA analysis. Clinical Chemistry. 50, 256-257 (2004).
- Parpart-Li, S., et al. The effect of preservative and temperature on the analysis of circulating tumor DNA. Clinical Cancer Research. 23 (10), 2471-2477 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved