Method Article
Préparation de pastilles de cellules mononucléaires de sang périphérique et de plasma à partir d’une seule prise de sang sur des sites d’essais cliniques pour l’analyse de biomarqueurs
Dans cet article
Résumé
Ce protocole détaille la préparation cliniquement réalisable de bioéchantillons pbmc et plasma de haute qualité sur le site de l’essai clinique qui peuvent être utilisés pour l’analyse translationnelle de biomarqueurs.
Résumé
L’analyse des biomarqueurs dans le sang périphérique devient de plus en plus importante dans les essais cliniques pour établir la preuve du mécanisme permettant d’évaluer les effets du traitement et d’aider à orienter l’établissement de la dose et du calendrier thérapeutique. D’une prise de sang simple, des cellules mononucléaires de sang périphérique peuvent être isolées et traitées pour analyser et quantifier des marqueurs de protéine, et des échantillons de plasma peuvent être utilisés pour l’analyse de l’ADN de circulation de tumeur, des cytokines, et de la métabolomique de plasma. Les échantillons longitudinaux d’un traitement fournissent des informations sur l’évolution d’un marqueur protéique donné, le statut mutationnel et le paysage immunologique du patient. Cela ne peut être réalisé que si le traitement du sang périphérique est effectué efficacement dans les sites cliniques et que les échantillons sont correctement préservés du chevet au banc. Ici, nous présentons un protocole optimisé à usage général qui peut être mis en œuvre sur des sites cliniques pour obtenir des pastilles PBMC et des échantillons de plasma dans des essais cliniques multicentriques, qui permettra aux professionnels cliniques des laboratoires hospitaliers de fournir avec succès des échantillons de haute qualité, quel que soit leur niveau d’expertise technique. D’autres variantes de protocole sont également présentées qui sont optimisées pour des méthodes d’analyse en aval plus spécifiques. Nous appliquons ce protocole pour étudier les biomarqueurs protéiques contre la réponse aux dommages à l’ADN (DDR) sur le sang irradié aux rayons X afin de démontrer la pertinence de l’approche dans les milieux oncologiques où les médicaments DDR et/ou la radiothérapie ont été pratiqués ainsi que dans les stades précliniques où des tests d’hypothèse mécanistes sont nécessaires.
Introduction
Le développement de médicaments vise à fournir de nouveaux traitements répondant aux besoins médicaux non satisfaits et une médecine personnalisée plus ciblée. De multiples mécanismes médicamenteux sont activement à l’étude, notamment l’inhibition enzymatique tels que la kinase1,la protéase2,ou les inhibiteurs de la poly (ADP-ribose) polymérase (PARP)3,les dégradeurs de protéines4,les anticorps thérapeutiques5et les médicaments conjugués aux anticorps (ADC)6,parmi beaucoup d’autres. Un exemple des efforts pour obtenir de meilleurs traitements en oncologie est l’utilisation d’inhibiteurs de kinase dans le but d’arrêter les cascades de signalisation qui maintiennent les cellules cancéreuses proliférant1,7. Mesurer les niveaux de phosphorylation du substrat spécifiques à ces kinases est le meilleur biomarqueur pharmacodynamique pour quantifier le mécanisme d’action de ces inhibiteurs8. D’autres médicaments peuvent moduler l’expression d’une protéine donnée et, dans ce cas, il est primordial de quantifier longitudinalement les changements de concentration de leur protéine cible tout au long du traitement. Par conséquent, indépendamment des caractéristiques d’un médicament ou d’une pathologie, l’évaluation des biomarqueurs pour établir la relation pharmacocinétique (PK)/pharmacodynamique (PD) entre l’exposition au médicament et la modulation cible est la meilleure pratique au début du développement clinique et permet de déterminer une dose/un calendrier pharmacologiquement actif sûr et toléré9.
Alors que dans le développement clinique en oncologie, l’analyse de biomarqueurs dans les biopsies pourrait être le meilleur cadre pour établir la preuve du mécanisme d’un médicament, le nombre de biopsies disponibles dans un essai est généralement assez limité10,11. Alternativement, les échantillons de sang périphériques sont très précieux pour les essais cliniques parce qu’ils impliquent une procédure mini-invasive, sont rapides et faciles à obtenir facilitant l’analyse longitudinale, sont moins chers que les biopsies et fournissent de vastes informations pour la surveillance en temps réel des résultats d’un traitement. Un avantage supplémentaire à l’évaluation des biomarqueurs de LAM dans le sang périphérique est la capacité d’utiliser l’échantillon biologique pour quantifier également la PK permettant d’obtenir l’exactitude de la détermination des relations quantitatives PK/PD et de la modélisation PK/PD ultérieure12,13. Les cellules mononucléaires du sang périphérique (PBMC) du sang total peuvent être isolées pour étudier les marqueurs protéiques, qui subissent des changements dans leur niveau d’expression ou dans leurs modifications post-traductionnelles. En outre, les PBMC peuvent être utilisés à des fins d’immunophénotypage14,15,des tests de fonctionnalité immunitaire tels que l’évaluation de la cytotoxicité cellulaire dépendante des anticorps (ADCC)16 et l’analyse épigénétique par isolation de l’ARN. De même, le plasma du sang total peut être utilisé pour quantifier les cytokines afin de caractériser la réponse immunologique d’un patient, d’effectuer des études métaboliques, et aussi d’isoler et de séquencer l’ADN tumoral circulant (ADNc) pour surveiller l’évolution clonale de la maladie sous sélection de l’agent thérapeutique, fournissant fréquemment une base mécaniste pour la résistance au traitement17,18,19 permettant le développement des générations suivantes de thérapeutiques20. Enfin, l’isolement des cellules tumorales circulantes (CTCs) à partir du sang périphérique permet d’évaluer la progression de la maladie par dénombrement longitudinal, séquençage ADN/ARN et analyse protéine-biomarqueur21. Bien que cet isolement soit compatible avec le protocole décrit ici22,la faible abondance de CTCs dans beaucoup de types de cancer et aux stades précoces de la maladie rend l’utilisation des tubes spécialisés plus appropriée pour réduire au minimum la dégradation de CTC23.
Ces dernières années, l’utilisation de biopsies liquides a amélioré les informations obtenues dans les essais cliniques et les collections pbmc ont été incluses dans de nombreuses études pour surveiller l’engagement de la cible et la preuve du mécanisme soit directement dans les cellules tumorales pour certains types de malignités hématologiques, ou sur les PBMC eux-mêmes comme substituts des cellules tumorales24,25,26. La préparation d’échantillons de haute qualité a un impact positif sur la détermination du traitement le plus sûr et le plus efficace pour une pathologie donnée, mais selon notre expérience, la qualité des préparations pbmc obtenues à partir de différents sites cliniques a été soumise à une grande variabilité de qualité résultant en des échantillons qui ne sont pas adaptés aux fins de l’analyse en aval. Cela a eu une incidence sur la quantité de données sur la MP qui pourraient être recueillies dans le cadre de ces études.
Ici nous décrivons en détail un protocole facile à suivre qui montre comment isoler efficacement pbmcs et échantillons de plasma d’une prise de sang simple dans un arrangement clinique. Le protocole est basé sur les instructions fournies par le fabricant des tubes de préparation de cellules mononucléaires, qui intègrent des modifications où l’expérience du monde réel a mis en évidence des difficultés dans l’exécution du protocole telles que rapportées par les sites cliniques, telles que des problèmes de centrifugation, des retards de traitement et le transfert d’échantillons aux cryovials. Il existe des procédés alternatifs disponibles dans le commerce à l’utilisation de tubes de préparation cellulaire mononucléaire basés sur la séparation par gradient de densité à l’aide de solutions polysaccharidiques avec ou sans barrière qui sépare la solution du sang27. Si l’emplacement clinique approprié est déjà bien expérimenté dans ces méthodologies alternatives, ce protocole peut être acceptablement substitué par ces dernières. Dans de tels cas, deux facteurs peuvent être pris en compte : certaines méthodes de rechange exigent un transfert de sang total d’un tube de collecte à un tube de préparation distinct où un transfert supplémentaire de matériel biologique primaire humain peut présenter un risque d’innocuité légèrement accru, et le succès des méthodes sans barrières séparant le sang de la solution polysaccharidique repose sur des étapes critiques telles que la superposition de l’échantillon de sang sur le milieu à gradient de densité nécessitant le développement d’un niveau raffiné d’expertise technique que l’on ne trouve pas toujours dans un laboratoire hospitalier. Nonobstant les points ci-dessus, la viabilité globale et la récupération cellulaire sont comparables entre ces techniques15,28. Le choix de la méthodologie dépend donc quelque peu de l’expérience technique antérieure, mais entre nos mains, des tubes mononucléaires de préparation de cellules peuvent être utilisés avec succès dans un large contexte clinique et sont notre, autrement, recommandation.
Bien que l’un des paramètres de ce protocole soit de produire des pastilles de PBMC pour un traitement ultérieur en lysats, d’autres applications finales de la collection de PBMC pourraient être mises en œuvre, telles que l’isolement des acides nucléiques ou la production de frottis de PBMC ou de blocs de PBMC adaptés aux méthodes d’immunohistochimie (IHC). Il est important de noter que chaque échantillon biologique prélevé sur des patients représente une procédure invasive à au moins un certain niveau, ce protocole maximise le matériel utile de chaque échantillon en isolant également le plasma qui peut être utilisé pour les analyses de cytokines, les études métabolomiques ou le séquençage de l’ADNc.
L’analyse des biomarqueurs périphériques dans les essais en oncologie est l’une des nombreuses applications des lysats pbmc. Un exemple est l’évaluation de la réponse aux dommages à l’ADN (DDR) dans des traitements tels que la chimiothérapie, la radiothérapie ou l’utilisation d’inhibiteurs d’enzymes impliquées dans le DDR tels que les kinases liées à la kinase phosphatidylinositol-3 (PIKKs)7 et les PARPs3,13. Le but de ces traitements est d’augmenter les dommages à l’ADN dans les cellules proliférantes, ce qui génère une toxicité élevée dans les cellules avec des mécanismes de DDR altérés et des points de contrôle du cycle cellulaire, tels que les cellules cancéreuses. Nous présentons ici un exemple avec une étude des biomarqueurs DDR dans le sang périphérique soumis à des rayons X.
Protocole
Le consentement éclairé du patient et le respect intégral des exigences éthiques nationales pertinentes dans chaque juridiction, par exemple la loi sur les tissus humains (HTA – Royaume-Uni, 2004) et la loi sur la portabilité et la responsabilité en matière d’assurance maladie (HIPAA – États-Unis, 1996) sont obligatoires. Assurez-vous d’avoir une approbation éthique entièrement documentée avant de commencer tout travail sur des matériaux d’origine humaine. Le sang utilisé dans l’optimisation de ce protocole a reçu le consentement approprié du Volunteers Advancing Medicine Panel (VAMP) (référence éthique 16/EE/0459, étude CRF494, sous-étude 001) géré par le NIHR Cambridge Clinical Research Facility, Cambridge, Royaume-Uni, en vertu d’un accord de fourniture d’échantillons biologiques humains avec le National Institute for Health Research (NIHR) Cambridge Biomedical Research Centre. La biobanque d’AstraZeneca au Royaume-Uni est autorisée par la Human Tissue Authority (licence n° 12109) et a l’approbation du National Research Ethics Service Committee (NREC) en tant que banque de tissus de recherche (RTB) (REC n° 17/NW/0207).
1. Conseils généraux de préparation
NOTA : Tous les travaux effectués avec du matériel humain non fixé, comme le sang, le plasma et les PBMC, dans le présent protocole doivent être effectués en supposant que ces matières peuvent être porteuses d’agents potentiellement infectieux et doivent donc être effectués selon des précautions de biosécurité appropriées. Pour les patients qui ont été testés négatifs pour des agents pathogènes connus, ne présumez pas que les échantillons ne sont pas infectieux et, par conséquent, des précautions de sécurité appropriées doivent tout de même être appliquées. Les déchets produits à partir de ces matières doivent être traités avec les mêmes précautions de biosécurité et éliminés conformément aux règles locales.
- Choisissez entre les deux types de tubes de préparation de cellules mononucléaires qui utilisent le citrate de sodium ou l’héparine de sodium comme anticoagulants. Pour de nombreuses applications en aval, ces deux anticoagulants peuvent être utilisés de manière interchangeable, mais les deux anticoagulants doivent être testés avant d’en sélectionner un pour l’essai.
- Étiqueter un tube de préparation de cellules mononucléaires de 8 mL à utiliser pour la collecte de sang avec l’ID codé du patient. Maintenir les tubes à température ambiante (18-25 °C).
- Conserver 1x PBS à température ambiante (18-25 °C). Utilisez 30 mL par préparation.
- Assurez-vous que les tubes pour les échantillons de plasma séparés et le cryovial pour l’échantillon PBMC sont étiquetés avec précision avec des identificateurs uniques, comme spécifié dans la section appropriée du manuel de laboratoire.
- Si les PBMC doivent être utilisés pour surveiller les protéines phosphorylées, préparer le PBS complété par des inhibiteurs de la phosphatase: mélanger 5 mL de PBS avec 50 μL de cocktail d’inhibiteurs de la phosphatase 2 + 50 μL de cocktail d’inhibiteurs de la phosphatase 3. Préparez frais et gardez sur la glace jusqu’à l’utilisation.
- Si les PBMC doivent être cryoconservés, préparer 1 mL de mélange de congélation par échantillon en mélangeant 90 % de FBS + 10 % de DMSO.
2. Collecte de PBMC (Figure 1A)
- Prélever 8 mL de sang dans le tube de préparation de cellules mononucléaires en utilisant la technique standard décrite par le fabricant. Inversez doucement le tube 8 à 10 fois pour mélanger l’additif anticoagulant avec du sang. Ne pas secouer pour éviter l’hémolyse. Notez l’heure à laquelle le sang a été prélevé.
- Après la collecte, rangez le tube à la verticale à température ambiante jusqu’à la centrifugation. Traiter les échantillons dès que possible, idéalement dans l’heure suivant ce prélèvement sanguin, mais au plus tard 4 h après le prélèvement. Notez le moment où vous commencez le traitement du sang.
- Immédiatement avant la centrifugation, remixez l’échantillon de sang en inversant doucement le tube 8 à 10 fois de plus.
- Centrifuger les tubes de prélèvement de tube/sang dans un rotor horizontal (tête pivotante) à 1 500 – 1 800 x g pendant 30 min à température ambiante (18-25 °C). Assurez-vous que tous les tubes sont équilibrés correctement.
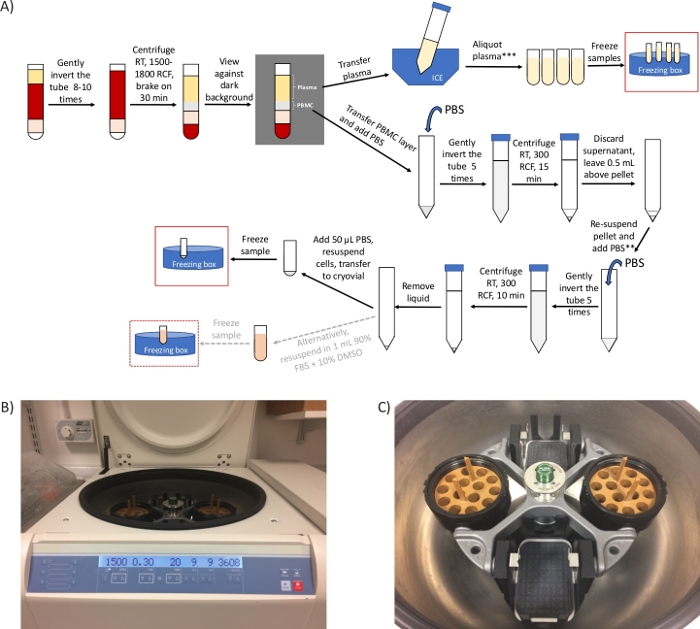
Figure 1 : Aperçu général du protocole et images représentatives de la centrifugeuse. (A) Vue d’ensemble schématique du protocole de préparation des PBMC et du plasma. *S’il y a des contraintes de temps, l’étape 2.4 peut être raccourcie à 20 min et les étapes 3.3 à 3.6 peuvent être supprimées. ** Prendre une partie aliquote pour compter les cellules, au besoin. 2 étapes de centrifugation supplémentaires requises pour l’analyse de l’ADNc/image métabolomique(B)d’une centrifugeuse à rotor à tête pivotante réglée pour l’étape 2.4. (C) Image du rotor, qui comprend deux godets contenant les adaptateurs pour faire tourner des tubes de préparation de cellules mononucléaires. Veuillez cliquer ici pour voir une version plus grande de cette figure.
REMARQUE: x g (également appelé RCF, unités centrifuges relatives) et RPM (tours par minute) sont des unités différentes. Assurez-vous de régler la centrifugeuse pour x g (RCF). Utilisez la calculatrice en ligne (voir la table des matériaux) pour la conversion. Si seul un rotor à angle fixe est disponible, effectuez cette étape pendant 10 min à 1 500 – 1 800 x g.
- Après centrifugation, vérifiez la présence d’une couche rouge foncé sous la barrière (contenant principalement des globules rouges) et de 2 couches au-dessus de la barrière. La couche supérieure est le plasma (de couleur paille) et la couche blanchâtre en dessous est la couche chamois contenant les PBMC. Ces couches peuvent être facilement distinguées lors de la visualisation du tube sur un fond sombre / noir.
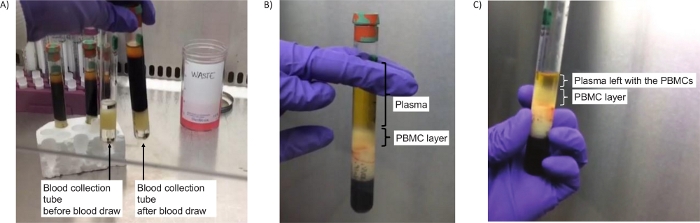
Figure 2 : Tubes pour isoler les PBMC. (A)Image des tubes avant centrifugation (étape 2.4), soit vides (à gauche), soit contenant du sang (à droite). (B)Séparation réussie de la couche PBMC après centrifugation (étape 2.5). (C) Image de la couche PBMC après centrifugation et un peu de plasma laissé pour s’assurer que tous les PBMC sont collectés (étape 2.7). Veuillez cliquer ici pour voir une version plus grande de cette figure.
Remarque : Si ces couches ne sont pas visibles, cela indique probablement une erreur dans la configuration des unités de centrifugation. Assurez-vous que le bon adaptateur de centrifugeuse est utilisé et que les « x g » corrects sont définis. Répétez l’étape 2.4.
- Immédiatement après la centrifugation, utilisez une pipette sérologique pour transférer environ la moitié du plasma dans un tube de centrifugation conique de 15 mL marqué avec capuchon, tout en prenant soin de ne pas perturber la couche PBMC (environ 4-5 mL). Stocker temporairement ce tube avec du plasma sur de la glace humide pour l’utiliser plus tard à l’étape 4. Mettre de côté pour l’instant.
- Recueillir toute la couche PBMC avec une pipette Pasteur en plaçant la pipette dans la couche de cellules et le transférer dans un tube de centrifugation conique de taille différente de 15 mL avec capuchon. Il est acceptable de prendre également une petite quantité de plasma, si nécessaire, pour obtenir complètement toute la couche PBMC. Le volume est généralement de 1-2 mL. Passez immédiatement à l’étape 3 ci-dessous.
3. Étapes de lavage PBMC
REMARQUE: Le but des étapes de lavage est de diluer et d’éliminer les plaquettes résiduelles et le plasma de la pastille PBMC. Toutes les étapes de centrifugation doivent être effectuées à température ambiante (18-25 °C).
- Ajouter du PBS à température ambiante au tube PBMC pour porter le volume à 15 mL. Coiffez le tube. Mélanger les cellules en inversant doucement le tube 5 fois.
- Centrifugeuse pendant 15 min à 300 x g. Notez qu’il s’agit d’une centrifugation beaucoup plus douce que la centrifugation initiale.
- Visualisez la pastille en visualisant le tube sur un fond sombre / noir. Retirer le surnageant par aspiration sous vide ou à l’aide d’une pipette(figure 3A). Jeter le surnageant en laissant un volume d’environ 500 μL au-dessus de la pastille de PBMC de couleur blanchâtre.
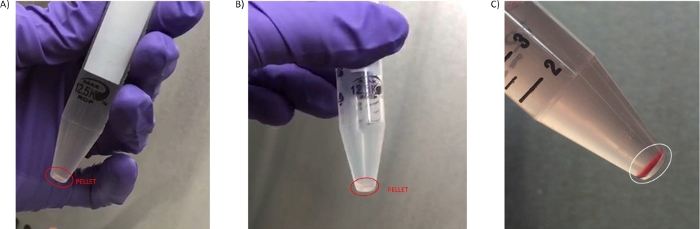
Figure 3 : Granulés de PBMC. (A) Granulés obtenus lors de la première étape de lavage 3.3. B)Granulés isolés lors du deuxième lavage (étape 3.7). (C) Granulé à haut niveau d’hémolyse obtenu à partir de sang traité après 4 h à partir de la prise de sang isolée lors du deuxième lavage (étape 3.6). Veuillez cliquer ici pour voir une version plus grande de cette figure.
- Remettez en suspension la pastille cellulaire en la pipetant doucement de haut en bas dans le surnageant résiduel.
- Ajoutez 1x PBS supplémentaire pour porter le volume à 10 mL. Coiffez le tube. Mélanger les cellules en inversant doucement le tube 5x. Si le comptage cellulaire est requis dans le protocole d’étude, passez à l’étape 3.5.1, si ce n’est pas nécessaire, passez directement à l’étape 3.6.
- Prendre une aliquote de 40 μL des cellules re-suspendues et mélanger avec 40 μL de bleu trypan. Comptez les cellules viables à l’aide d’un hémocytomètre ou d’un compteur automatique de cellules.
- Centrifuger la suspension de l’étape 3.5 pendant 10 min à 300 x g. Enlevez autant de surnageant que raisonnablement possible sans perturber la pastille cellulaire.
- Retirez et jetez soigneusement tout surnageant restant au-dessus de la pastille cellulaire en pipetant à l’aide d’une pipette Pasteur à pointe fine ou d’une micropipette sans perturber la pastille cellulaire. Laissez peu ou pas de liquide au-dessus de la pastille après avoir terminé cette étape. Si le point final de ce protocole est une pastille PBMC, passez à l’étape 3.8 ; si le point final est cryoconserved PBMC passez à l’étape 3.10.
- Ajouter 50 μL de nouveau PBS (ou le PBS complété préparé à l’étape 1.5, le cas échéant, à votre paramètre) à la pastille et pipetter doucement à l’aide d’une micropipette pour ressusciter de manière homogène toutes les cellules. Transférer toute la suspension cellulaire dans un cryovial marqué de 1,5 mL et la placer immédiatement sur de la glace humide jusqu’à congélation des échantillons.
- Congeler les échantillons marqués en les plaçant dans de l’azote liquide ou directement dans de la glace carbonique. Les cellules peuvent également être congelées à -80 °C au congélateur à l’aide de boîtes de congélation cellulaire. Dans ce cas, préchill les boîtes complètement en -80 °C avant d’ajouter les tubes cellulaires. Noter l’heure à laquelle les pastilles cellulaires ont été congelées. Une fois les cellules gelées, conserver à -80 °C, expédier congelé sur de la glace carbonique.
- Éventuellement, pour cryoconserver les PBMC, re-suspendre le culot dans 1 mL du mélange de congélation (étape 1.6) et le transférer dans un cryovial marqué. Continuer comme décrit à l’étape 3.9, mais, dans ce cas, il n’est acceptable d’utiliser que des boîtes de congélation cellulaire pour congeler les échantillons. Transférer dans de l’azote liquide pour l’expédition et le stockage après avoir été dans la boîte de congélation pendant au moins 24 h.
4. Étapes de préparation du plasma (Figure 1A)
- Après le stockage à -80 °C des pastilles de PBMC, préparez maintenant la partie aliquote plasmatique qui a été temporairement stockée sur de la glace humide à l’étape 2.6. Effectuez les étapes de centrifugation suivantes pour clarifier le plasma si le but de l’échantillon est l’analyse de l’ADNc, sinon passez directement à l’étape 4.2.
- Centrifuger le plasma pendant 10 min à 1 600 - 2 000 x g à 4 – 8 °C dans un rotor à angle fixe (ou 15 min dans un rotor pivotant).
- Pipetter soigneusement le surnageant plasmatique, en prenant soin de ne pas déranger les pastilles et de les transférer dans un nouveau tube de 15 mL. Jeter le tube contenant le matériau granulé.
- Centrifuger le plasma pendant 10 min à 1 600 - 2 000 x g à 4 – 8 °C dans un rotor à angle fixe (ou 15 min dans un rotor pivotant).
- Transférez soigneusement le surnageant plasmatique dans un nouveau tube de 15 mL, en vous assurant de ne pas déranger les matériaux granulés. Jeter le tube contenant le matériau granulé.
NOTA : Si une centrifugeuse réfrigérée n’est pas disponible, conservez les cellules sur la glace pendant 5 min entre chaque vrille ou les échantillons de centrifugeuse dans une chambre froide.
- Transférer le plasma dans des aliquotes de 1 mL dans 5 microtubes frais de 2 mL. Utilisez moins de 5 flacons s’il n’y a pas assez de plasma pour remplir 5 flacons avec des aliquotes de 1 mL et on s’attend à ce que le dernier flacon contienne moins de 1 mL de plasma. S’il y a plus de 5 mL de plasma, jetez le reste. Enregistrer le volume total de plasma dans chaque tube.
- Congeler immédiatement les aliquotes plasmatiques à la verticale, en les stockant à -80 °C.
5. Envoi d’échantillons
- Expédiez les pastilles de PBMC et les échantillons de plasma sur de la glace carbonique.
- S’assurer que l’échantillon n’est pas décongelé avant et pendant l’expédition. Emballer suffisamment de glace carbonique avec les échantillons pour s’assurer qu’ils restent congelés pendant toute la durée du processus d’expédition, en tenant compte des retards possibles qui peuvent survenir pendant le transport.
6. Irradiation du sang total et analyse par transfert western des biomarqueurs DDR (Figure 4A)
REMARQUE: Il s’agit d’un traitement ex vivo qui ne sera pas nécessaire dans la plupart des cas en clinique, mais ces expériences sont une stratégie exploratoire précieuse pour trouver des biomarqueurs cliniques appropriés. Les échantillons de sang doivent être traités dès que possible après le prélèvement afin d’assurer les meilleurs résultats.
- Réchauffez l’armoire à rayons X. Étiquetez trois tubes de 15 mL comme étant de 0, 0,2 et 7 Gy, respectivement.
- Prenez trois tubes de préparation de cellules mononucléaires contenant du sang fraîchement prélevé d’un seul individu et après avoir doucement inversé les tubes 8 à 10 fois transférer les sangs aux trois tubes de 15 mL.
- Placez le tube de 0,2 Gy dans l’armoire à rayons X, fermez la porte et appliquez une dose de 0,2 Gy sur le tube en sélectionnant le numéro d’étagère et la dose. Appliquer une dose de rayonnement de 7 Gy sur le tube de 7 Gy en ajustant la dose choisie dans l’armoire.
- Incuber les trois tubes à 37 °C pendant une heure.
- Transférer le sang vers les tubes de préparation de cellules mononucléaires et réaliser le protocole de préparation pbmc comme pour un cadre clinique de l’étape 2.4 à l’étape 3.8.
- Ajouter un volume de tampon de lyse complété par des inhibiteurs de la protéase et de la phosphatase égal au volume de pastille cellulaire (dans ce cas 70 μL de tampon RIPA) à chacune des pastilles cellulaires, pipetter de haut en bas et incuber sur de la glace pendant 10 min. Soniquez les échantillons si un sonicateur est disponible (3 cycles, 30 s ON / 30 s OFF, 4 ° C), en variante seringue les échantillons pour casser les acides nucléiques afin d’éliminer la viscosité dans l’échantillon.
- Centrifuger les échantillons pendant 10 min à ≥ 15 000 x g,à 4 °C. Transférer chaque surnageant dans un nouveau tube de 1,5 mL, évaluer qualitativement le niveau d’hémolyse (inspection visuelle) et mesurer la concentration en protéines par toute méthode préférée.
- Mélanger 40 μg de lysat total avec un tampon de chargement d’échantillon contenant une FDS et un agent réducteur d’échantillons. Faire bouillir les échantillons pendant 5 min dans un bloc chauffant.
- Chargez 20 μg de chaque échantillon par voie en double dans un gel protéique bis-tris à 4-12% et exécutez une FDS-PAGE.
- Après séparation, transférer les protéines dans une membrane de nitrocellulose à l’aide d’un système disponible dans le commerce (20 V, 10 min) et bloquer avec 5 % de lait dans TBST.
- Couper la membrane aux tailles moléculaires appropriées et incuber avec les anticorps primaires pendant la nuit à 4 °C (voir le tableau des matériaux pour les anticorps et les dilutions).
- Retirer les anticorps primaires et laver les membranes 3 fois avec TBST pendant 5 minutes à température ambiante. Incuber avec les anticorps secondaires conjugués HRP pendant 45 minutes à température ambiante.
- Laver 3 fois avec TBST pendant 5 min.
- Appliquez le réactif ECL et analysez les images obtenues par rapport au signal HRP.
Résultats
Pour améliorer la qualité des préparations pbmc dans nos essais cliniques, nous avons généré un protocole avec des étapes concises et claires qui peuvent être suivies par les professionnels de laboratoire hospitalier, indépendamment de leur formation en biologie moléculaire et de leurs compétences de laboratoire. Nous avons adapté le protocole du fabricant en incorporant des modifications sur les étapes où des problèmes d’exécution ont été identifiés ou signalés à partir de sites cliniques impliqués dans divers essais cliniques multicentriques. Cependant, le protocole peut être optimisé davantage pour répondre à des exigences spécifiques, telles que les contraintes de temps dans le site clinique ou le type d’analyses en aval (voir le dossier supplémentaire). Nous démontrons que le DDR peut être analysé dans les PBMC en examinant des biomarqueurs spécifiques sur les dommages à l’ADN générés par le rayonnement.
Les requêtes les plus courantes que nous avons reçues de sites cliniques concernent les étapes de centrifugation, qui ont un impact direct sur la capacité d’isoler avec succès les PBMC et d’obtenir la pastille finale de PBMC. L’utilisation du type approprié de centrifugeuse à rotor à tête pivotante(figure 1B,C)est la clé du succès du protocole. Cependant, quand seulement une centrifugeuse de rotor à angle fixe est disponible au site clinique, nous suggérons d’effectuer l’étape 2.4 dans un rotor à angle fixe au même RCF que pour un rotor de tête de basculement mais pour seulement 10 minutes. Cela garantit qu’une couche pbmc est séparée du plasma, (voir Figure 2B,C). Alors que la superposition de sang sur un milieu de séparation de gradient de densité nécessite une centrifugation frein-off, le sang dans les tubes de préparation de cellules mononucléaires peut être centrifugé avec des freins allumés en raison de la présence d’une barrière de gel dans le tube qui assure la préservation de la couche PBMC séparée des composants sanguins plus denses27,28.
Au moins 4 mL de plasma non dilué de haute qualité ont été obtenus à partir de la centrifugation du sang au format tube de 8 mL, ce qui pourrait être clarifié pour son utilisation dans des analyses spécialisées telles que le séquençage de l’ADNc ou les études métabolomiques29,30 (étapes facultatives 4.1.1-4.1.4). La quantité de PBMC isolés, la taille des pastilles et l’hémolyse ou la contamination par les globules rouges ont été d’autres préoccupations provenant de sites cliniques et de l’expérience d’analyse des échantillons. Le nombre de cellules obtenues à partir de 8 mL de sang était variable en fonction du milieu du patient et de la maladie, mais en général le granulé obtenu est de petite taille, et d’une coloration transparente/blanche(figure 3A,B). En raison de ces caractéristiques, il est important de visualiser la pastille sur un fond sombre pour éviter son aspiration accidentelle pendant les étapes de lavage (2.5 et 3.3). Parfois, les granulés peuvent avoir une coloration rouge en raison de la contamination des globules rouges (Figure 3C), et cela a un effet négatif sur la qualité de la préparation. Pour éviter de perdre de petites pastilles telles que celles illustrées à la figure 3,le transfert de la pastille PBMC vers un cryovial est facilité par l’étape 3.7 où la pastille PBMC est remise en suspension dans 50 μL de PBS.
Le rendement typique lors de l’utilisation de ces tubes et du sang d’individus en bonne santé varie entre 7 et 21 x10 6 cellules pour 8 mL, et une récupération cellulaire entre 70 et 80% comme c’est notre expérience et comme il a été précédemment montré27,28. Cela dépend à la fois du nombre de cellules individuelles et de l’opérateur et il est comparable aux nombres de cellules et aux valeurs de récupération de cellules obtenues par d’autres méthodes utilisant le gradient de densité (y compris les systèmes utilisant des tubes avec une barrière de séparation)15,27,28. Un exemple illustratif de la variation sur le nombre de PBMCs d’isolement avec cette méthode selon l’arrangement de la maladie est l’analyse des marqueurs de PBMC dans les patients de la leucémie lymphocytique chronique (CLL). Le nombre de cellules récupérées dans un tube de préparation de cellules mononucléaires de 8 mL lors de l’application de ce protocole variait de 1,62 x 104 à 1,99 x10 9 dans 45 échantillons obtenus auprès de 7 patients dans l’étude NCT0332827331 (tableau 1). Un paramètre connexe est la concentration en protéines des lysats de PBMC obtenue par cette méthode, et cela dépend du nombre de cellules isolées et de l’efficacité de l’extraction des protéines. Les pastilles cellulaires lysées dans la section 6 ont été générées avec un tampon RIPA et une sonication (étape 6.6). La remise en suspension des pastilles cellulaires dans leur même volume de tampon de lyse entraîne habituellement une gamme de concentrations de 3 à 10 mg/mL, et dans cet exemple particulier les concentrations de lysat étaient de 6,8, 8,3 et 8,6 mg/mL pour 0, 0,2 et 7 Gy, respectivement. Cependant, ceci est soumis à une variabilité élevée en recevant des échantillons des sites cliniques qui n’ont pas été préparés de manière optimale, patient' la maladie de s, et la présence de l’hémoglobine de la contamination de globule rouge. Par exemple, les très petites pastilles doivent être remises en suspension dans un volume de tampon de lyse plus grand que le volume de pastilles cellulaires pour permettre à la fois la mesure de la concentration en protéines et l’analyse des biomarqueurs en aval, ce qui donne plus d’échantillons dilués. Dans un tel cas, si la concentration de l’échantillon est inférieure à 1 mg/mL, cela peut poser un défi pour effectuer des essais comme le western blot en raison de ce facteur de dilution élevé. En revanche, dans les échantillons de LLC mentionnés précédemment, le volume de tampon de lyse ajouté pour ressusciter les pastilles cellulaires variait de 50 à 500 μL, et la concentration en protéines variait de 1,62 à 19,77 mg/mL(tableau 1).
Lorsque les échantillons présentent une contamination ou une hémolyse des globules rouges (figure 3C), la concentration en protéines du lysat de PBMC devient surestimée en raison de l’inclusion de l’hémoglobine dans les érythrocytes. C’est la raison pour laquelle il faut faire une inspection visuelle et une annotation de ces échantillons, comme décrit à l’étape 6.7 du protocole. Le chargement de l’échantillon en excès peut compenser la présence d’hémoglobine lors de l’analyse de biomarqueurs dans la mesure où un contrôle de charge est inclus dans le test. D’autres méthodes plus quantitatives pour mesurer l’hémolyse pourraient être mises en œuvre, telles que la mesure de l’absorbance à 414 nm32.
Le DDR a été analysé dans PBMCs obtenu suivant ce protocole clinique. Pour illustrer une situation qui imite les traitements cliniques dommageables à l’ADN tels que la radiothérapie ou la chimiothérapie, le sang total provenant de volontaires sains a été soumis ex vivo à des rayons X (Figure 4A). Les rayonnements ionisants (IR) tels que les rayons X induisent différents types de dommages à l’ADN, y compris les ruptures double brin (DSB) de l’ADN. La détection des dommages à l’ADN de ces lésions active les PIKKs tels que l’ataxie-télangiectasie mutée (ATM), l’ATM et Rad3-related (ATR) et la protéine kinase ADN-dépendante (DNA-PK), qui engagent des mécanismes de réparation d’ADN comme la recombinaison homologue (HR) ou l’assemblage d’extrémité non homologue (NHEJ). L’activation de l’ATM par la présence de DSB se produit par son recrutement sur les sites de dommages par le complexe MRN (MRE11-RAD50-NBS1), provoquant l’autophosphorylation ATM à plusieurs résidus dont Ser1981. À son tour, l’ATM activé phosphoryle les composants du complexe MRN et d’autres protéines telles que la variante histone H2AX sur Ser139 (où pSer139-H2AX est également connu sous le nom de γH2AX) pour favoriser un changement structurel de la chromatine s’étendant à partir du DSB qui facilite le recrutement d’autres facteurs DDR33. Les PBMC réagissent aux rayonnements ionisants malgré leur faible taux de prolifération et les méthodes de spectrométrie de masse ont permis de quantifier la régulation à la hausse du Ser635 phosphorylé sur RAD50 par ATM. Cette phosphorylation est réduite en présence d’inhibiteurs de l’ATM et RAD50 pS635 a été validé comme biomarqueur pharmacodynamique pour les traitements cliniques d’inhibiteurs de l’ATM dans les tumeurs par immunohistochimie8. Pour évaluer la réponse des PBMC aux radiations, le sang de volontaires sains a été soumis à différentes doses d’IR et des échantillons ont été prélevés après une incubation de 1 h à 37 °C(figure 4A). À cette fin, des sangs ont été transférés dans des tubes en plastique pour éviter de réduire le rendement de l’isolement pbmc dû à la température élevée (étape 6.2). Nous avons analysé comment l’ATM a été activé non seulement en examinant le RAD50 pS635 précédemment rapporté, mais aussi l’ATM pS1981 et γH2AX. Dans les trois cas examinés, une augmentation de ces modifications post-traductionnelles a été observée à des doses IR plus élevées(figure 4B). Intéressant, la phosphorylation de l’ATM et du RAD50 était substantielle à la basse dose de 0,2 GY, ce qui suggère que ces modifications post-traductionnelles puissent être interrogeablement en tant que biomarqueurs de palladium pour des traitements impliquant la génération de DSBs d’ADN avec une bonne plage dynamique, non seulement dans des échantillons de tumeur mais dans le sang périphérique. Cela permet de surveiller la réponse de la MP au traitement en acquérant des échantillons longitudinaux au cours du traitement. Le moment entre la prise de sang et le traitement des échantillons est essentiel pour s’assurer que ces cascades de signalisation sont toujours actives, car les retards dans le traitement auront un impact sur la cinétique de ces cascades et on pourrait manquer les événements de phosphorylation utilisés comme phosphomarkers.
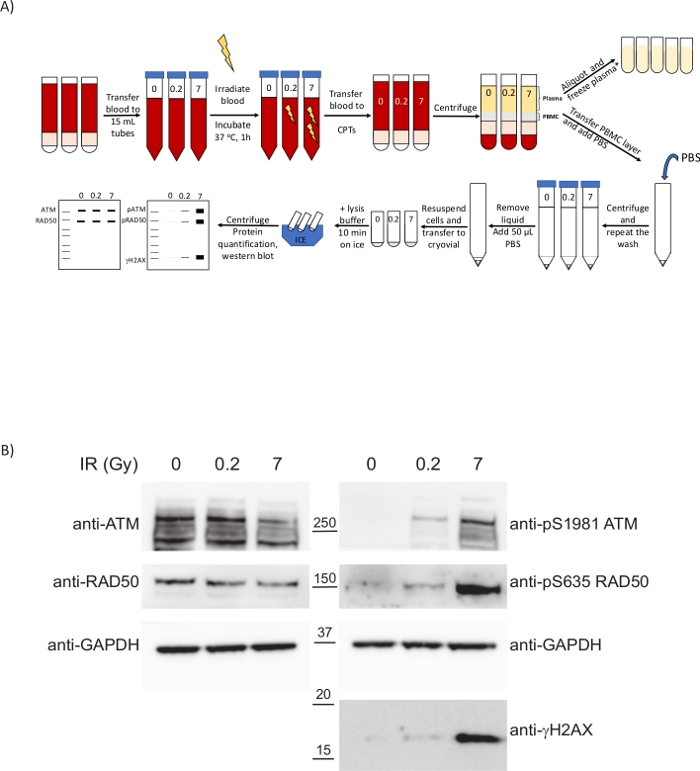
Figure 4 : Les PBMC isolés dans du sang irradié ex vivo suivant le présent protocole clinique affichent des biomarqueurs pour informer sur l’étendue des dommages à l’ADN causés par le traitement. (A) Aperçu schématique du protocole pour la préparation des PBMC et analyse du DDR lors de l’irradiation du sang total. *2 étapes supplémentaires de centrifugation requises pour l’analyse de l’ADNc/métabolomique. (B) Western blot montrant une régulation à la hausse dépendante de la dose des phospho-biomarqueurs DDR dans les PBMC. Veuillez cliquer ici pour voir une version plus grande de cette figure.
| Échantillon | Nombre de PBMC/8 mL de sang | Volume tampon RIPA complété (μL) | Concentration finale (mg/mL) |
| A.1 | 39100000 | 70 | 12.16 |
| A.2 | 97400000 | 100 | 4.54 |
| A.3 | 233000000 | 150 | 7.63 |
| A.4 | 316000000 | 150 | 16.87 |
| A.5 | 387000000 | 150 | 12.60 |
| A.6 | 459000000 | 150 | 12.71 |
| A.7 | 414000000 | 200 | 15.67 |
| A.8 | 253000000 | 150 | 14.56 |
| A.9 | 509000000 | 300 | 10.67 |
| B.1 | 15200000 | 70 | 2.96 |
| B.2 | 10500000 | 50 | 4.59 |
| B.3 | 13200000 | 50 | 3.99 |
| B.4 | 34800000 | 100 | 10.41 |
| B.5 | 1620000 | 70 | 7.11 |
| B.6 | 70200000 | 100 | 9.26 |
| B.7 | 65400000 | 100 | 12.10 |
| B.8 | 91100000 | 150 | 11.82 |
| C.1 | 6330000 | 70 | 4.04 |
| C.2 | 4400000 | 150 | 19.77 |
| C.3 | 68000000 | 100 | 8.96 |
| C.4 | 35100000 | 50 | 9.30 |
| C.5 | 35400000 | 70 | 10.55 |
| C.6 | 99200000 | 100 | 16.19 |
| D.1 | 402000000 | 70 | 7.23 |
| D.2 | 826000000 | 300 | 16.95 |
| D.3 | 1990000000 | 300 | 14.87 |
| D.4 | 1000000000 | 300 | 18.34 |
| D.5 | 1160000000 | 400 | 16.13 |
| D.6 | 806000000 | 400 | 19.40 |
| E.1 | 302000000 | 300 | 13.86 |
| E.2 | 990000000 | 500 | 19.04 |
| E.3 | 1200000000 | 400 | 17.13 |
| F.1 | 4010000 | 50 | 1.62 |
| F.2 | 5170000 | 50 | 2.84 |
| F.3 | 2810000 | 50 | 3.69 |
| F.4 | 3700000 | 75 | 3.62 |
| F.5 | 3460000 | 70 | 4.03 |
| F.6 | 7060000 | 50 | 3.32 |
| G.1 | 60700000 | 70 | 6.57 |
| G.2 | 82100000 | 150 | 7.78 |
| G.3 | 30500000 | 70 | 8.28 |
| G.4 | 134000000 | 100 | 15.14 |
| G.5 | 91900000 | 100 | 8.61 |
| G.6 | 372000000 | 150 | 15.88 |
| G.7 | 574000000 | 200 | 15.01 |
| Échantillons pbmc longitudinaux correspondant à 7 patients | |||
Tableau 1 : Nombre cellulaire et concentration en protéines des granulés de PBMC provenant de patients atteints de leucémie lymphoïde chronique (LLC). Les données présentées dans ce tableau correspondent à 45 échantillons de PBMC provenant de 7 patients atteints de LLC participant à l’étude NCT03328273 recueillis dans des tubes de préparation de cellules mononucléaires. Il s’agit de données originales générées à partir d’échantillons de l’étude citée31.
Fichier supplémentaire : Options de protocole alternatives. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Les préparations de haute qualité de PBMC et de plasma qui peuvent être préparées de manière robuste et reproductible sur les sites d’essais cliniques sont inestimables pour éclairer les paramètres de biomarqueurs translationnels prédictifs et pharmacodynamiques périphériques des essais cliniques. Ici, nous avons fourni un protocole court et clair qui aborde les étapes typiquement problématiques qui ont été jusqu’ici vulnérables aux erreurs d’exécution dans un cadre d’essai clinique. Cependant, le protocole peut être optimisé davantage pour répondre à des exigences spécifiques, telles que les contraintes de temps sur le site clinique ou le type d’analyses en aval (voir le dossier supplémentaire).
À cette fin, nous avons montré comment isoler les PBMC et le plasma du sang total à l’aide de tubes de préparation de cellules mononucléaires pour produire des pastilles de PBMC congelées et du plasma congelé adapté à une variété d’analyses en aval. Nous avons attiré l’attention sur les étapes particulièrement critiques du protocole impliquant la centrifugation et l’identification de la couche PBMC à l’étape 2.5 et des pastilles PBMC aux étapes 3.3 et 3.6. Historiquement, là où les sites cliniques ont souvent mal tourné, c’est dans le réglage de la centrifugeuse aux bonnes unités (confondant une valeur RCF ou x g avec une valeur RPM), retardant le traitement des échantillons de sang, la température et la présence de grands volumes de PBS au-dessus de la pastille de cellules congelées. Dans la plupart des rotors de centrifugeuse, entrer par erreur une valeur de x g comme réglage du régime entraînera une sous-centrifugation importante avec une couche de PBMC mal définie ou absente, et un rejet accidentel potentiel de PBMC pendant les étapes de lavage en raison d’un enrobage inefficace des cellules. Cependant, il y a une possibilité qu’une couche de PBMC ne soit pas visible en dépit de l’utilisation des bons arrangements de centrifugation et de l’adaptateur de rotor si le patient a développé le leukopenia. Cette condition peut affecter des patients inscrits dans des essais en oncologie en raison de la chimiothérapie ou de la radiothérapie et devrait être considérée. Un autre point critique qui a été précisé dans le protocole est que les échantillons doivent être traités dans les 1-2 h de la prise de sang pour diminuer la possibilité d’hémolyse ayant un impact négatif sur le protocole. De plus, le fait de viser à traiter les échantillons pendant la première heure de la prise de sang réduit la variabilité ex vivo, ce qui peut avoir un grand impact sur les lectures pharmacocinétiques et sur les biomarqueurs affectés par la préservation du sang ou les voies de signalisation active, comme le cas illustré à la figure 4. Les retards dans le traitement des échantillons peuvent également avoir un effet néfaste sur la viabilité des cellules si les cellules doivent être cryoconservées34. Un autre facteur qui peut affecter à la fois le rendement et la contamination des globules rouges est la température de stockage et de centrifugation, qui doit être maintenue à température ambiante (18-25 ° C). Des températures plus basses augmentent la densité du milieu à gradient de densité, ce qui entraîne un degré plus élevé de contamination par les globules rouges et les granulocytes, car ces cellules ne s’agrègent pas aussi bien. D’autre part, des températures plus élevées conduisent à des PBMC piégés entre les érythrocytes agrégés, réduisant ainsi le rendement de la préparation15,27,28. Et enfin, il est crucial que pas plus de 50-100 μL de liquide ne soient présents avec le culot cellulaire dans le cryovial, car cela a un impact négatif sur la concentration de tout lysat de protéines obtenu lors du traitement en aval de ces préparations pbmc. Un excès de liquide surdiluera les échantillons, conduisant à des lysats à très faible concentration en protéines qui ne conviennent pas à l’analyse de biomarqueurs. En outre, la préservation de toute modification post-traductionnelle sera altérée et l’efficacité de la lyse sera également considérablement réduite.
Des tubes mononucléaires de préparation de cellules ont été choisis car ils offrent le moyen le plus simple d’isoler les PBMC et le plasma dans une seule prise de sang pour des essais cliniques avec, selon notre expérience, une excellente reproductibilité. Le traitement du sang ne nécessite pas d’opérateurs hautement qualifiés, et l’utilisation d’un seul tube élimine la nécessité de diluer le sang et son transfert dans un autre tube, réduisant ainsi le risque de danger; raccourcit le protocole en raison de l’exécution des étapes de centrifugation avec les freins allumés; et tous les réactifs sont dans le tube, ce qui réduit la variabilité. D’après notre expérience, ces avantages l’emportent sur le coût plus élevé de ces tubes par rapport à d’autres méthodes classiques ne comprenant que l’utilisation d’un milieu de séparation à gradient de densité27,28 (£ 410 par 60 unités tandis que le milieu lymphoprep pour 66 préparations de 50 mL est de £ 215). Ils sont disponibles en deux types d’anticoagulants, l’héparine et le citrate, qui sont tous deux comparables pour maintenir la fonctionnalité des PBMC isolés35, par conséquent, le choix d’un anticoagulant par rapport à l’autre sera basé sur l’influence possible de l’héparine ou du citrate dans les études de biomarqueurs en aval. Bien qu’il ait été démontré que les tubes d’EDTA offrent le rendement d’isolement PBMC le plus élevé par rapport à l’héparine ou au citrate13,l’avantage de la facilité d’utilisation de la manipulation à un seul tube contrebalance cette considération. Si les cytokines vont être analysées, les anticoagulants peuvent avoir un effet sur les niveaux détectés dans le plasma, les deux anticoagulants doivent donc être testés avant d’en sélectionner un pour l’essai clinique36. Si le plasma doit être utilisé pour des études métabolomiques, l’utilisation de l’héparine comme anticoagulant serait préférable37. Par conséquent, le seul point laissé à l’utilisateur final ou au scientifique translationnel de l’essai clinique est de savoir si le citrate ou l’héparine seront plus appropriés à leurs fins une fois que les coûts auront été évalués.
Bien que les avantages de l’utilisation de tubes de préparation cellulaire soient nombreux par rapport aux limitations qu’ils posent (coût et disponibilité plus élevés d’une gamme restreinte d’anticoagulants), la principale limitation de l’utilisation de PBMC ou de plasma pour obtenir des biomarqueurs de MP dans les essais cliniques, en particulier en oncologie, peut être sans rapport avec la méthode d’isolement. À l’exception des cancers hématologiques, où la tumeur est directement prélevée à partir de sang périphérique, pour d’autres indications de cancer, le plasma et les PBMC sont des tissus de substitution qui n’imitent pas nécessairement la tumeur primaire. Le tissu périphérique peut ne pas partager le génome et l’épigénome avec la tumeur primaire, par conséquent, l’analyse périphérique des biomarqueurs dépendant d’une mutation tumorale spécifique est principalement limitée à l’analyse de ctDNA (du plasma) ou aux CTCs (par tri ultérieur de la couche PBMC). En outre, les cascades de signalisation conduisant ou contribuant à la prolifération de tumeur peuvent ne pas être aussi actives dans le sang périphérique. Ce défi peut être surmonté en appliquant des approches de découverte de biomarqueurs ciblant le sang8 pour identifier des biomarqueurs alternatifs ou en couplant des traitements ex vivo à l’isolement des préparationsplasmatique 38 et PBMC26.
Dans le protocole actuel, les pastilles de PBMC congelées peuvent être facilement traitées hors du site clinique pour donner des lysats de protéines qui peuvent être évalués par des techniques occidentales de buvardage ou ELISA. D’autres méthodes d’utilisation des PBMC pour activer les méthodes IHC ont également étéprésentées (fichier supplémentaire). En outre, nous avons également détaillé la possibilité de cryoconserver des PBMC (voir dossier supplémentaire)pour la surveillance des cellules immunitaires, une application pertinente en oncologie, avec des inhibiteurs du point de contrôle immunitaire et des ADC de plus en plus testés dans des essais cliniques. L’évaluation des fonctions immunitaires telles que l’ADCC16 et l’immunophénotypage sont des applications compatibles avec les PBMC cryoconservés isolés dans des tubes de préparation de cellules mononucléaires15. Il y a une mise en garde sur la cryoconservation, car elle peut favoriser la régulation à la baisse de certains marqueurs de surface et internes et pourrait altérer certaines fonctions cellulaires, cependant la cryoconservation PBMC est le seul moyen possible d’effectuer ces tests en raison de contraintes de temps lors de la manipulation d’échantillons de plusieurs sites cliniques au traitement dans des laboratoires externes14,15,et ces effets néfastes peuvent être grandement surmontés par de bonnes méthodes de décongélation et des périodes de repos39.
En conclusion, le protocole fourni ici permettra la préparation fiable des PBMC et des échantillons de plasma dans n’importe quel établissement clinique avec l’équipement et le matériel communs de sorte que les points finaux translationnels du sang périphérique puissent être robustement activés dans les essais cliniques mondiaux.
Enfin, nous démontrons comment l’analyse des lysats de PBMC peut mécaniquement informer la réponse aux agents dommageables pour l’ADN en montrant une modification post-traductionnelle dépendante de la dose des facteurs clés de DDR, qui peut être utilisée pour aider à façonner le développement clinique. Tournée vers l’avenir, la mise en œuvre de méthodes plus quantitatives que le western blotting (p. ex. spectrométrie de masse40)et nécessitant moins de matériel d’entrée (comme le western blotting capillaire et elisa) aiderait à faire évoluer ces résultats précliniques vers une évaluation plus robuste et systématique des échantillons de patients PBMC.
Déclarations de divulgation
Tous les auteurs sont ou ont été des employés et des parties prenantes d’AstraZeneca. VM est un employé d’Acerta Pharma, possède des actions dans AstraZeneca et Gilead Sciences.
Remerciements
Nous tenons à remercier tous les membres de la médecine translationnelle d’AstraZeneca Oncology Research and Early Development pour leurs commentaires sur le protocole, en particulier Hedley Carr, Tammie Yeh et Nathan Standifer pour leurs conseils sur la préparation plasmatique pour l’analyse de l’ADNc, sur l’isolement du PBMC et la cryoconservation et l’immunophénotypage du PBMC, respectivement.
matériels
| Name | Company | Catalog Number | Comments |
| 1.5 mL cryovial | Nalgene, ThermoFisher | 5000-1020 | To store PBMC pellets and re-suspended PBMCs |
| 1.5 mL microcentrifuge tubes | VWR | 525-0990 | This is an example, use your preferred provider |
| 15 mL conical sterile propylene centrifuge tube | Nunc, ThermoFisher | 339651 | Other brands can be used |
| 2 mL screw cap tube sterile, with attached cap | ThermoFisher | 3463 | For plasma aliquoting |
| 20X TBS Buffer | ThermoFisher Scientific | 28358 | Final is 25 mM Tris, 0,15 M NaCl; pH 7,5. This is an example, you can prepare your own stock or use a different provider |
| 20X TBS Tween 20 Buffer | ThermoFisher Scientific | 28360 | Or supplement TBS with 0.05% to prepare TBST buffer |
| Automated cell counter or haemocytometer | ThermoScientific | AMQAX1000 | We use Countess device and slides but could be other methods. |
| Adjustable micropipette allowing 50 µL measurements | To handle small volumes (i.e. western blot, transfer PBMC pellets to 1.5 mL tubes) | ||
| BD Vacutainer CPT mononuclear cell preparation tube (Na-citrate or Na-heparin) 8 mL | BD | 362761, 362753 | There are 4 mL tubes but if possible 8 mL tubes are recommended to obtain more PBMCs from a single blood draw |
| Cell-freezing box | ThermoFisher Scientific | 5100-0001 | This is an example, use your preferred provider. |
| Centrifugation unit converter | LabTools | http://www.labtools.us/centrifugation-speed-rpm-to-g-conversion/ | |
| DMSO | Sigma-Aldrich, MERK | D2438 | Use your preferred provider. Ued for PBMC cryopreservation |
| ECL horseradish peroxidase substrate | ThermoFisher | 34075 | Use your preferred reagent according to the sensitivity required to detect your biomarker by western blot. Other systems can be used such as IRDye secondary antibodies with imaging systems. |
| Faxitron MultiFocus X-ray cabinet | Faxitron Bioptics | To irradiate blood. Other models/makers are available | |
| Fetal Bovine Serum (FBS), heat inactivated | ThermoScientific | 102706 | Use your preferred provider. Ued for PBMC cryopreservation |
| Fine tip, sterile 1.5 mL Pasteur pipettes | VWR | 414004-018 | Optional |
| Fixed-angle rotor centrifuge | Optional for preparation of plasma for ctDNA/metabolomics | ||
| Gel doc imaging system | SYNGENE | For imaging HRP developed membranes | |
| Heat block | To denature lysates prior to run them in western blot, any maker equipped with suitable tube adaptors | ||
| Horizontal rotor (swing-out head) centrifuge | Thermoscientific | Heraeus Megafuge 40R | This is an example |
| Liquid nitrogen/dry ice | To flash-freeze samples | ||
| Marvel dried skimmed milk | Premier Foods | This is an example, use your preferred provider | |
| Micropipette tips for range 1-200 µL | To handle small volumes (i.e. western blot, transfer PBMC pellets to 1.5 mL tubes) | ||
| NuPAGE 4-12% Bis-Tris protein gel, 1 mm, 10 wells | ThermoFisher Scientific | NP0321BOX | This is an example, cast your own or use your preferred provider |
| NuPAGE LDS Sample Buffer (4X) | ThermoFisher Scientific | NP0007 | For imaging HRP developed membranes |
| NuPAGE Sample Reducing Agent (10X) | ThermoFisher Scientific | NP0009 | This is an example. |
| PBS, no calcium, no magnesium | Gibco, ThermoFisher | 14190-144 | This is usually provided in the clinical kit. |
| Phosphatase inhibitor cocktail 2 | Sigma-Aldrich, MERK | P5726-1ML | Optional for step 3.7 |
| Phosphatase inhibitor cocktail 3 | Sigma-Aldrich, MERK | P0044-1ML | Optional for step 3.7 |
| Rabbit anti GAPDH | Cell Signaling Technology | CST 2128 | 1:1000 dilution in 5% milk TBST |
| Rabbit anti γH2AX | Cell Signaling Technology | CST 2577, lot 11 | 1:2000 dilution in 5 % milk TBST |
| Rabbit anti pS1981 ATM | Abcam | ab81292 | 1:2000 dilution in 5 % milk TBST |
| Rabbit anti pS635 RAD50 | Cell Signaling Technology | CST 14223 | 1:1000 dilution in 5 % milk TBST |
| Rabbit anti total ATM | Abcam | ab32420 | 1:1000 dilution in 5 % milk TBST |
| Rabbit anti total RAD50 | Cell Signaling Technology | CST 3427, lot 2 | 1:1000 dilution in 5 % milk TBST |
| RIPA buffer | Sigma-Aldrich, MERK | R0278-50ML | For cell lysis. This is an example, use your preferred provider |
| Sonicator | Diagenode | B01060010 | Used for 3 cycles at 30 s on/ 30 s off, 4 oC. If using a different instrument, adjust number of cycles and intensity according to your sonicator. |
| Sterile 1.7 mL Pasteur pipettes | VWR | 414004-030 | This is an example, use your preferred provider |
| Sterile serological pipettes (5 and 10 mL volume) | Costar | 4101, 4051 | This is an example, use your preferred provider |
| Trypan blue | ThermoScientific | T10282 | This is for the automated cell counter listed above. |
| Wet ice | To keep plasma samples and lysates cold |
Références
- Hoelder, S., Clarke, P. A., Workman, P. Discovery of small molecule cancer drugs: successes, challenges. and opportunities. Molecular Oncology. 6, 155-176 (2012).
- Harrigan, J. A., Jacq, X., Martin, N. M., Jackson, S. P. Deubiquitylating enzymes and drug discovery: emerging opportunities. Nature Reviews Drug Discovery. 17, 57-77 (2018).
- Brown, J. S., O'Carrigan, B., Jackson, S. P., Yap, T. A. Targeting DNA repair in cancer: beyond PARP inhibitors. Cancer Discovery. 1, 20-37 (2017).
- Pettersson, M., Crews, C. M. PROteolysis TArgeting Chimeras (PROTACs)-Past, present and future. Drug Discovery Today: Technologies. 31, 15-27 (2019).
- Scott, A. M., Wolchok, J. D., Old, L. J. Antibody therapy of cancer. Nature Reviews Cancer. 12, 278-287 (2012).
- Thomas, A., Teicher, B. A., Hassan, R. Antibody-drug conjugates for cancer therapy. The Lancet Oncology. 17 (6), 254 (2016).
- Ferguson, F. M., Gray, N. S. Kinase inhibitors: the road ahead. Nature Reviews Drug Discovery. 17 (5), 353-377 (2018).
- Jones, G. N., et al. pRAD50: a novel and clinically applicable pharmacodynamic biomarker of both ATM and ATR inhibition identified using mass spectrometry and immunohistochemistry. British Journal of Cancer. 119 (10), 1233-1243 (2018).
- Cook, D., et al. Lessons learned from the fate of AstraZeneca's drug pipeline: a five-dimensional framework. Nature Reviews Drug Discovery. 13, 419-431 (2014).
- Overman, M. J., et al. Use of research biopsies in clinical trials: are risks and benefits adequately discussed. Journal of Clinical Oncology. 31 (1), 17-22 (2012).
- Olson, E. M., Lin, N. U., Krop, I. E., Winer, E. P. The ethical use of mandatory research biopsies. Nature reviews Clinical Oncology. 8, 620-625 (2011).
- O'Donnell, A., et al. Phase I pharmacokinetic and pharmacodynamic study of the oral mammalian target of rapamycin inhibitor Everolimus in patients with advanced solid tumors. Journal of Clinical Oncology. 26 (10), 1588-1595 (2008).
- Fong, P. C., et al. Inhibition of Poly(ADP-Ribose) polymerase in tumors from BRCA mutation carriers. The New England Journal of Medicine. 361 (2), 123-134 (2009).
- Verschoor, C. P., Kohli, V., Balion, C. A comprehensive assessment of immunophenotyping performed in cryopreserved peripheral whole blood. Cytometry B Clinical Cytometry. 94 (5), 662-670 (2018).
- Ruitenberg, J. J., et al. VACUTAINER®CPT™ and Ficoll density gradient separation perform equivalently in maintaining the quality and function of PBMC from HIV seropositive blood samples. BMC Immunology. 7 (11), (2006).
- Yamashita, M., et al. A novel method for evaluating antibody-dependent cell-mediated cytotoxicity by flowcytometry using cryopreserved human peripheral blood mononuclear cells. Scientific Reports. 6 (19772), 1-10 (2016).
- Schiavon, G., et al. Analysis of ESR1 mutation in circulating tumor DNA demonstrates evolution during therapy for metastatic breast cancer. Science Translational Medicine. 7 (313), 182 (2015).
- Lee, J., et al. Tumor genomic profiling guides metastatic gastric cancer patients to targeted treatment: the VIKTORY umbrella trial. Cancer Discovery. , (2019).
- Abbosh, C., et al. Phylogenetic ctDNA analysis depicts early-stage lung cancer evolution. Nature. 545, 545 (2017).
- Thress, K. S., et al. Acquired EGFR C797S mutation mediates resistance to AZD9291 in non-small cell lung cancer harboring EGFR T790M. Nature Medicine. 21 (6), 560-562 (2015).
- Rossi, G., Ignatiadis, M. Promises and pitfalls of using liquid biopsy for precision medicine. Cancer Research. 79 (11), 2798-2804 (2019).
- Balasubramanian, P., et al. Isolation and characterisation of circulating tumor cells (CTCs) from peripheral blood specimens of patients with advanced solid tumor malignancies (using ApoStream® instrumentation) [abstract 3062]. Proceedings of the Annual meeting of the American Association for Cancer Research. , (2014).
- Qin, J., Alt, J. R., Hunsley, B. A., Williams, T. L., Fernando, M. R. Stabilization of circulating tumor cells in blood using a collection device with a preservative reagent. Cancer Cell International. 14 (13), 1-6 (2014).
- Biomarkers definitions working group. Biomarkers and surrogate endpoints: preferred definitions and conceptual framework. Clinical Pharmacology & Therapeutics. 69 (3), 89-95 (2001).
- Crowley, E., Di Nicolantonio, F., Loupakis, F., Bardelli, A. Liquid biopsy: monitoring cancer-genetics in the blood. Nature Reviews Clinical Oncology. 10, 472-484 (2013).
- Bundred, N., et al. Evaluation of the pharmacodynamics of the PARP inhibitor olaparib: a phase I multicentre trial in patients scheduled for elective breast cancer surgery. Investigational New Drugs. 31, 949-958 (2013).
- Rosado, M., et al. Advances in biomarker detection: Alternative approaches for blood-based biomarker detection. Advances in Clinical Chemistry. 92, 141-199 (2019).
- Grievink, H. W., et al. Comparison of three isolation techniques for human peripheral blood mononuclear cells: cell recovery and viability, population composition and cell functionality. Biopreservation and Biobanking. 14 (5), 410-415 (2016).
- Khadka, M., et al. The effect of anticoagulants, temperature, and time on the human plasma metabolome and lipidome from healthy donors as determined by liquid chromatography-mass spectrometry. Biomolecules. 9 (5), 1-15 (2019).
- Hellmann, M. D., et al. Circulating tumor DNA analysis to assess risk of progression after long-term response to PD-(L)1 blockade in NSCLC. Clinical Cancer Research. 26 (12), 2849-2858 (2020).
- ClinicalTrials.gov [Internet}. Identifier NCT03328273, A study of AZD6738 and Acalabrutinib in subjects with relapsed or refractory chronic lymphocytic leukemia (CLL). National Library of Medicine (US) Available from: https://clinicaltrials.gov/ct2/show/NCT03328273 (2017)
- Kirschner, M. B., et al. The impact of hemolysis on cell-free microRNA biomarkers. Frontiers in Genetics. 4 (94), 1-13 (2013).
- Blackford, A. N., Jackson, S. P. ATM, ATR, and DNA-PK: The Trinity at the Heart of the DNA Damage Response. Molecular Cell. 66, 801-817 (2017).
- Riedhammer, C., Halbritter, D., Weissert, R. Peripheral Blood Mononuclear Cells: Isolation, Freezing, Thawing, and Culture. Methods in Molecular Biology. 1304, 53-61 (2016).
- Basavaraj, M. G., Østerud, B., Hansen, J. B. Influence of different anticoagulants on monocyte procoagulant functions and monocyte-platelet aggregates formation. Journal of Thrombosis and Haemostasis. 9 (8), 1673-1676 (2011).
- Biancotto, A., Feng, X., Langweiler, M., Young, N. S., McCoy, J. P. Effect of anticoagulants on multiplexed measurements of cytokine/chemokines in healthy subjects. Cytokine. 60, 438-446 (2012).
- Wawrzyniak, R., et al. New plasma preparation approach to enrich metabolome coverage in untargeted metabolomics: plasma protein bound hydrophobic metabolite release with proteinase K. Scientific Reports. 8, 1-10 (2018).
- Duffy, D., et al. Standardized whole blood stimulation improves immunomonitoring of induced immune responses in multi-center study. Clinical Immunology. 183, 325-335 (2017).
- Wang, L., et al. Standardization of cryopreserved peripheral blood mononuclear cells through a resting process for clinical immunomonitoring- development of an algorithm. Cytometry A Clinical Cytometry. 89, 246-258 (2016).
- Whiteaker, J. R., et al. Targeted mass spectrometry enables robust quantification of FANCD2 mono-ubiquitination in response to DNA damage. DNA Repair. 65, 47-53 (2018).
- Lam, N. Y., Rainer, T. H., Chiu, R. W., Lo, Y. M. EDTA is a better anticoagulant than heparin or citrate for delayed blood processing for plasma DNA analysis. Clinical Chemistry. 50, 256-257 (2004).
- Parpart-Li, S., et al. The effect of preservative and temperature on the analysis of circulating tumor DNA. Clinical Cancer Research. 23 (10), 2471-2477 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon