Method Article
在生物标志物分析临床试验场单次抽血时,准备外周血单核细胞颗粒和血浆
摘要
本协议详细介绍了可用于转化生物标志物分析的临床试验现场高质量PBMC和血浆生物采样剂的临床可实施制备。
摘要
对周围血液中生物标志物的分析在临床试验中变得越来越重要,以建立评估治疗效果的机制证明,并帮助指导治疗剂量和计划设置。从单次抽血中,可以分离和处理外周血单核细胞,分析和量化蛋白质标记物,血浆样本可用于分析循环肿瘤DNA、细胞因子和血浆代谢学。治疗的纵向样本提供了有关给定蛋白质标记物的进化、突变状态和患者免疫学景观的信息。只有有效地在临床部位进行外周血液的处理,并且从床边到长凳上适当保存样本,才能实现这一点。在这里,我们提出了一个优化的通用协议,可以在临床现场实施,在多中心临床试验中获取PBMC颗粒和血浆样本,这将使医院实验室的临床专业人员能够成功提供高质量的样品,无论他们的技术专长水平如何。还介绍了替代协议变体,这些变体针对更具体的下游分析方法进行了优化。我们应用此协议研究蛋白质生物标志物对 X 射线辐照血液中的 DNA 损伤反应 (DDR),以证明该方法在采用 DDR 药物和/或放射治疗的肿瘤学环境中以及在需要机械假说测试的临床前阶段是否合适。
引言
药物开发旨在提供新的治疗方法,满足未满足的医疗需求和更有针对性的个性化药物。多种药物机制正在积极研究,包括酶抑制,如激酶1,蛋白酶2,或聚(ADP-核糖)聚合酶(PARP)抑制剂3,蛋白质降解剂4,治疗抗体5,抗体结合药物(ADCs)6等。在肿瘤学中获得更好治疗的一个例子是使用激酶抑制剂,目的是阻止信号级联,使癌细胞增殖1,7。测量这些激酶特有的基质磷酸化水平是量化这些抑制剂8作用机制的最佳药效生物标志物。其他药物可能调节给定蛋白质的表达,在这种情况下,能够在整个治疗过程中纵向量化目标蛋白质浓度的变化至关重要。因此,独立于药物或病理学的特点,评估生物标志物,以建立药物接触和目标调制之间的药动力学(PK)/药理动力学(PD)关系,是早期临床开发的最佳实践,并能够确定一个安全和耐受的药理活性剂量/时间表9。
虽然在肿瘤临床开发中,活检中的生物标志物分析可能是建立药物机制证明的最佳环境,但试验中可用活检的数量通常相当有限,为10,11。或者,外周血液样本对临床试验具有很高的价值,因为它们涉及微创程序,快速易于获得促进纵向分析,比活检便宜,并为实时监测治疗结果提供大量信息。评估外周血液中的PD生物标志物的另一个好处是能够使用生物桑普尔来量化PK,从而准确确定PK/PD定量关系和随后的PK/PD建模12,13。可以分离出全血的外周血单核细胞(PBMC)来研究蛋白质标记,这些标记体在表达水平或转化后变化中都会经历变化。此外,PBMC可用于免疫调节目的14,15,免疫功能检测,如评估抗体依赖细胞毒性(ADCC)16和表观遗传分析通过RNA隔离。同样,全血血浆可用于量化细胞因子,以描述患者的免疫反应,进行代谢研究,并分离和序列循环肿瘤DNA(ctDNA),以监测从治疗剂中选择的疾病的克隆进化,经常为治疗抗药性提供机械基础17、18、19,从而发展后代治疗20。最后,从外周血液中分离循环肿瘤细胞(CTCs),通过纵向列举、DNA/RNA测序和蛋白质-生物标志物分析21,对疾病进展进行评估。虽然这种隔离符合本22号所述的协议,但许多癌症类型和疾病早期中CTC的低丰度使得使用专门的管子更适合将CTC降解降解降解23。
近年来,液体活检的使用改善了临床试验获得的信息,PBMC收集已纳入许多研究,以监测目标参与度和机制证明,无论是直接在肿瘤细胞的某些类型的血液恶性肿瘤,或在PBMC本身作为PCD替代肿瘤细胞24,25,26。高质量样品的制备对确定特定病理学最安全、最有效的治疗方法产生了积极影响,但根据我们的经验,从不同临床地点获得的PBMC制剂的质量在质量上存在广泛差异,导致样品不适合下游分析。这影响了可从这些研究中收集的 PD 数据量。
在这里,我们详细描述了一个易于遵循的协议,展示了如何有效地将 PBMC 和血浆样本从临床环境中的单次抽血中分离。该协议基于单核细胞制备管制造商提供的说明,该说明包含了实际经验突出表明临床部位报告的协议执行困难(如离心问题、处理延迟和样品转移到低温管)的修改。有替代商业上可用的方法,使用单核细胞制备管基于密度梯度分离使用多糖溶液有或没有屏障,从血液27分离溶液。如果相关的临床站点在这些替代方法中已经经验丰富,则此协议可以与这些方法进行可接受的替代。在这种情况下,可以考虑两个因素:一些替代方法需要将全血从收集管转移到单独的制备管,在这种管中,额外的人类初级生物材料转移可能会带来轻微增加的安全风险,而方法的成功没有障碍地将血液与多糖溶液分离,则依赖于关键步骤,例如将血液样本分层到密度梯度介质上,这需要开发一种精湛的技术专长水平,这在医院的实验室环境中并非总是如此。尽管上述观点,但总体生存能力和细胞恢复能力与这些技术15、28是可比的。因此,方法的选择在某种程度上取决于以前的技术经验,但在我们的手中,单核细胞制备管可以在广泛的临床环境中成功使用,否则,我们的建议。
虽然本协议的一个终点是生产PBMC颗粒,用于进一步处理到赖苏特,但PBMC集合的其他最终应用可以实施,例如核酸的分离,或产生适用于免疫化学 (IHC) 方法的 PBMC 涂片或 PBMC 块。重要的是,由于从患者身上取出的每种生物样本至少在某种程度上代表一种侵入性过程,此协议通过分离可用于细胞因子分析、代谢学研究或 ctDNA 测序的血浆,最大限度地利用每个样本中的有用材料。
肿瘤学试验中外周生物标志物的分析是PBMC赖塞酸盐的众多应用之一。一个例子是评估DNA损伤反应(DDR)的治疗,如化疗,放疗或使用抑制剂的酶参与DDR,如磷脂二二醇-3激酶相关激酶(PIKKs)7和PARP 3,13。这些治疗的目的是增加增殖细胞的DNA损伤,在DDR机制受损的细胞和细胞周期检查点(如癌细胞)中产生高毒性。在这里,我们举了一个例子,对接受X光检查的外周血液中的DDR生物标志物进行了研究。
研究方案
每个司法管辖区如《人体组织法》(HTA – 英国,2004年)和《健康保险可移植性和问责法》(HIPAA – 美国,1996年)必须征得知情的患者同意并完全遵守相关的国家道德要求。在开始任何有关人类衍生材料的工作之前,一定已经完全记录在案的道德批准。根据与国家卫生研究院(NIHR)剑桥生物医学研究中心签订的人类生物样本供应协议,在优化本协议时使用的血液得到了志愿者推进医学小组(伦理参考文献16/EE/0459,研究CRF494,子研究001)的适当同意。英国的阿斯利康生物库由人体组织管理局(许可证第12109号)颁发,并经国家研究伦理服务委员会(NREC)批准为研究组织银行(RTB)(REC 17/NW/0207)。
1. 一般准备指导
注:所有与未修复的人体材料(如本协议中的血液、血浆和全氟辛酸氢电池)一起工作,都必须假设这些材料可能携带潜在的传染性物质,因此必须在适当的生物安全预防措施下进行。对于已知病原体检测为阴性的患者,不要假设样本没有感染性,因此仍必须应用适当的安全预防措施。这些材料产生的废物应采取同样的生物安全预防措施处理,并按当地规则进行处置。
- 选择使用柠檬酸钠或肝素钠作为抗凝剂的两种单核细胞制备管。对于许多下游应用,这两种抗凝剂可以互换使用,但两种抗凝血剂在选择一种进行试验之前都应进行测试。
- 标记一个 8 mL 单核细胞制备管,用于患者编码 ID 的血液采集。将管子保持在室温下(18-25 °C)。
- 在室温下存储 1 倍 PBS(18-25 °C)。每次准备使用 30 mL。
- 确保单独血浆样品的管子和PBMC样品的低温管准确标注了独特的标识符,如实验室手册的相应部分所示。
- 如果 PBMC 将用于监测磷酸化蛋白质,则准备补充磷酸盐抑制剂的 PBS:将 5 mL PBS 与 50 μL 磷酸盐抑制剂鸡尾酒 2 + 50 μL 磷酸盐抑制剂鸡尾酒 3 混合。准备新鲜,并保持冰上,直到使用。
- 如果 PBMC 要冷冻保存,请混合 90% FBS + 10% DMSO,为每个样品准备 1 mL 冷冻混合物。
2. PBMC 集合 (图 1A)
- 使用制造商描述的标准技术将 8 mL 血液抽入单核细胞制备管中。将管子轻轻倒置 8 到 10 次,将抗凝剂添加剂与血液混合。不要摇晃以避免溶血。记录抽血的时间。
- 收集后,在室温下直立存放管子,直到离心。尽快处理样品,最好在采血后一小时内采集,但不迟于4小时后采集。记录开始处理血液时的计时。
- 离心前立即通过将管子轻轻倒置 8 到 10 次来混合血液样本。
- 在室温下(18-25 °C)将管/血样管在水平转子(摆动头)中分流至1,500 - 1,800 x g,30分钟。 确保所有管子都保持适当的平衡。
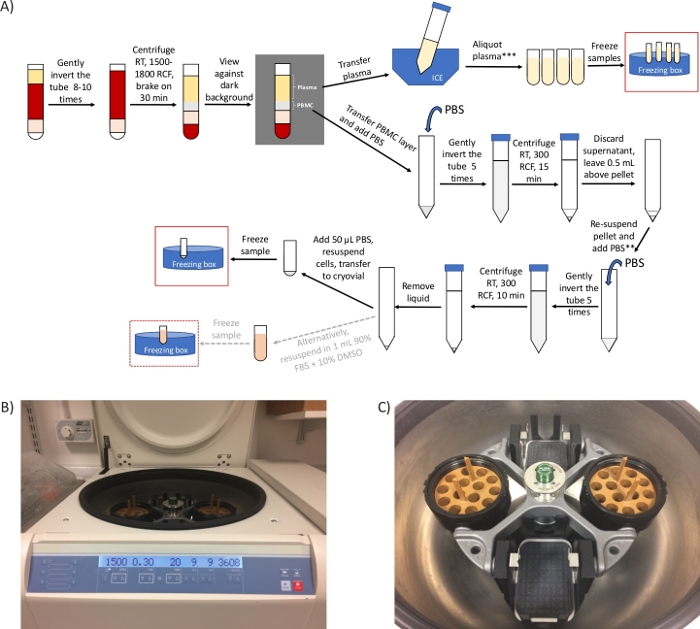
图1:离心机协议和代表性图像的一般概述。(A) PBMC和等离子体的编制议定书的原理图概述。*如果存在时间限制,步骤 2.4 可缩短至 20 分钟,步骤 3.3 至 3.6 可以删除。**如果需要,请使用一个引用来计算单元格。ctDNA 分析/代谢(B)图像所需的 2 个额外的离心步骤,用于第 2.4 步的摆动头转子离心机图像。(C) 转子图像,包括两个包含自旋单核细胞制备管的适配器的桶。 请单击此处查看此图的较大版本。
注 :x g( 也称为RCF、相对离心单元)和RPM(每分钟旋转)是不同的单位。请务必将离心机设置为 x g (RCF)。使用在线计算器(参见 材料表)进行转换。如果只有固定角度转子可用,则在 1,500 - 1,800 x g处执行此步骤 10 分钟。
- 离心后,检查屏障下是否存在深红色层(主要包含红血球)和屏障上方的 2 层。顶层是等离子体(稻草色),下面的白色层是含有 PBMC 的浅色外套。当根据深色/黑色背景查看管子时,这些图层可以很容易地分辨。
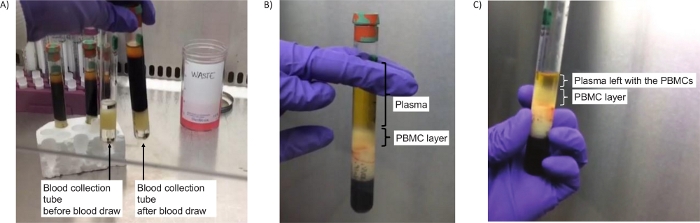
图2:分离生物弹道导弹的管子。(A) 离心前管的图像(第2.4步),要么空(左)或含有血液(右)。(B) 离心后成功分离PBMC层(第2.5步)。(C) 离心后PBMC层的图像和剩余的等离子体,以确保收集所有PCBC(步骤2.7)。 请单击此处查看此图的较大版本。
注意:如果这些图层不可见,这可能表示设置离心装置时存在错误。确保使用正确的离心机适配器,并设置正确的"x g"。 重复步骤2.4。
- 离心后立即使用血清移液器将大约一半的等离子体转移到带有盖子的标记为 15 mL 大小的圆锥形离心管中,同时小心不要干扰 PBMC 层(约 4-5 mL)。暂时将此管与等离子体储存在湿冰上,以便稍后在第 4 步中使用。暂时留出。
- 用巴斯德移液器收集整个 PBMC 层,将移液器放置在细胞层内,然后转移到带盖的不同 15 mL 大小的锥形离心管。如果必要的话,还需要少量的血浆来完全获得所有PBMC层,这是可以接受的。音量通常是1-2升。立即继续下面的第 3 步。
3. PBMC 洗涤步骤
注意:洗涤步骤的目的是稀释和去除PBMC颗粒中的残留血小板和血浆。所有离心步骤应在室温(18-25 °C)下进行。
- 将室温 PBS 添加到 PBMC 管中,使音量达到 15 mL。盖上管子。通过轻轻倒置管5次混合细胞。
- 离心机在300 x g下15分钟。请注意,这比最初的离心离心更温和。
- 通过在深色/黑色背景下查看管子,可视化颗粒。通过真空吸气或移液器(图3A)去除超自然。丢弃超自然体积,在白色PBMC颗粒上方留下约500μL的体积。
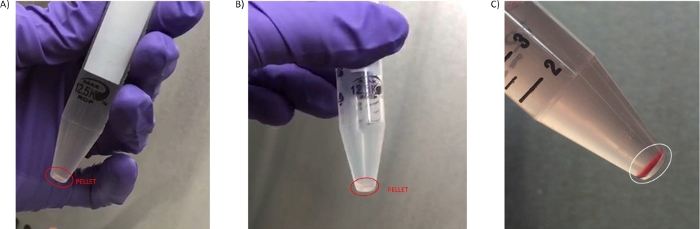
图3:PBMC颗粒。(A) 在第一步3.3中获得的颗粒。(B) 在第二次洗涤中隔离的颗粒(第 3.7 步)。(C) 从第二次洗血中分离的血液抽取中超过4小时的血液中获得血液高度溶解的颗粒(第3.6步)。 请单击此处查看此图的较大版本。
- 通过在残余超自然物中上下轻轻管道来补充细胞颗粒。
- 添加额外的 1 倍 PBS,使音量达到 10 mL。盖上管子。通过轻轻倒置管子 5 倍来混合细胞。如果研究协议中需要细胞计数,则转到步骤 3.5.1,如果没有需要,则直接移动到步骤 3.6。
- 服用重新悬浮的细胞的 40μL 等号,与 40 μL 的尝试蓝混合。使用血细胞计或自动细胞计数器计算可行细胞。
- 离心机暂停从步骤3.5 10分钟在300 x g。在不干扰细胞颗粒的情况下,尽可能多地去除超自然。
- 使用细尖的巴斯德移液器或微皮管,在不干扰细胞颗粒的情况下,小心地去除和丢弃细胞颗粒上方的任何剩余超细剂。完成此步骤后,在颗粒上方少留或不留液体。如果此协议的终点是PBMC颗粒移动到步骤3.8:如果端点是冷冻保存的PCBCs转到步骤3.10。
- 在颗粒中加入 50μL 的新 PBS(或在步骤 1.5 中准备的补充 PBS,如果适用于您的终点),使用微皮球上下轻轻将所有细胞重新分配。将整个细胞悬架转移到标有 1.5 mL 的低温细胞中,并立即放置在湿冰上,直到样品冻结。
- 将标记样品放入液氮或直接放入干冰中,从而冻结标记的样品。使用细胞冷冻盒,也可以将细胞冻结在-80°C冰柜中。在这种情况下,在添加细胞管之前,将盒子完全置于-80°C。记录细胞颗粒冻结的时间。一旦细胞冻结,储存在-80°C,船舶冻结在干冰上。
- 可选地,冷冻保存 PBMC 将颗粒重新悬浮在冷冻混合物的 1 mL 中(步骤 1.6),并转移到标记的低温颗粒中。继续按步骤 3.9 描述,但是,在这种情况下,使用细胞冻结盒冻结样品是可以接受的。在冷冻箱中至少存放24小时后,转移到液氮中进行运输和储存。
4. 等离子准备步骤 (图 1A)
- 继 -80 °C 存储 PBMC 颗粒后,现在准备在第 2.6 步暂时存储在湿冰上的等离子体别名。如果样品的目的是 ctDNA 分析,则执行以下离心步骤以澄清等离子体,否则直接移动到步骤 4.2。
- 在固定角度转子(或摆动转子中 15 分钟)中,在 4 - 8 °C 处以 1,600 - 2,000 x g 将等离子体离心 10 分钟。
- 小心移液器关闭等离子超自然,小心不要打扰任何颗粒,并转移到一个新的15mL管。丢弃含有凹槽材料的管子。
- 在固定角度转子(或摆动转子中 15 分钟)中,在 4 - 8 °C 处以 1,600 - 2,000 x g 将等离子体离心 10 分钟。
- 小心地将等离子体超细剂转移到新的 15 mL 管中,确保不会干扰任何压实材料。丢弃含有凹槽材料的管子。
注意:如果没有冷藏离心机,请在每次旋转之间将电池放在冰上5分钟,或在寒冷的房间里保留离心机样品。
- 将1mL等离子体传输到5个新鲜的2mL微管中。如果没有足够的等离子体用 1 mL 等离子体填充 5 瓶,则使用少于 5 瓶,预计最后一小瓶将包含小瓶少于 1 mL 等离子体。如果血浆超过 5 mL,则丢弃剩余的等离子体。记录每个管中的等离子体总体积。
- 立即将等离子体直接冻结,将其存储在 -80 °C。
5. 样品装运
- 将PBMC颗粒和血浆样品同时运送到干冰上。
- 确保样品在装运前和装运期间不会解冻。将足够的干冰与样品一起包装,以确保它们在整个运输过程中保持冻结状态,并考虑运输过程中可能发生的延误。
6. DDR生物标志物的全血照射和西斑分析 (图4A)
注意:这是一种在临床上大多数情况下不需要的活体治疗,但这些实验是寻找合适的临床生物标志物的宝贵探索策略。采集血液样本后应尽快处理,以确保最佳效果。
- 加热 X 光柜。将三个 15 mL 管分别标记为 0、0.2 和 7 Gy。
- 取三个单核细胞制备管,其中含有来自单个个体的新鲜血液,在轻轻倒置管8至10次后,将血液转移到三个15mL管。
- 将 0.2 Gy 管放在 X 光柜中,关闭门,通过选择架子编号和剂量将 0.2 Gy 剂量涂抹在管中。通过调整橱柜中选择的剂量,将 7 Gy 辐射剂量应用于 7 Gy 管。
- 在37°C下孵化三根管子一小时。
- 将血液传回单核细胞制备管,并执行PBMC制备方案,从步骤2.4到步骤3.8的临床设置。
- 在每个细胞颗粒中加入一卷裂解缓冲器,辅以蛋白酶和磷酸酶抑制剂,等于细胞颗粒体积(在此例中为 RIPA 缓冲区 70 μL),上下吹笛,在冰上孵育 10 分钟。如果有声波器(3个周期,30 s ON/ 30s OFF,4°C),则对样品进行声波化,以打破核酸以消除样品中的粘度。
- 在 15,000 x g≥,在 4 °C 下将样品离心 10 分钟。 将每个超自然体转移到新的 1.5 mL 管中,定性地评估溶血水平(目视检查),并通过任何首选方法测量蛋白质浓度。
- 将总 40μg 的 lysate 与包含 SDS 和样品减少剂的样品加载缓冲器混合。在热块中煮样品5分钟。
- 将每个通道的每个样本的 20 μg 重复加载到 4-12% 的二分五裂蛋白凝胶中,并运行 SDS-PAGE。
- 分离后,使用市售系统(20 V,10分钟)将蛋白质转移到硝基纤维素膜,并在TBST中用5%的牛奶阻断。
- 在相关分子大小处切割膜,并在 4 °C 时与主要抗体一起孵化(参见抗体和稀释 材料表 )。
- 取出主要抗体,在室温下用TBST清洗膜3次,5分钟。在室温下与 HRP 结合的二次抗体孵育 45 分钟。
- 用TBST清洗3次5分钟。
- 应用 ECL 试剂并分析相对于 HRP 信号获得的图像。
结果
为了提高临床试验中PBMC制剂的质量,我们生成了一个协议,其中简洁明了的步骤,医院实验室专业人员可以遵循这些步骤,而不受其分子生物学背景和实验室技能的了解。我们已修改制造商的协议,对从参与各种多中心临床试验的临床部位发现或报告执行问题的步骤进行修改。但是,可以进一步优化协议以满足特定要求,例如临床站点中的时间限制或下游分析类型(参见 补充文件)。我们通过观察辐射产生的DNA损伤的特定生物标志物,在PCBC中分析DDR。
我们从临床现场收到的最常见查询与离心步骤有关,这直接影响到能够成功分离 PBMC 并获得最终的 PBMC 颗粒。使用适当类型的摆动头转子离心机(图1B,C)是协议成功的关键。但是,当临床现场只有一个固定角度转子离心机时,我们建议在同一 RCF 的定角转子中执行步骤 2.4,但只需 10 分钟。这可确保 PBMC 层与等离子体分离(见图 2B,C)。虽然将血液分层在密度梯度分离介质上需要制动离心离心,但由于管内存在凝胶屏障,可用制动器离心,确保与密度更稠密的血液成分27、28分离的 PBMC 层保持保存。
至少4mL的高质量、非稀释血浆是从8mL管格式的血液离心中获得的,可以进一步澄清,用于ctDNA测序或代谢学研究29、30(可选步骤4.1.1-4.1.4)等专门分析。分离的 PBMC 数量、颗粒大小、溶血或红细胞污染一直是来自临床部位和样本分析经验的其他问题。从8mL血液中获得的细胞数量根据患者和疾病设置而变化,但一般来说,获得的颗粒体积较小,并且具有透明/白色(图3A,B)。由于这些特性,在深色背景下可视化颗粒非常重要,以避免在洗涤步骤(2.5 和 3.3)期间意外吸入颗粒。有时颗粒会因为红细胞污染(图3C)而产生一些红色,这对制剂的质量有负面影响。为了避免丢失小颗粒,如图 3中显示的颗粒,通过步骤 3.7 促进 PBMC 颗粒在 50 μL 的 PBS 中恢复,从而将 PBMC 颗粒转移到低温颗粒。
使用这些管子和来自健康个体的血液时的典型产量在7至21 x 106细胞之间,为8mL,细胞恢复在70至80%之间,因为它是我们的经验,正如它以前已经显示27,28。这取决于单个细胞计数和操作员,它可与其他方法使用密度梯度(包括使用带分离屏障的管子的系统)15、27、28获得的细胞数量和细胞恢复值相媲美。根据疾病设置,使用这种方法分离的 PBMC 数量变化的一个说明性示例是分析慢性淋巴细胞白血病 (CLL) 患者的 PBMC 标记。应用此协议时,从 8 mL 单核细胞制备管中恢复的细胞数量从 1.62 x 104到 1.99 x 109在从研究 NCT0332827331 (表 1)中获得的 7 个样本中有所不同。相关参数是该方法获得的PBMC赖塞的蛋白质浓度,这取决于分离的细胞数量和蛋白质提取的效率。第 6 节中裂解的细胞颗粒是使用 RIPA 缓冲和声波(第 6.6 步)生成的。细胞颗粒在相同体积的裂解缓冲器中的悬念通常导致浓度范围从 3 到 10 mg/mL,在此特定示例中,裂解液浓度分别为 6.8、8.3 和 8.6 毫克/mL,分别为 0、0.2 和 7 Gy。然而,当从尚未最佳准备的临床部位采集样本、患者疾病以及红细胞污染产生的血红蛋白时,这种变异性会很高。例如,非常小的颗粒需要在大于细胞颗粒体积的裂解缓冲器中再喷出,以便进行蛋白质浓度测量和下游生物标志物分析,从而产生更稀释的样品。在这种情况下,如果样品浓度低于 1 毫克/mL,由于这种高稀释系数,这可能会对执行类似西方污点的检测构成挑战。相比之下,在前面提到的CLL样本中,为补充细胞颗粒而添加的裂解缓冲器体积从50到500微升不等,蛋白质浓度从1.62毫克/mL(表1)到19.77毫克/升不等。
当样本出现红细胞污染或溶血(图3C)时,由于红细胞中含有血红蛋白,PBMC裂解物的蛋白质浓度被高估。这就是为什么人们应该对此类样本进行目视检查和注释的原因,如协议第 6.7 步所述。在执行生物标志物分析时,如果在检测中包含加载控制,超额加载样品可以补偿血红蛋白的存在。其他更量化的方法,以测量溶血可以实施,如测量吸收在414 nm32。
DDR 在在此临床协议后获得的 PBMC 中进行了分析。为了说明一种模仿DNA破坏临床治疗(如放疗或化疗)的情况,健康志愿者的全血受到X射线辐射(图4A)。电传辐射 (IR) (X 射线) 会诱发不同类型的 DNA 损伤,包括 DNA 双链断裂 (DSBs)。这些病变的DNA损伤感应激活PIK,如阿塔夏-端粒细胞变异(ATM)、ATM和Rad3相关(ATR)和DNA依赖蛋白激酶(DNA-PK),它们与DNA修复机制(如同源重组(HR)或非同源端连接(NHEJ)。由于DSB的存在,自动对焦处理机的激活是由于它招募到MRB(MRE11-RAD50-NBS1)综合体的损坏地点,导致ATM自动磷化在包括Ser1981在内的几个残留物上。反过来,激活的ATM磷酸酯的MRN复合物和其他蛋白质,如Ser139上的组蛋白变种H2AX(其中pser139-H2AX也被称为γH2AX),以促进从DSB跨越的色度发生结构性变化,从而促进招募其他DDR因子33。PBMC 对电离辐射有反应,尽管其增殖率低,质谱测量方法允许 ATM 对 RAD50 上的磷酸化 Ser635 进行定量调节。这种磷酸化在ATM抑制剂的存在下减少,RAD50 pS635已被进一步验证为药效生物标志物,用于临床ATM抑制剂治疗肿瘤的免疫化学8。为了评估PBMC对辐射的反应,健康志愿者的血液受到不同的红外剂量,在37°C(图4A)的1小时潜伏后采集样本。为此,血液被转移到塑料管中,以避免因高温(第6.2步)而降低PBMC隔离的产量。我们不仅通过查看之前报告的 RAD50 pS635 以及 ATM pS1981 和γH2AX分析了 ATM 是如何激活的。在检查的三个案例中,这些转化后修改在较高 IR 剂量(图 4B)中观察到增加。有趣的是,ATM 和 RAD50 的磷化在 0.2 Gy 的低剂量下是巨大的,这表明这些转化后修饰可能作为 PD 生物标志物进行实际审讯,用于涉及产生具有良好动态范围的 DNA DSB 的治疗,不仅在肿瘤样本中,而且在外周血液中。这允许通过在治疗过程中获取纵向样本来监测PD对治疗的反应。从抽血到处理样品的时机对于确保这些信号级联仍然有效至关重要,因为处理延迟将影响此类级联的动力学,并且可能会错过用作磷标志物的磷酸化事件。
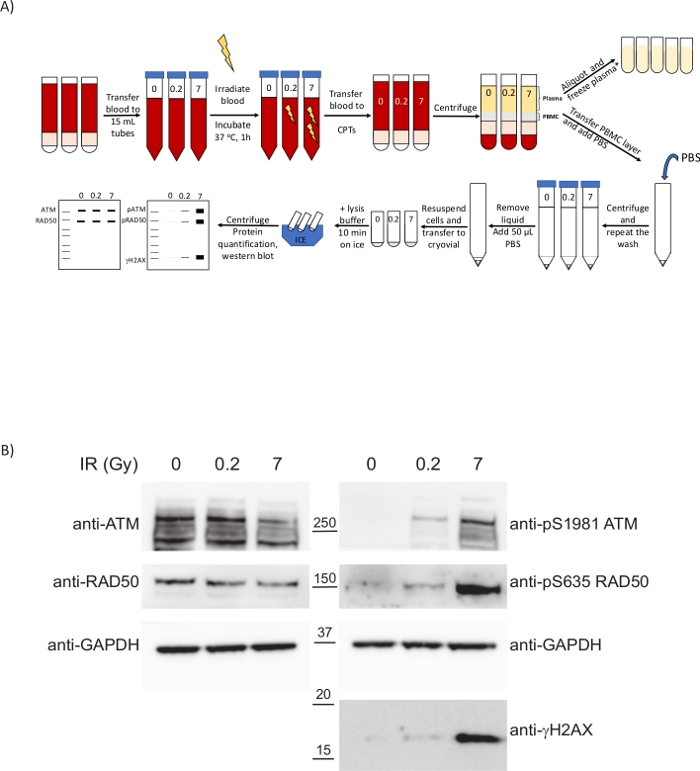
图4:在目前的临床协议显示生物标志物后,从前活体辐照血液中分离出的PBMC,以告知治疗造成的DNA损伤程度。(A) 全血辐照时准备 PBMC 和分析 DDR 的方案概述。*ctDNA分析/代谢学所需的2个额外的离心步骤。(B) 显示 PBMC 中 DDR 磷生物标志物的剂量依赖性上升调节的西方污点。 请单击此处查看此图的更大版本。
| 样本 | PBMC/8 mL 血液数量 | 补充 RIPA 缓冲体积 (μL) | 最终浓度(毫克/mL) |
| A.1 | 39100000 | 70 | 12.16 |
| A.2 | 97400000 | 100 | 4.54 |
| A.3 | 233000000 | 150 | 7.63 |
| A.4 | 316000000 | 150 | 16.87 |
| A.5 | 387000000 | 150 | 12.60 |
| A.6 | 459000000 | 150 | 12.71 |
| A.7 | 414000000 | 200 | 15.67 |
| A.8 | 253000000 | 150 | 14.56 |
| A.9 | 509000000 | 300 | 10.67 |
| B.1 | 15200000 | 70 | 2.96 |
| B.2 | 10500000 | 50 | 4.59 |
| B.3 | 13200000 | 50 | 3.99 |
| B.4 | 34800000 | 100 | 10.41 |
| B.5 | 1620000 | 70 | 7.11 |
| B.6 | 70200000 | 100 | 9.26 |
| B.7 | 65400000 | 100 | 12.10 |
| B.8 | 91100000 | 150 | 11.82 |
| C.1 | 6330000 | 70 | 4.04 |
| C.2 | 4400000 | 150 | 19.77 |
| C.3 | 68000000 | 100 | 8.96 |
| C.4 | 35100000 | 50 | 9.30 |
| C.5 | 35400000 | 70 | 10.55 |
| C.6 | 99200000 | 100 | 16.19 |
| D.1 | 402000000 | 70 | 7.23 |
| D.2 | 826000000 | 300 | 16.95 |
| D.3 | 1990000000 | 300 | 14.87 |
| D.4 | 1000000000 | 300 | 18.34 |
| D.5 | 1160000000 | 400 | 16.13 |
| D.6 | 806000000 | 400 | 19.40 |
| E.1 | 302000000 | 300 | 13.86 |
| E.2 | 990000000 | 500 | 19.04 |
| E.3 | 1200000000 | 400 | 17.13 |
| F.1 | 4010000 | 50 | 1.62 |
| F.2 | 5170000 | 50 | 2.84 |
| F.3 | 2810000 | 50 | 3.69 |
| F.4 | 3700000 | 75 | 3.62 |
| F.5 | 3460000 | 70 | 4.03 |
| F.6 | 7060000 | 50 | 3.32 |
| G.1 | 60700000 | 70 | 6.57 |
| G.2 | 82100000 | 150 | 7.78 |
| G.3 | 30500000 | 70 | 8.28 |
| G.4 | 134000000 | 100 | 15.14 |
| G.5 | 91900000 | 100 | 8.61 |
| G.6 | 372000000 | 150 | 15.88 |
| G.7 | 574000000 | 200 | 15.01 |
| 纵向PBMC样本对应7名患者 | |||
表1:慢性淋巴细胞白血病患者PBMC颗粒的细胞数量和蛋白质浓度(CLL)。 本表中提供的数据对应于参与研究的 7 名 CLL 患者在单核细胞制备管中收集的 45 个 PBMC 样本。这些是使用引用的研究31的样本生成的原始数据。
补充文件:替代协议选项。请单击此处下载此文件。
讨论
PBMC 和血浆的高质量制剂,可在临床试验现场进行稳健和可重复的准备,为临床试验外围预测和药效转化生物标志物终点提供宝贵信息。在这里,我们提供了一个简短而明确的协议,解决了迄今为止在临床试验环境中容易出现执行错误通常有问题的步骤。但是,可以进一步优化协议以满足特定要求,例如临床现场的时间限制或下游分析类型(参见 补充文件)。
为此,我们展示了如何利用单核细胞制备管将PBMC和血浆从全血中分离出来,以产生适合各种下游分析的冷冻PBMC颗粒和冷冻血浆。我们已提请注意特别关键的协议步骤,包括第 2.5 步中 PBMC 层的离心和识别,以及步骤 3.3 和 3.6 中的 PBMC 颗粒。从历史上看,临床部位经常出错的地方是将离心机设置为正确的单位(将RCF或 x g值与RPM值混淆),延迟血液样本的处理、温度和冷冻细胞颗粒上方大量PBS的存在。在大多数离心机转子错误地输入x g值作为 RPM 设置将导致显着离心不足,导致定义不明确或缺席 PBMC 层,以及由于低效细胞平滑在洗涤步骤期间可能无意中丢弃 PBMC。但是,尽管患者已患上白血病,则使用正确的离心设置和转子适配器,但 PBMC 层仍可能不可见。这种情况可能会影响因化疗或放射治疗而参加肿瘤学试验的患者,应予以考虑。协议中已阐明的另一个关键点是,必须在抽血后1-2小时内处理样品,以减少血液溶解对协议产生负面影响的可能性。此外,旨在处理样本在抽血的第一个小时减少前活性变异性,这可能有很大的影响,药动力学读数和生物标志物的影响,血液保存或主动信号通路,如图4中显示的情况。样品处理的延迟也会对细胞的生存能力产生有害影响,如果细胞要冷冻保存34。另一个可能影响产量和红细胞污染的因素是储存和离心温度,应保持在室温(18-25 °C)。较低的温度会增加密度梯度介质的密度,这会导致红血球和颗粒细胞污染的程度较高,因为这些细胞不会聚集。另一方面,较高的温度导致PCBC夹在聚合红细胞之间,从而降低制备15,27,28的产量。最后,在低温细胞颗粒中,液体的浓度不得超过50-100μL,这一点至关重要,因为这将对这些PBMC制剂的下游加工中获得的任何蛋白质乳酸酯的浓度产生负面影响。过量的液体会使样品过多,导致蛋白质浓度极低的利萨酸盐不适合生物标志物分析。此外,任何翻译后修改的保存都会受到损害,裂解的效率也会大大降低。
单核细胞制备管被选择,因为它们提供了最直接的方法,隔离PCBC和血浆在一次抽血的临床试验,在我们的经验,优秀的可重复性。血液处理不需要训练有素的操作员,使用单管可消除稀释血液和转移到另一管的需要,降低危险风险:由于踩刹车执行离心步骤,缩短了协议时间;并且所有试剂都在管中,这减少了变异性。根据我们的经验,与其他经典方法相比,这些好处大于这些管子的较高成本,包括仅使用密度梯度分离介质27、28(每 60 个单位 410 英镑,而淋巴素介质用于 66 50 mL 制剂是 215 英镑)。它们有两种抗凝血剂,肝素和柠檬酸盐,两种在维持分离的PCBMC35的功能方面都是可比的,因此,选择一种抗凝剂而不是另一种抗凝剂将基于肝素或柠檬酸盐在下游生物标志物研究中的可能影响。虽然已经表明,与肝素或柠檬酸盐13相比,EDTA管提供最高的PBMC隔离产量,但单管操作的易用性抵消了这一考虑。如果细胞因子要分析抗凝血剂可以有血浆检测到的水平的影响,因此这两种抗凝剂应测试之前,选择一个临床试验36。如果血浆要用于代谢学研究,使用肝素作为抗凝血剂将是首选37。因此,留给最终用户或临床试验转化科学家的唯一一点是,一旦评估成本,柠檬酸盐或肝素是否更适合其用途。
虽然使用细胞制备管的好处是多种多方面的,但与它们带来的限制(高成本和有限范围抗凝剂的可用性)相比,使用PBMC或血浆在临床试验中获取PD生物标志物的主要限制可能与隔离方法无关。除了血液癌,其中肿瘤直接从外周血液采样,其他癌症适应症血浆和PBMC是代孕组织,不一定模仿原发性肿瘤。外周组织可能不与原发性肿瘤共享基因组和表观基因组,因此,依赖特定肿瘤突变的生物标志物的外围分析主要限于ctDNA分析(来自血浆)或CTC(通过随后对PBMC层进行排序)。此外,信号级联驱动或促成肿瘤增殖可能不如活跃在外周血液中。这一挑战可以通过应用生物标志物发现方法瞄准血液8 来识别替代生物标志物或耦合前体内治疗分离血浆38 和PBMC制剂26来克服。
在目前的协议中,冷冻PBMC颗粒可以很容易地在临床部位外加工,以提供蛋白质解体,这些蛋白化解可以通过西方印迹或ELISA技术进行评估。还提出了使用 PBMC 启用 IHC 方法的替代方法(补充文件)。此外,我们还详细介绍了低温保存PBMC(见补充文件)用于免疫细胞监测的可能性,这是肿瘤学的相关应用,免疫检查点抑制剂和ADC越来越多地在临床试验中测试。评估免疫功能,如ADCC16和免疫异种化是与从单核细胞制备管15分离的冷冻保存的PBMC兼容的应用程序。低温保存有一个警告,因为它可以促进某些表面和内部标记的向下调节,并可能损害某些细胞功能,但PBMC低温保存是唯一可行的方法来执行这些检测由于时间限制时,处理样品从多个临床地点到外部实验室14,15处理,这些有害影响可以大大克服良好的解冻方法和休息期39。
总之,这里提供的协议将允许任何临床机构使用通用设备和材料可靠地制备PBMC和血浆样本,以便在全球临床试验中有力地启用来自外周血液的转化端点。
最后,我们演示了PBMC赖素的分析如何通过显示关键DDR因子的剂量依赖性转化后修饰,以机械方式告知对DNA损伤剂的反应,这可用于帮助塑造临床发展。前瞻性地实施比西方印迹(例如质谱40)更定量的方法,并且需要较少的输入材料(如毛细管西印和ELISA),将有助于将这些前结核结果转向对PBMC患者样本进行更有力、更系统的评估。
披露声明
所有作者都是或都是阿斯利康的员工和股东。VM 是宏达制药的员工,拥有阿斯利康和吉拉德科学的股票。
致谢
我们要感谢阿斯利康肿瘤学研究和早期开发部的转化医学所有成员对协议的反馈,特别是赫德利·卡尔、塔米·叶和内森·斯坦迪弗分别就ctDNA分析的血浆制备、PBMC隔离和PBMC低温保存和免疫异种平提供建议。
材料
| Name | Company | Catalog Number | Comments |
| 1.5 mL cryovial | Nalgene, ThermoFisher | 5000-1020 | To store PBMC pellets and re-suspended PBMCs |
| 1.5 mL microcentrifuge tubes | VWR | 525-0990 | This is an example, use your preferred provider |
| 15 mL conical sterile propylene centrifuge tube | Nunc, ThermoFisher | 339651 | Other brands can be used |
| 2 mL screw cap tube sterile, with attached cap | ThermoFisher | 3463 | For plasma aliquoting |
| 20X TBS Buffer | ThermoFisher Scientific | 28358 | Final is 25 mM Tris, 0,15 M NaCl; pH 7,5. This is an example, you can prepare your own stock or use a different provider |
| 20X TBS Tween 20 Buffer | ThermoFisher Scientific | 28360 | Or supplement TBS with 0.05% to prepare TBST buffer |
| Automated cell counter or haemocytometer | ThermoScientific | AMQAX1000 | We use Countess device and slides but could be other methods. |
| Adjustable micropipette allowing 50 µL measurements | To handle small volumes (i.e. western blot, transfer PBMC pellets to 1.5 mL tubes) | ||
| BD Vacutainer CPT mononuclear cell preparation tube (Na-citrate or Na-heparin) 8 mL | BD | 362761, 362753 | There are 4 mL tubes but if possible 8 mL tubes are recommended to obtain more PBMCs from a single blood draw |
| Cell-freezing box | ThermoFisher Scientific | 5100-0001 | This is an example, use your preferred provider. |
| Centrifugation unit converter | LabTools | http://www.labtools.us/centrifugation-speed-rpm-to-g-conversion/ | |
| DMSO | Sigma-Aldrich, MERK | D2438 | Use your preferred provider. Ued for PBMC cryopreservation |
| ECL horseradish peroxidase substrate | ThermoFisher | 34075 | Use your preferred reagent according to the sensitivity required to detect your biomarker by western blot. Other systems can be used such as IRDye secondary antibodies with imaging systems. |
| Faxitron MultiFocus X-ray cabinet | Faxitron Bioptics | To irradiate blood. Other models/makers are available | |
| Fetal Bovine Serum (FBS), heat inactivated | ThermoScientific | 102706 | Use your preferred provider. Ued for PBMC cryopreservation |
| Fine tip, sterile 1.5 mL Pasteur pipettes | VWR | 414004-018 | Optional |
| Fixed-angle rotor centrifuge | Optional for preparation of plasma for ctDNA/metabolomics | ||
| Gel doc imaging system | SYNGENE | For imaging HRP developed membranes | |
| Heat block | To denature lysates prior to run them in western blot, any maker equipped with suitable tube adaptors | ||
| Horizontal rotor (swing-out head) centrifuge | Thermoscientific | Heraeus Megafuge 40R | This is an example |
| Liquid nitrogen/dry ice | To flash-freeze samples | ||
| Marvel dried skimmed milk | Premier Foods | This is an example, use your preferred provider | |
| Micropipette tips for range 1-200 µL | To handle small volumes (i.e. western blot, transfer PBMC pellets to 1.5 mL tubes) | ||
| NuPAGE 4-12% Bis-Tris protein gel, 1 mm, 10 wells | ThermoFisher Scientific | NP0321BOX | This is an example, cast your own or use your preferred provider |
| NuPAGE LDS Sample Buffer (4X) | ThermoFisher Scientific | NP0007 | For imaging HRP developed membranes |
| NuPAGE Sample Reducing Agent (10X) | ThermoFisher Scientific | NP0009 | This is an example. |
| PBS, no calcium, no magnesium | Gibco, ThermoFisher | 14190-144 | This is usually provided in the clinical kit. |
| Phosphatase inhibitor cocktail 2 | Sigma-Aldrich, MERK | P5726-1ML | Optional for step 3.7 |
| Phosphatase inhibitor cocktail 3 | Sigma-Aldrich, MERK | P0044-1ML | Optional for step 3.7 |
| Rabbit anti GAPDH | Cell Signaling Technology | CST 2128 | 1:1000 dilution in 5% milk TBST |
| Rabbit anti γH2AX | Cell Signaling Technology | CST 2577, lot 11 | 1:2000 dilution in 5 % milk TBST |
| Rabbit anti pS1981 ATM | Abcam | ab81292 | 1:2000 dilution in 5 % milk TBST |
| Rabbit anti pS635 RAD50 | Cell Signaling Technology | CST 14223 | 1:1000 dilution in 5 % milk TBST |
| Rabbit anti total ATM | Abcam | ab32420 | 1:1000 dilution in 5 % milk TBST |
| Rabbit anti total RAD50 | Cell Signaling Technology | CST 3427, lot 2 | 1:1000 dilution in 5 % milk TBST |
| RIPA buffer | Sigma-Aldrich, MERK | R0278-50ML | For cell lysis. This is an example, use your preferred provider |
| Sonicator | Diagenode | B01060010 | Used for 3 cycles at 30 s on/ 30 s off, 4 oC. If using a different instrument, adjust number of cycles and intensity according to your sonicator. |
| Sterile 1.7 mL Pasteur pipettes | VWR | 414004-030 | This is an example, use your preferred provider |
| Sterile serological pipettes (5 and 10 mL volume) | Costar | 4101, 4051 | This is an example, use your preferred provider |
| Trypan blue | ThermoScientific | T10282 | This is for the automated cell counter listed above. |
| Wet ice | To keep plasma samples and lysates cold |
参考文献
- Hoelder, S., Clarke, P. A., Workman, P. Discovery of small molecule cancer drugs: successes, challenges. and opportunities. Molecular Oncology. 6, 155-176 (2012).
- Harrigan, J. A., Jacq, X., Martin, N. M., Jackson, S. P. Deubiquitylating enzymes and drug discovery: emerging opportunities. Nature Reviews Drug Discovery. 17, 57-77 (2018).
- Brown, J. S., O'Carrigan, B., Jackson, S. P., Yap, T. A. Targeting DNA repair in cancer: beyond PARP inhibitors. Cancer Discovery. 1, 20-37 (2017).
- Pettersson, M., Crews, C. M. PROteolysis TArgeting Chimeras (PROTACs)-Past, present and future. Drug Discovery Today: Technologies. 31, 15-27 (2019).
- Scott, A. M., Wolchok, J. D., Old, L. J. Antibody therapy of cancer. Nature Reviews Cancer. 12, 278-287 (2012).
- Thomas, A., Teicher, B. A., Hassan, R. Antibody-drug conjugates for cancer therapy. The Lancet Oncology. 17 (6), 254 (2016).
- Ferguson, F. M., Gray, N. S. Kinase inhibitors: the road ahead. Nature Reviews Drug Discovery. 17 (5), 353-377 (2018).
- Jones, G. N., et al. pRAD50: a novel and clinically applicable pharmacodynamic biomarker of both ATM and ATR inhibition identified using mass spectrometry and immunohistochemistry. British Journal of Cancer. 119 (10), 1233-1243 (2018).
- Cook, D., et al. Lessons learned from the fate of AstraZeneca's drug pipeline: a five-dimensional framework. Nature Reviews Drug Discovery. 13, 419-431 (2014).
- Overman, M. J., et al. Use of research biopsies in clinical trials: are risks and benefits adequately discussed. Journal of Clinical Oncology. 31 (1), 17-22 (2012).
- Olson, E. M., Lin, N. U., Krop, I. E., Winer, E. P. The ethical use of mandatory research biopsies. Nature reviews Clinical Oncology. 8, 620-625 (2011).
- O'Donnell, A., et al. Phase I pharmacokinetic and pharmacodynamic study of the oral mammalian target of rapamycin inhibitor Everolimus in patients with advanced solid tumors. Journal of Clinical Oncology. 26 (10), 1588-1595 (2008).
- Fong, P. C., et al. Inhibition of Poly(ADP-Ribose) polymerase in tumors from BRCA mutation carriers. The New England Journal of Medicine. 361 (2), 123-134 (2009).
- Verschoor, C. P., Kohli, V., Balion, C. A comprehensive assessment of immunophenotyping performed in cryopreserved peripheral whole blood. Cytometry B Clinical Cytometry. 94 (5), 662-670 (2018).
- Ruitenberg, J. J., et al. VACUTAINER®CPT™ and Ficoll density gradient separation perform equivalently in maintaining the quality and function of PBMC from HIV seropositive blood samples. BMC Immunology. 7 (11), (2006).
- Yamashita, M., et al. A novel method for evaluating antibody-dependent cell-mediated cytotoxicity by flowcytometry using cryopreserved human peripheral blood mononuclear cells. Scientific Reports. 6 (19772), 1-10 (2016).
- Schiavon, G., et al. Analysis of ESR1 mutation in circulating tumor DNA demonstrates evolution during therapy for metastatic breast cancer. Science Translational Medicine. 7 (313), 182 (2015).
- Lee, J., et al. Tumor genomic profiling guides metastatic gastric cancer patients to targeted treatment: the VIKTORY umbrella trial. Cancer Discovery. , (2019).
- Abbosh, C., et al. Phylogenetic ctDNA analysis depicts early-stage lung cancer evolution. Nature. 545, 545 (2017).
- Thress, K. S., et al. Acquired EGFR C797S mutation mediates resistance to AZD9291 in non-small cell lung cancer harboring EGFR T790M. Nature Medicine. 21 (6), 560-562 (2015).
- Rossi, G., Ignatiadis, M. Promises and pitfalls of using liquid biopsy for precision medicine. Cancer Research. 79 (11), 2798-2804 (2019).
- Balasubramanian, P., et al. Isolation and characterisation of circulating tumor cells (CTCs) from peripheral blood specimens of patients with advanced solid tumor malignancies (using ApoStream® instrumentation) [abstract 3062]. Proceedings of the Annual meeting of the American Association for Cancer Research. , (2014).
- Qin, J., Alt, J. R., Hunsley, B. A., Williams, T. L., Fernando, M. R. Stabilization of circulating tumor cells in blood using a collection device with a preservative reagent. Cancer Cell International. 14 (13), 1-6 (2014).
- Biomarkers definitions working group. Biomarkers and surrogate endpoints: preferred definitions and conceptual framework. Clinical Pharmacology & Therapeutics. 69 (3), 89-95 (2001).
- Crowley, E., Di Nicolantonio, F., Loupakis, F., Bardelli, A. Liquid biopsy: monitoring cancer-genetics in the blood. Nature Reviews Clinical Oncology. 10, 472-484 (2013).
- Bundred, N., et al. Evaluation of the pharmacodynamics of the PARP inhibitor olaparib: a phase I multicentre trial in patients scheduled for elective breast cancer surgery. Investigational New Drugs. 31, 949-958 (2013).
- Rosado, M., et al. Advances in biomarker detection: Alternative approaches for blood-based biomarker detection. Advances in Clinical Chemistry. 92, 141-199 (2019).
- Grievink, H. W., et al. Comparison of three isolation techniques for human peripheral blood mononuclear cells: cell recovery and viability, population composition and cell functionality. Biopreservation and Biobanking. 14 (5), 410-415 (2016).
- Khadka, M., et al. The effect of anticoagulants, temperature, and time on the human plasma metabolome and lipidome from healthy donors as determined by liquid chromatography-mass spectrometry. Biomolecules. 9 (5), 1-15 (2019).
- Hellmann, M. D., et al. Circulating tumor DNA analysis to assess risk of progression after long-term response to PD-(L)1 blockade in NSCLC. Clinical Cancer Research. 26 (12), 2849-2858 (2020).
- ClinicalTrials.gov [Internet}. Identifier NCT03328273, A study of AZD6738 and Acalabrutinib in subjects with relapsed or refractory chronic lymphocytic leukemia (CLL). National Library of Medicine (US) Available from: https://clinicaltrials.gov/ct2/show/NCT03328273 (2017)
- Kirschner, M. B., et al. The impact of hemolysis on cell-free microRNA biomarkers. Frontiers in Genetics. 4 (94), 1-13 (2013).
- Blackford, A. N., Jackson, S. P. ATM, ATR, and DNA-PK: The Trinity at the Heart of the DNA Damage Response. Molecular Cell. 66, 801-817 (2017).
- Riedhammer, C., Halbritter, D., Weissert, R. Peripheral Blood Mononuclear Cells: Isolation, Freezing, Thawing, and Culture. Methods in Molecular Biology. 1304, 53-61 (2016).
- Basavaraj, M. G., Østerud, B., Hansen, J. B. Influence of different anticoagulants on monocyte procoagulant functions and monocyte-platelet aggregates formation. Journal of Thrombosis and Haemostasis. 9 (8), 1673-1676 (2011).
- Biancotto, A., Feng, X., Langweiler, M., Young, N. S., McCoy, J. P. Effect of anticoagulants on multiplexed measurements of cytokine/chemokines in healthy subjects. Cytokine. 60, 438-446 (2012).
- Wawrzyniak, R., et al. New plasma preparation approach to enrich metabolome coverage in untargeted metabolomics: plasma protein bound hydrophobic metabolite release with proteinase K. Scientific Reports. 8, 1-10 (2018).
- Duffy, D., et al. Standardized whole blood stimulation improves immunomonitoring of induced immune responses in multi-center study. Clinical Immunology. 183, 325-335 (2017).
- Wang, L., et al. Standardization of cryopreserved peripheral blood mononuclear cells through a resting process for clinical immunomonitoring- development of an algorithm. Cytometry A Clinical Cytometry. 89, 246-258 (2016).
- Whiteaker, J. R., et al. Targeted mass spectrometry enables robust quantification of FANCD2 mono-ubiquitination in response to DNA damage. DNA Repair. 65, 47-53 (2018).
- Lam, N. Y., Rainer, T. H., Chiu, R. W., Lo, Y. M. EDTA is a better anticoagulant than heparin or citrate for delayed blood processing for plasma DNA analysis. Clinical Chemistry. 50, 256-257 (2004).
- Parpart-Li, S., et al. The effect of preservative and temperature on the analysis of circulating tumor DNA. Clinical Cancer Research. 23 (10), 2471-2477 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。