Method Article
Preparazione di pellet e plasma di cellule mononucleari periferici da un singolo estrapolazione di sangue presso siti di studio clinico per l'analisi dei biomarcatori
In questo articolo
Riepilogo
Questo protocollo descrive in dettaglio la preparazione clinicamente implementabile di pbmc di alta qualità e biocampioni al plasma nel sito di sperimentazione clinica che possono essere utilizzati per l'analisi del biomarcatore trascizionale.
Abstract
L'analisi dei biomarcatori nel sangue periferico sta diventando sempre più importante negli studi clinici per stabilire la prova del meccanismo per valutare gli effetti del trattamento e aiutare a guidare la dose e la pianificazione della definizione delle terapie. Da un singolo estrapolamento del sangue, le cellule mononucleari del sangue periferico possono essere isolate ed elaborate per analizzare e quantificare marcatori proteici, e campioni plasmatici possono essere utilizzati per l'analisi del DNA tumorale circolante, delle citochine e della metabolomica plasmatica. Campioni longitudinali di un trattamento forniscono informazioni sull'evoluzione di un determinato marcatore proteico, sullo stato mutazionale e sul paesaggio immunologico del paziente. Questo può essere ottenuto solo se il trattamento del sangue periferico viene effettuato efficacemente in siti clinici e i campioni sono adeguatamente conservati dal comodino alla panchina. Qui presentiamo un protocollo ottimizzato per uso generale che può essere implementato in siti clinici per ottenere pellet PBMC e campioni di plasma in studi clinici multi-centro, che consentirà ai professionisti clinici nei laboratori ospedalieri di fornire con successo campioni di alta qualità, indipendentemente dal loro livello di competenza tecnica. Vengono presentate anche varianti alternative del protocollo ottimizzate per metodi analitici downstream più specifici. Applichiamo questo protocollo per lo studio dei biomarcatori proteici contro la risposta ai danni al DNA (DDR) sul sangue irradiato a raggi X per dimostrare l'idoneità dell'approccio in contesti oncologici in cui sono stati praticati farmaci DDR e / o radioterapia, nonché in fasi precliniche in cui è richiesto test di ipotesi meccaniche.
Introduzione
Lo sviluppo di farmaci mira a fornire nuove terapie che affrontano esigenze mediche insoddisfatte e medicina più mirata e personalizzata. Sono in fase di studio più meccanismi farmacologici tra cui inibizione enzimaticacome chinasi 1,proteasi2o inibitori della poli (ADP-ribosio) polimerasi (PARP)3,degradanti proteici4,anticorpiterapeutici 5e farmaci coniugati anticorpali (ADC)6, tra molti altri. Un esempio degli sforzi per ottenere trattamenti migliori in oncologia è l'uso di inibitori della chinasi con l'obiettivo di fermare le cascate di segnalazione che mantengono le cellule cancerose proliferano1,7. Misurare i livelli di fosforilazione del substrato specifici di quelle chinasi è il miglior biomarcatore farmacodinamico per quantificare il meccanismo d'azione di questi inibitori8. Altri farmaci possono modulare l'espressione di una data proteina, e in tal caso è fondamentale essere in grado di quantificare longitudinalmente i cambiamenti nella concentrazione della loro proteina bersaglio durante il corso del trattamento. Pertanto, indipendentemente dalle caratteristiche di un farmaco o di una patologia, la valutazione dei biomarcatori per stabilire la relazione farmacocinetica (PK)/ farmacodinamica (PD) tra esposizione al farmaco e modulazione target è la migliore pratica nello sviluppo clinico precoce e consente la determinazione di una dose /programma farmacologicamente attiva sicura etollerata 9.
Mentre nello sviluppo clinico oncologico, l'analisi del biomarcatore nelle biopsie potrebbe essere l'impostazione migliore per stabilire la prova del meccanismo di un farmaco, il numero di biopsie disponibili in uno studio è di solitopiuttosto limitato 10,11. In alternativa, i campioni di sangue periferico sono altamente preziosi per gli studi clinici perché comportano una procedura minimamente invasiva, sono rapidi e facili da ottenere facilitando l'analisi longitudinale, sono meno costosi delle biopsie e forniscono ampie informazioni per il monitoraggio in tempo reale dell'esito di un trattamento. Un ulteriore vantaggio nella valutazione dei biomarcatori PD nel sangue periferico è la capacità di utilizzare il biocampione per quantificare anche la chiave di piattaforma consentendo l'esattezza nella determinazione delle relazioni quantitative PK / PD e la successiva modellazione PK / PD12,13. Le cellule mononucleari del sangue periferico (PBPC) del sangue intero possono essere isolate per studiare marcatori proteici, che sperimentano cambiamenti nel loro livello di espressione o nelle loro modifiche post-tras traslizionali. Inoltre, i PBMM possono essere utilizzati per scopi di immunofenotipizzazione14,15, test di funzionalità immunitaria come la valutazione della citotossicità cellulare dipendente dagli anticorpi (ADCC)16 e l'analisi epigenetica attraverso l'isolamento dell'RNA. Allo stesso modo, il plasma di sangue intero può essere utilizzato per quantificare le citochine per caratterizzare la risposta immunologica di un paziente, per eseguire studi metabolici, e anche per isolare e sequenziare il DNA tumorale circolante (ctDNA) per monitorare l'evoluzione clonale della malattia sotto selezione dall'agente terapeutico, fornendo spesso una base meccanicistica per la resistenza altrattamento 17,18,19 consentendo lo sviluppo delle generazioni successive di terapie20. Infine, l'isolamento delle cellule tumorali circolanti (CTC) dal sangue periferico consente la valutazione della progressione della malattia mediante enumerazione longitudinale, sequenziamento dna/RNA e analisi proteina-biomarcatore21. Sebbene questo isolamento sia compatibile con il protocollo descritto nelpresente documento 22, la bassa abbondanza di CTC in molti tipi di cancro e nelle prime fasi della malattia rende l'uso di tubi specializzati più adatto per ridurre al minimo la degradazione del CTC23.
Negli ultimi anni, l'uso di biopsie liquide ha migliorato le informazioni ottenute negli studi clinici e le raccolte pbmc sono state incluse in molti studi per monitorare l'impegno target e la prova del meccanismo direttamente nelle cellule tumorali per alcuni tipi di neoplasie ematologiche, o sugli stessi PBMC come surrogati PD delle cellule tumorali24,25,26. La preparazione di campioni di alta qualità influisce positivamente sulla determinazione del trattamento più sicuro ed efficace per una determinata patologia ma, secondo la nostra esperienza, la qualità dei preparati PBMC ottenuti da diversi siti clinici è stata sottoposta a un'ampia variabilità di qualità con conseguente campioni non idonei allo scopo dell'analisi a valle. Ciò ha influito sulla quantità di dati PD che potrebbero essere raccolti da tali studi.
Qui descriviamo in dettaglio un protocollo facile da seguire che mostra come isolare in modo efficiente sia i PBBC che i campioni di plasma da un singolo disegno sanguigno in un ambiente clinico. Il protocollo si basa sulle istruzioni fornite dal produttore dei tubi di preparazione delle cellule mononucleari, che incorporano modifiche in cui l'esperienza reale ha evidenziato difficoltà nell'esecuzione del protocollo come riportato da siti clinici, come problemi di centrifugazione, ritardi di elaborazione e trasferimento del campione ai crioviali. Esistono metodi alternativi disponibili in commercio all'uso di tubi di preparazione delle cellule mononucleari basati sulla separazione del gradiente di densità utilizzando soluzioni di polisaccaride con o senza una barriera che separa lasoluzione dal sangue 27. Se il sito clinico pertinente è già ben esperto in queste metodologie alternative, questo protocollo può essere accettato con queste. In questi casi, si possono considerare due fattori: alcuni metodi alternativi richiedono un trasferimento di sangue intero da un tubo di raccolta a un tubo di preparazione separato in cui un ulteriore trasferimento di materiale biologico primario umano può presentare un rischio di sicurezza leggermente aumentato e il successo di metodi senza barriere che separano il sangue dalla soluzione di polisaccaride si basa su passaggi critici come la stratificazione del campione di sangue sul mezzo gradiente di densità che richiede lo sviluppo di un raffinato livello di competenza tecnica non sempre presente in un ambiente di laboratorio ospedaliero. Nonostante questi punti, la redditività complessiva e il recupero cellulare sono comparabili tra questetecniche 15,28. La scelta della metodologia dipende quindi in qualche modo da una precedente esperienza tecnica, ma nelle nostre mani i tubi di preparazione delle cellule mononucleari possono essere utilizzati con successo in un ampio contesto clinico e sono la nostra raccomandazione, altrimenti.
Mentre un endpoint di questo protocollo è quello di produrre pellet PBMC per un'ulteriore lavorazione in lisati, potrebbero essere implementate altre applicazioni finali della raccolta PBMC, come l'isolamento degli acidi nucleici o la produzione di strisci PBMC o blocchi PBMC adatti ai metodi di immunoistochimica (IHC). È importante sottolineare che, poiché ogni biocampione prelevato dai pazienti rappresenta una procedura invasiva almeno a un certo livello, questo protocollo massimizza il materiale utile di ogni campione isolando anche il plasma che può essere utilizzato per analisi citochine, studi metabolomici o sequenziamento ctDNA.
L'analisi dei biomarcatori periferici negli studi di oncologia è una delle tante applicazioni dei llysati PBMC. Un esempio è la valutazione della risposta al danno al DNA (DDR) in trattamenti come la chemioterapia, la radioterapia o l'uso di inibitori di enzimi coinvolti nel DDR come le chinasi fosfatidilinositolo-3 chinasi (PIKKs)7 e PARP3,13. Lo scopo di questi trattamenti è aumentare i danni al DNA nelle cellule proliferato, che generano un'elevata tossicità nelle cellule con meccanismi DDR compromessi e checkpoint del ciclo cellulare, come le cellule tumorali. Qui presentiamo un esempio con uno studio sui biomarcatori DDR nel sangue periferico sottoposto a raggi X.
Protocollo
Il consenso informato del paziente e la piena conformità ai pertinenti requisiti etici nazionali in ogni giurisdizione, ad esempio l'Human Tissues Act (HTA – Regno Unito, 2004) e il Health Insurance Portability and Accountability Act (HIPAA – Stati Uniti, 1996) sono obbligatori. Assicurati di avere un'approvazione etica completamente documentata prima di iniziare qualsiasi lavoro su materiali derivati dall'uomo. Il sangue utilizzato nell'ottimizzazione di questo protocollo è stato fornito con il consenso appropriato del Volunteers Advancing Medicine Panel (VAMP) (riferimento etico 16/EE/0459, studio CRF494, sub study 001) gestito dal NIHR Cambridge Clinical Research Facility, Cambridge, Regno Unito, nell'ambito di un accordo di fornitura di campioni biologici umani con il National Institute for Health Research (NIHR) Cambridge Biomedical Research Centre. La Biobanca di AstraZeneca nel Regno Unito è autorizzata dalla Human Tissue Authority (Licenza n. 12109) e ha l'approvazione del National Research Ethics Service Committee (NREC) come Research Tissue Bank (RTB) (REC n. 17/NW/0207).
1. Orientamento generale alla preparazione
NOTA: Tutti i lavori con materiale umano non con prefisso come il sangue, il plasma e i PBBC in questo protocollo devono funzionare nell'ipotesi che questi materiali possano trasportare agenti potenzialmente infettivi e quindi devono essere eseguiti con adeguate precauzioni di biosicurezza. Per i pazienti che sono stati testati come negativi per agenti patogeni noti, non presumere che i campioni non siano infettivi e quindi devono ancora essere applicate adeguate precauzioni di sicurezza. I prodotti di scarto generati da questi materiali devono essere trattati con le stesse precauzioni di biosicurezza e smaltiti secondo le norme locali.
- Scegli tra i due tipi di tubi di preparazione delle cellule mononucleari che utilizzano citrato di sodio o eparina di sodio come anticoagulanti. Per molte applicazioni a valle questi due anticoagulanti possono essere utilizzati in modo intercambiabile, ma entrambi gli antico coagulanti devono essere testati prima di selezionarne uno per lo studio.
- Etichettare un tubo di preparazione a cellule mononucleari da utilizzare per la raccolta del sangue con l'ID codificato del paziente. Mantenere i tubi a temperatura ambiente (18-25 °C).
- Conservare 1x PBS a temperatura ambiente (18-25 °C). Utilizzare 30 mL per preparazione.
- Assicurarsi che i tubi per campioni di plasma separati e il criooviale per il campione PBMC siano accuratamente etichettati con identificatori univoci, come specificato nella sezione appropriata del manuale di laboratorio.
- Se i PBBC devono essere utilizzati per monitorare le proteine fosforilate, preparare pbs integrato con inibitori della fosfatasi: mescolare 5 mL di PBS con 50 μL di cocktail inibitore della fosfatasi 2 + 50 μL di cocktail inibitore della fosfatasi 3. Preparare fresco e tenere sul ghiaccio fino all'uso.
- Se i PBBC devono essere crioconservati, preparare 1 miscela di congelamento mL per campione mescolando 90% FBS + 10% DMSO.
2. Raccolta PBMC (Figura 1A)
- Estraere 8 ml di sangue nel tubo di preparazione delle cellule mononucleari utilizzando la tecnica standard descritta dal produttore. Invertire delicatamente il tubo da 8 a 10 volte per mescolare l'additivo anticoagulante con il sangue. Non agitare per evitare l'emolisi. Registrare il momento in cui il sangue è stato prelevato.
- Dopo il ritiro, conservare il tubo in posizione verticale a temperatura ambiente fino alla centrifugazione. Elaborare i campioni il prima possibile, idealmente entro un'ora da questa raccolta del sangue ma non oltre 4 ore di post raccolta. Registrare i tempi all'inizio dell'elaborazione del sangue.
- Immediatamente prima della centrifugazione remixare il campione di sangue invertendo delicatamente il tubo da 8 a 10 volte in più.
- Centrifugare i tubi del campione tubo/sangue in un rotore orizzontale (testa oscillante) a 1.500 - 1.800 x g per 30 minuti a temperatura ambiente (18-25 °C). Assicurarsi che tutti i tubi siano bilanciati correttamente.
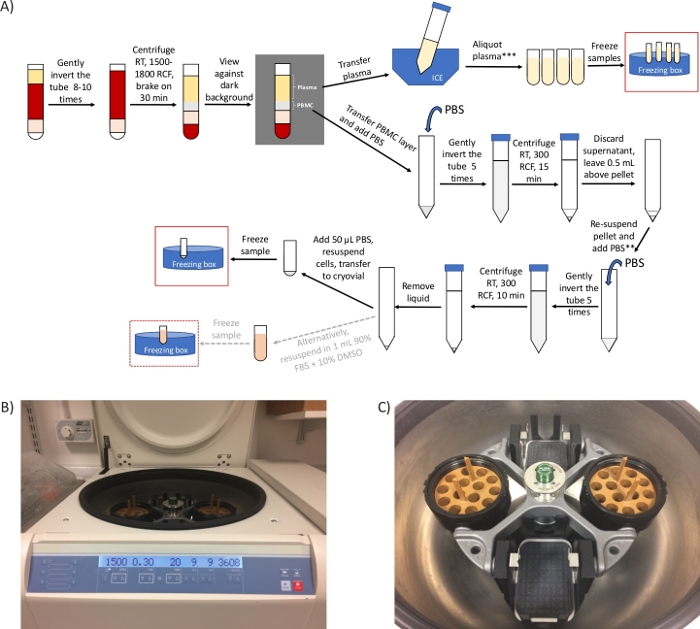
Figura 1: Panoramica generale del protocollo e immagini rappresentative della centrifuga. (A) Panoramica schematica del protocollo per la preparazione dei PBBC e del plasma. *Se ci sono vincoli di tempo, il passaggio 2.4 può essere ridotto a 20 minuti e i passaggi da 3.3 a 3.6 possono essere rimossi. ** Prendere un'aliquota per contare le celle, se necessario. 2 passaggi di centrifugazione supplementari necessari per l'analisi ctDNA/metabolomica (B) immagine di una centrifuga del rotore a testa oscillante impostata per il passaggio 2.4. (C) Immagine del rotore, che comprende due benne contenenti gli adattatori per ruotare tubi di preparazione delle celle mononucleari. Clicca qui per visualizzare una versione più grande di questa figura.
NOTA: x g (indicato anche come RCF, unità centrifughe relative) e RPM (giri al minuto) sono unità diverse. Assicurarsi di impostare la centrifuga per x g (RCF). Utilizzare il calcolatore online (vedere Tabella dei materiali) per la conversione. Se è disponibile solo un rotore ad angolo fisso, eseguire questo passaggio per 10 minuti a 1.500 - 1.800 x g.
- Dopo la centrifugazione, verificare la presenza di uno strato rosso scuro sotto la barriera (contenente principalmente globuli rossi) e 2 strati sopra la barriera. Lo strato superiore è il plasma (color paglierino) e lo strato biancastro sottostante è il mantello buffy contenente i PBPC. Questi strati possono essere facilmente distinti quando si visualizza il tubo su uno sfondo scuro / nero.
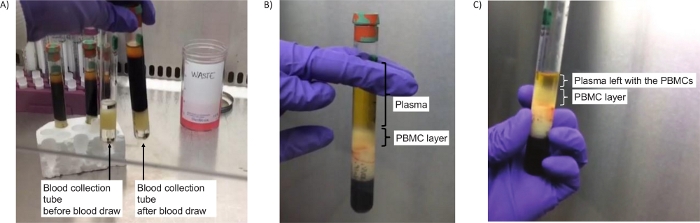
Figura 2: Tubi per isolare i PBBC. (A) Immagine dei tubi prima della centrifugazione (fase 2.4), vuota (sinistra) o contenente sangue (destra). (B) Separazione riuscita dello strato PBMC dopo la centrifugazione (fase 2.5). (C) Immagine dello strato PBMC dopo la centrifugazione e un po ' di plasma lasciato per garantire la raccolta di tutti i PBMC (passaggio 2.7). Clicca qui per visualizzare una versione più grande di questa figura.
NOTA: Se questi livelli non sono visibili, questo probabilmente indica un errore nella configurazione delle unità di centrifugazione. Assicurarsi che l'adattatore di centrifuga giusto sia utilizzato e che sia impostata la "x g" corretta. Ripetere il passaggio 2.4.
- Immediatamente dopo la centrifugazione, utilizzare una pipetta sierologica per trasferire circa la metà del plasma in un tubo di centrifuga conico di dimensioni di 15 ml etichettato con tappo, facendo attenzione a non disturbare lo strato PBMC (circa 4-5 mL). Conservare temporaneamente questo tubo con plasma su ghiaccio umido da utilizzare più avanti nel passaggio 4. Accantonati per ora.
- Raccogliere l'intero strato PBMC con una pipetta Pasteur posizionando la pipetta all'interno dello strato di celle e trasferirlo in un diverso tubo di centrifuga conica di dimensioni 15 mL con tappo. È accettabile anche prendere una piccola quantità di plasma, se necessario, per ottenere completamente tutto lo strato PBMC. Il volume è solitamente di 1-2 mL. Continuare immediatamente con il passaggio 3 sottostante.
3. Fasi di lavaggio PBMC
NOTA: Lo scopo delle fasi di lavaggio è quello di diluire e rimuovere piastrine residue e plasma dal pellet PBMC. Tutti i passaggi di centrifugazione devono essere eseguiti a temperatura ambiente (18-25 °C).
- Aggiungere pbs a temperatura ambiente al tubo PBMC per portare il volume a 15 mL. Capovolta il tubo. Mescolare le cellule invertendo delicatamente il tubo 5 volte.
- Centrifuga per 15 min a 300 x g. Si noti che questa è una centrifugazione molto più delicata rispetto alla centrifugazione iniziale.
- Visualizzare il pellet visualizzando il tubo su uno sfondo scuro/nero. Rimuovere il supernatante per aspirazione sottovuoto o con una pipetta (Figura 3A). Scartare il supernatante lasciando un volume di circa 500 μL sopra il pellet PBMC di colore biancastro.
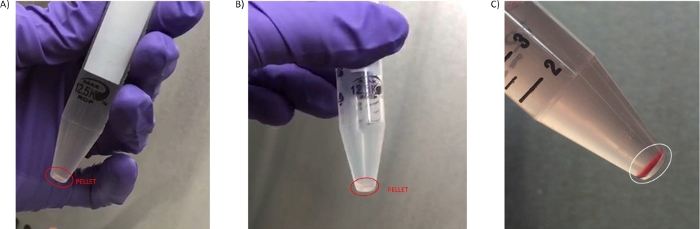
Figura 3: Pellet PBMC. (A) Pellet ottenuto nella prima fase di lavaggio 3.3. (B) Pellet isolato nel secondo lavaggio (fase 3.7). (C) Pellet ad alto livello di emolisi ottenuto dal sangue trattato più tardi di 4 ore dal sangue isolato nel secondo lavaggio (fase 3.6). Clicca qui per visualizzare una versione più grande di questa figura.
- Rimescolare il pellet cellulare tubazione delicatamente su e giù nel supernatante residuo.
- Aggiungere 1x PBS aggiuntivo per portare il volume a 10 mL. Capovolta il tubo. Mescolare le celle invertendo delicatamente il tubo 5x. Se il conteggio delle celle è richiesto nel protocollo di studio, passare al passaggio 3.5.1, se non è necessario passare direttamente al passaggio 3.6.
- Prendere un'aliquota di 40 μL delle cellule ri-sospese e mescolare con 40 μL di tripano blu. Contare le cellule vitali usando un emocitometro o un contatore automatico delle cellule.
- Centrifugare la sospensione dal passo 3.5 per 10 min a 300 x g. Rimuovere il più supernatante possibile senza disturbare il pellet cellulare.
- Rimuovere e scartare con cura qualsiasi supernatante rimanente sopra il pellet di cella pipettando utilizzando una pipetta Pasteur a punta fine o una micropipetta senza disturbare il pellet cellulare. Lasciare poco o nessun liquido sopra il pellet dopo aver completato questo passaggio. Se l'endpoint di questo protocollo è un passaggio del pellet PBMC al passaggio 3.8; se l'endpoint è PBBC crioconservato, passare al passaggio 3.10.
- Aggiungere 50 μL di nuovo PBS (o il PBS integrato preparato al passaggio 1.5 se applicabile al punto finale) al pellet e alla pipetta su e giù delicatamente utilizzando un micropipette per rimospendare omogeneamente tutte le cellule. Trasferire l'intera sospensione cellulare su un crioviale etichettato da 1,5 mL e posizionarlo immediatamente sul ghiaccio bagnato fino a congelare i campioni.
- Congelare i campioni etichettati posizionandoli in azoto liquido o direttamente nel ghiaccio secco. Le cellule possono anche essere congelate a -80 °C congelatore utilizzando scatole di congelamento cellulare. In questo caso, prechill le scatole completamente in -80 °C prima di aggiungere i tubi cellulari. Registrare il momento in cui i pellet cellulari sono stati congelati. Una volta che le cellule si congelano, conservare a -80 °C, spedire congelate sul ghiaccio secco.
- Facoltativamente, per crioconservare i PBPC sospendere di nuovo il pellet in 1 mL della miscela di congelamento (fase 1.6) e trasferirlo in un crioviale etichettato. Continuare come descritto al passaggio 3.9, ma, in questo caso, è accettabile utilizzare solo scatole di congelamento delle celle per congelare i campioni. Trasferimento all'azoto liquido per la spedizione e lo stoccaggio dopo essere stato nella scatola di congelamento per un minimo di 24 ore.
4. Fasi di preparazione al plasma(figura 1A)
- Dopo lo stoccaggio a -80 °C dei pellet PBMC, preparare ora l'aliquota plasmatica che è stata temporaneamente immagazzinata sul ghiaccio umido nel passaggio 2.6. Eseguire i seguenti passaggi di centrifugazione per chiarire il plasma se lo scopo del campione è l'analisi ctDNA, altrimenti spostarsi direttamente al passaggio 4.2.
- Centrifugare il plasma per 10 min a 1.600 - 2.000 x g a 4 - 8 °C in un rotore ad angolo fisso (o 15 minuti in un rotore oscillante).
- Pipettare con cura il supernatante al plasma, facendo attenzione a non disturbare alcun pellet e trasferito in un nuovo tubo da 15 ml. Scartare il tubo contenente il materiale pelletato.
- Centrifugare il plasma per 10 min a 1.600 - 2.000 x g a 4 - 8 °C in un rotore ad angolo fisso (o 15 minuti in un rotore oscillante).
- Trasferire con cura il supernatante al plasma su un nuovo tubo da 15 ml, assicurandosi di non disturbare alcun materiale pelletato. Scartare il tubo contenente il materiale pelletato.
NOTA: Se non è disponibile una centrifuga refrigerata, tenere le celle sul ghiaccio per 5 minuti tra ogni giro o centrifugare i campioni in una cella frigorifera.
- Trasferire plasma in aliquote da 1 mL in 5 microtubi freschi da 2 mL. Utilizzare meno di 5 flaconcini se non c'è abbastanza plasma per riempire 5 flaconcini con aliquote da 1 mL e si prevede che l'ultima fiala conterrà meno di 1 mL plasma. Se c'è più di 5 mL plasma, scartare il resto. Registrare il volume totale di plasma in ogni tubo.
- Congelare immediatamente le aliquote del plasma in posizione verticale, conservandole a -80 °C.
5. Spedizione campiona
- Spedire sia pellet PBMC che campioni di plasma su ghiaccio secco.
- Assicurarsi che il campione non sia scongelato prima e durante la spedizione. Imballare ghiaccio secco sufficiente con i campioni per assicurarsi che rimangano congelati per l'intero processo di spedizione, considerando eventuali ritardi che possono verificarsi durante il transito.
6. Irradiazione del sangue intero e analisi western dei biomarcatori DDR(figura 4A)
NOTA: Questo è un trattamento ex vivo che non sarà richiesto nella maggior parte dei casi in clinica, ma questi esperimenti sono una preziosa strategia esplorativa per trovare biomarcatori clinici adatti. I campioni di sangue devono essere trattati il prima possibile al momento della raccolta per garantire i migliori risultati.
- Riscalda l'armadio a raggi X. Etichettare tre tubi da 15 ml rispettivamente come 0, 0,2 e 7 Gy.
- Prendere tre tubi di preparazione delle cellule mononucleari contenenti sangue appena prelevato da un singolo individuo e dopo aver invertito delicatamente i tubi da 8 a 10 volte trasferire il sangue ai tre tubi da 15 ml.
- Posizionare il tubo 0.2 Gy nell'armadio a raggi X, chiudere la porta e applicare la dose di 0,2 Gy sul tubo selezionando il numero di scaffale e la dose. Applicare 7 dosi di radiazioni Gy sul tubo 7 Gy regolando la dose selezionata nell'armadio.
- Incubare i tre tubi a 37 °C per un'ora.
- Trasferire il sangue ai tubi di preparazione delle cellule mononucleari ed eseguire il protocollo di preparazione PBMC come per un ambiente clinico dal passaggio 2.4 al passaggio 3.8.
- Aggiungere un volume di tampone di lisi integrato con inibitori della proteasi e della fosfatasi pari al volume del pellet cellulare (in questo caso 70 μL di tampone RIPA) a ciascuno dei pellet cellulari, pipettare su e giù e incubare sul ghiaccio per 10 min. Sonicare i campioni se è disponibile un sonicatore (3 cicli, 30 s ON / 30 s OFF, 4 °C), in alternativa siringare i campioni per rompere gli acidi nucleici per eliminare la viscosità nel campione.
- Centrifugare i campioni per 10 min a ≥ 15.000 x g, a 4 °C. Trasferire ogni supernatante in un nuovo tubo da 1,5 ml, valutare qualitativamente il livello di emolisi (ispezione visiva) e misurare la concentrazione proteica con qualsiasi metodo preferito.
- Mescolare 40 μg di lisato totale con tampone di caricamento del campione contenente SDS e agente riducente del campione. Far bollire i campioni per 5 minuti in un blocco di calore.
- Caricare 20 μg di ogni campione per corsia in duplicato in un gel proteico bis-tris 4-12% ed eseguire un SDS-PAGE.
- Dopo la separazione, trasferire le proteine su una membrana di nitrocellulosa utilizzando un sistema disponibile in commercio (20 V, 10 min) e bloccare con il 5 % di latte in TBST.
- Tagliare la membrana alle dimensioni molecolari pertinenti e incubare con gli anticorpi primari durante la notte a 4 °C (vedi Tabella dei materiali per anticorpi e diluizioni).
- Rimuovere gli anticorpi primari e lavare le membrane 3 volte con TBST per 5 minuti a temperatura ambiente. Incubare con gli anticorpi secondari coniugati con HRP per 45 minuti a temperatura ambiente.
- Lavare 3 volte con TBST per 5 minuti.
- Applicare il reagente ECL e analizzare le immagini ottenute rispetto al segnale HRP.
Risultati
Per migliorare la qualità dei preparati PBMC nei nostri studi clinici, abbiamo generato un protocollo con passaggi concisi e chiari che possono essere seguiti da professionisti del laboratorio ospedaliero, indipendentemente dal loro background di biologia molecolare e dalle competenze di laboratorio. Abbiamo adattato il protocollo del produttore incorporando modifiche su quei passaggi in cui i problemi di esecuzione sono stati identificati o segnalati da siti clinici coinvolti in vari studi clinici multi-centro. Tuttavia, il protocollo può essere ulteriormente ottimizzato per soddisfare requisiti specifici, ad esempio vincoli di tempo nel sito clinico o tipo di analisi downstream (vedere File aggiuntivo). Dimostriamo che il DDR può essere analizzato nei PBBC esaminando biomarcatori specifici sui danni al DNA generati dalle radiazioni.
Le query più comuni che abbiamo ricevuto dai siti clinici si riferiscono alle fasi di centrifugazione, che hanno un impatto diretto sulla possibilità di isolare con successo i PBMC e ottenere il pellet PBMC finale. L'utilizzo del tipo appropriato di centrifuga del rotore a testa oscillante(Figura 1B,C) è la chiave del successo del protocollo. Tuttavia, quando nel sito clinico è disponibile solo una centrifuga del rotore ad angolo fisso, si consiglia di eseguire il passaggio 2.4 in un rotore ad angolo fisso allo stesso RCF come per un rotore a testa oscillante ma per soli 10 minuti. Ciò garantisce che uno strato PBMC sia separato dal plasma (vedere figura 2B,C). Mentre la stratificazione del sangue su un mezzo di separazione del gradiente di densità richiede una centrifugazione frenante, il sangue nei tubi di preparazione delle cellule mononucleari può essere centrifugato con freni attivi a causa della presenza di una barriera al gel nel tubo che garantisce la conservazione dello strato PBMC separato dai componenti del sanguepiù densi 27,28.
Almeno 4 ml di plasma non diluito di alta qualità sono stati ottenuti dalla centrifugazione del sangue nel formato del tubo da 8 ml, che potrebbe essere ulteriormente chiarito per il suo utilizzo in analisi specializzate come il sequenziamento del ctDNA o gli studi di metabolomica29,30 (passaggi opzionali 4.1.1-4.1.4). La quantità di PBPC isolati, le dimensioni del pellet e l'emolisi o la contaminazione dei globuli rossi sono state altre preoccupazioni provenienti da siti clinici e hanno esperienza nell'analisi dei campioni. Il numero di cellule ottenute da 8 mL di sangue era variabile a seconda dell'impostazione del paziente e della malattia, ma in generale il pellet ottenuto è di piccole dimensioni e di una colorazione trasparente/bianca(figura 3A,B). A causa di queste caratteristiche, è importante visualizzare il pellet su uno sfondo scuro per evitare la sua aspirazione accidentale durante le fasi di lavaggio (2.5 e 3.3). A volte i pellet possono avere una colorazione rossa a causa della contaminazione dei globuli rossi (Figura 3C), e questo ha un effetto negativo sulla qualità della preparazione. Per evitare di perdere piccoli pellet come quelli mostrati nella figura 3, il trasferimento del pellet PBMC in un crioviale è facilitato dal passaggio 3.7 in cui il pellet PBMC viene rimorsi in 50 μL di PBS.
La resa tipica quando si utilizzano questi tubi e sangue da individui sani varia da 7 a 21 x 106 cellule per 8 ml e un recupero cellulare tra il 70 e l'80% in quanto è la nostra esperienza e come è stato precedentementemostrato 27,28. Ciò dipende sia dal conteggio delle singole cellule che dall'operatore ed è paragonabile ai numeri di cella e ai valori di recupero cellulare ottenuti con altri metodi utilizzando gradiente di densità (compresi i sistemi che utilizzano tubi con una barriera di separazione)15,27,28. Un esempio illustrativo della variazione del numero di PBMC isolati con questo metodo a seconda dell'impostazione della malattia è l'analisi dei marcatori PBMC nei pazienti con leucemia linfocitica cronica (CLL). Il numero di cellule recuperate da un tubo di preparazione a cellule mononucleari da 8 ml durante l'applicazione di questo protocollo variava da 1,62 x10 4 a 1,99 x10 9 in 45 campioni ottenuti da 7 pazienti nello studio NCT0332827331 (tabella 1). Un parametro correlato è la concentrazione proteica dei liti PBMC ottenuti con questo metodo, e questo dipende dal numero di cellule isolate e dall'efficienza dell'estrazione proteica. Le pastiglie cellulari lese nella sezione 6 sono state generate con tampone RIPA e sonicazione (fase 6.6). La resspensione del pellet cellulare nel loro stesso volume di tampone di lysis di solito si traduce in una gamma di concentrazioni da 3 a 10 mg/mL, e in questo particolare esempio le concentrazioni di lysato erano rispettivamente di 6,8, 8,3 e 8,6 mg/mL per 0, 0,2 e 7 Gy. Tuttavia, questo è sottoposto a un'elevata variabilità quando si ricevono campioni da siti clinici che non sono stati preparati in modo ottimale, la malattia del paziente e la presenza di emoglobina dalla contaminazione dei globuli rossi. Ad esempio, è necessario riutilizzare pellet molto piccoli in un volume di tampone di lysis maggiore del volume del pellet cellulare per consentire sia la misurazione della concentrazione proteica che l'analisi del biomarcatore a valle, con conseguente aumento dei campioni diluiti. In tal caso, se una concentrazione del campione è inferiore a 1 mg/mL, ciò può rappresentare una sfida per eseguire saggi come western blot a causa di questo alto fattore di diluizione. Per contro, nei campioni di CLL precedentemente menzionati, il volume del tampone di lysis aggiunto per rimescolare il pellet cellulare variava da 50 a 500 μL e la concentrazione proteica variava da 1,62 a 19,77 mg/mL(tabella 1).
Quando i campioni presentano contaminazione o emolisi dei globuli rossi (Figura 3C), la concentrazione proteica del lisato PBMC viene sopravvalutata a causa dell'inclusione dell'emoglobina dagli etrociti. Questo è il motivo per cui si dovrebbe fare un'ispezione visiva e un'annotazione di tali campioni, come descritto nel passaggio 6.7 del protocollo. Il caricamento del campione in eccesso può compensare la presenza di emoglobina quando si esegue l'analisi del biomarcatore nella misura in cui un controllo di carico è incluso nel saggio. Potrebbero essere implementati altri metodi più quantitativi per misurare l'emolisi, come la misurazione dell'assorbanza a 414 nm32.
Il DDR è stato analizzato in PBPC ottenuti a seguito di questo protocollo clinico. Per illustrare una situazione che imita trattamenti clinici dannosi per il DNA come la radioterapia o la chemioterapia, il sangue intero proveniente da volontari sani è stato sottoposto ex vivo a radiazioni a raggi X (Figura 4A). Le radiazioni ionizzanti (IR) come i raggi X inducono diversi tipi di danni al DNA, tra cui le rotture a doppio filamento del DNA (DSB). Il rilevamento del danno del DNA di queste lesioni attiva I PIKK come l'atassia-telangiectasia mutata (ATM), atm e rad3-related (ATR) e dna-dependent protein chinasi (DNA-PK), che innestano meccanismi di riparazione del DNA come la ricombinazione omologa (HR) o l'unione finale non omologa (NHEJ). L'attivazione del bancomat da parte della presenza di DSB avviene mediante il suo reclutamento in siti di danni da parte del complesso MRN (MRE11-RAD50-NBS1), causando autofosforilazione atm a diversi residui tra cui Ser1981. A sua volta, atm attivato fosforilati i componenti del complesso MRN e altre proteine come la variante istonica H2AX su Ser139 (dove pSer139-H2AX è anche noto come γH2AX) per promuovere un cambiamento strutturale nella cromatina che si estende dal DSB che facilita il reclutamento di altri fattori DDR33. I PBPC sono reattivi alle radiazioni ionizzanti nonostante il loro basso tasso di proliferazione e i metodi di spettrometria di massa hanno permesso la quantificazione dell'upregolazione del Ser635 fosforilato su RAD50 da parte del bancomat. Questa fosforilazione è ridotta in presenza di inibitori atm e RAD50 pS635 è stato ulteriormente convalidato come biomarcatore farmacodinamico per trattamenti clinici inibitori del bancomat nei tumori mediante immunoistochimica8. Per valutare la risposta dei PBPC alle radiazioni, il sangue proveniente da volontari sani è stato sottoposto a diverse dosi ir e sono stati raccolti campioni dopo un'incubazione di 1 h a 37 °C(figura 4A). A tal fine, i sangue sono stati trasferiti in tubi di plastica per evitare di ridurre la resa dell'isolamento PBMC a causa dell'alta temperatura (fase 6.2). Abbiamo analizzato come atm è stato attivato non solo guardando il RAD50 pS635 precedentemente segnalato, ma anche ATM pS1981 e γH2AX. Nei tre casi esaminati è stato osservato un aumento di queste modifiche post-tras traslazione a dosi IR più elevate (figura 4B). È interessante notare che la fosforilazione di ATM e RAD50 è stata sostanziale alla bassa dose di 0,2 Gy, il che suggerisce che queste modifiche post-traslazionali possono essere interrogate come biomarcatori PD per trattamenti che coinvolgono la generazione di DSB del DNA con un buon intervallo dinamico, non solo nei campioni di tumore ma nel sangue periferico. Ciò consente il monitoraggio della risposta PD al trattamento acquisendo campioni longitudinali attraverso il corso del trattamento. La tempistica dal disegno sanguigno all'elaborazione dei campioni è fondamentale per garantire che queste cascate di segnalazione siano ancora attive poiché i ritardi nell'elaborazione avranno un impatto sulla cinetica di tali cascate e si potrebbero perdere gli eventi di fosforilazione utilizzati come fosfomarcatori.
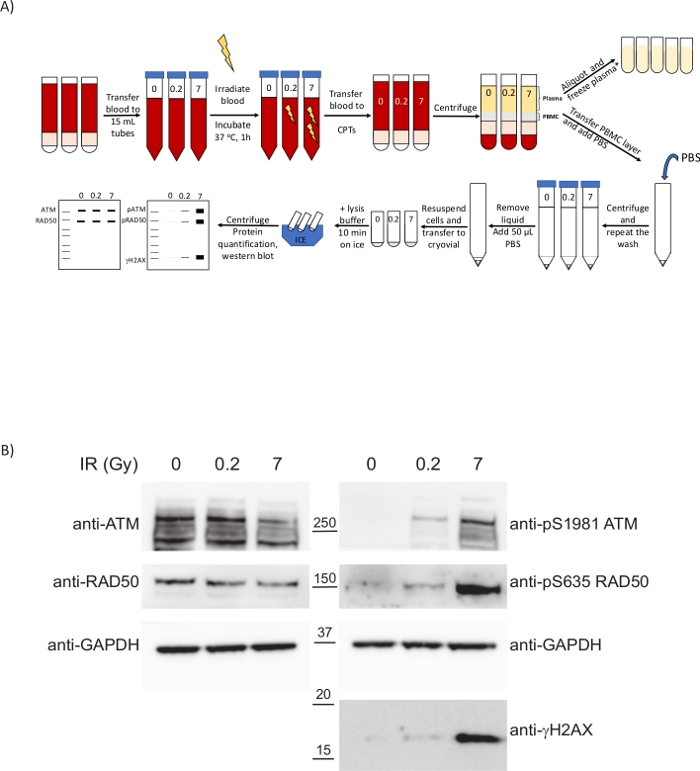
Figura 4: I PBPC isolati dal sangue irradiato ex vivo a seguito del presente protocollo clinico mostrano biomarcatori per informare sull'entità del danno al DNA causato dal trattamento. (A) Panoramica schematica del protocollo per la preparazione dei PBPC e l'analisi del DDR in caso di irradiazione del sangue intero. *2 passaggi di centrifugazione aggiuntivi necessari per l'analisi ctDNA/metabolomica. (B) Western blot che mostra l'upregolazione dose-dipendente dei fosfo-biomarcatori DDR nei PBPC. Fare clic qui per visualizzare una versione più ampia di questa cifra.
| Campione | Numero di PBPC/ 8 mL di sangue | Volume tampone RIPA integrato (μL) | Concentrazione finale (mg/mL) |
| A.1 | 39100000 | 70 | 12.16 |
| A.2 | 97400000 | 100 | 4.54 |
| A.3 | 233000000 | 150 | 7.63 |
| A.4 | 316000000 | 150 | 16.87 |
| A.5 A.5 | 387000000 | 150 | 12.60 |
| A.6 A.6 | 459000000 | 150 | 12.71 |
| A.7 A.7 | 414000000 | 200 | 15.67 |
| A.8 | 253000000 | 150 | 14.56 |
| A.9 A.9 | 509000000 | 300 | 10.67 |
| B.1 B.1 | 15200000 | 70 | 2.96 |
| B.2 B.2 | 10500000 | 50 | 4.59 |
| B.3 B.3 | 13200000 | 50 | 3.99 |
| B.4 B.4 | 34800000 | 100 | 10.41 |
| B.5 B.5 | 1620000 | 70 | 7.11 |
| B.6 B.6 | 70200000 | 100 | 9.26 |
| B.7 B.7 | 65400000 | 100 | 12.10 |
| B.8 B.8 | 91100000 | 150 | 11.82 |
| C.1 | 6330000 | 70 | 4.04 |
| C.2 | 4400000 | 150 | 19.77 |
| C.3 | 68000000 | 100 | 8.96 |
| C.4 | 35100000 | 50 | 9.30 |
| C.5 | 35400000 | 70 | 10.55 |
| C.6 | 99200000 | 100 | 16.19 |
| D.1 | 402000000 | 70 | 7.23 |
| D.2 | 826000000 | 300 | 16.95 |
| D.3 | 1990000000 | 300 | 14.87 |
| D.4 | 1000000000 | 300 | 18.34 |
| D.5 | 1160000000 | 400 | 16.13 |
| D.6 | 806000000 | 400 | 19.40 |
| E.1 | 302000000 | 300 | 13.86 |
| E.2 | 990000000 | 500 | 19.04 |
| E.3 | 1200000000 | 400 | 17.13 |
| F.1 | 4010000 | 50 | 1.62 |
| F.2 | 5170000 | 50 | 2.84 |
| F.3 | 2810000 | 50 | 3.69 |
| F.4 | 3700000 | 75 | 3.62 |
| F.5 | 3460000 | 70 | 4.03 |
| F.6 | 7060000 | 50 | 3.32 |
| G.1 | 60700000 | 70 | 6.57 |
| G.2 | 82100000 | 150 | 7.78 |
| G.3 | 30500000 | 70 | 8.28 |
| G.4 | 134000000 | 100 | 15.14 |
| G.5 | 91900000 | 100 | 8.61 |
| G.6 | 372000000 | 150 | 15.88 |
| G.7 | 574000000 | 200 | 15.01 |
| Campioni longitudinali di PBMC corrispondenti a 7 pazienti | |||
Tabella 1: Numero di cellule e concentrazione proteica di pellet PBMC da pazienti cronici affetti da leucemia linfocitica (CLL). I dati presentati in questa tabella corrispondono a 45 campioni di PBMC di 7 pazienti affetti da CLL che partecipano allo studio NCT03328273 raccolti in tubi di preparazione di cellule mononucleari. Si tratta di dati originali generati utilizzando campioni dello studio citato31.
File supplementare: Opzioni di protocollo alternative. Clicca qui per scaricare questo file.
Discussione
I preparati di alta qualità di PBBC e plasma che possono essere preparati in modo robusto e riproducibile nei siti di sperimentazione clinica sono preziosi per informare gli endpoint biomarcatori trascizionali predittivi e farmacodinamici periferici degli studi clinici. Qui abbiamo fornito un protocollo breve e chiaro che affronta i passaggi tipicamente problematici che sono stati finora vulnerabili agli errori di esecuzione in un ambiente di sperimentazione clinica. Tuttavia, il protocollo può essere ulteriormente ottimizzato per soddisfare requisiti specifici, ad esempio vincoli di tempo nel sito clinico o tipo di analisi downstream (vedere File aggiuntivo).
A tal fine, abbiamo dimostrato come isolare sia i PBMC che il plasma dal sangue intero utilizzando tubi di preparazione delle cellule mononucleari per produrre pellet PBMC congelati e plasma congelato adatti a una varietà di analisi a valle. Abbiamo richiamato l'attenzione su passaggi di protocollo particolarmente critici che coinvolgono la centrifugazione e l'identificazione dello strato PBMC nel passaggio 2.5 e pellet PBMC nei passaggi 3.3 e 3.6. Storicamente, dove i siti clinici sono spesso andati male è nell'impostare la centrifuga sulle unità corrette (confondendo un valore RCF o x g con un valore RPM), ritardando il trattamento dei campioni di sangue, la temperatura e la presenza di grandi volumi di PBS sopra il pellet di cellule congelate. Nella maggior parte dei rotori di centrifuga che entrano erroneamente in un valore x g come impostazione RPM si tradurrà in una significativa sotto-centrifugazione con uno strato PBMC poco definito o assente risultante e potenziale scartamento PBMC involontario durante le fasi di lavaggio a causa di una pellettizzazione cellulare inefficiente. Tuttavia, c'è la possibilità che uno strato PBMC non sia visibile nonostante utilizzi le giuste impostazioni di centrifugazione e adattatore del rotore se il paziente ha sviluppato leucopenia. Questa condizione può influenzare i pazienti arruolati in studi oncologici a causa della chemioterapia o della radioterapia e deve essere presa in considerazione. Un altro punto critico che è stato chiarito nel protocollo è che i campioni devono essere elaborati entro 1-2 ore dal disegno di sangue per ridurre la possibilità di emolisi che influisce negativamente sul protocollo. Inoltre, l'obiettivo di elaborare i campioni durante la prima ora del sangue riduce la variabilità ex vivo, che può avere un grande impatto nelle letture farmacocinetiche e sui biomarcatori interessati dalla conservazione del sangue o dalle vie di segnalazione attive, come nel caso mostrato nella figura 4. I ritardi nell'elaborazione dei campioni possono anche avere un effetto dannoso sulla vitalità cellulare se le cellule devono essere crioconservate34. Un altro fattore che può influenzare sia la resa che la contaminazione dei globuli rossi è la temperatura di conservazione e centrifugazione, che deve essere mantenuta a temperatura ambiente (18-25 °C). Temperature più basse aumentano la densità del mezzo gradiente di densità, il che si traduce in un più alto grado di contaminazione dei globuli rossi e dei granulociti in quanto anche queste cellule non si aggregano. D'altra parte, temperature più elevate portano a PBBC intrappolati tra gli eriociti aggregati, riducendo così laresa del preparato 15,27,28. Infine, è fondamentale che non siano presenti più di 50-100 μL di liquido con il pellet cellulare nel crioviale, in quanto ciò influisce negativamente sulla concentrazione di tutti i lisati proteici ottenuti nella lavorazione a valle di questi preparati PBMC. Un eccesso di liquido diluirà esente da campioni, portando a lisati con una concentrazione proteica molto bassa non adatta per l'analisi del biomarcatore. Inoltre, la conservazione di eventuali modifiche post-tras traslizionali sarà compromessa e anche l'efficienza della lisi sarà notevolmente ridotta.
I tubi di preparazione delle cellule mononucleari sono stati scelti in quanto offrono il modo più semplice per isolare sia i PBBC che il plasma in un'unica estrapolazione per studi clinici con, secondo la nostra esperienza, un'eccellente riproducibilità. L'elaborazione del sangue non richiede operatori altamente addestrati e l'uso di un singolo tubo elimina la necessità di diluire il sangue e il suo trasferimento in un tubo diverso, abbassando il rischio di pericolo; accorcia il protocollo a causa dell'esecuzione dei passaggi di centrifugazione con freni ad alta; e tutti i reagenti sono nel tubo, il che riduce la variabilità. Nella nostra esperienza, questi benefici superano il costo più elevato di questi tubi rispetto ad altri metodi classici che comprendono solo l'uso di un mezzo di separazione del gradiente di densità27,28 (£ 410 per 60 unità mentre il mezzo linfoprep per 66 preparati da 50 ml è di £ 215). Sono disponibili in due tipi di anticoagulanti, eparina e citrato, entrambi comparabili al mantenimento della funzionalità dei PBPCisolati 35, pertanto, la scelta di un anticoagulante rispetto all'altro si baserà su una possibile influenza dell'eparina o del citrato negli studi sui biomarcatori a valle. Sebbene sia stato dimostrato che i tubi EDTA forniscono la più alta resa di isolamento PBMC rispetto all'eparina o al citrato13, il vantaggio della facilità d'uso del controbilanciamento della manipolazione a un tubo. Se le citochine devono essere analizzate, gli antico coagulanti possono avere un effetto dei livelli rilevati nel plasma, quindi entrambi gli anticoagulanti devono essere testati prima di selezionarne uno per lo studioclinico 36. Se il plasma sta per essere utilizzato per studi di metabolomica, l'uso dell'eparina come anticoagulante sarebbe preferito37. Pertanto, l'unico punto lasciato all'utente finale o allo scienziato traslatore della sperimentazione clinica è se il citrato o l'eparina saranno più appropriati per i loro scopi una volta valutati i costi.
Mentre i benefici dell'uso di tubi di preparazione cellulare sono numerosi rispetto alle limitazioni che pongono (costo più elevato e disponibilità di una gamma limitata di anticoagulanti), la principale limitazione dell'uso di PBBC o plasma per ottenere biomarcatori PD negli studi clinici, specialmente in oncologia, può non essere correlata al metodo di isolamento. Ad eccezione dei tumori ematologici, dove il tumore viene campionato direttamente dal sangue periferico, per altre indicazioni tumorali plasma e PBPC sono tessuti surrogati che non imitano necessariamente il tumore primario. Il tessuto periferico potrebbe non condividere il genoma e l'epigenoma con il tumore primario, quindi, l'analisi periferica dei biomarcatori dipendenti da una specifica mutazione tumorale è principalmente limitata all'analisi ctDNA (dal plasma) o ai CTC (mediante successivo smistamento dello strato PBMC). Inoltre, segnalare le cascate che guidano o contribuiscono alla proliferazione tumorale potrebbe non essere così attivo nel sangue periferico. Questa sfida può essere superata applicando approcci di scoperta di biomarcatori miratial sangue 8 per identificare biomarcatori alternativi o associare trattamenti ex vivo all'isolamento dei preparati al plasma38 e PBMC26.
Nell'attuale protocollo i pellet PBMC congelati possono essere facilmente lavorati fuori dal sito clinico per fornire lire proteiche che possono essere valutate con tecniche di soffiatura occidentale o ELISA. Sono stati inoltre presentati metodi alternativi per l'utilizzo dei PBPC per abilitare i metodi IHC (Supplementary File). Inoltre, abbiamo anche dettagliato la possibilità di crioconservare i PBBC (vedi File aggiuntivo) per il monitoraggio delle cellule immunitarie, un'applicazione rilevante in oncologia, con inibitori del checkpoint immunitario e ADC sempre più testati negli studi clinici. La valutazione delle funzioni immunitarie come l'ADCC16 e l'immunofenotipizzazione sono applicazioni compatibili con PBPC crioconservati isolati dai tubi di preparazione delle cellule mononucleari15. C'è un avvertimento sulla crioconservazione, in quanto può promuovere la down-regulation di alcuni marcatori superficiali e interni e potrebbe compromettere alcune funzioni cellulari, tuttavia la crioconservazione PBMC è l'unico modo fattibile per eseguire questi test a causa di vincoli di tempo quando si maneggiano campioni da più siti clinici all'elaborazione inlaboratori esterni 14,15, e questi effetti dannosi possono essere notevolmente superati con buoni metodi di scongelamento e periodi diriposo 39.
In conclusione, il protocollo qui fornito consentirà la preparazione affidabile di PBBC e campioni di plasma in qualsiasi istituto clinico con attrezzature e materiali comuni in modo che gli endpoint traslittivi dal sangue periferico possano essere solidamente abilitati negli studi clinici globali.
Infine, dimostriamo come l'analisi dei lisati PBMC possa informare meccanicamente la risposta agli agenti dannosi per il DNA mostrando una modifica post-traslatore dose-dipendente dei principali fattori DDR, che può essere utilizzata per contribuire a plasmare lo sviluppo clinico. L'implementazione lungimirante di metodi più quantitativi rispetto all'assorbimento occidentale (ad esempio, spettrometria di massa40) e che richiedono meno materiale di input (come il gonfiore occidentale capillare e l'ELISA) aiuterebbe a spostare questi risultati preclinici verso una valutazione più robusta e sistematica dei campioni di pazienti PBMC.
Divulgazioni
Tutti gli autori sono o erano dipendenti e azionisti di AstraZeneca. VM è un dipendente di Acerta Pharma, possiede azioni in AstraZeneca e Gilead Sciences.
Riconoscimenti
Vorremmo ringraziare tutti i membri di Translational Medicine presso AstraZeneca Oncology Research and Early Development per il loro feedback sul protocollo, in particolare Hedley Carr, Tammie Yeh e Nathan Standifer per consigli sulla preparazione al plasma per l'analisi ctDNA, sull'isolamento PBMC e sulla crioconservazione e immunofenotipizzazione PBMC, rispettivamente.
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5 mL cryovial | Nalgene, ThermoFisher | 5000-1020 | To store PBMC pellets and re-suspended PBMCs |
| 1.5 mL microcentrifuge tubes | VWR | 525-0990 | This is an example, use your preferred provider |
| 15 mL conical sterile propylene centrifuge tube | Nunc, ThermoFisher | 339651 | Other brands can be used |
| 2 mL screw cap tube sterile, with attached cap | ThermoFisher | 3463 | For plasma aliquoting |
| 20X TBS Buffer | ThermoFisher Scientific | 28358 | Final is 25 mM Tris, 0,15 M NaCl; pH 7,5. This is an example, you can prepare your own stock or use a different provider |
| 20X TBS Tween 20 Buffer | ThermoFisher Scientific | 28360 | Or supplement TBS with 0.05% to prepare TBST buffer |
| Automated cell counter or haemocytometer | ThermoScientific | AMQAX1000 | We use Countess device and slides but could be other methods. |
| Adjustable micropipette allowing 50 µL measurements | To handle small volumes (i.e. western blot, transfer PBMC pellets to 1.5 mL tubes) | ||
| BD Vacutainer CPT mononuclear cell preparation tube (Na-citrate or Na-heparin) 8 mL | BD | 362761, 362753 | There are 4 mL tubes but if possible 8 mL tubes are recommended to obtain more PBMCs from a single blood draw |
| Cell-freezing box | ThermoFisher Scientific | 5100-0001 | This is an example, use your preferred provider. |
| Centrifugation unit converter | LabTools | http://www.labtools.us/centrifugation-speed-rpm-to-g-conversion/ | |
| DMSO | Sigma-Aldrich, MERK | D2438 | Use your preferred provider. Ued for PBMC cryopreservation |
| ECL horseradish peroxidase substrate | ThermoFisher | 34075 | Use your preferred reagent according to the sensitivity required to detect your biomarker by western blot. Other systems can be used such as IRDye secondary antibodies with imaging systems. |
| Faxitron MultiFocus X-ray cabinet | Faxitron Bioptics | To irradiate blood. Other models/makers are available | |
| Fetal Bovine Serum (FBS), heat inactivated | ThermoScientific | 102706 | Use your preferred provider. Ued for PBMC cryopreservation |
| Fine tip, sterile 1.5 mL Pasteur pipettes | VWR | 414004-018 | Optional |
| Fixed-angle rotor centrifuge | Optional for preparation of plasma for ctDNA/metabolomics | ||
| Gel doc imaging system | SYNGENE | For imaging HRP developed membranes | |
| Heat block | To denature lysates prior to run them in western blot, any maker equipped with suitable tube adaptors | ||
| Horizontal rotor (swing-out head) centrifuge | Thermoscientific | Heraeus Megafuge 40R | This is an example |
| Liquid nitrogen/dry ice | To flash-freeze samples | ||
| Marvel dried skimmed milk | Premier Foods | This is an example, use your preferred provider | |
| Micropipette tips for range 1-200 µL | To handle small volumes (i.e. western blot, transfer PBMC pellets to 1.5 mL tubes) | ||
| NuPAGE 4-12% Bis-Tris protein gel, 1 mm, 10 wells | ThermoFisher Scientific | NP0321BOX | This is an example, cast your own or use your preferred provider |
| NuPAGE LDS Sample Buffer (4X) | ThermoFisher Scientific | NP0007 | For imaging HRP developed membranes |
| NuPAGE Sample Reducing Agent (10X) | ThermoFisher Scientific | NP0009 | This is an example. |
| PBS, no calcium, no magnesium | Gibco, ThermoFisher | 14190-144 | This is usually provided in the clinical kit. |
| Phosphatase inhibitor cocktail 2 | Sigma-Aldrich, MERK | P5726-1ML | Optional for step 3.7 |
| Phosphatase inhibitor cocktail 3 | Sigma-Aldrich, MERK | P0044-1ML | Optional for step 3.7 |
| Rabbit anti GAPDH | Cell Signaling Technology | CST 2128 | 1:1000 dilution in 5% milk TBST |
| Rabbit anti γH2AX | Cell Signaling Technology | CST 2577, lot 11 | 1:2000 dilution in 5 % milk TBST |
| Rabbit anti pS1981 ATM | Abcam | ab81292 | 1:2000 dilution in 5 % milk TBST |
| Rabbit anti pS635 RAD50 | Cell Signaling Technology | CST 14223 | 1:1000 dilution in 5 % milk TBST |
| Rabbit anti total ATM | Abcam | ab32420 | 1:1000 dilution in 5 % milk TBST |
| Rabbit anti total RAD50 | Cell Signaling Technology | CST 3427, lot 2 | 1:1000 dilution in 5 % milk TBST |
| RIPA buffer | Sigma-Aldrich, MERK | R0278-50ML | For cell lysis. This is an example, use your preferred provider |
| Sonicator | Diagenode | B01060010 | Used for 3 cycles at 30 s on/ 30 s off, 4 oC. If using a different instrument, adjust number of cycles and intensity according to your sonicator. |
| Sterile 1.7 mL Pasteur pipettes | VWR | 414004-030 | This is an example, use your preferred provider |
| Sterile serological pipettes (5 and 10 mL volume) | Costar | 4101, 4051 | This is an example, use your preferred provider |
| Trypan blue | ThermoScientific | T10282 | This is for the automated cell counter listed above. |
| Wet ice | To keep plasma samples and lysates cold |
Riferimenti
- Hoelder, S., Clarke, P. A., Workman, P. Discovery of small molecule cancer drugs: successes, challenges. and opportunities. Molecular Oncology. 6, 155-176 (2012).
- Harrigan, J. A., Jacq, X., Martin, N. M., Jackson, S. P. Deubiquitylating enzymes and drug discovery: emerging opportunities. Nature Reviews Drug Discovery. 17, 57-77 (2018).
- Brown, J. S., O'Carrigan, B., Jackson, S. P., Yap, T. A. Targeting DNA repair in cancer: beyond PARP inhibitors. Cancer Discovery. 1, 20-37 (2017).
- Pettersson, M., Crews, C. M. PROteolysis TArgeting Chimeras (PROTACs)-Past, present and future. Drug Discovery Today: Technologies. 31, 15-27 (2019).
- Scott, A. M., Wolchok, J. D., Old, L. J. Antibody therapy of cancer. Nature Reviews Cancer. 12, 278-287 (2012).
- Thomas, A., Teicher, B. A., Hassan, R. Antibody-drug conjugates for cancer therapy. The Lancet Oncology. 17 (6), 254 (2016).
- Ferguson, F. M., Gray, N. S. Kinase inhibitors: the road ahead. Nature Reviews Drug Discovery. 17 (5), 353-377 (2018).
- Jones, G. N., et al. pRAD50: a novel and clinically applicable pharmacodynamic biomarker of both ATM and ATR inhibition identified using mass spectrometry and immunohistochemistry. British Journal of Cancer. 119 (10), 1233-1243 (2018).
- Cook, D., et al. Lessons learned from the fate of AstraZeneca's drug pipeline: a five-dimensional framework. Nature Reviews Drug Discovery. 13, 419-431 (2014).
- Overman, M. J., et al. Use of research biopsies in clinical trials: are risks and benefits adequately discussed. Journal of Clinical Oncology. 31 (1), 17-22 (2012).
- Olson, E. M., Lin, N. U., Krop, I. E., Winer, E. P. The ethical use of mandatory research biopsies. Nature reviews Clinical Oncology. 8, 620-625 (2011).
- O'Donnell, A., et al. Phase I pharmacokinetic and pharmacodynamic study of the oral mammalian target of rapamycin inhibitor Everolimus in patients with advanced solid tumors. Journal of Clinical Oncology. 26 (10), 1588-1595 (2008).
- Fong, P. C., et al. Inhibition of Poly(ADP-Ribose) polymerase in tumors from BRCA mutation carriers. The New England Journal of Medicine. 361 (2), 123-134 (2009).
- Verschoor, C. P., Kohli, V., Balion, C. A comprehensive assessment of immunophenotyping performed in cryopreserved peripheral whole blood. Cytometry B Clinical Cytometry. 94 (5), 662-670 (2018).
- Ruitenberg, J. J., et al. VACUTAINER®CPT™ and Ficoll density gradient separation perform equivalently in maintaining the quality and function of PBMC from HIV seropositive blood samples. BMC Immunology. 7 (11), (2006).
- Yamashita, M., et al. A novel method for evaluating antibody-dependent cell-mediated cytotoxicity by flowcytometry using cryopreserved human peripheral blood mononuclear cells. Scientific Reports. 6 (19772), 1-10 (2016).
- Schiavon, G., et al. Analysis of ESR1 mutation in circulating tumor DNA demonstrates evolution during therapy for metastatic breast cancer. Science Translational Medicine. 7 (313), 182 (2015).
- Lee, J., et al. Tumor genomic profiling guides metastatic gastric cancer patients to targeted treatment: the VIKTORY umbrella trial. Cancer Discovery. , (2019).
- Abbosh, C., et al. Phylogenetic ctDNA analysis depicts early-stage lung cancer evolution. Nature. 545, 545 (2017).
- Thress, K. S., et al. Acquired EGFR C797S mutation mediates resistance to AZD9291 in non-small cell lung cancer harboring EGFR T790M. Nature Medicine. 21 (6), 560-562 (2015).
- Rossi, G., Ignatiadis, M. Promises and pitfalls of using liquid biopsy for precision medicine. Cancer Research. 79 (11), 2798-2804 (2019).
- Balasubramanian, P., et al. Isolation and characterisation of circulating tumor cells (CTCs) from peripheral blood specimens of patients with advanced solid tumor malignancies (using ApoStream® instrumentation) [abstract 3062]. Proceedings of the Annual meeting of the American Association for Cancer Research. , (2014).
- Qin, J., Alt, J. R., Hunsley, B. A., Williams, T. L., Fernando, M. R. Stabilization of circulating tumor cells in blood using a collection device with a preservative reagent. Cancer Cell International. 14 (13), 1-6 (2014).
- Biomarkers definitions working group. Biomarkers and surrogate endpoints: preferred definitions and conceptual framework. Clinical Pharmacology & Therapeutics. 69 (3), 89-95 (2001).
- Crowley, E., Di Nicolantonio, F., Loupakis, F., Bardelli, A. Liquid biopsy: monitoring cancer-genetics in the blood. Nature Reviews Clinical Oncology. 10, 472-484 (2013).
- Bundred, N., et al. Evaluation of the pharmacodynamics of the PARP inhibitor olaparib: a phase I multicentre trial in patients scheduled for elective breast cancer surgery. Investigational New Drugs. 31, 949-958 (2013).
- Rosado, M., et al. Advances in biomarker detection: Alternative approaches for blood-based biomarker detection. Advances in Clinical Chemistry. 92, 141-199 (2019).
- Grievink, H. W., et al. Comparison of three isolation techniques for human peripheral blood mononuclear cells: cell recovery and viability, population composition and cell functionality. Biopreservation and Biobanking. 14 (5), 410-415 (2016).
- Khadka, M., et al. The effect of anticoagulants, temperature, and time on the human plasma metabolome and lipidome from healthy donors as determined by liquid chromatography-mass spectrometry. Biomolecules. 9 (5), 1-15 (2019).
- Hellmann, M. D., et al. Circulating tumor DNA analysis to assess risk of progression after long-term response to PD-(L)1 blockade in NSCLC. Clinical Cancer Research. 26 (12), 2849-2858 (2020).
- ClinicalTrials.gov [Internet}. Identifier NCT03328273, A study of AZD6738 and Acalabrutinib in subjects with relapsed or refractory chronic lymphocytic leukemia (CLL). National Library of Medicine (US) Available from: https://clinicaltrials.gov/ct2/show/NCT03328273 (2017)
- Kirschner, M. B., et al. The impact of hemolysis on cell-free microRNA biomarkers. Frontiers in Genetics. 4 (94), 1-13 (2013).
- Blackford, A. N., Jackson, S. P. ATM, ATR, and DNA-PK: The Trinity at the Heart of the DNA Damage Response. Molecular Cell. 66, 801-817 (2017).
- Riedhammer, C., Halbritter, D., Weissert, R. Peripheral Blood Mononuclear Cells: Isolation, Freezing, Thawing, and Culture. Methods in Molecular Biology. 1304, 53-61 (2016).
- Basavaraj, M. G., Østerud, B., Hansen, J. B. Influence of different anticoagulants on monocyte procoagulant functions and monocyte-platelet aggregates formation. Journal of Thrombosis and Haemostasis. 9 (8), 1673-1676 (2011).
- Biancotto, A., Feng, X., Langweiler, M., Young, N. S., McCoy, J. P. Effect of anticoagulants on multiplexed measurements of cytokine/chemokines in healthy subjects. Cytokine. 60, 438-446 (2012).
- Wawrzyniak, R., et al. New plasma preparation approach to enrich metabolome coverage in untargeted metabolomics: plasma protein bound hydrophobic metabolite release with proteinase K. Scientific Reports. 8, 1-10 (2018).
- Duffy, D., et al. Standardized whole blood stimulation improves immunomonitoring of induced immune responses in multi-center study. Clinical Immunology. 183, 325-335 (2017).
- Wang, L., et al. Standardization of cryopreserved peripheral blood mononuclear cells through a resting process for clinical immunomonitoring- development of an algorithm. Cytometry A Clinical Cytometry. 89, 246-258 (2016).
- Whiteaker, J. R., et al. Targeted mass spectrometry enables robust quantification of FANCD2 mono-ubiquitination in response to DNA damage. DNA Repair. 65, 47-53 (2018).
- Lam, N. Y., Rainer, T. H., Chiu, R. W., Lo, Y. M. EDTA is a better anticoagulant than heparin or citrate for delayed blood processing for plasma DNA analysis. Clinical Chemistry. 50, 256-257 (2004).
- Parpart-Li, S., et al. The effect of preservative and temperature on the analysis of circulating tumor DNA. Clinical Cancer Research. 23 (10), 2471-2477 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon