Method Article
تقييم مورفولوجية ووظيفية من أكسونس ونقاط الاشتباك العصبي خلال وفاة أكسون في دروسوفيلا melanogaster
* These authors contributed equally
In This Article
Summary
هنا ، نقدم بروتوكولات لتنفيذ ثلاثة بسيط من حالات الإصابة الناجمة عن تنكس المحور (موت المحور المحوري) في drosophila melanogaster لتقييم الحفاظ المورفولوجية والوظيفية من المحاور المقطوعة ونقاط الاشتباك العصبي.
Abstract
تنكس أكسون هو سمة مشتركة في الأمراض العصبية وعندما يتم تحدي الأجهزة العصبية من قبل القوى الميكانيكية أو الكيميائية. ومع ذلك، لا يزال فهمنا للآليات الجزيئية الكامنة وراء انحطاط محور عصبي محدودًا. الإصابة الناجمة عن انحطاط محور عصبي بمثابة نموذج بسيط لدراسة كيفية قطع محاور تنفيذ التفكيك الخاصة بهم (موت محور عصبي). على مدى السنوات الأخيرة ، تم تحديد سلسلة إشارات موت المحور المحوري المحفوظة تطوريًا من الذباب إلى الثدييات ، وهو أمر مطلوب لتحول المحور المحوري المنفصل بعد الإصابة. وعلى العكس من ذلك، فإن إشارات موت المحور المحوري المهيونة تؤدي إلى الحفاظ المورفولوجي والوظيفي على المحاور المقطوعة ونقاط الاشتباك العصبي الخاصة بها. هنا ، نقدم ثلاثة بروتوكولات بسيطة ومطورة مؤخرًا تسمح بمراقبة مورفولوجيا المحور ، أو وظيفة المحور العصبي والتشابك من المحاور المقطوعة التي تم قطعها من جسم الخلية العصبية ، في ذبابة الفاكهة Drosophila. يمكن ملاحظة مورفولوجيا في الجناح ، حيث ينتج عن إصابة جزئية موت محور عصبي جنبًا إلى جنب من محاور التحكم غير المصابة داخل حزمة الأعصاب نفسها. بدلا من ذلك ، يمكن أيضًا ملاحظة مورفولوجيا المحاور في الدماغ ، حيث تخضع حزمة الأعصاب بأكملها لموت محور عصبي بسبب استئصال الهوائيات. يمكن تقييم الحفاظ الوظيفي على المحاور المقطوعة ونقاط الاشتباك العصبي الخاصة بها من خلال نهج بسيط optogenetic مقرونابسلوك الاستمالة بعد متشابك. نحن نقدم أمثلة باستخدام طفرة عالية الأسلاك فقدان وظيفة وعن طريق الإفراط في التعبير عن dnmnat، وكلاهما قادر على تأخير موت محور عصبي لأسابيع إلى أشهر. والأهم من ذلك، يمكن استخدام هذه البروتوكولات إلى ما بعد الإصابة؛ أنها تسهل توصيف عوامل الصيانة العصبية, نقل المحور, والميتوكوندريا المحورية.
Introduction
سلامة المورفولوجية من الخلايا العصبية أمر ضروري لوظيفة الجهاز العصبي المستدامة طوال الحياة. الغالبية العظمى من حجم الخلايا العصبية تؤخذ من قبل محاور عصبية1،2؛ وبالتالي صيانة مدى الحياة من محاور عصبية طويلة بشكل خاص هو التحدي البيولوجي وحيوية رئيسية للجهاز العصبي. وقد تم تحديد آليات متعددة للدعم المحوري الجوهري والدلي ةليفي، مما يضمن البقاء على قيد الحياة المحورية. ضعفها يؤدي إلى انحطاط محور عصبي3، وهو سمة شائعة من السمات الشائعة للأجهزة العصبية التي تواجه التحدي في المرض ، والقوى الميكانيكية أو الكيميائية4،5. ومع ذلك ، فإن الآليات الجزيئية الأساسية لانحطاط محور عصبي لا تزال غير مفهومة بشكل جيد في أي سياق ، مما يجعل تطوير علاجات فعالة لمنع فقدان محور عصبي أمرًا صعبًا. تطوير علاجات فعالة ضد هذه الحالات العصبية أمر مهم ، لأنها تخلق عبئا هائلا في مجتمعنا6.
الإصابة الناجمة عن انحطاط محور عصبي بمثابة نموذج بسيط لدراسة كيفية قطع محاور تنفيذ التفكيك الخاصة بهم. اكتشف من قبل واسمه Augustus والر في عام 1850 ، والاير (WD) هو مصطلح مظلة التي تتألف من عمليتين متميزة ، فصل جزيئيا7. أولا، بعد إصابة محور عصبي، محاور منفصلة عن أجسامهم الخلية تنفيذ بنشاط التدمير الذاتي الخاصة بهم (موت محور عصبي) من خلال موت محور عصبي حفظها تطوريا إشارة تتالي في غضون يوم واحد بعد الإصابة8. ثانياً، تشارك غليا المحيطة والبلعوم المتخصصة وإزالة الحطام المحوري الناتج في غضون ثلاثة إلى خمسة أيام. التوهين من إشارات الموت محور عصبي النتائج في محاور مقطوعة التي لا تزال محفوظة لأسابيع9،10،11،12، في حين أن التوهين من ابتلاع الدبقية يتوج في الحطام المحوري الذي يستمر لأسابيع في الجسم الحي13،14،15.
كشفت الأبحاث في الذباب والفئران والجرذان وسمك الحمار الوحشي العديد من الوسطاء التطوري والأساسيين لوفاة محور عصبي مما يشير إلى8. المسوخ الموت أكسون تحتوي على محاور عصبية مقطوعة ونقاط الاشتباك العصبي التي تفشل في الخضوع للموت محور عصبي; أنها لا تزال مورفولوجية ووظيفية الحفاظ عليها لأسابيع، في حالة عدم وجود دعم الجسم الخلية9،,10،12،,13،,16،,17،,18،,19،,20،,21،,22،,23., أدى اكتشاف وتوصيف هؤلاء الوسطاء إلى تعريف مسار جزيئي ينفذ موت المحور المحوري. الأهم من ذلك ، يتم تنشيط إشارات الموت المحوري ليس فقط عندما يتم قطع محور عصبي ، سحق أو امتدت24،25. كما يبدو أن مساهما في نماذج الحيوانات متميزة من الحالات العصبية (على سبيل المثال، حيث البديهيات تتدهور بطريقة إصابة مستقلة4، ولكن مع مجموعة من النتائج المفيدة4،8). لذلك، فهم كيفية موت محور عصبي ينفذ انحطاط محور عصبي بعد الإصابة قد تقدم رؤى وراء نموذج إصابة بسيطة; كما يمكن أن توفر أهدافا للتدخل العلاجي.
وقد ثبت ذبابة الفاكهة Drosophila melanogaster (Drosophila)أن يكون نظاما لا يقدر بثمن لإشارات الموت محور عصبي. كشفت الأبحاث في الذبابة عن أربعة جينات موت محور عصبي أساسية محفوظة تطورياً: هاي واير (hiw)11،14، dnmnat12،26، dsarm10 و axundead (axed)12. تعديل هذه الوسطاء - فقدان وظيفة الطفرات من hiw، dsarm ومحورها،والإفراط في التعبير عن dnmnat - كتل بقوة موت محور عصبي لمدى حياة الذبابة. في حين قطع محاور نوع البرية الخضوع موت محور عصبي في غضون 1 يوم، محاور عصبية مقطوعة ونقاط الاشتباك العصبي التي تفتقر إلى hiw، dsarm أو axed لا تزال مورفولوجية فقط، ولكن أيضا الحفاظ عليها وظيفيا لأسابيع. ما إذا كان يمكن أيضا الحفاظ الوظيفي من خلال مستويات عالية من dnmnat لا يزال يتعين تحديدها.
هنا ، سوف نقدم ثلاثة بروتوكولات بسيطة ومطورة مؤخرا لدراسة موت محور عصبي (على سبيل المثال ، مورفولوجيا وظيفة محاور عصبية مقطوعة ونقاط الاشتباك العصبي على مر الزمن) في غياب دعم الجسم الخلية. نحن نبين كيف يؤدي موت المحور المحوري المضعف إلى محاور عصبية مقطوعة يتم الحفاظ عليها شكلياً مع طفرة فقدان وظيفة hiw (hiw-N)وكيف يؤدي موت المحور المحوري المضعف إلى محاور عصبية ونقاط الاشتباك العصبي المقطوعة التي لا تزال محفوظة وظيفيًا لمدة 7 أيام على الأقل مع الإفراط في التعبير عن dnmnat (dnmnatOE ). تسمح هذه البروتوكولات لمراقبة مورفولوجيا المحاور العصبية الفردية والمتشابكة إما في الجهاز المركزي أو العصبي المحيطي (CNS و PNS ، على التوالي)13،14، في حين يمكن تصور الحفاظ الوظيفي على المحاور المقطوعة ونقاط الاشتباك العصبي في الجهاز العصبي المركزي من خلال استخدام إعداد بسيط للجينات الفيولوجية جنبا إلى جنب مع الاستمالة كقراءة سلوكية12.
Protocol
1. مراقبة مورفولوجيا أكسون أثناء موت أكسون في PNS
- إصابة الجناح: إصابة جزئية من حزم محور عصبي
- استخدام 5 الإناث العذراء و 5 ذكور من النمط الجيني الأيمن(الشكل 4A، P0 جيل) لأداء الصلبان في درجة حرارة الغرفة (RT). مرر P0 إلى قوارير جديدة كل 3-4 أيام. جمع ذرية الكبار المغلقة حديثا (F1 جيل) يوميا والعمر لهم لمدة 7-14 يوما.
- تُسهّم الذباب على منصات ثاني أكسيدالكربون. استخدام مقص صغير لقطع الوريد الجناح الأمامي تقريبا في منتصف الجناح(الشكل 1A). استخدام جناح واحد للإصابة والجناح الآخر كسيطرة العمر غير مصاب. تطبيق إصابة واحدة لكل جناح، وتأكد من الحصول على أجنحة كافية المصابين (ما يقرب من 15 جناحا).
ملاحظة: يمكن قطع الجناح كله من خلال، ولكن يكفي لقطع الوريد الجناح الأمامي فقط. هذا هو الجزء الأقوى من الجناح. - استعادة الذباب في قوارير تحتوي على الغذاء.
- تشريح الجناح وتصور محاور عصبية
- انتشار 10 ميكرولتر من زيت الهالوكربون 27 مع ماصة على طول شريحة زجاجية كاملة(الشكل 1B).
- قطع الجرحى، وكذلك، جناح التحكم غير المصاب في النقاط الزمنية المطلوبة (على سبيل المثال، 1 أو 7 أيام بعد الإصابة). استخدام مقص صغير لقطع، وملاقط للاستيلاء على الجناح. جبل أقصى 4 أجنحة في زيت الهالوكربون 27(الشكل 1B)وتغطيتها مع شريحة الغطاء.
- صورة الجناح على الفور باستخدام المجهر القرص الغزل. الحصول على سلسلة من المقاطع البصرية على طول المحور z مع 0.33 ميكرومتر حجم الخطوة وضغط كومة z في ملف واحد للتحليلات اللاحقة.
ملاحظة: لا تمسك ووين الجناح الأمامي حيث يتم إيواء الخلايا ومحاور عصبية. أمسك بالجناح في المركز الأنسجة في الأجنحة ليست ثابتة. الحفاظ على الوقت من تركيب أجنحة لتصوير هذه تحت 8 دقيقة.
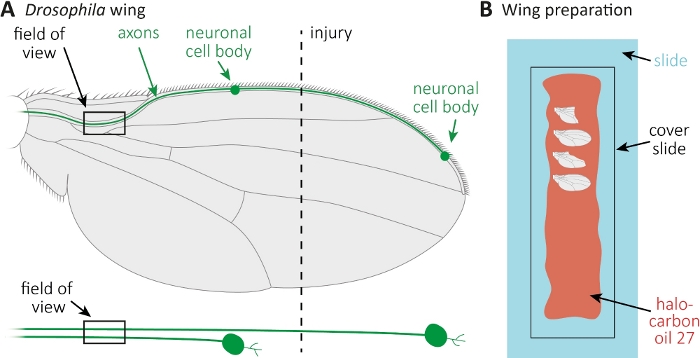
الشكل 1: مراقبة مورفولوجيا المحور المحوري أثناء موت المحور المحوري في الجناح. (أ)الجناح ذبابة التخطيطية مع اثنين من الخلايا العصبية الحسية المسمى GFP قليلة، والتي هي أيضا المشار إليها بشكل منفصل أدناه. ويشار إلى موقع الإصابة وميدان المراقبة. (ب)الإعداد التخطيطي لتصوير الجناح. يتم تركيب أجنحة التحكم المصابة وغير المصابة (الرمادية) في زيت الهالوكربون 27 (أحمر) على شريحة زجاجية (أزرق فاتح) ومغطاة بشريحة غطاء (أسود). يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
2. مراقبة أكسون ومورفولوجيا سينابس أثناء موت أكسون في الجهاز العصبي المركزي
- استئصال الهوائي: إصابة حزم محور عصبي كامل
- استخدام 5 الإناث العذراء و 5 ذكور من النمط الجيني الأيمن(الشكل 5A، P0 جيل) لأداء الصلبان في RT. تمرير P0 في قوارير جديدة كل 3-4 أيام. جمع ذرية الكبار المغلقة حديثا (F1 جيل) يوميا والسماح لهم العمر لمدة 7 تصل إلى 14 يوما.
- تُسهّم الذباب على منصات ثاني أكسيدالكربون. استخدام ملاقط لتخلص الحق 3الجزء الهوائي الثالث للاجتثاث من جانب واحد؛ أو على حد سواء اليسار واليمين 3 قطاعات الهوائياتالثالثة للاجتثاث الثنائية(الشكل 2A-C). سيؤدي ذلك إلى إزالة أجسام الخلايا العصبية المسماة GFP ، في حين تظل إسقاطاتها المحورية في الجهاز العصبي المركزي.
ملاحظة: استئصال الهوائيات يُقطع حزمة axon بأكملها. إذا تم إجراء الاجتثاث من جانب واحد، فإن حزمة المحور المحوري على الجانب المقابل (الهوائي غير المناب) تعمل كتحكم داخلي. تأكد من إجراء عمليات استئصال هوائيات كافية (حوالي 15 الحيوانات). - استعادة الذباب في قوارير تحتوي على الغذاء.
- تشريح الدماغ وتصور محاور عصبية
- مزيج قاعدة اللاتومر السيليكون (9 مل) وعامل المعالجة (1 مل) في نسبة حجم 10:1. نقل كل خليط 5 مل في لوحة ثقافة الأنسجة 35 ملم، والحد من الهواء التي أدخلت عن طريق خلط مع الانفعالات لطيف في غطاء الدخان بين عشية وضحاها. يُصلب الخليط خلال 24 ساعة.
ملاحظة: يجب إعداد لوحات التشريح مرة واحدة فقط ويمكن استخدامها عدة مرات. - تُخَطّر الذباب على منصات CO2 وقطع رؤوس البالغين باستخدام ملاقطين عند النقاط الزمنية المطلوبة (على سبيل المثال، بعد 1 أو 7 أيام من استئصال الهوائي). استخدام ملاقط واحد للاستيلاء على الرقبة، والملاقط الآخر لإصلاح الصدر. سحب بلطف الرقبة والرأس قبالة الصدر.
ملاحظة: اترك رؤوس مقطوعة الرأس على لوحة CO2 حتى يتحقق العدد المطلوب، ولكن تأكد من الانتقال إلى الخطوة التالية في غضون 30 دقيقة. - نقل جميع الرؤوس إلى أنبوب طرد مركزي صغير 1.5 مل يحتوي على 1 مل من محلول التثبيت الذي يحتوي على 4٪ بارافورمالديهايد (PFA) و 0.1٪ تريتون X-100 في الفوسفات المالحة العازلة (PBS) باستخدام الملاقط التي تم غمسها في حل التثبيت.
ملاحظة: رؤساء يطير عصا جيدا على ملاقط الرطب. يجعل من الممكن نقل جميع الرؤوس بسهولة إلى أنبوب الطرد المركزي الدقيق. - إصلاح رؤساء لمدة 20 دقيقة مع الانفعالات لطيف في RT. وضع أنبوب الطرد المركزي على الجليد، ورؤساء تنجذب إلى الجزء السفلي من أنبوب الطرد المركزي الدقيق. إزالة supernatant مع ماصة وتكرار هذا الإجراء مع خمس 2 دقيقة يغسل مع 1 مل من العازلة الغسيل التي تحتوي على 0.1٪ تريتون X-100 في برنامج تلفزيوني مع الانفعالات لطيف في RT، لإزالة المتبقية إصلاح الحل.
ملاحظة: أشرطة الفيديو حول كيفية تشريح العقول دروسوفيلا الكبار متاحة بسهولة27. - نقل الرؤوس مع ماصة الزجاج في لوحة تشريح مليئة العازلة الغسيل. استخدام ملاقط واحد للاستيلاء على وسحب خرطوم قبالة الرأس، في حين عقد الرأس مع ملاقط أخرى. هذا سيترك حفرة لو كان البوّاب مربوطاً بالهيكل الخارجي
- استخدام اثنين من ملاقط لإزالة الهيكل الخارجي بين الثقب وكل العين المركبة. وهذا سيجعل من الممكن لفتح هيكل الرأس مع كل من ملاقط, وخدش بلطف من الدماغ داخل.
- تنظيف كل دماغ عن طريق إزالة القصبة الهوائية أو الدهون تمسك به(الشكل 2D، أعلى). بمجرد تنظيف الدماغ ، ضعه في أنبوب طرد مركزي صغير جديد يحتوي على 1 مل من الغسيل المؤقت على الجليد.
ملاحظة: لن تؤثر الفصات البصرية التالفة أو المفقودة على الفص الشمي في وسط الدماغ(الشكل 2D، أعلى). - استبدال الغسيل العازلة مع 1 مل من حل تحديد مرة واحدة يتم جمع جميع العقول وتراكمت في الجزء السفلي من أنبوب الطرد المركزي الدقيق. إصلاح العقول لمدة 10 دقائق مع هزاز في RT، تليها خمس يغسل 2 دقيقة في 1 مل من العازلة الغسيل مع هزاز في RT.
- تطبيق الأجسام المضادة الأولية (1:500) في العازلة الغسيل بين عشية وضحاها مع هزاز في 4 درجة مئوية، تليها 10 يغسل أكثر من 2 ساعة باستخدام 1 مل من العازلة الغسيل مع هزاز في RT.
- تطبيق الأجسام المضادة الثانوية (1:500) في العازلة الغسيل 2 ساعة مع هزاز في RT والتفاف أنبوب الطرد المركزي الدقيق في رقائق الألومنيوم لمنع الضوء. الحفاظ على أنبوب الطرد المركزي الدقيق مغطاة احباط الألومنيوم لبقية الإجراء. تطبيق عشرة يغسل مع 1 مل من العازلة الغسيل أكثر من 2 ساعة مع هزاز في RT.
- إزالة supernatant واستخدام قطرة واحدة من الكاشف antifade لتغطية العقول في أنبوب الطرد المركزي الدقيق. احتضان الأدمغة لمدة 30 دقيقة على الأقل عند 4 درجات مئوية قبل إعدادها للتركيب والتصوير.
- إعداد شريحة غطاء، عصا شريط المختبر على ذلك، وقطع شكل "T" مثل من الشريط(الشكل 2D،أسفل). الفضاء الناتج بمثابة منطقة حيث الكاشف المضاد ة التلاشي التي تحتوي على الدماغ28 سيتم pipetted في, ويفضل في كل من الغرفتين.
ملاحظة: استخدم طرف ماصة 20-200 ميكرولتر حيث تم قطع 3 مم من الطرف لتوسيع فتحة الماصة. وهذا سيجعل من الممكن أن ماصة الكاشف antifade التي تحتوي على الدماغ. تغطية بعناية العقول مع شريحة غطاء. - استخدام الطين لإعداد اثنين من لفات صغيرة حتى. تأكد من أن لفات الطين ليست أعلى من ارتفاع شريحة زجاجية. عصا لفات الطين على الشريحة الزجاجية(الشكل 2D،أسفل). ضع شطيرة شريحة الغلاف المحتوية على الدماغ على لفات الطين.
ملاحظة: تقع محاور عصبية تحمل علامة GFP ونقاط الاشتباك العصبي الخاصة بها في الجزء الأمامي من الدماغ. ولذلك، فمن الأسهل لتصويرها من الأمام. ومع ذلك، فإن العقول إما مواجهة، أو الوجه لأسفل على شطيرة الشريحة الغطاء. لفات الطين بمثابة أصحاب ساندويتش، وأثناء التصوير، يمكن أن تنقلب شطيرة رأسا على عقب. وهذا سيجعل من الممكن الحصول على صور من الجبهة من كل الدماغ. - الحصول على سلسلة من المقاطع البصرية على طول المحور z مع 1.0 ميكرومتر حجم الخطوة باستخدام المجهر البؤري، وضغط ز مداخن في ملف واحد للتحليلات اللاحقة، لتقييم عدد الإسقاطات المحورية المتبقية سليمة.
- مزيج قاعدة اللاتومر السيليكون (9 مل) وعامل المعالجة (1 مل) في نسبة حجم 10:1. نقل كل خليط 5 مل في لوحة ثقافة الأنسجة 35 ملم، والحد من الهواء التي أدخلت عن طريق خلط مع الانفعالات لطيف في غطاء الدخان بين عشية وضحاها. يُصلب الخليط خلال 24 ساعة.
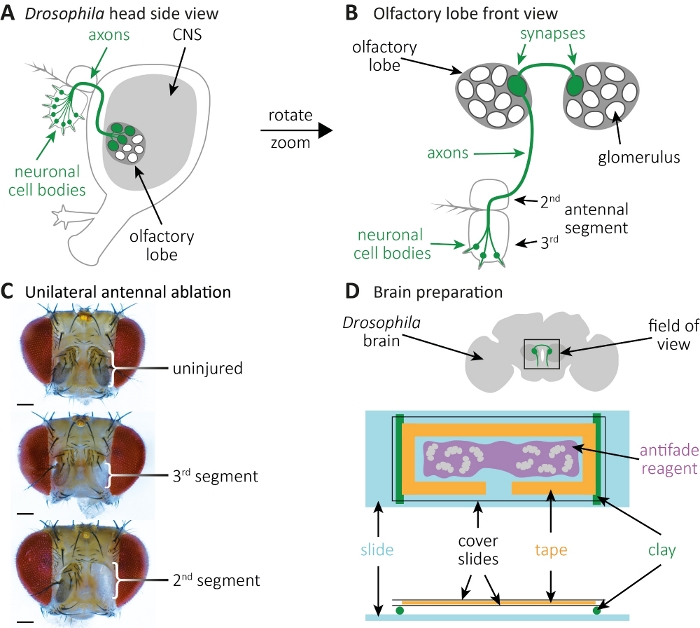
الشكل 2: مراقبة مورفولوجيا المحور العصبي والمشبك أثناء موت المحور المحوري في الدماغ. (أ)عرض جانبي لرئيس ذبابة تخطيطي مع أجسام الخلايا المسماة GFP ومحاور عصبية ونقاط الاشتباك العصبي. (ب)عالية التكبير عرض الجبهة من الخلايا العصبية مستقبلات الشم المسمى GPF ومحاورها ونقاط الاشتباك العصبي. يتم إيواء الأجسام الخلوية في الجزء 3rd الهوائيات، ومشروع محاورها في الجهاز العصبي المركزي. محاور أكسون تشكل نقاط الاشتباك العصبي في الكبيبات في الفص الشمي الأيسر، وعبور خط الوسط وتشكيل نقاط الاشتباك العصبي في الكبيبات على الفص الشمية العارضة. (ج)أمثلة على رؤوس الذباب ة باستئصال هوائيات أحادية الجانب. الأعلى: التحكم غير المصاب. الأوسط: اجتثاث الجزء الهوائيالثالث. أسفل: اجتثاث من2 nd (وبالتالي أيضا 3rd)قطاع الهوائي. (د)إعداد الدماغ. أعلى: تخطيطي تشريح الدماغ ذبابة مع فصوص الشم المشار إليها والإسقاطات المحورية في مجال الرؤية. أسفل: الإعداد التخطيطي لتصوير الدماغ. يتم تركيب لفات الطين اثنين (الأخضر) على شريحة زجاجية (الأزرق الفاتح)، وأنها تحمل شطيرة الشريحة الغطاء، الذي يحتوي على أدمغة ذبابة (رمادي). يتم تركيب الأدمغة في كاشف مضاد للتلاشي (أرجواني) ، محاطًا بشريط مختبر (برتقالي) ، وتغطيها شريحتان غلاف (أسود). يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
3. الاستمالة الناجمة عن Optogenetics كقراءة لوظيفة أكسون وسينابس
- الإعداد البوجيني
- إجراء التجربة البوجينية في غرفة مظلمة. تأكد من أن الإعداد يتكون من 850 نانومتر الأشعة تحت الحمراء (الأشعة تحت الحمراء) أضواء LED لإلقاء الضوء على الذباب في الظلام(الشكل 3A)،وامض 660 نانومتر أضواء LED حمراء لتنشيط الخلايا العصبية التي تعبر عن CsChrimson، وكاميرا أحادية اللون مع مرشح لونغباس 700 نانومتر، والذي يمنع تسجيل ومضات الضوء الأحمر.
- استخدم طابعة ثلاثية الأبعاد لإنشاء غرفة سلوك دائرية صغيرة بقطر 1 سم ، وتغطيتها بشريحة غطاء ، ووضع باعث 860 نانومتر إلى أضواء LED حمراء بجوار الغرفة(الشكل 3B).
ملاحظة: يشير الباعث إلى وقت تشغيل أضواء LED الحمراء، وبالتالي تنشيط الخلايا العصبية. - قم بتركيب أضواء LED والكاميرا أعلى الغرفة(الشكل 3A، C).
- تنشيط الخلايا العصبية من قبل 10 هرتز ومضات خلال 10 ق. ويمكن تعديل مدة التنشيط وفقا للتصميم التجريبي.
- إعداد الذباب لعلم الوراثة البصرية
- تذوب يطير الطعام في الميكروويف. بعد تبريد الطعام ، قبل التصلب ، أضف 1:100 من 20 mm جميع عبر الشبكية في الإيثانول (EtOH) إلى تركيز نهائي قدره 200 ميكرومتر.
ملاحظة: تجنب إضافة جميع عبر الشبكية إلى الطعام الساخن، وهذا يمكن أن يؤدي إلى علم البصريات أقل كفاءة. - قم بتغطية القنينات التي تحتوي على طعام صلب مع المقابس أو كرات القطن. قارورة التفاف مع رقائق الألومنيوم. ثم قم بتخزين القنينات المحتوية على الطعام في غرفة مظلمة وباردة.
- استخدام 5 الإناث العذراء و 5 الذكور(الشكل 6A،الجيل P0)من النمط الجيني الأيمن لأداء الصلبان في RT. تمرير P0 في قوارير جديدة كل 3-4 أيام. جمع ذرية الكبار المغلقة حديثا (الجيل F1)على قاعدة يومية والسماح لهم العمر لمدة 7 تصل إلى 14 يوما في قارورة مغطاة بالألومنيوم تحتوي على 200 ميكرومتر جميع عبر الشبكية في الغذاء يطير.
- جمع الذباب عن طريق التنصت عليها من قوارير تحتوي على الغذاء في قارورة فارغة مع عدم وجود طعام. تبريد القارورة أسفل في الماء الذي يحتوي على الجليد لمدة 30 s تقريبا. سوف يطير تغفو. وضع الذباب الفردية بسرعة في غرف صغيرة مغطاة بشريحة غطاء(الشكل 3B).
ملاحظة: بمجرد أن الاحماء الذباب، يستيقظون. من الأهمية بمكان نشر الذباب الفردي بسرعة في غرف واحدة لكل غرفة. تجنب منصات CO2 لتطفل الذباب ، وهذا سيؤثر على سلوكهم. - أداء علم الوراثة البصرية للحصول على الاستمالة الهوائي. هنا، يتكون البروتوكول من الفواصل التالية: 30 s حيث يكون الضوء الأحمر غائبًا، يليه 10 ثوانمن التعرض للضوء الأحمر عند 10 هرتز. كرر هذا الإجراء ثلاث مرات في المجموع، يليه فاصل زمني إضافي 30 s حيث يكون الضوء الأحمر غائبًا12،29،30.
ملاحظة: يمكن تعديل هذا البروتوكول وفقًا للتفضيل التجريبي. - جمع الذباب الفردية من كل غرفة على منصات CO2. تخضع لهم لإصابة الهوائي. ابطأ كل من اليسار واليمين 2 قطاعات الهوائيات(الشكل 2C). سيؤدي ذلك إلى إزالة الخلايا من الخلايا العصبية التابعة لجهاز Johnston (JO) ، في حين تظل الإسقاطات المحورية في الجهاز العصبي المركزي. استعادة الذباب في قوارير مغطاة بالألمنيوم تحتوي على 200 ميكرومتر عبر الشبكية.
ملاحظة: بالنسبة للاستمالة الهوائي الناجم عن علم البصريات، يتم إيواء الهيئات الخلايا العصبية الحسية في الجزء الهوائيالثاني 2(الشكل 2C). - في النقاط الزمنية المقابلة (على سبيل المثال، 7 أيام بعد استئصال الهوائي)، يخضع الذباب إلى فحص آخر للاستمالة (العودة إلى الخطوة 3.2.4).
- تذوب يطير الطعام في الميكروويف. بعد تبريد الطعام ، قبل التصلب ، أضف 1:100 من 20 mm جميع عبر الشبكية في الإيثانول (EtOH) إلى تركيز نهائي قدره 200 ميكرومتر.
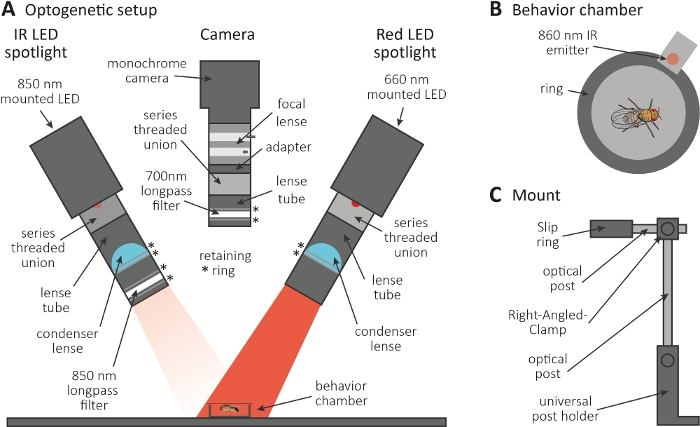
الشكل 3: الإعداد البوجيني للحث على الاستمالة كقراءة لوظيفة محور عصبي ومشبك. (أ)توضيح للمكونات المجمعة المطلوبة لعلم الوراثة البصرية. الأشعة تحت الحمراء (IR) أضواء LED، والكاميرا وأضواء LED الحمراء (من اليسار إلى اليمين، على التوالي). يتم سرد المكونات بما في ذلك وصف مفصل في جدول المواد. (ب)أعلى عرض التوضيح من غرفة السلوك بما في ذلك باعث الأشعة تحت الحمراء للإشارة إلى تنشيط أضواء LED الحمراء. (C)توضيح لإعداد جبل واحد. هناك حاجة إلى ما مجموعه ثلاثة إعدادات جبل لاثنين من الأضواء LED والكاميرا، على التوالي. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
أعلاه، وصفنا ثلاث طرق لدراسة مورفولوجيا ووظيفة محاور عصبية مقطوعة ونقاط الاشتباك العصبي الخاصة بهم. الطريقة الأولى تسمح لمراقبة عالية الدقة من محاور عصبية الفردية في PNS. فإنه يتطلب استنساخ ولدت من قبل تقنية MARCM14،31. هنا، قمنا الصلبان لتوليد نوع البرية واستنساخ MARCM متحولة highwire (الشكل 4A). قطع بسيط في منتصف الجناح يؤدي إلى إصابة محور عصبي من الخلايا العصبية التي تقع في النُسان (على سبيل المثال، في الجانب الخارجي من الجناح)، في حين أن الخلايا العصبية القريبة (على سبيل المثال، بين موقع القطع والصدر) لا تزال غير مصابة. هذا النهج يجعل من الممكن لمراقبة موت محور عصبي جنبا إلى جنب من محاور التحكم غير المصابة في حزمة الأعصاب نفسها(الشكل 1A، الشكل 4B). هنا ، استخدمنا خلفية وراثية مما أدى إلى انخفاض أعداد المستنسخين المسمى GFP (على سبيل المثال ، اثنان في كل تجربة14). نقدم أمثلة من 1 و 7 أيام بعد إصابة محاور نوع البرية، لتقديم أمثلة من محاور عصبية السيطرة، محاور عصبية تمر موت محور عصبي، وشظايا محور عصبي يجري مسحها من قبل جليا المحيطة، على التوالي. بالإضافة إلى ذلك ، كررنا إصابة محور عصبي في المسوخ عالية الأسلاك حيث قمنا بتحليل النتيجة بعد 7 أيام من الإصابة.
أجنحة التحكم غير المصابة الميناء اثنين من الحيوانات المستنسخة البرية من نوع، وبالتالي اثنين من المحاور البرية المسمى GFP من نوع(الشكل 4B،نوع البرية، والتحكم غير مصاب). يوم واحد بعد قطع منتصف الجناح باستخدام مقص صغير، يتم حث موت محور عصبي في محاور GFP المسمى حيث الهيئات الخلية هي بعيدة إلى موقع قطع، في حين محاور عصبية من الهيئات خلية قريبة تعمل كرقابة داخلية داخل حزمة الأعصاب نفسها(الشكل 4B،نوع البرية، 1 بعد إصابة يوم). لاحظ أثر الحطام المحوري في الجزء العلوي المشار به بالسهم. 7 أيام بعد إصابة محور عصبي، يتم مسح الحطام المحوري المسمى GFP من قبل جليا المحيطة، في حين تسمية GFP محاور التحكم غير المصابة لا تزال في حزمة الأعصاب(الشكل 4B،نوع البرية، 7 أيام بعد الإصابة، السهم). في المقابل، محاور متحولة highwire التي تم قطعها لمدة 7 أيام لا تزال محفوظة مورفولوجية، بما يتفق مع النتائج السابقة11،,14 (الشكل 4B، highwire،7 أيام بعد الإصابة، السهم). هذه النتائج تثبت دقة بصرية قوية من جناح Drosophila. يمكن ملاحظة موت أكسون جنبًا إلى جنب من عناصر التحكم غير المصابة في نفس حزمة الأعصاب. في حين أن المحاور البرية من نوع الخضوع موت محور عصبي في غضون 1 بعد يوم من الإصابة ويتم مسح الحطام الناتج في غضون 7 أيام ، فإن المسوخ عالية الأسلاك الخالية من الأكسون لا تزال محفوظة شكليا لمدة 7 أيام.

الشكل 4: نهج لدراسة موت محور عصبي من محاور عصبية الحسية المسمى GFP في الجناح. (أ)الصلبان التخطيطية لتوليد نوع البرية واستنساخ highwire في الجناح (P0 و F1 جيل، على التوالي). الإناث العذراء على اليسار، الذكور على اليمين. راجع جدول المواد للحصول على تفاصيل النمط الجيني. (ب)أمثلة على السيطرة والمحاور المسماة GFP المصابة. يشار إلى مجال الرؤية في(الشكل 1A). من اليسار إلى اليمين: محاور التحكم في نوع البرية غير المصابة، محاور نوع البرية 1 بعد يوم إصابة، محاور نوع البرية 7 أيام بعد الإصابة، محاور متحولة highwire 7 أيام بعد الإصابة، على التوالي. الأسهم تشير إلى محاور عصبية مقطوعة، مقياس شريط = 5 μm. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
الطريقة الثانية تصف كيفية تصور حزم محور عصبي كامل إسقاط في الجهاز العصبي المركزي حيث أنها تشكل نقاط الاشتباك العصبي، والتي تنتمي إلى الخلايا العصبية الموجودة في كل من الهوائيات اليسرى واليمنى(الشكل 2A-C). هنا، قمنا الصلبان لتوليد نوع البرية واستنساخ MARCM متحولة highwire (الشكل 5A). يمكن تصور محاور عصبية غير مصابة ، تحمل علامة GFP ونقاط الاشتباك العصبي على مدار أيام إلى أسابيع ، في حالة عدم وجود إصابة(الشكل 5B، نوع البرية ، التحكم غير المصاب). وبدلاً من ذلك، يمكن إخضاع الحيوانات لاجتثاث الجزءالهوائي الثالث الثالث، ويمكن ملاحظة محاور عصبية مقطوعة تحمل علامة GFP ونقاط الاشتباك العصبي خلال دورة زمنية على مدى ساعات إلى أيام. ركزنا على 7 أيام بعد استئصال الهوائي ، لأنه في هذه النقطة ، شهدت محاور عصبية ونقاط الاشتباك العصبي موت محور عصبي ، ويتم مسح الحطام الناتج عن ذلك من قبل glia المحيطة. إذا تم إجراء اجتثاث أحادي الجانب من الهوائي الصحيح ، ثم يتم قطع حزمة محور عصبي اليمنى وسيتم تفكيك ويتم مسح الحطام الناتج بالكامل بعد 7 أيام من الإصابة(الشكل 5B، النوع البري ، الاستئصال من جانب واحد ، 7 أيام بعد الإصابة ، السهام) ، بما يتفق مع النتائج السابقة13. بدلا من ذلك، يمكن أن يكون كل من الهوائيات اليمنى واليسرى ablated، والتي سوف قطع كل حزم محور عصبي، و 7 أيام بعد الإصابة، ومحاور عصبية ونقاط الاشتباك العصبي اختفت(الشكل 5B،نوع البرية، الاجتثاث الثنائية، 7 أيام بعد الإصابة، السهم). في المقابل، الاجتثاث من جانب واحد من الهوائيات اليمنى في المسوخ highwire النتائج في محاور قطعية التي لا تزال محفوظة 7 أيام بعد الإصابة، بما يتفق مع النتائج السابقة11،,14 (الشكل 5B، highwire،الاجتثاث من جانب واحد، 7 أيام بعد الإصابة، السهم). هذه النتائج تبين أن قطع محاور عصبية البرية من نوع الخضوع موت محور عصبي ويتم مسح الحطام الناتج في غضون 7 أيام، في حين أن المسوخ عالية الأسلاك قصور موت أكسيد عصبي تفشل في الخضوع للموت محور عصبي وتبقى محفوظة مورفولوجيا لمدة 7 أيام.
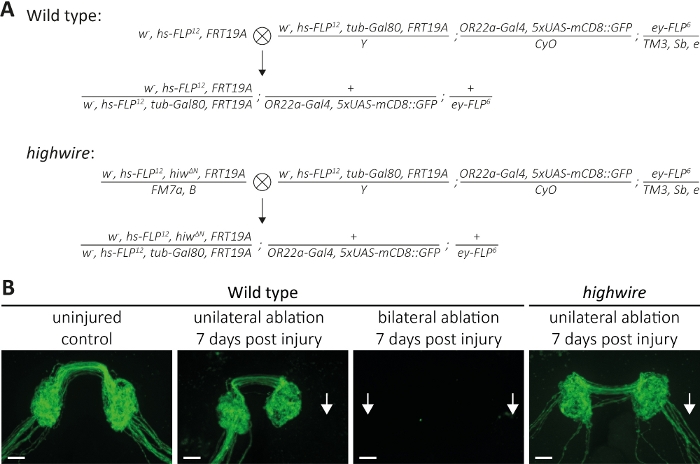
الشكل 5: نهج لدراسة موت محور عصبي من محاور عصبية الحسية المسمى GFP في الدماغ. (أ)الصلبان التخطيطية لتوليد نوع البرية واستنساخ highwire في الدماغ (P0 و F1 جيل، على التوالي). الإناث العذراء على اليسار، الذكور على اليمين. راجع جدول المواد للحصول على تفاصيل النمط الجيني. (ب)أمثلة على السيطرة والمحاور المسماة GFP المصابة. من اليسار إلى اليمين: ضوابط نوع البرية غير المصابة، البرية نوع 7 أيام بعد اجتثاث الهوائي من جانب واحد، البرية نوع 7 أيام بعد اجتثاث الهوائي الثنائية، والمسوخ highwire 7 أيام بعد اجتثاث الهوائي من جانب واحد، على التوالي. الأسهم تشير إلى حزم محور عصبي مقطوعة، شريط مقياس = 10 ميكرومتر. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
الطريقة الثالثة تسمح لمراقبة الحفظ الوظيفي للمحاور المقطوعة ونقاط الاشتباك العصبي في الجهاز العصبي المركزي. وهو يعتمد على التلاعب في مجموعة فرعية من الخلايا العصبية جو الموجودة في الجزء الهوائيالثاني 2 التي هي كافية للحث على الاستمالة الهوائي. التعبير عن قناة حمراء تحول rhodopsin (CsChrimson) في الخلايا العصبية جو، جنبا إلى جنب مع مكملات الغذائية لجميع عبر الشبكية، كافية لاستخلاص بسيطة بعد متشابك سلوك الاستمالة على التعرض الضوء الأحمر12،,30. هنا، قمنا الصلبان لتوليد الخلايا العصبية جو نوع البرية، والخلايا العصبية JO الإفراط في التعبير عن dnmnat (dnmnatOE)(الشكل 6A). نوع البرية الذباب أو الذباب التي تحتوي على الخلايا العصبية JO مع موت محور عصبي مخفف(dnmnatOE),كل من ميناء سلوك الاستمالة قوية قبل الإصابة. ومع ذلك، 7 أيام بعد الإصابة (على سبيل المثال، الاجتثاث الثنائي ة من الجزء الهوائيالثاني 2)، يفشل الاستمالة في أن يتم استثارتها من قبل optogenetics في ذباب ة من النوع البري بسبب انحطاط المحور العصبي والمشبك الناجم عن الإصابة، في حين تستمر الحيوانات ذات موت المحور المحوري المهون في العريس(الشكل 6B، الفيلم 1،2). وبالتالي فإن موت المحور المحوري المُهلن قادر على الحفاظ وظيفيًا على المحاور المقطوعة ونقاط الاشتباك العصبي الخاصة بها لمدة 7 أيام.

الشكل 6: نهج لتصور وظيفة محور عصبي ومتشابك بعد axotomy. (أ)الصلبان التخطيطية لتوليد نوع البرية وdnmnat الإفراط في التعبير عن الخلايا العصبية الحسية JO (P0 و F1 جيل، على التوالي). الإناث العذراء على اليسار، الذكور على اليمين. راجع جدول المواد للحصول على تفاصيل النمط الجيني. (ب)المخططات الفردية لسلوك الاستمالة الناجم عن علم الوراثة البصرية. أعلى: الأوثوجرام الفردية من نوع البرية الذباب قبل و 7 أيام بعد الإصابة (الأزرق). أسفل: ethograms الفردية من الذباب الإفراط في التعبير عن dnmnat (dnmnatOE)في الخلايا العصبية JO قبل و 7 أيام بعد الإصابة (الأحمر). يشير كل سلة على الأقل 1 سلوك الاستمالة في غضون 1 ق. يشير الخط الأسود إلى مجموع كافة الصناديق. (ج)القياس الكمي لسلوك الاستمالة. تظهر البيانات على أنها متوسط ± الانحراف المعياري، p > 0.001 (ANOVA أحادية الاتجاه، مقارنة متعددة مع اختبار Tukey بعد مخصص). يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
الفيلم 1: تمثيل سلوك الاستمالة نوع البرية التي أثارها optogenetics قبل و 7 أيام بعد استئصال الهوائي. يرجى الضغط هنا لتحميل هذا الفيديو.
الفيلم 2: سلوك الاستمالة التمثيلي ة التي أثارتها علم البصريات في الذباب المفرط في التعبير عن dnmnat في الخلايا العصبية JO قبل و 7 أيام بعد استئصال الهوائيات. يرجى الضغط هنا لتحميل هذا الفيديو.
Discussion
البروتوكولات الموصوفة هنا تسمح لمراقبة قوية وقابلة للاستنساخ من مورفولوجيا وكذلك وظيفة محاور عصبية ونقاط الاشتباك العصبي الخاصة بهم فصل من أجسامهم الخلية في Drosophila. يسهل فحص الجناح مراقبة موت محور عصبي جنبًا إلى جنب من محاور التحكم غير المصابة في PNS14، في حين يسهل فحص الهوائي مراقبة حزم الأعصاب الكاملة من محاور عصبية تحمل علامة GFP ونقاط الاشتباك العصبي الخاصة بهم ، لتقييم كل من المورفولوجيا والوظيفة في الدماغ (CNS)12. هناك خطوات حاسمة ومزايا معينة لكل نهج لدراسة مورفولوجيا التي يجب أن تؤخذ في الاعتبار عند تصميم التجارب.
لمراقبة مورفولوجيا محور عصبي في PNS في الجناح ، يمكن إجراء التجارب بسهولة ، بسبب شفافية الجناح: فهو يسمح بتجاوز التشريح والكيمياء الهيستوكيميائية المناعية. ومع ذلك ، بسبب عدم وجود التثبيت ، يجب أن يتم التصوير بالأجنحة مباشرة بعد تركيب14. حاليا، يتم استخدام اثنين من السائقين Gal4 متميزة بشكل متكرر، إما ok371Gal4 أو dpr1Gal4، وكلا المراجع تقدم نهج متميزة لتحديد الانحطاط14،26. ويوصى الوسم متفرق من عدد قليل من الخلايا العصبية، وذلك باستخدام "تحليل الفسيفساء مع علامة خلية قمعها (MARCM)"14،31، كما قرار مورفولوجيا المحور المحوري لم يسبق له مثيل. في المقابل ، فإن مراقبة نقاط الاشتباك العصبي غير ممكنة في الأجنحة ، فهي تقع في الحبل العصبي البطني داخل صدر الذباب. وعلاوة على ذلك، لا يمكن تصور علامات المحاور الإضافية من قبل الكيمياء المناعية: بشرة شمعية يجعل من المستحيل لنشر المثبتات والأجسام المضادة في الأنسجة الكامنة.
لمراقبة محور عصبي ومورفولوجيا المشبك في الجهاز العصبي المركزي، تشريح الدماغ يجب أن يتم. أنها توفر ميزة تصور علامات إضافية محور عصبي ومتشابك من خلال استخدام المناعة histochemistry، ويمكن ملاحظة نقاط الاشتباك العصبي جنبا إلى جنب مع محاور عصبية في نفس المجال من الرأي10،13. مجموعة كبيرة من الخلايا العصبية مستقبلات الشم ية (ORN) Gal4 المتاحة بسهولة32، وفي كثير من الأحيان ، OR22aGal4 هو المحرك المفضل. لاجتثاث الهوائي، يتم وضع الهيئات خلية من الخلايا العصبية OR22a في الجزء3 rd (الشكل 2B). يتم استخدام القياس الكمي القائم على كثافة الفلور لقياس كمية انحطاط المحاور أو نقاط الاشتباك العصبي13. وعلى العكس من ذلك، تستغرق التجارب وقتاً طويلاً بسبب تشريح الدماغ وتلطيخ الأجسام المضادة.
لتصور وظيفة محور عصبي ومتشابك بعد axotomy، يستخدم optogenetics لتحريك الاستمالة الهوائي: أنه بمثابة قراءة للحفاظ الوظيفي من محاور عصبية مقطوعة ونقاط الاشتباك العصبي12. وقد وصفت بدقة دائرة الاستمالة والحسية المقابلة، بين والمحركات Gal4 السائقين وصفها بدقة29،30. GMR60E02Gal4 تسميات مجموعة فرعية من الجهاز جونستون (JO) الخلايا العصبية الحسية، والتي هي مطلوبة وكافية للاستمالة29،,30. لاجتثاث الهوائي، يتم وضع الهيئات الخلية من الخلايا العصبية جو في الجزء الهوائيالثاني 2(الشكل 2B). يمكن بسهولة إنشاء إعداد optogenetic من الصفر، أو تعديل إعداد موجود. الأهم من ذلك، يجب إجراء التجارب في غرفة مظلمة، وبالتالي يتم تصور الذباب مع أضواء LED تحت الحمراء (IR). عند استخدام CsChrimson كقناة، فمن الأهمية بمكان لتوريد الطعام مع جميع عبر الشبكية وأضواء LED حمراء لتنشيط الخلايا العصبية JO29. بدلا من ذلك، يمكن استخدام القنوات الزرقاء الحساسة للضوء وأضواء LED الزرقاء، أو قناة TrpA1 ودرجة الحرارة لتنشيط الخلايا العصبية29،33. وقد تم بالفعل وصف القياس الكمي لسلوك الاستمالة12،29.
عندما تستخدم هذه الاختبارات لدراسة موت المحور المحوري على وجه التحديد ، من المهم ملاحظة أن النمط الظاهري للحفظ المورفولوجي أو الوظيفي يجب أن يكون قويًا بمرور الوقت. هناك حالات حيث يؤدي موت المحور المحوري إلى نمط ظاهري ثابت ولكنه أقل وضوحًا في الحفاظ المورفولوجية34،35، وما إذا كان مثل هذا النمط الظاهري يترجم إلى الحفاظ الوظيفي يبقى تحديدًا.
وقد لوحظت أيضا phenotypes الموت أكسون في الخلايا العصبية أثناء تطوير يرقات Drosophila، حيث تم سحق الأعصاب بدلا من إصابة11،23. هنا، ركزنا على وجه التحديد على الخلايا العصبية Drosophila الكبار التي أكملت التنمية. في هذا السياق، يمكن بسهولة استخدام تدخل الحمض النووي الريبي36، أو الأنسجة محددة CRISPR/Cas937. الأهم من ذلك ، يمكن استخدام التقنيات المذكورة أعلاه في سياق مستقل للموت محور عصبي: فهي تسهل توصيف عوامل الصيانة العصبية38، والنقل المحوري39، الميتوكوندريا المحورية المعتمدة على العمرتتغير 40، ومورفولوجيا الميتوكوندريا المحورية41.
Disclosures
ويعلن صاحبا البلاغ أنه ليس لديهما ما يكشفان عنه.
Acknowledgements
نود أن نشكر مختبر نيوكوم بأكمله على المساهمات. تم دعم هذا العمل من قبل جائزة أستاذ مساعد من المؤسسة الوطنية السويسرية للعلوم (منحة 176855)، والمؤسسة الدولية للبحوث في بارابليجيا (IRP، منحة P180)، SNSF Spark (منحة 190919) وبدعم من جامعة لوزان و قسم العلوم العصبية الأساسية (État de Vaud) إلى LJN.
Materials
| Name | Company | Catalog Number | Comments |
| Tweezers (high precision, ultra fine) | EMS | 78520-5 | Antennal ablation |
| MicroPoint Scissors (5-mm cutting edge) | EMS | 72933-04 | Wing injury |
| 1.5 mL microcentrifuge tube | Eppendorf | 30120086.0000 | |
| 35mm tissue culture dish | Sarstedt | 83.3900 | |
| Cover Slips, Thickness 1 | Thermo Scientific™ | BB02400600A113MNT0 | |
| Superfrost Microscope Slides | Thermo Scientific™ | AA00008032E00MNT10 | |
| High-Sensitivity USB 2.0 CMOS Camera, 1280 x 1024, Global Shutter | Thorlabs | DCC1240M | Camera setup |
| SM1 Retaining Ring for Ø1" Lens Tubes and Mounts | Thorlabs | SM1RR | |
| 25mm 1/1.2" C mount Lens | Tamron | M112FM25 | |
| Adapter with External M27 x 0.5 Threads and Internal SM1 Threads | Thorlabs | SM1A36 | |
| Aspheric Condenser Lens, Ø25 mm, f=20.1 mm, NA=0.60, ARC: 650-1050 nm | Thorlabs | ACL2520U-B | |
| Ø25.0 mm Premium Longpass Filter, Cut-On Wavelength: 700 nm | Thorlabs | FELH0700 | |
| SM1 (1.035"-40) Coupler, External Threads, 0.5" Long | Thorlabs | SM1T2 | |
| SM1 Lens Tube Without External Threads, 1" Long, Two Retaining Rings Included | Thorlabs | SM1M10 | |
| 850 nm, 900 mW (Min) Mounted LED, 1200 mA | Thorlabs | M850L3 | IR LED spotlight |
| SM1 (1.035"-40) Coupler, External Threads, 0.5" Long | Thorlabs | SM1T2 | |
| SM1 Lens Tube Without External Threads, 2" Long, Two Retaining Rings Included | Thorlabs | SM1M20 | |
| Aspheric Condenser Lens, Ø25 mm, f=20.1 mm, NA=0.60, ARC: 650-1050 nm | Thorlabs | ACL2520U-B | |
| Ø25.0 mm Premium Longpass Filter, Cut-On Wavelength: 850 nm | Thorlabs | FELH0850 | |
| SM1 Retaining Ring for Ø1" Lens Tubes and Mounts | Thorlabs | SM1RR | |
| 660 nm, 940 mW (Min) Mounted LED, 1200 mA | Thorlabs | M660L4 | Red LED spotlight |
| Aspheric Condenser Lens, Ø25 mm, f=20.1 mm, NA=0.60, ARC: 650-1050 nm | Thorlabs | ACL2520U-B | |
| SM1 (1.035"-40) Coupler, External Threads, 0.5" Long | Thorlabs | SM1T2 | |
| SM1 Lens Tube Without External Threads, 2" Long, Two Retaining Rings Included | Thorlabs | SM1M20 | |
| 15 V, 2.4 A Power Supply Unit with 3.5 mm Jack Connector for One K- or T-Cube | Thorlabs | KPS101 | LED control |
| T-Cube LED Driver, 1200 mA Max Drive Current | Thorlabs | LEDD1B | |
| 150 mm x 300 mm x 12.7 mm Aluminum Breadboard, M6 Double-Density Taps | Thorlabs | MB1530/M | Mount base |
| Ø12.7 mm Universal Post Holder, Spring-Loaded Locking Thumbscrew, L = 75 mm | Thorlabs | UPH75/M | Mount, 3x (IR LED, red LED, cam) |
| Ø1.20" Slip Ring for SM1 Lens Tubes and C-Mount Extension Tubes, M4 Tap | Thorlabs | SM1RC/M | |
| Ø12.7 mm Optical Post, SS, M4 Setscrew, M6 Tap, L = 150 mm | Thorlabs | TR150/M | |
| Ø12.7 mm Optical Post, SS, M4 Setscrew, M6 Tap, L = 40 mm | Thorlabs | TR40/M | |
| Right-Angle Clamp for Ø1/2" Posts, 5 mm Hex | Thorlabs | RA90/M | |
| M6 x 1.0 Stainless Steel Cap Screw, 16 mm Long, Pack of 25 | Thorlabs | SH6MS16 | screws for mount onto base |
| USB-6001 14-Bit 20 kS/s Multifunction I/O and NI-DAQmx | National Instruments | 782604-01 | Red LED spotlight controller |
| 20k Ohm 1 Gang Linear Panel Mount Potentiometer | TT Electronics/BI | P230-2EC22BR20K | fintuner for indicator |
| IR (860nm) emitter, 100 mA radial | Osram | 475-1365-ND | Red light indicator |
| cable | - | - | Misc |
| All-trans retinal | Sigma | R2625 | |
| Ethanol absolute | Vwr | 20821.296 | |
| Halocarbon Oil 27 | Sigma | H8773 | |
| Mowiol | Merk | 81381 | |
| Paraformaldehyde | Sigma | F8775 | |
| Phosphate buffered saline (PBS) | Sigma | P5493 | |
| Sylgard 184 silicone elastomer base | Dow Corning Corp | 4019862 | |
| Sylgard 184 silicone elastomer curing agent | Dow Corning Corp | 4019862 | |
| Triton X-100 | Sigma | T8787 | |
| Chicken anti-GFP antibodies | Rockland | 600-901-215 | Antibodies |
| Goat Dylight anti-Chicken | Abcam | ab96947 | |
| FM7a, B | BDSC | RRID:BDSC_785 | X chromosome |
| FRT19A[hs-neo] | BDSC | RRID:BDSC_1709 | |
| hiw[ΔN] | BDSC | RRID:BDSC_51637 | |
| hs-FLP[12] | BDSC | RRID:BDSC_1929 | |
| tub-Gal80[LL1] | BDSC | RRID:BDSC_5132 | |
| w[1118] | BDSC | RRID:BDSC_3605 | |
| 20xUAS-IVS-CsChrimson::mVenus | BDSC | RRID:BDSC_55135 | 2nd chromosome |
| 5xUAS-Gal4[12B] | Kyoto | RRID:Kyoto_108492 | |
| 5xUAS-HA::dnmnat | BDSC | RRID:BDSC_39702 | |
| 5xUAS-mCD8::GFP[LL5] | BDSC | RRID:BDSC_5134 | |
| ase-FLP[2d] | Freeman laboratory | Neukomm et al., 2014 (PNAS) | |
| CyO | BDSC | RRID:BDSC_2555 | |
| dpr1-Gal4 | BDSC | RRID:BDSC_25083 | |
| OR22a-Gal4 | BDSC | RRID:BDSC_9952 | |
| ey-FLP[6] | BDSC | RRID:BDSC_5577 | 3rd chromosome |
| GMR60E02-Gal4 | BDSC | RRID:BDSC_39250 | |
| TM3,Sb,e | BDSC | RRID:BDSC_3644 |
References
- Matsuda, W., et al. Single Nigrostriatal Dopaminergic Neurons Form Widely Spread and Highly Dense Axonal Arborizations in the Neostriatum. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 29 (2), 444-453 (2009).
- Wedel, M. J. A Monument of Inefficiency: The Presumed Course of the Recurrent Laryngeal Nerve in Sauropod Dinosaurs. Acta Palaeontologica Polonica. 57 (2), 251-256 (2012).
- Mariano, V., Domínguez-Iturza, N., Neukomm, L. J., Bagni, C. Maintenance mechanisms of circuit-integrated axons. Current Opinion in Neurobiology. 53, 162-173 (2018).
- Conforti, L., Gilley, J., Coleman, M. P. Wallerian degeneration: an emerging axon death pathway linking injury and disease. Nature reviews Neuroscience. 15 (6), 394-409 (2014).
- Neukomm, L. J., Freeman, M. R. Diverse cellular and molecular modes of axon degeneration. Trends in Cell Biology. 24 (9), 515-523 (2014).
- Gustavsson, A., et al. Cost of disorders of the brain in Europe 2010. European Neuropsychopharmacology: The Journal of the European College of Neuropsychopharmacology. 21 (10), 718-779 (2011).
- Waller, A. Experiments on the Section of the Glossopharyngeal and Hypoglossal Nerves of the Frog, and Observations of the Alterations Produced Thereby in the Structure of Their Primitive Fibres. Philosophical Transactions of the Royal Society of London. 140, 423-429 (1850).
- Rosell, A. L., Neukomm, L. J. Axon death signalling in Wallerian degeneration among species and in disease. Open Biology. 9 (8), 190118(2019).
- Mack, T. G., et al. Wallerian degeneration of injured axons and synapses is delayed by a Ube4b/Nmnat chimeric gene. Nature Neuroscience. 4 (12), 1199-1206 (2001).
- Osterloh, J. M., et al. dSarm/Sarm1 is required for activation of an injury-induced axon death pathway. Science. 337 (6093), New York, NY. 481-484 (2012).
- Xiong, X., et al. The highwire ubiquitin ligase promotes axonal degeneration by tuning levels of nmnat protein. PLoS Biology. 10 (12), 1001440(2012).
- Neukomm, L. J., et al. Axon Death Pathways Converge on Axundead to Promote Functional and Structural Axon Disassembly. Neuron. 95 (1), 78-91 (2017).
- MacDonald, J. M., et al. The Drosophila cell corpse engulfment receptor Draper mediates glial clearance of severed axons. Neuron. 50 (6), 869-881 (2006).
- Neukomm, L. J., Burdett, T. C., Gonzalez, M. A., Zuchner, S., Freeman, M. R. Rapid in vivo forward genetic approach for identifying axon death genes in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 111 (27), 9965-9970 (2014).
- Lu, T. Y., et al. Axon degeneration induces glial responses through Draper-TRAF4-JNK signalling. Nature Communications. 8, 14355(2017).
- Lunn, E. R., Perry, V. H., Brown, M. C., Rosen, H., Gordon, S. Absence of Wallerian Degeneration does not Hinder Regeneration in Peripheral Nerve. The European Journal of Neuroscience. 1 (1), 27-33 (1989).
- Adalbert, R., et al. A rat model of slow Wallerian degeneration (Wld(S)) with improved preservation of neuromuscular synapses. The European Journal of Neuroscience. 21 (1), 271-277 (2005).
- Martin, S. M., O'Brien, G. S., Portera-Cailliau, C., Sagasti, A. Wallerian degeneration of zebrafish trigeminal axons in the skin is required for regeneration and developmental pruning. Development. 137 (23), Cambridge, England. 3985-3994 (2010).
- Feng, Y., et al. Overexpression of Wld(S) or Nmnat2 in Mauthner Cells by Single-Cell Electroporation Delays Axon Degeneration in Live Zebrafish. Journal of Neuroscience Research. 88 (15), 3319-3327 (2010).
- Gilley, J., Coleman, M. P. Endogenous Nmnat2 is an essential survival factor for maintenance of healthy axons. PLoS Biology. 8 (1), 1000300(2010).
- Babetto, E., Beirowski, B., Russler, E. V., Milbrandt, J., DiAntonio, A. The Phr1 ubiquitin ligase promotes injury-induced axon self-destruction. Cell Reports. 3 (5), 1422-1429 (2013).
- Gerdts, J., Summers, D. W., Sasaki, Y., DiAntonio, A., Milbrandt, J. Sarm1-mediated axon degeneration requires both SAM and TIR interactions. The Journal of Neuroscience. 33 (33), 13569-13580 (2013).
- Gerdts, J., Brace, E. J., Sasaki, Y., DiAntonio, A., Milbrandt, J. SARM1 activation triggers axon degeneration locally via NAD+ destruction. Science. 348 (6233), New York, NY. 453-457 (2015).
- Bridge, P. M., et al. Nerve crush injuries--a model for axonotmesis. Experimental Neurology. 127 (2), 284-290 (1994).
- Maxwell, W. L., Bartlett, E., Morgan, H. Wallerian Degeneration in the Optic Nerve Stretch-Injury Model of Traumatic Brain Injury: A Stereological Analysis. Journal of Neurotrauma. 32 (11), 780-790 (2015).
- Fang, Y., Soares, L., Teng, X., Geary, M., Bonini, N. M. A novel Drosophila model of nerve injury reveals an essential role of Nmnat in maintaining axonal integrity. Current Biology. 22 (7), 590-595 (2012).
- Janelia Farm Adult Drosophila Brain Dissection. , Available from: https://www.janelia.org/project-team/flylight/protocols (2015).
- Cold Spring Harbor. Mowiol mounting medium. Cold Spring Harbor Protocols. 2006 (1), (2006).
- Seeds, A. M., et al. A suppression hierarchy among competing motor programs drives sequential grooming in Drosophila. eLife. 3, 02951(2014).
- Hampel, S., Franconville, R., Simpson, J. H., Seeds, A. M. A neural command circuit for grooming movement control. eLife. 4, 08758(2015).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker for studies of gene function in neuronal morphogenesis. Neuron. 22 (3), 451-461 (1999).
- Vosshall, L. B., Wong, A. M., Axel, R. An olfactory sensory map in the fly brain. Cell. 102 (2), 147-159 (2000).
- Hampel, S., McKellar, C. E., Simpson, J. H., Seeds, A. M. Simultaneous activation of parallel sensory pathways promotes a grooming sequence in Drosophila. eLife. 6, (2017).
- Farley, J. E., et al. Transcription factor Pebbled/RREB1 regulates injury-induced axon degeneration. Proceedings of the National Academy of Sciences of the United States of America. 23 (6), (2018).
- Wang, H., et al. Rapid depletion of ESCRT protein Vps4 underlies injury-induced autophagic impediment and Wallerian degeneration. Science Advances. 5 (2), 4971(2019).
- Dietzl, G., et al. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 448 (7150), 151-156 (2007).
- Port, F., et al. A large-scale resource for tissue-specific CRISPR mutagenesis in Drosophila. bioRxiv. 102, 636076(2019).
- Vagnoni, A., Hoffmann, P. C., Bullock, S. L. Reducing Lissencephaly-1 levels augments mitochondrial transport and has a protective effect in adult Drosophila neurons. Journal of Cell Science. 129 (1), 178-190 (2016).
- Vagnoni, A., Bullock, S. L. A cAMP/PKA/Kinesin-1 Axis Promotes the Axonal Transport of Mitochondria in Aging Drosophila Neurons. Current Biology. 28 (8), 1265-1272 (2018).
- Cao, X., et al. In vivo imaging reveals mitophagy independence in the maintenance of axonal mitochondria during normal aging. Aging Cell. 16 (5), 1180-1190 (2017).
- Smith, G. A., et al. Glutathione S-Transferase Regulates Mitochondrial Populations in Axons through Increased Glutathione Oxidation. Neuron. 103 (1), 52-65 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved