Method Article
Morphologische und funktionelle Bewertung von Axonen und ihren Synapsen während des Axon-Todes bei Drosophila melanogaster
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier stellen wir Protokolle zur Verfügung, um drei einfache verletzungsinduzierte Axondegeneration (Axontod) Assays in Drosophila melanogaster durchzuführen, um die morphologische und funktionelle Konservierung von abgetrennten Axonen und ihren Synapsen zu bewerten.
Zusammenfassung
Axondegeneration ist ein gemeinsames Merkmal bei neurodegenerativen Erkrankungen und wenn Nervensysteme durch mechanische oder chemische Kräfte herausgefordert werden. Unser Verständnis der molekularen Mechanismen, die der Axondegeneration zugrunde liegen, bleibt jedoch begrenzt. Die verletzungsbedingte Axondegeneration dient als einfaches Modell, um zu untersuchen, wie abgetrennte Axone ihre eigene Demontage durchführen (Axontod). In den letzten Jahren wurde eine evolutionär konservierte Axon-Todessignal-Kaskade von Fliegen zu Säugetieren identifiziert, die erforderlich ist, damit das getrennte Axon nach Verletzungen degeneriert. Umgekehrt führt die abgeschwächte Axon-Todessignalisierung zu einer morphologischen und funktionellen Konservierung von abgetrennten Axonen und deren Synapsen. Hier stellen wir drei einfache und kürzlich entwickelte Protokolle vor, die die Beobachtung der axonalen Morphologie oder axonalen und synaptischen Funktion von abgetrennten Axonen ermöglichen, die vom neuronalen Zellkörper abgeschnitten wurden, in der Fruchtfliege Drosophila. Morphologie kann im Flügel beobachtet werden, wo eine Teilverletzung zum Axontod nebeneinander von unverletzten Kontrollaxonone innerhalb desselben Nervenbündels führt. Alternativ kann auch die axonale Morphologie im Gehirn beobachtet werden, wo das gesamte Nervenbündel einem Axontod durch Antennenablation durchläuft. Die funktionelle Konservierung von abgetrennten Axonen und deren Synapsen kann durch einen einfachen optogenetischen Ansatz in Verbindung mit einem postsynaptischen Pflegeverhalten beurteilt werden. Wir präsentieren Beispiele mit einer Highwire Loss-of-Function-Mutation und durch überexzessende dnmnat,beide in der Lage, axon Tod für Wochen bis Monate zu verzögern. Wichtig ist, dass diese Protokolle über Verletzungen hinaus verwendet werden können; sie erleichtern die Charakterisierung neuronaler Erhaltungsfaktoren, axonalen Transports und axonaler Mitochondrien.
Einleitung
Die morphologische Integrität von Neuronen ist wesentlich für die nachhaltige Funktion des Nervensystems im Laufe des Lebens. Die überwiegende Mehrheit des neuronalen Volumens wird von Axonen1,2genommen; Damit ist die lebenslange Aufrechterhaltung besonders langer Axone eine große biologische und bioenergetische Herausforderung für das Nervensystem. Es wurden mehrere axonal-intrinsische und glial-extrinsische Unterstützungsmechanismen identifiziert, die ein lebenslanges axonales Überleben gewährleisten. Ihre Beeinträchtigung führt zu Axondegeneration3, die ein gemeinsames Merkmal des Nervensystems bei Krankheiten herausgefordert ist, und durch mechanische oder chemische Kräfte4,5. Die zugrunde liegenden molekularen Mechanismen der Axondegeneration bleiben jedoch in jedem Zusammenhang schlecht verstanden, was die Entwicklung wirksamer Behandlungen zur Blockierung von Axonverlusten schwierig macht. Die Entwicklung wirksamer Therapien gegen diese neurologischen Erkrankungen ist wichtig, da sie eine enorme Belastung in unserer Gesellschaft verursachen6.
Die verletzungsbedingte Axondegeneration dient als einfaches Modell, um zu untersuchen, wie abgetrennte Axone ihre eigene Demontage durchführen. Die Wallerische Degeneration (WD), die 1850 von Augustus Waller entdeckt und nach Augustus Waller benannt wurde, ist ein Oberbegriff, der zwei unterschiedliche, molekular trennbare Prozesse umfasst7. Erstens führen Axone, die von ihren Zellkörpern getrennt sind, nach axonaler Verletzung aktiv ihre eigene Selbstzerstörung (Axontod) durch einen evolutionär konservierten Axontod, der kaskadiert, innerhalb eines Tages nach Verletzung8. Zweitens greifen umliegende Glia und spezialisierte Phagozyten innerhalb von drei bis fünf Tagen in die resultierenden axonalen Trümmer ein und räumen sie. Die Dämpfung der Axon-Todessignalisierung führt zu abgetrennten Axonen, die wochenlang erhalten bleiben9,10,11,12, während die Dämpfung der gliaalen Verschlangen in axonalen Trümmern gipfelt, die wochenlang in vivo13,14,15anhält.
Die Forschung an Fliegen, Mäusen, Ratten und Zebrafischen ergab mehrere evolutionär konservierte und wesentliche Vermittler des Axon-Todes, die8signalisieren. Axon-Todesmutanten enthalten abgetrennte Axone und Synapsen, die nicht axontoden; sie bleiben morphologisch und funktionell für Wochen erhalten, in Abwesenheit von Zellkörperunterstützung9,10,12,13,16,17,18,19,20,21,22,23. Die Entdeckung und Charakterisierung dieser Mediatoren führte zur Definition eines molekularen Pfades, der den Axontod ausführt. Wichtig ist, dass die Axon-Todessignalisierung nicht nur aktiviert wird, wenn das Axon geschnitten, zerkleinert oder gedehnt wird24,25; es scheint auch ein Beitrag zu verschiedenen Tiermodellen von neurologischen Erkrankungen zu sein (z.B. wo Axone in einer verletzungsunabhängigen Art und Weise degenerieren4, aber mit einer Reihe von positiven Ergebnissen4,8). Daher könnte das Verständnis, wie der Axontod die Axondegeneration nach verletzungen ausführt, Erkenntnisse über ein einfaches Verletzungsmodell hinaus bieten; sie könnte auch Ziele für therapeutische Interventionen liefern.
Die Fruchtfliege Drosophila melanogaster (Drosophila) hat sich als ein unschätzbares System für die Axon-Todessignalisierung erwiesen. Die Forschung in der Fliege ergab vier wesentliche evolutionär konservierte Axon-Todesgene: Highwire (hiw)11,14, dnmnat12,26, dsarm10 und axundead (axed)12. Die Modifikation dieser Mediatoren — Funktionsverlustmutationen von hiw, dsarm und axedund Überexpression von dnmnat – blockiert den Axontod für die Lebensdauer der Fliege. Während abgetrennte wilde Typ Axone innerhalb von 1 Tag Axontod erleiden, bleiben abgetrennte Axone und ihre Synapsen ohne Hiw, Dsarm oder Axed nicht nur morphologisch, sondern auch funktionell über Wochen erhalten. Ob die funktionelle Konservierung auch durch hohe Dnmnat-Werte erreicht werden kann, muss noch ermittelt werden.
Hier werden wir drei einfache und kürzlich entwickelte Protokolle zur Untersuchung des Axontodes (z. B. Morphologie und Funktion von abgetrennten Axonen und deren Synapsen im Laufe der Zeit) ohne Zellkörperunterstützung vorstellen. Wir zeigen, wie ein abgeschwächter Axontod zu abgetrennten Axonen führt, die morphologisch mitOEeiner Hiw-Verlust-funktions-Mutation (hiwN) konserviert werden und wie ein abgeschwächter Axontod zu abgetrennten Axonen und Synapsen führt, die mindestens 7 Tage lang mit einer über-Expression von dnmnat (dnmnatOE ) funktional erhalten bleiben. hiw Diese Protokolle ermöglichen die Beobachtung einzelner axonaler und synaptischer Morphologieentweder im zentralen oder peripheren Nervensystem (ZNS bzw. PNS)13,14, während die funktionelle Konservierung von abgetrennten Axonen und deren Synapsen im ZNS durch die Verwendung eines einfachen optogenetischen Setups kombiniert mit Derprägung als Verhaltensauslese12visualisiert werden kann.
Protokoll
1. Beobachtung der Axonmorphologie während des Axon-Todes im PNS
- Flügelverletzung: Teilverletzung von Axonbündeln
- Verwenden Sie 5 jungfräuliche Weibchen und 5 Männchen aus dem rechten Genotyp(Abbildung 4A, P0-Generation), um Kreuze bei Raumtemperatur (RT) durchzuführen. Übergeben Sie P0 alle 3 bis 4 Tage in neue Fläschchen. Sammeln Sie täglich frisch geschlossene Nachkommen (F1 Generation) und altern Sie sie für 7-14 Tage.
- Anästhesisiert Fliegt auf CO2-Pads. Verwenden Sie eine Mikroschere, um die vordere Flügelvene etwa in der Mitte des Flügels zu schneiden (Abbildung 1A). Verwenden Sie einen Flügel für die Verletzung und den anderen Flügel als altersgerechte sende, unverletzte Kontrolle. Tragen Sie eine Verletzung pro Flügel auf, und stellen Sie sicher, dass genügend Flügel verletzt (ca. 15 Flügel).
HINWEIS: Der gesamte Flügel kann durchgeschnitten werden, aber es genügt, nur die vordere Flügelvene zu schneiden. Dies ist der stärkste Teil des Flügels. - Die Fliegen in lebensmittelhaltigen Fläschchen wiederherstellen.
- Flügelsemitschnitt und Visualisierung von Axonen
- 10 l Halocarbonöl 27 mit einer Pipette entlang einer ganzen Glasrutsche verteilen (Abbildung 1B).
- Schneiden Sie den Verletzten sowie den unverletzten Kontrollflügel zu den gewünschten Zeitpunkten ab (z. B. 1 oder 7 Tage nach der Verletzung). Verwenden Sie Mikroschere zu schneiden, und Pinzette, um den Flügel zu greifen. Montieren Sie maximal 4 Flügel in Halocarbonöl 27 (Abbildung 1B) und bedecken Sie sie mit einem Deckelschlitten.
- Stellen Sie den Flügel sofort mit einem sich drehenden Scheibenmikroskop ab. Erfassen Sie eine Reihe von optischen Abschnitten entlang der Z-Achse mit 0,33 m Schrittgröße und komprimieren Sie Z-Stacks für nachfolgende Analysen in eine einzige Datei.
HINWEIS: Greifen Sie nicht die vordere Flügelvene, in der Zellkörper und Axone untergebracht sind. Schnappen Sie sich den Flügel in der Mitte. Das Gewebe in den Flügeln ist nicht fixiert; halten Sie die Zeit von der Montage von Flügeln bis zur Abbildung dieser unter 8 min.
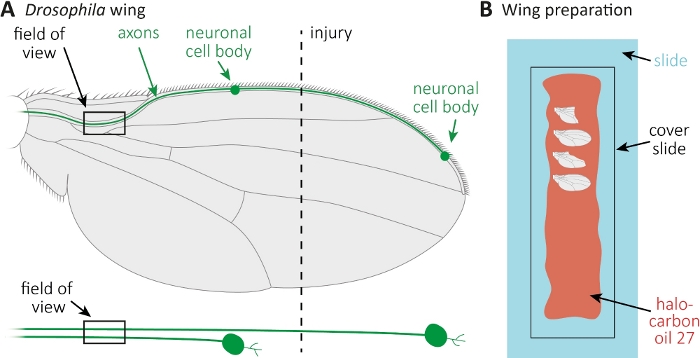
Abbildung 1: Beobachtung der Axonmorphologie beim Axontod im Flügel. (A) Schematische Fliegenflügel mit zwei spärlich GFP-markierten sensorischen Neuronen, die auch unten separat angegeben sind. Der Ort der Verletzung und das Beobachtungsfeld sind angegeben. (B) Schematische Einrichtung für Flügelbildgebung. Verletzte und unverletzte Steuerflügel (grau) sind in Halocarbonöl 27 (rot) auf einer Glasrutsche (hellblau) montiert und mit einem Deckelschlitten (schwarz) bedeckt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Beobachtung der Axon- und Synapsenmorphologie während des Axon-Todes im ZNS
- Antennenablation: Verletzung ganzer Axonbündel
- Verwenden Sie 5 jungfräuliche Weibchen und 5 Männchen aus dem rechten Genotyp(Abbildung 5A, P0-Generation), um Kreuze bei RT durchzuführen. Pass P0 in neue Fläschchen alle 3 bis 4 Tage. Sammeln Sie täglich frisch geschlossene Nachkommen (F1 Generation) und lassen Sie sie 7 bis 14 Tage altern.
- Anästhesisiert Fliegt auf CO2-Pads. Verwenden Sie Pinzette, um das rechte3rd Antennensegment für einseitige Ablation abzutragen; oder sowohl linke als auch rechte3. Antennensegmente für bilaterale Ablation (Abbildung 2A-C). Dadurch werden GFP-markierte neuronale Zellkörper entfernt, während ihre axonalen Projektionen im ZNS verbleiben.
HINWEIS: Die Antennenablation durchtrennen das gesamte Axonbündel. Wenn eine einseitige Ablation durchgeführt wird, dient das Axonbündel auf der kontralateralen Seite (der unvergären Antenne) als interne Kontrolle. Achten Sie darauf, ausreichende Antennenablationen (ca. 15 Tiere) durchzuführen. - Die Fliegen in lebensmittelhaltigen Fläschchen wiederherstellen.
- Hirnsektion und Visualisierung von Axonen
- Mischen Sie Silikonelastomerbasis (9 ml) und Aushärtungsmittel (1 ml) in einem Volumenverhältnis von 10:1. Jede 5 ml Mischung in eine 35-mm-Gewebekulturplatte geben und die durch Mischen mit sanfter Rührung in der Dunstabzugshaube über Nacht eingeführte Luft reduzieren. Die Mischung verfestigt sich innerhalb von 24 h.
HINWEIS: Dissektionsplatten dürfen nur einmal hergestellt werden und dürfen mehrmals verwendet werden. - Anästhesisieren Sie Fliegen auf CO2-Pads und enthaupten Erwachsene Köpfe mit zwei Pinzette zu den gewünschten Zeitpunkten (z. B. 1 oder 7 Tage nach Antennenablation). Verwenden Sie eine Pinzette, um den Hals zu greifen, und die andere Pinzette, um den Thorax zu fixieren. Ziehen Sie vorsichtig den Hals und Kopf aus dem Thorax.
HINWEIS: Lassen Sie enthauptete2 Köpfe auf dem CO 2-Pad, bis die gewünschte Zahl erreicht ist, aber stellen Sie sicher, dass Sie innerhalb von 30 min mit dem nächsten Schritt fortfahren. - Übertragen Sie alle Köpfe in ein 1,5 ml Mikrozentrifugenrohr, das 1 ml Fixierlösung enthält, die 4% Paraformaldehyd (PFA) und 0,1% Triton X-100 in phosphatgepufferter Salin (PBS) enthält, mit einer Pinzette, die in die Fixierlösung getaucht wurde.
HINWEIS: Fliegenköpfe kleben gut auf nasser Pinzette. Es macht es möglich, alle Köpfe leicht in das Mikrozentrifugenrohr zu übertragen. - Fixköpfe für 20 min mit sanfter Erregung bei RT. Setzen Sie das Mikrozentrifugenrohr auf Eis, Köpfe gravitieren auf den Boden des Mikrozentrifugenrohrs. Entfernen Sie den Überstand mit einer Pipette und wiederholen Sie diesen Vorgang mit fünf 2 min Waschungen mit 1 ml Waschpuffer, der 0,1% Triton X-100 in PBS mit sanfter Rührung bei RT enthält, um Restbefestigungslösung zu entfernen.
HINWEIS: Videos, wie man erwachsene Drosophila Gehirne sezieren sind leicht verfügbar27. - Die Köpfe mit einer Glaspipette in eine mit Waschpuffer gefüllte Sezierplatte geben. Verwenden Sie eine Pinzette, um den Proboscis vom Kopf zu greifen und zu ziehen, während Sie den Kopf mit der anderen Pinzette halten. Dies wird ein Loch hinterlassen, wenn der Proboscis am Exoskelett befestigt wurde.
- Verwenden Sie zwei Pinzette, um das Exoskelett zwischen dem Loch und jedem zusammengesetzten Auge zu entfernen. Dies macht es möglich, die Kopfstruktur mit beiden Pinzetten zu öffnen und das Gehirn im Inneren sanft zu kratzen.
- Reinigen Sie jedes Gehirn, indem Sie Luftröhrchen oder Fett entfernen, die daran kleben (Abbildung 2D, oben). Sobald das Gehirn gereinigt ist, legen Sie es in ein neues Mikrozentrifugenrohr mit 1 ml Waschpuffer auf Eis.
HINWEIS: Beschädigte oder verlorene optische Lappen haben keinen Einfluss auf den riechigen Lappen in der Mitte des Gehirns(Abbildung 2D, oben). - Ersetzen Sie den Waschpuffer durch 1 ml Befestigungslösung, sobald alle Gehirne gesammelt und an der Unterseite des Mikrozentrifugenrohrs angesammelt sind. Fix Gehirne für 10 min mit Schaukeln bei RT, gefolgt von fünf 2 min Wähungen in 1 ml Waschpuffer mit Schaukeln bei RT.
- Primäre Antikörper (1:500) im Waschpuffer über Nacht mit Schaukeln bei 4 °C auftragen, gefolgt von 10 Wäbungen über 2 h mit 1 ml Waschpuffer mit Schaukeln bei RT.
- Sekundärantikörper (1:500) im Waschpuffer 2 h mit Schaukeln bei RT auftragen und Mikrozentrifugenrohr in Aluminiumfolie wickeln, um Licht zu blockieren. Halten Sie das Mikrozentrifugenrohr für den Rest des Verfahrens mit Aluminiumfolie bedeckt. Tragen Sie zehn Wähen mit 1 ml Waschpuffer über 2 h mit Schaukeln bei RT auf.
- Entfernen Sie den Überstand und verwenden Sie einen einzigen Tropfen Antifade-Reagenz, um das Gehirn in der Mikrozentrifugenröhre zu bedecken. Inkubieren Sie Gehirne für mindestens 30 min bei 4 °C, bevor Sie sie für die Montage und Bildgebung vorbereiten.
- Bereiten Sie eine Deckfolie vor, kleben Sie Laborband darauf und schneiden Sie eine "T"-ähnliche Form aus dem Band aus(Abbildung 2D, unten). Der resultierende Raum dient als Bereich, in den das hirnhaltige Antifade-Reagenz28 eingelassen wird, vorzugsweise in beide Kammern.
HINWEIS: Verwenden Sie eine 20-200 L Pipettenspitze, bei der 3 mm der Spitze abgeschnitten wurden, um die Öffnung der Pipette zu verbreitern. Dies macht es möglich, das hirnhaltige Antifade-Reagenz zu pipette. Bedecken Sie das Gehirn vorsichtig mit einer Abdeckungsfolie. - Verwenden Sie Ton, um zwei kleine gerade Rollen vorzubereiten. Stellen Sie sicher, dass die Tonrollen nicht höher als die Höhe einer Glasrutsche sind. Stecken Sie die Tonrollen auf die Glasrutsche(Abbildung 2D, unten). Legen Sie das hirnhaltige Abdeckungs-Slide-Sandwich auf die Tonrollen.
HINWEIS: GFP-markierte Axone und ihre Synapsen befinden sich in der Vorderseite des Gehirns. Es ist daher einfacher, sie von vorne abzubilden. Allerdings werden Gehirne entweder nach oben oder mit dem Gesicht nach unten auf dem Cover-Slide-Sandwich. Tonrollen dienen als Sandwichhalter, und während der Bildgebung kann das Sandwich auf den Kopf gestellt werden. Dies wird es möglich machen, Bilder von vorne von jedem Gehirn zu erfassen. - Erfassen Sie eine Reihe von optischen Abschnitten entlang der Z-Achse mit einer Schrittgröße von 1,0 m mit einem konfokalen Mikroskop, und komprimieren Sie z-stacks in eine einzige Datei für nachfolgende Analysen, um die Anzahl der intakten axonalen Projektionen zu bewerten.
- Mischen Sie Silikonelastomerbasis (9 ml) und Aushärtungsmittel (1 ml) in einem Volumenverhältnis von 10:1. Jede 5 ml Mischung in eine 35-mm-Gewebekulturplatte geben und die durch Mischen mit sanfter Rührung in der Dunstabzugshaube über Nacht eingeführte Luft reduzieren. Die Mischung verfestigt sich innerhalb von 24 h.
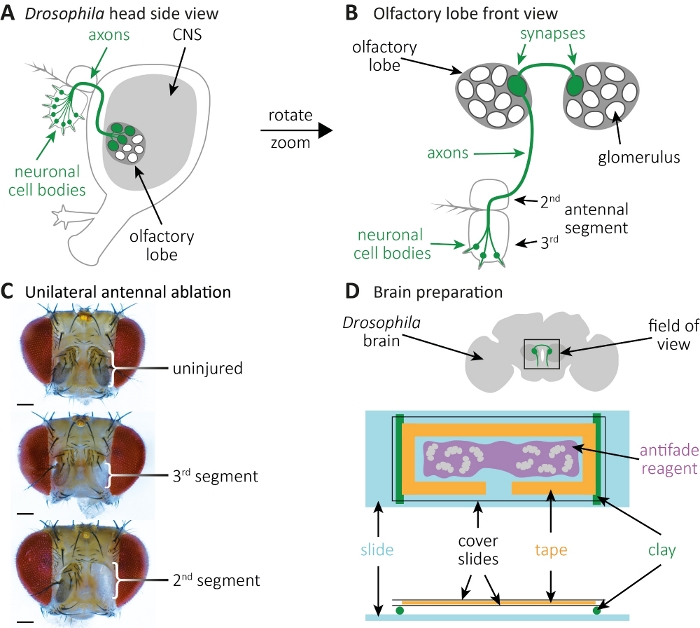
Abbildung 2: Beobachtung der Axon- und Synapsenmorphologie während des Axontodes im Gehirn. (A) Seitenansicht eines schematischen Fliegenkopfes mit GFP-markierten Zellkörpern, Axonen und Synapsen. (B) Hochvergrößerung Sanififs Frontansicht von GPF-markierten olfaktorischen Rezeptorneuronen und ihren Axonen und Synapsen. Zellkörper sind im3. Antennensegment untergebracht, und ihre Axone projizieren in das CNS. Axone bilden Synapsen in einem Glomerulus im linken Olfaktor, überqueren die Mittellinie und bilden Synapsen im Glomerulus auf dem kontralateralen Olfaktor. (C) Beispiele für Fliegenköpfe mit einseitiger Antennenablation. Oben: Unverletzte Kontrolle. Mitte: Ablation des3. Antennensegments. Unten: Ablation des2. (und damit auch3.) Antennensegments. (D) Gehirnvorbereitung. Oben: Schematisch seziertes Fliegenhirn mit angezeigten Olfaktorlappen und axonalen Projektionen im Sichtfeld. Unten: Schematische Einrichtung für die Bildgebung des Gehirns. Zwei Tonrollen (grün) sind auf einer Glasrutsche (hellblau) montiert, sie tragen ein Cover-Slide-Sandwich, das fliegende Gehirne (grau) enthält. Die Gehirne sind in Antifade-Reagenz (lila) montiert, von einem Laborband (orange) umgeben und von zwei Deckrutschen (schwarz) bedeckt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Grooming Induziert durch Optogenetik als Auslese für Axon und Synapse-Funktion
- Optogenetische Einrichtung
- Führen Sie das optogenetische Experiment in einem dunklen Raum durch. Stellen Sie sicher, dass das Setup aus einem 850 nm Infrarot (IR) LED-Strahler besteht, um Fliegen im Dunkeln zu beleuchten(Abbildung 3A),einem blinkenden 660 nm roten LED-Strahler zur Aktivierung von Neuronen, die CsChrimson ausdrücken, und einer monochromen Kamera mit einem 700 nm Langpassfilter, der die Aufnahme von Rotlichtblitzen verhindert.
- Verwenden Sie einen 3D-Drucker, um eine winzige kreisförmige Verhaltenskammer mit einem Durchmesser von 1 cm zu erzeugen, sie mit einem Abdeckschlitten zu bedecken und einen 860 nm Emitter neben den roten LED-Strahler neben die Kammer zu stellen (Abbildung 3B).
HINWEIS: Der Emitter zeigt an, wenn der rote LED-Strahler eingeschaltet ist, wodurch die Neuronen aktiviert werden. - Montieren Sie die LED-Strahler und die Kamera auf der Oberseite der Kammer (Abbildung 3A, C).
- Aktivieren Sie Neuronen um 10 Hz-Blitze während 10 s. Die Dauer der Aktivierung kann entsprechend dem experimentellen Design angepasst werden.
- Vorbereitung von Fliegen für die Optogenetik
- Schmelzfliegenfutter in einer Mikrowelle. Nach dem Abkühlen des Lebensmittels, vor der Erstarrung, 1:100 von 20 mM alle transretinalen in Ethanol (EtOH) auf eine endgültige Konzentration von 200 m hinzufügen. Gut mischen, und gießen Sie das Essen sofort in leere Fläschchen.
HINWEIS: Vermeiden Sie die Zugabe aller transretinalen zu heißen Lebensmitteln, dies könnte zu weniger effizienten Optogenetik führen. - Bedecken Sie Fläschchen mit erstarrten Lebensmitteln mit Steckern oder Baumwollkugeln. Wrap Fläschchen mit Aluminiumfolie. Dann lagern Sie die lebensmittelhaltigen Fläschchen in einem dunklen, kalten Raum.
- Verwenden Sie 5 jungfräuliche Weibchen und 5 Männchen (Abbildung 6A, Generation P0) aus dem rechten Genotyp, um Kreuze bei RT durchzuführen. Pass P0 in neue Fläschchen alle 3 bis 4 Tage. Sammeln Sie täglich frisch geschlossene Erwachsene Nachkommen (Generation F1) und lassen Sie sie 7 bis 14 Tage in aluminiumbedeckten Fläschchen mit 200 M alle transretinalen in Fliegenfutter altern.
- Sammeln Sie Fliegen, indem Sie sie aus lebensmittelhaltigen Fläschchen in eine leere Durchstechflasche ohne Nahrung tippen. Kühlen Sie die Durchstechflasche in eishaltigem Wasser für ca. 30 s. Fliegen werden einschlafen. Legen Sie einzelne Fliegen schnell in kleine Kammern mit einer Abdeckung Folie bedeckt(Abbildung 3B).
HINWEIS: Sobald sich die Fliegen aufwärmen, wachen sie auf. Es ist entscheidend, einzelne Fliegen schnell in einzelne Kammern zu verteilen. Vermeiden2 Sie CO 2-Pads, um Fliegen zu beästhesieren, dies wird ihr Verhalten beeinflussen. - Führen Sie Optogenetik durch, um die Antennenpflege zu entlocken. Hier besteht das Protokoll aus den folgenden Intervallen: 30 s, wo das rote Licht fehlt, gefolgt von 10 s Rotlichtbelichtung bei 10 Hz. Wiederholen Sie diesen Vorgang insgesamt dreimal, gefolgt von einem zusätzlichen 30 s Intervall, in dem das rote Licht fehlt12,29,30.
HINWEIS: Dieses Protokoll kann entsprechend der experimentellen Präferenz angepasst werden. - Sammeln Sie einzelne Fliegen aus jeder Kammer auf CO2 Pads. Unterziehen Sie sie Antennenverletzungen. Abgleich sowohl die linken als auch die rechten 2nd Antennensegmente (Abbildung 2C). Dadurch werden die Zellkörper von Johnstons Organ (JO)-Neuronen entfernt, während die axonalen Projektionen im ZNS verbleiben. Stellen Sie die Fliegen in aluminiumbedeckten Fläschchen mit 200 M all transretinalen Fläschchen wieder her.
HINWEIS: Für die durch die Optogenetik induzierte Antennenpflege sind die sensorischen Neuronenkörper im2. Antennensegment untergebracht (Abbildung 2C). - An entsprechenden Zeitpunkten (z.B. 7 Tage nach antennelablation) fliegt das Subjekt zu einem anderen Pflegetest (zurück zu Schritt 3.2.4).
- Schmelzfliegenfutter in einer Mikrowelle. Nach dem Abkühlen des Lebensmittels, vor der Erstarrung, 1:100 von 20 mM alle transretinalen in Ethanol (EtOH) auf eine endgültige Konzentration von 200 m hinzufügen. Gut mischen, und gießen Sie das Essen sofort in leere Fläschchen.
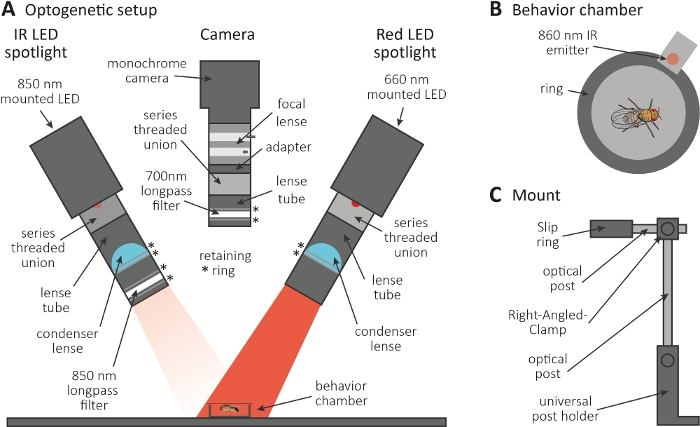
Abbildung 3: Optogenetische Einrichtung, um Diepflege als Auslesung für Axon- und Synapsenfunktion zu induzieren. (A) Abbildung der für die Optogenetik erforderlichen montierten Komponenten. Infrarot (IR) LED-Strahler, Kamera und roter LED-Strahler (von links nach rechts). Die Komponenten mit einer detaillierten Beschreibung sind in der Materialtabelleaufgeführt. (B) Die obere Ansicht zeigt eine Verhaltenskammer einschließlich eines IR-Emitters, um die Rote LED-Strahleraktivierung anzuzeigen. (C) Abbildung eines einzelnen Mount-Setups. Für die beiden LED-Strahler bzw. die Kamera sind insgesamt drei Montage-Setups erforderlich. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Oben beschrieben wir drei Methoden, um die Morphologie und Funktion von abgetrennten Axonen und deren Synapsen zu untersuchen. Die erste Methode ermöglicht eine hochauflösende Beobachtung einzelner Axone im PNS. Es erfordert Klone, die durch die MARCM-Technik14,31generiert werden. Hier führten wir Kreuze durch, um Wildtyp und Highwire-Mutanten MARCM-Klone zu erzeugen (Abbildung 4A). Ein einfacher Schnitt in der Mitte des Flügels induziert Axonverletzungen von Neuronen, die distal untergebracht sind (z. B. an der Außenseite des Flügels), während proximale Neuronen (z. B. zwischen schnittweiser Stelle und Thorax) unverletzt bleiben. Dieser Ansatz macht es möglich, den Axontod Nebeneinander von unverletzten Kontrollaxonten im selben Nervenbündel zu beobachten (Abbildung 1A, Abbildung 4B). Hier verwendeten wir einen genetischen Hintergrund, der zu einer geringen Anzahl von GFP-markierten Klonen führte (z. B. zwei in jedem Experiment14). Wir präsentieren Beispiele von 1 und 7 Tagen nach der Verletzung von wilden Axonen, um Beispiele für Kontrollaxone, Axone, die axontoden, und axonale Fragmente, die durch umliegende Glia gelöscht werden, zu geben. Darüber hinaus wiederholten wir axonale Verletzungen in Hochdrahtmutanten, wo wir das Ergebnis 7 Tage nach der Verletzung analysiert.
Unverletzte Kontrollflügel beherbergen zwei Wild-Typ-Klone, also zwei GFP-markierte Wild-Typ-Axone(Abbildung 4B, Wildtyp, unverletzte Kontrolle). Einen Tag nach dem Schneiden der Mitte des Flügels durch den Einsatz von Mikroscheren wird der Axontod in GFP-markierten Axonen induziert, wo Zellkörper distal zur Schnittstelle sind, während Axone aus proximal untergebrachten Zellkörpern als interne Kontrolle innerhalb desselben Nervenbündels dienen(Abbildung 4B, wilder Typ, 1 Tag nach einer Verletzung). Beachten Sie die axonale Trümmerspur im oberen Teil, die durch den Pfeil angezeigt wird. 7 Tage nach einer axonalen Verletzung wird gfP-markierte Axonablagerungen durch umliegende Glia beseitigt, während GFP-markierte unverletzte Kontrollaxone im Nervenbündel verbleiben(Abbildung 4B, Wildtyp, 7 Tage nach Verletzung, Pfeil). Im Gegensatz dazu bleiben Hochdraht-mutierte Axone, die 7 Tage lang abgetrennt wurden, morphologisch erhalten, im Einklang mit früheren Befunden11,14 (Abbildung 4B, Hochdraht, 7 Tage nach der Verletzung, Pfeil). Diese Ergebnisse zeigen die starke visuelle Auflösung des Drosophila-Flügels. Der Axontod kann nebeneinander von unverletzten Kontrollen im selben Nervenbündel beobachtet werden. Während wilde Axone innerhalb von 1 Tag nach der Verletzung axontoden und die daraus highwire resultierenden Trümmer innerhalb von 7 Tagen beseitigt werden, bleiben Axon-Todesdeuter-Mangel-Hochdrahtmutanten morphologisch für 7 Tage erhalten.

Abbildung 4: Ansatz zur Untersuchung des Axontodes von GFP-markierten sensorischen Neuronaxonen im Flügel. (A) Schematische Kreuze, um Wildtyp- und Highwire-Klone im Flügel zu erzeugen (P0 bzw. F1-Generation). Jungfrauenweibchen sind auf der linken Seite, Männchen auf der rechten Seite. Siehe Tabelle der Materialien für Genotyp-Details. (B) Beispiele für Kontroll- und verletzte GFP-markierte Axone. Das Sichtfeld ist in (Abbildung 1A) angegeben. Von links nach rechts: unverletzte Wildtyp-Kontrollaxone, Wilde-Typ-Axone 1-Tage-Post-Verletzung, highwire Wilde-Typ-Axone 7 Tage nach der Verletzung, Hochdraht-Mutanten-Axone 7 Tage nach der Verletzung. Pfeile zeigen abgetrennte Axone, Skalenleiste = 5 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die zweite Methode beschreibt, wie ganze Axonbündel, die in das ZNS projiziert werden, visualisiert werden, wo sie Synapsen bilden, die zu Neuronen gehören, die sowohl in linken als auch rechten Antennen untergebracht sind (Abbildung 2A-C). Hier führten wir Kreuze durch, um Wildtyp und Highwire-Mutanten MARCM-Klone zu erzeugen (Abbildung 5A). Unverletzte, GFP-markierte Axone und ihre Synapsen können im Laufe von Tagen bis Wochen in Abwesenheit von Verletzungen visualisiert werden(Abbildung 5B, Wild-Typ, unverletzte Kontrolle). Alternativ können Tiere einer3. Antennensegmentablation unterzogen werden, und durchtrennte GFP-markierte Axone und ihre Synapsen können während eines Zeitverlaufs über Stunden bis Tage beobachtet werden. Wir konzentrierten uns auf 7 Tage nach der Antennenablation, weil zu diesem Zeitpunkt Axone und ihre Synapsen Axontod durchgemacht haben, und die daraus resultierenden Trümmer werden durch die umgebende Glia beseitigt. Wenn einseitige Ablation der rechten Antenne durchgeführt wird, dann wird das rechte Axon-Bundle abgetrennt und zerlegt und die resultierenden Trümmer vollständig 7 Tage nach der Verletzung beseitigt(Abbildung 5B, Wildtyp, einseitige Ablation, 7 Tage nach der Verletzung, Pfeile), im Einklang mit früheren Erkenntnissen13. Alternativ können sowohl die rechte als auch die linke Antenne ablated werden, was beide Axonbündel durchtrennen wird, und 7 Tage nach der Verletzung verschwanden Axone und ihre Synapsen(Abbildung 5B, Wildtyp, bilaterale Ablation, 7 Tage nach verletzungsbedingt, Pfeil). Im Gegensatz dazu führt die einseitige Ablation der rechten Antennen in Hochdrahtmutanten zu abgetrennten Axonen, die 7 Tage nach der Verletzung erhalten bleiben, im Einklang mit früheren Befunden11,14 (Abbildung 5B, Hochdraht, einseitige Ablation, 7 Tage nach verletzungsbedingt, Pfeil). Diese Ergebnisse zeigen, dass abgetrennte Wildeaxone axontoden und die daraus resultierenden Trümmer innerhalb highwire von 7 Tagen beseitigt werden, während Axon-Todesdeuter-Mangel-Highwire-Mutationen nicht axontoden und 7 Tage lang morphologisch erhalten bleiben.
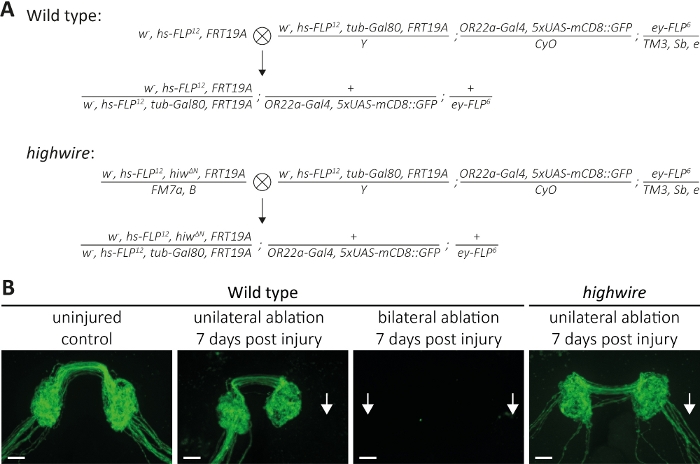
Abbildung 5: Ansatz zur Untersuchung des Axontodes von GFP-markierten sensorischen Neuronaxonen im Gehirn. (A) Schematische Kreuze, um Wildtyp- und Highwire-Klone im Gehirn zu erzeugen (P0 bzw. F1-Generation). Jungfrauenweibchen sind auf der linken Seite, Männchen auf der rechten Seite. Siehe Tabelle der Materialien für Genotyp-Details. (B) Beispiele für Kontroll- und verletzte GFP-markierte Axone. Von links nach rechts: unverletzte Wildtyp-Steuerungen, Wildtyp 7 Tage nach einseitiger Antennenablation, Wildtyp 7 Tage nach bilateraler Antennenablation und Hochdrahtmutanten 7 Tage nach einseitiger Antennenablation. Pfeile zeigen abgetrennte Axonbündel, Scale bar = 10 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die dritte Methode ermöglicht die Beobachtung der funktionellen Konservierung von abgetrennten Axonen und deren Synapsen im ZNS. Es stützt sich auf die Manipulation einer Teilmenge von JO-Neuronen im2. Antennensegment untergebracht, die ausreichen, um Antennenpflege zu induzieren. Expression eines rot-versetzten Kanalrhodopsin (CsChrimson) in JO-Neuronen, kombiniert mit Nahrungsergänzung aller transretinalen, ist ausreichend, um ein einfaches postsynaptisches Pflegeverhalten bei Rotlicht-Exposition12,30zu entlocken. Hier führten wir Kreuze durch, um wildtypige JO-Neuronen zu erzeugen, und JO-Neuronen überexmittiere dnmnat (dnmnatOE) (Abbildung 6A). Wildtyp fliegen oder fliegen JO Neuronen mit abgeschwächtem AxonTod (dnmnatOE), beide beherbergen ein starkes Pflegeverhalten vor Verletzungen. Jedoch, 7 Tage nach der Verletzung (z.B. bilaterale Ablation des2. Antennensegments), Pflege nicht durch Optogenetik in wildArten fliegen aufgrund von Verletzungen-induzierte Axon und Synapsendegeneration ausgelöst werden, während Tiere mit abgeschwächtem Axontod weiterhin zu pflegen (Abbildung 6B, Film 1,2). Abgeschwächter Axontod ist daher in der Lage, abgetrennte Axone und deren Synapsen 7 Tage lang funktionell zu erhalten.

Abbildung 6: Ansatz zur Visualisierung der axonalen und synaptischen Funktion nach der Axotomie. (A) Schematische Kreuze, um wilden Typ und dnmnat überexzessende JO-Sensorneuronen (P0 bzw. F1-Generation) zu erzeugen. Jungfrauenweibchen sind auf der linken Seite, Männchen auf der rechten Seite. Siehe Tabelle der Materialien für Genotyp-Details. (B) Individuelle Ethogramme des Pflegeverhaltens, die durch Optogenetik induziert werden. Oben: Einzelne Ethogramme der Wildfliegen vor und 7 Tage nach der Verletzung (blau). Unten: einzelne Ethogramme von Fliegen überexzessiierend dnmnat (dnmnatOE) in JO Neuronen vor und 7 Tage nach der Verletzung (rot). Jeder Behälter zeigt mindestens 1 Pflegeverhalten innerhalb von 1 s an. Die schwarze Linie gibt die Summe aller Abschnitte an. (C) Quantifizierung des Pflegeverhaltens. Die Daten werden als durchschnittliche Standardabweichung, p > 0,001 (einwegige ANOVA, mehrfacher Vergleich mit Tukeys Post-hoc-Test) angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Film 1: Repräsentatives Wildtyp-Grooming-Verhalten, das durch Optogenetik vor und 7 Tage nach der Antennenablation ausgelöst wird. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Film 2: Repräsentatives Pflegeverhalten, das durch Optogenetik bei Fliegen ausgelöst wird, die Dnmnat in JO-Neuronen vor und 7 Tage nach der Antennenablation überausdrücken. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Diskussion
Die hier beschriebenen Protokolle ermöglichen die robuste und reproduzierbare Beobachtung der Morphologie sowie die Funktion von Axonen und ihren Synapsen, die von ihren Zellkörpern in Drosophilagetrennt sind. Der Flügeltest erleichtert die Beobachtung des Axontodes nebeneinander von unverletzten Kontrollaxonten im PNS14, während der Antennentest die Beobachtung ganzer Nervenbündel von GFP-markierten Axonen und deren Synapsen erleichtert, um sowohl die Morphologie als auch die Funktion im Gehirn (CNS) zu beurteilen12. Es gibt kritische Schritte und gewisse Vorteile für jeden Ansatz zur Untersuchung der Morphologie, die bei der Entwicklung von Experimenten berücksichtigt werden müssen.
Um die Axonmorphologie in den PNS im Flügel zu beobachten, können Experimente aufgrund der Transparenz des Flügels leicht durchgeführt werden: es ermöglicht, Die Sezieren und Immunhistochemie zu umgehen. Aufgrund der fehlenden Fixierung müssen die Flügel jedoch unmittelbar nach der Montage14abgebildet werden. Derzeit werden zwei unterschiedliche Gal4-Treiber häufig verwendet, entweder ok371Gal4 oder dpr1Gal4, und beide Referenzen bieten unterschiedliche Ansätze zur Quantifizierung der Degeneration14,26. Die spärliche Kennzeichnung einiger Neuronen wird empfohlen, indem "Mosaikanalyse mit einem repressiblen Zellmarker (MARCM)"14,31verwendet wird, da die Auflösung der axonalen Morphologie beispiellos ist. Im Gegensatz dazu ist die Beobachtung von Synapsen in Flügeln nicht möglich, sie befinden sich in der ventralen Nervenschnur im Thorax der Fliegen. Darüber hinaus können zusätzliche axonale Marker nicht durch Immunhistochemie visualisiert werden: Die wachsartige Nagelhaut macht die Diffusion von Fixativen und Antikörpern in das darunter liegende Gewebe unmöglich.
Um die Axon- und Synapsenmorphologie im ZNS zu beobachten, müssen Hirnsektionen durchgeführt werden. Sie bieten den Vorteil der Visualisierung zusätzlicher axonaler und synaptischer Marker durch den Einsatz von Immunhistochemie, und Synapsen können neben Axonen im gleichen Sichtfeld beobachtet werden10,13. Eine große Sammlung von charakterisierten olfaktorischen Rezeptor neuron (ORN) Gal4 Treiber ist leicht verfügbar32, und häufig, OR22aGal4 ist der Treiber der Wahl. Für die Antennenablation sind Zellkörper von OR22a-Neuronen im3. Segment untergebracht (Abbildung 2B). Eine fluoreszenzintensitätsbasierte Quantifizierung wird verwendet, um die Degeneration von Axonen oder Synapsen13zu quantifizieren. Umgekehrt sind Experimente aufgrund von Hirnsektion und Antikörperfärbung zeitaufwändig.
Um die axonale und synaptische Funktion nach der Axotomie zu visualisieren, wird die Optogenetik verwendet, um die Antennenpflege auszulösen: Sie dient als Auslese für die funktionelle Konservierung von abgetrennten Axonen und ihren Synapsen12. Die Pflegeschaltung und die entsprechenden sensorischen, inter- und motorneurongal4 Treiber wurden ausführlich beschrieben29,30. GMR60E02Gal4 beschriftet eine Teilmenge von Johnstons Organ (JO) sensorischen Neuronen, die erforderlich sind und ausreichend für die Pflege29,30. Für die Antennenablation sind Zellkörper von JO-Neuronen im2. Antennensegment untergebracht (Abbildung 2B). Ein optogenetisches Setup kann leicht von Grund auf neu aufgebaut oder ein vorhandenes Setup angepasst werden. Wichtig ist, dass Experimente in einem dunklen Raum durchgeführt werden müssen und Fliegen, die so mit einem Infrarot-LED-Strahler (IR) visualisiert werden. Bei der Verwendung von CsChrimson als Kanal ist es wichtig, die Nahrung mit allen transretinalen und einem roten LED-Strahler zu versorgen, um JO Neuronen29zu aktivieren. Alternativ können blaue lichtempfindliche Kanäle und ein blauer LED-Strahler oder der TrpA1-Kanal und die Temperatur für die neuronale Aktivierung29,33verwendet werden. Die Quantifizierung des Pflegeverhaltens wurde bereits beschrieben12,29.
Wenn diese Assays speziell verwendet werden, um den Axontod zu untersuchen, ist es wichtig zu beachten, dass der Phänotyp der morphologischen oder funktionellen Konservierung im Laufe der Zeit robust sein sollte. Es gibt Fälle, in denen der Axontod zu einem konsistenten, aber weniger ausgeprägten Phänotyp in der morphologischen Konservierung34,35führt und ob ein solcher Phänotyp sich in funktionelle Konservierung niederschlägt, bleibt noch zu bestimmen.
Axon-Todesphänotypen wurden auch in Neuronen während der Entwicklung von Drosophila Larven beobachtet, wo Nerven zerquetscht wurden, anstatt verletzt11,23. Hier konzentrierten wir uns speziell auf erwachsene Drosophila Neuronen, die die Entwicklung abgeschlossen. In diesem Zusammenhang kann die Verwendung von RNA-Interferenzen36oder gewebespezifischem CRISPR/Cas937 problemlos umgesetzt werden. Wichtig ist, dass die oben genannten Techniken in einem axontodunabhängigen Kontext verwendet werden können: Sie erleichtern die Charakterisierung der neuronalen Erhaltungsfaktoren38, axonalen Transport39, altersabhängige axonale Mitochondrien veränderungen40, und Morphologie der axonalen Mitochondrien41.
Offenlegungen
Die Autoren erklären, dass sie nichts zu offenbaren haben.
Danksagungen
Wir bedanken uns beim gesamten Neukomm-Labor für die Beiträge. Diese Arbeit wurde unterstützt durch einen Assistant Professor Award (Stipendium 176855), die Internationale Stiftung für Paraplegieforschung (IRP, Stipendium P180), SNF Spark (Stipendium 190919) und mit Unterstützung der Universität Lausanne und die Abteilung für Neurowissenschaften (Tat de Vaud) an die LJN.
Materialien
| Name | Company | Catalog Number | Comments |
| Tweezers (high precision, ultra fine) | EMS | 78520-5 | Antennal ablation |
| MicroPoint Scissors (5-mm cutting edge) | EMS | 72933-04 | Wing injury |
| 1.5 mL microcentrifuge tube | Eppendorf | 30120086.0000 | |
| 35mm tissue culture dish | Sarstedt | 83.3900 | |
| Cover Slips, Thickness 1 | Thermo Scientific™ | BB02400600A113MNT0 | |
| Superfrost Microscope Slides | Thermo Scientific™ | AA00008032E00MNT10 | |
| High-Sensitivity USB 2.0 CMOS Camera, 1280 x 1024, Global Shutter | Thorlabs | DCC1240M | Camera setup |
| SM1 Retaining Ring for Ø1" Lens Tubes and Mounts | Thorlabs | SM1RR | |
| 25mm 1/1.2" C mount Lens | Tamron | M112FM25 | |
| Adapter with External M27 x 0.5 Threads and Internal SM1 Threads | Thorlabs | SM1A36 | |
| Aspheric Condenser Lens, Ø25 mm, f=20.1 mm, NA=0.60, ARC: 650-1050 nm | Thorlabs | ACL2520U-B | |
| Ø25.0 mm Premium Longpass Filter, Cut-On Wavelength: 700 nm | Thorlabs | FELH0700 | |
| SM1 (1.035"-40) Coupler, External Threads, 0.5" Long | Thorlabs | SM1T2 | |
| SM1 Lens Tube Without External Threads, 1" Long, Two Retaining Rings Included | Thorlabs | SM1M10 | |
| 850 nm, 900 mW (Min) Mounted LED, 1200 mA | Thorlabs | M850L3 | IR LED spotlight |
| SM1 (1.035"-40) Coupler, External Threads, 0.5" Long | Thorlabs | SM1T2 | |
| SM1 Lens Tube Without External Threads, 2" Long, Two Retaining Rings Included | Thorlabs | SM1M20 | |
| Aspheric Condenser Lens, Ø25 mm, f=20.1 mm, NA=0.60, ARC: 650-1050 nm | Thorlabs | ACL2520U-B | |
| Ø25.0 mm Premium Longpass Filter, Cut-On Wavelength: 850 nm | Thorlabs | FELH0850 | |
| SM1 Retaining Ring for Ø1" Lens Tubes and Mounts | Thorlabs | SM1RR | |
| 660 nm, 940 mW (Min) Mounted LED, 1200 mA | Thorlabs | M660L4 | Red LED spotlight |
| Aspheric Condenser Lens, Ø25 mm, f=20.1 mm, NA=0.60, ARC: 650-1050 nm | Thorlabs | ACL2520U-B | |
| SM1 (1.035"-40) Coupler, External Threads, 0.5" Long | Thorlabs | SM1T2 | |
| SM1 Lens Tube Without External Threads, 2" Long, Two Retaining Rings Included | Thorlabs | SM1M20 | |
| 15 V, 2.4 A Power Supply Unit with 3.5 mm Jack Connector for One K- or T-Cube | Thorlabs | KPS101 | LED control |
| T-Cube LED Driver, 1200 mA Max Drive Current | Thorlabs | LEDD1B | |
| 150 mm x 300 mm x 12.7 mm Aluminum Breadboard, M6 Double-Density Taps | Thorlabs | MB1530/M | Mount base |
| Ø12.7 mm Universal Post Holder, Spring-Loaded Locking Thumbscrew, L = 75 mm | Thorlabs | UPH75/M | Mount, 3x (IR LED, red LED, cam) |
| Ø1.20" Slip Ring for SM1 Lens Tubes and C-Mount Extension Tubes, M4 Tap | Thorlabs | SM1RC/M | |
| Ø12.7 mm Optical Post, SS, M4 Setscrew, M6 Tap, L = 150 mm | Thorlabs | TR150/M | |
| Ø12.7 mm Optical Post, SS, M4 Setscrew, M6 Tap, L = 40 mm | Thorlabs | TR40/M | |
| Right-Angle Clamp for Ø1/2" Posts, 5 mm Hex | Thorlabs | RA90/M | |
| M6 x 1.0 Stainless Steel Cap Screw, 16 mm Long, Pack of 25 | Thorlabs | SH6MS16 | screws for mount onto base |
| USB-6001 14-Bit 20 kS/s Multifunction I/O and NI-DAQmx | National Instruments | 782604-01 | Red LED spotlight controller |
| 20k Ohm 1 Gang Linear Panel Mount Potentiometer | TT Electronics/BI | P230-2EC22BR20K | fintuner for indicator |
| IR (860nm) emitter, 100 mA radial | Osram | 475-1365-ND | Red light indicator |
| cable | - | - | Misc |
| All-trans retinal | Sigma | R2625 | |
| Ethanol absolute | Vwr | 20821.296 | |
| Halocarbon Oil 27 | Sigma | H8773 | |
| Mowiol | Merk | 81381 | |
| Paraformaldehyde | Sigma | F8775 | |
| Phosphate buffered saline (PBS) | Sigma | P5493 | |
| Sylgard 184 silicone elastomer base | Dow Corning Corp | 4019862 | |
| Sylgard 184 silicone elastomer curing agent | Dow Corning Corp | 4019862 | |
| Triton X-100 | Sigma | T8787 | |
| Chicken anti-GFP antibodies | Rockland | 600-901-215 | Antibodies |
| Goat Dylight anti-Chicken | Abcam | ab96947 | |
| FM7a, B | BDSC | RRID:BDSC_785 | X chromosome |
| FRT19A[hs-neo] | BDSC | RRID:BDSC_1709 | |
| hiw[ΔN] | BDSC | RRID:BDSC_51637 | |
| hs-FLP[12] | BDSC | RRID:BDSC_1929 | |
| tub-Gal80[LL1] | BDSC | RRID:BDSC_5132 | |
| w[1118] | BDSC | RRID:BDSC_3605 | |
| 20xUAS-IVS-CsChrimson::mVenus | BDSC | RRID:BDSC_55135 | 2nd chromosome |
| 5xUAS-Gal4[12B] | Kyoto | RRID:Kyoto_108492 | |
| 5xUAS-HA::dnmnat | BDSC | RRID:BDSC_39702 | |
| 5xUAS-mCD8::GFP[LL5] | BDSC | RRID:BDSC_5134 | |
| ase-FLP[2d] | Freeman laboratory | Neukomm et al., 2014 (PNAS) | |
| CyO | BDSC | RRID:BDSC_2555 | |
| dpr1-Gal4 | BDSC | RRID:BDSC_25083 | |
| OR22a-Gal4 | BDSC | RRID:BDSC_9952 | |
| ey-FLP[6] | BDSC | RRID:BDSC_5577 | 3rd chromosome |
| GMR60E02-Gal4 | BDSC | RRID:BDSC_39250 | |
| TM3,Sb,e | BDSC | RRID:BDSC_3644 |
Referenzen
- Matsuda, W., et al. Single Nigrostriatal Dopaminergic Neurons Form Widely Spread and Highly Dense Axonal Arborizations in the Neostriatum. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 29 (2), 444-453 (2009).
- Wedel, M. J. A Monument of Inefficiency: The Presumed Course of the Recurrent Laryngeal Nerve in Sauropod Dinosaurs. Acta Palaeontologica Polonica. 57 (2), 251-256 (2012).
- Mariano, V., Domínguez-Iturza, N., Neukomm, L. J., Bagni, C. Maintenance mechanisms of circuit-integrated axons. Current Opinion in Neurobiology. 53, 162-173 (2018).
- Conforti, L., Gilley, J., Coleman, M. P. Wallerian degeneration: an emerging axon death pathway linking injury and disease. Nature reviews Neuroscience. 15 (6), 394-409 (2014).
- Neukomm, L. J., Freeman, M. R. Diverse cellular and molecular modes of axon degeneration. Trends in Cell Biology. 24 (9), 515-523 (2014).
- Gustavsson, A., et al. Cost of disorders of the brain in Europe 2010. European Neuropsychopharmacology: The Journal of the European College of Neuropsychopharmacology. 21 (10), 718-779 (2011).
- Waller, A. Experiments on the Section of the Glossopharyngeal and Hypoglossal Nerves of the Frog, and Observations of the Alterations Produced Thereby in the Structure of Their Primitive Fibres. Philosophical Transactions of the Royal Society of London. 140, 423-429 (1850).
- Rosell, A. L., Neukomm, L. J. Axon death signalling in Wallerian degeneration among species and in disease. Open Biology. 9 (8), 190118(2019).
- Mack, T. G., et al. Wallerian degeneration of injured axons and synapses is delayed by a Ube4b/Nmnat chimeric gene. Nature Neuroscience. 4 (12), 1199-1206 (2001).
- Osterloh, J. M., et al. dSarm/Sarm1 is required for activation of an injury-induced axon death pathway. Science. 337 (6093), New York, NY. 481-484 (2012).
- Xiong, X., et al. The highwire ubiquitin ligase promotes axonal degeneration by tuning levels of nmnat protein. PLoS Biology. 10 (12), 1001440(2012).
- Neukomm, L. J., et al. Axon Death Pathways Converge on Axundead to Promote Functional and Structural Axon Disassembly. Neuron. 95 (1), 78-91 (2017).
- MacDonald, J. M., et al. The Drosophila cell corpse engulfment receptor Draper mediates glial clearance of severed axons. Neuron. 50 (6), 869-881 (2006).
- Neukomm, L. J., Burdett, T. C., Gonzalez, M. A., Zuchner, S., Freeman, M. R. Rapid in vivo forward genetic approach for identifying axon death genes in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 111 (27), 9965-9970 (2014).
- Lu, T. Y., et al. Axon degeneration induces glial responses through Draper-TRAF4-JNK signalling. Nature Communications. 8, 14355(2017).
- Lunn, E. R., Perry, V. H., Brown, M. C., Rosen, H., Gordon, S. Absence of Wallerian Degeneration does not Hinder Regeneration in Peripheral Nerve. The European Journal of Neuroscience. 1 (1), 27-33 (1989).
- Adalbert, R., et al. A rat model of slow Wallerian degeneration (Wld(S)) with improved preservation of neuromuscular synapses. The European Journal of Neuroscience. 21 (1), 271-277 (2005).
- Martin, S. M., O'Brien, G. S., Portera-Cailliau, C., Sagasti, A. Wallerian degeneration of zebrafish trigeminal axons in the skin is required for regeneration and developmental pruning. Development. 137 (23), Cambridge, England. 3985-3994 (2010).
- Feng, Y., et al. Overexpression of Wld(S) or Nmnat2 in Mauthner Cells by Single-Cell Electroporation Delays Axon Degeneration in Live Zebrafish. Journal of Neuroscience Research. 88 (15), 3319-3327 (2010).
- Gilley, J., Coleman, M. P. Endogenous Nmnat2 is an essential survival factor for maintenance of healthy axons. PLoS Biology. 8 (1), 1000300(2010).
- Babetto, E., Beirowski, B., Russler, E. V., Milbrandt, J., DiAntonio, A. The Phr1 ubiquitin ligase promotes injury-induced axon self-destruction. Cell Reports. 3 (5), 1422-1429 (2013).
- Gerdts, J., Summers, D. W., Sasaki, Y., DiAntonio, A., Milbrandt, J. Sarm1-mediated axon degeneration requires both SAM and TIR interactions. The Journal of Neuroscience. 33 (33), 13569-13580 (2013).
- Gerdts, J., Brace, E. J., Sasaki, Y., DiAntonio, A., Milbrandt, J. SARM1 activation triggers axon degeneration locally via NAD+ destruction. Science. 348 (6233), New York, NY. 453-457 (2015).
- Bridge, P. M., et al. Nerve crush injuries--a model for axonotmesis. Experimental Neurology. 127 (2), 284-290 (1994).
- Maxwell, W. L., Bartlett, E., Morgan, H. Wallerian Degeneration in the Optic Nerve Stretch-Injury Model of Traumatic Brain Injury: A Stereological Analysis. Journal of Neurotrauma. 32 (11), 780-790 (2015).
- Fang, Y., Soares, L., Teng, X., Geary, M., Bonini, N. M. A novel Drosophila model of nerve injury reveals an essential role of Nmnat in maintaining axonal integrity. Current Biology. 22 (7), 590-595 (2012).
- Janelia Farm Adult Drosophila Brain Dissection. , Available from: https://www.janelia.org/project-team/flylight/protocols (2015).
- Cold Spring Harbor. Mowiol mounting medium. Cold Spring Harbor Protocols. 2006 (1), (2006).
- Seeds, A. M., et al. A suppression hierarchy among competing motor programs drives sequential grooming in Drosophila. eLife. 3, 02951(2014).
- Hampel, S., Franconville, R., Simpson, J. H., Seeds, A. M. A neural command circuit for grooming movement control. eLife. 4, 08758(2015).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker for studies of gene function in neuronal morphogenesis. Neuron. 22 (3), 451-461 (1999).
- Vosshall, L. B., Wong, A. M., Axel, R. An olfactory sensory map in the fly brain. Cell. 102 (2), 147-159 (2000).
- Hampel, S., McKellar, C. E., Simpson, J. H., Seeds, A. M. Simultaneous activation of parallel sensory pathways promotes a grooming sequence in Drosophila. eLife. 6, (2017).
- Farley, J. E., et al. Transcription factor Pebbled/RREB1 regulates injury-induced axon degeneration. Proceedings of the National Academy of Sciences of the United States of America. 23 (6), (2018).
- Wang, H., et al. Rapid depletion of ESCRT protein Vps4 underlies injury-induced autophagic impediment and Wallerian degeneration. Science Advances. 5 (2), 4971(2019).
- Dietzl, G., et al. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 448 (7150), 151-156 (2007).
- Port, F., et al. A large-scale resource for tissue-specific CRISPR mutagenesis in Drosophila. bioRxiv. 102, 636076(2019).
- Vagnoni, A., Hoffmann, P. C., Bullock, S. L. Reducing Lissencephaly-1 levels augments mitochondrial transport and has a protective effect in adult Drosophila neurons. Journal of Cell Science. 129 (1), 178-190 (2016).
- Vagnoni, A., Bullock, S. L. A cAMP/PKA/Kinesin-1 Axis Promotes the Axonal Transport of Mitochondria in Aging Drosophila Neurons. Current Biology. 28 (8), 1265-1272 (2018).
- Cao, X., et al. In vivo imaging reveals mitophagy independence in the maintenance of axonal mitochondria during normal aging. Aging Cell. 16 (5), 1180-1190 (2017).
- Smith, G. A., et al. Glutathione S-Transferase Regulates Mitochondrial Populations in Axons through Increased Glutathione Oxidation. Neuron. 103 (1), 52-65 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten