Method Article
Drosophila melanogaster'de Akson Ölümü Sırasında Aksonların ve Sinapslarının Morfolojik ve Fonksiyonel Değerlendirilmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, Drosophila melanogaster'de üç basit yaralanmaya bağlı akson dejenerasyonu (akson ölüm) tahlilleri yaparak kopmuş aksonların ve sinapslarının morfolojik ve fonksiyonel korunmasını değerlendirmek için protokoller salıyoruz.
Özet
Akson dejenerasyonu nörodejeneratif hastalıklarda ve sinir sistemlerinin mekanik veya kimyasal güçler tarafından zorlandığında ortak bir özelliktir. Ancak akson dejenerasyonunun altında yatan moleküler mekanizmaları anlamamız sınırlı dır. Yaralanmaya bağlı akson dejenerasyonu, kopan aksonların kendi demontajlarını (akson ölümü) nasıl yürüttükleri üzerinde çalışmak için basit bir model olarak hizmet vermektedir. Son yıllarda, evrimsel olarak korunmuş bir akson ölüm sinyali çağlayan sineklerden memelilere tespit edilmiştir, bu da ayrılmış akson için yaralanma dan sonra dejenere olması için gereklidir. Tersine, zayıflatılmış akson ölüm sinyali, kopmuş aksonların ve sinapslarının morfolojik ve fonksiyonel olarak korunmasına neden olabilir. Burada, aksonal morfolojisi gözlem için izin üç basit ve son zamanlarda geliştirilen protokoller mevcut, ya da nöronal hücre vücudundan kesilmiş aksonların aksonal ve sinaptik fonksiyonu, meyve sinek Drosophila. Morfoloji kanatta görülebilir, kısmi bir yaralanma aynı sinir demeti içinde yaralanmamış kontrol akson yan yana akson ölüm sonuçları. Alternatif olarak, aksonal morfoloji de beyinde görülebilir, tüm sinir demeti anten ablasyon tarafından tetiklenen akson ölüm uğrar nerede. Kopmuş aksonların ve sinapslarının fonksiyonel olarak korunması basit bir optogenetik yaklaşım ve sinaptik bakım sonrası davranışla değerlendirilebilir. Biz highwire kaybı-of-fonksiyon mutasyonu kullanarak ve aşırı ifade dnmnatkullanarak örnekler savuruyoruz , her ikisi de haftalarca akson ölüm geciktirme yeteneğine sahip. Daha da önemlisi, bu protokoller yaralanma ötesinde kullanılabilir; nöronal bakım faktörlerinin, aksonal taşımanın ve aksonal mitokondrilerin karakterizasyonunu kolaylaştırırlar.
Giriş
Nöronların morfolojik bütünlüğü yaşam boyunca sürekli sinir sistemi fonksiyonu için gereklidir. Nöronal hacmin büyük çoğunluğu akson1tarafındanalınır ,2; bu nedenle özellikle uzun aksonların yaşam boyu bakım sinir sistemi için önemli bir biyolojik ve biyoenerjik sorundur. Multipl aksonal-intrinsik ve glial-ekstrensek destek mekanizmaları tespit edilmiştir, yaşam boyu aksonal sağkalım sağlanması. Onların bozulma sonuçları aksondejenerasyonu 3, hangi sinir sistemlerinin ortak bir özelliği dir hastalık meydan olmak, ve mekanik veya kimyasal kuvvetler tarafından4,5. Ancak, akson dejenerasyonunun altında yatan moleküler mekanizmalar hiçbir bağlamda yeterince anlaşılmaz kalır ve akson kaybını engellemek için etkili tedavilerin geliştirilmesini zorlaştırmaktadır. Bu nörolojik durumlara karşı etkili tedavilerin geliştirilmesi önemlidir, onlar toplumumuzda büyük bir yük oluşturmak gibi6.
Yaralanmaya bağlı akson dejenerasyonu, kopan aksonların kendi demontajlarını nasıl yürüttüklerini incelemek için basit bir model görevi görehizmet eder. 1850 yılında Augustus Waller tarafından keşfedilen ve adını alan Wallerian dejenerasyonu (WD),7. İlk olarak, aksonal yaralanma dan sonra, akson aktif olarak kendi kendini imha (akson ölüm) evrimsel olarak korunmuş akson ölüm sinyalçağlayan ile kendi kendini imha yürütmek sonra bir gün sonra yaralanma8. İkinci olarak, çevreleyen glia ve özel fagositler meşgul ve üç ila beş gün içinde ortaya çıkan aksonal enkaz temizleyin. Akson ölüm sinyalinin zayıflatılması,9,10,1111,12hafta boyunca korunmuş olan kopmuş aksonlar ile sonuçlanırken, glial yutmanın zayıflaması, vivo13, 14,,15'tehaftalarca devam eden aksonal enkazda doruğa ulaşır.14
Sinekler, fareler, sıçanlar ve zebra balıkları üzerinde yapılan araştırmalar, axon ölüm sinyalinin evrimsel olarak korunmuş ve gerekli aracılarının8. Akson ölüm mutantları akson ölüme uğramayan kopmuş akson lar ve sinapslar içerir; onlar morfolojik ve fonksiyonel olarak haftalarca korunmuş kalır, hücre vücut desteği yokluğunda9,10,12,13,1616,17,18,19,20,21,22,23. Bu arabulucuların keşfi ve karakterizasyonu, akson ölümünü gerçekleştiren moleküler bir yolun tanımlanmasına yol açtı. Daha da önemlisi, akson ölüm sinyali sadece akson kesildiğinde, ezildiğinde veya gerildiğindedeğil, 24,25; aynı zamanda nörolojik koşulların farklı hayvan modellerinde bir katkı gibi görünüyor (örneğin, aksonlar bir yaralanma-bağımsız bir şekilde dejenere4, henüz yararlı sonuçlar bir diziile 4,8). Bu nedenle, baltaölüm yaralanma dan sonra akson dejenerasyon uyguluyor nasıl anlamak basit bir yaralanma modeli ötesinde anlayışlar sunabilir; terapötik müdahale için de hedefler sağlayabilir.
Meyve sinek Drosophila melanogaster (Drosophila)akson ölüm sinyaliçin paha biçilmez bir sistem olduğu kanıtlanmıştır. Sinek araştırma dört temel evrimsel olarak korunmuş akson ölüm genleri ortaya: highwire (hiw)11,14, dnmnat12,26, dsarm10 ve aksundead (baltalı)12. Bu arabulucuların modifikasyonu - hiwfonksiyon kaybı mutasyonlar , dsarm ve baltalı, ve dnmnat aşırı ifade - güçlü sinek ömrü için akson ölüm engeller. Kopmuş yabani tip aksonlar 1 gün içinde akson ölüme uğrasalar da, kopmuş aksonlar ve sinapsları hiw, dsarm veya aksed eksik sadece morfolojik olarak değil, aynı zamanda işlevsel olarak haftalarca korunur. Fonksiyonel korumanın yüksek dnmnat seviyeleri ile de sağlanıp sağlanamayacağı henüz belirlenmemiştir.
Burada, hücre vücut desteği yokluğunda akson ölüm (örneğin, kopmuş aksonların morfolojisi ve fonksiyonu ve zaman içinde sinapslar) incelemek için üç basit ve son zamanlarda geliştirilen protokoller sunacak. Zayıflatılmış akson ölümünün, morfolojik olarak hiw fonksiyon kaybı mutasyonu(hiw-n) ile korunmuş kopmuş aksonlar ile nasıl sonuçlandığını ve akson ölümünün dnmnat (dnmnatOE)aşırı ifadesi ile en az 7 gün boyunca işlevsel olarak korunmuş olan kopmuş aksonlar ve sinapslarla nasıl sonuçverdiğini gösteriyoruz. Bu protokoller merkezi veya periferik sinir sisteminde (Sırasıyla CNS ve PNS)13,,14bireysel aksonal ve sinaptik morfolojigözlem için izin , kopmuş aksonlar ve CNS onların sinaps fonksiyonel korunması bir davranışsal okuma olarak damat ile birlikte basit bir optogenetik kurulum kullanımı ile görselleştirilebilir iken12.
Protokol
1. PNS'de Akson Ölümü Sırasında Akson Morfolojisinin Gözlemi
- Kanat yaralanması: akson demetlerinin kısmi yaralanması
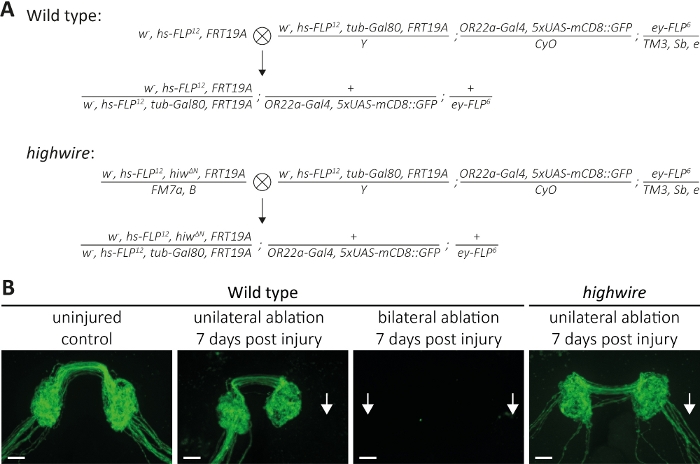
- Oda sıcaklığında (RT) haç yapmak için doğru genotipten(Şekil 4A, P0 nesil) 5 bakire dişi ve 5 erkek kullanın. Her 3-4 günde bir P0'ı yeni şişelere geçirin. Taze ekaplı yetişkin soyundan (F1 nesil) günlük toplayın ve 7-14 gün yaşlayın.
- CO2 pedleri üzerinde esesthetize sinekler. Kanat ortasında kabaca ön kanat damarKesmek için mikro makas kullanın(Şekil 1A). Yaralanma için bir kanat ve yaş ayarı yaralanmamış kontrol olarak diğer kanat kullanın. Kanat başına bir yaralanma uygulayın ve yeterli kanatları yaralı (yaklaşık 15 kanat) almak için emin olun.
NOT: Tüm kanat kesilebilir, ancak sadece ön kanat damarKesmek için yeterlidir. Burası kanadın en güçlü kısmı. - Sinekleri yiyecek içeren şişelerde kurtarın.
- Aksonların kanat diseksiyonu ve görselizasyonu
- Bütün bir cam kaydırak boyunca bir pipet ile halokarbon yağı 27 10 μL spread(Şekil 1B).
- Yaralanmaların yanı sıra, istenilen zaman noktalarında (örneğin, yaralanma sonrası 1 veya 7 gün) yaralanmamış kontrol kanatını da kesin. Kesmek için mikro makas kullanın, ve kanat kapmak için cımbız. Halokarbon yağı 27(Şekil 1B)içine maksimal 4 kanat monte ve bir kapak slayt ile kaplayın.
- Dönen bir disk mikroskobu kullanarak kanadı hemen görüntüleyin. Z ekseni boyunca 0,33 m adım boyutunda bir dizi optik bölüm edinin ve sonraki analizler için z yığınlarını tek bir dosyaya sıkıştırın.
NOT: Hücre gövdelerinin ve aksonlarin bulunduğu ön kanat damarını almayın. Merkezdeki kanadı tut. Kanatlarda doku sabit değildir; 8 dk altında bu görüntüleme için kanatları montaj zaman tutun.
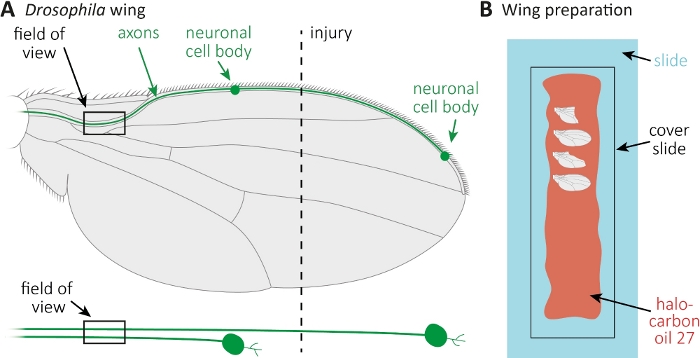
Şekil 1: Kanatta akson ölümü sırasında akson morfolojisinin gözlemi. (A) Şematik sinek kanadı iki seyrek GFP etiketli duyusal nöronlar, ayrıca ayrı ayrı aşağıda belirtilmiştir. Yaralanma yeri ve gözlem alanı belirtilir. (B) Kanat görüntüleme için şematik kurulum. Yaralı ve yaralanmamış kontrol kanatları (gri) halokarbon yağı 27 (kırmızı) bir cam slayt (açık mavi) üzerine monte edilir ve bir kapak slayt (siyah) ile kaplıdır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. CNS'de Akson Ölümü Sırasında Akson ve Sinaps Morfolojisinin Gözlemi
- Anten ablasyon: tüm akson demetleri yaralanma
- RT. Pass P0'da her 3-4 günde bir yeni şişelere haç yapmak için doğru genotipten(Şekil 5A, P0 nesil) 5 bakire dişi ve 5 erkek kullanın. Her gün taze ekaplamış yetişkin soyundan (F1 kuşağı) toplayın ve 7 ila 14 gün yaşlayın.
- CO2 pedleri üzerinde esesthetize sinekler. Tek taraflı ablasyon için sağ3 anten segmentini ablate cımbız kullanın; veya bilateral ablasyon için hem sol hem de sağ3 anten segmentleri (Şekil 2A-C). Bu GFP etiketli nöronal hücre organları kaldıracaktır, onların aksonal projeksiyonlar CNS kalır.
NOT: Anten ablasyon tüm akson demeti keser. Tek taraflı ablasyon yapılırsa, kontralateral taraftaki akson demeti (ablated olmayan anten) iç kontrol görevi görür. Yeterli anten ablasyonları (yaklaşık 15 hayvan) yaptığınızdan emin olun. - Sinekleri yiyecek içeren şişelerde kurtarın.
- Aksonların beyin diseksiyonu ve görselleştirilmesi
- 10:1 hacim oranı silikon elastomer baz (9 mL) ve kür leme maddesi (1 mL) karıştırın. Her 5 mL karışımı nı 35 mm'lik doku kültür plakasına aktarın ve bir gecede duman kaputuna hafif ajitasyonla karıştırılarak tanıtılan havayı azaltın. Karışım 24 saat içinde katılaşır.
NOT: Diseksiyon plakaları sadece bir kez hazırlanmalı ve birden çok kez kullanılabilir. - Anesthetize CO2 pedleri üzerinde sinekler ve istenilen zaman noktalarında iki cımbız kullanarak yetişkin kafaları decapitate (örneğin, anten ablasyon sonra 1 veya 7 gün). Boynunu kapmak için bir cılız, toraksı tamir etmek için diğer cılızı kullan. Yavaşça boynunu çekin ve göğüs kapalı kafa.
NOT: İstenilen sayı elde edilene kadar co2 pedüzerinde kafası kesilmiş kafaları bırakın, ancak 30 dakika içinde bir sonraki adıma geçmek için emin olun. - Tüm kafaları sabitleme çözeltisine batırılmış cımbız kullanarak %4 paraformaldehit (PFA) ve %0,1 Triton X-100 fosfat tamponlu salin (PBS) içeren 1 mL'lik sabitleme solüsyonu içeren 1,5 mL mikrosantrifüj tüpe aktarın.
NOT: Sinek kafaları ıslak cımbız üzerinde iyi sopa. Tüm kafaları mikrosantrifüj tüpüne kolayca aktarmayı mümkün kılar. - RT nazik ajitasyon ile 20 dk kafaları düzeltmek. Bir pipet ile supernatant çıkarın ve rt nazik ajitasyon ile PBS% 0,1 Triton X-100 içeren yıkama tampon 1 mL yıkama tampon ile beş 2 dakika yıkar ile bu işlemi tekrarlayın, rt nazik ajitasyon ile, artık sabitleme çözeltisi kaldırmak için.
NOT: Yetişkin Drosophila beyinlerinin nasıl diseksiyon alabildiğini anlatan videolar hazırdır 27. - Cam pipetle kafaları yıkama tamponu yla dolu bir diseksiyon plakasına aktarın. Diğer cızırdayan ile başını tutarken, kapmak ve baş hortum çekin için bir cıvezer kullanın. Bu hortum dış iskelet bağlı olsaydı bir delik bırakacaktır.
- Delik ve her bileşik göz arasındaki dış iskeletkaldırmak için iki cımbız kullanın. Bu, her iki cımbız ile baş yapısını açmak için mümkün hale getirecek, ve yavaşça içinde beyin kazımak için.
- Her beyni trakea veya yağ ları çıkararak temizleyin(Şekil 2D, üst). Beyin temizlendikten sonra, buz üzerinde yıkama tampon1 mL içeren yeni bir mikrosantrifüj tüp koymak.
NOT: Hasarlı veya kayıp optik loblar beynin merkezindeki koku lobunu etkilemez(Şekil 2D, üst). - Tüm beyinler toplanıp mikrosantrifüj tüpünün altında biriktikten sonra yıkama tamponunun 1 mL'lik sabitleme çözeltisi ile değiştirin. Rt sallanan ile 10 dakika için beyinleri düzeltin, RT sallanan ile yıkama tampon 1 mL beş 2 dakika yıkar izledi.
- 4 °C'de sallanan bir gecede birincil antikorları (1:500) çamaşır tamponuna uygulayın, ardından RT'de sallanan 1 mL yıkama tamponu kullanarak 2 saat üzerinden 10 yıkama uygulayın.
- Rt sallanan ve alüminyum folyo içinde mikrocentrifuge tüp sarmak Ile yıkama tampon 2 h ikincil antikorlar (1:500) uygulayın ışık engellemek için. Prosedürün geri kalanı için alüminyum folyo ile kaplı mikrocentrifuge tüp tutun. RT sallanan ile 2 saat üzerinde yıkama tampon 1 mL ile on yıkar uygulayın.
- Supernatant çıkarın ve mikrocentrifuge tüp beyinleri kapsayacak şekilde antifade reaktif tek bir damla kullanın. Beyinleri montaj ve görüntülemeye hazırlamadan önce 4 °C'de en az 30 dakika kuluçkaya yatırın.
- Bir kapak slayt ı hazırlayın, üzerine laboratuvar bandı yapıştırın ve banttan "T" benzeri bir şekil kesin(Şekil 2D, alt). Ortaya çıkan alan, beyin içeren antifade reaktif28'in tercihen her iki odaya da borulandığı alan olarak hizmet vermektedir.
NOT: Ucun 3 mm'sinin kesildiği 20-200 μL'lik pipet ucu kullanın ve pipetin açılmasını genişletin. Bu, beyin içeren antifade reaktifini pipetle mesleğini mümkün kındıracaktır. Dikkatle bir kapak slayt ile beyinleri kaplayın. - İki küçük eşit rulo hazırlamak için kil kullanın. Kil rulobir cam slayt yüksekliği daha yüksek olmadığından emin olun. Kil ruloları cam kaydırağa yapıştırın(Şekil 2D, alt). Kil rulo üzerine beyin içeren kapak slayt sandviç yerleştirin.
NOT: GFP etiketli aksonlar ve sinapsları beynin ön tarafında yer alır. Bu nedenle, ön onları görüntülemek daha kolaydır. Ancak, beyinler ya yukarı yüz, ya da kapak slayt sandviç yüz aşağı. Kil rulo sandviç tutucular olarak hizmet ve görüntüleme sırasında, sandviç baş aşağı çevrilebilir. Bu, her beyinden önden görüntü elde etmeyi mümkün kındıracaktır. - Konfokal mikroskop kullanarak z ekseni boyunca 1,0 m adım boyutunda bir dizi optik bölüm edinin ve bozulmadan kalan aksonal projeksiyonların sayısını değerlendirmek için sonraki analizler için z-yığınlarını tek bir dosyaya sıkıştırın.
- 10:1 hacim oranı silikon elastomer baz (9 mL) ve kür leme maddesi (1 mL) karıştırın. Her 5 mL karışımı nı 35 mm'lik doku kültür plakasına aktarın ve bir gecede duman kaputuna hafif ajitasyonla karıştırılarak tanıtılan havayı azaltın. Karışım 24 saat içinde katılaşır.
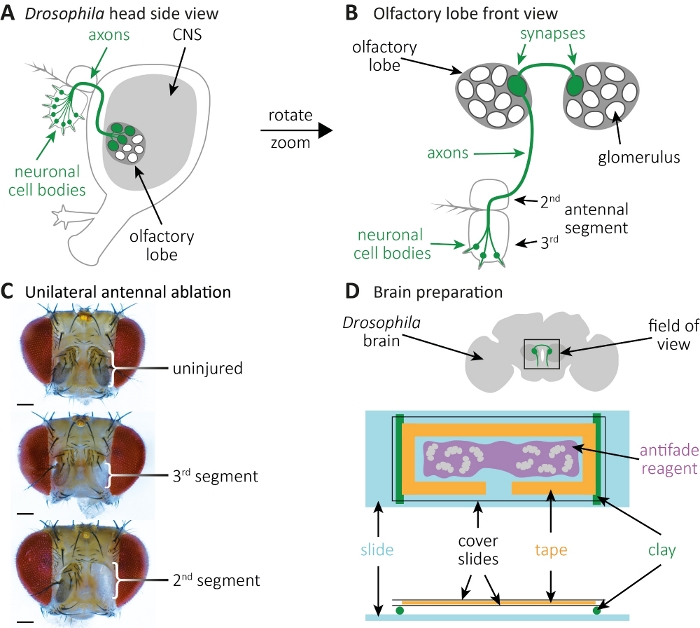
Şekil 2: Beyinde akson ölümü sırasında akson ve sinaps morfolojisinin gözlemi. (A) GFP etiketli hücre gövdeleri, aksonlar ve sinapslar ile şematik sinek başının yan görünümü. (B) GPF etiketli koku reseptör nöronları ve aksonları ve sinapslarının yüksek büyütme ön görünümü. Hücre gövdeleri3. Aksonlar sol koku lobunda glomerulus ta sinapslar oluştururlar, orta çizgiyi geçerler ve kontralateral koku lobunda glomerulusta sinapsoluştururlar. (C) Tek taraflı anten ablasyonlu sinek kafaları örnekleri. Üst: Yaralanmamış kontrol. Orta:3. anten segmentinin ablasyon. Alt: Ablasyon 2(ve böylece de3)anten segmenti. (D) Beyin hazırlığı. Üst: Şematik görüntülenerek koku lobları ve görüş alanında aksonal projeksiyonlar ile sinek beyin diseksiyon. Alt: Beyin görüntüleme için şematik kurulum. İki kil rulo (yeşil) bir cam slayt üzerine monte edilir (açık mavi), onlar sinek beyinleri (gri) içeren bir kapak slayt sandviç, taşırlar. Beyinler antifade reaktifine (mor), bir laboratuvar bandı (turuncu) ile çevrili ve iki kapak slaytı (siyah) ile kaplı olarak monte edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Axon ve Sinaps Fonksiyonu için Bir Okuma olarak Optogenetics tarafından indüklenen Damat
- Optogenetik kurulum
- Optogenetik deneyi karanlık bir odada gerçekleştirin. Kurulumun karanlıkta sinekleri aydınlatmak için 850 nm kızılötesi (IR) LED spot ışığı(Şekil 3A),CsChrimson'u ifade eden nöronları etkinleştirmek için yanıp sönen 660 nm kırmızı LED spot ışığı ve kırmızı ışık yanıp sönerlerinin kaydedilmesini engelleyen 700 nm uzunpas filtreli tek renkli kameradan oluştuğundan emin olun.
- Çapı 1 cm olan küçük dairesel bir davranış odası oluşturmak için 3D yazıcı kullanın, üzerini bir kapak kaydırağıyla kapatın ve haznenin yanındaki kırmızı LED spot ışığına birleştirilmiş 860 nm'lik bir emperyaç yerleştirin(Şekil 3B).
NOT: Yayımlayıcı, kırmızı LED spot ışığının ne zaman yansAn olduğunu gösterir ve böylece nöronları aktive eder. - LED spot ışıklarını ve kamerayı odanın üstüne monte edin(Şekil 3A, C).
- 10 s sırasında 10 Hz yanıp söner nöronlar etkinleştirin. Aktivasyon süresi deneysel tasarıma göre ayarlanabilir.
- Optogenetik için sinek hazırlama
- Mikrodalgada sinek yiyeceği erit. Gıda soğuduktan sonra, katılaşmadan önce, 20m'lik tüm trans-retinal in etanol (EtOH) 1:100'ünü 200 μM'lik son konsantrasyona ekleyin.
NOT: Sıcak gıda tüm trans-retinal ekleyerek kaçının, bu daha az verimli optogenetik neden olabilir. - Fişler veya pamuk topları ile katılaştırılmış gıda içeren şişeleri kapatın. Alüminyum folyo ile şal şişeleri. Daha sonra, yiyecek içeren şişeleri karanlık ve soğuk bir odada saklayın.
- Rt. Pass P0'da her 3-4 günde bir yeni şişelere çapraz yapmak için doğru genotipten 5 bakire dişi ve 5 erkek(Şekil 6A, nesil P0)kullanın. Günlük bir temelde taze ekaplanmış yetişkin soyundan (f1)toplayın ve sineklikte 200 μM'lik tüm trans retinal içeren alüminyum kaplı şişelerde 7 ila 14 gün yaşlayın.
- Hiçbir gıda ile boş bir şişe içine gıda içeren şişeler dokunarak sinektoplamak. Yaklaşık 30 s. Sinekler uykuya dalacak için buz içeren su da aşağı şişe soğutun. Tek tek sinekleri bir kapak slaytı ile kaplı küçük odalara hızlı bir şekilde koyun (Şekil 3B).
NOT: Sinekler ısınır ısınmaz uyanırlar. Her biri tek bir odaya hızlı bir şekilde sinmek çok önemlidir. Sinekleri uyuştururmak için CO2 pedleri kaçının, bu onların davranışlarını etkileyecektir. - Anten tımar ı ortaya çıkarmak için optogenetik yapın. Burada protokol aşağıdaki aralıklardan oluşur: kırmızı ışığın olmadığı 30 s, ardından 10 S'de 10 s kırmızı ışık maruziyeti, bu işlemi toplamda üç kez tekrarlayın, ardından kırmızı ışığın12,29,30olmadığı ek bir 30 s aralığı nı takip edin.
NOT: Bu protokol deneysel tercihe göre ayarlanabilir. - CO2 pedleri üzerinde her odadan ayrı sinekler toplayın. Onları anten yaralanmasına maruz bırak. Hem sol hem de sağ2 anten segmentleri ablate (Şekil 2C). Bu Johnston organının hücre organları kaldıracak (JO) nöronlar, aksonal projeksiyonlar CNS kalır. Tüm trans-retinal 200 μM içeren alüminyum kaplı şişelerde sinekleri kurtarın.
NOT: Optogenetik tarafından indüklenen anten tımariçin duyusal nöron hücre gövdeleri 2anten segmentinde yer almaktadır (Şekil 2C). - Karşılık gelen zaman noktalarında (örn. 7 gün sonra anten ablasyon), denek başka bir tımar tamlaması (adım 3.2.4'e geri dön) uçar.
- Mikrodalgada sinek yiyeceği erit. Gıda soğuduktan sonra, katılaşmadan önce, 20m'lik tüm trans-retinal in etanol (EtOH) 1:100'ünü 200 μM'lik son konsantrasyona ekleyin.
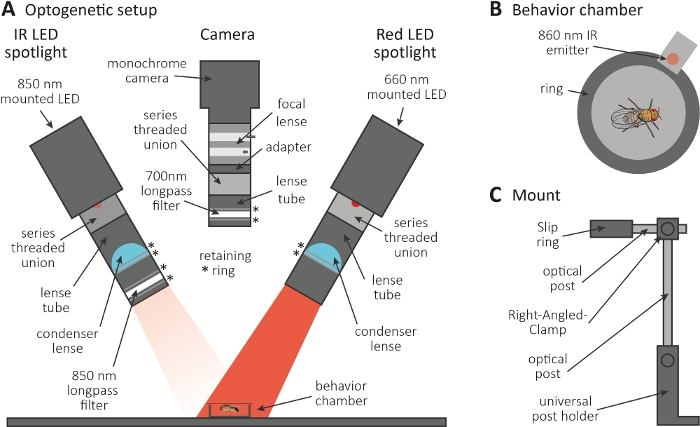
Şekil 3: Ekson ve sinaps fonksiyonu için bir okuma olarak tımar neden optogenetik kurulum. (A) Optogenetik için gerekli olan monte edilmiş bileşenlerin çizimi. Kızılötesi (IR) LED spot, kamera ve kırmızı LED spot (sırasıyla soldan sağa). Ayrıntılı bir açıklama içeren bileşenler Malzemeler Tablosu'ndalistelenmiştir. (B) Kırmızı LED spot etkinleştirme göstermek için bir IR yayımlayıcısı da dahil olmak üzere bir davranış odası üst görünüm illüstrasyon. (C) Tek bir montaj kurulumunun çizimi. İki LED spot ışığı ve kamera için sırasıyla toplam üç montaj kurulumu gereklidir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Yukarıda, kopmuş aksonların ve sinapslarının morfolojisi ve işlevini incelemek için üç yöntem açıklanmıştır. İlk yöntem PNS bireysel akson yüksek çözünürlüklü gözlem sağlar. Bu MARCM tekniği14tarafından oluşturulan klonlar gerektirir,31. Burada, yabani tip ve highwire mutant MARCM klonları(Şekil 4A)oluşturmak için haçlar gerçekleştirdi. Kanadın ortasındaki basit bir kesik distal (örneğin, kanadın dış tarafında) bulunan nöronların akson yaralanmasına neden olurken, proksimal nöronlar (örn. kesme bölgesi ile toraks arasında) yaralanmamış olarak kalır. Bu yaklaşım, aynı sinir demeti içinde yaralanmamış kontrol aksonları yan yana akson ölüm gözlemlemek mümkün hale getirir(Şekil 1A, Şekil 4B). Burada, gfp etiketli klonların düşük sayıda sonuçlanan bir genetik arka plan kullanılır (örneğin, her deneyde iki14). Yaban tipi aksonlarin yaralanmasından 1 ve 7 gün sonra, sırasıyla kontrol aksonlari, akson ölüm geçiren aksonlar ve aksonal parçaların çevreglia tarafından temizlenmesi örneklerini sunmak için sayılmaktayız. Buna ek olarak, highwire mutantlarda aksonal yaralanmayı tekrarladık ve yaralanmadan 7 gün sonra sonucu analiz ettik.
Yaralanmamış kontrol kanatları iki vahşi tip klonları barındırır, böylece iki GFP etiketli yabani tip aksonlar(Şekil 4B, yabani tip, yaralanmamış kontrol). Mikro makas kullanılarak kanadın ortasını kestikten bir gün sonra, hücre gövdelerinin kesik bölgeye distal olduğu GFP etiketli aksonlarda akson ölümü indüklenirken, proksimikalan daki hücre gövdelerinden aksonlar aynı sinir demeti içinde bir iç kontrol görevi olarak kullanılırken(Şekil 4B, yabani tip, 1 gün sonrası yaralanma). Okla gösterilen üst kısımdaki aksonal enkaz izine dikkat edin. Aksonal yaralanmadan 7 gün sonra GFP etiketli aksonal enkaz çevreleyen glia tarafından temizlenirken, GFP etiketli yaralanmamış kontrol aksonlar sinir paketinde kalır(Şekil 4B, yabani tip, 7 gün sonrası yaralanma, ok). Buna karşılık, 7 gün boyunca kopmuş olan highwire mutant aksonları morfolojik olarak korunmuş olarak kalır, önceki bulgularla tutarlı11,14 (Şekil 4B, highwire, 7 gün yaralanma sonrası, ok). Bu sonuçlar Drosophila kanadının güçlü görsel çözünürlüğünü göstermektedir. Akson ölümü aynı sinir demeti içinde yaralanmamış kontrollerin yan yana görülebilir. Vahşi tip aksonlar yaralanmadan sonraki 1 gün içinde akson ölüme uğrarken ve ortaya çıkan enkaz 7 gün içinde temizlenirken, akson ölümü eksik highwire mutantlar morfolojik olarak 7 gün boyunca korunur.

Şekil 4: Kanatta GFP etiketli duyusal nöron aksonların akson ölümünü inceleme yaklaşımı. (A) Şematik kanat (P0 ve F1 nesil, sırasıyla) yabani tip ve highwire klonlar oluşturmak için haçlar. Bakire dişiler solda, erkekler sağda. Genotip ayrıntıları için Malzeme Tablosu'na bakınız. (B) Kontrol ve yaralı GFP etiketli akson örnekleri. Görüş alanı ( Şekil1A)olarak belirtilir. Soldan sağa: yaralanmamış yabani tip kontrol aksonları, yabani tip aksonlar 1 günlük post yaralanma, yabani tip aksonlar 7 gün sonrası yaralanma, highwire mutant akson7 gün yaralanma sonrası, sırasıyla. Oklar kopmuş aksonları gösterir, Ölçek çubuğu = 5 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
İkinci yöntem, cns'ye yansıtılan ve hem sol hem de sağ antenlerde bulunan nöronlara ait sinapsların bulunduğu tüm akson demetlerinin nasıl görselleştirilebildiğini açıklar(Şekil 2A-C). Burada, yabani tip ve highwire mutant MARCM klonları(Şekil 5A)oluşturmak için haçlar gerçekleştirdi. Yaralanmamış, GFP etiketli aksonların ve sinapsları, yaralanma yokluğunda günler arasında görüntülenebilir(Şekil 5B, Yabani tip, yaralanmamış kontrol). Alternatif olarak, hayvanlar 3anten segmentabasyonuna maruz kalınabilir ve gfp etiketli aksonlar ve sinapsları saatler ile günler arasında bir zaman diliminde gözlemlenebilir. Anten ablasyonundan 7 gün sonra odaklandık, çünkü şu anda aksonlar ve sinapsları akson ölümü yle sonuçlandı ve ortaya çıkan enkaz çevredeki glia tarafından temizlendi. Sağ antenin tek taraflı ablasyon yapılırsa, sağ akson demeti kesilir ve sökülür ve ortaya çıkan enkaz yaralanmadan 7 gün sonra tamamen temizlenir(Şekil 5B, yabani tip, tek taraflı ablasyon, 7 gün sonrası yaralanma, oklar), önceki bulgular la tutarlı13. Alternatif olarak, hem sağ hem de sol anten ablated olabilir, hangi hem akson demetleri kesecek, ve yaralanma sonra 7 gün, akson ve sinaps kayboldu(Şekil 5B, yabani tip, bilateral ablasyon, 7 gün sonrası yaralanma, ok). Buna karşılık, highwire mutantlarda sağ antenin tek taraflı ablasyon, önceki bulgular11,14 (Şekil 5B, highwire, tek taraflı ablasyon, 7 gün sonrası yaralanma, ok) ile tutarlı, 7 gün yaralanma sonrası korunmuş kalır kesilmiş akson sonuçları. Bu sonuçlar, kopmuş yabani tip aksonlarin akson ölüme tabi olduğunu ve ortaya çıkan enkazın 7 gün içinde temizlendiğini, akson ölüm eksikliği olan highwire mutantlarının akson ölüme uğrayamadığını ve morfolojik olarak 7 gün boyunca korunduğunu göstermektedir.
Şekil 5: Beyindeki GFP etiketli duyusal nöron aksonların akson ölümünü inceleme yaklaşımı. (A) Şematik beyinde yabani tip ve highwire klonlar oluşturmak için haçlar (P0 ve F1 nesil, sırasıyla). Bakire dişiler solda, erkekler sağda. Genotip ayrıntıları için Malzeme Tablosu'na bakınız. (B) Kontrol ve yaralı GFP etiketli akson örnekleri. Soldan sağa: yaralanmamış vahşi tip kontroller, vahşi tip 7 gün tek taraflı anten ablasyon sonrası, vahşi tip 7 gün sonrası bilateral anten ablasyon, ve highwire mutantlar 7 gün sonrası tek taraflı anten ablasyon, sırasıyla. Oklar kopmuş akson demetleri gösterir, Ölçek çubuğu = 10 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Üçüncü yöntem, CNS'de kopmuş aksonların ve sinapslarının fonksiyonel olarak korunmasını sağlar. Bu anten tımar neden için yeterli olan 2 anten segmentinde yer jo nöronlar bir alt kümesinin manipülasyon dayanır. Jo nöronlarda kırmızı-shifted channelrhodopsin ifadesi (CsChrimson) tüm trans-retinal diyet takviyesi ile birlikte, kırmızı ışık maruz kalma üzerine basit bir post-saptik damat davranışı ortaya çıkarmak için yeterlidir12,30. Burada, yabani tip JO nöronlar oluşturmak için haçlar gerçekleştirilen, ve JO nöronlar aşırı ifade dnmnat (dnmnatOE) (Şekil 6A). Yabani tip sinekler veya zayıflatılmış akson ölüm ile JO nöronlar içeren sinekler(dnmnatOE),her ikisi de yaralanmadan önce güçlü bir damat davranışı liman. Ancak, 7 gün sonrası yaralanma (örneğin,2 anten segmentinin ikili ablasyon), damat yaralanmaya bağlı akson ve sinaps dejenerasyonu nedeniyle yabani tip sinekler optogenetik tarafından ortaya çıkarılmaz, zayıflatılmış akson ölüm ile hayvanlar damat devam ederken(Şekil 6B, Film 1,2). Zayıflatılmış akson ölümü bu nedenle kopmuş aksonları ve sinapslarını 7 gün boyunca işlevsel olarak koruyabilme yeteneğine sahiptir.

Şekil 6: Aksotomi sonrası aksonal ve sinaptik fonksiyonu görselleştirme yaklaşımı. (A) Şematik yabani tip ve dnmnat aşırı jo duyusal nöronlar (P0 ve F1 nesil, sırasıyla) ifade oluşturmak için haçlar. Bakire dişiler solda, erkekler sağda. Genotip ayrıntıları için Malzeme Tablosu'na bakınız. (B) Optogenetik tarafından indüklenen tımar davranışının bireysel ethogramları. Top: vahşi tip bireysel ethogramlar önce ve 7 gün yaralanma (mavi) sonra sinekler. Alt: jo nöronlarda aşırı ifade dnmnat sineklerin bireysel ethogramlar önce ve 7 gün yaralanma (kırmızı).dnmnatOE Her çöp kutusu 1 s içinde en az 1 tımar davranışı gösterir. Siyah çizgi tüm kutuların toplamını gösterir. (C) Tımar davranışının nicelikselleştirilmesi. Veriler ortalama ± standart sapma, p > 0.001 (tek yönlü ANOVA, Tukey sonrası hoc testi ile çoklu karşılaştırma) olarak gösterilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Film 1: Anten ablasyondan önce ve 7 gün sonra optogenetik tarafından ortaya çıkan temsili yabani tip tımar davranışı. Bu videoyu indirmek için lütfen buraya tıklayın.
Film 2: Antel ablasyondan önce ve 7 gün sonra JO nöronlarında dnmnat'ı aşırı ifade eden sineklerde optogenetik tarafından ortaya çıkan temsili bakım davranışı. Bu videoyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Burada açıklanan protokoller morfolojinin sağlam ve tekrarlanabilir gözlemine ve Drosophila'dakihücre vücutlarından ayrılan aksonların ve sinapslarının işlevini sağlar. Kanat tsay PNS14yaralanmamış kontrol aksonların akson ölüm yan yana gözlem kolaylaştırır , anten tsay GFP etiketli aksonlar ve sinapstüm sinir demetleri gözlem kolaylaştırır ken, beyinde hem morfoloji ve fonksiyon değerlendirmek için (CNS)12. Deneyler tasarlarken göz önünde bulundurulması gereken morfolojiyi incelemek için her yaklaşım için kritik adımlar ve bazı avantajlar vardır.
Kanattaki PNS'de akson morfolojisini gözlemlemek için, kanadın şeffaflığı nedeniyle deneyler kolayca yapılabilir: diseksiyon ve immünohistokimyayı atlatır. Ancak, fiksasyon eksikliği nedeniyle, kanatları14montaj hemen sonra görüntülenmiş olması gerekir. Şu anda, iki farklı Gal4 sürücüleri sık sık kullanılır, ya ok371Gal4 veya dpr1Gal4, ve her iki referans dejenerasyon ölçmek için farklı yaklaşımlar sunuyoruz14,26. Birkaç nöronların seyrek etiketleme tavsiye edilir, kullanılarak "Bir Bastırılabilir Hücre Marker ile Mozaik Analizi (MARCM)"14,31, aksonal morfoloji çözünürlüğü benzeri görülmemiş olarak. Buna karşılık, sinapsların gözlem kanatları mümkün değildir, onlar sineklerin toraks içinde ventral sinir kordonu bulunur. Ayrıca, ek aksonal belirteçler immünohistokimya ile görselleştirilemez: mumlu mitikül altta yatan dokuiçine fiksatif ve antikorların difüzyon için imkansız hale getirir.
CNS'de akson ve sinaps morfolojisini gözlemlemek için beyin diseksiyonu yapılmalıdır. Onlar immünohistokimya kullanımı ile ek aksonal ve sinaptik belirteçleri görselleştirme avantajı sunuyoruz, ve sinaps görüş aynı alanda aksonlar ile birlikte görülebilir10,13. Karakterize koku reseptör nöron büyük bir koleksiyon (ORN) Gal4 sürücüleri hazır32, ve sık sık, OR22aGal4 tercih edilen sürücüdür. Anten ablasyon için, OR22a nöronların hücre gövdeleri3 segmentinde yer almaktadır(Şekil 2B). Bir floresan yoğunluğu tabanlı nicelleştirme ya akson veya sinaps13dejenerasyonu ölçmek için kullanılır. Tersine, deneyler beyin diseksiyonu ve antikor boyama nedeniyle zaman alıcıdır.
Aksotomi sonrası aksonal ve sinaptik fonksiyonu görselleştirmek için, optogenetik anten tımar tetiklemek için kullanılır: kopmuş aksonların fonksiyonel korunması için bir okuma olarak hizmet vermektedir ve sinapslar12. Tımar devresi ve ilgili duyusal, inter- ve motorneuron Gal4 sürücüleri iyice tarif edilmiştir29,30. GMR60E02Gal4 Johnston organının bir alt kümesi etiketler (JO) duyusal nöronlar, hangi gerekli ve damat için yeterli29,30. Anten ablasyon için, JO nöronların hücre organları2 anten segmentinde yer almaktadır ( Şekil2B). Optogenetik kurulum sıfırdan kolayca oluşturulabilir veya varolan bir kurulum ayarlanabilir. Daha da önemlisi, deneyler karanlık bir odada yapılmalıdır ve böylece kızılötesi (IR) LED spot ışığı ile görselleştirilmiş sinekler. Bir kanal olarak CsChrimson kullanırken, jo nöronlar etkinleştirmek için tüm trans-retinal ve kırmızı LED spot ile gıda tedarik etmek çok önemlidir29. Alternatif olarak, mavi ışığa duyarlı kanallar ve mavi LED spot, ya da TrpA1 kanal ve sıcaklık nöronal aktivasyon için kullanılabilir29,33. Tımar davranışının nicelikselleştirilmesi zaten12,29.
Bu tahliller özellikle akson ölüm çalışma için kullanıldığında, morfolojik veya fonksiyonel koruma fenotip zaman içinde sağlam olması gerektiğini unutmayın önemlidir. Aksinon ölüm morfolojik koruma tutarlı ama daha az belirgin fenotip yol açtığı durumlar vardır34,35, ve böyle bir fenotip fonksiyonel koruma çevirir olup olmadığı belirlenecek kalır.
Akson ölüm fenotipleri de Drosophila larvagelişimi sırasında nöronlarda gözlenmiştir, sinirler yerine yaralı ezildinerede 11,23. Burada, özellikle gelişimi tamamlamış yetişkin Drosophila nöronlar üzerinde duruldu. Bu bağlamda, RNA girişim36veya dokuya özgü CRISPR/Cas937 kullanımı kolayca uygulanabilir. Daha da önemlisi, yukarıdaki teknikler akson ölüm bağımsız bağlamda kullanılabilir: onlar nöronal bakım faktörlerinin karakterizasyonu kolaylaştırmak38, aksonal taşıma39, yaşa bağlı aksonal mitokondri değişiklikler40, ve aksonal mitokondri morfolojisi41.
Açıklamalar
Yazarlar açıklayacak bir şey olmadığını beyan ediyorlar.
Teşekkürler
Tüm Neukomm laboratuvarına katkılarından dolayı teşekkür ederiz. Bu çalışma İsviçre Ulusal Bilim Vakfı (SNSF) Yardımcı Doçent ödülü (hibe 176855), Uluslararası Parapleji Araştırma Vakfı (IRP, grant P180), SNSF Spark (grant 190919) ve Lozan Üniversitesi'nin desteği ile desteklenmiştir. Temel Nöroloji Bölümü (État de Vaud) LJN için.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Tweezers (high precision, ultra fine) | EMS | 78520-5 | Antennal ablation |
| MicroPoint Scissors (5-mm cutting edge) | EMS | 72933-04 | Wing injury |
| 1.5 mL microcentrifuge tube | Eppendorf | 30120086.0000 | |
| 35mm tissue culture dish | Sarstedt | 83.3900 | |
| Cover Slips, Thickness 1 | Thermo Scientific™ | BB02400600A113MNT0 | |
| Superfrost Microscope Slides | Thermo Scientific™ | AA00008032E00MNT10 | |
| High-Sensitivity USB 2.0 CMOS Camera, 1280 x 1024, Global Shutter | Thorlabs | DCC1240M | Camera setup |
| SM1 Retaining Ring for Ø1" Lens Tubes and Mounts | Thorlabs | SM1RR | |
| 25mm 1/1.2" C mount Lens | Tamron | M112FM25 | |
| Adapter with External M27 x 0.5 Threads and Internal SM1 Threads | Thorlabs | SM1A36 | |
| Aspheric Condenser Lens, Ø25 mm, f=20.1 mm, NA=0.60, ARC: 650-1050 nm | Thorlabs | ACL2520U-B | |
| Ø25.0 mm Premium Longpass Filter, Cut-On Wavelength: 700 nm | Thorlabs | FELH0700 | |
| SM1 (1.035"-40) Coupler, External Threads, 0.5" Long | Thorlabs | SM1T2 | |
| SM1 Lens Tube Without External Threads, 1" Long, Two Retaining Rings Included | Thorlabs | SM1M10 | |
| 850 nm, 900 mW (Min) Mounted LED, 1200 mA | Thorlabs | M850L3 | IR LED spotlight |
| SM1 (1.035"-40) Coupler, External Threads, 0.5" Long | Thorlabs | SM1T2 | |
| SM1 Lens Tube Without External Threads, 2" Long, Two Retaining Rings Included | Thorlabs | SM1M20 | |
| Aspheric Condenser Lens, Ø25 mm, f=20.1 mm, NA=0.60, ARC: 650-1050 nm | Thorlabs | ACL2520U-B | |
| Ø25.0 mm Premium Longpass Filter, Cut-On Wavelength: 850 nm | Thorlabs | FELH0850 | |
| SM1 Retaining Ring for Ø1" Lens Tubes and Mounts | Thorlabs | SM1RR | |
| 660 nm, 940 mW (Min) Mounted LED, 1200 mA | Thorlabs | M660L4 | Red LED spotlight |
| Aspheric Condenser Lens, Ø25 mm, f=20.1 mm, NA=0.60, ARC: 650-1050 nm | Thorlabs | ACL2520U-B | |
| SM1 (1.035"-40) Coupler, External Threads, 0.5" Long | Thorlabs | SM1T2 | |
| SM1 Lens Tube Without External Threads, 2" Long, Two Retaining Rings Included | Thorlabs | SM1M20 | |
| 15 V, 2.4 A Power Supply Unit with 3.5 mm Jack Connector for One K- or T-Cube | Thorlabs | KPS101 | LED control |
| T-Cube LED Driver, 1200 mA Max Drive Current | Thorlabs | LEDD1B | |
| 150 mm x 300 mm x 12.7 mm Aluminum Breadboard, M6 Double-Density Taps | Thorlabs | MB1530/M | Mount base |
| Ø12.7 mm Universal Post Holder, Spring-Loaded Locking Thumbscrew, L = 75 mm | Thorlabs | UPH75/M | Mount, 3x (IR LED, red LED, cam) |
| Ø1.20" Slip Ring for SM1 Lens Tubes and C-Mount Extension Tubes, M4 Tap | Thorlabs | SM1RC/M | |
| Ø12.7 mm Optical Post, SS, M4 Setscrew, M6 Tap, L = 150 mm | Thorlabs | TR150/M | |
| Ø12.7 mm Optical Post, SS, M4 Setscrew, M6 Tap, L = 40 mm | Thorlabs | TR40/M | |
| Right-Angle Clamp for Ø1/2" Posts, 5 mm Hex | Thorlabs | RA90/M | |
| M6 x 1.0 Stainless Steel Cap Screw, 16 mm Long, Pack of 25 | Thorlabs | SH6MS16 | screws for mount onto base |
| USB-6001 14-Bit 20 kS/s Multifunction I/O and NI-DAQmx | National Instruments | 782604-01 | Red LED spotlight controller |
| 20k Ohm 1 Gang Linear Panel Mount Potentiometer | TT Electronics/BI | P230-2EC22BR20K | fintuner for indicator |
| IR (860nm) emitter, 100 mA radial | Osram | 475-1365-ND | Red light indicator |
| cable | - | - | Misc |
| All-trans retinal | Sigma | R2625 | |
| Ethanol absolute | Vwr | 20821.296 | |
| Halocarbon Oil 27 | Sigma | H8773 | |
| Mowiol | Merk | 81381 | |
| Paraformaldehyde | Sigma | F8775 | |
| Phosphate buffered saline (PBS) | Sigma | P5493 | |
| Sylgard 184 silicone elastomer base | Dow Corning Corp | 4019862 | |
| Sylgard 184 silicone elastomer curing agent | Dow Corning Corp | 4019862 | |
| Triton X-100 | Sigma | T8787 | |
| Chicken anti-GFP antibodies | Rockland | 600-901-215 | Antibodies |
| Goat Dylight anti-Chicken | Abcam | ab96947 | |
| FM7a, B | BDSC | RRID:BDSC_785 | X chromosome |
| FRT19A[hs-neo] | BDSC | RRID:BDSC_1709 | |
| hiw[ΔN] | BDSC | RRID:BDSC_51637 | |
| hs-FLP[12] | BDSC | RRID:BDSC_1929 | |
| tub-Gal80[LL1] | BDSC | RRID:BDSC_5132 | |
| w[1118] | BDSC | RRID:BDSC_3605 | |
| 20xUAS-IVS-CsChrimson::mVenus | BDSC | RRID:BDSC_55135 | 2nd chromosome |
| 5xUAS-Gal4[12B] | Kyoto | RRID:Kyoto_108492 | |
| 5xUAS-HA::dnmnat | BDSC | RRID:BDSC_39702 | |
| 5xUAS-mCD8::GFP[LL5] | BDSC | RRID:BDSC_5134 | |
| ase-FLP[2d] | Freeman laboratory | Neukomm et al., 2014 (PNAS) | |
| CyO | BDSC | RRID:BDSC_2555 | |
| dpr1-Gal4 | BDSC | RRID:BDSC_25083 | |
| OR22a-Gal4 | BDSC | RRID:BDSC_9952 | |
| ey-FLP[6] | BDSC | RRID:BDSC_5577 | 3rd chromosome |
| GMR60E02-Gal4 | BDSC | RRID:BDSC_39250 | |
| TM3,Sb,e | BDSC | RRID:BDSC_3644 |
Referanslar
- Matsuda, W., et al. Single Nigrostriatal Dopaminergic Neurons Form Widely Spread and Highly Dense Axonal Arborizations in the Neostriatum. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 29 (2), 444-453 (2009).
- Wedel, M. J. A Monument of Inefficiency: The Presumed Course of the Recurrent Laryngeal Nerve in Sauropod Dinosaurs. Acta Palaeontologica Polonica. 57 (2), 251-256 (2012).
- Mariano, V., Domínguez-Iturza, N., Neukomm, L. J., Bagni, C. Maintenance mechanisms of circuit-integrated axons. Current Opinion in Neurobiology. 53, 162-173 (2018).
- Conforti, L., Gilley, J., Coleman, M. P. Wallerian degeneration: an emerging axon death pathway linking injury and disease. Nature reviews Neuroscience. 15 (6), 394-409 (2014).
- Neukomm, L. J., Freeman, M. R. Diverse cellular and molecular modes of axon degeneration. Trends in Cell Biology. 24 (9), 515-523 (2014).
- Gustavsson, A., et al. Cost of disorders of the brain in Europe 2010. European Neuropsychopharmacology: The Journal of the European College of Neuropsychopharmacology. 21 (10), 718-779 (2011).
- Waller, A. Experiments on the Section of the Glossopharyngeal and Hypoglossal Nerves of the Frog, and Observations of the Alterations Produced Thereby in the Structure of Their Primitive Fibres. Philosophical Transactions of the Royal Society of London. 140, 423-429 (1850).
- Rosell, A. L., Neukomm, L. J. Axon death signalling in Wallerian degeneration among species and in disease. Open Biology. 9 (8), 190118(2019).
- Mack, T. G., et al. Wallerian degeneration of injured axons and synapses is delayed by a Ube4b/Nmnat chimeric gene. Nature Neuroscience. 4 (12), 1199-1206 (2001).
- Osterloh, J. M., et al. dSarm/Sarm1 is required for activation of an injury-induced axon death pathway. Science. 337 (6093), New York, NY. 481-484 (2012).
- Xiong, X., et al. The highwire ubiquitin ligase promotes axonal degeneration by tuning levels of nmnat protein. PLoS Biology. 10 (12), 1001440(2012).
- Neukomm, L. J., et al. Axon Death Pathways Converge on Axundead to Promote Functional and Structural Axon Disassembly. Neuron. 95 (1), 78-91 (2017).
- MacDonald, J. M., et al. The Drosophila cell corpse engulfment receptor Draper mediates glial clearance of severed axons. Neuron. 50 (6), 869-881 (2006).
- Neukomm, L. J., Burdett, T. C., Gonzalez, M. A., Zuchner, S., Freeman, M. R. Rapid in vivo forward genetic approach for identifying axon death genes in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 111 (27), 9965-9970 (2014).
- Lu, T. Y., et al. Axon degeneration induces glial responses through Draper-TRAF4-JNK signalling. Nature Communications. 8, 14355(2017).
- Lunn, E. R., Perry, V. H., Brown, M. C., Rosen, H., Gordon, S. Absence of Wallerian Degeneration does not Hinder Regeneration in Peripheral Nerve. The European Journal of Neuroscience. 1 (1), 27-33 (1989).
- Adalbert, R., et al. A rat model of slow Wallerian degeneration (Wld(S)) with improved preservation of neuromuscular synapses. The European Journal of Neuroscience. 21 (1), 271-277 (2005).
- Martin, S. M., O'Brien, G. S., Portera-Cailliau, C., Sagasti, A. Wallerian degeneration of zebrafish trigeminal axons in the skin is required for regeneration and developmental pruning. Development. 137 (23), Cambridge, England. 3985-3994 (2010).
- Feng, Y., et al. Overexpression of Wld(S) or Nmnat2 in Mauthner Cells by Single-Cell Electroporation Delays Axon Degeneration in Live Zebrafish. Journal of Neuroscience Research. 88 (15), 3319-3327 (2010).
- Gilley, J., Coleman, M. P. Endogenous Nmnat2 is an essential survival factor for maintenance of healthy axons. PLoS Biology. 8 (1), 1000300(2010).
- Babetto, E., Beirowski, B., Russler, E. V., Milbrandt, J., DiAntonio, A. The Phr1 ubiquitin ligase promotes injury-induced axon self-destruction. Cell Reports. 3 (5), 1422-1429 (2013).
- Gerdts, J., Summers, D. W., Sasaki, Y., DiAntonio, A., Milbrandt, J. Sarm1-mediated axon degeneration requires both SAM and TIR interactions. The Journal of Neuroscience. 33 (33), 13569-13580 (2013).
- Gerdts, J., Brace, E. J., Sasaki, Y., DiAntonio, A., Milbrandt, J. SARM1 activation triggers axon degeneration locally via NAD+ destruction. Science. 348 (6233), New York, NY. 453-457 (2015).
- Bridge, P. M., et al. Nerve crush injuries--a model for axonotmesis. Experimental Neurology. 127 (2), 284-290 (1994).
- Maxwell, W. L., Bartlett, E., Morgan, H. Wallerian Degeneration in the Optic Nerve Stretch-Injury Model of Traumatic Brain Injury: A Stereological Analysis. Journal of Neurotrauma. 32 (11), 780-790 (2015).
- Fang, Y., Soares, L., Teng, X., Geary, M., Bonini, N. M. A novel Drosophila model of nerve injury reveals an essential role of Nmnat in maintaining axonal integrity. Current Biology. 22 (7), 590-595 (2012).
- Janelia Farm Adult Drosophila Brain Dissection. , Available from: https://www.janelia.org/project-team/flylight/protocols (2015).
- Cold Spring Harbor. Mowiol mounting medium. Cold Spring Harbor Protocols. 2006 (1), (2006).
- Seeds, A. M., et al. A suppression hierarchy among competing motor programs drives sequential grooming in Drosophila. eLife. 3, 02951(2014).
- Hampel, S., Franconville, R., Simpson, J. H., Seeds, A. M. A neural command circuit for grooming movement control. eLife. 4, 08758(2015).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker for studies of gene function in neuronal morphogenesis. Neuron. 22 (3), 451-461 (1999).
- Vosshall, L. B., Wong, A. M., Axel, R. An olfactory sensory map in the fly brain. Cell. 102 (2), 147-159 (2000).
- Hampel, S., McKellar, C. E., Simpson, J. H., Seeds, A. M. Simultaneous activation of parallel sensory pathways promotes a grooming sequence in Drosophila. eLife. 6, (2017).
- Farley, J. E., et al. Transcription factor Pebbled/RREB1 regulates injury-induced axon degeneration. Proceedings of the National Academy of Sciences of the United States of America. 23 (6), (2018).
- Wang, H., et al. Rapid depletion of ESCRT protein Vps4 underlies injury-induced autophagic impediment and Wallerian degeneration. Science Advances. 5 (2), 4971(2019).
- Dietzl, G., et al. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 448 (7150), 151-156 (2007).
- Port, F., et al. A large-scale resource for tissue-specific CRISPR mutagenesis in Drosophila. bioRxiv. 102, 636076(2019).
- Vagnoni, A., Hoffmann, P. C., Bullock, S. L. Reducing Lissencephaly-1 levels augments mitochondrial transport and has a protective effect in adult Drosophila neurons. Journal of Cell Science. 129 (1), 178-190 (2016).
- Vagnoni, A., Bullock, S. L. A cAMP/PKA/Kinesin-1 Axis Promotes the Axonal Transport of Mitochondria in Aging Drosophila Neurons. Current Biology. 28 (8), 1265-1272 (2018).
- Cao, X., et al. In vivo imaging reveals mitophagy independence in the maintenance of axonal mitochondria during normal aging. Aging Cell. 16 (5), 1180-1190 (2017).
- Smith, G. A., et al. Glutathione S-Transferase Regulates Mitochondrial Populations in Axons through Increased Glutathione Oxidation. Neuron. 103 (1), 52-65 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır