A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحريض من منتشر إصابة الدماغ أكسونال في الفئران على أساس تسارع التناوب
* These authors contributed equally
In This Article
Summary
هذا البروتوكول بالتحقق من صحة موثوق بها وسهلة الأداء واستنساخ نموذج القوارض من الدماغ منتشر إصابة المحور (DAI) الذي يسبب تلف المادة البيضاء على نطاق واسع دون كسور الجمجمة أو كدمات.
Abstract
إصابة الدماغ الرضية (TBI) هي السبب الرئيسي للوفاة والعجز. الإصابة المحورة المنتشرة (DAI) هي الآلية الغالبة للإصابة في نسبة كبيرة من مرضى TBI الذين يحتاجون إلى دخول المستشفى. DAI ينطوي على ضرر عصبي واسع النطاق من اهتزاز, دوران أو إصابة الانفجار, مما يؤدي إلى إصابة التمدد المحوري السريع والتغيرات المحورية الثانوية التي ترتبط مع تأثير طويل الأمد على الانتعاش الوظيفي. تاريخيا، النماذج التجريبية من DAI دون إصابة البؤري كان من الصعب تصميم. هنا نحن التحقق من صحة نموذج القوارض بسيطة وموثوق بها واستنساخ من DAI الذي يسبب تلف المادة البيضاء على نطاق واسع دون كسور الجمجمة أو كدمات.
Introduction
إصابة الدماغ الرضية (TBI) هي سبب رئيسي للوفاة والعجز في الولايات المتحدة. TBIs تساهم في حوالي 30٪ من جميع الوفيات المرتبطة بالإصابات1,2. تختلف الأسباب الرئيسية لـ TBI بين الفئات العمرية وتشمل السقوط والاصطدامات عالية السرعة أثناء الرياضة وإيذاء الذات المتعمد وحوادث السيارات والاعتداءات1و2و3.
إصابة محورية منتشر في الدماغ (DAI) هي نوع معين من TBI الناجمة عن تسارع الدوران أو الهز أو إصابة الانفجار في الدماغ الناتجة عن حركة الرأس غير المقيدة في لحظة بعد الإصابة4،5،6،7،8. DAI ينطوي على أضرار عصبية واسعة النطاق مما يؤدي إلى ضعف عصبي طويل الأمد يرتبط بالنتيجة السيئة ، وتكاليف الرعاية الصحية المرهقة ، ومعدل الوفيات 33-64٪1،2،4،,5،9،10،11. على الرغم من البحوث الهامة الأخيرة في الإمراض من DAI, لم يكن هناك توافق في الآراء حول أفضل خيارات العلاج11,,12,,13,,14.
على مدى العقود الماضية، حاولت العديد من النماذج التجريبية لتكرار بدقة جوانب مختلفة من DAI11،12،15،16. ومع ذلك، هذه النماذج لديها قيود نظرا للعرض الفريد من DAI بالمقارنة مع الإصابات البؤرية الأخرى. هذه النماذج السابقة ليس فقط تسبب إصابة محورية في مناطق المادة البيضاء ولكن أيضا يؤدي إلى إصابات الدماغ البؤري. سريريا، ويرافق DAI نزيف صغير، والتي قد تشكل سببا رئيسيا للضرر الذي يلحق بالمادة البيضاء.
وقد ثبت نموذجين فقط على الحيوانات لتكرار السمات السريرية الرئيسية لDAI. أنتجت Gennarelli وزملاؤه أول جهاز دوران الرأس الجانبي في عام 1982 ، وذلك باستخدام تسارع دوران الرأس غير الارتقان للحث على الغيبوبة مع DAI في نموذج الرئيسيات غير البشرية15. هذا النموذج الرئيسي اتّهم بالتناوب المتحكم به للتسارع والتباطؤ لإزاحة الرأس من خلال 60 درجة في غضون 10-20 مللي ثانية، وكانت هذه التقنية قادرة على محاكاة ضعف الوعي والضرر المحوري على نطاق واسع الذي يشبه آثار TBI الشديدة التي لوحظت في أدمغة الإنسان. ومع ذلك، نماذج4الرئيسيات مكلفة جدا4،11،,16. استنادا إلى نموذج سابق, نموذج خنزير من تسارع دوران إصابات الدماغ تم تصميمه في 1994 (روس وآخرون.) مع نتائج مماثلة14.
وقد أضاف هذان النموذجان الحيوانيان ، على الرغم من أنهما أنتجا عروضًا مختلفة من علم الأمراض النموذجي ، إلى حد كبير إلى مفاهيم التهاب الإمراض DAI. يتم قبول دوران الرأس السريع بشكل عام كأفضل طريقة لتحفيز DAI ، وتوفر القوارض نموذجًا أقل تكلفة لدراسات دوران الرأس السريع11،16. هنا، نحن التحقق من صحة نموذج القوارض بسيطة وموثوق بها واستنساخ من DAI الذي يسبب تلف المادة البيضاء على نطاق واسع دون كسور الجمجمة أو كدمات. هذا النموذج الحالي سوف تمكن من فهم أفضل للفيزيولوجيا المرضية من DAI وتطوير علاجات أكثر فعالية.
Protocol
وأجريت التجارب بناء على توصيات إعلاني هلسنكي وطوكيو وللمبادئ التوجيهية لاستخدام الحيوانات التجريبية للجماعة الأوروبية. وقد وافقت لجنة رعاية الحيوانات التابعة لجامعة بن غوريون في النقب على هذه التجارب.
1. إعداد الفئران للإجراء التجريبي
ملاحظة: حدد الفئران الذكور الكبار سبراغ-داولي وزنها 300-350 غرام.
- الحصول على الموافقة على إجراء هذه التجارب من اللجنة المؤسسية لرعاية الحيوان واستخدامه.
- الحفاظ على الفئران في درجة حرارة الغرفة من 22 ± 1 درجة مئوية، مع ضوء 12 ساعة ودورات مظلمة 12 ساعة. توفير تشاو الفئران والمياه الإعلانية libitum.
- إجراء جميع التجارب بين الساعة 6:00 صباحاً و12:00 ظهراً.
- استخدام نظام إدارة الإيزوفدران المستمر للحث على التخدير. تأكد من أن نظام المبخّر مليء بالإيزوفدران.
- قم بأضاة الفئران بـ 2% من الإيزوفيران
- تأكد من أن الفئران هو مُسبّس بالكامل من خلال ملاحظة نقص الحركة أو انعكاس الدواسة استجابة لمحفزات خارجية.
2. تحريض من إصابة عصبيّة منتشر
ملاحظة: يتكون الجهاز من المكونات التالية: 1) اسطوانة بلاستيكية شفافة، 2) وزن الحديد (1308 ز)، 3) آلية دوران تتكون من أنبوب أسطواني، ومحامل اثنين يدور عليها المحور ومثبت الرأس (لدبابيس الأذن)؛ 4) منصة أفقية التي هي ثابتة اثنين محامل.
- ضع الجهاز على طاولة مختبر ثقيلة ومستقرة.
- إرفاق الوزن إلى سلسلة التي يتم رفعها إلى ارتفاع 120 سم.
- السماح للوزن السقوط بحرية لتصل إلى الترباس، وتفعيل آلية التناوب. باستخدام جهاز دوران الرأس الجانبي ، يتم تشغيل رأس القوارض بسرعة من 0 إلى 90 درجة.
- بعد تحريض إصابة الدماغ المحوري المنتشر، نقل الفئران إلى غرفة الإنعاش.
3. قياس المعالم الحركية الدورانية / البيوميكانيكية.
- قياس الحركية الدورانية / المعلمات الميكانيكية الحيوية على النحو التالي:
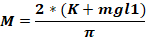
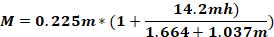

حيث Fس - القوة المطبقة على رأس الحيوان (كجم)؛ M - لحظة القوة؛ K – الطاقة الحركية; م – كتلة من انخفاض الوزن; ز - تسارع الجاذبية؛ ح – الارتفاع (سم)؛ د – المسافة بين دبابيس الأذن (سم).
ملاحظة: لحساب القوة المطبقة على رأس الحيوان (Fo)،من الضروري معرفة كتلة الوزن المتساقط، والطول الذي يسقط عليه الوزن، والمسافة بين دبابيس الأذن. تبقى المعلمات الأخرى دون تغيير.
4. تقييم درجة شدة عصبية بعد 48 ساعة
ملاحظة: تم تقييم العجز العصبي وتصنيفه باستخدام درجة شدة عصبية، كما سبق وصفه17،18،19. يتم تقييم التعديلات في الوظيفة الحركية والسلوك من قبل نظام نقطة بحيث درجة الحد الأقصى من 24 يمثل خلل عصبي حاد. تشير درجة 0 إلى حالة عصبية سليمة. يتم تقييم الوظائف السلوكية التالية.
- تقييم عدم قدرة الجرذ على الخروج من دائرة (قطرها 50 سم) عند تركها في وسطها. قم بإجراء هذا لثلاث جلسات فردية تدوم 30 دقيقة و60 دقيقة وأكثر من 60 دقيقة.
- اختبار الفئران لفقدان رد الفعل الحق في ثلاث جلسات تستمر 20 دقيقة، 40 دقيقة، وأكثر من 60 دقيقة.
- إجراء اختبار لhemiplegia، وعدم قدرة الفئران على مقاومة التغيرات القسرية في الموقف.
- رفع الجرذ من ذيله لاختبار الانثناء من المؤخرة.
- ضع الجرذ على الأرض لاختبار قدرته على المشي مباشرة.
- اختبار لثلاث ردود فعل منفصلة: رد الفعل pinna، رد الفعل القرنية، ومنعكس الانعكس البجل.
- معدل الفئران مع الصف السريري على أساس فقدان البحث عن السلوك والسجود.
- اختبار ردود الفعل الطرفللوضع. إجراء الاختبار على الأطراف الأمامية اليسرى واليمنى، ومن ثم الأطراف الخلفية اليسرى واليمنى.
- إجراء اختبار وظيفي عبر مهمة موازنة الحزمة. يجب أن يقيس الشعاع 1.5 سم. قم بتشغيل الاختبار لجلسات من 20 s و 40 s وأكثر من 60 s.
- إجراء اختبار المشي شعاع على الفئران مع الحزم من ثلاثة عروض مختلفة: 8.5 سم واسعة، 5 سم واسعة، و 2.5 سم واسعة.
5. جمع الدماغ للفحص النسيجي بعد 48 ساعة
- في 48 ساعة بعد الإصابة، القتل الرحيم الفئران عن طريق استبدال خليط الغاز مستوحاة مع 20٪ O2/ 80٪ CO2. ضمان تسليمثاني أكسيد الكربون بمعدل محدد مسبقًا وفقًا للمبادئ التوجيهية للجنة رعاية الحيوانات واستخدامها المؤسسية.
- ضمان تأكيد الوفاة وفقًا للمبادئ التوجيهية للجنة مؤسسية لرعاية الحيوان واستخدامه.
- عبر القلب يبشر الفئران مع 0.9٪ الهيل الهيبارين في درجة حرارة 4 °C، تليها 500 مل من 4٪ باراماديهايد في 0.1 M الفوسفات العازلة المالحة (درجة الحموضة 7.4).
- بعد التبرّق، قم بعملية قطع الرأس بمقصلة.
- إجراء جمع الدماغ عن طريق إزالة calvarias مع ملقط قطع العظام لتجنب تلف أنسجة الدماغ.
- إزالة الدماغ على الفور وإصلاح في محلول الفورمالديهايد المخزنة مؤقتا 4٪ لمدة 48 ساعة في 4 درجة مئوية.
- كتلة العقول في أقسام إكليلية 5 ملم من وجه لمبة شمي ة إلى القشرة البصرية وتقسيم المخيخ وينبع الدماغ.
- بعد تضمين البارافين، قطع أقسام التاجية وsagittal (5 ميكرون) بعيدا عن المهاد عن طريق المقاطع الميكروتومي.
6. تلطيخ المناعة الكيميائية والفحص
- ضع الشرائح برفق على شرائح زجاجية مع فرشاة ناعمة، شريحة واحدة لكل شريحة.
- إنتاج تلطيخ كيميائي من αAPP.
- شرائح Deparaffinize مع الزيلين (3 مرات لمدة 5 دقيقة لكل منهما) وإعادة الترطيب مع تركيزات الإيثانول منخفضة تدريجيا في درجة حرارة الغرفة: 3 دقيقة في الإيثانول 100٪ مرتين، 3 دقيقة في 95٪ الإيثانول مرتين، 3 دقيقة في 90٪ الإيثانول، 3 دقيقة في الإيثانول 70٪ الإيثانول، و 3 دقيقة في DDW.
- علاج أقسام الدماغ deparaffinized وrehydrated مع 3٪ H2O2 لمدة 15 دقيقة في درجة حرارة الغرفة لمنع نشاط البيروكسيداز الذاتي.
- أقسام الاحتضان مع سترات الصوديوم 0.01 M (درجة الحموضة 6.0) في 98 درجة مئوية لمدة 5 دقيقة لاسترجاع المستضد.
- الحفاظ على الشرائح في المخزن المؤقت لمدة 20 دقيقة في درجة حرارة الغرفة لتبرد.
- غسل المقاطع مع محلول المالحة المخزنة مؤقتاً (PBS) مرتين لمدة 5 دقيقة.
- منع المقاطع مع 2.5٪ مصل الحصان العادي لمدة 1 ساعة في درجة حرارة الغرفة واحتضان بين عشية وضحاها في 4 درجة مئوية في الأرنب الرئيسي المضادة APP (1:4000) المخفف في مصل الحجب.
- بعد الحضانة في الأجسام المضادة الأولية، وغسل أقسام في برنامج تلفزيوني في درجة حرارة الغرفة.
- تحضن أقسام في الأجسام المضادة الثانوية المخففة بشكل مناسب لمدة 15 دقيقة وتغسل مع PBS لمدة 3 دقيقة مرتين في درجة حرارة الغرفة.
- الاحتضان في العقديات-البيروكسيداز لمدة 15 دقيقة ويغسل مرة أخرى في برنامج تلفزيوني لمدة 3 دقيقة مرتين في درجة حرارة الغرفة.
- أقسام الحاضنة مع محلول الركيزة العازلة (درجة الحموضة 7.5) التي تحتوي على بيروكسيد الهيدروجين و3،3-diaminobenzidine chromogen الحل وحماية من الضوء حتى يتم تطوير اللون.
- احتضان الشرائح مع DDW في درجة حرارة الغرفة لمدة 5 دقيقة من أجل وقف رد الفعل.
- مقاطع مضادة مع الهيماتوكسيلين لمدة 3 دقيقة في درجة حرارة الغرفة ويغسل لمدة 5 دقيقة مع مياه الصنبور المتدفقة.
- تجفيف الشرائح مع زيادة تركيزات الإيثانول تدريجيا في درجة حرارة الغرفة: 2 دقيقة في DDW، 2 دقيقة في 70٪ الإيثانول، 2 دقيقة في 90٪ الإيثانول، 2 دقيقة في الإيثانول 95٪، 2 دقيقة في الإيثانول 100٪، و 3 دقيقة في الزيلين ثلاث مرات.
- الجافة وجبل مع المتوسطة المتصاعدة.
- فحص شرائح تحت المجهر التكبير من 200x مع عدسة الهدف 20 ملم باستخدام المجهر.
النتائج
ويوضح الجدول 1 الجدول الزمني للبروتوكول. وكان معدل الوفيات في هذا النموذج من DAI 0٪. وأشار اختبار مان ويتني إلى أن العجز العصبي كان أكبر بكثير بالنسبة للفئران 15 DAI مقارنة بالفئران الصورية الـ 15 في 48 ساعة بعد التدخل (Mdn = 1 مقابل 0)، U = 22.5، p & 0.001، r = 0.78 (انظر الجدول 2). يتم قياس البيا...
Discussion
يصف هذا البروتوكول نموذج القوارض من DAI. في DAI، يؤدي التسارع الدوراني على الدماغ إلى تأثير القص الذي يؤدي إلى تغييرات عصبية وكيميائية حيوية تؤدي إلى فقدان الوظيفة المحورية في عملية تدريجية. يتم إنتاج التغيرات المحورية الثانوية من قبل إصابة التمدد المحوري السريع وهي متغيرة في مداها وشدتها
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
ويعرب المؤلفان عن امتنانهما للدكتور ناثان كليورين (قسم الهندسة الميكانيكية، جامعة بن غوريون في النقب) على مساعدته في القياسات الميكانيكية الحيوية. كما نشكر البروفيسورة أولينا سيفيلنوفسكا، ومارينا كوشينيفا، وماكسيم كريفونوسوف، وداريا ياكومينيكو، وإيفجينيا غونتشاريك من قسم علم وظائف الأعضاء، كلية البيولوجيا، والبيئة، والطب، جامعة أوليس هونشار دنيبرو، دنيبرو، أوكرانيا على دعمها ومساهماتها المفيدة في مناقشاتنا.
Materials
| Name | Company | Catalog Number | Comments |
| 0.01 M sodium citrate | SIGMA - ALDRICH | ||
| 2.5% normal horse serum | SIGMA - ALDRICH | H0146 | Liquid |
| 4 % buffered formaldehyde solution | |||
| Anti-Amyloid Precursor Protein, C - terminal antibodyproduced in rabbit | SIGMA - ALDRICH | Lot 056M4867V | |
| biotinylated secondary antibody | Vector | BA-1000-1.5 | 10 mM sodium phosphate, pH 7.8, 0.15 M NaCl, 0.08% sodium azide, 3 mg/ml bovine serum albumin |
| bone-cutting forceps | |||
| DAB Peroxidase (HRP) Substrate Kit (with Nickel), 3,3’-diaminobenzidine | vector laboratory | ||
| embedding cassettes | |||
| ethanol 99.9 % | ROMICAL | Flammable Liquid | |
| guillotine | |||
| Hematoxylin | SIGMA - ALDRICH | H3136-25G | |
| Hydrogen peroxide solution | Millipore | 88597-100ML-F | |
| Isofluran, USP 100% | Piramamal Critical Care, Inc | ||
| Olympus BX 40 microscope | Olympus | ||
| paraffine | paraplast plus leica biosystem | Tissue embedding medium | |
| phosphate-buffered saline (PBS) | SIGMA - ALDRICH | P5368-10PAK | Contents of one pouch, when dissolved in one liter of distilled or deionized water, will yield 0.01 M phosphate buffered saline (NaCl 0.138 M; KCl - 0.0027 M); pH 7.4, at 25 °C. |
| Streptavidin HRP | ABCAM | ab64269 | Streptavidin-HRP for use with biotinylated secondary antibodies during IHC / immunohistochemistry. |
| xylene |
References
- Faul, M., Wald, M. M., Xu, L., Coronado, V. G. Traumatic brain injury in the United States; emergency department visits, hospitalizations, and deaths, 2002-2006. US Government. , (2010).
- Taylor, C. A., Bell, J. M., Breiding, M. J., Xu, L. Traumatic Brain Injury-Related Emergency Department Visits, Hospitalizations, and Deaths - United States, 2007 and 2013. MMWR Surveillance Summaries. 66, 1-16 (2017).
- Peterson, A. B., Xu, L., Daugherty, J., Breiding, M. J. Surveillance report of traumatic brain injury-related emergency department visits, hospitalizations, and deaths, United States, 2014. US Government. , (2014).
- Su, E., Bell, M. Diffuse axonal injury. Translational Research in Traumatic Brain Injury. 57, 41 (2016).
- Hammoud, D. A., Wasserman, B. A. Diffuse axonal injuries: pathophysiology and imaging. Neuroimaging Clinics. 12, 205-216 (2002).
- Adams, J. H., Graham, D. I., Gennarelli, T. A., Maxwell, W. L. Diffuse axonal injury in non-missile head injury. Journal of Neurology, Neurosurgery, and Psychiatry. 54, 481-483 (1991).
- Slazinski, T., Johnson, M. C. Severe diffuse axonal injury in adults and children. Journal of Neuroscience Nursing. 26, 151-154 (1994).
- Gentleman, S. M., et al. Axonal injury: a universal consequence of fatal closed head injury. Acta Neuropathologica. 89, 537-543 (1995).
- Marehbian, J., Muehlschlegel, S., Edlow, B. L., Hinson, H. E., Hwang, D. Y. Medical Management of the Severe Traumatic Brain Injury Patient. Neurocritical Care. 27, 430-446 (2017).
- Adams, J. H., et al. Diffuse axonal injury in head injury: definition, diagnosis and grading. Histopathology. 15, 49-59 (1989).
- Xiao-Sheng, H., Sheng-Yu, Y., Xiang, Z., Zhou, F., Jian-ning, Z. Diffuse axonal injury due to lateral head rotation in a rat model. Journal of Neurosurgery. 93, 626-633 (2000).
- Ross, D. T., Meaney, D. F., Sabol, M. K., Smith, D. H., Gennarelli, T. A. Distribution of forebrain diffuse axonal injury following inertial closed head injury in miniature swine. Experimental Neurology. 126, 291-299 (1994).
- Bullock, R. Opportunities for neuroprotective drugs in clinical management of head injury. Journal of Emergency Medicine. 11, 23-30 (1993).
- Gennarelli, T. A. Mechanisms of brain injury. Journal of Emergency Medicine. 11, 5-11 (1993).
- Gennarelli, T. A., et al. Diffuse axonal injury and traumatic coma in the primate. Annals of Neurology. 12, 564-574 (1982).
- Xiaoshengi, H., Guitao, Y., Xiang, Z., Zhou, F. A morphological study of diffuse axonal injury in a rat model by lateral head rotation trauma. Acta Neurologica Belgica. 110, 49-56 (2010).
- Zlotnik, A., et al. beta2 adrenergic-mediated reduction of blood glutamate levels and improved neurological outcome after traumatic brain injury in rats. Journal of Neurosurgical Anesthesiology. 24, 30-38 (2012).
- Boyko, M., et al. An Alternative Model of Laser-Induced Stroke in the Motor Cortex of Rats. Biological Procedures Online. 21, 9 (2019).
- Boyko, M., et al. The neuro-behavioral profile in rats after subarachnoid hemorrhage. Brain Research. 1491, 109-116 (2013).
- Ma, J., Zhang, K., Wang, Z., Chen, G. Progress of Research on Diffuse Axonal Injury after Traumatic Brain Injury. Neural Plasticity. 2016, 9746313 (2016).
- Medana, I. M., Esiri, M. M. Axonal damage: a key predictor of outcome in human CNS diseases. Brain. 126, 515-530 (2003).
- Tang-Schomer, M. D., Johnson, V. E., Baas, P. W., Stewart, W., Smith, D. H. Partial interruption of axonal transport due to microtubule breakage accounts for the formation of periodic varicosities after traumatic axonal injury. Experimental Neurology. 233, 364-372 (2012).
- Johnson, V. E., Stewart, W., Smith, D. H. Traumatic brain injury and amyloid-beta pathology: a link to Alzheimer's disease. Nature Reviews Neuroscience. 11, 361-370 (2010).
- Sherriff, F. E., Bridges, L. R., Sivaloganathan, S. Early detection of axonal injury after human head trauma using immunocytochemistry for beta-amyloid precursor protein. Acta Neuropathologica. 87, 55-62 (1994).
- Reichard, R. R., White, C. L., Hladik, C. L., Dolinak, D. Beta-amyloid precursor protein staining of nonaccidental central nervous system injury in pediatric autopsies. Journal of Neurotrauma. 20, 347-355 (2003).
- Gentleman, S. M., Nash, M. J., Sweeting, C. J., Graham, D. I., Roberts, G. W. Beta-amyloid precursor protein (beta APP) as a marker for axonal injury after head injury. Neuroscience Letters. 160, 139-144 (1993).
- Smith, D. H., Hicks, R., Povlishock, J. T. Therapy development for diffuse axonal injury. Journal of Neurotrauma. 30, 307-323 (2013).
- McKenzie, K. J., et al. Is beta-APP a marker of axonal damage in short-surviving head injury. Acta Neuropathologica. 92, 608-613 (1996).
- Wilkinson, A., Bridges, L., Sivaloganathan, S. Correlation of survival time with size of axonal swellings in diffuse axonal injury. Acta Neuropathologicaogica. 98, 197-202 (1999).
- Thompson, H. J., et al. Lateral fluid percussion brain injury: a 15-year review and evaluation. Journal of Neurotrauma. 22, 42-75 (2005).
- Alder, J., Fujioka, W., Lifshitz, J., Crockett, D. P., Thakker-Varia, S. Lateral fluid percussion: model of traumatic brain injury in mice. Journal of Visualized Experiments. , e3063 (2011).
- Povlishock, J., Marmarou, A., McIntosh, T., Trojanowski, J., Moroi, J. Impact acceleration injury in the rat: evidence for focal axolemmal change and related neurofilament sidearm alteration. Journal of Neuropathology & Experimental Neurology. 56, 347-359 (1997).
- Heath, D. L., Vink, R. Impact acceleration-induced severe diffuse axonal injury in rats: characterization of phosphate metabolism and neurologic outcome. Journal of Neurotrauma. 12, 1027-1034 (1995).
- Lighthall, J. W. Controlled cortical impact: a new experimental brain injury model. Journal of Neurotrauma. 5, 1-15 (1988).
- Palmer, A. M., et al. Traumatic brain injury-induced excitotoxicity assessed in a controlled cortical impact model. Journal of Neurochemistry. 61, 2015-2024 (1993).
- Hamm, R. J., et al. Cognitive deficits following traumatic brain injury produced by controlled cortical impact. Journal of Neurotrauma. 9, 11-20 (1992).
- Nyanzu, M., et al. Improving on Laboratory Traumatic Brain Injury Models to Achieve Better Results. International Journal of Medical Sciences. 14, 494-505 (2017).
- Xiong, Y., Mahmood, A., Chopp, M. Animal models of traumatic brain injury. Nature Reviews Neuroscience. 14, 128-142 (2013).
- Lighthall, J. W., Dixon, C. E., Anderson, T. E. Experimental models of brain injury. Journal of Neurotrauma. 6, 83-97 (1989).
- Meaney, D. F., et al. Modification of the cortical impact model to produce axonal injury in the rat cerebral cortex. Journal of Neurotrauma. 11, 599-612 (1994).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved