È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Induzione di lesioni cerebrali assonali diffuse nei ratti in base all'accelerazione rotazionale
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo convalida un modello di roditore affidabile, facile da eseguire e riproducibile di lesioni assonali diffuse dal cervello (DAI) che induce danni diffusi alla materia bianca senza fratture o contusioni al cranio.
Abstract
La lesione cerebrale traumatica (TBI) è una delle principali cause di morte e disabilità. Lesioni assonali diffuse (DAI) è il meccanismo predominante di lesioni in una grande percentuale di pazienti TBI che necessitano di ricovero in ospedale. IL DAI comporta un diffuso danno assonale dovuto a uno scuotimento, una rotazione o lesioni da scoppio, che porta a una rapida lesione assonale e a cambiamenti assonali secondari associati a un impatto duraturo sul recupero funzionale. Storicamente, i modelli sperimentali di DAI senza lesioni focali sono stati difficili da progettare. Qui convalidiamo un modello di roditore semplice, riproducibile e affidabile di DAI che causa danni diffusi alla materia bianca senza fratture o contusioni al cranio.
Introduzione
Lesione cerebrale traumatica (TBI) è una delle principali cause di morte e disabilità negli Stati Uniti. I TBI contribuiscono a circa il 30% di tutti i decessi correlati alle lesioni1,2. Le principali cause di TBI differiscono tra le fasce di età e includono cadute, collisioni ad alta velocità durante lo sport, autolesionismo intenzionale, incidenti automobilistici e assalti1,2,3.
La lesione assonale diffusa del cervello (DAI) è un tipo specifico di TBI indotto dall'accelerazione rotazionale, scuotendo o lesione di scoppio del cervello risultante dal movimento senza restrizioni della testa nell'istante dopo la lesione4,5,6,7,8. DAI comporta un diffuso danno assonale che porta a un danno neurologico di lunga durata associato a scarsi esiti, costi sanitari gravosi e un tasso di mortalità del 33-64%1,2,4,5,9,10,11. Nonostante una recente ricerca significativa sulla patogenesi del DAI, non c'è stato un consenso sulle migliori opzioni di trattamento11,12,13,14.
Negli ultimi decenni, numerosi modelli sperimentali hanno tentato di replicare con precisione diversi aspetti di DAI11,12,15,16. Tuttavia, questi modelli hanno limitazioni data la presentazione unica di DAI rispetto ad altre lesioni focali. Questi modelli precedenti non solo causano lesioni assonali nelle regioni della materia bianca, ma provocano anche lesioni cerebrali focali. Clinicamente, DAI è accompagnato da micro emorragie, che possono costituire una grande causa di danni alla materia bianca.
Solo due modelli animali hanno dimostrato di replicare le caratteristiche cliniche chiave del DAI. Gennarelli e colleghi hanno prodotto il primo dispositivo di rotazione della testa laterale nel 1982, utilizzando l'accelerazione rotazionale della testa senza impatto per indurre il coma con DAI in un primate non umano modello15. Questo modello di primate utilizzava una singola rotazione controllata per l'accelerazione e la decelerazione per passare la testa a 60 gradi entro 10-20 ms. Questa tecnica è stata in grado di emulare la coscienza compromessa e danni assonali diffusi che assomigliavano agli effetti di una grave TBI osservata nei cervelli umani. Tuttavia, i modelli di primati sono molto costosi4,11,16. Basato in parte sul modello precedente, un modello suinato di lesione cerebrale a accelerazione rotazionale è stato progettato nel 1994 (Ross et al.) con risultati simili14.
Questi due modelli animali, anche se hanno prodotto diverse presentazioni di patologia tipica, hanno aggiunto notevolmente ai concetti di patogenesi DAI. La rotazione rapida della testa è generalmente accettata come il metodo migliore per indurre DAI, e i roditori forniscono un modello meno costoso per gli studi di rotazione rapida della testa11,16. Qui, convalidiamo un modello di roditore semplice, riproducibile e affidabile di DAI che causa danni diffusi alla materia bianca senza fratture del cranio o contusioni. Questo modello attuale consentirà una migliore comprensione della fisiopatologia del DAI e lo sviluppo di trattamenti più efficaci.
Protocollo
Gli esperimenti sono stati condotti in base alle raccomandazioni delle dichiarazioni di Helsinki e Di Oleosa e alle linee guida per l'uso degli animali sperimentali della Comunità europea. Gli esperimenti sono stati approvati dal Comitato per la cura degli animali dell'Università Ben-Gurion del Negev.
1. Preparazione dei ratti per la procedura sperimentale
NOTA: Selezionare i ratti Maschi Adulti Sprague-Dawley del peso di 300-350 g.
- Ottenere l'approvazione per l'esecuzione di questi esperimenti dal Comitato istituzionale per la cura e l'uso degli animali.
- Mantenere i ratti a una temperatura ambiente di 22 x 1 gradi centigradi, con 12 ore di luce e cicli scuri di 12 ore. Fornire ratto chow e acqua ad libitum.
- Eseguire tutti gli esperimenti tra le 6:00 e le 12:00 p.m.
- Utilizzare un sistema di amministrazione isoflurano continuo per indurre l'anestesia. Assicurarsi che il sistema vaporizzatore sia riempito con isoflurane.
- Anestesizzare i ratti con 2% isoflurane.
- Confermare che il ratto è completamente anestetizzato osservando una mancanza di movimento o riflesso del pedale in risposta a uno stimolo esterno.
2. Induzione di lesioni assonali diffuse
NOTA: Il dispositivo è costituito dai seguenti componenti: 1) cilindro di plastica trasparente, 2) peso di ferro (1308 g), 3) meccanismo di rotazione costituito da un tubo cilindrico, due cuscinetti su cui ruota l'asse e una fissazione della testa (per perni auricolari); 4) piattaforma orizzontale su cui sono fissati due cuscinetti.
- Posizionare il dispositivo su un tavolo da laboratorio pesante e stabile.
- Fissare il peso a una corda elevata a un'altezza di 120 cm.
- Permettere al peso che cade liberamente di colpire il bullone, attivando il meccanismo di rotazione. Utilizzando il dispositivo di rotazione laterale della testa, la testa del roditore viene ruotata rapidamente da 0 a 90 gradi.
- Dopo l'induzione di lesioni cerebrali assonali diffuse, trasferire il ratto in una stanza di recupero.
3. Misurazione dei parametri rotativi Kinematics/Biomeccanici.
- Misurare i parametri di kinematica/biomeccanica rotazionale come segue:
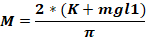
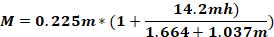

dove Fo - forza applicata alla testa animale (kg); M – momento di forza; K – energia cinetica; m – massa del peso in caduta; g - accelerazione gravitazionale; h – altezza (cm); D – distanza tra i perni dell'orecchio (cm).
NOTA: Per calcolare la forza applicata alla testa dell'animale (Fo), è necessario conoscere la massa del peso che cade, l'altezza alla quale il peso cade e la distanza tra i perni dell'orecchio. Gli altri parametri rimangono invariati.
4. Valutazione del punteggio di gravità neurologica dopo 48 ore
NOTA: I deficit neurologici sono stati valutati e classificati utilizzando un punteggio di gravità neurologica, come descritto in precedenza17,18,19. Le alterazioni della funzione e del comportamento motorio sono valutate da un sistema a punti in modo tale che un punteggio massimo di 24 rappresenti una grave disfunzione neurologica. Un punteggio pari a 0 indica lo stato neurologico intatto. Vengono valutate le seguenti funzioni comportamentali.
- Valutare l'incapacità del ratto di uscire da un cerchio (50 cm di diametro) quando lasciato al centro. Eseguire questa operazione per tre sessioni individuali della durata di 30 min, 60 min e più di 60 min.
- Prova il ratto per una perdita di riflesso di raddalquio in tre sessioni della durata di 20 min, 40 min e oltre 60 min.
- Eseguire il test per l'emiplegia, l'incapacità del ratto di resistere ai cambiamenti forzati in posizione.
- Sollevare il ratto per la coda per testare la flessione dell'arto posteriore.
- Posizionare il ratto sul pavimento per testare la sua capacità di camminare dritto.
- Prova per tre riflessi separati: il riflesso pinna, il riflesso corneale e il riflesso di partenza.
- Valutare il ratto con un grado clinico basato sulla perdita di comportamento alla ricerca e prostrazione.
- Testare i riflessi degli arti per il posizionamento. Eseguire il test sugli arti anteriori sinistro e destro, quindi sugli arti posteriori sinistro e destro.
- Eseguire un test funzionale tramite l'attività di bilanciamento del fascio. La trave deve misurare 1,5 cm di larghezza. Eseguire il test per sessioni di 20 s, 40 s e più di 60 s.
- Eseguire test a piedi del fascio sul ratto con travi di tre diverse larghezze: 8,5 cm di larghezza, 5 cm di larghezza e 2,5 cm di larghezza.
5. Raccolta del cervello per l'esame istologico dopo 48 ore
- A 48 ore dopo l'infortunio, eutanasia i ratti sostituendo la loro miscela di gas ispirata con 20% O2/ 80% CO2. Assicurarsi checo2 sia consegnata ad un tasso predeterminato in conformità con le linee guida del Comitato istituzionale per la cura e l'uso degli animali.
- Garantire la conferma della morte in conformità con le linee guida del Comitato istituzionale per la cura e l'uso degli animali.
- Traspatriare trascardiacamente il ratto con lo 0,9% di salinella eparinizzata alla temperatura di 4 gradi centigradi, seguito da 500 mL di paraformaldeide del 4% in buffer salina da 0,1 M di fosfato (pH 7,4).
- Dopo la perfusione, eseguire la decapitazione con una ghigliottina.
- Eseguire la raccolta del cervello rimuovendo le calvarias con pinze di taglio osseo per evitare di danneggiare il tessuto cerebrale.
- Rimuovere immediatamente il cervello e fissare in una soluzione di formaldeide tampobuffermenta 4% per 48 h a 4 gradi centigradi.
- Blocca i cervelli in sezioni coronali da 5 mm dalla faccia del bulbo olfattivo alla corteccia visiva e al cervelletto bieletto e ai gambi cerebrali.
- Dopo l'incorporamento della paraffina, tagliare le sezioni coronali e sagittali (5 m) di distanza dal talamo mediante sezionamento di microtomi.
6. Colorazione ed esame immunochimici
- Posizionare delicatamente le fette su vetrini di vetro con un pennello morbido, 1 fetta per diapositiva.
- Produrre colorazione immunochimica di APP.
- Deparaffina le fette con xilene (3 volte per 5 min ciascuna) e reidrata con concentrazioni di etanolo gradualmente ridotte a temperatura ambiente: 3 min nel 100% di etanolo due volte, 3 min nel 95% di etanolo due volte, 3 min nel 90% di etanolo, 3 min in 70% etanolo e 3 min in DDW.
- Trattare le sezioni cerebrali deparate e reidratate con 3% H2O2 per 15 min a temperatura ambiente per bloccare l'attività perossidasi endogena.
- Incubare sezioni con citrato di sodio di 0,01 M (pH 6,0) a 98 gradi centigradi per 5 min per il recupero dell'antigene.
- Conservare i vetrini nel buffer per 20 min a temperatura ambiente per raffreddare.
- Lavare due volte le sezioni con soluzione salina (PBS) con buffer fosfato per 5 min.
- Bloccare le sezioni con 2,5% siero di cavallo normale per 1 h a temperatura ambiente e incubare durante la notte a 4 gradi centigradi in coniglio primario anti-APP (1:4000) diluito nel siero di blocco.
- Dopo l'incubazione nell'anticorpo primario, lavare le sezioni in PBS a temperatura ambiente.
- Sezioni incubate in anticorpi secondari biotinylati opportunamente diluiti per 15 min e lavare con PBS per 3 min due volte a temperatura ambiente.
- Incubare in streptavidin-peroxidase per 15 min e lavare di nuovo in PBS per 3 min due volte a temperatura ambiente.
- Incubare sezioni con soluzione di substrato tampone (pH 7.5) contenente perossido di idrogeno e 3,3-diaminobenzidine soluzione di cromogenna e proteggere dalla luce fino a sviluppare il colore.
- Incubare i vetrini con DDW a temperatura ambiente per 5 min per fermare la reazione.
- Controleva le sezioni con Hematoxylin per 3 min a temperatura ambiente e lavare per 5 min con acqua di rubinetto scorrevole.
- Disidratare i vetrini con concentrazioni di etanolo gradualmente aumentando a temperatura ambiente: 2 min in DDW, 2 min nel 70% di etanolo, 2 min nel 90% di etanolo, 2 min in etanolo 95%, 2 min in 100% etanolo e 3 min in xilene tre volte.
- Asciugare e montare con supporto di montaggio.
- Esaminare le fette al massimo dell'ingrandimento del microscopio di 200x con una lente obiettivo da 20 mm utilizzando un microscopio.
Risultati
La tabella 1 illustra la sequenza temporale del protocollo. Il tasso di mortalità in questo modello di DAI era dello 0%. Un test di Mann-Whitney ha indicato che il deficit neurologico era significativamente maggiore per i 15 ratti DAI rispetto ai 15 ratti sham a 48 ore dopo l'intervento (Mdn x 1 contro 0), U 22,5, p < 0,001, r - 0,78 (cfr. tabella 2). I dati sono misurati in conteggi e sono presentati come intervallo mediano e 25-75 percentile.
Le fotomicrogr...
Discussione
Questo protocollo descrive un modello di roditore di DAI. In DAI, l'accelerazione rotazionale sul cervello provoca un effetto di taglio che innesca cambiamenti assonali e biochimici che portano alla perdita della funzione assonale in un processo progressivo. I cambiamenti assonali secondari sono prodotti da una rapida lesione assonale e sono variabili nella loro estensione e gravità4,5,10. Entro ore o giorni dopo la lesione pri...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori riconoscono con gratitudine il Dr. Nathan Kleeorin (Dipartimento di Ingegneria Meccanica, Ben-Gurion University del Negev) per il suo aiuto con le misurazioni biomeccaniche. Inoltre, ringraziamo la professoressa Olena Severynovska, Maryna Kuscheriava, Maksym Kryvonosov, Daryna Yakumenko e Evgenia Goncharyk del Dipartimento di Fisiologia, Facoltà di Biologia, Ecologia e Medicina, Oles Honchar Dnipro University, Dproni, Ucraina per il suo sostegno e contributi utili alle nostre discussioni.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.01 M sodium citrate | SIGMA - ALDRICH | ||
| 2.5% normal horse serum | SIGMA - ALDRICH | H0146 | Liquid |
| 4 % buffered formaldehyde solution | |||
| Anti-Amyloid Precursor Protein, C - terminal antibodyproduced in rabbit | SIGMA - ALDRICH | Lot 056M4867V | |
| biotinylated secondary antibody | Vector | BA-1000-1.5 | 10 mM sodium phosphate, pH 7.8, 0.15 M NaCl, 0.08% sodium azide, 3 mg/ml bovine serum albumin |
| bone-cutting forceps | |||
| DAB Peroxidase (HRP) Substrate Kit (with Nickel), 3,3’-diaminobenzidine | vector laboratory | ||
| embedding cassettes | |||
| ethanol 99.9 % | ROMICAL | Flammable Liquid | |
| guillotine | |||
| Hematoxylin | SIGMA - ALDRICH | H3136-25G | |
| Hydrogen peroxide solution | Millipore | 88597-100ML-F | |
| Isofluran, USP 100% | Piramamal Critical Care, Inc | ||
| Olympus BX 40 microscope | Olympus | ||
| paraffine | paraplast plus leica biosystem | Tissue embedding medium | |
| phosphate-buffered saline (PBS) | SIGMA - ALDRICH | P5368-10PAK | Contents of one pouch, when dissolved in one liter of distilled or deionized water, will yield 0.01 M phosphate buffered saline (NaCl 0.138 M; KCl - 0.0027 M); pH 7.4, at 25 °C. |
| Streptavidin HRP | ABCAM | ab64269 | Streptavidin-HRP for use with biotinylated secondary antibodies during IHC / immunohistochemistry. |
| xylene |
Riferimenti
- Faul, M., Wald, M. M., Xu, L., Coronado, V. G. Traumatic brain injury in the United States; emergency department visits, hospitalizations, and deaths, 2002-2006. US Government. , (2010).
- Taylor, C. A., Bell, J. M., Breiding, M. J., Xu, L. Traumatic Brain Injury-Related Emergency Department Visits, Hospitalizations, and Deaths - United States, 2007 and 2013. MMWR Surveillance Summaries. 66, 1-16 (2017).
- Peterson, A. B., Xu, L., Daugherty, J., Breiding, M. J. Surveillance report of traumatic brain injury-related emergency department visits, hospitalizations, and deaths, United States, 2014. US Government. , (2014).
- Su, E., Bell, M. Diffuse axonal injury. Translational Research in Traumatic Brain Injury. 57, 41 (2016).
- Hammoud, D. A., Wasserman, B. A. Diffuse axonal injuries: pathophysiology and imaging. Neuroimaging Clinics. 12, 205-216 (2002).
- Adams, J. H., Graham, D. I., Gennarelli, T. A., Maxwell, W. L. Diffuse axonal injury in non-missile head injury. Journal of Neurology, Neurosurgery, and Psychiatry. 54, 481-483 (1991).
- Slazinski, T., Johnson, M. C. Severe diffuse axonal injury in adults and children. Journal of Neuroscience Nursing. 26, 151-154 (1994).
- Gentleman, S. M., et al. Axonal injury: a universal consequence of fatal closed head injury. Acta Neuropathologica. 89, 537-543 (1995).
- Marehbian, J., Muehlschlegel, S., Edlow, B. L., Hinson, H. E., Hwang, D. Y. Medical Management of the Severe Traumatic Brain Injury Patient. Neurocritical Care. 27, 430-446 (2017).
- Adams, J. H., et al. Diffuse axonal injury in head injury: definition, diagnosis and grading. Histopathology. 15, 49-59 (1989).
- Xiao-Sheng, H., Sheng-Yu, Y., Xiang, Z., Zhou, F., Jian-ning, Z. Diffuse axonal injury due to lateral head rotation in a rat model. Journal of Neurosurgery. 93, 626-633 (2000).
- Ross, D. T., Meaney, D. F., Sabol, M. K., Smith, D. H., Gennarelli, T. A. Distribution of forebrain diffuse axonal injury following inertial closed head injury in miniature swine. Experimental Neurology. 126, 291-299 (1994).
- Bullock, R. Opportunities for neuroprotective drugs in clinical management of head injury. Journal of Emergency Medicine. 11, 23-30 (1993).
- Gennarelli, T. A. Mechanisms of brain injury. Journal of Emergency Medicine. 11, 5-11 (1993).
- Gennarelli, T. A., et al. Diffuse axonal injury and traumatic coma in the primate. Annals of Neurology. 12, 564-574 (1982).
- Xiaoshengi, H., Guitao, Y., Xiang, Z., Zhou, F. A morphological study of diffuse axonal injury in a rat model by lateral head rotation trauma. Acta Neurologica Belgica. 110, 49-56 (2010).
- Zlotnik, A., et al. beta2 adrenergic-mediated reduction of blood glutamate levels and improved neurological outcome after traumatic brain injury in rats. Journal of Neurosurgical Anesthesiology. 24, 30-38 (2012).
- Boyko, M., et al. An Alternative Model of Laser-Induced Stroke in the Motor Cortex of Rats. Biological Procedures Online. 21, 9 (2019).
- Boyko, M., et al. The neuro-behavioral profile in rats after subarachnoid hemorrhage. Brain Research. 1491, 109-116 (2013).
- Ma, J., Zhang, K., Wang, Z., Chen, G. Progress of Research on Diffuse Axonal Injury after Traumatic Brain Injury. Neural Plasticity. 2016, 9746313 (2016).
- Medana, I. M., Esiri, M. M. Axonal damage: a key predictor of outcome in human CNS diseases. Brain. 126, 515-530 (2003).
- Tang-Schomer, M. D., Johnson, V. E., Baas, P. W., Stewart, W., Smith, D. H. Partial interruption of axonal transport due to microtubule breakage accounts for the formation of periodic varicosities after traumatic axonal injury. Experimental Neurology. 233, 364-372 (2012).
- Johnson, V. E., Stewart, W., Smith, D. H. Traumatic brain injury and amyloid-beta pathology: a link to Alzheimer's disease. Nature Reviews Neuroscience. 11, 361-370 (2010).
- Sherriff, F. E., Bridges, L. R., Sivaloganathan, S. Early detection of axonal injury after human head trauma using immunocytochemistry for beta-amyloid precursor protein. Acta Neuropathologica. 87, 55-62 (1994).
- Reichard, R. R., White, C. L., Hladik, C. L., Dolinak, D. Beta-amyloid precursor protein staining of nonaccidental central nervous system injury in pediatric autopsies. Journal of Neurotrauma. 20, 347-355 (2003).
- Gentleman, S. M., Nash, M. J., Sweeting, C. J., Graham, D. I., Roberts, G. W. Beta-amyloid precursor protein (beta APP) as a marker for axonal injury after head injury. Neuroscience Letters. 160, 139-144 (1993).
- Smith, D. H., Hicks, R., Povlishock, J. T. Therapy development for diffuse axonal injury. Journal of Neurotrauma. 30, 307-323 (2013).
- McKenzie, K. J., et al. Is beta-APP a marker of axonal damage in short-surviving head injury. Acta Neuropathologica. 92, 608-613 (1996).
- Wilkinson, A., Bridges, L., Sivaloganathan, S. Correlation of survival time with size of axonal swellings in diffuse axonal injury. Acta Neuropathologicaogica. 98, 197-202 (1999).
- Thompson, H. J., et al. Lateral fluid percussion brain injury: a 15-year review and evaluation. Journal of Neurotrauma. 22, 42-75 (2005).
- Alder, J., Fujioka, W., Lifshitz, J., Crockett, D. P., Thakker-Varia, S. Lateral fluid percussion: model of traumatic brain injury in mice. Journal of Visualized Experiments. , e3063 (2011).
- Povlishock, J., Marmarou, A., McIntosh, T., Trojanowski, J., Moroi, J. Impact acceleration injury in the rat: evidence for focal axolemmal change and related neurofilament sidearm alteration. Journal of Neuropathology & Experimental Neurology. 56, 347-359 (1997).
- Heath, D. L., Vink, R. Impact acceleration-induced severe diffuse axonal injury in rats: characterization of phosphate metabolism and neurologic outcome. Journal of Neurotrauma. 12, 1027-1034 (1995).
- Lighthall, J. W. Controlled cortical impact: a new experimental brain injury model. Journal of Neurotrauma. 5, 1-15 (1988).
- Palmer, A. M., et al. Traumatic brain injury-induced excitotoxicity assessed in a controlled cortical impact model. Journal of Neurochemistry. 61, 2015-2024 (1993).
- Hamm, R. J., et al. Cognitive deficits following traumatic brain injury produced by controlled cortical impact. Journal of Neurotrauma. 9, 11-20 (1992).
- Nyanzu, M., et al. Improving on Laboratory Traumatic Brain Injury Models to Achieve Better Results. International Journal of Medical Sciences. 14, 494-505 (2017).
- Xiong, Y., Mahmood, A., Chopp, M. Animal models of traumatic brain injury. Nature Reviews Neuroscience. 14, 128-142 (2013).
- Lighthall, J. W., Dixon, C. E., Anderson, T. E. Experimental models of brain injury. Journal of Neurotrauma. 6, 83-97 (1989).
- Meaney, D. F., et al. Modification of the cortical impact model to produce axonal injury in the rat cerebral cortex. Journal of Neurotrauma. 11, 599-612 (1994).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon