Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Induction de lésion diffuse du cerveau axonal chez les rats basés sur l’accélération rotationnelle
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole valide un modèle de rongeur fiable, facile à exécuter et reproductible de lésions axonales diffuses cérébrales (DAI) qui induit des dommages à la matière blanche généralisée sans fractures du crâne ou contusions.
Résumé
Les lésions cérébrales traumatiques (TBI) sont une cause majeure de décès et d’invalidité. Les dommages axonaux diffus (DAI) sont le mécanisme prédominant de blessure dans un grand pourcentage de patients TBI nécessitant une hospitalisation. DAI implique des dommages axonaux répandus de secousses, de rotation ou de dommages de souffle, menant à des dommages rapides d’étirement axonal et aux changements axonaux secondaires qui sont associés à un impact durable sur la récupération fonctionnelle. Historiquement, les modèles expérimentaux de DAI sans blessure focale ont été difficiles à concevoir. Ici, nous validons un modèle de rongeur simple, reproductible et fiable de DAI qui cause des dommages répandus de matière blanche sans ruptures de crâne ou contusions.
Introduction
Les lésions cérébrales traumatiques (TBI) sont une cause majeure de décès et d’invalidité aux États-Unis. Les TBI contribuent à environ 30 % de tous les décès liés aux blessures1,2. Les principales causes de l’IDT diffèrent d’un groupe d’âge à l’autre et comprennent les chutes, les collisions à grande vitesse pendant les sports, l’automutilation intentionnelle, les accidents de la route et les agressions1,2,3.
Brain diffuse axonal injury (DAI) is a specific type of TBI induced by rotational acceleration, shaking or blast injury of the brain resulting from unrestricted head movement in the instant after injury4,5,6,7,8. DAI implique des dommages axonaux répandus menant à une déficience neurologique de longue durée qui est associée à de mauvais résultats, les coûts de soins de santé lourds, et un taux de mortalité de 33-64%1,2,4,5,9,10,11. Malgré des recherches récentes importantes sur la pathogénie de DAI, il n’y a pas eu de consensus sur les meilleures options de traitement11,12,13,14.
Au cours des dernières décennies, de nombreux modèles expérimentaux ont tenté de reproduire avec précision différents aspects de DAI11,12,15,16. Cependant, ces modèles ont des limites étant donné la présentation unique de DAI par rapport à d’autres blessures focales. Ces modèles antérieurs causent non seulement des dommages axonaux dans les régions de matière blanche mais entraînent également des lésions cérébrales focales. Cliniquement, DAI est accompagnée de micro-hémorragies, qui peuvent constituer une cause majeure de dommages à la matière blanche.
Il est démontré que seulement deux modèles animaux reproduisent les principales caractéristiques cliniques de l’IDD. Gennarelli et ses collègues ont produit le premier dispositif latéral de rotation de la tête en 1982, en utilisant l’accélération rotationnelle de la tête non-modifiée pour induire le coma avec DAI dans un modèle de primate non humain15. Ce modèle de primate a employé la rotation simple commandée pour l’accélération et la décélération pour déplacer la tête par 60 'dans 10-20 ms. Cette technique a été capable d’imiter la conscience altérée et les dommages axonaux répandus qui ressemblaient aux effets du TBI grave observé dans les cerveaux humains. Cependant, les modèles de primates sont très chers4,11,16. Basé en partie sur le modèle précédent, un modèle porcin de l’accélération par rotation des lésions cérébrales a été conçu en 1994 (Ross et al.) avec des résultats similaires14.
Ces deux modèles animaux, bien qu’ils aient produit différentes présentations de pathologie typique, ont ajouté considérablement aux concepts de pathogénie DAI. La rotation rapide de la tête est généralement acceptée comme la meilleure méthode pour induire DAI, et les rongeurs fournissent un modèle moins coûteux pour les études rapides de rotation de la tête11,16. Ici, nous validons un modèle simple, reproductible et fiable de rongeur de DAI qui cause des dommages répandus de matière blanche sans ruptures de crâne ou contusions. Ce modèle actuel permettra une meilleure compréhension de la pathophysiologie de dAI et le développement de traitements plus efficaces.
Protocole
Les expériences ont été réalisées à la suite des recommandations des Déclarations d’Helsinki et de Tokyo et des Lignes directrices pour l’utilisation des animaux expérimentaux de la Communauté européenne. Les expériences ont été approuvées par le Comité de soins aux animaux de l’Université Ben-Gourion du Néguev.
1. Préparation des rats à la procédure expérimentale
REMARQUE : Sélectionnez des rats Sprague-Dawley mâles adultes pesant 300-350 g.
- Obtenir l’approbation pour l’exécution de ces expériences auprès du Comité institutionnel de soins et d’utilisation des animaux.
- Maintenir les rats à une température ambiante de 22 à 1 oC, avec 12 heures de lumière et 12 heures de cycles sombres. Fournir du chow de rat et de l’eau ad libitum.
- Effectuer toutes les expériences entre 6 h et 12 h.
- Utilisez un système continu d’administration d’isoflurane pour induire l’anesthésie. Assurez-vous que le système de vaporisateur est rempli d’isoflurane.
- Anesthésiez les rats avec 2% d’isoflurane.
- Confirmez que le rat est entièrement anesthésié en observant un manque de mouvement ou de réflexe de pédale en réponse à un stimulus externe.
2. Induction de lésions axonales diffuses
REMARQUE : L’appareil se compose des composants suivants : 1) cylindre en plastique transparent, 2) poids de fer (1308 g), 3) mécanisme de rotation composé d’un tube cylindrique, de deux roulements sur lesquels l’axe tourne et d’une fixation de tête (pour les épingles d’oreille); 4) plate-forme horizontale sur laquelle sont fixés deux roulements.
- Placez l’appareil sur une table de laboratoire lourde et stable.
- Attachez le poids à une ficelle élevée à une hauteur de 120 cm.
- Laissez le poids qui tombe librement frapper le boulon, en activant le mécanisme de rotation. À l’aide du dispositif de rotation latérale de la tête, la tête du rongeur est rapidement retournée de 0 à 90 degrés.
- Après l’induction des lésions cérébrales axonales diffuses, transférez le rat dans une salle de réveil.
3. Mesure des paramètres rotatifs Kinematics/Biomécanical.
- Mesurer la cinématique rotationnelle/paramètres biomécaniques comme suit :
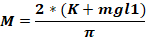
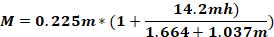

où Fo - force appliquée à la tête animale (kg); M - moment de force; K - énergie cinétique; m - masse de la chute du poids; g - accélération gravitationnelle; h - hauteur (cm); D - distance entre les broches d’oreille (cm).
REMARQUE: Pour calculer la force appliquée sur la tête de l’animal (Fo), il est nécessaire de connaître la masse de la chute du poids, la hauteur à laquelle le poids tombe, et la distance entre les broches d’oreille. Les autres paramètres restent inchangés.
4. Évaluation du score de gravité neurologique après 48 heures
REMARQUE : Les déficits neurologiques ont été évalués et classés à l’aide d’un score de gravité neurologique, tel que décrit précédemment17,18,19. Les modifications de la fonction et du comportement du moteur sont évaluées par un système de points de sorte qu’un score maximum de 24 représente un dysfonctionnement neurologique grave. Un score de 0 indique l’état neurologique intact. Les fonctions comportementales suivantes sont évaluées.
- Évaluer l’incapacité du rat à sortir d’un cercle (50 cm de diamètre) lorsqu’il est laissé en son centre. Effectuez ceci pendant trois sessions individuelles d’une durée de 30 min, 60 min, et plus de 60 min.
- Testez le rat pour une perte de réflexe de redressement en trois séances d’une durée de 20 min, 40 min et plus de 60 min.
- Effectuez le test d’hémiplégie, l’incapacité du rat à résister aux changements forcés de position.
- Levez le rat par sa queue pour tester la flexion de l’arrière-pays.
- Placez le rat sur le sol pour tester sa capacité à marcher tout droit.
- Testez trois réflexes distincts : le réflexe pinna, le réflexe cornéen et le réflexe de sursaut.
- Évaluez le rat avec une note clinique basée sur la perte de la recherche de comportement et de prostration.
- Testez les réflexes des membres pour le placement. Effectuez le test sur les membres antérieurs gauche et droit, puis les arrières gauche et droit.
- Effectuez un test fonctionnel via la tâche d’équilibrage du faisceau. Le faisceau doit mesurer 1,5 cm de large. Exécutez le test pour des sessions de 20 s, 40 s, et plus de 60 s.
- Effectuez l’essai de marche de faisceau sur le rat avec des faisceaux de trois largeurs différentes : 8.5 cm de large, 5 cm de large, et 2.5 cm de large.
5. Collecte de cerveau pour l’examen histologique après 48 heures
- À 48 heures après une blessure, euthanasiez les rats en remplaçant leur mélange de gaz inspiré par 20% O2/80% DE CO2. Veiller à ce que le CO2 soit livré à un taux prédéterminé conformément aux lignes directrices du Comité de soins et d’utilisation des animaux institutionnels.
- Assurer la confirmation du décès conformément aux lignes directrices du Comité de soins et d’utilisation des animaux institutionnels.
- Transcardiacally perfuser le rat avec 0,9% saline héparinisée à la température 4 oC, suivie de 500 mL de paraformaldéhyde de 0,1 M en tampon de phosphate (pH 7,4).
- Après la perfusion, effectuer la décapitation avec une guillotine.
- Effectuez la collecte du cerveau en enlevant les calvarias avec des forceps de coupe osseuse pour éviter d’endommager le tissu cérébral.
- Retirer immédiatement le cerveau et fixer dans une solution de formaldéhyde tampon de 4 % pour 48 h à 4 oC.
- Bloquer les cerveaux en sections coronales de 5 mm du visage olfactif de l’ampoule au cortex visuel et aux cervelets et aux tiges cérébrales de deux fois.
- Après l’embâmage par la paraffine, couper les sections coronales et sagittales (5 m) du thalamus par sectionnement microtome.
6. Coloration et examen immunochimiques
- Placer délicatement les tranches sur des toboggans en verre avec une brosse molle, 1 tranche par lame.
- Produire la coloration immunochimique de l’APP.
- Déparaffiniser les tranches de xylène (3 fois pour 5 min chacune) et réhydrailler avec des concentrations graduellement réduites d’éthanol à température ambiante : 3 min en 100% d’éthanol deux fois, 3 min en 95% d’éthanol deux fois, 3 min dans 90% d’éthanol, 3 min dans 70% d’éthanol et 3 min en DDW.
- Traiter les sections cérébrales déparaffinisées et réhydratées avec 3 % H2O2 pendant 15 min à température ambiante pour bloquer l’activité endogène de peroxidase.
- Sections incubés avec 0,01 M de citrate de sodium (pH 6,0) à 98 oC pendant 5 minutes pour la récupération d’antigène.
- Garder les lames dans le tampon pendant 20 minutes à température ambiante pour refroidir.
- Laver les sections avec la solution saline tamponnée par le phosphate (PBS) deux fois pendant 5 min.
- Bloquez les sections avec un sérum normal de cheval de 2,5 % pendant 1 h à température ambiante et incuber toute la nuit à 4 oC dans l’anti-APP primaire de lapin (1:4000) dilué dans le sérum bloquant.
- Après l’incubation dans l’anticorps primaire, laver les sections dans PBS à température ambiante.
- Incuber les sections dans un anticorps secondaire biotinylé dilué de façon appropriée pendant 15 min et laver avec PBS pendant 3 minutes deux fois à température ambiante.
- Incuber en streptavidine-peroxidase pendant 15 min et laver à nouveau dans PBS pendant 3 minutes deux fois à température ambiante.
- Sections incubées avec solution de substrat tampon (pH 7.5) contenant du peroxyde d’hydrogène et 3,3-diaminobenzidine chromogen solution et protéger de la lumière jusqu’à ce que la couleur est développée.
- Incuber les diapositives avec DDW à température ambiante pendant 5 minutes afin d’arrêter la réaction.
- Sections de contre-vente avec hématoxyline pendant 3 min à température ambiante et laver pendant 5 min avec l’eau du robinet qui coule.
- Déshydrater les diapositives avec des concentrations d’éthanol progressivement croissantes à température ambiante : 2 min en DDW, 2 min en 70 % d’éthanol, 2 min en 90 % d’éthanol, 2 min en éthanol 95 %, 2 min en 100 % d’éthanol et 3 min en xylène trois fois.
- Sécher et monter avec le milieu de montage.
- Examinez les tranches sous le grossissement de microscope de 200x avec une lentille objective de 20 mm à l’aide d’un microscope.
Résultats
Le tableau 1 illustre le calendrier du protocole. Le taux de mortalité dans ce modèle de DAI était de 0%. Un test Mann-Whitney a indiqué que le déficit neurologique était significativement plus grand pour les 15 rats DAI par rapport aux 15 rats simulés à 48 heures après l’intervention (Mdn - 1 vs 0), U - 22,5, p 'lt; 0.001, r - 0.78 (voir tableau 2). Les données sont mesurées en nombres et sont présentées comme médianes et 25 à 75 percentiles.
Discussion
Ce protocole décrit un modèle de rongeur de DAI. Dans DAI, l’accélération rotationnelle sur le cerveau provoque un effet de cisaillement qui déclenche des changements axonaux et biochimiques qui conduisent à la perte de la fonction axonale dans un processus progressif. Les changements axonaux secondaires sont produits par une blessure rapide d’étirement axonal et sont variables dans leur étendue et la sévérité4,5,10
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs remercient le Dr Nathan Kleeorin (Département de génie mécanique de l’Université Ben-Gourion du Néguev) pour son aide aux mesures biomécaniques. En outre, nous remercions le professeur Olena Severynovska, Maryna Kuscheriava, Maksym Kryvonosov, Daryna Yakumenko et Evgenia Goncharyk du Département de physiologie, faculté de biologie, d’écologie et de médecine, Oles Honchar Dnipro University, Dnipro, Ukraine pour son soutien et ses contributions utiles à nos discussions.
matériels
| Name | Company | Catalog Number | Comments |
| 0.01 M sodium citrate | SIGMA - ALDRICH | ||
| 2.5% normal horse serum | SIGMA - ALDRICH | H0146 | Liquid |
| 4 % buffered formaldehyde solution | |||
| Anti-Amyloid Precursor Protein, C - terminal antibodyproduced in rabbit | SIGMA - ALDRICH | Lot 056M4867V | |
| biotinylated secondary antibody | Vector | BA-1000-1.5 | 10 mM sodium phosphate, pH 7.8, 0.15 M NaCl, 0.08% sodium azide, 3 mg/ml bovine serum albumin |
| bone-cutting forceps | |||
| DAB Peroxidase (HRP) Substrate Kit (with Nickel), 3,3’-diaminobenzidine | vector laboratory | ||
| embedding cassettes | |||
| ethanol 99.9 % | ROMICAL | Flammable Liquid | |
| guillotine | |||
| Hematoxylin | SIGMA - ALDRICH | H3136-25G | |
| Hydrogen peroxide solution | Millipore | 88597-100ML-F | |
| Isofluran, USP 100% | Piramamal Critical Care, Inc | ||
| Olympus BX 40 microscope | Olympus | ||
| paraffine | paraplast plus leica biosystem | Tissue embedding medium | |
| phosphate-buffered saline (PBS) | SIGMA - ALDRICH | P5368-10PAK | Contents of one pouch, when dissolved in one liter of distilled or deionized water, will yield 0.01 M phosphate buffered saline (NaCl 0.138 M; KCl - 0.0027 M); pH 7.4, at 25 °C. |
| Streptavidin HRP | ABCAM | ab64269 | Streptavidin-HRP for use with biotinylated secondary antibodies during IHC / immunohistochemistry. |
| xylene |
Références
- Faul, M., Wald, M. M., Xu, L., Coronado, V. G. Traumatic brain injury in the United States; emergency department visits, hospitalizations, and deaths, 2002-2006. US Government. , (2010).
- Taylor, C. A., Bell, J. M., Breiding, M. J., Xu, L. Traumatic Brain Injury-Related Emergency Department Visits, Hospitalizations, and Deaths - United States, 2007 and 2013. MMWR Surveillance Summaries. 66, 1-16 (2017).
- Peterson, A. B., Xu, L., Daugherty, J., Breiding, M. J. Surveillance report of traumatic brain injury-related emergency department visits, hospitalizations, and deaths, United States, 2014. US Government. , (2014).
- Su, E., Bell, M. Diffuse axonal injury. Translational Research in Traumatic Brain Injury. 57, 41 (2016).
- Hammoud, D. A., Wasserman, B. A. Diffuse axonal injuries: pathophysiology and imaging. Neuroimaging Clinics. 12, 205-216 (2002).
- Adams, J. H., Graham, D. I., Gennarelli, T. A., Maxwell, W. L. Diffuse axonal injury in non-missile head injury. Journal of Neurology, Neurosurgery, and Psychiatry. 54, 481-483 (1991).
- Slazinski, T., Johnson, M. C. Severe diffuse axonal injury in adults and children. Journal of Neuroscience Nursing. 26, 151-154 (1994).
- Gentleman, S. M., et al. Axonal injury: a universal consequence of fatal closed head injury. Acta Neuropathologica. 89, 537-543 (1995).
- Marehbian, J., Muehlschlegel, S., Edlow, B. L., Hinson, H. E., Hwang, D. Y. Medical Management of the Severe Traumatic Brain Injury Patient. Neurocritical Care. 27, 430-446 (2017).
- Adams, J. H., et al. Diffuse axonal injury in head injury: definition, diagnosis and grading. Histopathology. 15, 49-59 (1989).
- Xiao-Sheng, H., Sheng-Yu, Y., Xiang, Z., Zhou, F., Jian-ning, Z. Diffuse axonal injury due to lateral head rotation in a rat model. Journal of Neurosurgery. 93, 626-633 (2000).
- Ross, D. T., Meaney, D. F., Sabol, M. K., Smith, D. H., Gennarelli, T. A. Distribution of forebrain diffuse axonal injury following inertial closed head injury in miniature swine. Experimental Neurology. 126, 291-299 (1994).
- Bullock, R. Opportunities for neuroprotective drugs in clinical management of head injury. Journal of Emergency Medicine. 11, 23-30 (1993).
- Gennarelli, T. A. Mechanisms of brain injury. Journal of Emergency Medicine. 11, 5-11 (1993).
- Gennarelli, T. A., et al. Diffuse axonal injury and traumatic coma in the primate. Annals of Neurology. 12, 564-574 (1982).
- Xiaoshengi, H., Guitao, Y., Xiang, Z., Zhou, F. A morphological study of diffuse axonal injury in a rat model by lateral head rotation trauma. Acta Neurologica Belgica. 110, 49-56 (2010).
- Zlotnik, A., et al. beta2 adrenergic-mediated reduction of blood glutamate levels and improved neurological outcome after traumatic brain injury in rats. Journal of Neurosurgical Anesthesiology. 24, 30-38 (2012).
- Boyko, M., et al. An Alternative Model of Laser-Induced Stroke in the Motor Cortex of Rats. Biological Procedures Online. 21, 9 (2019).
- Boyko, M., et al. The neuro-behavioral profile in rats after subarachnoid hemorrhage. Brain Research. 1491, 109-116 (2013).
- Ma, J., Zhang, K., Wang, Z., Chen, G. Progress of Research on Diffuse Axonal Injury after Traumatic Brain Injury. Neural Plasticity. 2016, 9746313 (2016).
- Medana, I. M., Esiri, M. M. Axonal damage: a key predictor of outcome in human CNS diseases. Brain. 126, 515-530 (2003).
- Tang-Schomer, M. D., Johnson, V. E., Baas, P. W., Stewart, W., Smith, D. H. Partial interruption of axonal transport due to microtubule breakage accounts for the formation of periodic varicosities after traumatic axonal injury. Experimental Neurology. 233, 364-372 (2012).
- Johnson, V. E., Stewart, W., Smith, D. H. Traumatic brain injury and amyloid-beta pathology: a link to Alzheimer's disease. Nature Reviews Neuroscience. 11, 361-370 (2010).
- Sherriff, F. E., Bridges, L. R., Sivaloganathan, S. Early detection of axonal injury after human head trauma using immunocytochemistry for beta-amyloid precursor protein. Acta Neuropathologica. 87, 55-62 (1994).
- Reichard, R. R., White, C. L., Hladik, C. L., Dolinak, D. Beta-amyloid precursor protein staining of nonaccidental central nervous system injury in pediatric autopsies. Journal of Neurotrauma. 20, 347-355 (2003).
- Gentleman, S. M., Nash, M. J., Sweeting, C. J., Graham, D. I., Roberts, G. W. Beta-amyloid precursor protein (beta APP) as a marker for axonal injury after head injury. Neuroscience Letters. 160, 139-144 (1993).
- Smith, D. H., Hicks, R., Povlishock, J. T. Therapy development for diffuse axonal injury. Journal of Neurotrauma. 30, 307-323 (2013).
- McKenzie, K. J., et al. Is beta-APP a marker of axonal damage in short-surviving head injury. Acta Neuropathologica. 92, 608-613 (1996).
- Wilkinson, A., Bridges, L., Sivaloganathan, S. Correlation of survival time with size of axonal swellings in diffuse axonal injury. Acta Neuropathologicaogica. 98, 197-202 (1999).
- Thompson, H. J., et al. Lateral fluid percussion brain injury: a 15-year review and evaluation. Journal of Neurotrauma. 22, 42-75 (2005).
- Alder, J., Fujioka, W., Lifshitz, J., Crockett, D. P., Thakker-Varia, S. Lateral fluid percussion: model of traumatic brain injury in mice. Journal of Visualized Experiments. , e3063 (2011).
- Povlishock, J., Marmarou, A., McIntosh, T., Trojanowski, J., Moroi, J. Impact acceleration injury in the rat: evidence for focal axolemmal change and related neurofilament sidearm alteration. Journal of Neuropathology & Experimental Neurology. 56, 347-359 (1997).
- Heath, D. L., Vink, R. Impact acceleration-induced severe diffuse axonal injury in rats: characterization of phosphate metabolism and neurologic outcome. Journal of Neurotrauma. 12, 1027-1034 (1995).
- Lighthall, J. W. Controlled cortical impact: a new experimental brain injury model. Journal of Neurotrauma. 5, 1-15 (1988).
- Palmer, A. M., et al. Traumatic brain injury-induced excitotoxicity assessed in a controlled cortical impact model. Journal of Neurochemistry. 61, 2015-2024 (1993).
- Hamm, R. J., et al. Cognitive deficits following traumatic brain injury produced by controlled cortical impact. Journal of Neurotrauma. 9, 11-20 (1992).
- Nyanzu, M., et al. Improving on Laboratory Traumatic Brain Injury Models to Achieve Better Results. International Journal of Medical Sciences. 14, 494-505 (2017).
- Xiong, Y., Mahmood, A., Chopp, M. Animal models of traumatic brain injury. Nature Reviews Neuroscience. 14, 128-142 (2013).
- Lighthall, J. W., Dixon, C. E., Anderson, T. E. Experimental models of brain injury. Journal of Neurotrauma. 6, 83-97 (1989).
- Meaney, D. F., et al. Modification of the cortical impact model to produce axonal injury in the rat cerebral cortex. Journal of Neurotrauma. 11, 599-612 (1994).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon