需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
基于旋转加速大鼠漫射性无羟基脑损伤的诱导
* 这些作者具有相同的贡献
摘要
该协议验证了大脑扩散性连体损伤 (DAI) 的可靠、易于执行和可重复的啮齿动物模型,这种模型可引起大范围的白质损伤,而不会造成颅骨骨折或挫伤。
摘要
创伤性脑损伤 (TBI) 是导致死亡和残疾的主要原因。扩散性斧伤 (DAI) 是需要住院的很大一部分 TBI 患者的主要伤害机制。DAI 涉及因晃动、旋转或爆炸伤害而造成的广泛斧头损伤,导致快速的斧头拉伸损伤和与功能恢复的长期影响相关的二次斧头变化。从历史上看,没有焦伤的DAI实验模型一直难以设计。在这里,我们验证了DAI的简单、可重复和可靠的啮齿动物模型,该模型不会造成广泛的白质损伤,而不会造成颅骨骨折或挫伤。
引言
创伤性脑损伤 (TBI) 是美国死亡和残疾的主要原因。结核病占所有与伤害有关的死亡1,22的约30%。TBI的主要原因因年龄组而异,包括跌倒、运动期间高速碰撞、故意自残、机动车碰撞和袭击11、2、3。2,3
脑扩散性斧头损伤(DAI)是一种特殊类型的TBI,由旋转加速、晃动或爆炸损伤引起的大脑在受伤后瞬间不受限制的头部运动44,5,6,7,8。5,6,7,8DAI涉及广泛的斧子损伤,导致长期神经损伤,与不良的结果,沉重的医疗费用,和33-64%的死亡率1,1,2,4,5,9,10,11。2,4,5,9,10,11尽管最近对DAI的发病机制进行了大量研究,但关于最佳治疗方案11、12、13、14,12,13,14仍没有达成共识。
在过去的几十年里,许多实验模型试图准确地复制DAI11、12、15、1612,15,16的不同方面。11然而,与其他焦伤相比,DAI 具有独特的表现方式,这些模型存在局限性。这些以前的模型不仅在白质区域造成斧伤,而且还会导致焦点脑损伤。临床上,DAI伴有微出血,这可能是白质损伤的主要原因。
只有两种动物模型被证明复制DAI的主要临床特征。Gennarelli和他的同事在1982年制造了第一个侧头旋转装置,使用非冲击头旋转加速诱导昏迷与DAI在非人类灵长类动物模型15。这种灵长类动物模型采用控制的单次旋转来加速和减速,在10-20毫秒内将头部通过60°取代。 这项技术能够模拟意识受损和广泛的斧头损伤,类似于在人类大脑中观察到的严重TBI的影响。然而,灵长类动物模型是非常昂贵的44,11,16。11,16部分基于以前的模型,猪模型旋转加速脑损伤是在1994年(罗斯等人)设计,类似的结果14。
这两种动物模型虽然产生了不同的典型病理学的介绍,但大大增加了DAI发病机制的概念。快速头部旋转被公认为诱导DAI的最好方法,啮齿动物为快速头部旋转研究11、16,16提供了一个更便宜的模型。在这里,我们验证了DAI的简单、可复制和可靠的啮齿动物模型,该模型在不造成颅骨骨折或挫伤的情况下造成广泛的白质损伤。目前的模型将使人们更好地了解DAI的病理生理学和更有效的治疗方法的发展。
研究方案
这些实验是在《赫尔辛基和东京宣言》和欧洲共同体《使用实验动物准则》的建议下进行的。这些实验得到了内盖夫本-古里安大学动物护理委员会的批准。
1. 为实验程序准备大鼠
注:选择成年雄性斯普拉格-达利大鼠体重300-350克。
- 获得机构动物护理和使用委员会的批准,以进行这些实验。
- 将大鼠保持在 22 ± 1 °C 的室温下,12 小时照明和 12 小时暗循环。提供鼠肉和水的盐水。
- 在上午 6:00 到下午 12:00 之间执行所有实验。
- 使用连续的等体管理系统诱导麻醉。确保蒸发器系统充满等体。
- 用2%的二分之一类物麻醉大鼠。
- 通过观察对外部刺激缺乏运动或踏板反射,确认大鼠完全麻醉。
2. 弥漫性斧伤的诱导
注:该装置由以下部件组成:1)透明塑料缸,2)铁重(1308克),3)旋转机构由圆柱形管、轴旋转的两个轴承和一个头固定(用于耳针);4) 固定两个轴承的水平平台。
- 将设备放在重、稳定的实验室桌子上。
- 将重量附加到高度为 120 厘米的字符串上。
- 允许自由下降的重量击中螺栓,激活旋转机构。使用侧头旋转装置,啮齿动物的头部从 0 迅速转向 90°。
- 诱导扩散性无氧脑损伤后,将大鼠转移到恢复室。
3. 旋转运动学/生物力学参数的测量。
- 测量旋转运动学/生物力学参数,如下所示:
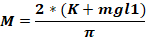
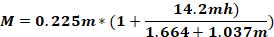

施用动物头部的Fo力(千克);M = 力矩;K = 动能;m = 重量下降的质量;g - 重力加速度;h = 高度(厘米);D = 耳针(厘米)之间的距离。
注:要计算应用于动物头部(Fo)的力,必须了解下降重量的质量、重量下降的高度以及耳针之间的距离。其他参数保持不变。
4. 48小时后神经严重性评分评估
注:神经缺陷是使用神经严重性评分进行评估和分级的,如先前描述的17、18、19。17,18,19运动功能和行为的变化由点系统评估,因此最高得分为24表示严重的神经功能障碍。分数 0 表示完整的神经系统状态。评估以下行为功能。
- 评估大鼠在位于其中心时无法从圆(直径50厘米)退出。执行三次持续 30 分钟、60 分钟和 60 分钟以上的单独会话。
- 测试大鼠在持续20分钟、40分钟和60分钟以上的三个疗程中,有右反射的丧失。
- 执行对异位性测试,大鼠无法抵抗位置的强制变化。
- 用尾巴抬起老鼠,以测试后肢的弯曲。
- 把老鼠放在地板上,以测试它直行的能力。
- 测试三个独立的反射:针刺反射,角膜反射,和肛门反射。
- 根据寻求行为和垂化损失对具有临床等级的大鼠进行评分。
- 测试放置肢体反射。在左前肢和右前肢,然后进行左和右后肢测试。
- 通过光束平衡任务执行功能测试。光束应宽 1.5 厘米。运行 20 s、40 和 60 s 以上的会话的测试。
- 对三个不同宽度的光束进行光束行走测试:8.5 厘米宽、5 厘米宽和 2.5 厘米宽。
5. 48小时后进行组织学检查的大脑收集
- 在受伤后48小时,用20%O2/80% CO2替换受启发的气体混合物,对大鼠进行安乐死。确保 CO2按照机构动物护理和使用委员会准则以预定费率交付。
- 确保根据机构动物护理和使用委员会准则确认死亡。
- 在温度 4 °C 下,在大鼠中注入 0.9% 的肝素盐水,随后在 0.1 M 磷酸盐缓冲盐水(pH 7.4)中注入 500 mL 的 4% 甲醛。
- 灌注后,用断头台进行斩首。
- 通过用骨切钳去除钙质,以避免损坏脑组织,从而进行大脑采集。
- 立即取出大脑,在4°C下固定在4%缓冲甲醛溶液中48小时。
- 将大脑从嗅球面块块块成5毫米的冠状部分,从视觉皮层和一部分分小脑和脑茎。
- 在石蜡嵌入后,通过微托姆切片切割日冕和下垂部分(5 μm),远离丘状人。
6. 免疫化学染色和检查
- 用软刷轻轻将切片放在玻璃幻灯片上,每张幻灯片 1 片。
- 生产βAPP的免疫化学染色。
- 用二甲苯脱硫切片(每片3次,每次5分钟),在室温下用逐渐降低乙醇浓度补充水分:3分钟在100%乙醇中两次,3分钟在95%乙醇中两次,3分钟在90%乙醇中,3分钟在70%乙醇中,3分钟在DDW中。
- 在室温下用3%H2O2治疗去石蜡和再水化脑部分15分钟,以阻止内源性过氧化物酶活性。
- 在98°C下用0.01M柠度钠(pH 6.0)孵育部分5分钟,用于抗原检索。
- 在室温下将滑片放在缓冲器中 20 分钟以冷却。
- 使用磷酸盐缓冲盐水 (PBS) 溶液清洗部分两次,5 分钟。
- 在室温下用2.5%正常马血清将部分块1小时,并在原兔抗APP(1:4000)中在4°C下孵育一夜。
- 在原抗体中孵育后,在室温下洗涤PBS部分。
- 在适当稀释的生物微化二次抗体中孵育部分15分钟,在室温下用PBS洗涤3分钟两次。
- 在链球菌中孵育15分钟,在室温下再次在PBS中洗涤3分钟。
- 用缓冲基底溶液(pH 7.5)孵育含有过氧化氢和3,3-二氨基苯铬原溶液的部分,并保护光,直到颜色形成。
- 在室温下用 DDW 孵育幻灯片 5 分钟,以停止反应。
- 在室温下用血氧林对块进行3分钟,用流动的自来水洗涤5分钟。
- 在室温下,乙醇浓度逐渐增加,脱水:DDW 2 分钟,70% 乙醇 2 分钟,90% 乙醇 2 分钟,乙醇 2 分钟 95%,100% 乙醇 2 分钟,二甲苯 3 分钟。
- 用安装介质干燥并安装。
- 使用显微镜使用 20 mm 目标透镜在显微镜放大 200 倍下检查切片。
结果
表 1说明了协议时间线。DAI模型的死亡率为0%。Mann-Whitney的一项测试表明,15只DAI大鼠的神经缺陷明显大于干预后48小时15只假鼠(Mdn = 1 vs. 0),U = 22.5,p < 0.001,r = 0.78(见表2)。数据以计数为单位进行测量,并呈现为中位数和 25-75 个百分位数范围。
图1显示了脑组织下部具有代表性的显微图。与对照组(67.46 × 30 vs. 0) 相比,?...
讨论
该协议描述了DAI的啮齿动物模型。在DAI中,大脑旋转加速导致剪切效应,触发斧和生化变化,导致在渐进过程中失去六角函数。二次斧子变化是由快速的斧子拉伸损伤产生的,其范围和严重程度44、5、105,10是可变的。在主损伤后几到数天内,生化变化将导致斧功能44、5、105,<...
披露声明
作者没有什么可透露的。
致谢
作者感谢内森·克利奥林博士(内盖夫本-古里安大学机械工程系)在生物力学测量方面的协助。此外,我们还感谢乌克兰德尼普罗大学生理学系的奥莱娜·斯潘诺夫斯卡教授、玛丽安娜·库舍里亚瓦教授、马克西姆·克里沃诺索夫教授、达里娜·亚库缅科教授和叶夫根尼亚·贡恰雷克教授对我们的讨论给予的支持和有益贡献。
材料
| Name | Company | Catalog Number | Comments |
| 0.01 M sodium citrate | SIGMA - ALDRICH | ||
| 2.5% normal horse serum | SIGMA - ALDRICH | H0146 | Liquid |
| 4 % buffered formaldehyde solution | |||
| Anti-Amyloid Precursor Protein, C - terminal antibodyproduced in rabbit | SIGMA - ALDRICH | Lot 056M4867V | |
| biotinylated secondary antibody | Vector | BA-1000-1.5 | 10 mM sodium phosphate, pH 7.8, 0.15 M NaCl, 0.08% sodium azide, 3 mg/ml bovine serum albumin |
| bone-cutting forceps | |||
| DAB Peroxidase (HRP) Substrate Kit (with Nickel), 3,3’-diaminobenzidine | vector laboratory | ||
| embedding cassettes | |||
| ethanol 99.9 % | ROMICAL | Flammable Liquid | |
| guillotine | |||
| Hematoxylin | SIGMA - ALDRICH | H3136-25G | |
| Hydrogen peroxide solution | Millipore | 88597-100ML-F | |
| Isofluran, USP 100% | Piramamal Critical Care, Inc | ||
| Olympus BX 40 microscope | Olympus | ||
| paraffine | paraplast plus leica biosystem | Tissue embedding medium | |
| phosphate-buffered saline (PBS) | SIGMA - ALDRICH | P5368-10PAK | Contents of one pouch, when dissolved in one liter of distilled or deionized water, will yield 0.01 M phosphate buffered saline (NaCl 0.138 M; KCl - 0.0027 M); pH 7.4, at 25 °C. |
| Streptavidin HRP | ABCAM | ab64269 | Streptavidin-HRP for use with biotinylated secondary antibodies during IHC / immunohistochemistry. |
| xylene |
参考文献
- Faul, M., Wald, M. M., Xu, L., Coronado, V. G. Traumatic brain injury in the United States; emergency department visits, hospitalizations, and deaths, 2002-2006. US Government. , (2010).
- Taylor, C. A., Bell, J. M., Breiding, M. J., Xu, L. Traumatic Brain Injury-Related Emergency Department Visits, Hospitalizations, and Deaths - United States, 2007 and 2013. MMWR Surveillance Summaries. 66, 1-16 (2017).
- Peterson, A. B., Xu, L., Daugherty, J., Breiding, M. J. Surveillance report of traumatic brain injury-related emergency department visits, hospitalizations, and deaths, United States, 2014. US Government. , (2014).
- Su, E., Bell, M. Diffuse axonal injury. Translational Research in Traumatic Brain Injury. 57, 41 (2016).
- Hammoud, D. A., Wasserman, B. A. Diffuse axonal injuries: pathophysiology and imaging. Neuroimaging Clinics. 12, 205-216 (2002).
- Adams, J. H., Graham, D. I., Gennarelli, T. A., Maxwell, W. L. Diffuse axonal injury in non-missile head injury. Journal of Neurology, Neurosurgery, and Psychiatry. 54, 481-483 (1991).
- Slazinski, T., Johnson, M. C. Severe diffuse axonal injury in adults and children. Journal of Neuroscience Nursing. 26, 151-154 (1994).
- Gentleman, S. M., et al. Axonal injury: a universal consequence of fatal closed head injury. Acta Neuropathologica. 89, 537-543 (1995).
- Marehbian, J., Muehlschlegel, S., Edlow, B. L., Hinson, H. E., Hwang, D. Y. Medical Management of the Severe Traumatic Brain Injury Patient. Neurocritical Care. 27, 430-446 (2017).
- Adams, J. H., et al. Diffuse axonal injury in head injury: definition, diagnosis and grading. Histopathology. 15, 49-59 (1989).
- Xiao-Sheng, H., Sheng-Yu, Y., Xiang, Z., Zhou, F., Jian-ning, Z. Diffuse axonal injury due to lateral head rotation in a rat model. Journal of Neurosurgery. 93, 626-633 (2000).
- Ross, D. T., Meaney, D. F., Sabol, M. K., Smith, D. H., Gennarelli, T. A. Distribution of forebrain diffuse axonal injury following inertial closed head injury in miniature swine. Experimental Neurology. 126, 291-299 (1994).
- Bullock, R. Opportunities for neuroprotective drugs in clinical management of head injury. Journal of Emergency Medicine. 11, 23-30 (1993).
- Gennarelli, T. A. Mechanisms of brain injury. Journal of Emergency Medicine. 11, 5-11 (1993).
- Gennarelli, T. A., et al. Diffuse axonal injury and traumatic coma in the primate. Annals of Neurology. 12, 564-574 (1982).
- Xiaoshengi, H., Guitao, Y., Xiang, Z., Zhou, F. A morphological study of diffuse axonal injury in a rat model by lateral head rotation trauma. Acta Neurologica Belgica. 110, 49-56 (2010).
- Zlotnik, A., et al. beta2 adrenergic-mediated reduction of blood glutamate levels and improved neurological outcome after traumatic brain injury in rats. Journal of Neurosurgical Anesthesiology. 24, 30-38 (2012).
- Boyko, M., et al. An Alternative Model of Laser-Induced Stroke in the Motor Cortex of Rats. Biological Procedures Online. 21, 9 (2019).
- Boyko, M., et al. The neuro-behavioral profile in rats after subarachnoid hemorrhage. Brain Research. 1491, 109-116 (2013).
- Ma, J., Zhang, K., Wang, Z., Chen, G. Progress of Research on Diffuse Axonal Injury after Traumatic Brain Injury. Neural Plasticity. 2016, 9746313 (2016).
- Medana, I. M., Esiri, M. M. Axonal damage: a key predictor of outcome in human CNS diseases. Brain. 126, 515-530 (2003).
- Tang-Schomer, M. D., Johnson, V. E., Baas, P. W., Stewart, W., Smith, D. H. Partial interruption of axonal transport due to microtubule breakage accounts for the formation of periodic varicosities after traumatic axonal injury. Experimental Neurology. 233, 364-372 (2012).
- Johnson, V. E., Stewart, W., Smith, D. H. Traumatic brain injury and amyloid-beta pathology: a link to Alzheimer's disease. Nature Reviews Neuroscience. 11, 361-370 (2010).
- Sherriff, F. E., Bridges, L. R., Sivaloganathan, S. Early detection of axonal injury after human head trauma using immunocytochemistry for beta-amyloid precursor protein. Acta Neuropathologica. 87, 55-62 (1994).
- Reichard, R. R., White, C. L., Hladik, C. L., Dolinak, D. Beta-amyloid precursor protein staining of nonaccidental central nervous system injury in pediatric autopsies. Journal of Neurotrauma. 20, 347-355 (2003).
- Gentleman, S. M., Nash, M. J., Sweeting, C. J., Graham, D. I., Roberts, G. W. Beta-amyloid precursor protein (beta APP) as a marker for axonal injury after head injury. Neuroscience Letters. 160, 139-144 (1993).
- Smith, D. H., Hicks, R., Povlishock, J. T. Therapy development for diffuse axonal injury. Journal of Neurotrauma. 30, 307-323 (2013).
- McKenzie, K. J., et al. Is beta-APP a marker of axonal damage in short-surviving head injury. Acta Neuropathologica. 92, 608-613 (1996).
- Wilkinson, A., Bridges, L., Sivaloganathan, S. Correlation of survival time with size of axonal swellings in diffuse axonal injury. Acta Neuropathologicaogica. 98, 197-202 (1999).
- Thompson, H. J., et al. Lateral fluid percussion brain injury: a 15-year review and evaluation. Journal of Neurotrauma. 22, 42-75 (2005).
- Alder, J., Fujioka, W., Lifshitz, J., Crockett, D. P., Thakker-Varia, S. Lateral fluid percussion: model of traumatic brain injury in mice. Journal of Visualized Experiments. , e3063 (2011).
- Povlishock, J., Marmarou, A., McIntosh, T., Trojanowski, J., Moroi, J. Impact acceleration injury in the rat: evidence for focal axolemmal change and related neurofilament sidearm alteration. Journal of Neuropathology & Experimental Neurology. 56, 347-359 (1997).
- Heath, D. L., Vink, R. Impact acceleration-induced severe diffuse axonal injury in rats: characterization of phosphate metabolism and neurologic outcome. Journal of Neurotrauma. 12, 1027-1034 (1995).
- Lighthall, J. W. Controlled cortical impact: a new experimental brain injury model. Journal of Neurotrauma. 5, 1-15 (1988).
- Palmer, A. M., et al. Traumatic brain injury-induced excitotoxicity assessed in a controlled cortical impact model. Journal of Neurochemistry. 61, 2015-2024 (1993).
- Hamm, R. J., et al. Cognitive deficits following traumatic brain injury produced by controlled cortical impact. Journal of Neurotrauma. 9, 11-20 (1992).
- Nyanzu, M., et al. Improving on Laboratory Traumatic Brain Injury Models to Achieve Better Results. International Journal of Medical Sciences. 14, 494-505 (2017).
- Xiong, Y., Mahmood, A., Chopp, M. Animal models of traumatic brain injury. Nature Reviews Neuroscience. 14, 128-142 (2013).
- Lighthall, J. W., Dixon, C. E., Anderson, T. E. Experimental models of brain injury. Journal of Neurotrauma. 6, 83-97 (1989).
- Meaney, D. F., et al. Modification of the cortical impact model to produce axonal injury in the rat cerebral cortex. Journal of Neurotrauma. 11, 599-612 (1994).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。