Method Article
ستائر الحمض النووي تلقي الضوء على الأنظمة الجزيئية المعقدة أثناء إعادة التركيب المتماثل
* These authors contributed equally
In This Article
Summary
تقدم ستائر الحمض النووي طريقة جديدة لتصور مئات أو حتى آلاف البروتينات المرتبطة بالحمض النووي في الوقت الفعلي لأنها تتفاعل مع جزيئات الحمض النووي المحاذاة على سطح غرفة عينة الموائع الدقيقة.
Abstract
إعادة التركيب المتماثل (HR) مهم لإصلاح فواصل الحمض النووي مزدوجة الشريطة (DSBs) وشوكات النسخ المتماثل المتوقفة في جميع الكائنات الحية. ترتبط العيوب في الموارد البشرية ارتباطا وثيقا بفقدان سلامة الجينوم والتحول الورمي في الخلايا البشرية. تتضمن الموارد البشرية إجراءات منسقة لمجموعة معقدة من البروتينات ، لا يزال الكثير منها غير مفهوم جيدا. الجانب الرئيسي للبحث الموصوف هنا هو تقنية تسمى "ستائر الحمض النووي" ، وهي تقنية تسمح بتجميع جزيئات الحمض النووي المحاذاة على سطح غرفة عينة الموائع الدقيقة. يمكن بعد ذلك تصورها عن طريق الفحص المجهري الفلوري للانعكاس الداخلي الكلي (TIRFM). كانت ستائر الحمض النووي رائدة في مختبرنا وتسمح بالوصول المباشر إلى المعلومات الزمانية المكانية بمقاييس زمنية بالمللي ثانية ودقة مقياس النانومتر ، والتي لا يمكن الكشف عنها بسهولة من خلال منهجيات أخرى. تتمثل الميزة الرئيسية لستائر الحمض النووي في أنها تبسط جمع البيانات ذات الصلة إحصائيا من تجارب الجزيء الفردي. يستمر هذا البحث في تقديم رؤى جديدة حول كيفية تنظيم الخلايا والحفاظ على سلامة الجينوم.
Introduction
يعد الحفاظ على سلامة الجينوم أمرا بالغ الأهمية لحسن سير جميع الخلايا الحية1. يمكن أن تؤدي العيوب في سلامة الجينوم إلى حالات صحية خطيرة ، بما في ذلك أنواع مختلفة من السرطان والأمراض التنكسية المرتبطةبالعمر 2. يستخدم إعادة التركيب المتماثل (HR) تخليق الحمض النووي المعتمد على القالب لإصلاح فواصل الحمض النووي المزدوجة الشريطة (DSB) ، وفجوات الحمض النووي أحادي الشريطة (ssDNA) ، والروابط المتشابكة للحمض النووي3. الموارد البشرية ضرورية أيضا لاستعادة شوكات النسخ المتماثل المتوقفة والمنهارة3،4. علاوة على ذلك ، يعد HR ضروريا لفصل الكروموسومات الدقيق أثناء الانقسام الاختزالي5،6.
يتضمن الموارد البشرية الإجراءات المنسقة لمجموعة معقدة من البروتينات ، لا يزال الكثير منها غير مفهوم جيدا1. تشمل الأمثلة بروتين النسخ المتماثل A (RPA) و Rad51 و Rad54 ، من بين العديد من البروتينالآخر 7. تتضمن تفاعلات HR في كل من الخلايا بدائية النواة وحقيقية النواة وسيطا SSDNA ، والذي يتم تغطيته بسرعة بواسطة بروتينات مرتبطة ب ssDNA (SSB في بدائيات النوى و RPA في حقيقيات النوى)8. تحمي هذه البروتينات ssDNA من النوكليازات ، وتزيل البنية الثانوية ، وتعزز تجنيد العوامل النهائية8،9. Rad51 هو عضو في عائلة Rad51 / RecA المعتمدة بشكل كبير على ATP من إعادة تركيب الحمض النووي ، والتي توجد في جميع الكائنات الحية1. يعزز Rad51 غزو خيوط الحمض النووي للمتبرع المتماثل dsDNA. نظرا لأهميته ، فإن Rad51 منظم للغاية ، وترتبط العيوب في هذه العمليات التنظيمية عادة بفقدان سلامة الجينوم والتحول الورمي7. Rad54 هو عضو في عائلة Swi2 / Snf2 من translocases dsDNA وإعادة تشكيل الكروماتين10،11. تعمل هذه البروتينات كعوامل تنظيمية أساسية ل Rad51. الأهم من ذلك ، أن Rad54 يزيل Rad51 من منتج dsDNA لغزو الخيط وهو ضروري أيضا لمنع التراكم غير الصحيح ل Rad51 على الكروماتين11. ألقت الأنشطة الجزيئية للبروتينات المشاركة في الموارد البشرية في كل من الخميرة والخلايا البكتيرية الضوء على وظيفتها في الموارد البشرية ، ولكن بالضبط كيف يساهم نشاطها في الموارد البشرية لا يزال غير مفهوم جيدا 12.
ظهرت ستائر الحمض النووي كمنصة فريدة توفر وصولا مباشرا إلى الآليات الجزيئية والديناميكيات الجزيئية الكبيرة التي ستظل غير قابلة للوصول13،14. لتحضير ستائر الحمض النووي ، يتم طلاء سطح غرفة الموائع الدقيقة بطبقة ثنائية الدهون ، ويتم ربط جزيئات الحمض النووي بالطبقة الثنائية من خلال ارتباط البيوتين والستربتافيدين. تجعل الطبقة الثنائية السطح خاملا عن طريق تقليد أغشية الخلايا الطبيعية. تعمل القوة الهيدروديناميكية على محاذاة الحمض النووي على طول الحواجز النانوية ، مما يسمح بتصور مئات الجزيئات في مجال رؤية واحد عن طريق الفحص المجهري الفلوري للانعكاس الداخلي الكلي (TIRFM). يتم إجراء الحواجز بواسطة الطباعة الحجرية لشعاع الإلكترون ، وتسمح الاختلافات في تصميم الحاجز بالتحكم الدقيق في توزيع وهندسة ربط الحمض النووي. هذه الأساليب قابلة للتطبيق بسهولة مع ssDNA أو dsDNA13،14،15،16،17،18. يمكن أيضا تصنيع الركائز نانوية (جنبا إلى جنب مع الحواجز) للسماح بربط طرفي الحمض النووي بسطح غرفة العينة بحيث يمكن إجراء تجارب الحالة المستقرة في حالة عدم وجود تدفق عازل.
يتم الكشف عن التغيرات المعتمدة على الوقت في مجمعات البروتين والحمض النووي الفردية من خلال فحص مقاطع الفيديو في الوقت الفعلي ويتم تمثيلها في الطباعة باستخدام التصوير الكيميائي ، والتي تقدم الموضع المتغير للبروتينات على الحمض النووي بمرور الوقت. يتمثل أحد الجوانب المهمة في نهج ستائر الحمض النووي في أنه لا يتطلب بالضرورة نماذج أو افتراضات مسبقة حول الآليات الجزيئية ، لأنه يمكن ملاحظة سلوك مكونات التفاعل الفردية في الوقت الفعلي. هذا يسمح بالملاحظة المباشرة للسلوكيات الجزيئية. هنا ، يصف هذا البروتوكول كيفية تحضير ستائر الحمض النووي مع ركائز dsDNA بالإضافة إلى تطبيقه لدراسة المواد الوسيطة في إعادة التركيب المتماثل.
Protocol
1. تحضير مخزون الدهون
- قم بإذابة 1 جم من 18: 1 (Δ9-CIS) PC ، و 100 مجم من 18: 1 PEG2000 PE ، و 5 مجم من غطاء البيوتينيل 18: 1 PE في 10 مل من الكلوروفورم.
ملاحظة: يتميز كل من DOPC و DPPE جيدا ويتم اختيارهما (جنبا إلى جنب مع تعديل PEG) لقدرتهما على تقليل الامتزاز غير المحدد على سطح خلية التدفق. يمكن تناول مزيج الدهون المذاب وتخزينه عند -20 درجة مئوية حتى 12 شهرا. - استخدم الكلوروفورم لتنظيف حقنة زجاجية ذات مذيبات عضوية ، ثم انقل 200 ميكرولتر (10٪ من الحجم النهائي المطلوب) من مزيج الدهون الرئيسي إلى القارورة الزجاجية.
- تبخر الكلوروفورم من القارورة الزجاجية باستخدام تيار لطيف جدا من النيتروجين المضغوط. قم بزيادة الضغط قليلا في نهاية التبخر لضمان إزالة جميع آثار الكلوروفورم.
ملاحظة: قم بإمالة القارورة وتدويرها أثناء عملية التبخر حتى تجف الدهون كطبقة موحدة من الفيلم الأبيض على الحائط. - ضع القارورة غير مغطاة تحت الفراغ طوال الليل.
- أضف 2 مل من المخزن المؤقت للدهون (10 ملي Tris-HCl [درجة الحموضة 8.0] ، 100 ملي كلوريد الصوديوم) إلى طبقة الدهون المجففة وقم بتغطية القارورة. احتضن في درجة حرارة الغرفة (RT) لمدة 1 ساعة على الأقل والدوامة حتى تذوب.
- انقل المحلول إلى أنبوب دائري القاع من البوليسترين سعة 5 مل وصوتنة على الجليد باستخدام طرف صغير مع المعلمات التالية: السعة = 50 ، وقت العملية = 1.5 دقيقة ، النبض = 15 ثانية ، وقت التوقف = 2 دقيقة. سيكون الحل واضحا بعد صوتنة (الطاقة الإجمالية = 1,500-2,000 جول).
- قم بتصفية المحلول من خلال مرشح حقنة PVDF 0.22 ميكرومتر وقم بتخزين مخزون الدهون عند 4 درجات مئوية لمدة تصل إلى شهر واحد.
2. تحضير ركيزة dsDNA
- قم بتسخين مخزون λ-DNA (500 ميكروغرام / مل) إلى 65 درجة مئوية.
- تحضير مزيج التلدين / الربط الذي يحتوي على: 1.6 جزء من λ-DNA ، 100x مولر فائض (160 جزء من المليون) من كل قليل النوكليوتيد (BioL: 5'Phos-AGG TCG CCG CCC-3Bio و DigR: 5'Phos-GGG CGG CGA CCT-3Dig_N) و 60 ميكرولتر من 10x T4 Ligase REGA.
ملاحظة: قليل النوكليوتيدات BioL و DigR بيوتينيل (Bio) ومعدلة باستخدام digoxigenin (Dig) ، على التوالي. يسمح البيوتينيل بربط جزيئات الحمض النووي بالدهون الحيوية عبر روابط الستربتافيدين. يتيح تعديل Dig الربط المزدوج من خلال ربط الأجسام المضادة المضادة للحفر المطلية على الركائز بشقوق الحفر. - قم بتلدين قليل النوكليوتيدات إلى نهايات λ-DNA عن طريق احتضان التفاعل عند 65 درجة مئوية لمدة 10 دقائق ، ثم اتركه يبرد ببطء إلى RT.
- أضف 5 ميكرولتر من T4 DNA ligase واحتضنه في RT طوال الليل.
ملاحظة: يمكن أيضا تنفيذ خطوات التلدين والربط في دورة حرارية. - قم بترسيب λ-DNA عن طريق إضافة 300 ميكرولتر من محلول PEG-8000 (30٪ وزن / حجم PEG-8000 و 10 ملي ملي MgCl2). احتضان عند 4 درجات مئوية لمدة 1 ساعة على الأقل.
- جهاز طرد مركزي عند 14,000 × جم لمدة 5 دقائق في RT. قم بإزالة المادة الطافية بعناية دون إزعاج الحبيبات. اختياريا, اغسل الحبيبات 1x مع 500 ميكرولتر من الإيثانول المبرد 70٪.
- أعد تعليق الحبيبات في 40 ميكرولتر من المخزن المؤقت TE (10 ملي مولار Tris-HCl ، 1 ملي EDTA [درجة الحموضة 8.0]).
3. التصنيع النانوي لأنماط الكروم
- قم بحفر فتحتين في وسط شريحة مجهر كوارتز مقاس 1 × 3 بوصة (~ 3 سم) باستخدام مثقاب مطلي بالماس مقاس 1.4 مم على مكبس حفر أعلى الطاولة (انظر الشكل 1 لمعرفة هندسة موضع الحفر).
- قم بتنظيف الشرائح المحفورة عن طريق غمرها في 200 مل من محلول سمكة البيرانا (75٪ حامض الكبريتيك [97٪] و 25٪ بيروكسيد الهيدروجين). احتضان لمدة 30 دقيقة.
تنبيه: يجب توخي الحذر الشديد لتجنب ملامسة الجلد المكشوف. تحضير المحلول عن طريق خلط بيروكسيد الهيدروجين البارد ببطء شديد مع حمض الكبريتيك. تخلص من نفايات سمكة البيرانا بشكل صحيح في حاوية نفايات مخصصة. - اشطف الشرائح عن طريق غمرها في 200 مل من الماء المقطر المزدوج. كرر 2x للتخلص من أي سمكة البيرانا المتبقية. جفف الشرائح بتيار لطيف من النيتروجين المضغوط.
- باستخدام آلة طلاء الدوران (4,000 دورة في الدقيقة لمدة 45 ثانية ، معدل منحدر 300 دورة في الدقيقة / ثانية) ، قم بتغطية الشرائح النظيفة بالبوليمر المقاوم للضوء والموصل على النحو التالي:
- قم بتغطية الشرائح بطبقة من 3٪ (وزن / حجم) بولي ميثيل ميثاكريلات (PMMA ؛ 24.3 كيلو ميجاوات ؛ مذاب في الأنيزول).
- طبقة من الشرائح بطبقة من 1.5٪ (وزن / حجم) بولي ميثيل ميثاكريلات (PMMA ؛ 495 كيلو ميجاوات ؛ مذاب في الأنيزول).
- معطف الشرائح بطبقة من العامل المضاد للكهرباء الساكنة للطباعة الحجرية لشعاع الإلكترون.
- اكتب أنماطا مخصصة للحواجز والركائز على الشرائح المطلية باستخدام الطباعة الحجرية لشعاع الإلكترون مع مجهر إلكتروني ماسح مزود ببرنامج نظام توليد الأنماط النانوية.
- قم بتطوير الشرائح عن طريق شطف العامل المضاد للكهرباء الساكنة لأول الطباعة الحجرية لشعاع الإلكترون بالماء المقطر المزدوج. بعد ذلك ، ضعها في أنابيب سعة 50 مل تحتوي على المحلول النامي (75٪ ميثيل إيزوبوتيل كيتون [MIBK] و 25٪ إيزوبروبانول ؛ يحفظ مبردا عند -20 درجة مئوية) والصوتنة في حمام جليدي على طاقة منخفضة لمدة 1 دقيقة.
- اشطف المحلول النامي بالأيزوبروبانول وجففه بتيار لطيف من النيتروجين المضغوط.
- باستخدام مبخر شعاع الإلكترون ، قم بإيداع طبقة سميكة 250 Å من الكروم على السطح المزخرف بسرعة 0.5 Å / s.
- ارفع الكروم والمتبقي PMMA باستخدام الأسيتون من زجاجة بخ ، متبوعا بالصوتنة على الشرائح في حمام الأسيتون لمدة 10 دقائق. يغسل مرة أخرى بالأسيتون من زجاجة بخ.
- لمنع أي رواسب من الأسيتون المتبقي ، اشطف الشرائح بكحول الأيزوبروبيل وجففها بتيار لطيف من النيتروجين المضغوط.
4. تجميع خلية التدفق
- ضع قالب ورق مستطيل مقاس 35 مم × 5 مم (يغطي نمط الكروم بالإضافة إلى فتحات المدخل / المخرج المحفورة مسبقا) فوق شريحة الكوارتز ، بحيث يكون الجانب المزخرف متجها لأعلى ( الشكل 1 أ).
- ضع قطعة من الشريط على الوجهين (بسمك 1 مم) فوق شريحة الكوارتز ، وتغطي قالب الورق ، ثم استخدم شفرة حلاقة لقص قالب الورق المستطيل ( الشكل 1 أ).
- ضع غطاء زجاجيا فوق الشريط على الوجهين واضغط برفق لإغلاق الغطاء على الشريط ( الشكل 1 أ). تشكل المسافة بين الغطاء والشريحة ، المختومة بشريط على الوجهين ، غرفة الموائع الدقيقة.
ملاحظة: من الأهمية بمكان أن يكون الختم بين زلة الغطاء والشريحة آمنا بدرجة كافية لمنع التسرب أثناء التجربة. - ضع شطيرة الغطاء المنزلق بين الشرائح الزجاجية وقم بإرفاق مشابك الموثق على جميع الجوانب الأربعة لتوزيع الضغط بالتساوي. ضع التجميع في فرن مفرغ لمدة 60 دقيقة عند 135 درجة مئوية لإذابة الشريط على الوجهين وإغلاق الغرفة.
- أخرجه من الفرن ، ثم حرر مشابك الموثق والشرائح الزجاجية.
- قم بتوصيل منافذ الموائع الدقيقة بفتحات المدخل / المخرج المحفورة مسبقا باستخدام مسدس الغراء الساخن عن طريق وضع المجموعة الملصقة على كتلة تسخين (220 درجة مئوية) لمدة دقيقة واحدة ، وخلعها ، وتطبيق ضغط لطيف بعناية لإغلاق منافذ الموائع الدقيقة بشكل صحيح. اترك الغراء يشفى تماما قبل المتابعة.
ملاحظة: يمكن وضع خلايا التدفق المجمعة في أنابيب سعة 50 مل وتخزينها تحت الفراغ.
5. تجميع ستارة dsDNA
- قم بتوصيل أنبوب المدخل / المخرج بمنافذ الموائع الدقيقة لخلية التدفق واغسل الغرفة ب 20 مل من الماء المقطر المزدوج باستخدام حقنتين سعة 10 مل.
- مع حقنة سعة 10 مل مملوءة بالماء المقطر المزدوج المتصل بجانبي خلية التدفق ، استخدم القوة لدفع / سحب الماء بين محاقن المدخل والمخرج. تزيل هذه الخطوة جميع فقاعات الهواء من خلية التدفق.
- اغسل الغرفة ب 3 مل من محلول الدهون (10 ملي Tris-HCl [درجة الحموضة 8.0] ، 100 ملي كلوريد الصوديوم).
ملاحظة: تأكد من أن جميع التوصيلات بخلايا التدفق من إسقاط إلى إسقاط لتجنب إدخال فقاعات الهواء في خلية التدفق. - امزج 40 ميكرولتر من محلول الجسيمات الشحمية مع 1 مل من محلول الدهون. حقن 300 ميكرولتر من محلول الدهون في خلية التدفق واحتضانها لمدة 5 دقائق. كرر الحقن والحضانة 2x.
ملاحظة: قم بتبديل جانب المدخل / المخرج للحقن في كل مرة يتم فيها توصيل حقنة بخلية التدفق. - اغسل الغرفة ب 3 مل من محلول الدهون واحتضانها لمدة 15 دقيقة.
ملاحظة: يمكن أن تختلف فترة الحضانة هذه من 5 دقائق إلى 2 ساعة ، اعتمادا على جدولة التجارب ، دون اختلافات ملحوظة في تجميع الستارة النهائية. - امزج 40 ميكرولتر من محلول مخزون 1 مجم / مل مضاد للديجوكسيجينين مع 200 ميكرولتر من محلول الدهون. حقن 100 ميكرولتر من المحلول واحتضانه لمدة 10 دقائق. كرر الحقن والحضانة 1 مرة قبل الغسيل باستخدام 3 مل من محلول الدهون.
ملاحظة: هذه الخطوة مطلوبة فقط للستائر dsDNA المربوطة المزدوجة. تخطي هذه الخطوة للحصول على ستائر dsDNA أحادية الربط. - اغسل الغرفة ب 3 مل من المخزن المؤقت BSA (40 ملي Tris-HCl [درجة الحموضة 8.0] ، 2 ملي ملي MgCl2 ، 1 ملي مولار DTT ، و 0.2 مجم / مل BSA).
- امزج 10 ميكرولتر من محلول مخزون الستربتافيدين 1 مجم / مل مع 990 ميكرولتر من محلول BSA. حقن كحقنتين منفصلتين 400 ميكرولتر مع حضانة لمدة 10 دقائق بعد كل حقنة.
- اغسل الحجرة ب 3 مل من المخزن المؤقت BSA لإزالة أي ستربتافيدين زائد.
- تمييع 25 نانوغرام من مخزون الركيزة dsDNA في 1 مل BSA عازلة. حقن محلول الحمض النووي ببطء 200 ميكرولتر في المرة الواحدة ، متبوعا بحضانة لمدة 5 دقائق بعد كل حقنة. يمكن تحسين كمية الحمض النووي المطلوبة لأنواع معينة من التجارب.
- قم بتركيب خلية التدفق على مرحلة المجهر واضبط التركيز حسب الضرورة.
- قم بتوصيل منافذ الإدخال والإخراج بنظام حقن العينة المكون من مضخة حقنة وصمام تبديل الضغط العالي.
- قم بربط الحمض النووي بقاعدة مزدوجة (طول الحبل 12 ميكرومتر) عن طريق غسل الغرفة باستمرار باستخدام المخزن المؤقت BSA بسرعة 0.8 مل / دقيقة لمدة 5 دقائق.
ملاحظة: قد يكون من الضروري ضبط معدلات التدفق وأوقاته لتحسين أطوال الحبل المزدوج المختلفة. هذه الخطوة مطلوبة فقط لستائر الحمض النووي المربوطة المزدوجة. تخطي هذه الخطوة للحصول على ستائر dsDNA أحادية الربط. - الستائر جاهزة الآن للتجارب.
6. إعادة تدوير خلايا التدفق
- اغمر الشرائح في الإيثانول لمدة 30 دقيقة على الأقل قبل استخدام شفرة الحلاقة لإزالة منافذ الموائع الدقيقة والغطاء بعناية. تخلص من الغطاء بشكل صحيح ونظف أي غراء متبقي من منافذ الموائع الدقيقة حتى يمكن إعادة استخدامها. افرك تنظيف أي بقايا غراء على الشريحة.
ملاحظة: احرص على عدم خدش المنطقة المزخرفة في وسط الشريحة. - اشطف الشرائح جيدا بالماء المقطر المزدوج واغمرها في مركز تنظيف الكوارتز السائل القلوي بنسبة 2٪ طوال الليل مع التحريك.
- شطف الشرائح جيدا مع الماء المقطر المزدوج واغمر في 2 ٪ القلوية السائل تنظيف تنظيف محلول تركيز الكوارتز لمدة 1 ساعة مع التحريك عند 80 درجة مئوية ، متبوعا بالصوتنة لمدة 15 دقيقة عند 45 درجة مئوية.
- اشطف الشرائح جيدا بالماء المقطر المزدوج واغمرها في 1 متر من هيدروكسيد الصوديوم لمدة 30-60 دقيقة مع التحريك.
- اشطف الشرائح جيدا بالماء المقطر المزدوج ، ثم اغمرها في كحول الأيزوبروبيل والصوتنة لمدة 15 دقيقة عند 45 درجة مئوية.
- شطف الشرائح جيدا مع الإيثانول واغمر في الإيثانول لمدة 1 ساعة مع التحريك.
- ضع الشرائح في فرن مفرغ لمدة ساعة واحدة حتى تجف عند 135 درجة مئوية. الشرائح جاهزة الآن لإعادة تجميعها في خلايا التدفق.
النتائج
الموصوفة أعلاه هي إعداد وتجميع وتصوير ستائر dsDNA أحادية ومزدوجة في سياق دراسة تفاعلات البروتين والحمض النووي في وسيطات إصلاح الحمض النووي. يوضح الشكل 1 أ جميع المكونات في خلية التدفق ، في طبقات بالترتيب الذي يتم تجميعها. يصور الشكل 1 ب الرسم التخطيطي لستارة الحمض النووي المفردة أو المزدوجة. يتم استخدام طبقة ثنائية الدهون لتخميل سطح خلية التدفق. تتكون ستارة الحمض النووي من مجموعة متوازية من جزيئات الحمض النووي المربوطة في أحد طرفيها بالدهون ومحاذاة عند حاجز الكروم ، موجهة بشكل عمودي على اتجاه التدفق. بالنسبة لستائر الحمض النووي المربوطة المزدوجة ، يتم ربط الطرف الآخر من الحمض النووي بالقاعدة من خلال تفاعلات Digoxigenin و anti-Digoxigenin ، بحيث يمكن إجراء التصوير في حالة عدم وجود تدفق بينما يظل الحمض النووي ممتد. يمكن تلطيخ dsDNA بصبغة الفلورسنت YoYo1 وتصورها بواسطة الفحص المجهري TIRF. يوضح الشكل 2 أ صورة تمثيلية واسعة المجال لستارة الحمض النووي المزدوجة المربوطة باللون YoYo1.
عادة ما يتم تحليل سلسلة صور الفاصل الزمني التي تم جمعها من تجارب ستارة الحمض النووي عن طريق إنشاء مخطط حرجي أولا ، والذي يرسم الموضع على طول جزيء الحمض النووي على المحور الرأسي مقابل الوقت على المحور الأفقي لكل جزيء DNA ذي أهمية في ImageJ. الشكل 2 ب عبارة عن أجهزة تصوير حرائية تمثيلية توضح استئصال λ-DNA أحادي الربط الملون ب YoYo1 (أخضر) بواسطة آلات استئصال الخميرة GFP-Sgs1 (غير مرئي) و Top3-Rmi1 و Dna2 في وجود بروتين ربط الحمض النووي أحادي الشريطة RPA-mCherry (أرجواني) و ATP. يتم فقد إشارة YoYo1 بمرور الوقت حيث يتم استئصال dsDNA من الطرف الحر بواسطة Sgs1-Dna2. في الوقت نفسه ، تتموضع إشارة mCherry مع نهايات الحمض النووي التي يتم عندها إنشاء ssDNA نتيجة الاستئصال. يمكن استخراج الخصائص ذات الصلة بالفيزياء الحيوية للاستئصال ، مثل السرعة والمعالجة ، عن طريق تحديد منحدرات مسارات فقدان إشارة YoYo1. يوضح الشكل 2C ، D توزيع السرعات والمعالجة ، على التوالي ، للاستئصال بواسطة Sgs1-Dna2.
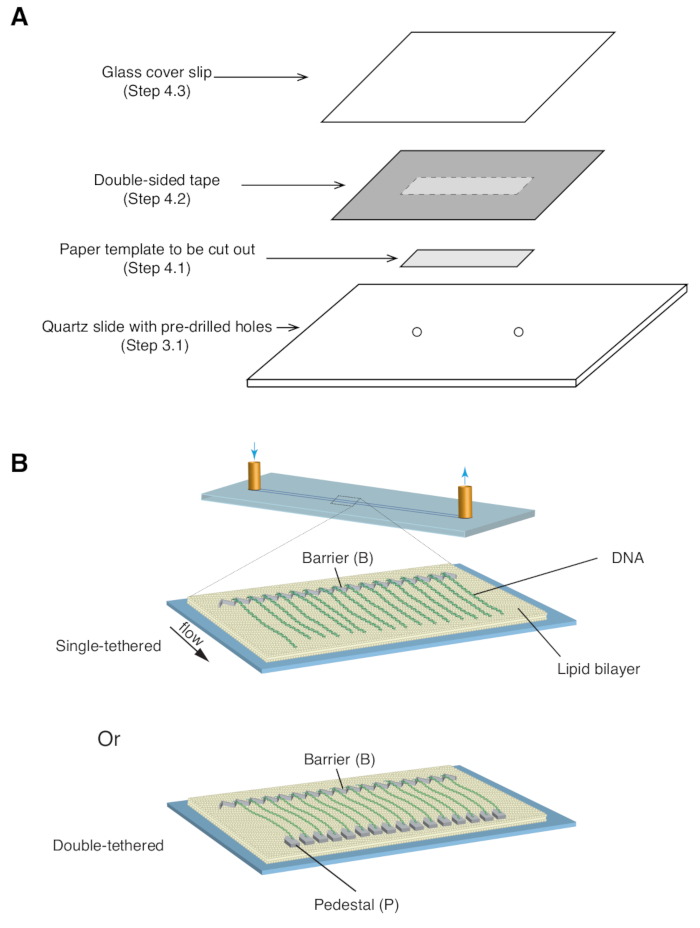
الشكل 1: مخططات تجميع خلايا التدفق وستائر الحمض النووي. (أ) توضيح تدريجي لتجميع خلايا التدفق. يتم وضع شريط على الوجهين أعلى شريحة الكوارتز ، ويتم استخدام قالب ورقي لقطع قناة مستطيلة من المركز ، والتي يتم إغلاقها بقلة غطاء في الأعلى لتشكيل غرفة. (ب) مخططات ستائر الحمض النووي المجمعة بالكامل. تقدم اللوحة الوسطى خلية تدفق أحادية الربط ، بينما تقدم اللوحة السفلية خلية تدفق مزدوجة الربط. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
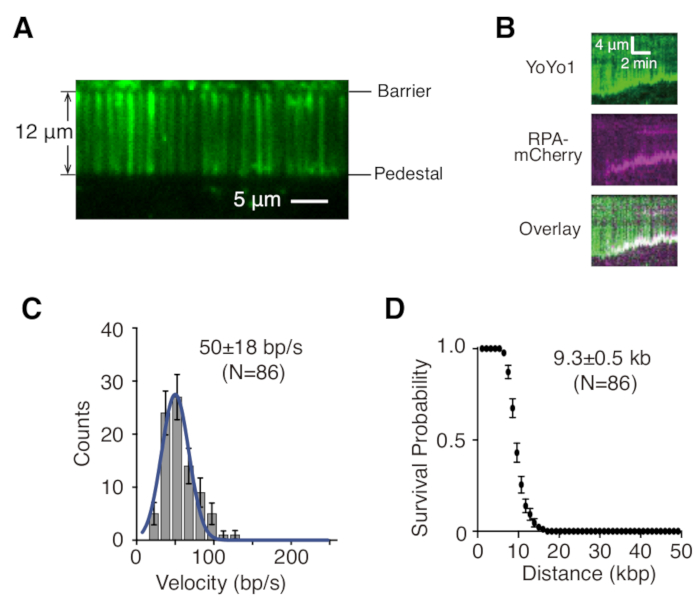
الشكل 2: تصور ستارة الحمض النووي أحادي الجزيء وتحليله. (أ) صورة تمثيلية واسعة المجال لستارة λ-DNA مزدوجة الربط ملطخة ب YoYo1 (أخضر). (ب) تصوير الوسائط التمثيلية الذي يظهر استئصال dsDNA الملون ب YoYo1 (أخضر) في وجود GFP-Sgs1 مرتبط مسبقا (غير مرئي) عند مطاردته باستخدام Dna2 ، في وجود RPA-mCherry (أرجواني) و 2 ملي مولار ATP. توزيع السرعة (C) ومخطط المعالجة (D) لاستئصال dsDNA بواسطة Sgs1-Dna2 ، الذي تم الحصول عليه عن طريق تحديد معدل ومدى فقدان إشارة YoYo1 بمرور الوقت. تم اقتباس اللوحات (B) و (C) و (D) من Xue et al.19. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
أثبتت ستائر الحمض النووي أنها منصة متعددة الاستخدامات لدراسة عمليات إصلاح الحمض النوويالمختلفة 13،14،15،16. تسمح جزيئات الحمض النووي التي تظل ممتدة بالقرب من السطح طوال التجربة ، إما من خلال التدفق العازل المستمر أو الربط المزدوج بالقاعدة ، بتصوير TIRFM لتفاعلات البروتين والحمض النووي على وسيطات الإصلاح على مستوى الجزيء الفردي. توفر هذه الطريقة تحسينا في الإنتاجية التجريبية والقدرة على التنبؤ ، نظرا لأن مئات جزيئات الحمض النووي تتم محاذاة بشكل منظم عند حواجز نانوية بدلا من ربطها على السطح بشكل غير محدد ، مما يفيد معالجة مجموعات البيانات الكبيرة.
يوفر التحليل الدقيق لسلسلة صور الفاصل الزمني الناتجة قياسات كمية لتفاعلات البروتين والحمض النووي (على سبيل المثال ، عمر الربط ، والمواقف ، وقياس المتكافئ ، وحركية التفكك ، ومعدلات النقل ، وعمليات البروتينات الحركية ، والتموضع والتفاعلات بين البروتينات و / أو الحمض النووي). بالمقارنة مع تقنيات التصوير الأخرى للجزيء الفردي التي إما تربط جزيئات الحمض النووي مباشرة بالسطح أو تجمع بين التصوير متحد البؤر والتلاعب بالقوة في الأدوات التجارية ، فإن المقايضة الرئيسية لستائر الحمض النووي للحصول على إنتاجية أعلى هي إنشاء التقنيات اللازمة للإعداد الأولي13،14،15،16. ومع ذلك ، بمجرد إنشائها ، تؤدي القدرة على جمع البيانات عن مئات الجزيئات في وقت واحد في خلية تدفق واحدة إلى توفير كبير في الوقت الذي يقضيه في جمع البيانات.
كما هو الحال مع العديد من طرق التصوير الأخرى للجزيء الفردي ، فإن القدرة على إعداد سطح نظيف تملي إلى حد كبير قدرة المستخدم على تجميع ستائر الحمض النووي بشكل موثوق. في هذه الحالة ، لا تتطلب الأسطح النظيفة البدء بشريحة نظيفة فحسب ، بل تتطلب أيضا التأكد من عدم إدخال فقاعات هواء مجهرية في الغرفة أثناء إجراء أي من التوصيلات السائلة. أولا ، فيما يتعلق بنظافة الشرائح ، يجب أن تكون الخطوات المفصلة أعلاه في القسم 6 كافية كعملية تنظيف روتينية. يوصى أيضا باستخدام الحلول والمخازن المؤقتة التي تمت تصفيتها. ثانيا ، يعد إجراء توصيلات من إسقاط إلى إسقاط أثناء ربط خلية التدفق بنظام الحقن المؤقت أمرا ضروريا لتجنب إدخال الفقاعات. قد يكون من المفيد إزالة الغاز من الماء المقطر المزدوج المستخدم في صنع المخازن المؤقتة. يوصى أيضا بمراقبة أي عملية حقن بعناية للتأكد من عدم وجود فقاعات. في حالة إدخال فقاعة مجهرية قبل أن تصل إلى المنطقة المزخرفة المركزية ، فيمكن معالجتها عن طريق حقن المخزن المؤقت من منفذ الموائع الدقيقة على الجانب الآخر لدفع الفقاعة للخارج.
نقطة أخرى مهمة للنظر فيها في أي تجارب قائمة على التألق هي الإشارة إلى الضوضاء. يكمن مفتاح مراقبة البروتينات الفلورية المفردة (أي GFP) أيضا في الأسطح النظيفة. بعد الاستخدام الممتد ، تتراكم مجاميع البروتين عادة عند حواجز الكروم والركائز. لذلك ، إذا لوحظت إشارة مضان قوية عند الحواجز قبل إضافة بروتينات الفلورسنت ، فمن المستحسن معالجة الشرائح بالغمر لمدة 10 دقائق في محلول سمكة البيرا. يتم الاحتفاظ بالفترة الزمنية قصيرة لتجنب تآكل ميزات الكروم. يجب أن يتبع غسل سمكة البيرانا إجراء التنظيف المنتظم.
يمكن أن يكون التصنيع النانوي باستخدام الطباعة الحجرية لشعاع الإلكترون أمرا صعبا ، نظرا لمتطلباته من المعدات والمرافق بالإضافة إلى الخبرة الحالية في علوم المواد. كبديل ، تم تطوير طريقة قائمة على الطباعة الحجرية للأشعة فوق البنفسجية لتصنيع ميزات الكروم لستائر الحمض النووي20. كما يتم توفير هذا البروتوكول نمطا أساسيا للربط المزدوج للحمض النووي لامدا عند 12 ميكرومتر (انظر المعلومات التكميلية). يمكن تعديل العديد من جوانب تصميم هذا النمط لتناسب الاحتياجات التجريبية المختلفة. وتشمل هذه المسافة بين الحواجز والركائز ، والتباعد بين الآبار المجاورة في الحاجز للتحكم في كثافة الحمض النووي ، وشكل وحجم الركائز لتحسين كفاءة الربط المزدوج وتقليل عدم اليقين في أطوال الربط المزدوج. قد تشمل التحديات العملية الأخرى اختيار استراتيجيات وضع العلامات الفلورية للبروتينات ، وتقليل التحيز في التحليل اليدوي للبيانات ، وتطوير البرامج النصية لمعالجة البيانات بشكل أكثر بساطة.
في حين أن البروتوكول الموصوف هنا يتضمن ركائز dsDNA ، فقد تم أيضا استخدام ستائر الحمض النووي القائمة على ssDNA على نطاق واسع13،14،15،16. يستخدم تحضير ركائز ssDNA تكرار الدائرة المتدحرجة لبلازميد M13 ssDNA مع بادئات بيوتينيل13. يتطلب تجميع ستارة ssDNA أيضا استخدام اليوريا والبروتين المرتبط ب ssDNA RPA للتخلص من البنية الثانوية وتوسيع ركيزة ssDNA13. قد يكون من الممكن أيضا تمديد ستائر الحمض النووي لاستخدام الحمض النووي الريبي أو الحمض النووي الريبي الهجينة لدراسات البروتينات المتفاعلة مع الحمض النووي الريبي. كما هو الحال حاليا ، يمكن أن تستفيد منصة ستارة الحمض النووي من الأتمتة في عملية التجميع كما هو مفصل في القسم 5 ، ومعظمها عبارة عن حقن متكررة لمجموعة قياسية من المخازن المؤقتة. قد يؤدي هذا إلى تحسين الكفاءة في إجراء تجارب متعددة في وقت واحد. بالإضافة إلى ذلك ، فإن مجموعة موحدة وربما قائمة على التعلم الآلي من البرامج النصية للتحليل من شأنها تسريع معالجة البيانات بأقل قدر من التحيز.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
يشكر المؤلفون الأعضاء السابقين والحاليين في مختبر جرين على تطوير بروتوكول ستائر الحمض النووي وتحسينه ومناقشته ، بالإضافة إلى التعليق على هذه المخطوطة. تم دعم هذا العمل من خلال منح من المؤسسة الوطنية للعلوم (MCB1154511 إلى ECG) والمعاهد الوطنية للصحة (R01CA217973 إلى ECG).
Materials
| Name | Company | Catalog Number | Comments |
| nano pattern generation system software | JC Nabity Lithography Systems | N/A | NPGS |
| PFA Tubing, Natural 1/16" OD x .020" ID | IDEX | 1512L | |
| Poly(Methyl Methacrylate), Atactic (24.3K MW) | Polymer Source Inc. | P9790-MMA | |
| Quartz Microscope Slide | G. Finkenbeiner Inc. | N/A | 1" x 3" x 1 mm thick |
| Scanning Electron Microscope | FEI | N/A | Nova Nano SEM 450 |
| Scotch Double Sided Tape, 3/4 x 300 inches | 3M | N/A | |
| Sonicator | Misonix | S-4000 | For preparation of lipids |
| Sonicator | Branson | 1800 | For sonicating slides |
| Streptavidin from Streptomyces avidinii | Sigma-Aldrich | S4762 | Dissolved in 1X PBS to a final concentration of 1 mg/mL |
| Sulfuric Acid | Avantor - J.T.Baker | 9681-01 | |
| Syringe Pump | KD Scientific | 78-0200 | |
| Syringe, 500 µL, Model 750 RN SYR, Large Removable NDL, 22 ga, 2 in, point style 2 | Hamilton | 80830 | Reserve for use only with lipids |
| T4 DNA Ligase (400,000 units/ml) | NEB | M0202S |
References
- Kowalczykowski, S. C. An Overview of the Molecular Mechanisms of Recombinational DNA Repair. Cold Spring Harbor Perspectives in Biology. 7, 016410(2015).
- Ferlay, J., et al. Estimating the global cancer incidence and mortality in 2018: globocan sources and methods. International Journal of Cancer. 144, 1941-1953 (2018).
- Li, X., Heyer, W. D. Homologous recombination in DNA repair and DNA damage tolerance. Cell Research. 18, 99-113 (2008).
- Michel, B., Baoubakri, H., Baharoglu, Z., LeMasson, M., Lestini, R. Recombination proteins and rescue of arrested replication forks. DNA Repair. 6, 967-980 (2007).
- Paques, F., Haber, J. E. Multiple pathways of recombination induced by double-strand breaks in Saccharomyces cerevisiae. Microbiology and Molecular Biology Reviews. 63, 349-404 (1999).
- Heyer, W. D., Ehmsen, K. T., Liu, J. Regulation of homologous recombination in eukaryotes. Annual Review of Genetics. 44, 113-139 (2010).
- Mason, J. M., et al. RAD54 family translocases counter genotoxic effects of RAD51 in human tumor cells. Nucleic Acids Research. 43, 3180-3196 (2015).
- Wold, M. S. Replication protein A: A heterotrimeric, single-stranded DNA-binding protein required for eukaryotic DNA metabolism. Annual Review of Biochemistry. 66, 61-92 (1997).
- Bianco, P. R. The tale of SSB. Progress in Biophysics and Molecular Biology. 127, 111-118 (2017).
- Hopfner, K. P., Gerhold, C. B., Lakomek, K., Wollmann, P. Swi2/Snf2 remodelers: hybrid views on hybrid molecular machines. Current Opinion in Structural Biology. 22, 225-233 (2012).
- Shah, P. P., et al. Swi2/Snf2-related translocases prevent accumulation of toxic Rad51 complexes during mitotic growth. Molecular Cell. 39, 862-872 (2010).
- Wright, W. D., Heyer, W. D. Rad54 functions as a heteroduplex DNA pump modulated by its DNA substrates and Rad51 during D loop formation. Molecular Cell. 53, 420-432 (2014).
- Ma, C. J., Steinfeld, J. B., Greene, E. C. Single-Stranded DNA Curtains for Studying Homologous Recombination. Methods in Enzymology. 582, 193-219 (2017).
- Qi, Z., et al. DNA sequence alignment by microhomology sampling during homologous recombination. Cell. 160, 856-869 (2015).
- Visnapuu, M. L., Greene, E. C. Single-molecule imaging of DNA curtains reveals intrinsic energy landscapes for nucleosome deposition. Nature Structural Molecular Biology. 16, 1056-1062 (2009).
- Kaniecki, K., De Tullio, L., Greene, E. C. A change of view: homologous recombination at single-molecule resolution. Nature Reviews Genetics. 19, 191-207 (2018).
- Redding, S., et al. Surveillance and Processing of Foreign DNA by the Escherichia coli CRISPR-Cas System. Cell. 163, 854-865 (2015).
- Lee, J. Y. Base triplet stepping by the Rad51/RecA family of recombinases. Science. 349, 977-981 (2015).
- Xue, C., et al. Regulatory control of Sgs1 and Dna2 during eukaryotic DNA end resection. Proceedings of the National Academy of Sciences USA. 116 (13), 6091-6100 (2019).
- Gallardo, I. F., Finkelstein, I. J. High-Throughput Universal DNA Curtain Arrays for Single-Molecule Fluorescence Imaging. Langmuir. 31 (37), 10310-10317 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved