Method Article
التصوير البصري المستند إلى الصمامات الثنائية الضوئية لتسجيل ديناميكيات الشبكة بدقة أحادية الخلايا العصبية في اللافقاريات غير المعدلة وراثيا
In This Article
Summary
يقدم هذا البروتوكول طريقة لتصوير النشاط السكاني للخلايا العصبية بدقة خلية واحدة في الأنواع غير اللافقارية غير المعدلة وراثيا باستخدام الأصباغ الحساسة لجهد الامتصاص ومجموعة الصمام الثنائي الضوئي. ويتيح هذا النهج سير عمل سريع، حيث يمكن متابعة التصوير والتحليل على مدار يوم واحد.
Abstract
تطوير الاستعدادات اللافقارية المعدلة وراثيا التي يمكن تسجيل نشاط مجموعات محددة من الخلايا العصبية والتلاعب بها مع الضوء يمثل تقدما ثوريا لدراسات الأساس العصبي للسلوك. ومع ذلك ، فإن الجانب السلبي لهذا التطور هو ميله إلى تركيز المحققين على عدد قليل جدا من الكائنات "المصممة" (مثل C. elegans و Drosophila)، مما قد يؤثر سلبا على متابعة الدراسات المقارنة عبر العديد من الأنواع ، وهو أمر ضروري لتحديد المبادئ العامة لوظيفة الشبكة. توضح هذه المقالة كيف يمكن استخدام التسجيل البصري مع الأصباغ الحساسة للجهد في أدمغة أنواع المعدة غير المعدلة وراثيا بسرعة (أي في غضون الوقت من التجارب الفردية) تكشف عن ملامح التنظيم الوظيفي لشبكاتها العصبية بدقة خلية واحدة. نحن الخطوط العريضة بالتفصيل تشريح, تلطيخ, وتسجيل الأساليب المستخدمة من قبل مختبرنا للحصول على آثار العمل المحتملة من عشرات إلى ~ 150 الخلايا العصبية خلال البرامج الحركية ذات الصلة سلوكيا في الجهاز العصبي المركزي من أنواع متعددة gastropod, بما في ذلك واحدة جديدة لعلم الأعصاب – وdyibranch بيرغيا stephanieae. يتم إجراء التصوير مع الأصباغ الحساسة للجهد امتصاص ومجموعة من 464 عنصرا الصمام الثنائي الضوئي أن عينات في 1600 لقطة / ثانية، وبسرعة كافية لالتقاط جميع إمكانات العمل التي تولدها الخلايا العصبية المسجلة. يمكن الحصول على تسجيلات متعددة لعدة دقائق لكل إعداد مع القليل من تبييض الإشارات أو السمية الضوئية. ويمكن تحليل البيانات البصرية الخام التي تم جمعها من خلال الأساليب الموصوفة في وقت لاحق من خلال مجموعة متنوعة من الأساليب المصورة. يمكن استخدام نهج التسجيل البصري لدينا بسهولة للتحقيق في نشاط الشبكة في مجموعة متنوعة من الأنواع غير المعدلة وراثيا ، مما يجعلها مناسبة تماما للدراسات المقارنة حول كيفية توليد الأدمغة للسلوك.
Introduction
وقد وفر تطوير خطوط اللافقاريات المعدلة وراثيا مثل دروسوفيلا وسي إليغانز أنظمة قوية يمكن فيها استجواب القواعد العصبية للسلوك والتلاعب بها بصريا. ومع ذلك، قد يكون لهذه الاستعدادات الخاصة الجانب السلبي للحد من الحماس لدراسات الدائرة العصبية للأنواع غير المعدلة وراثيا، لا سيما فيما يتعلق بإدخال أنواع جديدة في أبحاث علم الأعصاب. التركيز حصرا على واحد أو اثنين من النظم النموذجية يضر بالبحث عن المبادئ العامة لوظيفة الشبكة، لأن الدراسات المقارنة تمثل طريقا أساسيا يتم من خلاله اكتشاف هذه المبادئ1و2و3و4. هدفنا هنا هو إظهار نهج التصوير على نطاق واسع للحصول على نظرة سريعة في الهيكل الوظيفي للشبكات العصبية gastropod ، في محاولة لتسهيل الدراسات المقارنة لوظيفة الشبكة العصبية.
الرخويات Gastropod مثل Aplysia، Lymnaea، Tritonia، Pleurobranchaea وغيرها منذ فترة طويلة تستخدم للتحقيق في مبادئ وظيفة الشبكة العصبية، ويرجع ذلك إلى حد كبير إلى أن يتم التوسط في سلوكياتهم من قبل الخلايا العصبية الكبيرة، وغالبا ما يمكن التعرف عليها بشكل فردي تقع على سطح العقدة، مما يجعلها في متناول بسهولة لتسجيل تقنيات5. في 1970s، تم تطوير الأصباغ الحساسة للجهد (VSDs) التي يمكن أن تتكامل في غشاء البلازما التي سرعان ما مكنت التسجيلات الأولى خالية من القطب الكهربائي من إمكانات العمل التي ولدتها الخلايا العصبية متعددة6. هنا، ونحن نثبت استخدامنا VSDs لدراسة نشاط الشبكة في عدة أنواع من gastropods، بما في ذلك واحد جديد لعلم الأعصاب، بيرغيا stephanieae. جهاز التصوير هو مجموعة ثنائية ضوئية متاحة تجاريا من 464 عنصرا (PDA) التي عينات في 1600 لقطة / ثانية (الشكل 1)، والتي ، عند استخدامها مع VSDs امتصاص سريع ، ويكشف عن إمكانات العمل لجميع الخلايا العصبية المسجلة7. يتم عرض الإشارات المسجلة من قبل جميع الثنائيات مباشرة بعد الاستحواذ وفرضها على صورة للعصابة في برنامج اقتناء المساعد الشخصي الرقمي ، مما يجعل من الممكن التحقيق في الخلايا العصبية ذات الاهتمام مع أقطاب كهربائية حادة في نفس الإعداد8،9.
في بيانات المساعد الشخصي الرقمي الخام، العديد من الثنائيات تسجل بشكل زائد عن الحاجة الخلايا العصبية أكبر، والعديد منها يحتوي أيضا على إشارات مختلطة من الخلايا العصبية متعددة. نقطة تحول كان تطوير آلية ارتفاع الفرز طريقة باستخدام تحليل مكون مستقل لمعالجة بسرعة كل الخام 464 قناة PDA مجموعة البيانات في مجموعة جديدة من آثار, التي تظهر كل الخلايا العصبية المسجلة في تتبع منفصل يحتوي فقط على إمكانات عملها10,11.
في هذه المقالة نوضح الخطوات الأساسية التي ينطوي عليها الحصول على تسجيلات محتملة للعمل على نطاق واسع من الجهاز العصبي gastropod مع مجموعة الصمام الثنائي الضوئي وVSDs امتصاص سريع. وعلاوة على ذلك نحن نوضح الأساليب التحليلية التي يمكن استخدامها في تجميع ورسم خرائط الخلايا العصبية المسجلة بصريا فيما يتعلق بمجموعاتها الوظيفية ، وخصائص خصائص مستوى السكان التي غالبا ما تكون غير واضحة من خلال التفتيش البسيط لآثار إطلاقالنار 12،13.
Protocol
ملاحظة: ملخص سير العمل الموضح أدناه في الشكل 2.
1. تقليل الاهتزاز
- إذا كان ذلك ممكنا، تأكد من أن جهاز الحفر في الطابق الأرضي، واستخدم طاولة عزل قائمة على الربيع، مما يقلل من نطاق أوسع من ترددات الاهتزاز من طاولات الهواء.
- إذا كنت تستخدم جدولا يستند إلى الربيع، فتأكد من أنه عائم (يجب تعديله في كل مرة يضيف فيها أحدهم شيئا أو يأخذ شيئا من الطاولة).
- قلل من الضوضاء المستندة إلى الاهتزاز في غرفة التصوير قدر الإمكان، حتى في حالة إيقاف تدفق الهواء أثناء التصوير إذا لزم الأمر. تقليل أي اهتزاز ناجم عن اضطراب السوائل في أنظمة التشوه.
ملاحظة: يجب ألا يتحرك التحضير العصبي أثناء الامتلاك. تنتج الحركات من أي نوع تحولات من حواف التباين عبر الثنائيات ، مما يؤدي إلى إشارات artifactual. إذا كان الإجراء ينطوي على التحفيز أثناء الاستحواذ ، فيجب ألا يحفز حركة التحضير.
2. تشغيل اختبار الثقب لتمكين المحاذاة السليمة للصور العقدة مع بيانات المساعد الشخصي الرقمي
- ضع قطعة من رقائق الألومنيوم مع 3 ثقوب صغيرة مطعون في ذلك على شريحة المجهر. التقاط صورة للثقوب الثلاثة مع الكاميرا الرقمية التي شنت على منفذها الضوئي parfocal.
- باستخدام برنامج التصوير الذي يأتي مع المساعد الشخصي الرقمي ، والحصول على ملف قصير (على سبيل المثال ، 5 ق). في جزء من عملية الاستحواذ ، اضغط على الطاولة للحث على القطع الأثرية الاهتزازية التي ستكون مرئية جدا حول حواف الثقوب ، مما يسمح لمحاذاة صورة الثقوب بدقة مع البيانات البصرية.
- استخدام وظيفة التراكب في برنامج التصوير، وجدت في عنصر القائمة "عرض | فرض | الصفحة فرض آثار ث / صورة خارجية | صورة فرضية،" لتراكب بيانات الصمام الثنائي على صورة الثقوب ، ومن ثم ضبط إعدادات x و y والتكبير للصورة بشكل متكرر حتى تجلس الثقوب مباشرة فوق القطع الأثرية ذات الثقب في بيانات الصمام الثنائي.
- احفظ هذه الأرقام لمحاذاة صور التحضير التي تم التقاطها مع الكاميرا مع بيانات الصمام الثنائي في التجارب المستقبلية.
ملاحظة: محاذاة الثقب المساعد الشخصي الرقمي يحتاج فقط إلى أن يتم مرة واحدة بعد أن يتم تحميل المساعد الشخصي الرقمي على المجهر، حتى يتم تدويرها أو إزالتها، في الوقت الذي يجب أن يتم ذلك مرة أخرى.
- احفظ هذه الأرقام لمحاذاة صور التحضير التي تم التقاطها مع الكاميرا مع بيانات الصمام الثنائي في التجارب المستقبلية.
3. تشريح لثلاثة أنواع من المعدة البحرية
- بالنسبة للأنواع التي تنمو إلى حجم كبير ، مثل Tritonia و Aplysia، ابدأ بأفراد أصغر ، لديهم عصابة أرق وأقل غموضا ، مما يخفف من الحصول على ضوء كاف للإشارة إلى الضوضاء المثلى.
- يجب أن تستخدم مياه البحر الاصطناعية المصفاة الجاهزة كمحلول ملحي للتشريح وتجارب التصوير.
ملاحظة: في كافة الخطوات اللاحقة من البروتوكول، يشير "المالحة" إلى مياه البحر الاصطناعية. - تشريح تريتونيا ديوميديا
- ضع حيوانا في الثلاجة لمدة 20 دقيقة لتخديره.
- بالنسبة للحيوانات الكبيرة ، فضح الدماغ عن طريق عقد الحيوان في يد واحدة ، والسماح للرأس نهاية الستائر على السبابة لفضح "الرقبة". بالنسبة للحيوانات الصغيرة ، قم بتضمين الجانب الظهري في طبق تشريح مبطن بالشمع قبل تعريض الدماغ.
- باستخدام مقص تشريح، وجعل شق خط الوسط 3-4 سم على الجانب الظهري من الحيوان، فوق كتلة البوكال (التي يمكن أن يشعر من خلال جدار الجسم).
ملاحظة: الجزء المطلوب من الجهاز العصبي المركزي، الذي يتكون من العقدة المخية الثنائية والدواسة، برتقالي ومتميز في المظهر عن الأنسجة المحيطة؛ انها تقع مباشرة الخلفي إلى وحيد القرن وفوق كتلة buccal. - استئصال الجهاز العصبي المركزي عن طريق قطع تلك الأعصاب الداخلية جسم الحيوان باستخدام ملقط ومقص microdissection، والحفاظ على سليمة كل تلك الأعصاب التي تربط العقدة المركزية. اترك طولا طويلا من العصب الدواسات 3 (PdN3) ، أو أيهما سيتم تحفيز العصب.
- استخدم دبابيس minutien للصق الجهاز العصبي المركزي في الجزء السفلي من طبق مبطن بالأستومر مملوء بالملوحة لمزيد من التشريح. الحفاظ على درجة حرارة التحضير عند 11 درجة مئوية عن طريق تغلغل الطبق مع المالحة تسليمها مع التغذية المرتدة التي تسيطر عليها، في خط نظام التبريد بلتيير باستخدام مضخة التجبير.
- باستخدام ملقط ومقص microdissection، وإزالة بعناية طبقة التمسك فضفاضة من النسيج الضام من جميع أنحاء الجهاز العصبي المركزي. اترك الغمد الناعم ملتصقا عن كثب بالعصابة.
- لفترة وجيزة (~ 10 ق) تراجع ganglia في حل من 0.5٪ الغلوتارالدهيد في المالحة. ضع العقدة مرة أخرى في الطبق الملوح المبطن بالاستومر ، مما يسمح للمحلول الملحي بغسل الجلوتارالدهيد قبل البدء في تلطيخ VSD.
ملاحظة: سيساعد هذا الإصلاح الخفيف للأنسجة الضامة وعضلاتها الجوهرية على منع الحركة أثناء التصوير.
- تشريح Aplysia كاليفورنيكا
- تخدير 40 غرام تقريبا عن طريق حقن ~ 20 مل من 350 م م MgCl2 في الجسم من خلال سطح البطن (القدم).
- استخدم الدبابيس لوضع الجانب البطيني الحيواني في طبق تشريح مبطن بالشمع.
- باستخدام مقص تشريح، وجعل شق خط الوسط 2-3 سم على طول المدى الأمامي للقدم. دبوس أسفل اللوحات من القدم على جانبي الشق للكشف عن جزء من الجهاز العصبي المركزي والكتلة البوكال.
ملاحظة: الجزء المطلوب من الجهاز العصبي المركزي، وتتكون من العقدة الدماغية تنصهر، وapposed عن كثب، الجنبي الثنائية وعصابة دواسة، هو الأصفر والبرتقالي ومتميزة في المظهر من الأنسجة المحيطة بها؛ يجلس الظهرية والملصقات إلى كتلة العضلات البصيلة. - استخدام ملقط ومقص تشريح لتشريح بعناية بعيدا الكتلة buccal، والكشف عن العقدة الدماغية.
- استئصال الجهاز العصبي المركزي عن طريق قطع تلك الأعصاب الداخلية جسم الحيوان باستخدام ملقط ومقص microdissection، والحفاظ على سليمة كل تلك الأعصاب التي تربط العقدة المركزية. اترك طولا طويلا من العصب الدواسات 9 (PdN9) ، أو أيهما سيتم تحفيز العصب.
- استخدام دبابيس minutien لوضع الجهاز العصبي المركزي في طبق مبطنة الاستومر مملوءة المالحة. الحفاظ على درجة حرارة التحضير عند 15-16 درجة مئوية عن طريق تغلغل الطبق مع المالحة التي تمر عبر جهاز تبريد بلتيير.
- باستخدام ملقط ومقص microdissection، وإزالة الأنسجة الضامة المفرطة من الجهاز العصبي المركزي، وتشريح بعيدا جزء سطحي من غمد على العقدة أو العقدة ليتم تصويرها. كن حذرا خلال هذه العملية لعدم إحداث ثقب في غمد، مما سيؤدي إلى الخلايا العصبية تسرب من الداخل.
- لفترة وجيزة (~ 20 ق) تراجع ganglia في حل من 0.5٪ الغلوتارالدهيد في المالحة. ضع العقدة مرة أخرى في الطبق الملوح المبطن بالاستومر ، مما يسمح للمحلول الملحي بغسل الجلوتارالدهيد قبل البدء في تلطيخ VSD.
- تشريح بيرغيا ستيفاني
- ضع حيوانا في الثلاجة لمدة 20 دقيقة لتخديره.
- باستخدام طبق مبطن بالإلستومر مليء بالمحلول الملحي لدرجة حرارة الغرفة ، ضع دبابيس minutien في كل من الرأس والذيل.
- باستخدام مقص التشتيت الدقيق، قم بعمل شق ظهري من 5 إلى 7 مم سطحيا على الجهاز العصبي المركزي.
ملاحظة: العيون، البقع الداكنة التي تتواجد داخل الحيوان بجانب CNS، علامة مريح موقف الجزء اللازم CNS، الذي يتكون من العقدة cerebropleural تنصهر ثنائيا ودواسة ويجلس فوق كتلة buccal. - استئصال الجهاز العصبي المركزي عن طريق قطع تلك الأعصاب الداخلية جسم الحيوان باستخدام ملقط ومقص microdissection. اترك أي عصب يتم تحفيزه لفترة طويلة بما فيه الكفاية لقطب كهربائي للشفط.
4. وصمة عار إعداد مع صبغة حساسة للجهد
- إعداد حلول المخزون إما RH155 (المعروف أيضا باسم NK3041) أو RH482 (المعروف أيضا باسم NK3630 أو JPW1132).
- RH155: حل 5.4 ملغ من الصبغة الصلبة في 1 مل من 100٪ EtOH، pipetting 29 ميكرولتر في كل من أنابيب الطرد المركزي الدقيق 34. مع محتويات كل أنبوب يتعرض للهواء، والسماح لهم الجافة بين عشية وضحاها في الظلام. قم بوضع غطاء المغذيات الصلبة الناتجة من RH155 ، كل منها يحتوي على 0.15 ملغ ، في ثلاجة -20 درجة مئوية.
- RH482: حل 2 ملغ من الصبغة الصلبة في 100 ميكرولتر من DMSO، وتقسيم الحل إلى 20 aliquots من 5 ميكرولتر، كل منها يحتوي على 0.1 ملغ من RH482، وتخزينها في الثلاجة -20 درجة مئوية.
ملاحظة: لTritonia وAplysia، إما حمام التشوه أو الضغط التطبيق يمكن استخدامها لتحميل RH155 VSD في أغشية الخلايا العصبية في التحضير. تطبيق الضغط لديه ميزة تعريض مجرد العقدة التي يتم تصويرها إلى VSD.
- لتغلغل الحمام، إضافة 5 مل من المالحة إلى كل من اثنين من aliquots أعلاه من RH155 الصلبة ودوامة في الحل، وإنتاج حل مجتمعة من 10 مل تحتوي على 0.03 ملغم / مل RH155.
- Perfuse في الظلام (لتجنب photobleaching) لمدة 1 إلى 1.5 ساعة في 11 درجة مئوية لتريتونيا وعلى 16 درجة مئوية لAplysia. حافظ على درجة الحرارة عن طريق تمرير محلول التشوه من خلال نظام تبريد Peltier.
- لتطبيق الضغط، إضافة 500 ميكرولتر المالحة إلى واحد aliquot من RH155، ودوامة لإنتاج تركيز صبغة من 0.3 ملغم / مل.
- رسم حوالي 200 ميكرولتر من الحل في أنابيب البولي ايثيلين باستخدام microdispenser المحمولة، وضمان أن هناك تطابق جيد بين قطر الأنبوب وقطر العقدة لتكون ملطخة.
- استخدام micromanipulator لوضع بعناية نهاية الأنبوب على العقدة الهدف، وخفضه حتى يشكل ختم دافئ على العقدة. استخدام نوع من نظام التبريد المذكورة أعلاه للحفاظ على ganglia في درجة الحرارة المطلوبة.
- قم بتعتيم أضواء الغرفة لتجنب التعتيم الضوئي وتحويل مقبض قضيب الضغينة الصغير كل 5 دقائق لفرض المزيد من الصبغة على العقدة.
- تحقق في 30 دقيقة للتأكد من أن تلطيخ جيدة يحدث، ومن ثم الاستمرار في الوقت الإجمالي تلطيخ حوالي 1 ساعة.
- لتلطيخ في بيرغيا، إضافة 1 مل من المالحة إلى aliquot المجمدة من RH482 ، ودوامة لتذوب.
- نقل 200 ميكرولتر من هذا المحلول إلى أنبوب الطرد المركزي الدقيق التي تحتوي على 800 ميكرولتر من المالحة ودوامة في الحل، وإنتاج محلول تلطيخ النهائي من 0.02 ملغ/ مل RH482 في المالحة مع 0.1٪ DMSO.
- ضع الجهاز المركزي المركزي بأكمله في أنبوب الطرد الدقيق ، ولف الأنبوب في رقائق الألومنيوم لتجنب الbleaching ، ويصافح باليد كل 5-6 دقائق لمدة ساعة واحدة تقريبا. تخزين المتبقية 800 ميكرولتر من الحل الأول في الثلاجة، واستخدامها لمدة تصل إلى 3 أيام لتلطيخ الاستعدادات اللاحقة.
5. تسطيح إعداد وإعداد لتحفيز الأعصاب
ملاحظة: يجب تنفيذ الخطوات في هذا القسم تحت الإضاءة الحد الأدنى أو مع الضوء الأخضر لتقليل photobleaching.
- بعد تلطيخ، تزج الجهاز العصبي المركزي في المالحة داخل غرفة التصوير ومكان تحت المجهر تشريح.
- مكان قطعة من السيليكون (لTritonia أو Aplysia)أو النقط من هلام البترول (لBerghia) إلى اليسار واليمين من العقدة / ganglia أن تكون مصورة.
- اضغط على قطعة بحجم مناسب من الزجاج أو غطاء بلاستيكي أسفل على إعداد لتسطيح ذلك. اضغط بقوة ولكن ليس من الصعب جدا أن تلحق الضرر الخلايا العصبية.
ملاحظة: تسطيح سطح محدب من إعداد بهذه الطريقة سيجعل عددا أكبر من الخلايا العصبية parfocal، وبالتالي زيادة عدد الخلايا العصبية المسجلة، وسوف تساعد علاوة على ذلك لشل التحضير أثناء التصوير. - إذا كان تحفيز العصب للحصول على برنامج محرك وهمي، وإعداد قطب الشفط الذي تلميح الجبهة هو تقريبا واسعة مثل قطر العصب. إنجاز هذا عن طريق ذوبان بعناية جزء من أنابيب البولي ايثيلين PE-100 على لهب في حين سحب بلطف كلا طرفي الجزء أنابيب ومن ثم قطع تفتق الناتجة عند النقطة المطلوبة.
- رسم حجم صغير من المالحة من خلال نهاية مدبب من قطب شفط البولي ايثيلين، تليها نهاية العصب ليتم تحفيزها، عن طريق إرفاق طول سميكة الجدران، أنابيب البوليمر مرنة إلى الطرف الخلفي من القطب واستخدام شفط الفم لتطبيق الضغط السلبي.
- تأكد من أن المالحة في القطب تفتقر إلى الفقاعات التي يمكن أن توقف التوصيل الكهربائي.
6. إعداد وتحسين التصوير
- نقل الغرفة إلى جهاز التصوير. بدء التغلغل المالحة من خلال غرفة التسجيل ووضع مسبار درجة الحرارة بالقرب من إعداد. تعيين وحدة تحكم درجة الحرارة لدرجة الحرارة المطلوبة للأنواع التي يتم تصويرها (لTritonia، 11 درجة مئوية ، لAplysia، 15-16 درجة مئوية ، أو لBerghia، 26-27 درجة مئوية).
- ضع سلكا فضيا واحدا مكلورا أسفل قطب الشفط ، مع التأكد من أنه يتصل بالمحلول الملحي في القطب الكهربائي ، ووضع سلك Ag-AgCl الآخر (مسار العودة) في ملوحة الحمام ، بالقرب من قطب الشفط.
- خفض عدسة الغمر المياه في المالحة. أغلق الحجاب الحاجز الأساسي، ثم ارفع أو خفض المكثف تحت المرحلة واضبط التركيز حتى تصبح حواف الحجاب الحاجز في بؤرة تركيز حادة، مما يخلق إضاءة كوهلر.
- التركيز على المنطقة من التحضير ليتم تصويرها. التحيز مع التركيز على الخلايا العصبية الصغيرة على أكبر منها، والإشارات البصرية التي تنشأ في الخلايا العصبية أكبر هي أكثر عرضة من أصغر منها ليتم تسجيلها حتى لو كانت قليلا من التركيز.
- التقاط صورة للعصابة ليتم تصويرها مع الكاميرا الرقمية parfocal.
- مع لوحة التحكم كسب التبديل تعيين إلى 1x، تفقد شدة الضوء يستريح (RLI) في برنامج التصوير عن طريق النقر على زر "RLI"والتحقق من متوسط RLI من الثنائيات. ضبط مستوى الجهد المرسلة من محفز لإمدادات الطاقة مصباح LED ومواصلة التحقق من مستوى RLI متوسط حتى يكون في النطاق المطلوب (عادة حوالي 3-4 V).
ملاحظة: RLIs عالية، المقابلة لحوالي 3-4 V على المساعد الشخصي الرقمي، مرغوب فيه. وكلما ارتفع الضوء، كلما كانت نسبة الإشارة إلى الضوضاء للإشارات البصرية أفضل، ومع ذلك، يجب موازنة ذلك مع معدل أسرع من الbleaching الضوئية في RLIs أعلى. يتم تقليل هذا الخطر باستخدام العدسات عالية NA الهدف. العدسات الهدف الغمر المياه المستخدمة هي 10x/0.6 NA، 20x/0.95 NA، 40x/0.8 NA، و 40x/1.15 NA.
- تعيين لوحة التحكم كسب التبديل إلى 100x للتسجيل.
- إذا حفز العصب، تعيين الجهد المطلوب، والتردد، والمدة على محفز منفصل من تلك المستخدمة لضبط مستوى الضوء. تأكد من أن TTL المشغلة بين لوحة التحكم والمحفز تم تكوينها بشكل صحيح.
ملاحظة: عينة معلمات تحفيز الأعصاب في كل نوع هي على النحو التالي: Tritonia PdN3, 2 ق, 10 هرتز نبض القطار من 5 مللي ثانية, 10 نبضات V; أأليسيا PdN9، 2.5 ثانية، 20 هرتز نبض القطار من 5 مللي ثانية، 8 نبضات V؛ A الأعصاب دواسة بيرغيا، 2 ق، 10 هرتز نبض القطار من 5 مللي ثانية، 5 نبض V. - تحقق مرة أخرى من أن الينابيع أو طاولة الهواء عائمة.
7. التسجيل البصري
- قم بإيقاف تشغيل أضواء الغرفة أو تعتيمها، بما في ذلك أي إضاءة فلورية علوية.
- تعيين مدة الملف المطلوب، المسار، واسم الملف، ومن ثم انقر على"خذ البيانات"زر في برنامج التصوير للحصول على ملفات تصل إلى قدرة ذاكرة الوصول العشوائي الكمبيوتر المتاحة. البقاء لا يزال خلال التسجيل البصري، والاهتزازات الصغيرة يمكن أن أعرض التحف الكبيرة في بيانات التسجيل البصري.
ملاحظة: بالنسبة لعمليات الاستحواذ التي قد تتجاوز ذاكرة الوصول العشوائي المتاحة للكمبيوتر، يتوفر برنامج استحواذ C++ حسب الطلب من خلال الدكتور جيان يونغ وو من جامعة جورجتاون. - لعرض البيانات مباشرة بعد الحصول عليها، استخدم وظيفة التراكب في برنامج التصوير لفرض البيانات التي تم جمعها من قبل جميع الثنائيات 464 على صورة العقدة التي اتخذت في وقت سابق من إعداد7. انقر على أي من الثنائيات الممثلة في البرنامج لتوسيع ما سجلته على شاشة تتبع منفصلة.
- تحقيق المحاذاة الدقيقة للصمامات الثنائية فيما يتعلق بالإعداد عن طريق إدخال عوامل x و y والتكبير كما تم تحديدها مسبقا من خلال اختبار الثقب.
- لتحقيق أقصى قدر من العمل الرؤية المحتملة وتحسين العائد العصبي لارتفاع الفرزاللاحقة 14، فرض مرشح باتروورث bandpass مع 5 هرتز و 100 هرتز قطع (المتاحة في برامج التصوير) لإزالة كل من الضوضاء منخفضة وعالية التردد.
- لحفظ البيانات البصرية المصفاة كملف نصي لمزيد من التحليل في منصة الحوسبة العلمية ، حدد أولا مربع"مرشح TP"أسفل شاشة"الصفحة"في برنامج التصوير. ثم حدد "حفظ الصفحة ASCII" من علامة التبويب "الإخراج" ثم أدخل اسم الملف المطلوب في مربع الحوار الذي يظهر.
النتائج
تريتونيا
الجلد الاتصال مع المفترس نجم البحر يؤدي Tritonia diomedea 'sهروب السباحة ، التي تتكون من سلسلة إيقاعية من الثنيات الجسم كله أن يدفع بعيدا إلى بر الأمان (الشكل 3A). في الاستعدادات الدماغ معزولة, حافزا وجيزا لدواسة العصب 3 (PdN3) يثير برنامج محرك السباحة الإيقاعي (SMP) لهذا السلوك, الذي يمكن التعرف عليه بسهولة في التسجيلات البصرية من العقدة دواسة. يصور الشكل 3B تخطيط تجربة تصوير VSD مصممة لتسجيل نشاط إطلاق الخلايا العصبية على السطح الظهري لعصابة دواسة Tritonia اليسرى ، والتي تم وضع المساعد الشخصي الرقمي عليها ، كحافز ل PdN3 المقابل (يمين) يثير SMP. البيانات الخام وتصفيتها (bandpass بتروورث مرشح، 5 و 100 هرتز قطع) من 20 ثنائيات تسجيل النشاط قبل وأثناء وبعد التحفيز PdN3 تظهر في الأرقام 3C، D على التوالي. تم تسليم التحفيز العصبي 20 ق في ملف 2 دقيقة. مباشرة بعد اقتناء، يمكن عرض الإشارات التي تقاس جميع الثنائيات 464 من مجموعة التسجيل طبوغرافيا على صورة لإعداد في برنامج التصوير (الشكل 3E). عند هذه النقطة، تحتوي العديد من الآثار على مسامير مسجلة بشكل زائد عن الحاجة من نفس الخلايا العصبية، وبعض الآثار تحتوي على مسامير من أكثر من خلية عصبية واحدة. سبايك الفرز آثار الصمام الثنائي المصفاة مع ICA أسفرت عن 53 آثار الخلايا العصبية فريدة من نوعها، 30 منها تظهر في الشكل 3F. يمكن تقدير الحركية من طفرات الفردية في الشكل 3G، الذي يوسع مقتطفات من أربعة آثار من الشكل 3F (الصندوق الأحمر) ؛ تم التحقق من دقة خوارزمية ICA لفرز المسامير مسبقا باستخدام تسجيلات القطب الحادة المتزامنة ، والتي أظهرت أن جميع المسامير في الآثار المفرزة تتوافق مع طفرات مسجلة داخل الخلايا من الخلايا العصبية الفردية11،14.
أأليسيا
A حافز ذيل عكسي بقوة إلى Californica Aplysia يثير النمطية من جزأين استجابة الهروب الإيقاعي15. المرحلة الأولى من الاستجابة هي جالوب من عدة دورات من اندفاعات الرأس ويسحب الذيل التي تحرك الحيوان بسرعة إلى الأمام. ويتبع ذلك عادة فترة من الزحف ، والتي تنطوي على موجات متكررة من الانقباضات العضلية من الرأس إلى الذيل التي تدفع الحيوان إلى الأمام بسرعة أبطأ لعدة دقائق(الشكل 4A). لالتقاط هذه البرامج الحركية الهروب في التسجيلات البصرية، وكان المساعد الشخصي الرقمي تركز على السطح الظهري للعصابة دواسة الحق في إعداد الدماغ معزولة، ووضع قطب شفط على العصب دواسة الكونترلاتال (يسار) 9 (PdN9؛ الشكل 4ب). دقيقة واحدة في تسجيل بصري مستمر 20 دقيقة (الشكل 4C)، تم تحفيز PdN9 لانتزاع تسلسل برنامج الزحف الحركي. تم تعيين التوزيعات المكانية الغاوسية الاحتمالية للإشارات من جميع الخلايا العصبية المسجلة ال 81 على العقدة(الشكل 4D). كشف الحد من الأبعاد المطبقة على التسجيل الكامل أن مراحل جالوب (سماوي) والزحف (الأزرق الداكن) من برنامج الهروب احتلت مناطق متميزة وشكلت مسارات مختلفة ، حلزونية وحلقية تشبه ، على التوالي ، في الفضاء المكون الرئيسي(الشكل 4E).
وتبين ثلاثة أشرطة فيديو تستند إلى تسجيل Aplysia المبين في الشكل 4 أنواعا أخرى من التحليلات التي يمكن إجراؤها على مجموعات البيانات هذه. الفيديو 1 يحيي إطلاق جميع الخلايا العصبية المسجلة على مدى كامل مدة التسجيل. تميزت الفترة الأولية بعد التحفيز من برنامج محرك الهروب من قبل جالوب، الذي تميز النشاط في العقدة من قبل انفجار بالتناوب من مجموعات وظيفية مختلفة (فيديو 2). انتقل الركض في وقت لاحق إلى الزحف ، حيث ظل النشاط عبر مجموعات الخلايا العصبية تدريجيا بشكل عام ولكنه اتخذ مسارا دورانيا عكس عقارب الساعة في العقدة (فيديو 3). يتضمن الفيديوان الأخيران أيضا تجميعا توافقا في الآراء ، والذي يكشف عن إطلاق ومواقع الفرق الوظيفية المختلفة لممراحل الركض والزحف للاستجابة للهروب بشكل منفصل. لاحظ أن العديد من الخلايا العصبية المخصصة لنفس الكتلة في كل من مراحل الركض والزحف أظهرت القرب المادي من بعضها البعض في العقدة ، بما يتفق مع النتائج السابقة12.
بيرغيا
وaeolid nudibranch بيرغيا stephanieae (الشكل 5A) يمثل نظام نموذج جديد لعلم الأعصاب. يظهر إعداد التصوير لتجربة Berghia النموذجية في الشكل 5B. للحصول على نشاط الخلايا العصبية على نطاق واسع ، تم وضع قطب شفط على العصب الدواسة الأيسر الأبرز ، وتم تسليم حافز عصبي 30 s في تسجيل 2 دقيقة. كشفت آثار معالجة ICA عن نشاط عفوي وحافز في 55 خلية عصبية(الشكل 5C). كشف المجتمع عن طريق تجميع توافق الآراء حددت عشر فرق وظيفية متميزة، والتي يتم تصويرها في الشكل 5D في الرسم البياني للشبكة وفي الشكل 5E، الذي يعيد تنظيم الآثار المبينة في الشكل 5C على أساس مهام تجميعها. يتم فرض التوزيعات الغاوسية للإشارات من جميع الخلايا العصبية المسجلة على صورة للتحضير في الشكل 5F للإشارة إلى مواقف جميع الخلايا العصبية المسجلة 55.

الشكل 1: مناظر جهاز التصوير البصري ومجموعة الثنائي الضوئي (المساعد الشخصي الرقمي). (أ) جهاز التصوير البصري ، ويضم المساعد الشخصي الرقمي ، والكاميرا الرقمية ، والمجهر ، والمرحلة. (ب) التصميم الداخلي المساعد الشخصي الرقمي، حيث تربط الألياف البصرية فتحة التصوير ب 464 ثنائي ضوئي. يوجد صف من مكبرات الصوت فوق الثنائيات الضوئية. (ج)الوجه السداسي فتحة التصوير، التي تركز على المنطقة التي يتم تصويرها. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: رسم بياني يوضح سير العمل الأساسي في الحصول على التسجيلات البصرية. يتم تصوير الخطوات الأساسية في بروتوكول التصوير VSD ، من تشريح وتلطيخ من خلال تفاصيل التصوير ، في هذا المخطط الانسيابي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
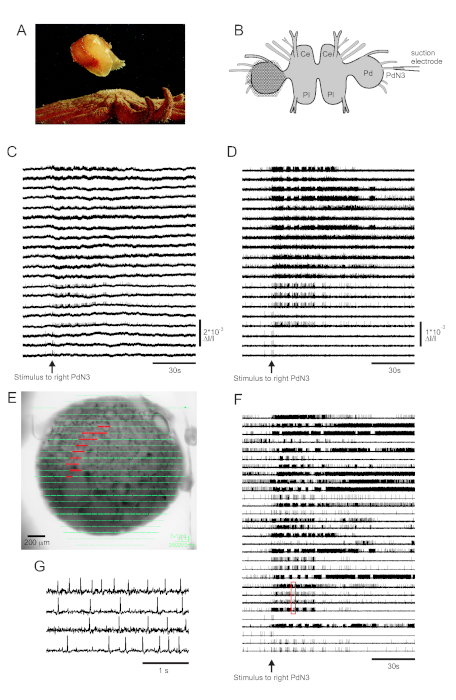
الشكل 3: نتائج من تريتونيا diomedea، مما يدل على الخام ، إد تصفية، وارتفاع فرزالبيانات. (أ) تريتونيا الهروب من نجم البحر المفترسة Pycnopodia helianthoides من خلال السباحة، والذي يتكون من المرن الظهري والبطيني بالتناوب من الجسم. (B) تخطيطي لإعداد التصوير. Ce = الفص الدماغي من العقدة الدماغية. Pl = الفص الجنبي للعصابة الدماغية. Pd = عصابة دواسة. (ج) البيانات الخام من 20 فوتودود، وعرض النشاط في العقدة دواسة اليسار لتحفيز PdN3 contralateral (التحفيز المشار إليها من قبل السهم). (D) البيانات المصفاة من نفس الثنائيات كما هو الحال في C (5 و 100 هرتز bandpass بتروورث مرشح). (E) إخراج برامج التصوير التي يتم فيها فرض الآثار المضغوطة التي تم جمعها بواسطة جميع الثنائيات ال 464 طوبوغرافيا على صورة للتحضير. يتم تمييز مواقع الثنائيات العشرين التي تظهر آثارها في C و D باللون الأحمر. (F) ثلاثون مختارة آثار الخلايا العصبية واحد التي تم إنشاؤها بواسطة ارتفاع الفرز عبر ICA. (G) عرض موسع لأربعة آثار أحادية الخلايا العصبية، المقابلة للصندوق الأحمر في F،يعرض إمكانات عملها في دقة زمنية أعلى. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
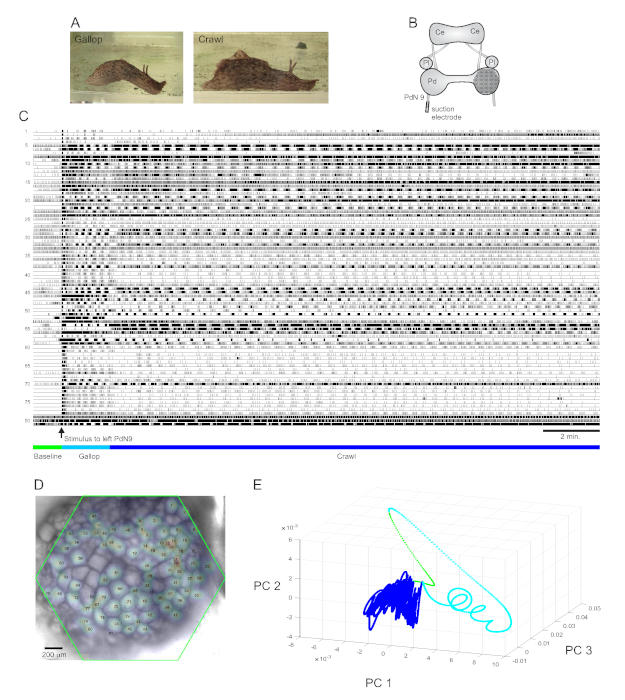
الشكل 4: نتائج من Aplysia californica, توضح تسجيل طويل الأمد, رسم خرائط إشارة, والحد من الأبعاد. (أ)المرحلتين من برنامج Aplysia الهروب المحرك متتابعة ، والركض والزحف. (B) تخطيطي لإعداد التصوير. Ce = العقدة الدماغية; Pl = العقدة الجنبية; Pd = عصابة دواسة. (ج) تسجيل 20 دقيقة من 81 الخلايا العصبية في العقدة دواسة الحق الاستجابة لتحفيز PdN9 contralateral (المشار إليها من قبل السهم). تشير القضبان الخضراء والسيانية والزرقاء الداكنة أسفل الآثار إلى فترة ما قبل التحفيز ، والركض ، ومراحل الزحف لبرنامج محرك الهروب ، على التوالي. (د) صورة لإعداد مع التوزيعات الغاوسية الاحتمالية المعينة لمواقع جميع مصادر إشارة الخلايا العصبية 81 التي حددتها ICA. يمثل المخطط الأخضر موضع الوجه السداسي ل المساعد الشخصي الرقمي فيما يتعلق بالعصابة. الأرقام على كل غاوسي تتوافق مع الأرقام النزرة في C. (ه) تخفيض الأبعاد باستخدام تحليل المكون الرئيسي رسم المكونات الرئيسية الثلاثة الأولى ضد بعضها البعض على مدى 20 دقيقة ملف. تظهر عهود خط الأساس والركض والزحف قبل التحفيز باللون الأخضر والسماوي والأزرق الداكن على التوالي. انظر أشرطة الفيديو 1-3 للرسوم المتحركة لاطلاق النار العصبية المقابلة لهذا التسجيل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
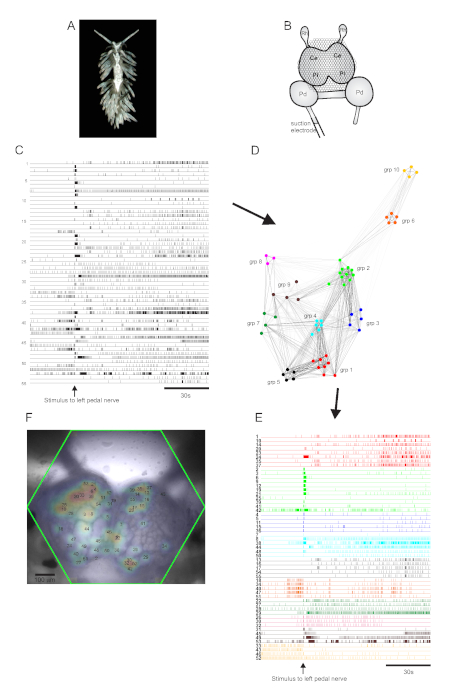
الشكل 5: نتائج من ستيفانيا بيرغيا، وهو نوع جديد لعلم الأعصاب ، مما يدل على الرسم البياني للشبكة ، والتكتلات الوظيفية، ورسم خرائط الإشارات الثنائية. (أ)عينة بيرغيا. (B) تخطيطي لإعداد التصوير. Ce = الفص الدماغي للغد العقدة الدماغية. Pl = الفص الجنبي للعصابة الدماغية. Pd = دواسة العقدة; Rh = العقدة وحيد القرن. (ج)آثار عرض النشاط العفوي والتحفيز أثار من 55 الخلايا العصبية الثنائية في العقدة الدماغية (يشار إلى تسليم التحفيز من قبل السهم). (د)رسم بياني للشبكة يعرض الفرق الوظيفية العشرة، كل منها معين بلون فريد، تم تحديده من خلال التجميع التوافقي. العقد في هذه المؤامرة تمثل الخلايا العصبية، حيث المسافة في مساحة الشبكة يمثل درجة من الارتباط اطلاق داخل وبين الفرق. (ه)يتم إعادة ترتيب آثار في C وترميزها بالألوان (بعد نظام الألوان من D)إلى مجموعات وظيفية. (F) صورة لإعداد تبين المواقع المرسومة للإشارات من كل الخلايا العصبية المسجلة، وأرقام التتبع في C و E التي تتوافق معها. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
فيديو 1: الرسوم المتحركة من كامل, 20 دقيقة Aplysia الهروب برنامج الحركة. كان الدافع وراء التعتيم من الأشكال البيضاء overlying 81 الخلايا العصبية الفردية في العقدة دواسة الحق (اللوحة اليسرى) من آثار الخلايا العصبية المقابلة (لوحة الحق) ومتنوعة خطيا كدالة لمعدل ارتفاع متوسط (binned لكل 0.61 ق من الوقت الحقيقي في التسجيل). لكل خلية عصبية، تم تطبيع التعتيم الكامل إلى معدل إطلاق النار الأقصى على مدى مدة التسجيل. تمثل ثانية واحدة من الوقت المنقضي في الفيديو 12.2 ثانية من الوقت الفعلي. يتوافق شريط المقياس مع الوقت الحقيقي ، مع الخطوط الزرقاء الخضراء والسيانية والداكنة أسفل الآثار التي تشير إلى مراحل خط الأساس قبل التحفيز ، والركض ، والزحف من برنامج الهروب الحركي ، على التوالي. المربعات الصفراء حول مرحلة الركض وجزء من مرحلة الزحف تشير إلى مقتطفات التسجيل المستخدمة لتوليد الرسوم المتحركة في الفيديو 2 و 3. الرجاء الضغط هنا لعرض هذا الفيديو. (انقر بزر الماوس الأيمن للتحميل.)
فيديو 2: الرسوم المتحركة للمرحلة جالوب من برنامج الهروب Aplysia الحركية. تم إجراء التجميع التوافقي على جميع الخلايا العصبية المسجلة 81 في مرحلة الركض فقط من برنامج المحرك لاشتقاق الفرق الوظيفية ، وذلك باستخدام النهج والبرمجيات الموصوفة والمتاحة في المرجع12. تم حذف الفرق العصبية التي تعرض أنماط إطلاق منشطة أو غير منتظمة إلى حد كبير خلال هذه المرحلة من برنامج الهروب من هذا الفيديو. يمكن سماع إمكانات عمل الخلايا العصبية التي تنتمي إلى الفرق السوداء والزيتونية الخضراء في المسار الصوتي للفيديو ، مع تسليط الضوء على الخلايا العصبية ولآثار المقابلة. تم تطبيع متوسط معدلات الارتفاع كما هو الحال في الفيديو 1 ومع ما يعادل الوقت binning; 1 ق من الوقت المنقضي في الفيديو يتوافق مع 6.1 ق من الوقت الحقيقي. الرجاء الضغط هنا لعرض هذا الفيديو. (انقر بزر الماوس الأيمن للتحميل.)
فيديو 3: الرسوم المتحركة للمرحلة الزحف من برنامج الهروب Aplysia الحركية. تم إجراء تجميع توافق الآراء على جميع الخلايا العصبية المسجلة 81 في مرحلة الزحف فقط من البرنامج الحركي لاشتقاق الفرق الوظيفية. تم حذف الفرق التي تعرض أنماط إطلاق منشطة أو غير منتظمة إلى حد كبير خلال هذه المرحلة من برنامج السيارات من هذا الفيديو. تم تطبيع متوسط معدلات الارتفاع كما هو الحال في الفيديو 1 و 2 ومع ما يعادل الوقت binning; 1 ق من الوقت المنقضي في الفيديو يتوافق مع ما يقرب من 12.2 ق من الوقت الحقيقي. الرجاء الضغط هنا لعرض هذا الفيديو. (انقر بزر الماوس الأيمن للتحميل.)
Discussion
واحدة من أهم التفاصيل في تنفيذ نهجنا التصوير VSD على نطاق واسع هو تقليل الاهتزاز، والتي تنتج حركات حواف التباين عبر الثنائيات، مما أدى إلى إشارات كبيرة artifactual. لأن VSDs امتصاص تنتج تغييرات نسبة مئوية صغيرة جدا في كثافة الضوء مع إمكانات العمل، والتحف الاهتزاز، إذا لم يتم منعها، يمكن أن تحجب إشارات الخلايا العصبية من الفائدة. نحن نستخدم عدة طرق لتقليل القطع الأثرية الاهتزاز. أولا، تقع غرفة التصوير في الطابق الأرضي، والتي تعزل الإعداد عن الاهتزازات المتعلقة ببناء معدات مناولة الهواء والعديد من المصادر الأخرى. ثانيا، تم استخدام جدول العزل القائم على الربيع، والتي أكد المستخدمين المساعد الشخصي الرقمي الأخرى يوفر أفضل المثبطة الاهتزاز من الجدول الهواء أكثر شيوعا16. ثالثا، استخدمت أهداف غمر المياه، التي تقضي على تقلبات الصور الناشئة عن التموجات السطحية. رابعا، تم الضغط بخفة على التحضير الذي يتم تصويره بين قاع غطاء الغرفة وجزء غطاء مضغوط من الأعلى يتم الاحتفاظ به في مكانه بواسطة مقابس السيليكون أو هلام البترول، مما يزيد من استقرار التحضير. هذا يسطح أيضا سطح محدب من العقدة أو العقدة التي يتم تصويرها، مما أدى إلى المزيد من الخلايا العصبية في الطائرة من التركيز على الهدف، مما يزيد من عدد الخلايا العصبية المسجلة.
لتحقيق أقصى قدر من نسبة الإشارة إلى الضوضاء للتغيرات الصغيرة جدا في درجة امتصاص ضوء VSD الناتجة عن إمكانات العمل ، من الضروري تحقيق ضوء شبه مشبع من خلال التحضير إلى المساعد الشخصي الرقمي ، وفي الوقت نفسه تقليل bleaching الضوئي للصبغة. وتحقيقا لهذه الغاية، ونحن نعمل عادة في 3-4 V من شدة الضوء يستريح، كما تقاس مع لوحة التحكم المساعد الشخصي الرقمي كسب التبديل في موقف 1x (مكبرات الصوت المساعد الشخصي الرقمي 464 تشبع في 10 V من الضوء). أثناء الحصول على البيانات يتم تغيير عامل الكسب هذا إلى 100x. الحصول على ضوء كاف للوصول إلى 3-4 V كما يقاس المساعد الشخصي الرقمي يمكن تحقيقه في عدة طرق. أولا، استخدم مصدر ضوء LED فائق المرونة الذي يوفر طول موجة مناسب لخصائص امتصاص صبغة الامتصاص المستخدمة. وبناء على ذلك، تم استخدام مصباح 135 نانومتر LED collimated، الذي يتداخل مع أطوال الموجات امتصاص الأمثل من RH155 وRH482. ثانيا، إذا لزم الأمر، استخدم مكثفا تحت المرحلة العلوية يركز الضوء من مصدر ضوء LED إلى منطقة أصغر. ثالثا، ضبط ارتفاع المكثف لتحقيق إضاءة كوهلر، مما يضمن سطوعا عاليا وجودة صورة فائقة. رابعا، تأكد من عدم وجود مرشحات حرارية في المسار البصري، والتي يمكن أن تضيء الطول الموجي لمصباح LED البالغ 735 نانومتر. خامسا، إزالة الناشرون، إذا كانت هناك حاجة إلى مزيد من الضوء، من المسار البصري. سادسا، استخدم أهداف NA العالية، التي توفر دقة مكانية عالية، وتسمح بمستويات كافية من الضوء للوصول إلى المساعد الشخصي الرقمي بكثافة مصباح أقل. وقد سمح لنا هذا لتقليل photobleaching إلى الحد الذي يمكننا الحصول على العديد من ملفات الاستحواذ من 10-20 دقيقة مدة كل إعداد باستخدام نفس كثافة الضوء عبر جميع الملفات ودون فقدان كبير من سعة إشارة أو الحاجة إلى إعادة تلطيخ. الأهم من ذلك، إذا كان المجرب يرغب في تتبع الخلايا العصبية عبر هذه الملفات أطول، وضمان أن الطائرة المحورية لا تتغير، وأن الإعداد لا يتحرك. وأخيرا ، فإن طريقة إضافية لتوجيه ضوء كاف إلى المساعد الشخصي الرقمي هو استخدام الحيوانات الأصغر سنا ، والتي لديها أرق ، وبالتالي أقل غموضا ganglia.
من وقت لآخر نجد أن نسبة الإشارة إلى الضوضاء للإشارات البصرية تتدهور و / أو إيقاعات البرنامج الحركي هي دون المستوى الأمثل (على سبيل المثال ، بطيئة أو غير طبيعية). عندما يبدأ هذا في الحدوث باستمرار، نخلط الحلول الجديدة ل VSD. Aliquots من VSD تبقى قابلة للحياة عادة لمدة 6 أشهر في الفريزر -20 درجة مئوية. ذات الصلة, تجدر الإشارة إلى أنه بالنسبة لبيرغيا, وقد تم الحصول على أفضل النتائج حتى الآن مع امتصاص VSD RH482. كما RH482 هو أكثر lipophilic من RH155، فإنه قد وصمة عار أفضل الخلايا العصبية أصغر نسبيا بيرغياأو البقاء في الأغشية العصبية بشكل أكثر فعالية في درجة حرارة ملحية تسجيل أعلى المستخدمة لهذا النوع الاستوائي.
أحد قيود التصوير القائم على المساعد الشخصي الرقمي للنشاط العصبي يتعلق باقتران التيار المتردد لإشارات الجهد في الأجهزة قبل خطوة التضخيم المسبق 100x: على الرغم من أن هذا يمثل ميزة ضرورية لإزالة إزاحة DC الكبيرة الناتجة عن مستوى الضوء العالي الذي تتطلبه هذه التقنية ، فإن اقتران AC الجوهري المساعد الشخصي الرقمي يحول دون قياس التغيرات البطيئة في إمكانات الأغشية ، مثل تلك المرتبطة المدخلات متشابك. إذا كان تسجيل التغييرات المحتملة بطيئة أو ثابتة الحالة المطلوبة، يمكن استخدام نظام التصوير كاميرا CMOS مقرونة DC لالتقاط النشاط تحت الحيازة. بيرن وزملاؤه تستخدم مؤخرا مثل هذا الإعداد مع RH155 لتصوير نشاط الخلايا العصبية في العقدة buccal من Aplysia17,18. لقد استخدمنا كلا النظامين ووجدنا أن كاميرا CMOS ، نظرا لكثافة أجهزة الكشف الأعلى بكثير (128 × 128) ، تولد ملفات بيانات أكبر 50x لنفس وقت التصوير7. تسهل الملفات الأصغر في المساعد الشخصي الرقمي المعالجة والتحليل بشكل أسرع. وهذا يتيح أيضا التسجيلات الموسعة لتجربة واحدة(الشكل 4)ودراسات التعلم ، حيث يتم ربط البيانات من تجارب متعددة في ملف واحد كبير قبل فرز الارتفاع ، مما يسمح بتتبع تنظيم الشبكة مع تطور التعلم19.
في تحقيقات أخرى تستند إلى الكاميرا ، تم استخدام VSDs الفلورية من قبل Kristan وزملاؤه لفحص وظيفة الشبكة في العقدة القطاعية لل. في دراسة مؤثرة واحدة أدى هذا إلى تحديد الخلايا العصبية المشاركة في قرار الحيوان للسباحة أو الزحف20. في دراسة أخرى، درس كريستان وآخرون مدى تحرك سلوكيات السباحة والزحف لل من قبل دوائر متعددة الوظائف مقابل مخصصة21. في الآونة الأخيرة ، استخدم Wagenaar وزملاؤه مجهرا على الوجهين لتصوير الجهد الذي يسمح لهم بتسجيل جميع الخلايا العصبية تقريبا في العقدة المجزأة22. على النقيض من العديد من أساليب التصوير القائمة على الكاميرا ، ميزة لدينا طريقة التصوير القائم على المساعد الشخصي الرقمي هو سريع وغير متحيزة ارتفاع الفرز من قبل ICA ، وهو شكل من أشكال فصل المصدر الأعمى الذي لا ينطوي على أي قرارات حول حدود الخلايا العصبية لمعالجة النتائج.
فيما يتعلق باختيار VSDs، ميزة واحدة من الأصباغ امتصاص RH155 وRH482 هو السمية الضوئية القليل إلى لا المرتبطة بها23،24،مما يتيح أوقات تسجيل أطول مما هو معتاد لVSDs الفلورسنت. وعلاوة على ذلك، فإن VSDs امتصاص سريع نستخدمها هي مناسبة تماما لتسجيل إمكانات العمل الجسدي تجاوز في الاستعدادات gastropod، والتي عادة ما تكون 80 mV في السعة. كما هو مبين في الشكل 3G، يمكن أن الأسلوب البصري لدينا تسجيل العمل المحتملة undershoots (أي من التسجيلات لدينا هي تتبع المتوسط) : وهذا يشير إلى أن VSDs نستخدم ينبغي أن تكون قادرة على تمييز إمكانات العمل في أنظمة النموذج الأخرى التي تتوهين إلى حد ما ، وبالتالي لا تتجاوز بحلول الوقت الذي تصل إلى سوما. ومع ذلك، قد لا يكون نهجنا البصري مثاليا للأنواع المعروفة بأنها تظهر إمكانات عمل مخففة للغاية عند تسجيلها في سوما.
وتركز الكثير من البحوث الحالية على الشبكات العصبية على عدد قليل من الأنواع المعدلة وراثيا مصمم. ومع ذلك، يستفيد علم الأعصاب من دراسة مجموعة واسعة من الأنواع المتميزة وراثيا. دراسة العديد من الأنواع المختلفة يوفر رؤى حول كيفية تطور الدوائر25،26، ويضيء مبادئ وظيفة الشبكة التي قد تكون شائعة عبر فيلا1،2،3،4،27. لقد طبقنا حتى الآن طريقة التصوير لدينا على عدد من أنواع المعدة، بما في ذلك Aplysia californica8،11،12،13،14،28، تريتونيا ديوميديا8،9،11،14،19،28، تريتونيا فيستيفا28، Pleurobranchaea californica (بيانات غير منشورة) ، ومؤخرا بيرغيا stephanieae (الشكل 5). ومن الجاذبية التي يوجهها هذا النهج أنه يمكن تطبيقه بسهولة على العديد من الأنواع، دون الحاجة إلى معدلة وراثيا. نود أن نعترف بأن استخدامنا للتصوير VSD مع أصباغ امتصاص سريعة وPDA يسير على خطى العمل الرائد الذي أنجز هذا في شبه سليمة ، والتصرف نافاناكس29 وAplysia30 الاستعدادات. تركيزنا على سرعة نهجنا هو في جزء منه ردا على المخاوف من أن العديد من المحققين قد تكون مترددة على نحو متزايد لبدء دراسات الشبكة في الأنواع الجديدة بسبب المخاوف من أن سنوات من الدراسة ستكون ضرورية لتوصيف تنظيم الشبكة الأساسية قبل أن تكون قادرة على استكشاف المسائل العلمية ذات أهمية واسعة لعلم الأعصاب31. وبناء على ذلك، فإن هدفنا هنا هو إظهار تقنية تسرع العملية بشكل كبير - لدرجة أنه يمكن الحصول على رؤى كبيرة في نفس اليوم في تنظيم الشبكة من الاستعدادات الفردية.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
وقد تم دعم هذا العمل من قبل 1257923 NSF والمعاهد القومية للصحة 1U01NS10837. ويرغب أصحاب البلاغ في الاعتراف بمساعدة جان وانغ في المختبر.
Materials
| Name | Company | Catalog Number | Comments |
| Achromat 0.9 NA swing condenser | Nikon | N/A | |
| Bipolar temperature controller | Warner Instruments | CL-100 with SC-20 | Controls perfusion saline temperature |
| Chamber thermometer | Physitemp | BAT-12 with IT-18 microprobe | |
| Digital camera | Optronics | S97808 | |
| Dissecting forceps | Dumont | #5 | |
| Dissecting scissors | American Diagnostic Corp. | ADC-3410Q | |
| Imaging microscope | Olympus | BX51WIF | |
| Imaging perfusion chamber | Siskiyou | PC-H | |
| Instant Ocean | Instant Ocean | SS6-25 | Makes 25 gallons at a time |
| Master-8 pulse stimulator | A.M.P.I. | Master-8 | |
| Microdispenser | Drummond Scientific | 3-000-752 | Dye applicator for pressure staining |
| Microdissection scissors | Moria | 15371-92 | |
| Minutien pins (0.1 mm) | Fine Science Tools | NC9677548 | For positioning and stabilizing CNS |
| Motorized microscope platform | Thorlabs | GHB-BX | Gibraltar platform |
| NeuroPlex imaging software | RedShirtImaging | NeuroPlex | Compatible with the WuTech photodiode array |
| Objective lenses | Olympus | XLPLN10XSVMP, XLUMPLFLN20XW, LUMPLFLN40XW, UAPON40XW340 | |
| PE-100 polyethylene tubing | VWR | 63018-726 | Tubing to make suction electrodes |
| Perfusion pump | Instech | P720 with DBS062SDBSU tube set | |
| Petroleum jelly | Equate | NDC 49035-038-54 | |
| Photodiode array with control panel | WuTech Instruments | 469-IV photodiode array | Contact jianwu2nd@gmail.com for ordering information |
| RH155 | Santa Cruz Biotechnology | sc-499432 | Voltage-sensitive dye |
| RH482 | Univ of Conn. Health Center | JPW-1132 | Voltage-sensitive dye; special order from Leslie Leow |
| Silicone earplugs | Mack's | Model 7 | To be use for preparation compression |
| Staining PE tubing | VWR | 63018-xxx | Different sizes depending on fit |
| Sylgard 184 silicone elastomer kit | Dow Corning | Sylgard 184 silicone elastomer kit | |
| Thorlabs LED and driver | Thorlabs | M735L2-C1, DC2100 | LED lamp and driver |
| Tygon tubing | Fisher Scientific | 14-171-xxx | |
| Vibration isolation table | Kinetic Systems | MK26 | Spring-based |
References
- Miller, C. T., Hale, M. E., Okano, H., Okabe, S., Mitra, P. Comparative Principles for Next-Generation Neuroscience. Frontiers in Behavioral Neuroscience. 13 (12), (2019).
- Brenowitz, E. A., Zakon, H. H. Emerging from the bottleneck: benefits of the comparative approach to modern neuroscience. Trends in Neuroscience. 38 (5), 273-278 (2015).
- Bolker, J. Model organisms: There's more to life than rats and flies. Nature. 491 (7422), 31-33 (2012).
- Carlson, B. A. Diversity matters: the importance of comparative studies and the potential for synergy between neuroscience and evolutionary biology. JAMA Neurology. 69 (8), 987-993 (2012).
- Chase, R. . Behavior and its neural control in gastropod molluscs. , (2002).
- Salzberg, B. M., Grinvald, A., Cohen, L. B., Davila, H. V., Ross, W. N. Optical recording of neuronal activity in an invertebrate central nervous system: simultaneous monitoring of several neurons. Journal of Neurophysiology. 40 (6), 1281-1291 (1977).
- Frost, W. N., et al. Monitoring Spiking Activity of Many Individual Neurons in Invertebrate Ganglia. Advances in Experimental Medicine and Biology. 859, 127-145 (2015).
- Frost, W. N., Wang, J., Brandon, C. J. A stereo-compound hybrid microscope for combined intracellular and optical recording of invertebrate neural network activity. Journal of Neuroscience Methods. 162 (1-2), 148-154 (2007).
- Frost, W. N., Wu, J. -. Y., Covey, E., Carter, M. Voltage-sensitive dye imaging. Basic Electrophysiological Methods. , 169-195 (2015).
- Brown, G. D., Yamada, S., Sejnowski, T. J. Independent component analysis at the neural cocktail party. Trends in Neuroscience. 24 (1), 54-63 (2001).
- Hill, E. S., Moore-Kochlacs, C., Vasireddi, S. K., Sejnowski, T. J., Frost, W. N. Validation of independent component analysis for rapid spike sorting of optical recording data. Journal of Neurophysiology. 104 (6), 3721-3731 (2010).
- Bruno, A. M., Frost, W. N., Humphries, M. D. Modular deconstruction reveals the dynamical and physical building blocks of a locomotion motor program. Neuron. 86 (1), 304-318 (2015).
- Bruno, A. M., Frost, W. N., Humphries, M. D. A spiral attractor network drives rhythmic locomotion. ELife. 6, 27342 (2017).
- Hill, E. S., Bruno, A. M., Vasireddi, S. K., Frost, W. N., Naik, G. R. ICA applied to VSD imaging of invertebrate neuronal networks. Independent Component Analysis for Audio and Biosignal Applications. , 235-246 (2012).
- Jahan-Parwar, B., Fredman, S. M. Neural control of locomotion in Aplysia: role of the central ganglia. Behavioral and Neural Biology. 27 (1), 39-58 (1979).
- Jin, W., Zhang, R. J., Wu, J. Y. Voltage-sensitive dye imaging of population neuronal activity in cortical tissue. Journal of Neuroscience Methods. 115 (1), 13-27 (2002).
- Neveu, C. L., et al. Unique Configurations of Compression and Truncation of Neuronal Activity Underlie l-DOPA-Induced Selection of Motor Patterns in Aplysia. eNeuro. 4 (5), 17 (2017).
- Cai, Z., Neveu, C. L., Baxter, D. A., Byrne, J. H., Aazhang, B. Inferring neuronal network functional connectivity with directed information. Journal of Neurophysiology. 118 (2), 1055-1069 (2017).
- Hill, E. S., Vasireddi, S. K., Wang, J., Bruno, A. M., Frost, W. N. Memory Formation in Tritonia via Recruitment of Variably Committed Neurons. Current Biology. 25 (22), 2879-2888 (2015).
- Briggman, K. L., Abarbanel, H. D., Kristan, W. B. Optical imaging of neuronal populations during decision-making. Science. 307 (5711), 896-901 (2005).
- Briggman, K. L., Kristan, W. B. Imaging dedicated and multifunctional neural circuits generating distinct behaviors. Journal of Neuroscience. 26 (42), 10925-10933 (2006).
- Tomina, Y., Wagenaar, D. A. A double-sided microscope to realize whole-ganglion imaging of membrane potential in the medicinal leech. ELife. 6, 29839 (2017).
- Chang, P. Y., Jackson, M. B. Interpretation and optimization of absorbance and fluorescence signals from voltage-sensitive dyes. Journal of Membrane Biology. 196 (2), 105-116 (2003).
- Parsons, T. D., Salzberg, B. M., Obaid, A. L., Raccuia-Behling, F., Kleinfeld, D. Long-term optical recording of patterns of electrical activity in ensembles of cultured Aplysia neurons. Journal of Neurophysiology. 66, 316-333 (1991).
- Katz, P. S. Evolution of central pattern generators and rhythmic behaviours. Transactions of the Royal Society of London, Series B. 371 (1685), 20150057 (2016).
- Moroz, L. L. Biodiversity Meets Neuroscience: From the Sequencing Ship (Ship-Seq) to Deciphering Parallel Evolution of Neural Systems in Omic's Era. Integrative and Comparative Biology. 55 (6), 1005-1017 (2015).
- Frost, W. N., Tian, L. -. M., Hoppe, T. A., Mongeluzi, D. L., Wang, J. A cellular mechanism for prepulse inhibition. Neuron. 40, 991-1001 (2003).
- Hill, E. S., Vasireddi, S. K., Bruno, A. M., Wang, J., Frost, W. N. Variable neuronal participation in stereotypic motor programs. PLoS One. 7 (7), 40579 (2012).
- London, J. A., Zecevic, D., Cohen, L. B. Simultaneous optical recording of activity from many neurons during feeding in Navanax. Journal of Neuroscience. 7 (3), 649-661 (1987).
- Wu, J., Cohen, L. B., Falk, C. X. Neuronal activity during different behaviors in Aplysia: A distributed organization. Science. 263 (5148), 820-823 (1994).
- Marder, E., North, G., Greenspan, R. J. Searching for insight. In Invertebrate Neurobiology. , 1-18 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved