Method Article
Photodiodenbasierte optische Bildgebung zur Aufzeichnung der Netzwerkdynamik mit Einzelneuronauflösung bei nicht-transgenen Wirbellosen
In diesem Artikel
Zusammenfassung
Dieses Protokoll stellt eine Methode zur Abbildung der neuronalen Populationsaktivität mit Einzelzellauflösung in nicht-transgenen wirbellosen Spezies unter Verwendung von absorptionsspannungsempfindlichen Farbstoffen und einem Photodiodenarray dar. Dieser Ansatz ermöglicht einen schnellen Workflow, bei dem Bildgebung und Analyse im Laufe eines einzigen Tages verfolgt werden können.
Zusammenfassung
Die Entwicklung transgener Wirbellosenpräparate, bei denen die Aktivität spezifizierbarer Neuronengruppen aufgezeichnet und mit Licht manipuliert werden kann, stellt einen revolutionären Fortschritt für die Untersuchung der neuronalen Grundlagen des Verhaltens dar. Ein Nachteil dieser Entwicklung ist jedoch ihre Tendenz, die Forscher auf eine sehr kleine Anzahl von "Designer" -Organismen (z. B. C. elegans und Drosophila)zu konzentrieren, was sich möglicherweise negativ auf die Verfolgung vergleichender Studien über viele Arten auswirkt, die für die Identifizierung allgemeiner Prinzipien der Netzwerkfunktion erforderlich sind. Der vorliegende Artikel zeigt, wie optische Aufzeichnungen mit spannungsempfindlichen Farbstoffen im Gehirn nicht-transgener Schneckenspezies genutzt werden können, um schnell (d.h. im Zeitverlauf einzelner Experimente) Merkmale der funktionellen Organisation ihrer neuronalen Netze mit Einzelzellauflösung aufzudecken. Wir beschreiben detailliert die Dissektions-, Färbe- und Aufzeichnungsmethoden, die von unserem Labor verwendet werden, um Aktionspotentialspuren von Dutzenden bis ~ 150 Neuronen während verhaltensrelevanter motorischer Programme im ZNS mehrerer Gastropodenarten zu erhalten, darunter eine neue in den Neurowissenschaften - die Nacktschnecke Berghia stephanieae. Die Bildgebung erfolgt mit absorptionsspannungsempfindlichen Farbstoffen und einem 464-Element-Photodiodenarray, das mit 1.600 Bildern / Sekunde abstimmt, schnell genug, um alle von den aufgezeichneten Neuronen erzeugten Aktionspotentiale zu erfassen. Pro Präparat können mehrere mehrminütige Aufnahmen mit wenig bis gar keiner Signalbleiche oder Phototoxizität erhalten werden. Die mit den beschriebenen Methoden gesammelten optischen Rohdaten können anschließend durch eine Vielzahl von illustrierten Methoden analysiert werden. Unser optischer Aufzeichnungsansatz kann leicht verwendet werden, um die Netzwerkaktivität in einer Vielzahl von nicht-transgenen Spezies zu untersuchen, was ihn gut für vergleichende Studien darüber eignet, wie Gehirne Verhalten erzeugen.
Einleitung
Die Entwicklung transgener Linien von Wirbellosen wie Drosophila und C. elegans hat leistungsfähige Systeme geschaffen, in denen die neuronalen Grundlagen des Verhaltens optisch abgefragt und manipuliert werden können. Diese speziellen Präparate können jedoch den Nachteil haben, dass die Begeisterung für neuronale Schaltkreisstudien an nicht-transgenen Spezies verringert wird, insbesondere im Hinblick auf die Einführung neuer Spezies in die neurowissenschaftliche Forschung. Die ausschließliche Fokussierung auf ein oder zwei Modellsysteme schadet der Suche nach allgemeinen Prinzipien der Netzwerkfunktion, da vergleichende Studien einen wesentlichen Weg darstellen, auf dem solche Prinzipien entdeckt werden1,2,3,4. Unser Ziel ist es, einen groß angelegten bildgebungstechnischen Ansatz zu demonstrieren, um einen schnellen Einblick in die funktionelle Struktur neuronaler Schneckennetze zu erhalten, um vergleichende Studien der neuronalen Netzwerkfunktion zu ermöglichen.
Schneckenmuscheln wie Aplysia, Lymnaea, Tritonia, Pleurobranchaea und andere werden seit langem verwendet, um Prinzipien der neuronalen Netzwerkfunktion zu untersuchen, zum großen Teil, weil ihr Verhalten durch große, oft individuell identifizierbare Neuronen auf der Oberfläche von Ganglien vermittelt wird, was sie für Aufzeichnungstechniken leicht zugänglich macht5. In den 1970er Jahren wurden spannungsempfindliche Farbstoffe (VSDs) entwickelt, die sich in die Plasmamembran integrieren lassen und bald die ersten elektrodenfreien Aufzeichnungen der von mehreren Neuronen erzeugten Aktionspotentiale ermöglichten6. Hier demonstrieren wir unsere Verwendung von VSDs zur Untersuchung der Netzwerkaktivität bei mehreren Arten von Schnecken, darunter eine neue in den Neurowissenschaften, Berghia stephanieae. Das bildgebungsgerät ist ein kommerziell erhältliches 464-Element-Photodiodenarray (PDA), das mit 1.600 Bildern/Sekunde abstimmt(Abbildung 1),das bei Verwendung mit schnell absorbierenden VSDs die Aktionspotentiale aller aufgezeichneten Neuronenaufdeckt 7. Die von allen Dioden aufgezeichneten Signale werden unmittelbar nach der Erfassung angezeigt und einem Bild des Ganglions in der PDA-Erfassungssoftware überlagert, so dass es möglich ist, neuronen von Interesse mit scharfen Elektroden in der gleichen Vorbereitung zu untersuchen8,9.
In den PDA-Rohdaten zeichnen viele Dioden redundant die größeren Neuronen auf, und viele enthalten auch gemischte Signale von mehreren Neuronen. Ein Wendepunkt war die Entwicklung einer automatisierten Spike-Sortiermethode mit unabhängiger Komponentenanalyse, um jeden rohen 464-Kanal-PDA-Datensatz schnell zu einem neuen Satz von Spuren zu verarbeiten, in dem jedes aufgezeichnete Neuron in einer separaten Spur erscheint, die nur seine Aktionspotentiale10,11enthält.
In diesem Artikel beschreiben wir die wesentlichen Schritte, um groß angelegte Aktionspotentialaufnahmen von Gastropoden-Nervensystemen mit einem Photodioden-Array und schnellen Absorptions-VSDs zu erhalten. Darüber hinaus veranschaulichen wir analytische Methoden, die zur Clusterung und Kartierung der optisch erfassten Neuronen hinsichtlich ihrer funktionellen Ensembles und zur Charakterisierung von Merkmalen auf Populationsebene eingesetzt werden können, die durch einfache Inspektion der Feuerspuren oft nicht erkennbar sind12,13.
Protokoll
HINWEIS: Der unten beschriebene Workflow ist in Abbildung 2zusammengefasst.
1. Vibrationen minimieren
- Wenn möglich, stellen Sie sicher, dass sich das Rig im Erdgeschoss befindet, und verwenden Sie einen federbasierten Isolationstisch, der einen breiteren Bereich von Vibrationsfrequenzen dämpft als Lufttische.
- Wenn Sie einen federbasierten Tisch verwenden, stellen Sie sicher, dass er schwebend ist (er muss jedes Mal angepasst werden, wenn man etwas hinzufügt oder vom Tisch nimmt).
- Reduzieren Sie vibrationsbasierte Geräusche im Bildgebungsraum so weit wie möglich, bei Bedarf sogar bis hin zur Abschaltung des Luftstroms während der Bildgebung. Minimieren Sie Vibrationen, die von Flüssigkeitsturbulenzen in Perfusionssystemen herrühren.
HINWEIS: Die neuronale Vorbereitung darf sich während der Erfassung nicht bewegen. Bewegungen jeglicher Art erzeugen Verschiebungen von Kontrastkanten über die Dioden, was zu künstlichen Signalen führt. Wenn das Verfahren während der Akquisition einen Reiz beinhaltet, darf es keine Vorbereitungsbewegung induzieren.
2. Führen Sie einen Lochtest durch, um die korrekte Ausrichtung von Ganglienfotos mit den PDA-Daten zu ermöglichen
- Legen Sie ein Stück Aluminiumfolie mit 3 kleinen Löchern auf einen Objektträger. Machen Sie ein Bild der drei Löcher mit der Digitalkamera, die auf ihrem parfokalen Photoport montiert ist.
- Erfassen Sie mit der Mithilfe der PDA gelieferten Imaging-Software eine kurze Datei (z. B. 5 s). Tippen Sie während der Aufnahme auf den Tisch, um Vibrationsartefakte zu induzieren, die an den Rändern der Pinholes gut sichtbar sind, so dass das Bild der Pinholes genau mit den optischen Daten ausgerichtet werden kann.
- Verwenden Sie die Überlagerungsfunktion in der Bildgebungssoftware, die Sie unter dem Menüpunkt "Anzeige | Seite überlagern | Überlagern Sie Spuren mit externen bild| Überlagern Sie Bild",um die Diodendaten auf das Foto der Pinholes zu überlagern und dann iterativ die x-, y- und Vergrößerungseinstellungen für das Foto anzupassen, bis die Pinholes direkt auf den Lochartefakten in den Diodendaten sitzen.
- Speichern Sie diese Zahlen, um die mit der Kamera aufgenommenen Vorbereitungsbilder in zukünftigen Experimenten mit den Diodendaten in Einklang zu bringen.
HINWEIS: Die Lochausrichtung des PDA muss nur einmal durchgeführt werden, nachdem der PDA auf dem Mikroskop montiert wurde, bis er gedreht oder entfernt wird, und muss erneut durchgeführt werden.
- Speichern Sie diese Zahlen, um die mit der Kamera aufgenommenen Vorbereitungsbilder in zukünftigen Experimenten mit den Diodendaten in Einklang zu bringen.
3. Dissektionen für drei Meeresschneckenarten
- Für Arten, die zu großer Größe werden, wie Tritonia und Aplysia,beginnen Sie mit kleineren Individuen, die dünnere, weniger undurchsichtige Ganglien haben, wodurch sie genügend Licht für ein optimales Signal-Rauschen erhalten.
- Haben Sie gefiltertes künstliches Meerwasser für die Dissektionen und Bildgebungsexperimente als Kochsalzlösung vorbereitet.
HINWEIS: In allen nachfolgenden Schritten des Protokolls bezeichnet "Kochsalzlösung" künstliches Meerwasser. - Dissektion von Tritonia diomedea
- Stellen Sie ein Tier für ca. 20 Minuten in den Kühlschrank, um es zu betäuben.
- Bei größeren Tieren entblößen Sie das Gehirn, indem Sie das Tier in einer Hand halten und das Kopfende über den Zeigefinger drapieren lassen, um den "Hals" freizulegen. Bei kleineren Tieren stecken Sie sie dorsal mit der Seite nach oben in eine mit Wachs ausgekleidete Sezierschale, bevor Sie das Gehirn freilegen.
- Machen Sie mit einer Dissektionsschere einen 3-4 cm großen Mittellinienschnitt auf der Rückenseite des Tieres, oberhalb der bukkalen Masse (die durch die Körperwand gefühlt werden kann).
HINWEIS: Der benötigte Teil des ZNS, bestehend aus verschmolzenen, bilateralen Zerebropleural- und Pedalganglien, ist orange und unterscheidet sich im Aussehen vom umgebenden Gewebe; es liegt unmittelbar hinter den Rhinophoren und auf der bukkalen Masse. - Schneiden Sie das ZNS ab, indem Sie diese Nerven durchtrennen, die den Körper des Tieres mit einer Zinnen- und Mikrodissektionsschere innervieren, wobei alle Nerven, die die zentralen Ganglien verbinden, intakt bleiben. Lassen Sie eine lange Länge des Pedalnervs 3 (PdN3) oder den Nerv, der stimuliert wird.
- Verwenden Sie Minutien-Stifte, um das ZNS am Boden einer mit Salz gefüllten elastomerausgekleideten Schüssel für die weitere Dissektion zu befestigen. Halten Sie die Zubereitungstemperatur bei 11 °C, indem Sie die Schüssel mit Kochsalzlösung aufschnappen, die mit einem rückkopplungsgesteuerten Inline-Peltier-Kühlsystem mit einer Peristaltikpumpe geliefert wird.
- Entfernen Sie mit einer Zette und einer Mikrodissektionsschere vorsichtig die locker anhaftende Schicht des Bindegewebes aus dem ZNS. Lassen Sie die feine Scheide eng an den Ganglien haften.
- Kurz (~10 s) die Ganglien in eine Lösung von 0,5% Glutaraldehyd in Kochsalzlösung tauchen. Legen Sie die Ganglien wieder in die mit Kochsalzlösung durchtränkte Elastomer-gefütterte Schale, damit Die Kochsalzlösung das Glutaraldehyd wegwaschen kann, bevor Sie mit der VSD-Färbung beginnen.
HINWEIS: Diese leichte Fixierung des Bindegewebes und seiner intrinsischen Muskeln hilft, Bewegungen während der Bildgebung zu verhindern.
- Dissektion von Aplysia californica
- Betäuben Sie ein ca. 40 g großes Tier, indem Sie ~20 ml 350 mM MgCl2 durch die ventrale Oberfläche (Fuß) in den Körper injizieren.
- Verwenden Sie Stifte, um die ventrale Seite des Tieres in einer mit Wachs ausgekleideten Sezierschale zu positionieren.
- Machen Sie mit einer Dissektionsschere einen 2-3 cm langen Mittellinienschnitt entlang der vordersten Ausdehnung des Fußes. Stecken Sie die Klappen des Fußes auf beiden Seiten des Schnitts fest, um einen Teil des ZNS und der bukkalen Masse freizulegen.
HINWEIS: Der benötigte Teil des ZNS, bestehend aus verschmolzenen Hirnganglien und eng verbundenen, bilateralen Pleura- und Pedalganglien, ist gelb-orange und unterscheidet sich im Aussehen vom umgebenden Gewebe; es sitzt dorsal und posterolateral zur bauchigen muskulären Wangenmasse. - Verwenden Sie eine Zette und eine Sezierschere, um die bukkale Masse vorsichtig zu sezieren und die Hirnganglien freizuentdecken.
- Schneiden Sie das ZNS ab, indem Sie diese Nerven durchtrennen, die den Körper des Tieres mit einer Zinnen- und Mikrodissektionsschere innervieren, wobei alle Nerven, die die zentralen Ganglien verbinden, intakt bleiben. Lassen Sie eine lange Länge des Pedalnervs 9 (PdN9) oder den Nerv, der stimuliert wird.
- Verwenden Sie Minutien-Stifte, um das ZNS in einer mit Kochsalzlösung gefüllten, mit Elastomeren ausgekleideten Schüssel zu positionieren. Halten Sie die Zubereitungstemperatur bei 15-16 °C, indem Sie die Schüssel mit Kochsalzlösung durch ein Peltier-Kühlgerät perfundieren.
- Entfernen Sie mit einer Zette und einer Mikrodissektionsschere übermäßiges Bindegewebe aus dem ZNS und sezieren Sie einen oberflächlichen Teil der Hülle auf dem Ganglion oder den Ganglien, die abgebildet werden sollen. Seien Sie während dieses Prozesses vorsichtig, um kein Loch in die Scheide zu machen, was dazu führen würde, dass Neuronen von innen herauslaufen.
- Kurz (~20 s) die Ganglien in eine Lösung von 0,5% Glutaraldehyd in Kochsalzlösung tauchen. Legen Sie die Ganglien wieder in die mit Kochsalzlösung durchtränkte Elastomer-gefütterte Schale, damit Die Kochsalzlösung das Glutaraldehyd wegwaschen kann, bevor Sie mit der VSD-Färbung beginnen.
- Sezieren von Berghia stephanieae
- Stellen Sie ein Tier für ca. 20 Minuten in den Kühlschrank, um es zu betäuben.
- Legen Sie mit einer mit Elastomer ausgekleideten Schüssel, die mit Kochsalzlösung bei Raumtemperatur gefüllt ist, Minutien-Stifte sowohl in den Kopf als auch in den Schwanz.
- Machen Sie mit einer Mikrodissektionsschere einen 5-7 mm rückenden Schnitt oberflächlich zum ZNS.
HINWEIS: Die Augen, dunkle Flecken, die sich im Tier neben dem ZNS befinden, markieren bequem die Position des benötigten Teils ZNS, der aus bilateral verschmolzenen Zerebropleural- und Pedalganglien besteht und auf der bukkalen Masse sitzt. - Schneiden Sie das ZNS ab, indem Sie diese Nerven durchtrennen, die den Körper des Tieres mit einer Zinnen- und Mikrodissektionsschere innervieren. Lassen Sie jeden stimulierten Nerv ausreichend lange für eine Saugelektrode.
4. Färben Sie das Präparat mit einem spannungsempfindlichen Farbstoff
- Bereiten Sie Stammlösungen von RH155 (auch bekannt als NK3041) oder RH482 (auch bekannt als NK3630 oder JPW1132) vor.
- RH155: 5,4 mg festen Farbstoff in 1 ml 100% EtOH auflösen und 29 μL in jeweils 34 Mikrozentrifugenröhrchen pipettieren. Wenn der Inhalt jedes Rohres der Luft ausgesetzt ist, lassen Sie sie über Nacht im Dunkeln trocknen. Die resultierenden festen Aliquoten von RH155, die jeweils 0,15 mg enthalten, werden in einen Gefrierfach mit -20 °C gegeben und in einen Gefrierschrank gegeben.
- RH482: 2 mg festen Farbstoff in 100 μL DMSO auflösen, die Lösung in 20 Aliquoten von 5 μL mit jeweils 0,1 mg RH482 aufteilen und in einem Gefrierfach mit -20 °C aufbewahren.
HINWEIS: Für Tritonie und Aplysiekann entweder Eine Badperfusion oder eine Druckanwendung verwendet werden, um den VSD RH155 in die Membranen der Neuronen in der Zubereitung zu laden. Die Druckanwendung hat den Vorteil, dass nur das abgebildete Ganglion dem VSD ausgesetzt wird.
- Für die Badperfusion 5 ml Kochsalzlösung zu jedem der beiden oben genannten Aliquoten von festem RH155 und Wirbel in Lösung geben, wodurch eine kombinierte Lösung von 10 ml mit 0,03 mg / ml RH155 erzeugt wird.
- Im Dunkeln (zur Vermeidung von Photobleaching) 1 bis 1,5 h bei 11 °C für Tritonia und bei 16 °C für Aplysia perperieren. Halten Sie die Temperatur aufrecht, indem Sie die Perfusionslösung durch ein Peltier-Kühlsystem geben.
- Für die Druckanwendung 500 μL Kochsalzlösung zu einem Aliquot RH155 und Wirbel hinzufügen, um eine Farbstoffkonzentration von 0,3 mg / ml zu erzeugen.
- Ziehen Sie etwa 200 μL der Lösung mit einem tragbaren Mikrodispenser in Polyethylenschläuche, um sicherzustellen, dass der Rohrdurchmesser und der Durchmesser des zu färbenden Ganglions gut übereinstimmen.
- Verwenden Sie einen Mikromanipulator, um das Ende des Röhrchens vorsichtig über das Zielganglion zu legen und es abzusenken, bis es eine eng anliegende Abdichtung am Ganglion bildet. Verwenden Sie die oben beschriebene Art des Kühlsystems, um die Ganglien auf der gewünschten Temperatur zu halten.
- Dimmen Sie die Raumbeleuchtung, um Photobleaching zu vermeiden, und drehen Sie den Mikrodispenser-Applikatorknopf alle 5 Minuten, um mehr Farbstoff auf das Ganglion zu zwingen.
- Überprüfen Sie nach 30 Minuten, ob eine gute Färbung auftritt, und fahren Sie dann für eine Gesamtfärbungszeit von etwa 1 h fort.
- Zur Färbung in Berghia1 ml Kochsalzlösung zu einem gefrorenen Aliquot von RH482 hinzufügen und wirbeln.
- 200 μL dieser Lösung werden in ein Mikrozentrifugenröhrchen mit 800 μL Kochsalzlösung und Wirbel in Lösung gegeben, wodurch eine endgültige Färbelösung von 0,02 mg/ml RH482 in Kochsalzlösung mit 0,1% DMSO erzeugt wird.
- Legen Sie das gesamte ZNS in das Mikrozentrifugenrohr, wickeln Sie das Röhrchen in Aluminiumfolie, um Photobleaching zu vermeiden, und schütteln Sie es alle 5-6 Minuten für ca. 1 h von Hand. Lagern Sie die restlichen 800 μL der ersten Lösung im Kühlschrank und verwenden Sie sie bis zu 3 Tage, um nachfolgende Präparate zu färben.
5. Präparat abflachen und für die Nervenstimulation einrichten
HINWEIS: Die Schritte in diesem Abschnitt sollten bei minimaler Beleuchtung oder mit grünem Licht durchgeführt werden, um das Photobleaching zu minimieren.
- Nach dem Färben tauchen Sie das ZNS in der Bildgebungskammer in Kochsalzlösung und legen Sie es unter ein Seziermikroskop.
- Legen Sie Silikonstücke (für Tritonia oder Aplysia)oder Vaselineklumpen (für Berghia)links und rechts des zu bildesden Ganglions/ Gangliens.
- Drücken Sie ein entsprechend großes Stück einer Glas- oder Kunststoffabdeckung auf die Zubereitung, um sie abzuflachen. Drücken Sie fest, aber nicht so stark, dass die Neuronen beschädigt werden.
HINWEIS: Wenn Sie die konvexe Oberfläche des Präparats auf diese Weise abflachen, wird eine größere Anzahl von Neuronen parfokal, wodurch die Anzahl der aufgezeichneten Neuronen erhöht wird, und hilft außerdem, das Präparat während der Bildgebung zu immobilisieren. - Wenn Sie einen Nerv stimulieren, um ein fiktives motorisches Programm hervorzubelocken, bereiten Sie eine Saugelektrode vor, deren vordere Spitze ungefähr so breit ist wie der Nervendurchmesser. Erreichen Sie dies, indem Sie ein Segment aus PE-100-Polyethylenrohren vorsichtig über einer Flamme schmelzen, während Sie vorsichtig an beiden Enden des Schlauchsegments ziehen und dann die resultierende Verjüngung an der gewünschten Stelle schneiden.
- Ziehen Sie ein kleines Volumen Kochsalzlösung durch das sich verjüngende Ende einer Polyethylen-Saugelektrode, gefolgt vom Ende des zu stimulierenden Nervs, indem Sie eine Länge dickwandiger, flexibler Polymerschläuche am hinteren Ende der Elektrode anbringen und Mundsaugung verwenden, um Unterdruck auszuüben.
- Vergewissern Sie sich, dass der Kochsalzlösung in der Elektrode Blasen fehlen, die die elektrische Leitung unterbrechen könnten.
6. Vorbereitung und Optimierung der Bildgebung
- Bewegen Sie die Kammer zum Bildgebungsgerät. Starten Sie die salzhaltige Perfusion durch die Aufnahmekammer und stellen Sie den Temperaturfühler in die Nähe des Präparats. Stellen Sie den Temperaturregler für die gewünschte Temperatur für die abgebildete Art ein (für Tritonia, 11 ° C, für Aplysia, 15-16 ° C oder für Berghia, 26-27 ° C).
- Legen Sie einen chloridierten Silberdraht auf die Saugelektrode, stellen Sie sicher, dass er die Kochsalzlösung in der Elektrode kontaktiert, und legen Sie den anderen Ag-AgCl-Draht (den Rückweg) in die Badsalzlösung in der Nähe der Saugelektrode.
- Senken Sie die Wasserimmersionslinse in die Kochsalzlösung. Schließen Sie die Grundmembran, heben oder senken Sie dann den Untergrundkondensator und stellen Sie den Fokus ein, bis die Kanten der Membran scharf fokussiert sind, wodurch eine Köhler-Beleuchtung entsteht.
- Konzentrieren Sie sich auf den Bereich der zu bildungsorientierten Zubereitung. Bias, die sich auf kleinere Neuronen gegenüber größeren konzentriert, da optische Signale, die von größeren Neuronen stammen, eher registriert werden als kleinere, auch wenn sie leicht unsauch sind.
- Machen Sie ein Bild des Ganglions, das mit der parfokalen Digitalkamera abgebildet werden soll.
- Wenn der Verstärkungsschalter des Bedienfelds auf 1x eingestellt ist, überprüfen Sie die Ruhelichtintensität (RLI) in der Bildgebungssoftware, indem Sie auf die Taste "RLI"klicken und das durchschnittliche RLI der Dioden überprüfen. Stellen Sie den Spannungspegel ein, der von einem Stimulator an das Netzteil der LED-Lampe gesendet wird, und überprüfen Sie den durchschnittlichen RLI-Pegel weiter, bis er im gewünschten Bereich liegt (normalerweise etwa 3-4 V).
HINWEIS: Hohe RLIs, die etwa 3-4 V auf dem PDA entsprechen, sind wünschenswert. Je höher das Licht, desto besser das Signal-Rausch-Verhältnis der optischen Signale, dies muss jedoch gegen eine schnellere Photobleaching-Rate bei höheren RLIs abgewogen werden. Dieses Risiko wird durch die Verwendung von Objektiven mit hohem NA minimiert. Die verwendeten Wasserimmersionsobjektive sind 10x/0,6 NA, 20x/0,95 NA, 40x/0,8 NA und 40x/1,15 NA.
- Stellen Sie den Verstärkungsschalter des Bedienfelds für die Aufnahme auf 100x ein.
- Wenn Sie einen Nerv stimulieren, stellen Sie die gewünschte Spannung, Frequenz und Dauer auf einem separaten Stimulator ein, der zum Einstellen des Lichtniveaus verwendet wird. Vergewissern Sie sich, dass die TTL-Auslösung zwischen Bedienfeld und Stimulator ordnungsgemäß konfiguriert ist.
HINWEIS: Die Proben-Nervenreizparameter in jeder Spezies sind wie folgt: Tritonia PdN3, 2 s, 10 Hz Pulszug von 5 ms, 10 V Impulse; Aplysia PdN9, 2,5 s, 20 Hz Impulszug von 5 ms, 8 V Impulse; ein Berghia-Pedalnerv, 2 s, 10 Hz Impulszug von 5 ms, 5 V Impulse. - Überprüfen Sie, ob die Feder oder der Lufttisch schwebt.
7. Optische Aufzeichnung
- Schalten Sie die Raumbeleuchtung aus oder dimmen Sie sie, einschließlich aller Leuchtstofflampen.
- Legen Sie die gewünschte Dateidauer, den Pfad und den Dateinamen fest und klicken Sie dann in der Imaging-Software auf die Schaltfläche "Daten aufnehmen", um Dateien bis zur Kapazität des verfügbaren Arbeitsspeichers des Computers zu erfassen. Bleiben Sie während der optischen Aufzeichnung still, da kleine Vibrationen große Artefakte in die optischen Aufzeichnungsdaten einbringen können.
HINWEIS: Für Akquisitionen, die den verfügbaren RAM des Computers übersteigen würden, ist ein maßgeschneidertes C ++ - Erfassungsprogramm über Dr. Jian-young Wu von der Georgetown University verfügbar. - Um Daten unmittelbar nach der Aufnahme anzuzeigen, verwenden Sie die Überlagerungsfunktion in der Bildgebungssoftware, um die von allen 464 Dioden gesammelten Daten über das Bild des Ganglions zu überlagern, das zuvor in der Zubereitung aufgenommen wurde7. Klicken Sie auf eine der in der Software dargestellten Dioden, um das, was sie auf einem separaten Trace-Bildschirm aufgezeichnet haben, zu erweitern.
- Erreichen Sie eine exakte Ausrichtung der Dioden in Bezug auf die Zubereitung, indem Sie die x-, y- und Vergrößerungsfaktoren eingeben, wie sie zuvor durch den Lochtest bestimmt wurden.
- Um die Sichtbarkeit des Aktionspotenzials zu maximieren und die Neuronenausbeute für die nachfolgende Spike-Sortierung14zu verbessern, legen Sie einen Bandpass-Butterworth-Filter mit 5 Hz- und 100-Hz-Cutoffs (verfügbar in Bildgebungssoftware) fest, um sowohl nieder- als auch hochfrequentes Rauschen zu entfernen.
- Um gefilterte optische Daten als Textdatei für die weitere Analyse in einer wissenschaftlichen Rechenplattform zu speichern, wählen Sie zunächst das Feld "TP-Filter" direkt unter dem Bildschirm "Seite" in der Bildgebungssoftware. Wählen Sie dann auf der Registerkarte "Ausgabe"Seite als ASCII speichern" und geben Sie den gewünschten Dateinamen in das angezeigte Dialogfeld ein.
Ergebnisse
Tritonia
Der Hautkontakt mit seinem Seesternraubtier löst tritonia diomedea's Fluchtschwimmen aus, das aus einer rhythmischen Reihe von Ganzkörperbeugungen besteht, die es in Sicherheit bringen (Abbildung 3A). In isolierten Hirnpräparaten löst ein kurzer Reiz zum Pedalnerv 3 (PdN3) das rhythmische Schwimmmotorikprogramm (SMP) für dieses Verhalten aus, das in optischen Aufnahmen von den Pedalganglien leicht erkennbar ist. Abbildung 3B zeigt das Layout eines VSD-Bildgebungsexperiments, das die Feueraktivität von Neuronen auf der dorsalen Oberfläche des linken Tritonia-Pedalganglions, über dem der PDA positioniert wurde, als Stimulus für das kontralaterale (rechte) PdN3 aufzeichnen soll, das den SMP hervorruft. Roh- und gefilterte Daten (Bandpass Butterworth-Filter, 5- und 100-Hz-Cutoffs) von 20 Dioden, die die Aktivität vor, während und nach der Stimulation von PdN3 aufzeichnen, sind in den Abbildungen 3C,D dargestellt. Der Nervenreiz wurde 20 s in die 2-minütige Datei geliefert. Unmittelbar nach der Erfassung können die von allen 464 Dioden des Aufzeichnungsarrays gemessenen Signale topographisch über ein Bild der Zubereitung in der Bildgebungssoftware dargestellt werden (Abbildung 3E). Zu diesem Zeitpunkt enthalten viele Spuren Spitzen, die redundant von denselben Neuronen aufgezeichnet wurden, und einige Spuren enthalten Spitzen von mehr als einem Neuron. Die Spike-Sortierung der gefilterten Diodenspuren mit ICA ergab 53 einzigartige neuronale Spuren, von denen 30 in Abbildung 3Fdargestellt sind. Die Kinetik einzelner Spikes kann in Abbildung 3Gnachvollzogen werden, die einen Auszug von vier Spuren aus Abbildung 3F (rotes Feld) erweitert; Die Genauigkeit des ICA-Spike-Sortieralgorithmus wurde zuvor durch simultane scharfe Elektrodenaufnahmen verifiziert, die zeigten, dass alle Spikes in den sortierten Spuren intrazellulär aufgezeichneten Spikes von einzelnen Neuronen entsprechen11,14.
Aplysia
Ein stark aversiver Schwanzreiz zu Aplysia californica löst eine stereotype zweiteilige rhythmische Fluchtreaktionaus 15. Die erste Phase der Reaktion ist ein Galopp aus mehreren Zyklen von Kopflungenschritten und Schwanzzügen, die das Tier schnell vorwärts bewegen. Darauf folgt typischerweise eine Krabbelphase, bei der wiederholte Wellen von Kopf-an-Schwanz-Muskelkontraktionen das Tier mehrere Minuten lang mit langsamerer Geschwindigkeit vorwärts treiben(Abbildung 4A). Um diese fluchtmotorischen Programme in optischen Aufnahmen zu erfassen, wurde der PDA in einem isolierten Gehirnpräparat auf die dorsale Oberfläche des rechten Pedalganglions konzentriert und eine Saugelektrode auf den kontralateralen (linken) Pedalnerv 9 (PdN9; Abbildung 4B). Eine Minute nach einer kontinuierlichen 20-minütigen optischen Aufzeichnung(Abbildung 4C)wurde PdN9 stimuliert, um den Galopp-Crawl-Motor-Programmablauf auszunehmen. Die probabilistischen Gaußschen Raumverteilungen der Signale aller 81 aufgezeichneten Neuronen wurden auf das Ganglion abgebildet (Abbildung 4D). Die auf die vollständige Aufzeichnung angewendete Dimensionalitätsreduktion zeigte, dass die Galopp- (Cyan) und Kriechphasen (dunkelblau) des Fluchtprogramms unterschiedliche Bereiche besetzten und unterschiedliche Trajektorien bildeten, spiral- bzw. schleifenartig im Hauptkomponentenraum (Abbildung 4E).
Drei Videos, die auf der in Abbildung 4 dargestellten Aplysia-Aufzeichnung basieren, zeigen weitere Arten von Analysen, die an solchen Datensätzen durchgeführt werden können. Video 1 animiert das Abfeuern aller aufgezeichneten Neuronen über die gesamte Dauer der Aufnahme. Die anfängliche poststimulatorische Phase des Fluchtmotorprogramms war durch einen Galopp gekennzeichnet, bei dem die Aktivität im Ganglion durch abwechselndes Platzen verschiedener funktioneller Cluster gekennzeichnet war (Video 2). Der Galopp ging anschließend in ein Krabbeln über, bei dem die Aktivität über neuronale Cluster weitgehend phasisch blieb, aber eine Rotationsbahn gegen den Uhrzeigersinn im Ganglion annahm (Video 3). Die letzten beiden Videos beinhalten auch Konsens-Clustering, das die Feuerung und Standorte der verschiedenen funktionalen Ensembles für die Galopp- und Crawl-Phasen der Fluchtreaktion separat zeigt. Beachten Sie, dass viele Neuronen, die sowohl in der Galopp- als auch in der Kriechphase demselben Cluster zugeordnet waren, im Ganglion physische Nähe zueinander aufwiesen, was mit früheren Befunden übereinstimmt12.
Berghia
Die aeolide Nacktschnecke Berghia stephanieae (Abbildung 5A) stellt ein neues Modellsystem für die Neurowissenschaften dar. Der Bildaufbau für ein typisches Berghia-Experiment ist in Abbildung 5B dargestellt. Um eine breit angelegte neuronale Aktivität hervorzulocken, wurde eine Saugelektrode auf den prominentesten linken Pedalnerv gelegt und ein Nervenreiz wurde 30 s in eine 2-minütige Aufnahme abgegeben. ICA-verarbeitete Spuren zeigten sowohl spontane als auch stimulus-evozierte Aktivität in 55 Neuronen (Abbildung 5C). Bei der Community-Erkennung mittels Konsens-Clustering wurden zehn verschiedene funktionale Ensembles identifiziert, die in Abbildung 5D in einem Netzwerkdiagramm und in Abbildung 5Edargestellt sind, die die in Abbildung 5C gezeigten Ablaufverfolgungen basierend auf ihren Clusterzuweisungen neu organisiert. Gaußsche Verteilungen der Signale aller aufgezeichneten Neuronen werden einem Bild des Präparats in Abbildung 5F überlagert, um die Positionen aller 55 aufgezeichneten Neuronen anzuzeigen.

Abbildung 1: Ansichten des optischen Bildgebungsgeräts und des Photodiodenarrays (PDA). (A) Das optische Bildgebungsgerät mit PDA, Digitalkamera, Mikroskop und Bühne. (B) Das interne Design des PDA, bei dem Glasfasern die Abbildungsöffnung mit 464 Photodioden verbinden. Über den Fotodioden befindet sich eine Reihe von Verstärkern. (C) Die sechseckige Fläche der Abbildungsöffnung, auf die der abgebildete Bereich fokussiert ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Ein Flussdiagramm, das den wesentlichen Arbeitsablauf bei der Gewinnung optischer Aufzeichnungen veranschaulicht. Die wesentlichen Schritte im VSD-Bildgebungsprotokoll, von der Dissektion und Färbung bis hin zu den Details der Bildgebung, sind in diesem Flussdiagramm dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
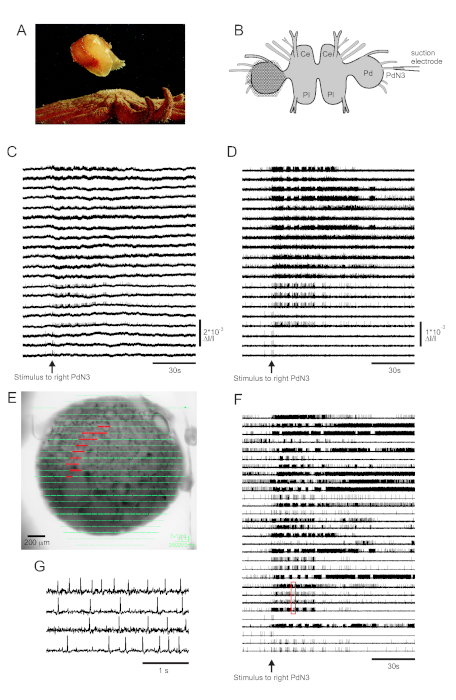
Abbildung 3: Ergebnisse von Tritonia diomedea, die Roh-, Filter-und Spike-sortierte Daten veranschaulichen. (A) Tritonia entkommt dem räuberischen Seestern Pycnopodia helianthoides durch sein Schwimmen, das aus abwechselnden dorsalen und ventralen Beugungen des Körpers besteht. (B) Schematische Darstellung des Imaging-Setups. Ce = Hirnlappen des Zerebropleuralganglions; Pl = Pleuralappen des Zerebropleuralganglions; Pd = Pedalganglion. (C) Rohdaten von 20 Photodioden, die die Aktivität im linken Pedalganglion zur Stimulation des kontralateralen PdN3 anzeigen (Reiz, der durch den Pfeil angezeigt wird). (D) Gefilterte Daten von den gleichen Dioden wie in C (5- und 100-Hz-Bandpass Butterworth-Filter). (E) Ausgabe einer Bildgebungssoftware, bei der komprimierte Spuren, die von allen 464 Dioden gesammelt wurden, topographisch über ein Bild der Zubereitung gelegt werden. Die Positionen der 20 Dioden, deren Spuren in C und D dargestellt sind, sind rot hervorgehoben. (F) Dreißig ausgewählte Einzelneuronspuren, die durch Spike-Sortierung über ICA erzeugt werden. (G) Eine erweiterte Ansicht von vier Einzelneuronspuren, die dem roten Kasten in Fentsprechen, zeigt ihre Aktionspotentiale bei höherer zeitlicher Auflösung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
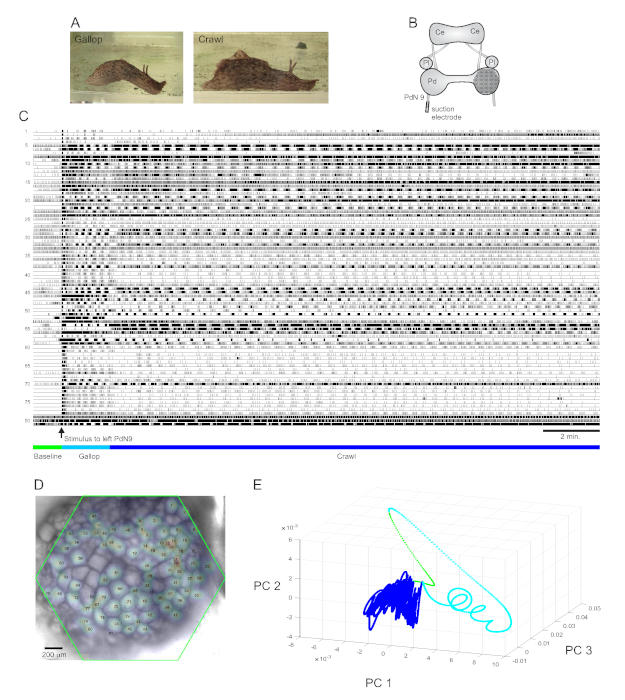
Abbildung 4: Ergebnisse von Aplysia californica, die Langzeitaufzeichnung, Signalkartierung und Dimensionalitätsreduktion veranschaulichen. (A) Die beiden Phasen des sequenziellen Fluchtmotorprogramms von Aplysia, der Galopp und der Krabbeln. (B) Schematische Darstellung des Imaging-Setups. Ce = hirnes Ganglion; Pl = Pleuraganglion; Pd = Pedalganglion. (C) Eine 20-minütige Aufnahme von 81 Neuronen im rechten Pedalganglion, die auf einen Reiz auf das kontralaterale PdN9 reagieren (durch den Pfeil gekennzeichnet). Grüne, cyanfarbene und dunkelblaue Balken unterhalb der Spuren zeigen die Vorstimulationszeit, den Galopp und die Kriechphasen des Fluchtmotorprogramms an. (D) Ein Bild der Zubereitung mit kartierten probabilistischen Gaußschen Verteilungen der Standorte aller 81 neuronalen Signalquellen, die von ICA identifiziert wurden. Der grüne Umriss stellt die Position der sechseckigen Fläche des PDA in Bezug auf das Ganglion dar. Die Zahlen auf jedem Gaußschen entsprechen den Spurennummern in C. (E) Dimensionsreduktion durch Hauptkomponentenanalyse, bei der die ersten drei Hauptkomponenten im Laufe der 20-minütigen Datei gegeneinander dargestellt werden. Die prästimulatorischen Baseline-, Galopp- und Crawl-Epochen sind in Grün, Cyan und Dunkelblau dargestellt. Siehe Videos 1-3 für Animationen des neuronalen Feuerns, die dieser Aufnahme entsprechen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
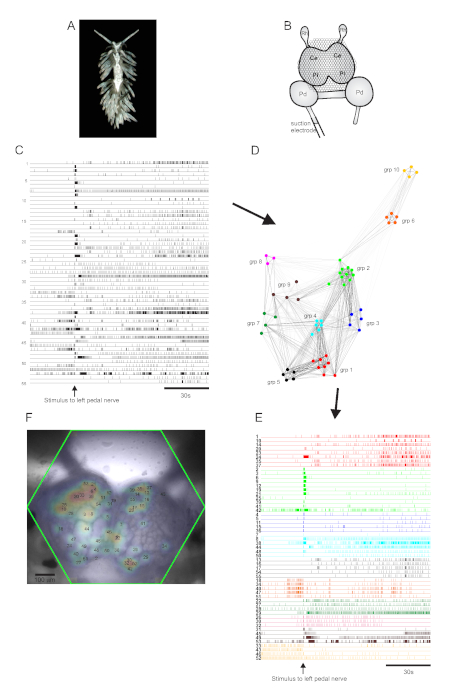
Abbildung 5: Ergebnisse von Berghia stephanieae, einer neuen Spezies für die Neurowissenschaften, die Netzwerkgraphik, funktionelles Clusteringund bilaterale Signalkartierungveranschaulicht. (A) Ein Berghia-Exemplar. (B) Schematische Darstellung des Imaging-Setups. Ce = Hirnlappen des Zerebropleuralganglions; Pl = Pleuralappen des Zerebropleuralganglions; Pd = Pedalganglion; Rh = Rhinophore Ganglion. (C) Spuren, die die spontane und stimulus-evozierte Aktivität von 55 bilateralen Neuronen in den zerebropleuralen Ganglien zeigen (die Abgabe des Reizes wird durch den Pfeil angezeigt). (D) Ein Netzwerkdiagramm, das die zehn funktionalen Ensembles zeigt, denen jeweils eine eindeutige Farbe zugewiesen ist, die durch Konsens-Clustering identifiziert wurden. Knoten in diesem Diagramm stellen Neuronen dar, wobei die Entfernung im Netzwerkraum den Grad der Feuerkorrelation innerhalb und zwischen Ensembles darstellt. (E) Die Spuren in C werden neu angeordnet und farbcodiert (nach dem Farbschema von D)zu funktionalen Ensembles. (F) Ein Bild der Zubereitung, das die kartierten Positionen der Signale von jedem aufgezeichneten Neuron und die Spurennummern in C und E zeigt, denen sie entsprechen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Video 1: Animation des vollständigen, 20-minütigen Aplysia Flucht-Bewegungsprogramms. Die Opazität der weißen Formen über 81 einzelnen Neuronen im rechten Pedalganglion (linkes Panel) wurde durch die entsprechenden neuronalen Spuren (rechtes Panel) gesteuert und variierte linear in Abhängigkeit von der durchschnittlichen Spike-Rate (binned pro 0,61 s Echtzeit in der Aufnahme). Für jedes Neuron wurde die volle Opazität über die Dauer der Aufnahme auf seine maximale Feuerrate normalisiert. Eine Sekunde der verstrichenen Zeit im Video entspricht 12,2 s Echtzeit. Der Maßstabsbalken entspricht der Echtzeit, wobei die grünen, cyanfarbenen und dunkelblauen Linien unter den Spuren die Phasen vor dem Stimulus, den Galopp und die Kriechphasen des Fluchtlokomotorprogramms anzeigen. Die gelben Kästchen um die Galoppphase und ein Teil der Crawling-Phase zeigen die Aufnahmeausschnitte an, mit denen die Animationen in den Videos 2 und 3generiert wurden. Bitte klicken Sie hier, um dieses Video anzusehen. (Klicken Sie mit der rechten Maustaste zum Herunterladen.)
Video 2: Animation der Galoppphase des Aplysia Escape Bewegungsprogramms. Konsens-Clustering wurde an allen 81 aufgezeichneten Neuronen allein in der Galoppphase des motorischen Programms durchgeführt, um die funktionellen Ensembles abzuleiten, wobei der Ansatz und die Software verwendet wurden, die in Referenz12beschrieben und zur Verfügung gestellt wurden. Neuronale Ensembles, die in dieser Phase des Fluchtprogramms weitgehend tonische oder unregelmäßige Feuermuster aufwiesen, wurden in diesem Video weggelassen. Die Aktionspotentiale der Neuronen, die zu den schwarzen und olivgrünen Ensembles gehören, sind in der Audiospur des Videos zu hören, wobei die entsprechenden Neuronen und Spuren hervorgehoben werden. Die durchschnittlichen Spitzenraten wurden wie in Video 1 und mit äquivalentem Zeitbinning normalisiert; 1 s verstrichene Zeit im Video entspricht 6,1 s Echtzeit. Bitte klicken Sie hier, um dieses Video anzusehen. (Klicken Sie mit der rechten Maustaste zum Herunterladen.)
Video 3: Animation der Kriechphase des Aplysia Fluchtmotorprogramms. Konsens-Clustering wurde an allen 81 aufgezeichneten Neuronen nur in der Crawl-Phase des motorischen Programms durchgeführt, um die funktionellen Ensembles abzuleiten. Ensembles, die in dieser Phase des Motorprogramms weitgehend tonische oder unregelmäßige Zündmuster aufwiesen, wurden in diesem Video weggelassen. Die durchschnittlichen Spitzenraten wurden wie in den Videos 1 und 2 und mit äquivalentem Zeitbinning normalisiert; 1 s verstrichene Zeit im Video entspricht ca. 12,2 s Echtzeit. Bitte klicken Sie hier, um dieses Video anzusehen. (Klicken Sie mit der rechten Maustaste zum Herunterladen.)
Diskussion
Eines der wichtigsten Details bei der Implementierung unseres groß angelegten VSD-Bildgebungsansatzes ist die Minimierung von Vibrationen, die Bewegungen von Kontrastkanten über die Dioden erzeugen, was zu großen künstlichen Signalen führt. Da Absorptions-VSDs sehr kleine prozentuale Veränderungen der Lichtintensität mit Aktionspotentialen erzeugen, können Schwingungsartefakte, wenn sie nicht verhindert werden, die neuronalen Signale von Interesse verdecken. Wir verwenden verschiedene Methoden, um Vibrationsartefakte zu minimieren. Erstens befindet sich unser Bildgebungsraum im Erdgeschoss, der die Vorbereitung von Vibrationen im Zusammenhang mit Gebäudeluftbehandlungsgeräten und vielen anderen Quellen isoliert. Zweitens wurde ein federbasierter Isolationstisch verwendet, von dem andere PDA-Benutzer bestätigt haben, dass er eine bessere Schwingungsdämpfung bietet als der gebräuchlichere Lufttisch16. Drittens wurden Wasserimmersionsobjektive verwendet, die Bildschwankungen durch Oberflächenwelligkeiten eliminieren. Viertens wurde die abgebildete Zubereitung leicht zwischen den Kammerboden und ein von oben nach unten gedrücktes Abdeckfragment gedrückt, das durch Silikonstopfen oder Vaseline an Ort und Stelle gehalten wird, wodurch die Zubereitung weiter stabilisiert wird. Dies flacht auch die konvexe Oberfläche des abgebildeten Ganglions oder der Ganglien ab, was zu mehr Neuronen in der Fokusebene des Objektivs führt, was die Anzahl der aufgezeichneten Neuronen erhöht.
Um das Signal-Rausch-Verhältnis für die sehr kleinen Änderungen des VSD-Lichtabsorptionsgrades, die sich aus einem Aktionspotential ergeben, zu maximieren, ist es wichtig, durch die Vorbereitung auf den PDA ein nahezu sättigendes Licht zu erreichen und gleichzeitig das Photobleaching des Farbstoffs zu minimieren. Zu diesem Zweck arbeiten wir typischerweise mit 3-4 V Ruhelichtintensität, gemessen mit dem PDA-Bedienfeld-Verstärkungsschalter in der 1x-Position (die 464 Verstärker des PDA sättigen bei 10 V Licht). Bei der Datenerfassung wird dieser Verstärkungsfaktor auf 100x geändert. Ausreichend Licht zu bekommen, um 3-4 V zu erreichen, wie vom PDA gemessen, kann auf verschiedene Arten erreicht werden. Verwenden Sie zunächst eine ultrahelle LED-Lichtquelle, die eine Wellenlänge liefert, die den Absorptionseigenschaften des verwendeten Absorptionsfarbstoffs entspricht. Dementsprechend wurde eine 735-nm-LED-Kollimiertenlampe verwendet, die sich mit den optimalen Absorptionswellenlängen von RH155 und RH482 überschneidet. Zweitens, falls erforderlich, verwenden Sie einen Flip-Top-Substage-Kondensator, der das Licht der LED-Lichtquelle auf einen kleineren Bereich konzentriert. Drittens, stellen Sie die Kondensatorhöhe ein, um eine Köhler-Beleuchtung zu erreichen, die eine hohe, gleichmäßige Helligkeit und maximale Bildqualität gewährleistet. Viertens, stellen Sie sicher, dass sich keine Wärmefilter im optischen Weg befinden, die die Wellenlänge der LED-Lampe von 735 nm abschwächen können. Fünftens, entfernen Sie Diffusoren, wenn mehr Licht benötigt wird, aus dem optischen Weg. Sechstens, verwenden Sie High-NA-Objektive, die eine hohe räumliche Auflösung bieten und ausreichend Licht ermöglichen, um den PDA bei niedrigeren Lampenstärken zu erreichen. Dies hat es uns ermöglicht, das Photobleaching so weit zu minimieren, dass wir mehrere Erfassungsdateien von 10-20 Minuten Dauer pro Präparat mit der gleichen Lichtintensität über alle Dateien hinweg und ohne einen signifikanten Verlust der Signalamplitude oder die Notwendigkeit einer erneuten Färbung erhalten können. Wenn der Experimentator Neuronen über diese längeren Dateien verfolgen möchte, stellen Sie entscheidend sicher, dass sich die Fokusebene nicht ändert und dass sich das Präparat nicht bewegt. Eine zusätzliche Möglichkeit, ausreichend Licht zum PDA zu leiten, besteht schließlich darin, jüngere Tiere zu verwenden, die dünnere und damit weniger undurchsichtige Ganglien haben.
Von Zeit zu Zeit stellen wir fest, dass sich das Signal-Rausch-Verhältnis der optischen Signale verschlechtert und/oder die rhythmen des Motorprogramms suboptimal sind (z. B. langsam oder abnormal). Wenn dies konsequent geschieht, mischen wir frische Lösungen von VSD. Aliquots von VSD bleiben typischerweise für etwa 6 Monate in einem -20 ° C Gefrierschrank lebensfähig. In diesem Zusammenhang ist es erwähnenswert, dass für Berghiabisher die besten Ergebnisse mit der Absorption VSD RH482 erzielt wurden. Da RH482 lipophiler ist als RH155, kann es berghiasvergleichsweise kleinere Neuronen besser färben oder bei der höheren Salztemperatur, die für diese tropische Spezies verwendet wird, effektiver in den neuronalen Membranen verbleiben.
Eine Einschränkung der PDA-basierten Bildgebung neuronaler Aktivität bezieht sich auf die AC-Kopplung der Spannungssignale in hardware vor dem 100-fachen Vorverstärkungsschritt: Obwohl dies ein notwendiges Merkmal darstellt, um den großen DC-Offset zu entfernen, der durch das hohe Ruhelicht erzeugt wird, das für diese Technik erforderlich ist, schließt die dem PDA innewohnende AC-Kopplung die Messung langsamer Änderungen des Membranpotentials aus. z. B. solche, die synaptischen Eingaben zugeordnet sind. Wenn die Aufzeichnung langsamer oder stationärer potenzieller Änderungen gewünscht wird, kann ein DC-gekoppeltes CMOS-Kamera-Bildgebungssystem verwendet werden, um Aktivitäten unterhalb der Schwellung zu erfassen. Byrne und Kollegen verwendeten kürzlich ein solches Setup mit RH155, um die Aktivität von Neuronen im bukkalen Ganglion von Aplysia17,18 abbilden. Wir haben beide Systeme verwendet und festgestellt, dass die CMOS-Kamera aufgrund ihrer viel höheren Dichte an Detektoren (128 x 128) 50x größere Datendateien für die gleiche Aufnahmezeit generiert7. Die kleineren Dateien des PDA ermöglichen eine schnellere Verarbeitung und Analyse. Dies ermöglicht auch erweiterte Einzelversuchsaufzeichnungen (Abbildung 4) und Lernstudien, in denen Daten aus mehreren Studien vor der Spike-Sortierung zu einer großen Datei verkettet werden, so dass die Netzwerkorganisation während der Lernentwicklung verfolgt werden kann19.
In anderen kamerabasierten Untersuchungen wurden fluoreszierende VSDs von Kristan und Kollegen verwendet, um die Netzwerkfunktion in den segmentalen Ganglien des Blutegels zu untersuchen. In einer einflussreichen Studie führte dies zur Identifizierung eines Neurons, das an der Entscheidung des Tieres beteiligt war, zu schwimmen oder zu kriechen20. In einer anderen Studie untersuchten Kristan et al., inwieweit das Schwimm- und Kriechverhalten des Blutegels durch multifunktionale vs. dedizierte Schaltkreise gesteuert wird21. In jüngerer Zeit verwendeten Wagenaar und Kollegen ein zweiseitiges Mikroskop für die Spannungsbildgebung, mit dem sie von fast allen Neuronen in einem Blutegelsegmentganglion22aufnehmen können. Im Gegensatz zu vielen kamerabasierten Bildgebungsverfahren ist ein Vorteil unserer PDA-basierten Bildgebungsmethode die schnelle und unvoreingenommene Spike-Sortierung durch ICA, eine Form der blinden Quellentrennung, die keine Entscheidungen über neuronale Grenzen für die Ergebnisverarbeitung beinhaltet.
In Bezug auf die Wahl der VSDs ist ein Vorteil der Absorptionsfarbstoffe RH155 und RH482 die geringe bis gar keine Phototoxizität, die mit ihnen verbunden ist23,24, was längere Aufnahmezeiten ermöglicht, als es für fluoreszierende VSDs typisch ist. Darüber hinaus eignen sich die von uns verwendeten schnell absorbierenden VSDs gut zur Erfassung der überschießenden somatischen Aktionspotentiale in Schneckenpräparaten, die typischerweise 80 mV amplitudenmäßig sind. Wie in Abbildung 3Ggezeigt, kann unsere optische Methode Aktionspotential-Unterschreitungen aufzeichnen (keine unserer Aufzeichnungen ist spurgemittelt): Dies deutet darauf hin, dass die von uns verwendeten VSDs in der Lage sein sollten, Aktionspotentiale in anderen Modellsystemen zu erkennen, die bis zu einem gewissen Grad abschwächen und somit nicht überschießen, wenn sie das Soma erreichen. Dennoch ist unser optischer Ansatz möglicherweise nicht ideal für Arten, von denen bekannt ist, dass sie stark abgeschwächte Aktionspotentiale aufweisen, wenn sie im Soma aufgezeichnet werden.
Ein Großteil der aktuellen Forschung zu neuronalen Netzen konzentriert sich auf eine kleine Anzahl von transgenen Designer-Spezies. Die Neurowissenschaft profitiert jedoch von der Untersuchung einer Vielzahl von phylogenetisch unterschiedlichen Arten. Das Studium vieler verschiedener Arten liefert Einblicke in die Entwicklung von Schaltkreisen25,26und beleuchtet Prinzipien der Netzwerkfunktion, die in den Phyla 1 ,2,3,4,27üblich sein können . Wir haben unsere bildgebungsgebende Methode bisher auf eine Reihe von Schneckenarten angewendet, darunter Aplysia californica8,11,12,13,14,28, Tritonia diomedea8,9,11,14,19,28, Tritonia festiva28, Pleurobranchaea californica (unveröffentlichte Daten) und zuletzt Berghia stephanieae (Abbildung 5). Ein Reiz dieses Ansatzes besteht darin, dass er leicht auf viele Arten angewendet werden kann, ohne dass transgene Tiere benötigt werden. Wir möchten anerkennen, dass unsere Verwendung der VSD-Bildgebung mit schnell absorbierenden Farbstoffen und einem PDA in die Fußstapfen der Pionierarbeit tritt, die dies in halbintakten, verhaltenden Navanax29- und Aplysia30-Präparaten erreicht hat. Unsere Betonung der Schnelligkeit unseres Ansatzes ist zum Teil eine Antwort auf Bedenken, dass viele Forscher zunehmend zögern könnten, Netzwerkstudien an neuen Arten zu initiieren, da sie befürchten, dass jahrelange Studien erforderlich sein werden, um die grundlegende Netzwerkorganisation zu charakterisieren, bevor sie in der Lage sind, wissenschaftliche Fragen von breitem Interesse für die Neurowissenschaften zu untersuchen31. Dementsprechend ist es unser Ziel, eine Technik zu demonstrieren, die den Prozess stark beschleunigt – bis zu dem Punkt, dass aus einzelnen Vorbereitungen signifikante Einblicke in die Netzwerkorganisation am selben Tag gewonnen werden können.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Diese Arbeit wurde von NSF 1257923 und NIH 1U01NS10837 unterstützt. Die Autoren möchten Jean Wangs Unterstützung im Labor anerkennen.
Materialien
| Name | Company | Catalog Number | Comments |
| Achromat 0.9 NA swing condenser | Nikon | N/A | |
| Bipolar temperature controller | Warner Instruments | CL-100 with SC-20 | Controls perfusion saline temperature |
| Chamber thermometer | Physitemp | BAT-12 with IT-18 microprobe | |
| Digital camera | Optronics | S97808 | |
| Dissecting forceps | Dumont | #5 | |
| Dissecting scissors | American Diagnostic Corp. | ADC-3410Q | |
| Imaging microscope | Olympus | BX51WIF | |
| Imaging perfusion chamber | Siskiyou | PC-H | |
| Instant Ocean | Instant Ocean | SS6-25 | Makes 25 gallons at a time |
| Master-8 pulse stimulator | A.M.P.I. | Master-8 | |
| Microdispenser | Drummond Scientific | 3-000-752 | Dye applicator for pressure staining |
| Microdissection scissors | Moria | 15371-92 | |
| Minutien pins (0.1 mm) | Fine Science Tools | NC9677548 | For positioning and stabilizing CNS |
| Motorized microscope platform | Thorlabs | GHB-BX | Gibraltar platform |
| NeuroPlex imaging software | RedShirtImaging | NeuroPlex | Compatible with the WuTech photodiode array |
| Objective lenses | Olympus | XLPLN10XSVMP, XLUMPLFLN20XW, LUMPLFLN40XW, UAPON40XW340 | |
| PE-100 polyethylene tubing | VWR | 63018-726 | Tubing to make suction electrodes |
| Perfusion pump | Instech | P720 with DBS062SDBSU tube set | |
| Petroleum jelly | Equate | NDC 49035-038-54 | |
| Photodiode array with control panel | WuTech Instruments | 469-IV photodiode array | Contact jianwu2nd@gmail.com for ordering information |
| RH155 | Santa Cruz Biotechnology | sc-499432 | Voltage-sensitive dye |
| RH482 | Univ of Conn. Health Center | JPW-1132 | Voltage-sensitive dye; special order from Leslie Leow |
| Silicone earplugs | Mack's | Model 7 | To be use for preparation compression |
| Staining PE tubing | VWR | 63018-xxx | Different sizes depending on fit |
| Sylgard 184 silicone elastomer kit | Dow Corning | Sylgard 184 silicone elastomer kit | |
| Thorlabs LED and driver | Thorlabs | M735L2-C1, DC2100 | LED lamp and driver |
| Tygon tubing | Fisher Scientific | 14-171-xxx | |
| Vibration isolation table | Kinetic Systems | MK26 | Spring-based |
Referenzen
- Miller, C. T., Hale, M. E., Okano, H., Okabe, S., Mitra, P. Comparative Principles for Next-Generation Neuroscience. Frontiers in Behavioral Neuroscience. 13 (12), (2019).
- Brenowitz, E. A., Zakon, H. H. Emerging from the bottleneck: benefits of the comparative approach to modern neuroscience. Trends in Neuroscience. 38 (5), 273-278 (2015).
- Bolker, J. Model organisms: There's more to life than rats and flies. Nature. 491 (7422), 31-33 (2012).
- Carlson, B. A. Diversity matters: the importance of comparative studies and the potential for synergy between neuroscience and evolutionary biology. JAMA Neurology. 69 (8), 987-993 (2012).
- Chase, R. . Behavior and its neural control in gastropod molluscs. , (2002).
- Salzberg, B. M., Grinvald, A., Cohen, L. B., Davila, H. V., Ross, W. N. Optical recording of neuronal activity in an invertebrate central nervous system: simultaneous monitoring of several neurons. Journal of Neurophysiology. 40 (6), 1281-1291 (1977).
- Frost, W. N., et al. Monitoring Spiking Activity of Many Individual Neurons in Invertebrate Ganglia. Advances in Experimental Medicine and Biology. 859, 127-145 (2015).
- Frost, W. N., Wang, J., Brandon, C. J. A stereo-compound hybrid microscope for combined intracellular and optical recording of invertebrate neural network activity. Journal of Neuroscience Methods. 162 (1-2), 148-154 (2007).
- Frost, W. N., Wu, J. -. Y., Covey, E., Carter, M. Voltage-sensitive dye imaging. Basic Electrophysiological Methods. , 169-195 (2015).
- Brown, G. D., Yamada, S., Sejnowski, T. J. Independent component analysis at the neural cocktail party. Trends in Neuroscience. 24 (1), 54-63 (2001).
- Hill, E. S., Moore-Kochlacs, C., Vasireddi, S. K., Sejnowski, T. J., Frost, W. N. Validation of independent component analysis for rapid spike sorting of optical recording data. Journal of Neurophysiology. 104 (6), 3721-3731 (2010).
- Bruno, A. M., Frost, W. N., Humphries, M. D. Modular deconstruction reveals the dynamical and physical building blocks of a locomotion motor program. Neuron. 86 (1), 304-318 (2015).
- Bruno, A. M., Frost, W. N., Humphries, M. D. A spiral attractor network drives rhythmic locomotion. ELife. 6, 27342 (2017).
- Hill, E. S., Bruno, A. M., Vasireddi, S. K., Frost, W. N., Naik, G. R. ICA applied to VSD imaging of invertebrate neuronal networks. Independent Component Analysis for Audio and Biosignal Applications. , 235-246 (2012).
- Jahan-Parwar, B., Fredman, S. M. Neural control of locomotion in Aplysia: role of the central ganglia. Behavioral and Neural Biology. 27 (1), 39-58 (1979).
- Jin, W., Zhang, R. J., Wu, J. Y. Voltage-sensitive dye imaging of population neuronal activity in cortical tissue. Journal of Neuroscience Methods. 115 (1), 13-27 (2002).
- Neveu, C. L., et al. Unique Configurations of Compression and Truncation of Neuronal Activity Underlie l-DOPA-Induced Selection of Motor Patterns in Aplysia. eNeuro. 4 (5), 17 (2017).
- Cai, Z., Neveu, C. L., Baxter, D. A., Byrne, J. H., Aazhang, B. Inferring neuronal network functional connectivity with directed information. Journal of Neurophysiology. 118 (2), 1055-1069 (2017).
- Hill, E. S., Vasireddi, S. K., Wang, J., Bruno, A. M., Frost, W. N. Memory Formation in Tritonia via Recruitment of Variably Committed Neurons. Current Biology. 25 (22), 2879-2888 (2015).
- Briggman, K. L., Abarbanel, H. D., Kristan, W. B. Optical imaging of neuronal populations during decision-making. Science. 307 (5711), 896-901 (2005).
- Briggman, K. L., Kristan, W. B. Imaging dedicated and multifunctional neural circuits generating distinct behaviors. Journal of Neuroscience. 26 (42), 10925-10933 (2006).
- Tomina, Y., Wagenaar, D. A. A double-sided microscope to realize whole-ganglion imaging of membrane potential in the medicinal leech. ELife. 6, 29839 (2017).
- Chang, P. Y., Jackson, M. B. Interpretation and optimization of absorbance and fluorescence signals from voltage-sensitive dyes. Journal of Membrane Biology. 196 (2), 105-116 (2003).
- Parsons, T. D., Salzberg, B. M., Obaid, A. L., Raccuia-Behling, F., Kleinfeld, D. Long-term optical recording of patterns of electrical activity in ensembles of cultured Aplysia neurons. Journal of Neurophysiology. 66, 316-333 (1991).
- Katz, P. S. Evolution of central pattern generators and rhythmic behaviours. Transactions of the Royal Society of London, Series B. 371 (1685), 20150057 (2016).
- Moroz, L. L. Biodiversity Meets Neuroscience: From the Sequencing Ship (Ship-Seq) to Deciphering Parallel Evolution of Neural Systems in Omic's Era. Integrative and Comparative Biology. 55 (6), 1005-1017 (2015).
- Frost, W. N., Tian, L. -. M., Hoppe, T. A., Mongeluzi, D. L., Wang, J. A cellular mechanism for prepulse inhibition. Neuron. 40, 991-1001 (2003).
- Hill, E. S., Vasireddi, S. K., Bruno, A. M., Wang, J., Frost, W. N. Variable neuronal participation in stereotypic motor programs. PLoS One. 7 (7), 40579 (2012).
- London, J. A., Zecevic, D., Cohen, L. B. Simultaneous optical recording of activity from many neurons during feeding in Navanax. Journal of Neuroscience. 7 (3), 649-661 (1987).
- Wu, J., Cohen, L. B., Falk, C. X. Neuronal activity during different behaviors in Aplysia: A distributed organization. Science. 263 (5148), 820-823 (1994).
- Marder, E., North, G., Greenspan, R. J. Searching for insight. In Invertebrate Neurobiology. , 1-18 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten